Формулы и названия некоторых неорганических кислот, их солей
Формулы, названия, графические формулы некоторых кислот и названия их солей
Названия солей(международные)
1
HF
фтороводородная (плавиковая)
H-F
фториды
2
HCL
хлороводородная (соляная)
H-CL
хлориды
3
HBr
бромоводородная
H-Br
бромиды
4
HI
йодоводородная
H-I
йодиды
5
H2S
сероводородная
H-S-H
сульфиды
6
HCN
циановодородная
(синильная)
H-C≡N
цианиды
7
HCNS
родановодородная
H-C≡N=S
роданиды
8
HN3
Азотистоводородная
(азидоводород)
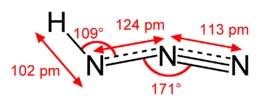
азиды
9
HCLO4
хлорная
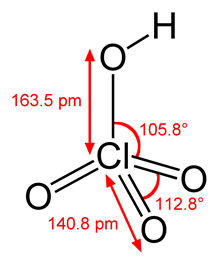
перхлораты
10
HCLO3
хлорноватая
хлораты
11
HCLO2
хлористая
хлориты
12
HCLO
хлорноватистая
H-O-CL
гипохлориты
13
HBrO3
бромноватая
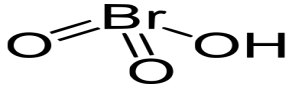
броматы
14
HBrO
бромноватистая
H-O-Br
гипобромиты
15
HIO4
йодная
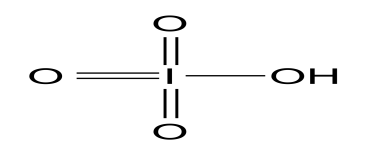
перйодаты
16
HIO3
йодноватая
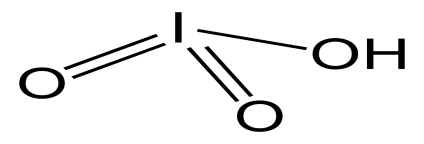
йодаты
17
HIO
йодноватистая
H-O-I
гипойодиты
18
HMnO4
марганцовая
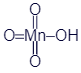
перманганаты
19
H2MnO4
марганцовистая
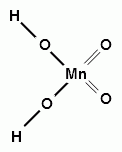
манганаты
20
H2SO4
серная
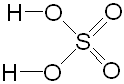
сульфаты
21
H2SO3
сернистая
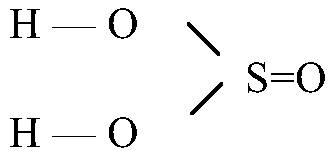
сульфиты
22
H2S2O7
дисерная (пиросерная)
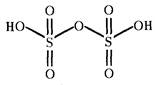
дисульфаты
(пиросульфаты)
23
H2S2O3
тиосерная
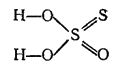
тиосульфаты
24
H2SO5
пероксомоносерная
—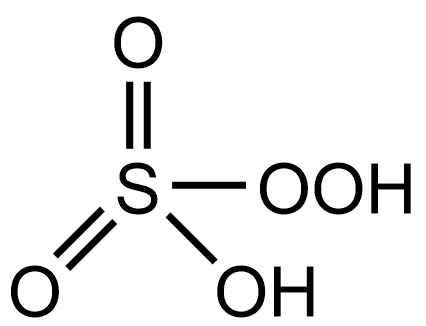
пероксосульфаты
25
H2S2O8
пероксодисерная

пероксодисульфаты
26
H2CrO4
хромовая
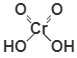
хроматы
27
H2Cr2O7
дихромовая
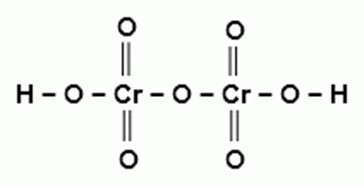
дихроматы
28
H3CrO3
ортохромистая
H-O
H-O
H-O
ортохромиты (хромиты)
29
HCrO2
метахромистая
H-O- Cr =O
метахромиты
30
HNO3
азотная
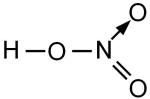
нитраты
31
HNO2
азотистая

нитриты
32
H3PO4
(орто) фосфорная
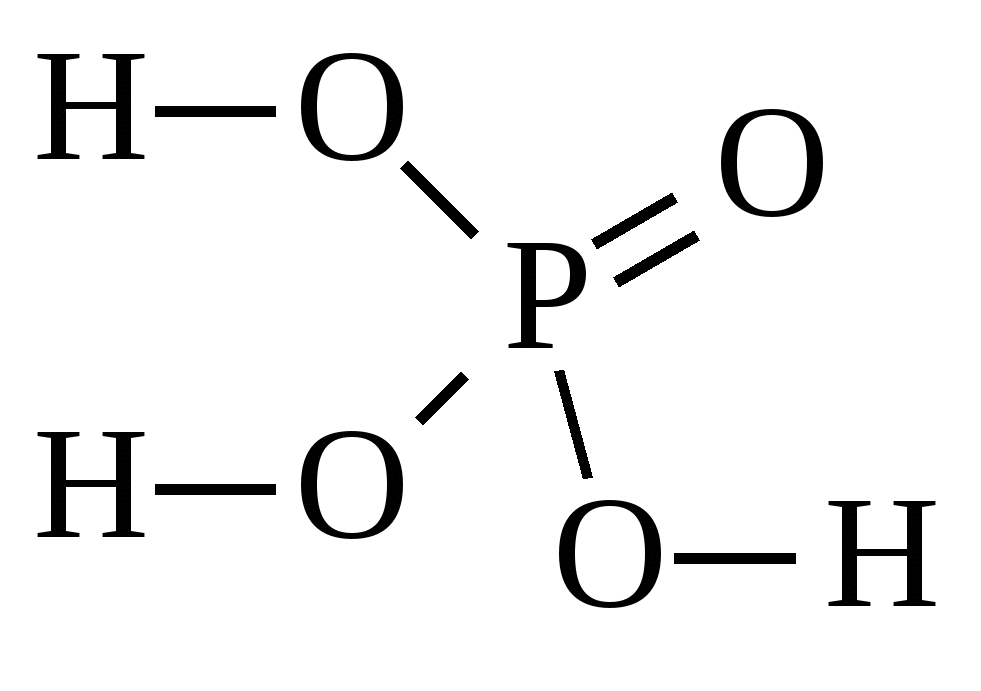
(орто) фосфаты
33
HPO3
метафосфорная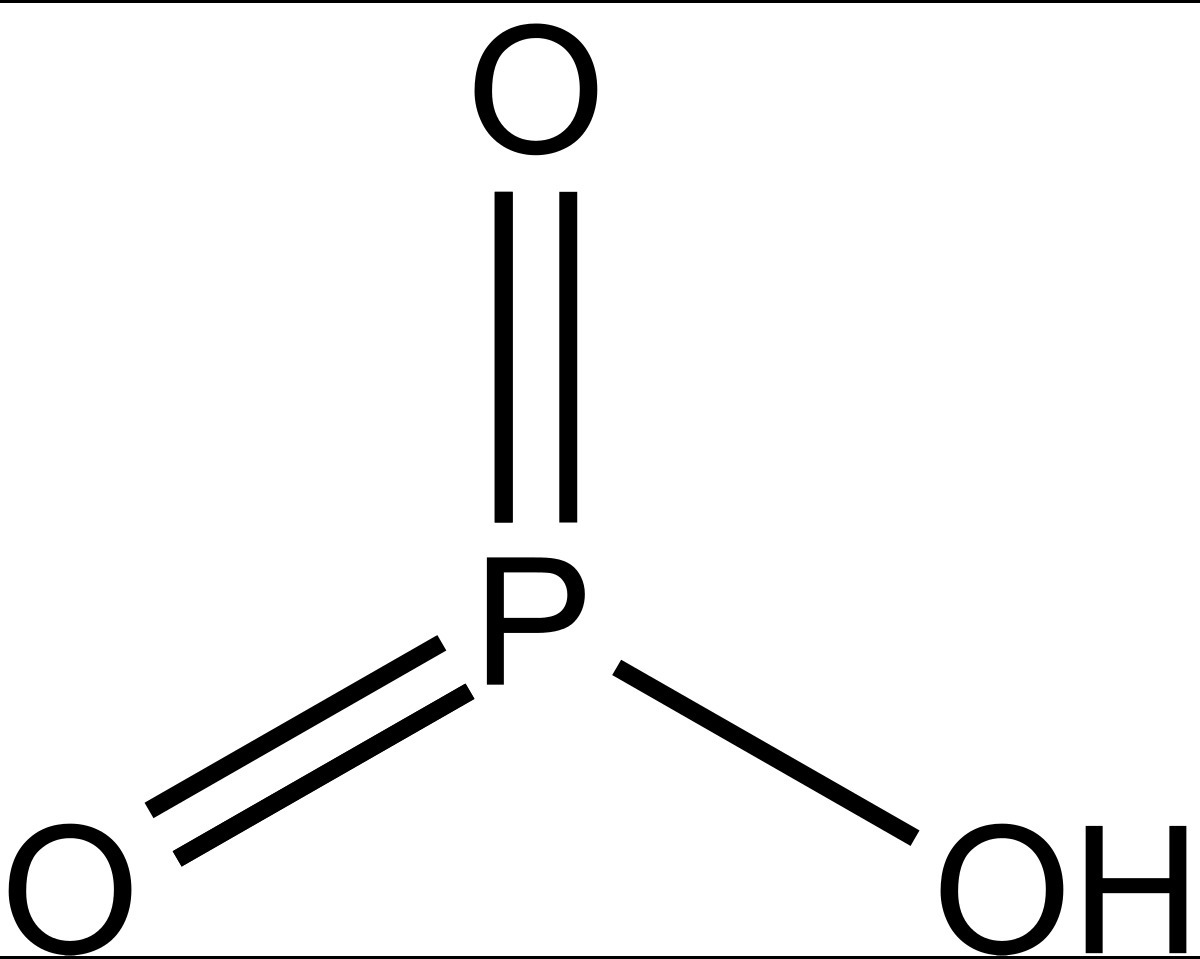
метафосфаты
34
H4P2O7
дифосфорная,
пирофосфорная
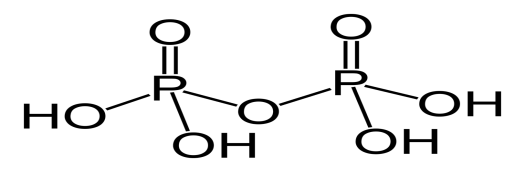
дифосфаты
35
H3PO5
надфосфорная,
пероксомонофосфорная
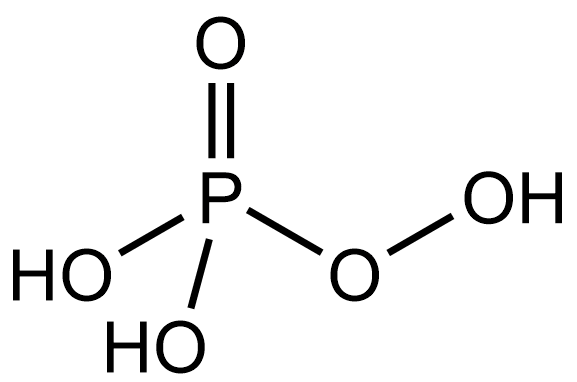
36
H3PO3
фосфористая
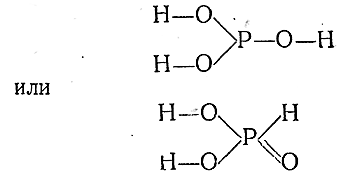
фосфиты
37
H3PO2
фосфорноватистая
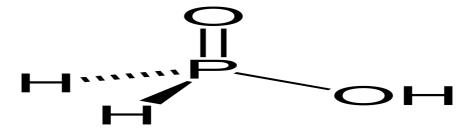
гипофосфиты
38
H3AsO4
ортомышьяковая
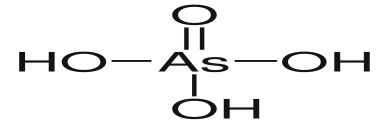
ортоарсенаты
39
H4As2O7
димышьяковая
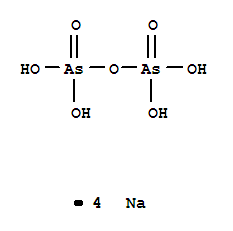
диарсенаты
40
HAsO3
метамышьяковая
H O As O
O
метаарсенаты
41
HAsO2
метамышьяковистая
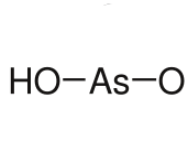
метарсениты
42
H3AsO3
ортомышьяковистая
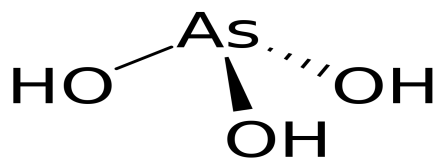
ортоарсениты
43
HSbO2
метасурьмянистая
H O Sb O
метаантимониты
44
H3SbO3
сурьмянистая
H O
H O Sb
H O
ортоантимониты
45
H3SbO4
ортосурьмяная
ортоантимонаты
46
HSbO3
метасурьмяная
H O Sb O
O
метаантимонаты
47
H2CO3
угольная
H O
C O
H O
карбонаты
48
H2CS3
тритиоугольная
SH—CS—SH
тиокарбонаты
49
H2SiO3
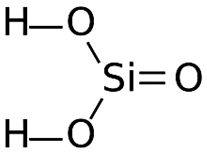
метасиликаты
50
H4SiO4
ортокремниевая
OH
HO Si OH
OH
ортосиликаты
Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая H4SiO4, дикремниевые H2Si2O5 и H10Si2O9, пирокремниевая H6Si2O7 и поликремниевые nSiO2•mH2O. Соответствующие соли называют силикатами (метасиликаты, ортосиликаты и др.).
51
H3ALO3
ортоалюминиевая
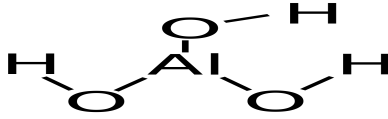
ортоалюминаты
52
HALO
2метаалюминиевая
H-O-AL=O
метаалюминаты
53
H2ZnO2
цинковая
H-O
Zn
H-O
цинкаты
54
H3BO3
ортоборная
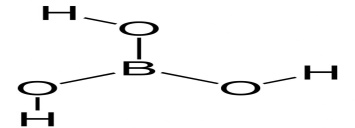
ортобораты
55
HBO2
метаборная
H-O-B=O
метабораты
56
H2B4O7
тетраборная
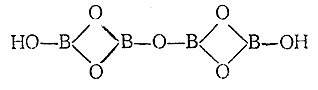
тетрабораты
Правила построения названий кислородсодержащих кислот
Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс(ная, овая, истая и пр.) кислота.
Суффикс -ная, -вая характерен для кислот, содержащих элемент в высшей степени окисления.
+7
Например, HCLO4— хлорная
+6
H2SO4— серная
+6
H2CrO4-хромовая
+5
HNO3— азотная
2. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например, +5
HCLO3 — хлорноватая
+3
HCLO2 — хлористая
+1
HCLO — хлорноватистая
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например,
+5
HPO3 — метафосфорная кислота
+5
H3PO4 — ортофосфорная кислота.
Для того, чтобы различить кислоты, содержащие разное количество атомов кислотообразующего элемента в одной степени окисления, применяют числовые приставки:
+6
H2Cr2O7 — дихромовая кислота;
+6
H2Cr3O10 — трихромовая кислота;
+4
H2S2O5 — дисернистая кислота;
+3
H2B 4O7 — тетраборная кислота.
Оксокислоты, в которых атомы кислорода замещены на атомы серы (частично или полностью) или на пероксогруппы (-О-О-), получают к своему названию приставку соответственно тио- или пероксо- (по необходимости, с числовой приставкой):
H2S2O3 (H2SO3S) — тиосерная кислота;
H2CS3 — тритиоугольная кислота;
HNO4 (HNO2(O2)) — пероксоазотная кислота;
H2S2O8 (H2S2O6(O2) — пероксодисерная кислота.
infourok.ru
Важнейшие классы неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Важнейшие классы неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
dpva.ru
Кремневые кислоты и их соли — Знаешь как
Кремневый ангидрид является кислотным окислом, которому соответствует ортокремневая кислота H4SiO4. Эта кислота очень легко конденсируется с образованием высокомолекулярной метакремневой кислоты (Н2SiO3)x. Упрощенную формулу метакремневой кислоты записывают так: Н2SiO3. Соли кремневых кислот называются кремнекислыми солями, или силикатами.
Силикаты калия и натрия получаются при сплавлении кремнезема с едкими щелочами или карбонатами калия и натрия, например:
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + K2CO3 = K2SiO3 + CO2
Образующиеся при этом сплавы имеют вид стекловидных масс и в отличие от всех остальных силикатов, растворяются в воде. Поэтому силикаты калия и натрия получили название растворимого стекла.
Приведенные выше формулы силикатов калия и натрия являются упрощенными. В действительности эти силикаты имеют переменный состав, выражаемый общей формулой R2O•SiO2, где R означает калий или натрий.
Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяется для изготовления кислотоупорного цемента и бетона, для керосинонепрони-цаемых штукатурок по бетону, для пропитывания тканей, для приготовления огнезащитных красок по дереву, для химического укрепления слабых грунтов.
При действии соляной или серной кислоты на раствор Na2SiO3или К2SiO3получается свободная метакремневая кислота, которая в зависимости от концентрации взятых растворов или выделяется из раствора в виде студенистого, осадка (иногда при этом вся жидкость превращается в студень), или остается в растворе вколлоидном состоянии.
Реакцию образования кремневой кислоты можно выразить следующим уравнением:
Na2SiO3 + 2НСl = H2SiO3 + 2NaCl
Выделяющийся из раствора студенистый осадок кремневой кислоты содержит огромное количество воды, которая может быть удалена нагреванием. Однако таким путем никакой определенной кислоты, состав которой можно было бы выразить формулой, получить не удается: осадок постепенно теряет воду, пока, наконец, при прокаливании не превратится в чистый безводный кремневый ангидриде Полагают, что кремневый ангидрид образует много различных кремневых кислот, отличающихся, подобно фосфорным кислотам, различным содержанием воды. На их существование указывает большое число разнообразных солей, которым соответствуют кислоты: H2SiO3(SiO2 + H2O), H4SiO4(SiO2 + 2h3O) и т. д.
Состав кремневых кислот можно выразить общей формулой: mSiO2• nН2O, где т и п — целые числа. Кислоты, для которых m>1, называются поликремневыми кислотами.
Пока с достоверностью установлено существование трех кисслот — ортокремневой H4SiO4, метакремневой H2SiO3, точнее (H2SiO3)x, и двуметакремневой (H2Si2O5)x. Когда при реакции выделяется кремневая кислота, то для выражения ее состава обычно пользуются упрощенной формулой метакремневой кислоты H2SiO3.
Если из студенистого осадка кремневой кислоты удалить большую часть воды (не доводя его, однако, до полного обезвоживания), то получается твердая, белая, слегка просвечивающая масса, пронизанная множеством тончайших пор и обладающая огромной адсорбционной способностью. Такой продукт называется сил ика гелем Он изготовляется в больших количестрах в промышленности и широко применяется для поглощения различных паров и газов, для очистки минеральных масел, как катализатор при многих реакциях и т.п. Силикагель используется также в качестве основы для нанесения катализаторов при получении серной кислоты контактным методом.
Кремневая кислота очень слабая, поэтому Na2SiО3 и K2SiO3 в растворах сильно гидролизованы и показывают щелочную реакцию.
Соли кремневой кислоты — силикаты — чрезвычайно распространены в природе. Как уже упоминалось, земная кора состоит главным образом из кремнезема и различных силикатов. К природным силикатам принадлежат полевые шпаты, слюды, глины, асбест, тальк и многие другие минералы. Силикаты входят в состав целого ряда горных пород: гранита, гнейса, базальта, различных сланцев и т. д. Многие драгоценные камни, например изумруд, топаз, аквамарин, представляют собой хорошо образованные, кристаллы природных силикатов.
Состав природных силикатов выражается в большинстве случаев довольно сложными формулами. Ввиду сложности этих формул, а также недоказанности существования соответствующих поликремневых кислот принято писать их несколько иначе, чем обычные формулы солей.
Дело в том, что всякую соль кислородной кислоты можно рассматривать как соединение кислотного окисла с основным (или даже с двумя основными окислами, если это двойная соль). Например, СаСО3 можно рассматривать как соединение СаО и СO2, Аl2(SO4)3 — как соединение Аl2O3 и 3SO3 и т. д. На этом основании при изображении состава силикатов обыкновенно пишут отдельно формулы кремневого ангидрида и всех окислов, образующих силикат, не сливая их в одну формулу соли.
Приведем формулы некоторых природных силикатов:
Каолин Аl2O3 • 2SiO2 • 2Н2O, или H4Al2Si2O9.
Слюда белая К2O • 3Аl2O3•6SiO2•2Н2O, или H4K2Al6Si6O24.
Асбест СаО • 3MgO • 4SiO2, или CaMg3Si4O12.
Как уже указывалось ранее, силикаты, содержащие алюминий, называются алюмосиликатами. Самыми важными из них являются полевые шпаты.
В состав полевых шпатов, кроме окислов кремния и алюминия, входят еще окислы калия, натрия или кальция. Обыкновенный полевой шпат, или ортоклаз, содержит окись калия; состав его выражается формулой К2О • Аl2O3• 6SiO2. Преобладающий цвет полевых шпатов — белый или красный. Они встречаются как сплошными залежами, так и в составе сложных горных пород.
К алюмосиликатам относятся также довольно известные минералы — слюды, отличающиеся способностью раскалываться на тонкие, гибкие листочки. Слюды имеют очень сложный состав и наряду с кремнием и алюминием содержат водород, калий или натрий; некоторые слюды содержат также кальций, магний и железо. Обычная белая слюда, большие прозрачные пластинки которой вследствие их тугоплавкости часто применяются для закрывания отверстий в различных печах, является силикатом калия и алюминия. Слюды, содержащие много железа и магния, имеют черный цвет. Отдельно слюды встречаются не часто, но зато входят в состав очень многих сложных горных пород. Из кристалликов кварца, полевого шпата и слюды состоят самые распространенные сложные горные породы — граниты и гнейсы.
На поверхности земли минералы и горные породы, соприкасаясь с атмосферой и подвергаясь механическому и химическому действию воды и воздуха, постепенно изменяются и разру-шаются. Это разрушение, обусловленное совместной деятельностью воды и воздуха, носит название выветривания. Особенное значение имеет разложение полевых шпатов, например ортоклаза. Вода, содержащая углекислый газ, действует на ортоклаз таким образом, что К2О отщепляется и, соединяясь с СО2, дает поташ К2СО3; отщепляется также часть SiО2, а остаток соединяется с водой и образует новый силикат — к а ол и н, составляющий основу различных глин.
Разложение ортоклаза можно выразить следующим уравнением:
К2О•Аl2O3 • 6SiO2 + СО2 + nН2O = K2CO3 + 4SiO2 • mH2O + Al2O3•2SiO2•2H2O
Подобно полевым шпатам, но более медленно, разлагаются слюды.
Процесс превращения полевых шпатов и других алюмосиликатов в каолин называется каолинизацией. Так как полевые шпаты очень распространены, то в результате их разложения в природе образуются огромные количества глины.
Чистый каолин встречается сравнительно редко. Он имеет белый цвет и содержит лишь незначительную примесь кварцевого песка. Такой каолин ценится как материал для приготовления фарфора. Богатые залежи каолина имеются во многих местах Советского Союза, особенно в южной его части. Лучший каолин получают из месторождений Глуховского района УССР. Обыкновенная глина представляет собой смесь каолина с другими веществами, окрашивающими ее в желтовато-бурый или синеватый цвет. Некоторые сорта глин, интенсивно окрашенные окислами железа,, применяются в качестве минеральных красок (охра и др.).
Соединения кремния играют важную роль в народном хозяйстве. Кремнезем и природные силикаты служат исходными материалами при производстве стекла, керамиковых изделий, фарфора и фаянса, строительных и вяжущих материалов. Все эти производства составляют большую отрасль народного хозяйства, носящую название силикатной промышленности.
182 183 184
Вы читаете, статья на тему Кремневые кислоты и их соли
znaesh-kak.com
Важнейшие кислоты серы и их соли
Формула | Константа диссоциации | Название кислоты | Название солей |
H2S | K1=110-7 K2=1,310-13 | Сероводород-ная | Сульфиды |
H2Sn | Сульфановые | Полисульфиды | |
H2SO3 | K1=1,710-2 K2=6,210-8 | Сернистая | Сульфиты |
H2S2O4 | K2=3,5510-3 | Дитионистая | Дитиониты |
H2S2O6 | K1=6,310-1 K2=4,010-4 | Дитионовая | Дитионаты |
H2SxO6 (x=3-6) | Политионовые | Политионаты | |
H2S2O3 | K1=2,510-1 K2=1,910—2 | Тиосерная (неустойчивая) | Тиосульфаты |
H2SO4 | K1=1,0103 K2=1,210—2 | Серная | Сульфаты |
H2S2O7 | Двусерная | Дисульфаты | |
H2S3O10 | Трисерная | Трисульфаты | |
H2S2O8 | Пероксодисер-ная | Пероксоди-сульфаты | |
H[SO3Cl] | Хлорсульфоно-вая | В воде полностью гидролизуются |
Получение серной кислоты из SO3 является основным методом ее производства (контактный метод). SO3 направляют на поглощение не в воду, а в концентрированную серную кислоту. Поглощение водой неэффективно, т.к. газообразный SO3 реагирует сначала с водяным паром и значительная часть H2SO4 получается в виде тумана.
В водных растворах H2SO4 сильная двухосновная кислота (К1 = 103; К2 = 1,210-2). Гидратация H2SO4 сопровождается выделением большого количества тепла за счет образования гидратов. (Почему при разбавлении серной кислоты необходимо приливать кислоту к воде, а не воду к кислоте?).
Большинство сульфатов хорошо растворимо в воде. Плохо растворимы сульфаты Ba2+, Sr2+, Pb2+, ряда редкоземельных элементов. Из водных растворов сульфаты выделяются в виде кристаллогидратов: CuSO45H2O, FeSO47H2O и т.д., которые называются купоросами.
Безводные сульфаты получают взаимодействием SO3 с хлоридами металлов в безводных растворах.
Подобно оксиду серы (VI), полимерными могут быть и сульфат-ионы, построенные из структурных тетраэдрических единиц SO42-. При растворении SO3 в концентрированной серной кислоте образуются полимерные кислоты: H2SO4, H2S2O7, H2S3O10 и т.д. (см. таблицу).
H O O O O O H
\ / \ /
S S
O O
двусерная кислота
Смесь H2SO4, H2S2O7, H2S3O10, H2S4O13 — густая маслянистая, дымящаяся на воздухе жидкость, называемая олеумом. Роль мостика, объединяющего сульфатные группы, может играть и пероксид — ион. H2S2O8 — пероксодисульфат водорода.
Экспериментальная часть Лабораторная работа № 2
Опыт 1. Ромбическая сера.
(Опыт проводится вдали от огня из-за огнеопасности растворителя)
Каплю раствора серы в толуоле нанести при помощи стеклянной палочки на предметное стекло, поместить его под объектив микроскопа и наблюдать за ростом кристаллов при испарении толуола. Зарисовать кристаллы серы.
Опыт 2. Пластическая сера.
Сухую пробирку (использовать имеющиеся в лаборатории битые пробирки), наполненную до половины кусочками серы, нагреть до плавления серы. Часть получившейся светло-желтой жидкости вылить в стакан с водой. Продолжать нагревание оставшейся жидкости, наблюдая за последующими изменениями цвета и вязкости серы. Довести серу до кипения и тоже вылить в стакан с водой. Сравнить обе полученные разновидности серы.
Опыт 3. Диспропорционирование серы.
К порошку серы, находящемуся в тигле, прилить концентрированный раствор щелочи. Смесь кипятить 10 минут. С помощью бумаги, смоченной раствором нитрата свинца, установить присутствие в растворе сульфид-иона. Какие продукты еще образуются? Запишите уравнение реакции.
Опыт 4. Окислительные свойства серы (ТЯГА!).
Тщательно перемешанную смесь цинковой пыли и серного цвета (в весовом соотношении 1:2) поместить на кусок асбеста и прикоснуться к ней горячей стеклянной палочкой или нагреть смесь на спиртовой горелке. Объясните вспышку.
Опыт 5. Получение и свойства сероводорода.
(Сероводород ядовит! Все работы обязательно проводить в вытяжном шкафу!)
Положить в пробирку кусочек сернистого железа и прилить соляной кислоты (1:1). Осторожно исследовать запах выделяющегося газа. Написать уравнение реакции получения сероводорода. Поднести к отверстию пробирки полоску влажной синей лакмусовой бумаги и объяснить наблюдаемое изменение цвета. Затем поднести к отверстию пробирки полоску фильтровальной бумаги, смоченной раствором нитрата свинца, наблюдать изменение цвета бумажки и написать уравнение реакции открытия сероводорода.
Опыт 6. Восстановительные свойства сероводорода.
а) Подействовать сероводородной водой на бромную воду. Наблюдать выделение серы и обесцвечивание раствора. Написать уравнение реакции.
б) Прилить к сероводородной воде несколько капель концентрированной азотной кислоты. Наблюдать выделение серы и окислов азота. Написать уравнения реакций.
в) На раствор перманганата калия, подкисленный несколькими каплями разбавленной серной кислоты, подействовать сероводородной водой. Наблюдать выделение серы и обесцвечивание раствора. Написать уравнение реакции.
Опыт 7. Получение и свойства сульфида алюминия.
Приготовить однородную смесь из 1 г порошка алюминия и 1,8 г серного цвета. Насыпать смесь кучкой на металлический лист и подогреть до начала реакции. Происходит сильная вспышка, образуется сульфид алюминия.
Перенести образовавшийся сульфид в пробирку с водой. Определить природу выделяющегося газа при помощи полоски фильтровальной бумаги, смоченной раствором нитрата или ацетата свинца. Испытать отношение оставшегося в пробирке осадка к растворам кислоты и щелочи. Какое вещество было в пробирке? Написать уравнения реакций.
Опыт 8. Получение сульфидов металлов.
а) Осаждение сульфидом аммония.
В ряд пробирок налить по 2 мл растворов солей железа (II), марганца (II), цинка, кадмия, сурьмы (III) и меди (II). В каждую пробирку прибавить по 2 мл раствора сульфида аммония. Отметить цвет образующихся осадков. Написать уравнения реакций и величины произведений растворимости сульфидов этих металлов (см. Справочник химика). Объяснить, используя понятие «произведение растворимости», процесс осаждения сульфидов в этих условиях.
Испытать действие 3%-ного раствора соляной кислоты на полученные осадки, взяв небольшое количество их. Объяснить различное действие соляной кислоты на сульфиды металлов.
Объяснить, почему осадки выпадают не из всех растворов. Какие вещества образуются при действии сероводорода на раствор соли железа (II)? Классифицировать исследованные сульфиды по их растворимости в воде и кислотах. Составить следующую таблицу:
Сульфиды, растворимые в воде | Сульфиды, раствори-мые в разбавленных кислотах и нераство-римые в воде | Сульфиды, нерастворимые в разбавленных кислотах. |
Для открытия сульфид-иона в растворе применяется раствор нитрата свинца.
Опыт 9. Получение сернистого газа сжиганием серы (ТЯГА!).
В чистую железную ложечку помещают немного серы, поджигают ее и вносят в колбу с небольшим количеством воды. Когда сера сгорит, закрыть колбу пробкой и взболтать. Полученный раствор сохранить для последующих опытов.
Опыт 10. Окислительно-восстановительные свойства сернистой кислоты.
а) К небольшому количеству раствора сернистой кислоты (использовать полученный в предыдущем опыте раствор) прилить бромной воды. Наблюдать обесцвечивание раствора и доказать образование серной кислоты. Написать уравнение реакции.
б) Подействовать на сероводородную воду полученным раствором сернистой кислоты. Наблюдать выпадение серы, написать уравнение реакции.
в) Налить в пробирку с раствором сернистой кислоты немного разбавленного раствора фуксина. Наблюдать исчезновение окраски. Затем смесь в пробирке нагреть. Что наблюдается?
Опыт 11. Реакция на сульфит-ион.
Прилить к раствору сернистой кислоты немного раствора едкого натра для того, чтобы сместить равновесие в сторону образования сульфит-ионов, затем подействовать раствором хлористого бария. Написать уравнение реакции в ионном виде. На полученный осадок подействовать концентрированной соляной кислотой. Что наблюдается?
Опыт 12. Обугливание органических веществ под действием серной кислоты.
а) Налить в пробирку немного концентрированной серной кислоты и опустить в нее лучинку. Объяснить причину обугливания лучинки.
б) На листке белой бумаги при помощи стеклянной палочки, смоченной разбавленной серной кислотой, сделать надпись. Подержать лист над горелкой или электрической плиткой до высыхания. Что наблюдается?
Сделать вывод о правилах обращения с растворами серной кислоты.
Опыт 13. Окислительные свойства серной кислоты.
а) Действие на металлы.
Подействовать разбавленной серной кислотой на следующие металлы: медь, цинк, алюминий. В случае медленно протекающих реакций осторожно подогреть. Что наблюдается? Написать уравнение реакций. Определить какой ион является окислителем в этих случаях.
Подействовать концентрированной серной кислотой на те же металлы, подогреть, отметить цвет и запах продуктов реакций. Написать уравнения реакций. Определить, какой ион является окислителем.
б) Действие на неметаллы.
Нагреть две пробирки с небольшим количеством концентрированной серной кислоты, в одну из которых поместить кусочек серы, в другую кусочек угля. Осторожно исследовать запах выделяющегося газа. Написать уравнения реакций.
Опыт 14. Реакция на сульфат-ион.
Налить в пробирку небольшое количество разбавленной серной кислоты и подействовать раствором хлорида бария. К полученному раствору прилить концентрированной соляной кислоты. Растворяется ли осадок? Написать уравнение реакции в ионной форме. Сравнить эту реакцию с реакцией открытия сульфит-иона.
Опыт 15. Тиосульфат натрия.
а) Получение тиосульфата натрия.
Поместить в небольшую коническую колбу 3,5 г сульфита натрия и 50 мл воды. Взвесить 2,5 г серного цвета и, смочив серу спиртом (зачем?), перенести ее в колбу с раствором сульфита натрия. Смесь нагреть до кипения. Признаком конца процесса является нейтральная реакция раствора. Полученный горячий раствор отфильтровать и упарить на водяной бане до начала кристаллизации. Выпавшие после охлаждения кристаллы отсосать на воронке Бюхнера. Написать уравнение реакции. Написать графическую формулу тиосульфата натрия.
б) Свойства тиосульфата натрия.
1. Растворить несколько кристаллов тиосульфата натрия в небольшом количестве воды и добавить 1-2 мл раствора соляной кислоты. Что наблюдается? Написать уравнение реакции.
2. Положить на крышку тигля несколько кристаллов тиосульфата натрия и сначала осторожно, а затем сильно нагреть. Что наблюдается? Написать уравнение реакции. Доказать, какие вещества образовались при распаде тиосульфата натрия.
3. Налить в пробирку 3-4 мл хлорной воды и прибавить по каплям раствор тиосульфата натрия до исчезновения запаха хлора. Написать уравнение реакции. Почему тиосульфат натрия называют «антихлором»?
4. Проделать аналогичный опыт с йодной водой. Написать уравнение реакции.
Почему при взаимодействии хлорной и йодной воды с тиосульфатом натрия получают различные продукты окисления серы? Что образуется при взаимодействии тиосульфата натрия с бромной водой?
Опыт 16. Катализ.
Приготовить в пробирке раствор 30%-ной серной кислоты, в который добавлено несколько капель раствора перманганата калия. Разлить раствор в три пробирки, в первую добавить 1 каплю 1М раствора нитрата калия. Затем одновременно положить в первую и вторую пробирки по одинаковому кусочку цинка и заметить время. Третья пробирка остается для сравнения. Наблюдать обесцвечивание жидкости в пробирках, отметить время полного обесцвечивания в каждой пробирке. Написать уравнение реакции обесцвечивания растворов. Объяснить роль добавки нитрата калия.
studfile.net