71 Составление овр методами электронного и ионно-электронного баланса (метод полуреакций).
Применяются два вида составления уравнений окислительно-восстановительных реакций:
1) Метод электронного баланса.
2) Метод полуреакций.
По методу электронного баланса сравнивают степени окисления атомов в исходных и конечных веществах, причем число электронов отданных восстановителем, должно ровняться числу электронов, присоединенных окислителем.
Метод полуреакций применяется для реакций между газообразными, твердыми или жидкими веществами, протекающих без электролитической диссоциации.
Например: 1) Метод электронного баланса
+3 +7 +5 +2
H3AsO3
Ортомышьяковистая Ортомышьяковая
кислота кислота
Из схемы реакции видно, что степень окисления атома мышьяка до реакции +3 , после +5, степень окисления марганца изменилась от +7 до +2.
Отражаем это изменение степени окисления в электронных уравнениях.
Восстановитель As+3 – 2e— = As+5 5 процесс окисления
Окислитель Mn+7 +5e— = Mn+2 2 процесс восстановления
или методом полуреакций
MnO4— + 8H+ +5e = Mn+2 + 4H2O 2
H3AsO3 + H2O – 2e = H3AsO4 + 2H+ 5
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное определяем, что молекул восстановителя должно быть 5, а молекул окислителя 2, т.е. находим соответствующие коэффициенты в уравнении.
Уравнение будет иметь вид:
5H3AsO3 + 2KMnO4 + 3H2SO4 = 5H3
При составлении уравнений окислительно-восстановительной реакции соблюдают последовательность в исходных веществах записывают сначала восстановитель, затем окислитель и среду, а в продуктах реакции – продукт окисления восстановителя, продукт восстановления окислителя и побочные продукты.
2)Метод полуреакций
Правила составления уравнений ионно-электронным методом
1) Если исходные соединения или ионы содержат больше атомов кислорода, чем продукты реакции, то в кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды:
MnО—4 + 8H+ + 5e →
Mn+2 + 4H2O,а в нейтральных и щелочных – молекулами воды с образованием гидроксид ионов
NO—3 + 6H2O → NH3 + 9OH— (нейтральная или щелочная)
MnО—4 + 2H2O +3e → MnO2 ↓ + 4OH—
2) Если исходные соединения содержат меньше атомов кислорода, чем продукты реакции, то недостаток кислорода восполняется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода,
I2 + 6H2
а в щелочной среде – за счет гидроксид-ионов, с образованием молекул воды.
CrO—2 + 4OH— = CrO-24 + 2H2O + 3e
SO3-2 + H2O – 2e → SO4-2 + 2H+
SO3-2 + 2OH— -2e → SO4-2 + H2O
Это же правило, но в более короткой формулировке:
если исходные вещества полуреакции содержат больше кислорода, чем продукты реакции, то в кислых растворах освобождающийся кислород связывается в воду, а в нейтральных и в щелочных в гидроксид ион (OH—)
O2-+2H+ = H 2O
O2-+HOH = 2OH—
2) если исходные вещества содержат меньше атомов кислорода, чем образующие, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных за счет гидроксид — ионов.
H2O = O2-+2H+
2OH— = O2-+ H2O
+
MnO4— + e = MnO42- 2
SO3-2 + 2OH — 2e = SO4-2+H2O 1
MnO43- + SO3-2 + 2OH— = 2MnO42 —+ SO42- + H
2OМетод полуреакций (электронно – ионный метод) применяют для реакций, протекающих в растворах.
Электронно-ионные уравнения точнее отражают истинные изменения веществ в процессе окислительно-восстановительной реакции и облегчают составление уравнений этих процессов в ионно-молекулярной формуле.
Ионно — электронный метод ( метод полуреакций ) – основан на составлении раздельных ионных уравнений полуреакций – процессов окисления и восстановления – с последующим их суммированием в общее ионное уравнение.
Главные этапы:
1)записывается общая молекулярная схема
K2Cr2O7 + Fe + H2SO4 →Cr2(SO4)3 + FeSO4
2)составляется ионная схема реакции. При этом сильные электролиты представлены в виде ионов, а слабые электролиты, осадки и газы – в молекулярном виде. В схеме определяется частица, определяется характер среды ( H+,H2O или OH—)
Cr2O72- + Fe + H+ → Cr3+ + Fe2+
3) Cоставляются уравнения 2-х полуреакций.
а) уравнивается число всех атомов, кроме водорода и кислорода
Cr2O72- + H+ → 2Cr3+
Fe → Fe2+
б) уравнивается кислород с использованием молекул H 2O или связывания его в H2O
Cr2O72- + 14H+ → 2Cr3+ + 7 H2O
в)уравниваются заряды с помощью прибавления электронов
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7 H2O
Fe – 2e → Fe2+
4) уравнивается общее число участвующих электронов путем подбора дополнительных множителей по правилу наименьшего кратного и суммируются уравнения обеих полуреакций.
Cr2O
Fe – 2e → Fe2+ 6 3
Cr2O72- + 3Fe + 14H+ → 2Cr3+ + 3Fe2+ + 7 H2O
5) записываются уравнения в молекулярной форме, с добавлением ионов, не участвующих в процессе окисления- восстановления.
K2Cr2O7 + 3Fe +7H2SO4 = Cr2(SO4)3 + FeSO4 + K2SO4 + + 7 H2O
Достоинства метода: видна роль среды, учитывается реальное состояние частиц в реакции, но применим лишь для реакций в растворах.
studfile.net
Методическая разработка » Составление уравнений ОВР методом электронного баланса в 9 классе.»
Методическая разработка по химии составление уравнений ОВР методом электронного баланса в 9 классе.
Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь. Дыхание, обмен веществ, синтез растениями клетчатки с углекислого газа и воды — все это окислительно-восстановительные процессы.
В технике за помощью реакций этого типа получают такие важные вещества, как аммиак (NH3), серную (H2SO4) и соляную (HCl) кислоты и много других продуктов. Вся металлургия основана на восстановлении металлов из их природных соединений — руд. Все реакции горения являются окислительно-восстановительными.
Большинство химических реакций, происходящих в природе — окислительно-восстановительные.
Изучение окислительно-восстановительных реакций вызывает у учащихся определенные трудности.
При составлении окислительно-восстановительных реакций необходимо не только правильно определять степень окисления элемента, но и уметь исходя из степени окисления, предсказывать продукты химической реакции в зависимости от условий среды. Для того чтобы определить окислительно-восстановительную реакцию необходимо установить степени окисления элементов в левой и в правой части уравнения. Для этого требуется знать, как определить степень окисления того или иного элемента.
Окислительно-восстановительные реакции – это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов.
Окисление и восстановление. Окислением называется отдача электронов, в результате чего степень окисления элемента повышается. Восстановлением называется присоединение электронов, в результате чего степень окисления элемента понижается.
Окислительные и восстановительные процессы тесно связаны между собой, так как химическая система только тогда может отдавать электроны, когда другая система их присоединяет (окислительно-восстановительная система). Присоединяющая электроны система (окислитель) сама восстанавливается (превращается в соответствующий восстановитель), а отдающая электроны система (восстановитель), сама окисляется (превращается в соответствующий окислитель).
Алгоритм составления уравнений ОВР методом электронного баланса:
Составить схему реакции.
Al + HCl → AlCl3 + H2
Определить степени окисления элементов в реагентах и продуктах реакции.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, является реакция окислительно-восстановительной или она протекает без изменения степеней окисления элементов.
Эта реакция является ОВР
Подчеркнуть элементы, степени, окисления которых изменяются.
Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
Определить, какой элемент окисляется, (его степень окисления повышается) и какой элемент восстанавливается (его степень окисления понижается), в процессе реакции.
Al0 → Al+3 окисляется
H+1→ H20 восстанавливается
В левой части схемы обозначить с помощью стрелок процесс окисления (смещение электронов от атома элемента) и процесс восстановления (смещение электронов к атому элемента)
Al0 – 3 ē → Al+3 процесс окисление
2H+1 + 2 ē → H20 процесс восстановление
Определить восстановитель и окислитель.
Al0 – 3 ē → Al+3 восстановитель
2H+1+ 2 ē → H20 окислитель
Сбалансировать число электронов между окислителем и восстановителем.
2H+1+ 2 ē → H20
6
Определить коэффициенты для окислителя и восстановителя, продуктов окисления и восстановления.
2H+1+ 2 ē → H20
6
х 2
х 3
Расставить коэффициенты перед формулами окислителя и восстановителя.
2Al +6 HCl → 2AlCl3 + 3H2
Проверить уравнение реакции.
Посчитаем количество атомов справа и слева, если их будет равное количество – коэффициенты мы расставили верно.
Задания для самостоятельного решения.
Используя метод электронного баланса, составьте уравнение реакции
NaMnO4 + NaOH → Na2MnO4 + O2 + h3O
Определите окислитель и восстановитель
Используя метод электронного баланса, составьте уравнение реакции
Br2 + KI + h3O → KIO3 + HBr
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
S + KOH → K2S + K2SO3 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
K2S + HNO3 → K2SO4 + NO + h3O
Определите окислитель и восстановитель.
Ca + HNO3 → N2O + Ca(NO3)2 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
Ph4 + Cl2 + h3O → h4PO4 + HCl
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
h3SO4 + Fe → Fe2(SO4)3 + SO2 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
MnCO3 + KClO3 → MnO2 + KCl + CO2
Определите окислитель и восстановитель
Используя метод электронного баланса, составьте уравнение реакции
Ph4 + Cl2 + h3O → h4PO4 + HCl
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
h3SO4 + Fe → Fe2(SO4)3 + SO2 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
MnCO3 + KClO3 → MnO2 + KCl + CO2
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
HNO3 + Na2SO3 → Na2SO4 + NO2 + h3O
Используя метод электронного баланса, составьте уравнение реакции
Cr + O2 + HCl → CrCl3 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
B + HBrO3 + h3O → h4BO3 + HBr
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
CrO3 + Nh4 → Cr2O3 + N2 + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
HNO2 + HI → I2 + NO + h3O
Определите окислитель и восстановитель.
Используя метод электронного баланса, составьте уравнение реакции
HNO3 + PbS → PbSO4 + NO + h3O
Определите окислитель и восстановитель.
infourok.ru
Cоставление уравнений окислительно – восстановительных реакций
Для составления уравнений окислительных – реакций используется метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которое отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
 Рассмотрим
применение метода электронного баланса
на примере реакции, которая выражается
следующей схемой:
Рассмотрим
применение метода электронного баланса
на примере реакции, которая выражается
следующей схемой:
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
а) Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
б) Находим элементы, которые изменяют степени окисления, это марганец и бром:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
в) Составляем уравнения процессов окисления и восстановления:
Mn +7 + 5e = Mn+2 восстановление окислителя
2Br-1 — 2e = Br2 окисление восстановителя
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые количество отданных и принятых электронов будут равны;
Mn +7 + 5e = Mn+2 |2
2Br-1 — 2e = Br2 | 5
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие процессах окисления и восстановления:
2KMnO4 + 10KBr + H2SO4 = 2MnSO4 + 5Br2 + K2SO4 + H2O
е) Уравниваем число атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода:
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Проверяем правильность уравнивания по равенству числа атомов кислорода в левой (40 атомов) и правой (40 атомов) частях уравнения.
Электролиз
Электролизом называется окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Заряженные ионы электролита под действием электрического тока начинают двигаться к электродам: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются.
Электролиз расплавов и растворов протекает по разному т.к. в растворах дополнительно присутствуют ионы Н+ и ОН— , которые также участвуют в процессе электролиза.
Электролиз расплава. В теоретическом плане простейшим примером электролиза является электролиз расплава. Рассмотрим процесс электролиза расплава NaCI
NaCI = Na+ + CI–
Под действием электрического тока катионы движутся катоду и принимают от него электроны:
Катод (—) Na+ + e = Na0 – процесс восстановления.
Анионы CI– движутся к аноду и отдают электроны:
Катод (—)
2 CI– — 2е = CI2 — процесс
окисления.
— процесс
окисления.
Na+ + e = Na0
2 CI– —
2е
= CI2 
Суммарное ионное
уравнение: 2Na+ + 2 CI– = 2Na0 + CI2
электролиз
Суммарное
молекулярное уравнение: 2NaCI
= 2Na
+ CI2
На катоде выделяется металлический натрий, на аноде – газообразный хлор. Это реакция окислительно — восстановительная, на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
Электролиз растворов.
Процесс на катоде.
1.Если катион электролита находится в начале электрохимического ряда (по AI включительно), то на катоде идет процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды.
3.Если катион электролита находится в ряду напряжения после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активных металлов.
Катодные процессы в водных растворах солей
Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
Men+ — металл не востанавливается | Men+ + Me0 | Men+ +2e = Me0 | |
2Н2О
+ 2е = Н2 | 2Н2О
+ 2е = Н2 |
Процесс на аноде. Продукты электролиза зависят от материала анода и природы аниона.
Если анод растворимый (железо, медь, серебро), то независимо от природы аниона всегда идет окисление металла анода.
Если анод нерастворимый (уголь, графит, платина, золото), то анионы безкислородных кислот (за исключением фторидов) окисляются на аноде, а анионы оксокислот и фториды не окисляются на аноде, а идет окисление воды с выделением кислорода. При электролизе щелочей идет окисление гидроксид ионов.
Анодные процессы в водных растворах
Анод | Анионы безкислородные | Анионы кислородсодержащие |
Нерастворимы | Окисление аниона (кроме фторидов) Асm — +me = Ас0 | В щелочной среде 4ОН——
4е = О2 В кислой, нейтральной средах 2Н2О — 4е = О2+ 4Н+ |
Растворимый | Окисление металла анода Ме0 —ne = Меn+ Анод раствор | Окисление металла анода Ме0 —ne = Меn+ Анод раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
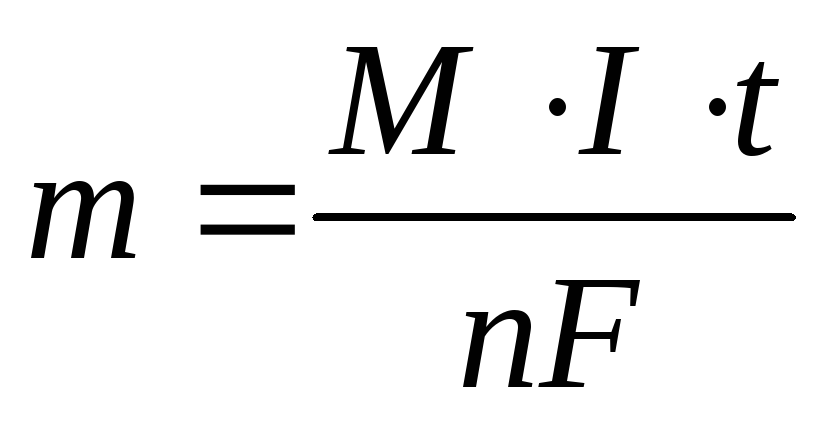 ,
где m
— масса вещества, М – малярная масса, n
— количество отданных или принятых
электронов, F
– число Фарадея (96500 Кл/моль) = А·ч/моль),
I
– сила тока (А), t
— продолжительность процесса.
,
где m
— масса вещества, М – малярная масса, n
— количество отданных или принятых
электронов, F
– число Фарадея (96500 Кл/моль) = А·ч/моль),
I
– сила тока (А), t
— продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые
применяют для непосредственного
преобразования энергии химических
реакций в электрическую энергию, называют
гальваническими элементами или
химическими источниками электрической
энергии. Действие любого гальванического
элемента основано на протекании в нем
окислительно – восстановительной
реакции.  Классический пример гальванического
элемента – элемент Даниэля – Якоби, он
состоит из цинковой пластины (1),
погруженной в раствор сульфата цинка
и медной пластины (2), погруженной в
раствор сульфата меди. Растворы разделены
пористой перегородкой (4) (или
электролитическим мостиком).
Классический пример гальванического
элемента – элемент Даниэля – Якоби, он
состоит из цинковой пластины (1),
погруженной в раствор сульфата цинка
и медной пластины (2), погруженной в
раствор сульфата меди. Растворы разделены
пористой перегородкой (4) (или
электролитическим мостиком).
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к цинковому электроду.
Процесс на аноде Zn = Zn+2 + 2e
Процесс на катоде Cu+2 + 2e = Cu
Суммарное уравнение: Zn + Cu+2 = Zn+2 + Cu
Молекулярное уравнение: Zn + CuSO4 = Zn SO4 + Cu
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
 ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ
ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ

Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
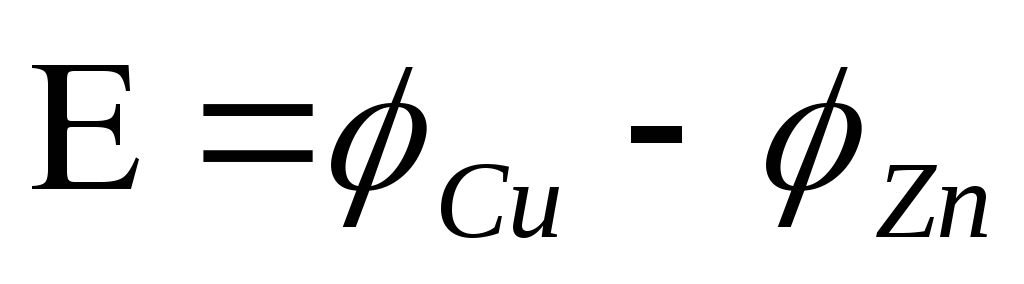


Скачок потенциала,
возникающий на границе раздела металл
– раствор его соли, называется электродным
или окислительно – восстановительным
потенциалом ( ).
).
Зависимость
электродного потенциала от природы
металла, концентрации его ионов в
растворе и температуры количественно
выражается уравнением В. Нернста. 
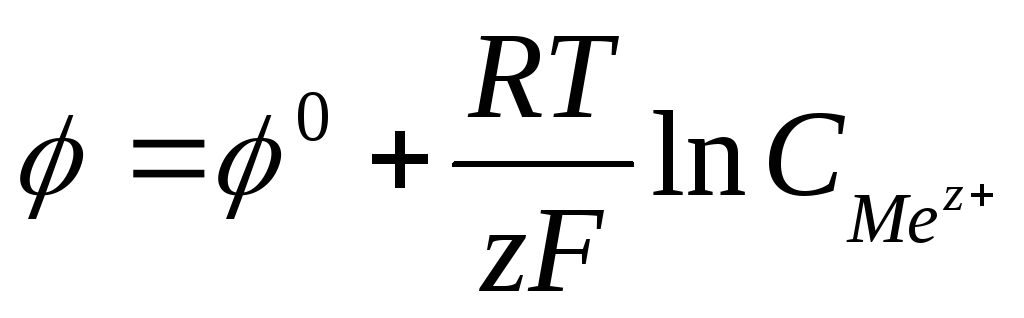 ,
где F — число Фарадея
,
где F — число Фарадея
равно 96500Кл/моль,
z – заряд иона, R – газовая постоянная
8,31Дж/моль·К,
Т температура по Кельвину, 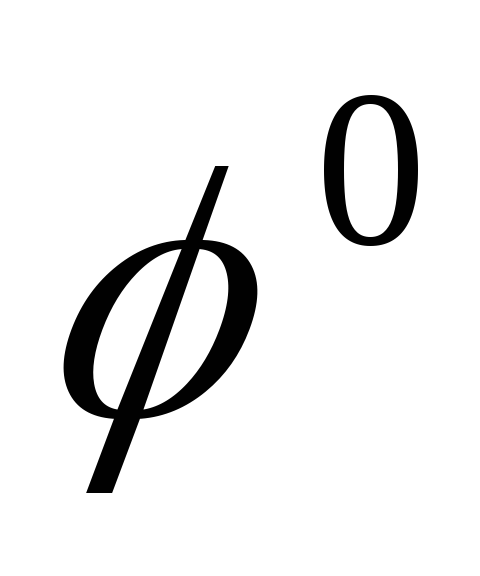 — стандартный электродный потенциал
металла. Подставляя в формулу число
Фарадея, температуру 298К, газовую
постоянную и десятичный логарифм,
получаем:
— стандартный электродный потенциал
металла. Подставляя в формулу число
Фарадея, температуру 298К, газовую
постоянную и десятичный логарифм,
получаем:
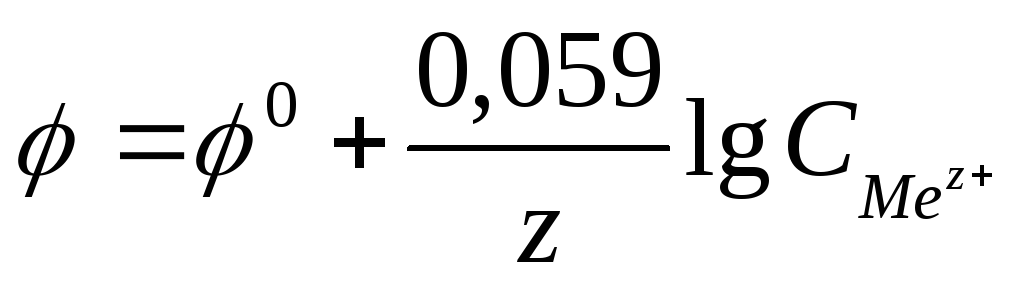
Стандартным
электродным потенциалом металла  называется скачок потенциала на границе
раздела металл — раствор его соли с
концентрацией 1 моль/л.
называется скачок потенциала на границе
раздела металл — раствор его соли с
концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента) , а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
К электрохимической коррозии относятся все случаи коррозии в водных растворах или во влажной атмосфере. Для предупреждения от электрохимической коррозии применяются различные методы. Например, защитные металлические покрытия. Железные изделия могут покрываться тонкой пленкой хрома, никеля, цинка, кадмия, алюминия, олова, серебра, золота и др. При нарушении целостности металлического покрытия в влажной среде, возникает гальванический элемент, что приводит к растворению более активного металла. Металл, который в ряду напряжения стоит левее, становится анодом и разрушается, при этом менее активный металл не изменяется.
Для защиты металлов от коррозии используют как анодное, так и катодное покрытие металлов. При анодном покрытии берется более активный металл (например, покрытие цинком железного изделия), он и растворяется при коррозии, а основной металл не разрушается. Катодное покрытие (например, серебрение железного изделия), защищает металл до тех пор пока пленка не нарушена. При нарушении защитной пленки основной металл становится анодом, а покрытие катодом, соответственно разрушается защищаемый металл, а покрытие не разрушается.
studfile.net
Урок химии в 11-м классе по теме «Составление уравнений окислительно-восстановительных реакций различными способами»
Цели урока:
- углубить знания по составлению уравнений ОВР методом электронного баланса;
- изучить ионно-электронный метод составлению уравнений ОВР, показать его преимущества в формировании умений прогнозирования направления протекания ОВР в растворах.
- закрепить умения по составлению уравнений ОВР, протекающих в различных средах;
Задачи урока.
Познакомить учащихся ещё с одним способом составления уравнений ОВР.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация;
- раствор соляной кислоты и кусочки цинка, железные гвозди и раствор медного купороса, пробирки в штативе на каждом столе;
- инструкция “Алгоритм составления уравнений ОВР методом электронного баланса”;
- инструкции “Алгоритм составления уравнений ОВР ионно-электронным методом”;
- таблицы: “Окислители и восстановители”.
Тип урока: усвоение новых знаний с применением имеющихся знаний и умений с последующим обобщением и систематизацией.
Методы.
- Словесные (беседа, объяснение).
- Наглядные (компьютерная презентация, инструкции, таблицы).
- Практические (демонстрация и выполнение опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий темы: ОВР, окислители, восстановители, процессы окисления и восстановления.
- Составлению уравнений ОВР методом электронного баланса, его недостатки.
- Ионно-электронный метод составления уравнений ОВР, его преимущества.
Ход урока
1. Актуализация знаний.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов. С их помощью получают щёлочи, кислоты и другие ценные продукты. Они лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу 20-го века была создана электронная теория окислительно-восстановительных процессов.
Повторение основных теоретических понятий темы: ОВР, окислители, восстановители, процессы окисления и восстановления. (Слайд 4). Презентация
Какие химические реакции относятся к окислительно-восстановительным, мы узнали в 8 классе, тогда же научились составлять уравнения этих реакций методом электронного баланса. В последствии, в 9 и 10 классе, мы отмечали, что в любой ОВР один из участников – восстановитель отдает электроны, окисляется, то есть повышает свою степень окисления, а другой – окислитель принимает электроны, восстанавливается, то есть понижает степень окисления. Поэтому, если оба её участника находятся в высшей (окислители: КМn+7О4 + HN+5O3) или низшей степени окисления (восстановители: H2S-2 + HCl-1), то реакция невозможна.. Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна (HCl-1 + HN+5O3—>).
Поэтому, прежде чем написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
- Возможна ли в принципе ОВР между данными веществами?
- Если да, то установить продукты реакции.
- Подобрать коэффициенты в уравнении реакции.
Задание №1. Определите, возможна ли в принципе ОВР между данными веществами? Если да, то определите восстановитель и окислитель в реакции. (Слайд 5)
KMnO4 + FeS O4 + h3SO4 —> FeCl3 + HNO3 (конц.) —>
.P + HNO3 + Н2О —> … K2Cr2O7 + HCl —>
K2Cr2O7 + HNO3 —>
Выполнение лабораторных опытов.
- Взаимодействие раствора соляной кислоты с цинком;
- Взаимодействие железного гвоздя и раствора медного купороса
Вывод после проведения опытов: к ОВР обязательно относятся все реакции замещения и реакции, в которых присутствуют простые вещества.
2. Составление уравнений ОВР методом электронного баланса, его недостатки.
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. (Слайд 6) Этот метод хорошо знают и используют все учащиеся при расстановке коэффициентов. И данным методом действительно удобно пользоваться и в неорганической и органической химии, конечно, если даны полные схемы реакций.
Алгоритм составления уравнений ОВР методом электронного баланса. (Приложение 1)
Работа у доски: (Слайд 7)
1. Записать схему реакции:
2. Определить, атомы, каких элементов изменяют степень окисления:
3. Составить электронные уравнения процессов окисления и восстановления:
4. Умножить полученные электронные уравнения на наименьшие множители для установления баланса по электронам:
5. Перенести множители из электронных уравнений в молекулярное уравнение реакции:
6. Проверить выполнение закона сохранения массы (число атомов каждого элемента в левой и правой части уравнения должно быть одинаковым) и, если требуется, ввести новые или изменить полученные коэффициенты:
Вывод: Данным способом расстановки коэффициентов удобно пользоваться, если известны исходные вещества и продукты реакции, т.е. даны полные схемы реакций.
3. Ионно-электронный метод составления уравнений ОВР, его преимущества.
Если ОВР протекает в водных растворах и участники реакции не очевидны, то удобнее использовать метод электронно-ионного баланса (другое название – метод полуреакций). А именно такие схемы реакций, в которых не известны некоторые исходные вещества и продукты реакции, даны в заданиях С1 единого государственного экзамена. Сегодня мы познакомимся с особенностями протекания ОВР в водных растворах, научимся определять продукты реакции, используя специфический для таких реакций метод составления их уравнений. (Слайд 8).
Метод полуреакций, или ионно-электронный метод составления ОВР заключается в том, что для окислительных и восстановительных процессов в отдельности записываются уравнения полуреакций. Затем их уравнивают отдельно, умножают на коэффициенты, чтобы получить общее уравнение, в котором соблюдены законы сохранения массы и заряда, и складывают. Метод на первый взгляд кажется громоздким, но он имеет жесткий алгоритм исполнения, что удобно и полезно.
Алгоритм составления уравнения ОВР методом электронно-ионного баланса
(Слайд 9) (Приложение 2):
- Составить перечень веществ и частиц, присутствующих в системе до начала реакции.
- Найти среди них окислитель и восстановитель; определить реакцию среды.
- Составить уравнение полуреакции окислителя.
- Составить уравнение полуреакции восстановителя.
- Уравнять число принятых и отданных электронов.
- Составить ионное уравнение.
- Составить молекулярное уравнение.
Составляя этим методом уравнений ОВР, необходимо учитывать следующие основные правила:
1) при составлении уравнений полуреакций можно использовать только те вещества и частицы, которые присутствуют в данной системе;
2) продуктами полуреакций могут быть только те вещества и частицы, которые устойчивы в данной системе;
3) при составлении уравнения полуреакции окислителя нельзя использовать частицы восстановителя и, наоборот, при составлении уравнения полуреакции восстановителя нельзя использовать частицы окислителя.
Рассмотрим взаимодействие дихромата калия К2Сг207 с соляной кислотой. (Работа у доски)
1. Запишим в левой части уравнения формулы исходных веществ.
Для создания в растворах кислой среды обычно пользуются серной кислотой. Соляная и азотная кислоты применяются редко, так как первая (НСl) способна окисляться, а вторая (НNО3) сама — сильный окислитель.
2. Определим окислитель и восстановитель.
Ион Сг2072-, содержащий хром в его высшей степени окисления, может быть только окислителем. В кислой среде степень окисления хрома понижается — он восстанавливается в Сг3+. Ионы С1— могут только окисляться – он восстановитель.
3. Составим схемы электронно-ионных уравнений полуреакций для процессов окисления и восстановления.
Полуреакция окисления: 2СГ — 2е = С12.
Полурсакция восстановления. Начинать подбор ее коэффициентов следует с уравнивания числа атомов элемента, который меняет свою степень окисления, в данном случае — хрома: Сг2072-—> 2Сг3+.
4. Проверим число атомов кислорода в каждом уравнении полуреакции слева и справа и уравняйте их. Уравниваем число атомов кислорода. Они превращаются в молекулы воды, степень окисления кислорода в которых та же, что и в Сг2072-. Для этого необходимо в левую часть добавить ионы Н+, которые заведомо имеются в растворе (среда кислая): Сг2072- + 14Н+ = 2Сг3+ + 7Н20.
Одновременно с атомами кислорода при этом уравнивается и число атомов водорода.
5. Проверим число атомов каждого элемента в левой и правой частях схем уравнений окисления и восстановления.
6. Проверим равенство сумм зарядов до и после реакции, в соответствии с законом электронейтральности — суммарное число зарядов продуктов реакции должно быть равно
суммарному числу зарядов исходных веществ.
В нашей записи суммарный заряд всех ионов слева +12, а справа +6, поэтому для баланса нужно добавить в левую часть нашего выражения 6 электронов, каждый из которых несет заряд — 1. В результате получим уравнение: Сг2072- + 14Н+ + бе = 2Сг3+ + 7Н20.
7. Подберем коэффициенты для окислителя и восстановителя согласно закону сохранения энергии (материи) — общее число электронов, отданных восстановителем и принятых окислителем, должно быть равным.
Сг2072— + 14H+ + 6e= 2Cr3+ + 7Н20 1
2С1— — 2е = С12 3
8. Суммируйте правые и левые части электронно-ионных уравнений, предварительно умножив соответствующие части на подобранные коэффициенты. Сг2072— + 14Н+ + 6СГ = 2Cr3++ 7Н20 + ЗС12,
9. Сократим подобные члены в правой и левой частях уравнения.
10. Перепишем ионное уравнение.
11. По ионному уравнению составим молекулярное, для этого необходимо в правой и левой частях уравнения каждому аниону приписать соответствующее число катионов, а
каждому катиону приписать соответствующее число анионов. Скомпонуйте ионы в молекулы.
В данном случае источником ионов Сг2072- была соль К2Сг207, поэтому с каждым молем Сг2072- в раствор попадает 2 моль ионов К+. В реакции они участия не принимают, поэтому в неизмененном виде должны перейти в правую часть. Вместе с 14 моль ионов Н+ в раствор вносится 14 моль ионов СГ. Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы К+, в неизмененном виде остаются после реакции, т. е. дописываются в правую часть. Проделав это, получим:
Сг2072- + 14Н+ + 6СГ + 2К+ + 8С1— = 2Сг3+ + 7Н20 + ЗС12 + 2К+ + 8С1—
После этого можно объединить ионы в формулы реальных веществ:
К2Сг207 + 14НС1 = 2СгС13 + ЗС12 + 2КС1 + 7Н20.
Правила уравнивания атомов кислорода и водорода при составлении полуреакций: (Слайд 10)
Преимущества электронно-ионного метода:
1. Рассматриваются реально существующие ионы:
2. Не нужно знать все получающиеся вещества, они появляются при его выводе.
3. При использовании этого метода нет необходимости определять степени окисления атомов отдельных элементов, что особенно важно в случае ОВР, протекающих с участием органических соединений, для которых подчас очень сложно сделать это.
4. Этот метод дает не только сведения о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
5. Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
6. Видна роль среды как активного участника всего процесса.
Самостоятельная работа (15 мин.): (Слайды 11, 12, 13, 14)
Закрепление. Составьте уравнение одной из 2 предложенных ОВР ионно-электронным методом или методом электронного баланса.
KMnO4 + FeSO4 + H2SO4—> Fe2(SO4)3 + …
CrCl3 + Br2 + КОН > К2CrO4 + KBr + …
(Анализ самостоятельной работы показал, что с работой справились все учащиеся, отдавая предпочтение ионно-электронному методу подбора продуктов реакции и коэффициентов).
Вывод: Если в ОВР не указаны продукты реакции, то удобнее использовать метод электронно-ионного баланса, который позволяет подобрать их, используя четкий алгоритм исполнения, что удобно и полезно.
Домашнее задание: (Слайд 15, 16)
Задание 2. Используя метод электронного баланса (или метод электронно-ионного баланса), составьте уравнения любых 3 реакций.
Определите окислитель и восстановитель.
K2Cr2O7 + HCl —> Cl2 + KCl + … + …
KMnO4 + H2S + H2SO4 —> Mn SO4 + S + …+ …
KMnO4 + … —> Cl2 + MnCl2 + … + …
H2S + HMnO4 —> S + MnO2 + …
KMnO4 + KBr + H2SO4 —> MnSO4 + Br2 + … + …
Вывод по итогам занятия: Учащиеся проявляют повышенный интерес к данной теме, они осознают важность и необходимость владения рассмотренным материалом, понимают, что полученные знания помогут им успешно выполнить задания ЕГЭ.
Анализ самостоятельной работы показал, что с работой справились все учащиеся, отдавая предпочтение ионно-электронному методу подбора продуктов реакции и коэффициентов.
urok.1sept.ru
Разработка урока с презентацией на тему «Составление уравнений ОВР методом электронного баланса»
Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
Цель: углубление знаний по составлению уравнений ОВР методом электронного баланса.
Задачи урока:
Образовательные: повторить основные понятия о процессах окисления и восстановления, степени окисления, окислителях и восстановителях, рассмотреть сущность окислительно-восстановительных реакций, выработать умения по составлению уравнений химических реакций, протекающих в различных средах методом электронного баланса.
Развивающие: способствовать формированию и развитию познавательного интереса учащихся к предмету, способствовать развитию речи учащихся, формирование умения анализировать, сопоставлять, и обобщать знания по теме.
Воспитательные: воспитание осознанной потребности в знаниях, совершенствовать умение выслушивать мнение каждого члена коллектива
Оборудование и реактивы:
персональный компьютер, проектор, презентация;
раствор соляной кислоты и кусочки цинка, железные гвозди и раствор медного купороса, растворы перманганата калия, серной кислоты, сульфита натрия, пробирки в штативе на каждом столе;
инструкция “Алгоритм составления уравнений ОВР методом электронного баланса”;
таблицы: “Окислители и восстановители”.
Методы.
Словесные (беседа, объяснение).
Наглядные (компьютерная презентация, инструкции, таблицы).
Практические (демонстрация и выполнение опытов).
Ход урока
1. Актуализация знаний.
Беседа (фронтальная) по ранее изученному материалу.
1) Какие реакции называются окислительно- восстановительными?
Окислительно — восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
2) Что такое процесс окисления?
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
3) Какой процесс называется восстановлением?
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
4) Как называются частицы, отдающие электроны?
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
5) Как называются частицы, принимающие электроны?
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
6) Что такое «степень окисления»?
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна (условный заряд атома, который мы приписываем ему в случае принятия или отдачи электронов).
7) Какой метод составления уравнения окислительно-восстановительных реакций вы знаете? Какое правило лежит в основе этого метода?
Самостоятельная работа учащихся у доски по карточкам (с дальнейшим обсуждением). (Слайд 4-5)
1. Определите валентность и степени окисления элементов в следующих соединениях:
СН4, Cl2, СО2, NH3, C2H4, СН3СOOH, V2O5, Na2B4O7, KClO4, K2HPO4, Na2Cr2O7.
Ответ: Для выполнения задания можно использовать приложение 1.
IV I I IV II III I IV I IV I IV II II I V II
С-4Н+14, Cl02, С+4О-22, N-3H+13, C-22H+14, С-3Н+13С+3O-2O-2H+1, V+52O-25,
I VII II I I V II I VI II
K+1Cl+7O-24, K+12H+1P+5O-24, Na+12Cr+62O-27.
2. В каких из приведенных ниже уравнений реакций MnО2 проявляет свойства окислителя, а в каких – восстановителя? (Слайд 6)
а) 2MnO2 + 2H2SO4 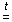 2MnSO4 + O2 + 2H2O;
2MnSO4 + O2 + 2H2O;
б) 2MnO2 + O2 + 4KOH  2K2MnO4 + 2H2O;
2K2MnO4 + 2H2O;
в) MnO2 + H2 = MnO + H2O;
г) 2MnO2 + 3NaBiO3 + 6HNO3 = 2HMnO4 + 3BiONO3 + 3NaNO3 + 2H2O
Ответ:
Окислитель принимает электроны и при этом степень окисления понижается, значит, в случаях а и в MnО2 является окислителем. Восстановитель отдает электроны и при этом степень окисления повышается, значит, в случаях б и г MnО2 является восстановителем.
II. Мотивация и целеполагание.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов. С их помощью получают щёлочи, кислоты и другие ценные продукты. Они лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу 20-го века была создана электронная теория окислительно-восстановительных процессов.
III. Отработка и расширение знаний.
Задание №1. Определите, возможна ли в принципе ОВР между данными веществами? Если да, то определите восстановитель и окислитель в реакции. (Слайд 7)
KMnO4 + FeSO4 + h3SO4 —>
P + HNO3 + Н2О —>
K2Cr2O7 + HNO3 —>
Инструктаж перед выполнение лабораторных опытов
Выполнение лабораторных опытов.
Взаимодействие раствора соляной кислоты с цинком;
Взаимодействие железного гвоздя и раствора медного купороса
Вывод после проведения опытов: к ОВР обязательно относятся все реакции замещения и реакции, в которых присутствуют простые вещества.
2. Составление уравнений ОВР методом электронного баланса.
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. (Слайд 6) Этот метод хорошо знают и используют все учащиеся при расстановке коэффициентов. И данным методом действительно удобно пользоваться и в неорганической и органической химии, конечно, если даны полные схемы реакций.
Алгоритм составления уравнений ОВР методом электронного баланса. (Приложение 1)
Работа у доски: (Слайд 9)
1. Записать схему реакции:
2. Определить, атомы, каких элементов изменяют степень окисления:
3. Составить электронные уравнения процессов окисления и восстановления:
4. Умножить полученные электронные уравнения на наименьшие множители для установления баланса по электронам:
5. Перенести множители из электронных уравнений в молекулярное уравнение реакции:
6. Проверить выполнение закона сохранения массы (число атомов каждого элемента в левой и правой части уравнения должно быть одинаковым) и, если требуется, ввести новые или изменить полученные коэффициенты:
Выполнение лабораторного опыта 3: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте, как изменяется окраска раствора в каждой пробирке.
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4—):
в кислой среде – Mn+2 (соль), бесцветный раствор;
в нейтральной среде – MnO2, бурый осадок;
в щелочной среде — MnO42- , раствор зеленого цвета.
Задание. Даны схемы реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na2SO3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na2SO3 + KOH → K2MnO4 +Na2SO4 + H2O
Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно:
KMnO4 + Na2SO3 + H2SO4 →
KMnO4 + Na2SO3 + H2O →
KMnO4 + Na2SO3 + КOH →
Подберите коэффициенты методом электронного баланса по алгоритму (Приложение 1). Укажите окислитель и восстановитель.
Ответ:
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 3Na2SO3 + H2O → 2MnO2↓ + 3Na2SO4 + 2KOH
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 +Na2SO4 + H2O
Кроме перманганата калия окислительной способностью обладают и другие вещества. Можно с ними познакомиться в приложении 2.
1) H2SO4 (разбавленная), окислитель Н+1
Продукт восстановления металлом, стоящим в ряду напряжения до водорода, – Н2.
Например,
H2SO4 (разб.) + Zn —> ZnSO4 + H2 ,
,
H2SO4 (разб.) + Cu  не реагирует.
не реагирует.
2) H2SO4 (концентрированная), окислитель S+6
В зависимости от активности металла продукты восстановления концентрированной H2SO4 разные: H2S; S; SO2. Продукт восстановления зависит также и от концентрации кислоты
3) HNO3, окислитель N+5
Концентрированная HNO3 пассивирует такие металлы, как Fe, Cr, Al, что связано c образованием на поверхности этих металлов тонкой, но очень плотной оксидной пленки.
Au и Pt не реагируют с HNO3, но эти металлы растворяются в «царской водке» – смеси концентрированных соляной и азотной кислот в соотношении 3 : 1.
Например:
Au + 3HCl (конц.) + HNO3 (конц.) = AuCl3 + NO + 2H2O.
4) К2Сr2O7 в кислой среде восстанавливается до Cr3+
в нейтральной среде до Сr2O3
в щелочной среде до CrO42-
Окислительно-восстановительные реакции в органической химии связано либо с образованием связей по кислороду, либо с отщеплением водорода.
Правило образование связей: — ОН → -1е
=О → -2е
отщепление 1атома Н → -1е
IV. Первичное закрепление:
Составьте уравнение одной из 4 предложенных ОВР методом электронного баланса. (У доски работают 4 учащихся), после составления уравнений сравнивают правильность выполнения задания.
KMnO4 + FeSO4+ H2SO4→ Fe2(SO4)3 + …
CrCl3 + Br 2 + КОН → К2CrO4 + KBr + …
NaNO2 + KI + H2SO4→ I2 + NO + …
KIO3 + H2O2 + H2SO4 → I2+ O2 + …
Самостоятельная работа:
Вариант 1
1. Какой из неметаллов является сильным окислителем?
1)фтор 2)сера 3)озон 4)кремний
2. Степень окисления серы в сульфате калия равна
1)+6 2)+4 3)0 4)-2
3. В каком из приведенных реакций атом хлора выступает в роли восстановителя
1) Cu + Cl2 = CuCl2
2) HCl + NaOH = NaCl + H2O
3) HCl + MnO2= MnCl2 + Cl2 + H2O
4) Cl2 + H2= HCl
4. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции:
Уравнение реакции Изменение степени окисления окислителя
A) SО2 + NО2 = SО3+NO 1) -1 → 0
Б) 2NH3 + 2Na = 2NaNH2 + H2 2) 0 → -2
В) 4NО2 + О2 + 2H2О = 4HNО3 3) +4 → +2
Г) 4NH3 + 6NO = 5N2 + 6Н2О 4) +1 → 0
5) +2 → 0
6) 0 → — 1
5. Используя метод электронного баланса составить уравнение реакции:
PbS + H2O2 → PbSO4 + H2O
Определите окислитель и восстановитель.
6. Используя метод электронного баланса составить уравнение реакции:
KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O
Определите окислитель и восстановитель.
Вариант 2
1. В каком из перечисленных соединений атом серы находится в степени окисления +6
1) FeSO3 2) S 3) SO2 4) К2SO4
2. Какой элемент восстанавливается в реакции Fe2O3 + CO = Fe + СО2
1)железо 2)кислород 3)углерод
3. Выберите уравнение реакции, в котором элемент углерод является окислителем.
1)2С + O2 = 2CO
2) CO2 + 2Mg = 2MgO + C
3) CH4 + 2O2 = CO2 + 2H2O
4) C + 2H2SO4 = CO2 + 2H2O + 2SO2
4. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции:
Уравнение реакции Изменение степени окисления окислителя
A) SО2 + NО2 = SО3+NO 1) -1 → 0
Б) 2NH3 + 2Na = 2NaNH2 + H2 2) 0 → -2
В) 4NО2 + О2 + 2H2О = 4HNО3 3) +4 → +2
Г) 4NH3 + 6NO = 5N2 + 6Н2О 4) +1 → 0
5) +2 → 0
6) 0 → — 1
5. Используя метод электронного баланса, составьте уравнение реакции:
NaNO2 + NH4Cl → NaCl + 2H2O + N2
Определите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции:
KI + H2SO4 + NaNO2 → …… + K2SO4 + Na2SO4 + NO + H2O
Определите окислитель и восстановитель.
Вариант 1: Ответ: 1-1; 2-1; 3-3; 4-А3, Б4, В2, Г5.
Вариант 2: Ответ: 1-4; 2-1; 3-2; 4-А3, Б4, В2, Г5.
V. Домашнее задание: (Слайд 13)
Параграф 19, упр 2
Расставить коэффициенты в одном из предложенных уравнений
CrCl3 + Br2 + КОН → К2CrO4 + KBr + …
NaNO2 + KI + H2SO4 → I2 + NO + …
KIO3 + H2O2 + H2SO4 → I2 + O2 + …
VI. Подведение итогов урока
Какие вопросы мы сегодня изучали?
Какой алгоритм составления уравнений ОВР?
infourok.ru
Окислительно-восстановительные реакции (ОВР). Составление уравнений ОВР методом электронного баланса. — КиберПедия
Тип урока: Практическое занятие
Обучающие цели урока:
– формирование знаний важнейших химических понятий в области ОВР;
– формирование умения составлять уравнения ОВР
– формирование общих компетенций в соответствии с требованиями ФГОС;
– развитие межпредметных связей.
Учащиеся должны знать: сущность процессов окисления и восстановления; определения: степень окисления, окисление и восстановление, окислитель и восстановитель. Уметь: составлять уравнения окислительно-восстановительных реакций методом электронного баланса.
Воспитательные и развивающие задачи:
— развитие умения анализировать и обобщать информацию, делать выводы;
— развитие самостоятельного мышления;
— развитие умения организовывать собственную деятельность, выбирать типовые методы и способы выполнения поставленных задач, оценивать их эффективность и качество.
— повышение интереса к предмету за счет взаимосвязи темы урока с избранной специальностью.
Приемы активизации познавательной деятельности:
— разъяснение целесообразности урока
— наглядность
— демонстрационный опыт
— проблемные вопросы
— работа в парах постоянного состава
Межпредметные связи:физика, электротехника, металлургия.
Оборудование и реактивы:
Для демонстрационного опыта:
· Растворы:
– Перманганат калия в мерном цилиндре
– Сульфит натрия
– Серная кислота
Технические средства обучения:
— компьютер, проектор, экран
ЭОР: презентация к уроку
Методическое обеспечение урока:
– методическое пособие «Окислительно-восстановительные реакции»;
– бланк отчета.
План урока:
1. Актуализация знаний
2. Объяснение терминов и определений
3. Формирование и закрепление умений составлять уравнения реакций методом электронного баланса в ходе практической работы
4. Домашнее задание
5. Значение изученной темы.
Ход урока:
Разъяснение цели урока.
Знание темы «Окислительно-восстановительные реакции», понимание процессов окисления и восстановления необходимо современному специалисту, так как многие процессы в технике и промышленности являются окислительно-восстановительными. В живой природе процессы дыхания, выработки энергии в клетках являются окислительно-восстановительными. Получение металлов из руд также является окислительно-восстановительным процессом.
- Актуализация знаний
Краткое сообщение студента о взаимосвязи изученной темы и выбранной специальности (для нетехнических специальностей – взаимосвязь с физикой, биологией, повседневной жизнью). Сообщение должно быть подготовлено как индивидуальное домашнее задание.
Вопросы к аудитории.
17. Объяснение терминов и определений
Презентация: Окислительно-восстановительные реакции.
Задание:
• Определите степени окисления элементов в веществах:
• Сера
• Азотная кислота
• Вода
• Фосфат калия
• Оксид натрия
- Формирование и закрепление умений составлять уравнения реакций методом электронного баланса в ходе практической работы
Демонстрационный опыт:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 +5Na2SO4 + K2SO4 + 3H2O
Выполнение практической работы:
– Работа в парах постоянного состава – составление уравнения ОВР по алгоритму, представленному в методическом пособии.
– Индивидуальные задания по вариантам в методическом пособии.
- Домашнее задание
Оформление отчета по практической работе
Значение изученной темы
Сообщение «Окислительно-восстановительные реакции в металлургических процессах»
Урок 34.
Лабораторная работа 6. Важнейшие окислители Влияние среды раствора на ход реакции
Цель работы.Изучение окислительно-восстановительных свойств различных веществ, типов окислительно-восстановительных реакций, а также методов составления уравнений окислительно-восстановительных реакций (ОВР).
Пояснения к работе
Перманганат-ион – сильный окислитель, но его окислительная способность ослабевает с уменьшением кислотности раствора. Под действием восстановителей в щелочной среде MnO4— восстанавливается до манганат-иона MnO42—:
MnO4— + e— = MnO42—,
В нейтральной, слабокислой и слабощелочной среде MnO4— переходит в диоксид марганца MnO2:
MnO4— + 2H2O + 3e— = MnO2 + 4OH—
В кислотной среде перманганат-ион превращается в аквакатион [Mn(H2O)6]2+:
MnO4— + 8H3O+ + 5e— = [Mn(H2O)6]2+ + 4H2O
Разбавленные водные растворы перманганата калия неустойчивы, они разлагаются (особенно быстро под действием солнечных лучей) с образованием бурого осадка диоксида марганца и выделением кислорода:
4KMnO4 + 2H2O = 4KOH + 4MnO2¯ + 3O2
Особенно быстро раствор KMnO4 портится в присутствии восстановителей, органических веществ, которые всегда есть в воздухе. Этиловый спирт C2H5OH: так реагирует с перманганатом калия
2KMnO4 + 3C2H5OH = 2KOH + 2MnO2¯ + 3CH3CHO + 2H2O
В подкисленном растворе вместо MnO2 образуются бесцветные катионы Mn2+. Например, в присутствии серной кислоты взаимодействие перманганата калия с таким общепризнанным восстановителем, как сульфит натрия, дает сульфат марганца и сульфат натрия, а также сульфат калия и воду:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Точно такая же реакция, но проведенная в сильнощелочной среде, дает манганат-ионы MnO42— зеленого цвета:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
Химики прошлого прозвали перманганат калия «хамелеоном»
Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4H2O
Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска».
Порядок работы.
cyberpedia.su
План-конспект урока по химии (9 класс) по теме: Составление уравнений окислительно – восстановительных реакций методом электронного баланса.
Тема: Составление уравнений окислительно – восстановительных
реакций методом электронного баланса.
Цель: Развивать умения составлять уравнения окислительно – восстановительных
реакций методом электронного баланса, выявлять окислители и
восстановители на основе сравнения степеней окисления атомов,
расставлять коэффициенты в уравнениях окислительно –
восстановительных реакций.
Тип урока: комбинированный.
Дидактические и материальные оснащения: Периодическая система химических элементов Д.И.Менделеева.
Содержание и ход урока.
I. Организационный момент.
II. Актуализация знаний, умений и навыков.
Устный опрос.
- На конкретных примерах объясните возможные степени окисления атомов.
- Объясните на конкретных примерах, какие вещества могут быть восстановителями?
- Объясните на конкретных примерах, какие вещества могут быть окислителями ?
- Что такое окислительно – восстановительная двойственность?
Письменный опрос.
Проверка выполнения упражнений заданных на дом.
III. Формирование новых знаний, умений и навыков.
Одним из методов составления уравнений окислительно – восстановительных реакций является метод электронного баланса.
Для составления уравнения окислительно – восстановительных реакций методом электронного баланса необходимо:
- Составить схему реакции – записать формулы исходных веществ и продуктов реакции;
- Отметить элементы, атомы которых изменили степень окисления в результате реакции. Найти среди исходных веществ окислитель и восстановитель;
- Составить электронные уравнения для процессов окисления и восстановления;
- Составить схему электронного баланса. Для этого в электронных уравнениях необходимо подобрать коэффициенты при окислителе и восстановителе так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении. Найденные коэффициенты записать в правой части электронного баланса;
- Расставить коэффициенты для оставшихся веществ в следующей последовательности: вещества, содержащие атомы металлов и кислотные остатки, водород и кислород;
- Проверить число атомов кислорода в обеих частях схемы;
1. 2K+I- +CI20 = 2K+CI- + I20
2I- — 2e = I20 2 1 B
CI20 + 2e = 2CI- 2 1 O
Если окислитель или восстановитель в исходных веществах или продуктах реакции представлен двумя атомами (Н2, О2), то в электронных уравнениях надо брать сразу же два атома. Цифру два ставят перед ионом или справа внизу при записи молекулы.
2. 2K+Mn+7O4-2 + 3K2+S+4O3-2 + h3+O-2 = 2Mn+4O2-2 + 3K2+S+6O4-2 + 2K+O-2H+
Mn+7 + 3e = Mn+4 3 2 O
S+4 – 2e = S+6 2 3 B
3. h3+S-2 + 4CI20 + 4h3+O-2 = h3+S+6O4-2 + 8H+CI-
S-2 – 8e = S+6 8 4 1 B
CI20 +2e = 2CI- 2 1 4 O
4. 2Ag+N+5O3-2 = 2Ag0 + 2N+4O2-2 + O20
Ag+ +e = Ag0 1} 2 2 O
N+5 +e = N+4 1}
2O-2 – 4e = O20 4 4 1 B
5. 3S0 + 6K+O-2H+ = 2K2+S-2 + K2+S+4O3-2 + 3h3+O-2
S0 + 2e = S-2 2 1 2 O
S0 – 4e = S+4 4 2 1 B
IV. Применение знаний, умений и навыков.
Для данных окислительно – восстановительных реакций составьте схему электронного баланса, укажите окислитель и восстановитель, расствьте коэффициенты.
Эл.ток
1. h3O === h3 + O2
2. CuSO4 + Fe = Cu + FeSO4
3. CuS + HNO3 = Cu(NO3)2 + S + NO + h3O
4. Nh4 + O2 = N2 + h3O
5. KCIO3 = KCI + KCIO4
6. SO2 + h3O + NaIO3 = h3SO4 + NaI
V. Д/З s 3, упр. 1.
nsportal.ru
 + 2ОН—
+ 2ОН— + 2ОН—
+ 2ОН— й
й + 2Н2О
+ 2Н2О