Составление химических формул простым и доступным языком
Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула — это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является «валентность«. Валентность — это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций — 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую — 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li 3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
Алгоритм составления химических формул
www.alto-lab.ru
Составление формул веществ по валентности элементов. Видеоурок. Химия 8 Класс
В уроке рассматривается алгоритм составления химических формул веществ по известным валентностям химических элементов. Учитель объяснит два разных способа вывода химической формулы вещества.
Графические (структурные) формулы показывают порядок соединения атомов в молекуле и реализацию валентных возможностей атомов элементов. Зная валентности атомов элементов и используя графическую формулу, можно вывести химическую формулу вещества.
Пример. Сера может иметь валентность IV, а валентность кислорода всегда равна II. Составим формулу вещества, образованного этими элементами.
Обозначим валентные возможности атомов черточками: =S= и =O .
Атомы серы могут быть связаны только с атомами кислорода, таким образом, что бы все связи серы и кислорода были задействованы. Для насыщения всех валентных возможностей атома серы необходимо два атома кислорода. Число общих единиц валентностей равно четырем. Таким образом, графическая формула данного вещества: О=S=О.
Для насыщения всех валентных возможностей атома серы необходимо два атома кислорода. Число общих единиц валентностей равно четырем. Таким образом, графическая формула данного вещества: О=S=О. Химическая формула вещества – SO2. Название вещества — сернистый газ.
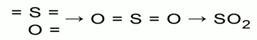
Рис. 1. Составление химической формулы сернистого газа
Можно выводить химические формулы вещества без использования графических формул.
Пример 1. Составим формулу вещества, образованного атомами серы (с валентностью IV) и атомами кислорода. Для этого:
1. запишем знаки элементов – серы и кислорода, а над ними укажем их валентности;
2. определим число общих единиц валентности, оно равно наименьшему общему кратному валентностей элементов: НОК (2,4)= 4;
3. определим число атомов каждого химического элемента в молекуле, разделив число общих единиц валентности на валентность элемента;
4. запишем формулу вещества: SO2.
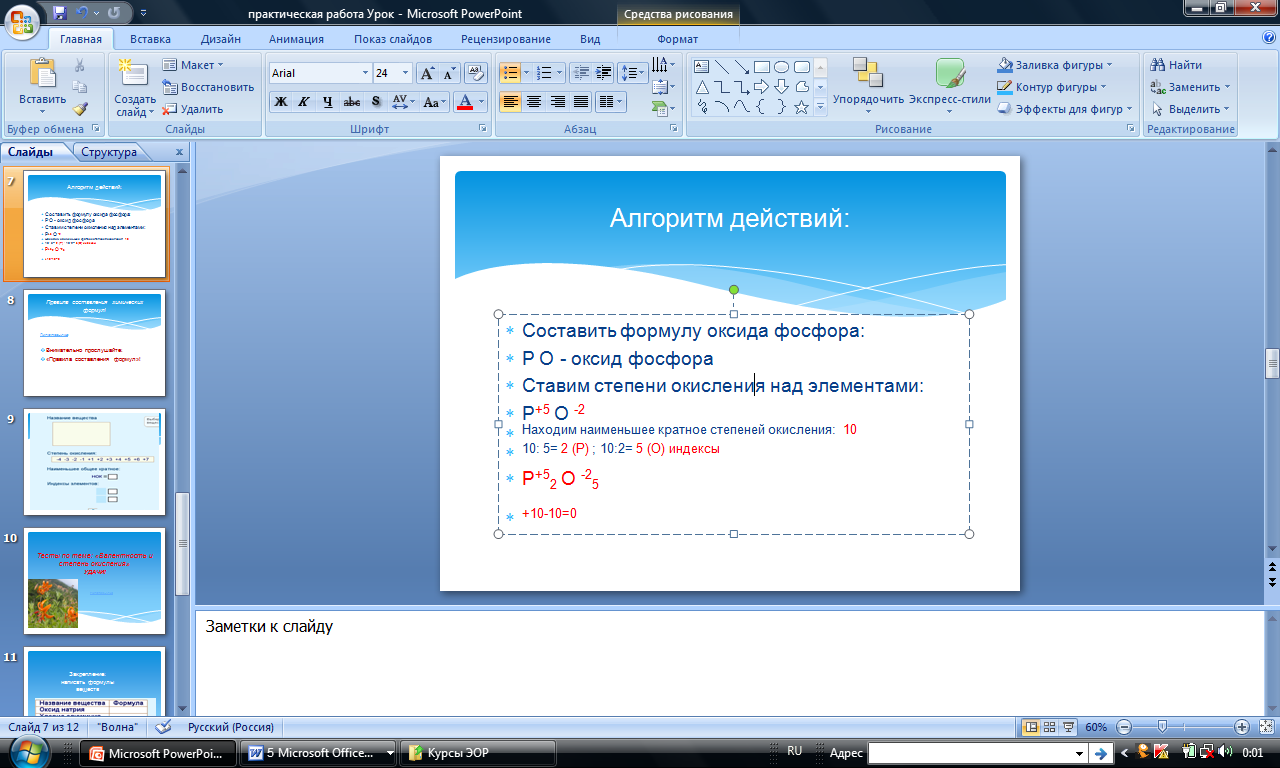
Пример 2. Составим формулу вещества, образованного атомами фосфора (с валентностью V) и атомами кислорода.
1. Запишем знаки элементов и над ними укажем их валентности: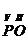
2. Найдем число общих единиц валентности: НОК(2,5)=10
3. Найдем число атомов фосфора в молекуле: 10:5=2.
4. Найдем число атомов кислорода в молекуле: 10:2=5.
5. Запишем формулу вещества: 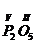 .
.
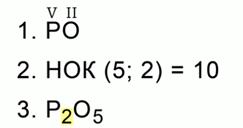
Рис. 2. Составление химической формулы оксида фосфора
Список рекомендованной литературы
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.33)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 36-38)3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§16)
4. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2016. (§§16-17)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
Домашнее задание
1. с.84 №№ 3,4
2. с. 38 № 9 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Урок по химии 8 класс «Составление химических формул»
План – конспект урока:
«Использование электронных образовательных ресурсов в работе педагога».
2
Место работы: МКОУ «Хаилинская средняя школа».
3
Должность: учитель химии и биологии.
4
Предмет: химия.
5
Класс: 8
6
Базовый учебник: Г.Е. Рудзитис, Ф.Г. Фельдман
7
Цель урока: научить учащихся составлять формулы химических соединений по валентности и степени окисления.
8
Задачи:
обучающие: научить составлять формулы бинарных соединений.
развивающие: вырабатывать умение логически рассуждать, грамотно излагать свои мысли, глубже осмыслить и понять ег.
воспитательные: развивать самостоятельность, сообразительность.
9
Тема урока: Составление химических формул.
10
Тип урока: Урок изучения и первичного закрепления новых знаний.
11
Техническое оборудование: компьютер, мультимедийный проектор
12
Структура и ход урока:
Этапы урока:
Организация начала урока.
Мотивация учебной деятельности.
Важность понимания изучения данной темы, заключается в ее биологическом смысле.
Вся Вселенная, в том числе и планета Земля и все царства (бактерии, грибы, простейшие, растения и животные) состоят из одних и тех же химических атомов, элементов. Атомы одинаковые и разные, соединяясь, образуют вещества неорганические и органические. Из веществ состоят все тела и предметы. Выразим через формулы – состав веществ.
Подготовка учащихся к усвоению, актуализация опорных знаний.
Учащиеся уже изучили и познакомились с такими понятиями как:
Закон постоянства состава вещества. (1799 – 1806 гг. – Ж. Пруст)
Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
Н а основе закона постоянства состава веществ можно вывести химические формулы.
2. Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Индекс в химических формулах обозначает число атомов.
Al 2 индекс O 3 индекс
Fe Cl 3 – индексВалентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность водорода принята за единицу.
Валентность кислорода равна двум.
Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электротрицательностью.
Степень окисления – условный заряд элемента.
Величину степени окисления определяет число электронов, смещенных от атомов менее электроотрицательного элемента к атому более электроотрицательного элемента.
Изучение нового материала.
Химические формулы это аналоги слов, как слова записываются с помощью букв, так и формулы записываются с помощью химических символов, знаков. Химические формулы отражают состав вещества.
Цель урока.
Задачи урока.
Составление химических формул по валентности.
Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. При составлении химических формул необходимо соблюдать порядок действий:
1.Пишут рядом химические знаки элементов, которые входят в состав соединения:
K O Al Cl AlO
2. Над знаками химических элементов проставляют их валентность:
I II III I III II
K O Al Cl Al O
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов:
2 3 6
I II III I III II
K O Al Cl Al O
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы
2 3 6
I II III I III II
K 2O Al Cl 3 Al2 O3
5. В названии веществ, образованных элементами с переменной валентностью, пишут в скобках цифру, показывающую валентность данного элемента в этом соединении.
Например,
Cu O – оксид меди (II)
Cu 2 O – оксид меди ( I)
Fe Cl 2 – хлорид железа (II)
Fe Cl 3 – хлорид железа(III)
6. Некоторые элементы в разных соединениях проявляют различную валентность.
(см. таблицу)
Валентность некоторых элементов в химических соединениях.
Химические элементы.
С постоянной валентностью
I
H Na K Li
II
O Be Mg Ca Ba Zn
III
Al B
С переменной валентностью
I II
Cu
II III
Fe Co Ni
II IV
Sn Pb
III V
P
II III VI
Cr
II IV VI
S
При составлении химических формул по степени окисления необходимо знать:
степени окисления элементов, образующих данное химическое соединение;
их элекроотрицательность, так как самый электроотрицательный элемент ставится последним;
сумма отрицательных и положительных степеней окисления в правильно составленной формуле всегда равна нулю.
Первичная проверка усвоения знаний.
Правила составления химических формул.
гиперссылка
Первичное закрепление знаний.
Тесты по теме: «Валентность и степень окисления»
гиперссылка
Контроль и самопроверка знаний.
Работа с учебником: Страница 37, упражнение 4, 5
Подведение итогов урока. Рефлексия.
Информация о домашнем задании.
Учебник: 12 Стр. 33 – 35; упр. 6,7 на стр. 37 на составление формул бинарных соединений по валентности .
13
Гиперссылки на ЭОР: http://fcior.edu.ru, school-collection.edu.ru
infourok.ru
Валентность. Составление химических формул по валентности
Класс 8 Дата урока
Тема урока: Валентность. Составление химических формул
по валентности
Цели. Дидактическая: рассмотреть понятие «валентность» как атомность элемента, познакомить учащихся с различными видами валентности (высшей и низшей, переменной и постоянной).
Психологическая: вызвать интерес к предмету, выработать умение логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно, оценивать ответы своих товарищей.
Тип урока. Комбинированный.
Методы обучения. Частично поисковый, репродуктивный, программированный опрос, беседа с элементами лекции.
Эпиграф к уроку. «Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны: свойства, состав, строение…» (Б.М.Кедров).
Оборудование. Модели молекул воды, углекислого газа, наборы для построения моделей молекул различных веществ, индивидуальные карточки для проверки домашнего задания и самостоятельной работы учащихся в группе, таблички-анаграммы для химической разминки, шкала для определения эмоционального состояния ученика.
ХОД УРОКА
 Ориентировочно-мотивационный этап
Ориентировочно-мотивационный этап
Психологическая разминка
Цель разминки – определить эмоциональное состояние учащихся. У каждого ученика на внутренней стороне обложки тетради приклеена табличка с шестью лицами – шкала для определения эмоционального состояния (рис.). Каждый ученик ставит галочку под той рожицей, чье выражение отражает его настроение.
Рис. Определи свое эмоциональное состояниеУчитель. Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клеточку влево.
Для этого нужно задуматься над вопросами: может ли человек полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать?
Химическая разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая относительная атомная масса.
«Маилинюй» – этот элемент называют «крылатым» металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы непрочными и хрупкими.
«Росфоф» – веществом, состоящим из атомов этого элемента, была намазана шерсть собаки Баскервилей.
Учитель. Если вы легко разгадали слова-анаграммы, скажите себе: «Я – молодец!»
Химические знаки и химические формулы
(Проверка домашнего задания)
Индивидуальная работа у доски по карточкам.
К а р т о ч к а 1(примерные задания для карточек)
Задание 1. Разгадай загадку:
«И графит я, и алмаз,
В организме есть у вас,
Хоть в печах меня и жгут –
Черным золотом зовут!»
Задание 2. Ответь на вопросы.
1. Какой химический знак имеет этот элемент?
2. К металлам или неметаллам он относится?
3. Какова его относительная атомная масса?
4. Рассчитай массовую долю этого элемента в соединении ЭО2.
Цифровой диктант
Контроль за выполнением диктанта учащиеся осуществляют методом взаимопроверки.
Задание. Напротив правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения и названия элемента, записаны два числа: верхнее – относительная атомная масса элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы атома, выраженной в а. е. м., никогда не совпадают численно.
6. Простыми называют вещества, состоящие из атомов одного элемента.
7. Индекс – это число, показывающее количество взятых частиц (атомов или молекул) вещества.
8. Массовая доля элемента показывает, какую часть (долю) составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н2О равна 20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 – 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
 Операционно-исполнительный этап
Операционно-исполнительный этап
Учитель. Вы знаете, что химические формулы веществ показывают количественные соотношения, в которых атомы соединяются между собой, вы также научились рассчитывать массовую долю элемента по химической формуле вещества. Например, в воде Н2О на один атом кислорода приходится два атома водорода, или 11% Н и 89% О. В углекислом газе СО2 на один атом углерода приходится два атома кислорода. (демонстрация моделей молекул данных веществ.)
Валентность
Учитель. Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
 Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
 Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
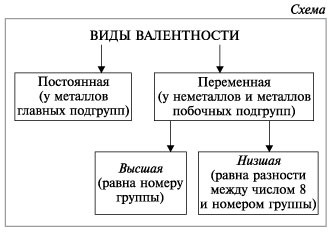
 Высшая валентность равна номеру группы.
Высшая валентность равна номеру группы.
 Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
Последовательность действийСоставление формулы оксида фосфора
1. Написать символы элементов
Р О
2. Определить валентности элементов
V II
P O
3. Найти наименьшее общее кратное численных значений валентностей
5•2 = 10
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов
10 : 5 = 2, 10 : 2 = 5;
P : О = 2 : 5
5. Записать индексы при символах элементов
Р2 О5
6. Формула соединения (оксида)
Р2О5
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 1. Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3,
Mg3N2, MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
 Закрепление изученного материала
Закрепление изученного материала
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой –
2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом приводит анализ ошибок.
Задание на дом. По учебнику «Химия-8» Л.С.Гузея: § 3.1, задания № 3, 4, 5, с. 51. Желающие могут подготовить сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
 Рефлексивно-оценочный этап и подведение итогов урока
Рефлексивно-оценочный этап и подведение итогов урока
Объявить оценки за урок отвечавшим ученикам, поблагодарить всех за работу на уроке. Провести оценку эмоционального состояния по шкале (см. рис.). Учитель еще раз напоминает вопросы, над которыми необходимо подумать для эффективной работы на следующем уроке.
Л и т е р а т у р а
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия-8, М.: Дрофа, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1988; Букреева Р.В., Быканова Т.А. Уроки новых технологий по химии. Воронеж, 1997.
infourok.ru
Методическая разработка по химии (8 класс) по теме: Задания к уроку «Составление химических формул по валентности»
Тема №11 «Составление химических формул по валентности».
- Номенклатура бинарных соединений.
Сложные вещества, состоящие из двух элементов, одним из которых является:
Br
Бромиды
NaBr
Cl
Хлориды
AlCl₃
О
Оксиды
ZnO
S
Сульфиды
BaS
N
Нитриды
Ca₃N₂
J
Йодиды
KJ
Н
Гидриды
NaH
Назовите вещества: CrCl₃, MnO₂, H₂O, Li₂S, SO₃, Ca₃N₂, BaO, FeCl₃.
- Вставьте пропущенные слова в фразах:
- в состав воды входят два …… водород и кислород.
- В организме человека содержится большое количество ………. элементов.
- …серной кислоты H₂SO₄ состоят из двух ….водорода, одного …. серы и четырех …..кислорода.
- …. хлорида алюминия состоит из ….двух ……..
- ……воды входят в состав всех живых организмов.
- …. азота образуют сложные органические вещества белки.
- Химический ……. алюминий занимает второе место по распространенности в земной коре.
- Составьте формулы:
— оксида углерода(II) — хлорида кобальта(II)
— оксида углерода (IV) — нитрида железа (III)
— хлорида фосфора(III) — сульфида меди(II)
— бромида алюминия — оксида марганца (VII)
— йодида магния — оксида хрома (III)
— гидрида калия — гидрида кальция
Ш. Определите валентности химических элементов в формулах NH₃ и CaO и составьте формулу соединения кальция с азотом, в которой они проявляют такую же валентность. Назовите все три вещества, встречающиеся в задании.
Д/з. 1.Определите валентность элементов в соединениях: KClO₃, AlPO₄, CaCO₃, FeSO₄
2. Перепишите формулы веществ, помещенных под номерами (I-VII) в левом столбце. Выберите и допишите соответствующие им названия из правого столбика (А-Ж):
I. Na₂S А. Нитрид……
II. MnO₂ Б. Хлорид……
III FeCl₃ В. Оксид…….
- Ca₃N₂ Г. Йодид……
- AlJ₃ Д. Сульфид….
- NiH₃ Е. Бромид……
- MgBr₂ Ж. Гидрид……
nsportal.ru
Разработка урока для 8 класса. Составление формул по валентности
Тема2.урок№ 11: Составление химических формул по валентности
Цели урока.
Дидактические:
опираясь на знания учащихся, повторить понятия “химическая формула”;
способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ;
акцентировать внимание школьников на возможности интеграции курсов химии, математики, ИКТ
Развивающие:
продолжить формирование умений формулировать определения;
разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества;
способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
воспитывать чувство товарищества, умение работать коллективно;
повысить уровень эстетического воспитания учащихся;
ориентировать учащихся на здоровый образ жизни.
Прививать умение самостоятельно добывать знания (использование Интернет ресурсов)
Оборудование для учащихся: компьютер, интернет
Ход урока
I. Организационный момент.
1. Проверка домашнего задания.
Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Что показывает химическая формула?
Что такое валентность?
Какие виды валентности вы знаете?
Как определить высшую валентность и нисшую?
1.Вычеркните ложные утверждения.
• Валентность является для всех химических элементов величиной постоянной. —
• Валентность химических элементов может быть как дробным числом, так и целым.
• При составлении химических формул значением валентности можно пренебречь.
• Валентность показывает сколько атомов других элементов, может присоединить к себе атом.
• Валентность водорода принята за единицу валентности.
• Валентность кислорода равна двум.
Посась2. Впишите валентность элементов цифрами.
1) Основной частью кварца является оксид кремния SiO2.
Валентность кремния в этом веществе равна .
2) Минерал флюорит – это фторид кальция CaF2.
Валентность кальция в этом веществе равна , валентность фтора – .
3) Галит или каменная соль с химической точки зрения является хлоридом натрия NaCl,
валентность натрия равна , валентность хлора – .
4) Минерал касситерит представляет собой оксид олова SnO2.
Валентность олова в этом оксиде равна .
3.Заполните пропуски.
1)Химическая формула соединения алюминия с серой(II) .
2)Химическая формула соединения серы (VI) со фтором .
3)Химическая формула соединения марганца(II) с кислородом .
4)Химическая формула соединения марганца (IV) с кислородом .
5) Химическая формула соединения марганца (VII) с кислородом .
MnS, SF4, Mn2O7, MnO2, MnO, SF6, Al2S3..

II. Изучение нового материала
Составление химических формул по валентности. алгоритм
С помощью химических знаков по валентности элементов можно составить формулу сложного вещества. Для этого необходимо знать:
— химические знаки элементов, входящих в состав сложного вещества;
— валентность элементов;
— уметь находить наименьшее общее кратное для валентностей элементов;
— определять индексы для атомов элементов.
Рассмотрим правила составления химических формул сложных соединений по валентности на примере неорганических веществ разных классов:
а) оксиды
Предположим, что нам необходимо вывести формулу оксида железа (III). Для этого нужно осуществить следующие действия:
— изображаем химические знаки элементов, входящих в состав сложного вещества:
FeO
— поставим над знаком каждого элемента валентность римской цифрой:
FeIIIOII
— найдем наименьшее общее кратное чисел единиц валентностей:
III × II = 6
— разделим наименьшее общее кратное на число единиц валентности каждого элемента в отдельности (полученные частные и будут индексами в формуле):
6 / 3 = 2;
6 / 2 = 3;
Fe2O3.
б) основания, соли и кислоты
При составлении формул оснований и солей пользуются теми же действиями, что и при составлении формул оксидов. Различие заключается лишь в том, что вместо атома кислорода будут стоять гидроксогруппа (OH) или кислотные остатки (SO4, SO3, CO3, NO3, PO4, SiO3, S, Cl и т.д.).
2.Особенности составления химических формул соединений.
Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
III.Закрепление
№1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III IV III II I III
Li O Ca O P O PbO N H MnO Fe O H S N O Cr Cl
№2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) меди и хлора,
3) натрия и брома,
4) калия и серы.
№3.
Составьте бинарные формулы :
А) азот и кислород;
Б) железо и хлор;
В) литий и сера.
№4.
Составьте формулы веществ по их названиям:
оксид серы (IV) , хлорид железа (II), сульфид углерода, оксид азота (III), оксид азота (IV), хлорид серы (IV), сульфид углерода
№5.
Вычислите относительные молекулярные массы веществ Al2S3, Fe Cl2 по их химическим формулам.
IV. Подведение итогов
V.Домашнее задание§14,заданияна стр.63
infourok.ru
Формулы для решения задач по химии
Так как химия наука точная, она неразрывно связана с различного рода вычислениями. Чтобы решать задачи, нужно знать формулы и хорошо в них ориентироваться. Без этих базовых знаний и навыков изучение химии становится невозможным.
Мы собрали для вас основные химические формулы, изучаемые в школьном курсе. Они пригодятся каждому ученику, особенно тем, кто будет сдавать ОГЭ или ЕГЭ по этому непростому, но очень интересному предмету.
Нахождение количества вещества
Первое и основное понятие, которое необходимо усвоить – это количество вещества, измеряемое в молях и обозначающееся латинской буквой «n». Для его нахождения нужно основываться на условии задачи, так как вычислить количество вещества можно по трём формулам:
1) По массе. n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль).
2) По объёму. n=V/Vm — Отношением объёма вещества к его молярному объёму (используется для газов).
3) По числу молекул. n=N/NA – Число молекул вещества делённое на число Авогадро. Число Авогадро (NA) – физическая величина, указывающая на число молекул, содержащихся в 1 моле вещества, и численно равная 6,0221 * 1023 моль-1.
Формулы для нахождения массы
Массу вещества можно найти несколькими способами:
1. Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
2. Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
3. Перемножив массовую долю с массой раствора: m = m(р-ра) × ω.
Молярная масса (М) – это масса одного моля вещества. Вычисляется она следующим образом: посредством сложения атомных масс элементов, из которых состоит вещество, получаем относительную молекулярную массу. Молярная масса численно равна относительной молекулярной массе, но имеет размерность «г/моль». Также молярную массу можно найти с помощью отношения массы вещества к его количеству:
M = m/n
Формулы для нахождения объёма
Для вычисления объёма того или иного вещества можно воспользоваться одной из формул:
1. Объём раствора находится как отношение массы раствора к его плотности:
V(р-ра) = m(р-ра) / ρ
2. Объём газа равен отношению его количества вещества к молярному объёму:
V(газа) = n/VM
Молярный объём (VM) – объём, который занимает 1 моль вещества при определённых показателях давления и температуры. Находится при делении молярной массы вещества на его плотность:
VM = M/ρ
При нормальных условиях молярный объём газа равен 22,4 л/моль.
Формулы для нахождения плотности и относительной плотности
Плотность (ρ) – физическая величина, указывающая на массу определённого вещества, содержащуюся в единице объёма.
Следовательно, формула для её вычисления имеет вид:
ρ=m/V
Помимо основной, существует формула для нахождения плотности газа при нормальных условиях, где молярная масса делится на молярный объём газа при н.у.:
ρ=M/VM
Относительная плотность (D) газов – величина, указывающая насколько одно вещество тяжелее или легче другого. Вычисляется она отношением молярных масс газов:
D = M(1) / M(2)
Например, условием было найти плотность газа по водороду. Решение будет иметь вид: D = M(газа)/M(H2) = M(газа)/2. Относительная плотность является безразмерной величиной.
Формулы для нахождения концентрации
Молярная концентрация (С) – отношение количества растворённого вещества к объёму раствора. Единица измерения – моль/л. Молярная концентрация вычисляется по формуле:
С = n/V
Массовая концентрация чаще всего называется титром (Т). Это отношение массы растворённого вещества к объёму раствора. Единица измерения — г/л.
T = m/V
Массовая доля (ω) – это один из вариантов выражения концентрации. С её помощью можно вычислить процентное содержание растворённого вещества в общей массе раствора:
ω = (mр.в./mр-ра) × 100%
По такому же принципу вычисляется массовая доля определённого компонента в смеси:
ω = (mкомпонента / mсистемы) × 100%
Если возникает необходимость найти массовую долю химического элемента в соединении, то нужно относительную атомную массу этого элемента умножить на число атомов в соединении и разделить на молекулярную массу вещества:
ω = (Ar × N) / M
Формулы для нахождения выхода продукта реакции
Под выходом продукта реакции (ᶯ) подразумевается отношение массы (объёма, количества) вещества, полученного на практике, к теоретически возможному (рассчитанному по уравнению реакции). Единица измерения – доля, а проценты — если результат умножить на 100 !
Для его вычисления, в зависимости от условия задачи, используются следующие формулы:
ᶯ=(mпракт./mтеорет.) × 100%
ᶯ=(Vпракт./Vтеорет.) × 100%
ᶯ=(nпракт./nтеорет.) × 100%
Попрактиковать решение задач и знание формул возможно в приложении «ХиШник». Оно содержит в себе каталог заданий, которые, в свою очередь, разделены по темам и уровням сложности. Если вы дали неверный ответ, то приложение не просто уведомит об этом, а предложит правильный алгоритм решения. Также в нём есть раздел для подготовки к ОГЭ и ЕГЭ, в котором собраны типовые задания.
Знание расчётных формул – это ключевой момент при решении задач. Главное, понимать их, а не бездумно заучивать. Так как они будут использоваться не только в школьных задачах, на ЕГЭ и ОГЭ, но и в дальнейшей жизни, даже если ваша профессиональная сфера будет далека от химии.
hishnik-school.ru