Сильные и слабые электролиты — степень диссоциации
Электролиты — вещества, расплавы или растворы которых могут проводить электрический ток.
Неэлектролиты — вещества, расплавы или растворы которых не могут проводить электрический ток.
Диссоциация и степень диссоциации
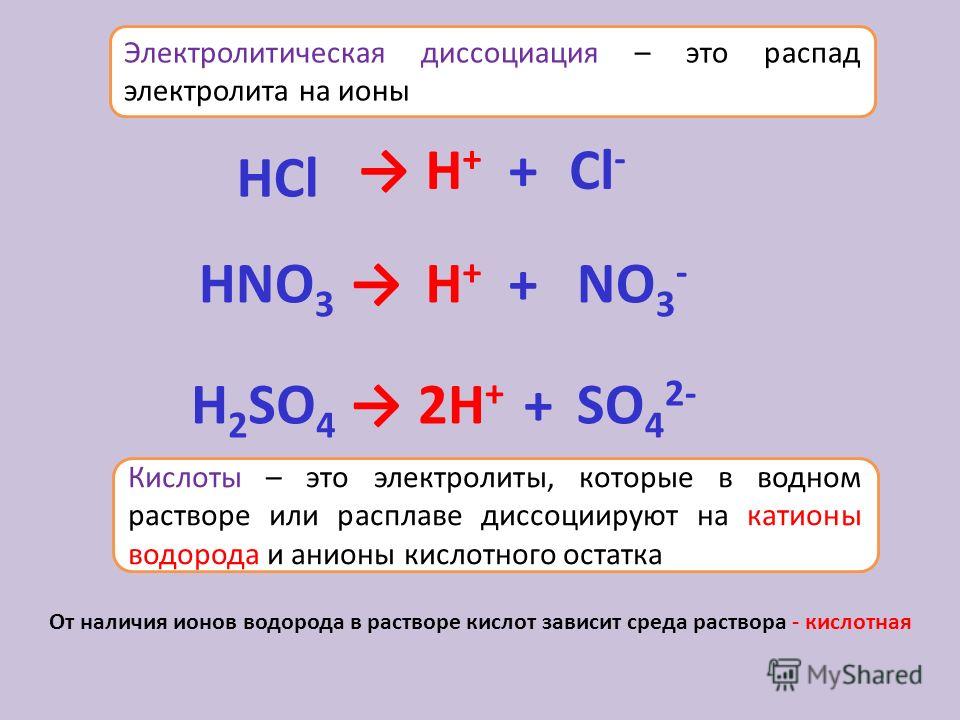
Диссоциация — это распад соединений на ионы.
Степень диссоциации (α) — это отношения числа продиссоциировавших, то есть распавшихся на ионы молекул к их общему числу растворенных молекул.
Формула:
Стрелкой → обозначают распад соединений на ионы.
Стрелкой ← обозначают обратный процесс.
Сильные электролиты
Сильные электролиты — это вещества, которые при растворении в воде почти полностью диссоциируют на ионы.
К сильным электролитам относятся:
- Многие неорганические кислоты, такие как: h3SO4, HNO3, HClO3, HMnO4, HClO4, HBr, HCl, HI.
- Основания щелочноземельных (Ca(OH)2, Ba(OH)2, Sr(OH)2) и щелочных (KOH, NaOH, LiOH) металлов.
- Растворимые соли.
Слабые электролиты
Слабые электролиты — это такие вещества, которые только частично диссоциируют на ионы.
Поэтому в уравнениях диссоциации ставят знак обратимости (⇄) для слабых электролитов.
К слабым электролитам относятся:
- Вода и практически все органические кислоты.
- Некоторые неорганические кислоты: h4PO4, h3SiO3, h3S, h4PO4, HNO2, h3CO3.
- Нерастворимые гидроксиды металлов: Zn(OH)2, Mg(OH)2, Fe(OH)2.

Сильные и слабые электролиты
Как различить сильные и слабые электролиты? Сильные электролиты в растворах почти полностью диссоциированы. К данной группе в большой степени относятся соли, сильные кислоты и щелочи. Слабые электролиты включают слабые основания и кислоты, а также некоторые соли, цианид ртути (II), хлорид ртути (II), иодид кадмия и роданид железа (II).
Степень диссоциации, сильные и слабые электролиты — видео
Растворы и электролиты — список препаратов

Лекарства
Название, производитель Применение Животные Метастоп, ВЕДА Препарат применяют до и послеоперационный период в качестве

Лекарства
Название, производитель Применение Животные 8 в 1 Эксель Детер, 8 in 1 Pet Products

Лекарства
Название, производитель Применение Животные Дельцид, Агроветзащита Препарат применяют для обработки при арахно-энтомозах, а также

Лекарства
Название, производитель Применение Животные Делеголь, Байер Препарат предназначен для дезинфекции Поверхности, помещения Экоцид С,

Лекарства
Название, производитель Применение Животные Био Спот-он спрей для кошек, Beaphar Препарат применяют для ухода

Лекарства
Название, производитель Применение Животные Анальгивет, АлексАнн Препарат назначают при лечении заболеваний опорно-двигательного аппарата, сопровождающихся
что такое электролиты и приведите примеры пожалуйста
Электролиты — то вещества, которые в расплавах и растворах распадаются на ионы (диссоциируют) и поэтому из расплавы и растворы проводят электрический ток. К электролитам относятся основания, кислоты, соли, т. е. вещества, у которых имеются сильно полярные и ионнные связи. Чем выше степень ионности связи, тем легче идёт процесс диссоциации. Растворы электролитов входят в состав ЛЮБОЙ живой клтки, т. е. Вы, Александр, — ходячий электролит. Это и кровь, и нервы, и все физиологические жидкости. Именно они растворы электролитов, обеспечивают электропроводность, т. е. прохождение нервных импульсов, позволяют вам двигаться, думать и ощущать
К сожалению не знаю, какое определение нынче используется в школьных учебниках, обычно они сильно отстают, а в науке ЭЛЕКТРОЛИТОМ называется материал (жидкость, раствор, гель, твёрдое тело, но не газ и не плазма) с низкой электронной и высокой ионной проводимостью. Примеры. Раствор кислоты (h3SO4) в воде — применяется в автомобильных свинцовых аккумуляторах. Расплавленная соль (NaCl) Используется при производстве натрия. Раствор перхлората лития LiClO4 в пропиленкарбонате — электролит литиевых батареек. Сульфированный политетрафторэтилен (торговое название Nafion) — электролит генераторов водорода, водородных топливных элементов, твердоэлектролитных онденсаторов. Керамика кубического диоксида циркония (того самого, который вместо бриллиантов в колечках) — в высокотемпературных топливных элементах и электрохимических кислородных насосах….
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)
Приведите пожалуйста по три примера электролитов и неэлектролитов
Вот ведь знаю же я вашу химию 9 класса как облупленных. Габриэлян небось сто пудов, электролитическую диссоциацию проходите. Лан, смотри: Неэлектролиты: С2Н5ОН, дистиллированная Н2О и пускай бкдет раствор сахара в воде С6Н12О6. вобще, органические в-ва не диссоциируют как правило. Электролиты все в-ва, которые способны диссоциироваться и имеют положит. и отрицат. ион. Пускай это будут известные всем кислоты: HNO3 (H+ NO3-), HCl (H+ Cl-), h4PO4. Кислотный остаток — как правило анион, т. е. отрицат. заряженный, или анион кислотного остатка.
Электролиты. HNO3 (H+ NO3-), HCl (H+ Cl-), h4PO4 Неэлектролиты. С2Н5ОН, дистиллированная Н2О и пускай бкдет раствор сахара в воде С6Н12О6.
если рассматривать неэлектролиты в водном растворе то наиболее простым типом являются инертные газы.