Урок 33. Получение и применение оксидов – HIMI4KA
В уроке 33 «Получение и применение оксидов» из курса «Химия для чайников» узнаем как получать оксиды различными способами, а также познакомимся с широким спектром применения оксидов во всех отраслях промышленности и быта.


Получение оксидов
1. Взаимодействие простых веществ с кислородом
Некоторые оксиды образуются в результате сжигания в кислороде (или на воздухе) соответствующих простых веществ. Так можно получить оксиды углерода(IV), серы(IV), фосфора(V), магния и других неметаллов и металлов:
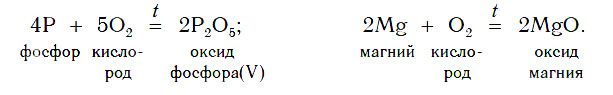
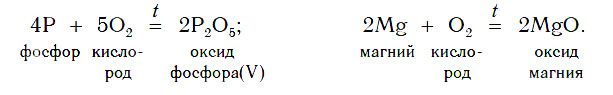
2. Взаимодействие сложных веществ с кислородом
Оксиды можно получать также сжиганием в кислороде (или на воздухе) некоторых сложных веществ, например:


3. Термическое разложение нерастворимых оснований

Применение оксидов
Один из наиболее широко использующихся оксидов — вода H2O, о применении которой в быту, технике и ромышленности вы уже знаете.
Разнообразное применение находят и некоторые другие оксиды. Так, например, из оксида железа(III) Fe2O3, входящего в состав железных руд, в промышленности получают железо, а из оксида алюминия Al2O3 — алюминий. Оксид алюминия применяют также для изготовления искусственных драгоценных камней — рубина и сапфира. Мелкие кристаллы этого оксида применяются также в производстве наждачной бумаги.
Оксид углерода(IV) (углекислый газ) используют в пищевой промышленности для изготовления всех газированных напитков, для увеличения срока сохранности фруктов и овощей. Этим веществом наполняют углекислотные огнетушители. Твердый оксид углерода(IV) под названием «сухой лед» (рис. 117) применяют для хранения мороженого, для сильного охлаждения различных материалов.


Достаточно широко используется и оксид серы(IV) SO2 (сернистый газ). Он находит применение в производстве серной кислоты, для дезинфекции складских помещений, уничтожения вредных насекомых и бактерий, отбеливания бумаги.
Оксид кремния(IV) SiO2 в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца(II) PbO он применяется для изготовления полудрагоценных камней и украшений («кристаллы Сваровски»).
Оксид кальция СaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок. Так, например, Fe2O3 используют для изготовления краски коричневого, Сr2O3 — зеленого, ZnO и TiO2 — белого цветов.
Краткие выводы урока:
- Оксиды образуются при взаимодействии кислорода с простыми и сложными веществами.
- Оксиды можно получить термическим разложением нерастворимых оснований.
- Оксиды находят широкое практическое применение в промышленности и в быту.
- Оксиды — вода H2O и углекислый газ СО2 — участвуют в процессе фотосинтеза.
Надеюсь урок 33 «Получение и применение оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
«Оксиды, свойства, их получение и применение»
Методическая разработка открытого занятия.
Тема занятия: Оксиды: получение, свойства, применение.
Цель занятия: систематизировать, углубить знания обучающихся об оксидах, способах их получения, свойствах и областях применения;
Задачи занятия:
Обучающий аспект:
Уменить применять знания на практике,
Оперировать терминологией по данной тематике.
Показать различия и сходство между кислотными и основными оксидами.
Научить подставлять в схему формулы оксидов и писать соответствующие химические уравнения.
Закрепить умение расстановки коэффициентов в уравнениях реакций.
Развивающий аспект: развивать у обучающихся активизацию к деятельности и логическое мышление.
Воспитательный аспект: способствовать формированию сотрудничество и сплоченность в коллективе.
Оборудование: Периодическая система химических элементов Д.И. Менделеева,
таблица «Оксиды», блок-схема «Получение и химические свойства оксидов»
Лабораторное оборудование: спиртовка, спички, пробиркодержатель, вещества: медная проволока, этанол.
Ход урока
I. Организационный момент. Выбор эксперта!!!!!(учет дополнительных баллов)
II. Актуализация знаний: (Демонстрационные опыты)
1.!!! Демонстрационный опыт — окисление меди
(оксид меди (II) (черный налет) кислородом в пламени спиртовки
!!! Демонстрационный опыт – горение C2H5OH этанол
2. Фронтальный опрос обучающихся по вопросам:
1) Вещества подразделяют на простые и сложные, укажите их отличия?
2) Перечислите классы неорганических соединений.
3) Дайте определение понятию «Оксиды».
4) Общая формула оксидов.
5) Перечислите виды оксидов.
6) . В каком агрегатном состоянии можно встретить оксиды? Приведите примеры.
7) Дайте определения понятий основных, кислотных, амфотерных оксидов.
III. Закрепление:
По вопросам основного содержания:
1. Основные способы получения оксидов.
2. Химические свойства:
— основных оксидов;
— кислотных оксидов;
— амфотерных оксидов.
3. Области применения оксидов.
1. Обучающиеся делятся на микрогруппы для повторения материала по определенному плану. Основные, кислотные, амфотерные оксиды.
По ходу урока обучающиеся записывают материал на доску.
2. Химические свойства оксидов.
1) Основные оксиды.
а) взаимодействие с кислотами: BaO + 2HCl = BaCl2 + H2O
б) взаимодействие с водой: MgO + H2O = Mg(OH)2
в) взаимодействие с кислотным оксидом: CaO + CO2 = CaCO3
г) взаимодействие с амфотерным оксидом: Na
2) Кислотные оксиды.
а) взаимодействие с водой: SO3 + H2O = H2SO4
б) взаимодействие с основанием: Ca(OH)2 + CO2 = CaCO3 + H2O
в) взаимодействие с основным оксидом: CO2 + CaO = CaCO3
3) Амфотерные оксиды.
а) взаимодействие с кислотами: ZnO + 2HCl = ZnCl2 + H2O
б) взаимодействие с основаниями: ZnO + 2NaOH = Na2ZnO2 + H2O
3. Получение оксидов.
1) окисление металлов: 2Cu + O2 = 2CuO ! Демонстрационный опыт — окисление меди
оксид меди (II)( черный налет) кислородом в пламени спиртовки
2) окисление неметаллов: C + O2 = CO2
3) разложение кислот
4) разложение солей
5) разложение оснований
6) вытеснение из солей другими оксидами
7) горение сложных веществ: ! Демонстрационный
этанол опыт – горение C2H5OH
в ложечке для сжигания
веществ
4. Применение оксидов:
Fe2O3 – оксид железа (III) – темно-красного цвета – гематит или красный железняк – для изготовления красок.
Fe3O4 – оксид железа (II, III) – минерал магнетит или магнитный железняк, хороший проводник электричества – для получения и изготовления электродов.
CaO – оксид кальция (II) – порошок белого цвета – «негашеная» известь, используют в строительстве.
Al2O3 – оксид алюминия (III) – минерал твердый корунд – как полирующее средство.
SO2 – оксид серы (IV) или сернистый газ – бесцветный газ, имеющий удушливый запах, убивает микроорганизмы, плесневые грибки – окуривают подвалы, погреба, при перевозке и хранении фруктов и ягод.
CO2 – оксид углерода (IV), углекислый газ. Твердый оксид углерода – сухой лед. Для изготовления соды, сахара, газированных напитков, в жидком виде в огнетушителях.
SiO2 – оксид кремния (IV) – твердое, тугоплавкое вещество в природе в двух видах:
1) кристаллический кремнезем – в виде минерала кварца и его разновидностей: горный хрусталь, халцедон, агат, яшма, кремень – используют в силикатной промышленности, строительстве.
2) аморфный кремнезем SiO2 ∙ nH2O – минерал опал.
Применяют соединения оксида кремния в ювелирном деле, изготовлении химической посуды, кварцевых ламп.
Для создания цветных стекол используют следующие оксиды:
Cо2O3 – синий цвет , Cr2O3 – зеленый цвет, MnO2 – розовый цвет.
IV. Задания для взаимоконтроля:
1. Написать формулы оксидов, определить их вид? (оксид натрия, оксид железа (II), оксид серы (IV), оксид алюминия, оксид углерода(II))
2. Закончите уравнения химических реакций, дайте название веществам:
а) P + O2 →
б) Al + O2 →
в) H2SO4 + Fe2O3 →
г) BaO + HCl →
д) C2H4 + O2 →
3. Написать уравнения реакций химических свойств следующих оксидов:
1 вариант 2 вариант
a) SO2 a) MgO
б) Na2O б) CO2
V. Проверочная работа на доске
Тема занятия: Оксиды: получение, свойства, применение.
Цель занятия: систематизировать, углубить знания обучающихся об оксидах, способах их получения, свойствах и областях применения;
Задачи занятия:
Обучающий аспект:
Уменить применять знания на практике,
Оперировать терминологией по данной тематике.
Показать различия и сходство между кислотными и основными оксидами.
Научить подставлять в схему формулы оксидов и писать соответствующие химические уравнения.
Закрепить умение расстановки коэффициентов в уравнениях реакций.
Развивающий аспект: развивать у обучающихся активизацию к деятельности и логическое мышление.
Воспитательный аспект: способствовать формированию сотрудничество и сплоченность в коллективе.
Оборудование: Периодическая система химических элементов Д.И. Менделеева,
таблица «Оксиды», блок-схема «Получение и химические свойства оксидов»
Лабораторное оборудование: спиртовка, спички, пробиркодержатель, вещества: медная проволока, этанол.
Ход урока
I. Организационный момент. Выбор эксперта!!!!! (учет дополнительных баллов)
II. Актуализация знаний: (Демонстрационные опыты)
1.!!! Демонстрационный опыт — окисление меди
(оксид меди (II) (черный налет) кислородом в пламени спиртовки!!! Демонстрационный опыт – горение C2H5OH этанол
2. Фронтальный опрос обучающихся по вопросам:
III. Закрепление:
По вопросам основного содержания:
1. Основные способы получения оксидов.
2. Химические свойства:
— основных оксидов;
— кислотных оксидов;
— амфотерных оксидов.
3. Области применения оксидов.
IV. Задания для взаимоконтроля:
V. Контроль знаний (проверочная работа)
infourok.ru
Химические свойства оксидов
Оксиды | |||
Основные Na2O, CaO, MgO, CuO, Fe2O3, ВаО | Кислотные SO2, SO3, P2O5, CO2, Cl2O, Mn2O7, CrO3 | Амфотерные ВеО, ZnO, PbO, MnO2, SnO, Al2O3, Cr2O3 | |
С водой | Реагируют только оксиды щелочных и щелочноземельных металлов, образуя щелочи: Na2O+H2O= 2NaOH | Образуют кислоты: SO3+H2O=H2SO4 | Не взаимодействуют |
С кислотами или основаниями | Взаимодействуют с кислотамис образованием соли и воды: CаO+ 2HCl= = CаCl2 +H2O | Взаимодействуют с основаниямис образованием соли и воды: CO2 + Ba(OH)2 = = BaCO3 + H2O | Взаимодействуют с кислотами как основные оксиды:BeO+ 2HNO3=Be(NO3)2+H2O и с основаниями как кислотные оксиды: BeO +
2KOH BeO
+ 2KOH + H2O
= K |
Между собой | При взаимодействии основного и кислотного оксидов образуется соль: Na2O +SO3= Na2SO4 | ||
Одним из способов получения оксидов является взаимодействие простых веществ с кислородом: 2Са + O2 = 2СаO; С + O2 = СО2.
Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка (HNO3, HCl, H2SO4, Н3РО4).
Кислоты взаимодействуют
1. С основаниями с образованием соли и воды:
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O.
2. С основными и амфотерными оксидами с образованием соли и воды:
2HCl + ВаO = ВаCl2 + H2O;
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O.
3. С солями с образованием новой соли и новой кислоты:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3.
Одним из способов получения кислот является взаимодействие кислотного оксида с водой:
P2O5 + 3H2O = 2H3PO4.
Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами (NaOH, Cu(OH)2, Fe(OH)3).
Основания взаимодействуют
1. С кислотами с образованием соли и воды:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
2. С кислотными и амфотерными оксидами с образованием соли и воды:
2KOH + N2O5 = 2KNO3 + H2O;
2NaOH + Al2O3 + 3Н2О = 2Na[Al(OH)4];
2NaOH
+ Al2O3 2NaAlO2 + H2O.
2NaAlO2 + H2O.
3. С солями с образованием новой соли и нового основания:
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl.
Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой:
2Na + 2H2O = 2NaOH + H2↑;
BaO + H2O = Ba(OH)2.
Нерастворимые в воде основания получают реакцией обмена:
Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4.
Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками.
Средние соли (К2SO4, Na3PO4) – это продукты полного замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотные остататки: H2SO4 + 2KOH = K2SO4 + 2H2O;
Mg(ОН)2 + 2HCl = MgCl2 + 2Н2О.
Кислые соли (Сa(HCO3)2, Nа2НРО4) – это продукты неполного замещения водорода в кислоте на металл:
KOH + H2SO4 = KHSO4 + H2O.
Кислые соли образуют только многоосновные кислоты, например H2SO4, Н3РО4, Н2СО3, H2S.
Основные соли (СuOHNO3, AlOHCl2) – это продукты неполного замещения гидроксогрупп в основании на кислотные остатки:
Fe(ОН)3 + HNO3 = Fe(OH)2NO3 + 2Н2О;
Fe(ОН)3 + 2HNO3 = FeOH(NO3)2 + 2Н2О.
Основные соли образуют только многокислотные основания, например Сu(OH)2, Fe(OH)3, Mg(ОН)2.
studfile.net
 K2BeO2 + H2O;
K2BeO2 + H2O;