Двойные соли: номенклатура, примеры
Соли делятся на средние, кислые, основные, двойные и смешанные. Все они имеют широкое применение в быту, но еще большее — в промышленности. Понимание классификации солей дает возможность понять основы химии.
Как классифицировать соли
Для начала дадим определение солям. Они являются химическими соединениями, в которых с кислотным остатком соединен атом металла. В отличие от остальных классов веществ, для солей характерна ионная химическая связь.
Представители этого класса подразделяются на несколько групп, имеющих специфические особенности.
Нормальные соли
Средние соли в своем составе имеют только катионы определенного металла и кислотный остаток. В качестве примера подобных соединений можно упомянуть хлорид натрия, сульфат калия. Именно эта группа считается самой распространенной в земной коре. Среди способов их получения отметим процесс нейтрализации, осуществляемый между кислотой и основанием.
Кислые соли
Эта группа соединений состоит из металла, водорода, а также кислотного остатка. Образуют подобные соединения многоосновные кислоты: фосфорная, серная, угольная. В качестве примера кислой соли, имеющей широкое распространение в повседневной жизни, можно отметить гидрокарбонат натрия (питьевая сода). Получают такие вещества путем взаимодействия между средней солью и кислотой.
Образуют подобные соединения многоосновные кислоты: фосфорная, серная, угольная. В качестве примера кислой соли, имеющей широкое распространение в повседневной жизни, можно отметить гидрокарбонат натрия (питьевая сода). Получают такие вещества путем взаимодействия между средней солью и кислотой.
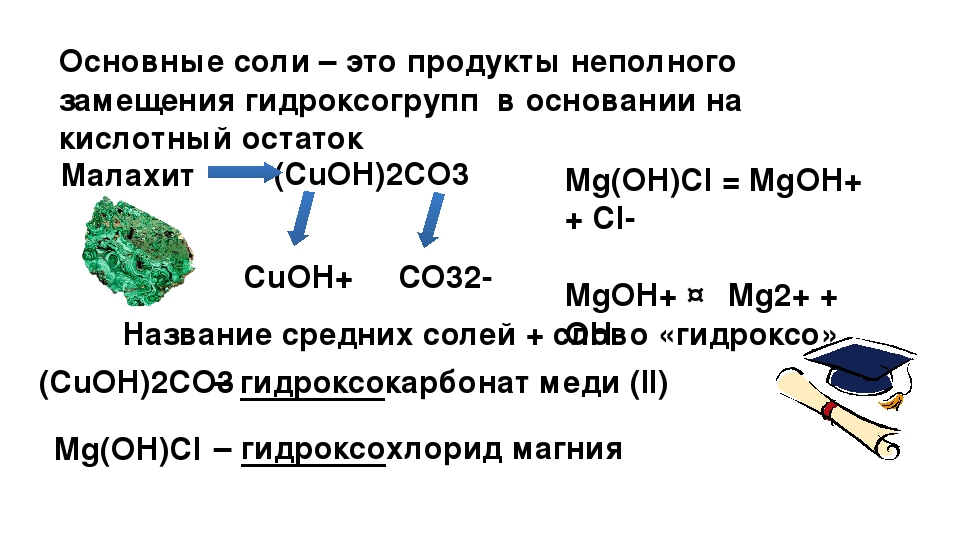
Основные соли
В этих соединениях присутствуют катионы металла, гидроксильная группа, а также анионы кислотного остатка. Примером основной соли является гидроксохлорид кальция.
Смешанные соли
Двойные соли подразумевают наличие двух металлов, которые замещают водород в кислоте. Образование веществ подобного состава характерно для полиосновных кислот. Например, в карбонате натрия калия присутствуют сразу два активных металла. Двойные смешанные соли имеют значение для химической промышленности, широко используются в быту.
Особенности смешанных солей
Двойные соли калия и натрия содержатся в природе в виде сильвинита. Также калий способен образовывать смешанные соли с алюминием.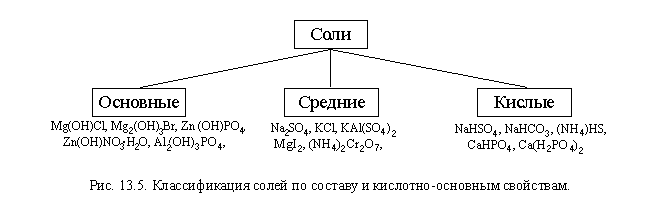
Смешанные (двойные) соли представляют собой соединения, которые состоят из различных анионов либо катионов. К примеру, хлорная известь в своем составе имеет анион хлорноватистой и хлороводородной кислоты.
Особый интерес представляют двойные соли аммония. Большая часть получаемых веществ используется в качестве минеральных удобрений.
Получение двойных солей аммония осуществляется путем взаимодействия аммиака с многоосновными кислотами. Диаммонийфосфаты востребованы в изготовлении антипиренов (огнезащитных веществ). Двойные соли, не содержащие примесей, необходимы в фармацевтической и пищевой промышленности.
Промышленное значение имеют аммонийцинковые, магниевые фосфаты. Из-за несущественной растворимости в воде, такие соли выполняют функцию антипиренов в красках и пластических массах.
Эти двойные соли подходят для пропитки тканей и древесины, защиты поверхностей от повышенной влажности. Железные и алюминиевые аммониевые фосфаты – отличное средство для защиты металлических конструкций от процессов естественной коррозии.
Примеры двойных солей, имеющих техническое значение, можно привести для железа и цинка. Они являются питательной средой для выращивания дрожжей, востребованы в изготовлении спичек, производстве изоляционных материалов, слюды.
Получение
Двойные соли аммония получают путем термического насыщения фосфорной кислоты аммиаком и определенной щелочью. Промышленный интерес представляет диммонийфосфат. Его производят при термической обработке аммиаком фосфорной кислоты. Для успешного протекания процесса необходима температура порядка 70 градусов по Цельсию. Технология предполагает образование в виде осадков фосфатов алюминия и железа, которые также находят свое промышленное применение.
Некоторые сложности возникают с названиями двойных солей из-за того, что в них присутствуют да кислотных остатка, либо два катиона.
Магнийаммонийфосфат востребован в химической промышленности, поэтому технология его создания имеет определенные особенности. Осуществляют нейтрализацию газообразным аммиаком экстракционную фосфорную кислоту, которая смешана с фосфатом магния.
Комплексные соединения
Между комплексными и двойными солями есть определенные отличия. Попробуем выяснить особенности комплексных солей. В их составе предполагается присутствие комплексного иона, который заключается в квадратные скобки. Кроме того в таких соединениях присутствует комплексообразователь (центральный ион). Его окружают частицы, которые называют лигандами. Для комплексных солей характерна ступенчатая диссоциация. По первой ступени идет образование комплексного иона в виде катиона либо аниона. Далее, идет частичная диссоциация комплексного иона на катион и лиганды.
Особенности номенклатуры солей
Учитывая, что существует множество различных видов солей, интерес представляет их номенклатура. Для средних солей название формируется на основе аниона (хлорид, сульфат, нитрат), к которому добавляют русское название металла. Например, СаСО3 – это карбонат кальция.
Для кислых солей характерно добавление приставки гидро-. Например, КНСО3- гидрокарбонат калия.
Номенклатура основных солей подразумевает использование приставки гидроксо-. Так, соль Al(OH)2Cl имеет название дигидроксохлорид алюминия.
При названии двойных солей, содержащих два катиона, сначала нужно дать название аниону, затем перечислить оба металла, входящие в соединение.
Более сложные названия характерны для комплексных соединений. В химии существует специальный раздел, который занимается изучением таких солей.
Если анализировать физические свойства разных представителей двойных солей, можно отметить, что они существенно различаются по способности растворяться в воде. Среди двойных солей есть примеры веществ, имеющих хорошую растворимость, например, хлорид натрия, калия. Среди малорастворимых соединений можно привести двойные соли фосфорной и кремниевой кислоты.
По химическим свойствам двойные соли аналогичны нормальным (средним), способны взаимодействовать с кислотами, другими солями.
Нитраты и соли аммония подвергаются термическому разложению, образуя несколько продуктов реакции.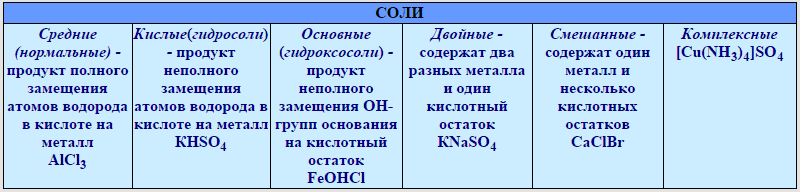
В случае электролитической диссоциации таких соединений можно получить анионы остатка и катионы металлов. Например, при распаде на ионы алюмокалиевых квасцов, в растворе можно обнаружить катионы алюминия и калия, а также сульфат – ионы.
Разделение смеси солей
Учитывая, что в природных минералах содержатся сразу два металла, возникает необходимость их разделения. Среди множества способов, позволяющих разделять смеси солей, можно выделить фракционную кристаллизацию. Этот способ предполагает предварительное расплавление двойной соли, последующее деление ее на разные соединения, затем кристаллизацию. Такой вариант разделения смесей связан с физическими характеристиками веществ. При разделении смеси химическими методами, подбирают реактивы, являющиеся качественными на определенные катионы или анионы. После осаждения одних их частей двойной соли, осадки убирают.
При необходимости разделения трехкомпонентной системы, в которой есть твердая фаза, а также присутствуют эмульсии, осуществляется центрифугирование.
Заключение
Двойные соли отличаются от остальных видов солей присутствием в формуле двух металлов. В чистом виде такие соединения используют редко, в основном их первоначально разделяют физическими либо химическими методами, и только потом используются в различных сферах промышленного производства. Двойные соли применяют и в химической промышленности как источник получения множества востребованных химических веществ.
Соли в химии. Краткие теоретические сведения с примерами
Соли. Краткие теоретические сведенияСоли — это продукты взаимодействия кислот с основаниями. Соль — это продукт замещения атомов водорода в кислороде на металл или продукт замещения гидроксильных групп в основании на кислотные остатки.
Общая формула соли —
где К — катион; А — анион.
Классификация солей. Соли подразделяются на средние (нормальные) соли, которые являются продуктами полного замещения водорода кислоты на металл и полного замещения гидроксильных групп на кислотный остаток; кислые соли, которые являются продуктами неполного замещения водорода кислоты на металл, и основные, которые являются продуктами неполного замещения гидроксильных групп на кислотный остаток.
Номенклатура средних солей. Название средней соли дается следующим образом: для кислородсодержащего кислотного остатка называется кислотный остаток с окончанием «ат» для высшей валентности центрального атома с добавлением названия катиона и с окончанием «ит» — для низшей валентности центрального атома; для бескислородного кислотного остатка — окончание «ид». Если металл проявляет переменную валентность, то ее указывают римскими цифрами в скобках.
Например:
Рекомендую самостоятельно привести несколько примеров солей и дать им название.
Приведем несколько графических формул солей. Они подобны графическим формулам кислот, в которых атомы водорода замещены на атомы металла:
Когда атом металла в средней соли связан с двумя различными кислотными остатками, такие соли называют смешанными, например хлорная известь:
Если атомы водорода многоосновной кислоты замещены двумя различными металлами, то такую соль называют «двойной», например:
Кислые соли — это продукты неполного замещения атомов водорода в многоосновной кислоте на металл, например:
В название кислой соли добавляется перед кислотным остатком приставка гидро- или дигидро-.
Например:
Основные соли — это продукты неполного замещения гидроксильных групп в многокислотном основании, например:
Название основной соли происходит от названия средней соли с добавлением приставки гидрокси-, дигидрокси, тригидрокси-, например:
Графические формулы нескольких основных солей:
Основные соли могут терять воду, образующиеся соединения называются оксосолями, они также имеют основный характер, например:
дихлорид ванадила
Рекомендую привести примеры кислых и основных солей, дать им название, привести графические формулы.
Получение солей. Соли получаются:
1) Взаимодействием металла с неметаллом:
Например:
2) Взаимодействием кислоты с любым основанием:
3) Взаимодействием кислоты с основным или амфотерным оксидом:
4) Взаимодействием основных или амфотерных оксидов с кислотными оксидами:
(См. подразадел 1.4).
5) Взаимодействием металла с кислотой:
6) Взаимодействием металла с раствором соли:
7) Взаимодействием двух солей:
Эта реакция возможна лишь в случае образования малорастворимой соли, например:
8) Взаимодействием соли с кислотой:
Эта реакция возможна лишь в случае образования нерастворимой соли или летучей, нерастворимой или слабодиссоциируемой кислоты, например:
9) Взаимодействием соли со щелочью:
Эта реакция возможна лишь в случае образования нерастворимой соли или нерастворимого основания, например:
10) Взаимодействием кислотного или амфотерного оксида со щелочью:
Например:
11) Взаимодействием основного оксида с амфотерным:
12) Взаимодействием амфотерного основания со щелочью
13) Кислые соли получают действием щелочи в недостатке на кислоту, или действием кислот в недостатке на нормальные соли
Например:
14) Основные соли получают действием кислоты в недостатке на основание или действием щелочи в недостатке на нормальную соль
Например:
Рекомендую самостоятельно привести по нескольку примеров каждого способа получения солей и запомнить все общие схемы получения солей.
Химические свойства солей:
а) Взаимодействие солей со щелочами:
Кислые соли при взаимодействии со щелочами образуют нормальные соли:
Например:
Основные соли при взаимодействии со щелочами образуют основания:
Например:
б) Взаимодействие солей с кислотами:
Основные соли реагируют с избытком кислоты с образованием нормальной соли
Кислая соль реагирует с избытком кислоты, образуя кислоту и соль:
Например:
в) Взаимодействие соли с солью
г) Взаимодействие соли с металлом
д) Термическое разложение солей
При нагревании карбонаты, нитраты и другие соли разлагаются, образуя, чаще всего, кислотный и основный оксиды (см. методы получения оксидов).
Например:
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
примеры, состав, названия и химические свойства
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород).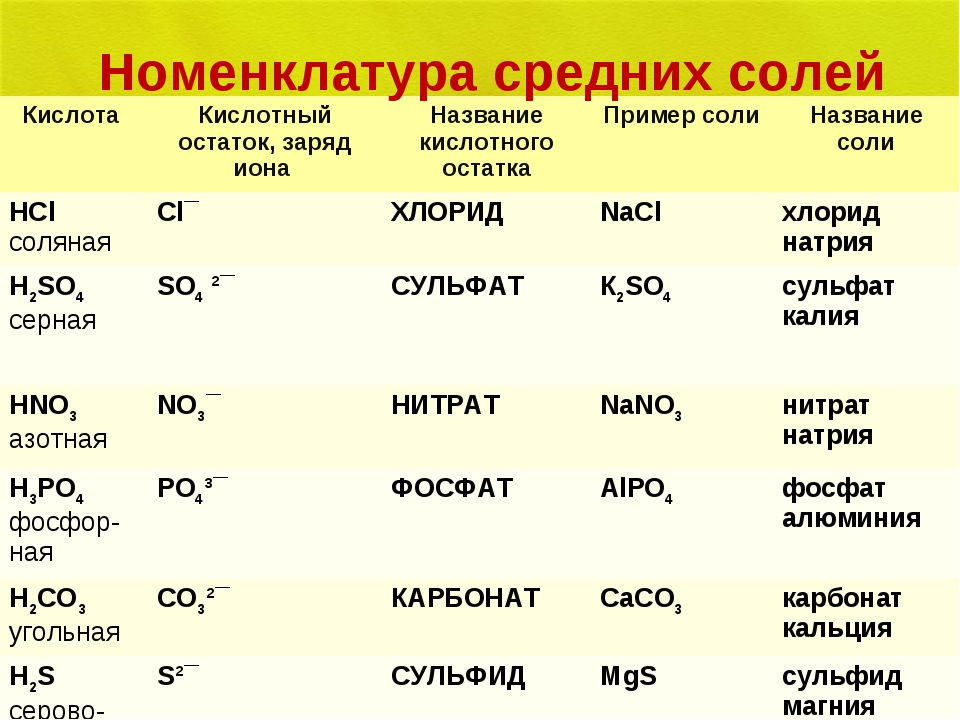 Например, NaCl – хлорид натрия, СаSO 4 – сульфат кальция и т. д.
Например, NaCl – хлорид натрия, СаSO 4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na 2 CO 3 , KNO 3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO 3 , NaH 2 PO 4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO 3 , KAl(SO 4) 2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO 4 , Zn(OH)Cl и т.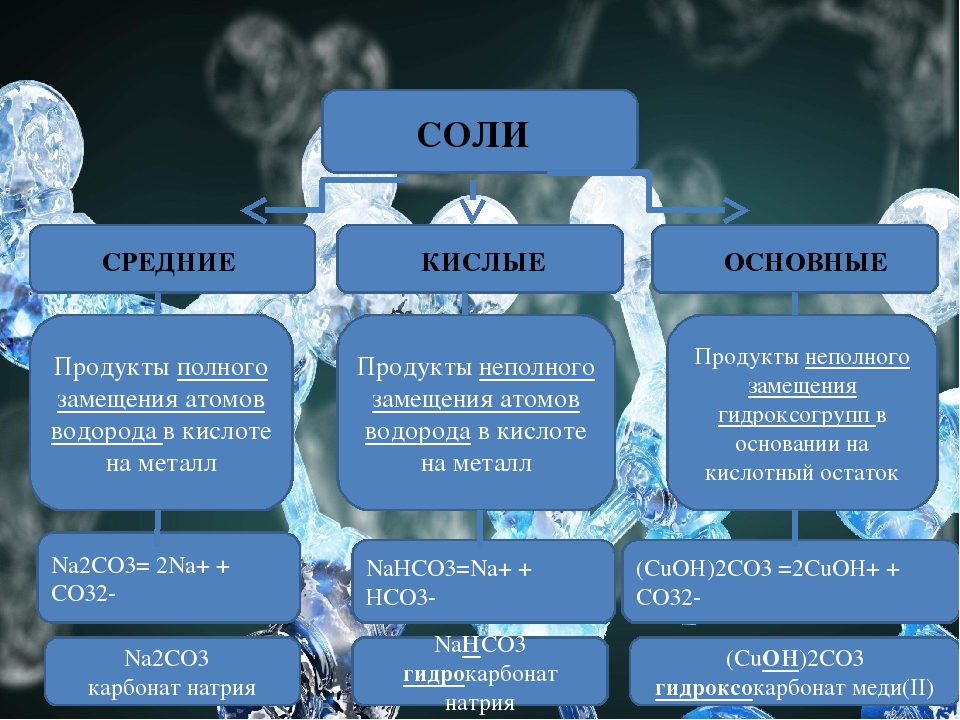
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO 4 – сульфат кальция, Mg SO 4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI 2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl 3) 2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH 2 PO 4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO 3 = CaO + CO 2
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl.
3. Взаимодействуют с основаниями , образуя новую соль и новое основание:
Ba(OH) 2 + Mg SO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO 3 → AgCl + NaNO 3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO 4 → FeSO 4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO 4 – сульфат кальция и т.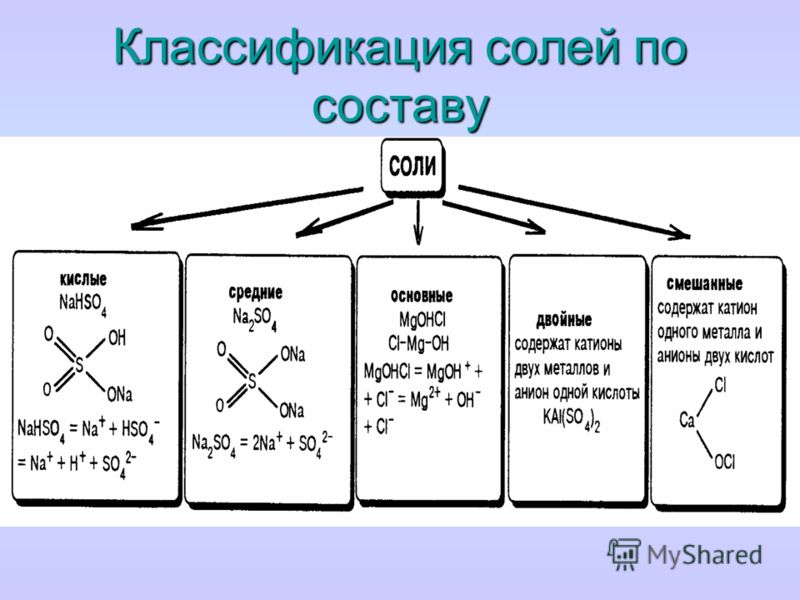 д.
д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na 2 CO 3 , KNO 3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO 3 , NaH 2 PO 4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO 3 , KAl(SO 4) 2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO 4 , Zn(OH)Cl и т. д.
д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO 4 – сульфат кальция, Mg SO 4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI 2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl 3) 2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH 2 PO 4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO 3 = CaO + CO 2
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl.
3. Взаимодействуют с основаниями , образуя новую соль и новое основание:
Ba(OH) 2 + Mg SO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO 3 → AgCl + NaNO 3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO 4 → FeSO 4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Основания могут взаимодействовать:
- с неметаллами —
6KOH + 3S → K2SO 3 + 2K 2 S + 3H 2 O;
- с кислотными оксидами —
2NaOH + CO 2 → Na 2 CO 3 + H 2 O;
- с солями (выпадение осадка, высвобождение газа) —
2KOH + FeCl 2 → Fe(OH) 2 + 2KCl.

Существую также другие способы получения:
- взаимодействие двух солей —
CuCl 2 + Na 2 S → 2NaCl + CuS↓;
- реакция металлов и неметаллов —
- соединение кислотных и основных оксидов —
SO 3 + Na 2 O → Na 2 SO 4 ;
- взаимодействие солей с металлами —
Fe + CuSO 4 → FeSO 4 + Cu.
Химические свойства
Растворимые соли являются электролитами и подвержены реакции диссоциации. При взаимодействии с водой они распадаются, т.е. диссоциируют на положительно и отрицательно заряженные ионы — катионы и анионы соответственно. Катионами являются ионы металлов, анионами — кислотные остатки. Примеры ионных уравнений:
- NaCl → Na + + Cl − ;
- Al 2 (SO 4) 3 → 2Al 3 + + 3SO 4 2− ;
- CaClBr → Ca2 + + Cl — + Br — .
Помимо катионов металлов в солях могут присутствовать катионы аммония (Nh5 +) и фосфония (Ph5 +).
Другие реакции описаны в таблице химических свойств солей.
Рис. 3. Выделение осадка при взаимодействии с основаниями.
3. Выделение осадка при взаимодействии с основаниями.
Некоторые соли в зависимости от вида разлагаются при нагревании на оксид металла и кислотный остаток или на простые вещества. Например, СаСO 3 → СаO + СО 2 , 2AgCl → Ag + Cl 2 .
Что мы узнали?
Из урока 8 класса химии узнали об особенностях и видах солей. Сложные неорганические соединения состоят из металлов и кислотных остатков. Могут включать водород (кислые соли), два металла или два кислотных остатка. Это твёрдые кристаллические вещества, которые образуются в результате реакций кислот или щелочей с металлами. Реагируют с основаниями, кислотами, металлами, другими солями.
Соли — это продукты замещения водорода кислоты металлом или гидроксогрупп оснований кислотными остатками.
Например,
H 2 SO 4 + Zn = ZnSO 4 + Н 2
кислота соль
NaOH + НС1 = NaCl + H 2 O
основание кислота соль
С позиций теории электролитической диссоциации, соли – это электролиты, при диссоциации которых образуются катионы,отличные от катионов водорода, и анионы, отличные от анионов ОН — .
Классификация. Соли бывают средние, кислые, основные, двойные, комплексные.
Средняя соль — это продукт полного замещения водорода кислоты металлом или гидроксогруппы основания кислотным остатком. Например, Na 2 SO 4 , Ca(NO 3) 2 — средние соли.
Кислая соль — продукт неполного замещения водорода многоосновной кислоты металлом. Например, NaHSO 4 , Са(НСО 3) 2 — кислые соли.
Основная соль — продукт неполного замещения гидроксогрупп многокислотного основания кислотными остатками. Например, Mg(OН)С1, Bi(OH)Cl 2 — основные соли
Если атомы водорода в кислоте замещаются атомами разных металлов или гидроксогруппы оснований замещаются различными кислотными остатками, то образуются двойные соли. Например, KAl(SO 4) 2 , Са(ОС1)С1. Двойные соли существуют только в твердом состоянии.
Комплексные соли — это соли, в состав которых входят комплексные ионы. Например, соль K 4 — комплексная, так как в ее состав входит комплексный ион 4- .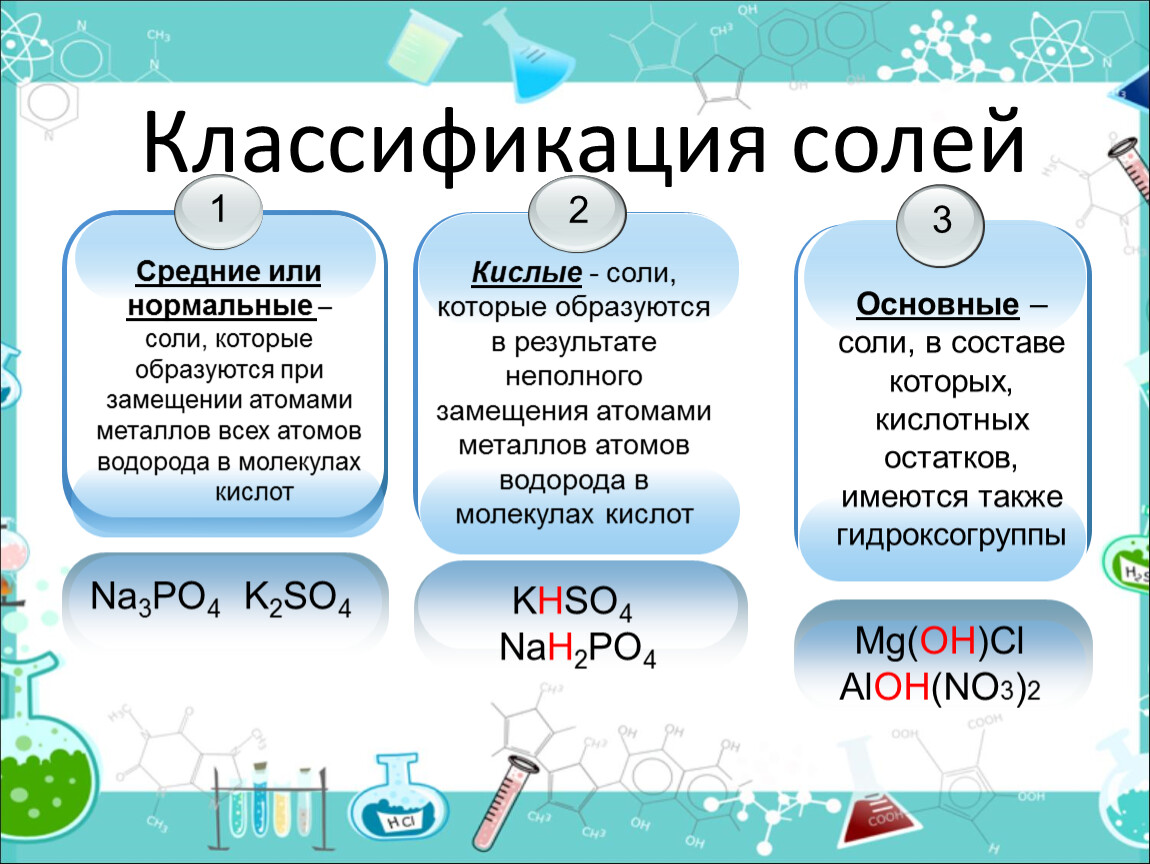
Составление формул солей. Можно сказать, что соли состоят из остатков оснований и остатков кислот. При составлении формул солей нужно помнить правило: абсолютная величина произведения заряда остатка основания на число остатков основания равна абсолютной величине произведения заряда кислотного остатка на число кислотных остатков. Для тх = пу, где K — остаток основания, A — кислотный остаток, т — заряд остатка основания, n — заряд кислотного остатка, х — число остатков основания, у — число кислотных остатков. Например,
Номенклатура солей . Названия солей составляют из
названия аниона (кислотного остатка (табл.. 15)) в именительном падеже и названия катиона (остатка основания (табл. 17)) в родительном падеже (без слова «ион»).
Для названия катиона используют русское название соответствующего металла или группы атомов (в скобках римскими цифрами указывают степень окисления металла, если это необходимо).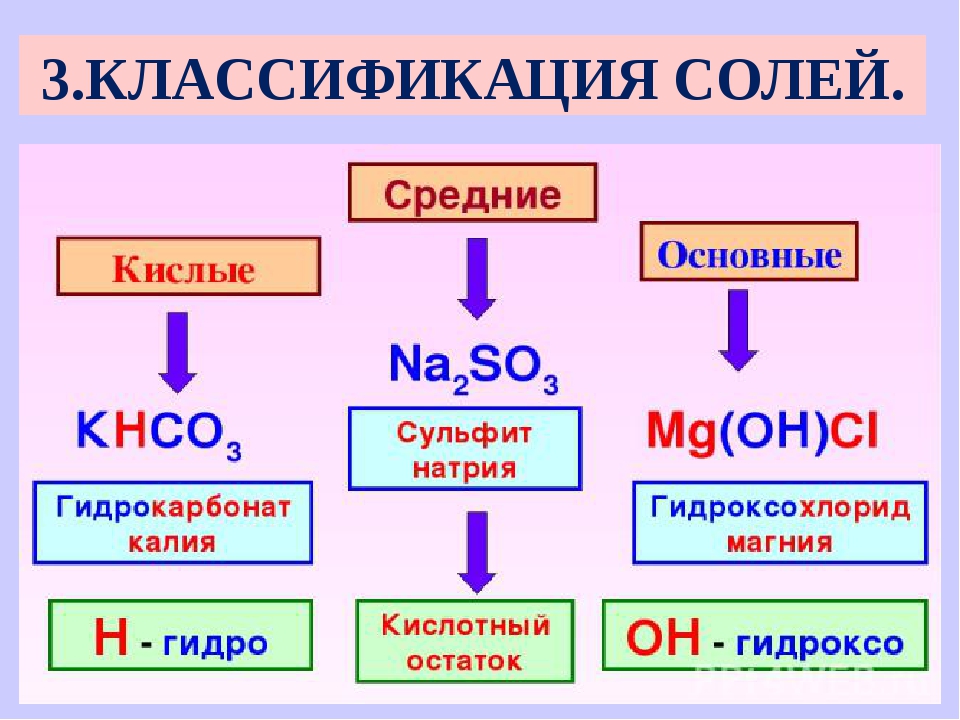
Анионы бескислородных кислот называют, используя окончание –ид (NH 4 F – фторид аммония, SnS – сульфид олова (II), NaCN – цианид натрия). Окончания названий анионов кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента:
Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро- , указывающей на наличие незамещенных атомов водорода (число атомов водорода указывают греческими числительными приставками). Катион основной соли получает приставку гидроксо- , указывающую на наличие незамещенных гидроксогрупп.
Например,
MgС1 2 – хлорид магния
Ba 3 (РО 4) 2 – ортофосфат бария
Na 2 S – сульфид натрия
CaHPO 4 – гидрофосфат кальция
K 2 SO 3 – сульфит калия
Ca(H 2 PO 4) 2 – дигидрофосфат кальция
А1 2 (SO 4) 3 – сульфат алюминия
Mg(OH)Cl – хлорид гидроксомагния
КА1(SO 4) 2 – сульфат калия-алюминия
(MgOH) 2 SO 4 – сульфат гидроксомагния
KNaHPO 4 – гидрофосфат калия-натрия
MnCl 2 – хлорид марганца (II)
Са(OCI)C1 – хлорид-гипохлорит кальция
MnSO 4 – сульфат марганца (II)
К 2 S – cульфид калия
NaHCO 3 – гидрокарбонат натрия
К 2 SO 4 – сульфат калия
В
предыдущих разделах постоянно встречались
реакции, в которых образуются соли.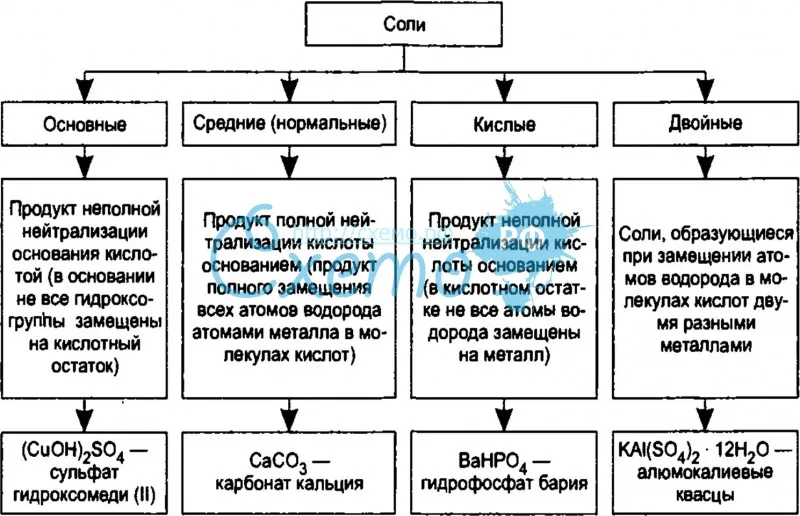
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH 4 + . Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
Na 2 SO 4 – сульфат натрия,
СаSO 4 – сульфат кальция,
СаCl 2 – хлорид кальция,
(NH 4) 2 SO 4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Названия
солей составляются из названия кислотного
остатка и названия металла. Главным в
названии является кислотный остаток.
Названия солей в зависимости от кислотного
остатка показаны в таблице 4.6. В
верхней части таблицы приведены
кислородсодержащие кислотные остатки,
в нижней – бескислородные.
Таблица 4-6. Построение названий солей.
Соль какой кислоты | Кислот-ный остаток | Валент-ность остатка | Название солей | |
Азотная HNO 3 | Ca(NO 3)2 нитрат кальция | |||
Кремниевая H 2 SiO 3 | силикаты | Na 2 SiO 3 силикат натрия | ||
Серная H 2 SO 4 | сульфаты | PbSO 4 сульфат свинца | ||
Угольная H 2 CO 3 | карбонаты | Na 2 CO 3 карбонат натрия | ||
Фосфорная H 3 PO 4 | AlPO 4 фосфат алюминия |
Бромоводородная HBr | NaBr бромид натрия | |||
Иодоводородная HI | KI иодид калия | |||
Сероводородная H 2 S | сульфиды | FeS сульфид железа (II) | ||
Соляная HCl | NH 4 Cl хлорид аммония | |||
Фтороводородная HF | CaF 2 фторид кальция |
Из
таблицы 4-6 видно, что названия
кислородсодержащих солей имеют окончания
«ат »,
а названия бескислородных солей – окончания
«ид ».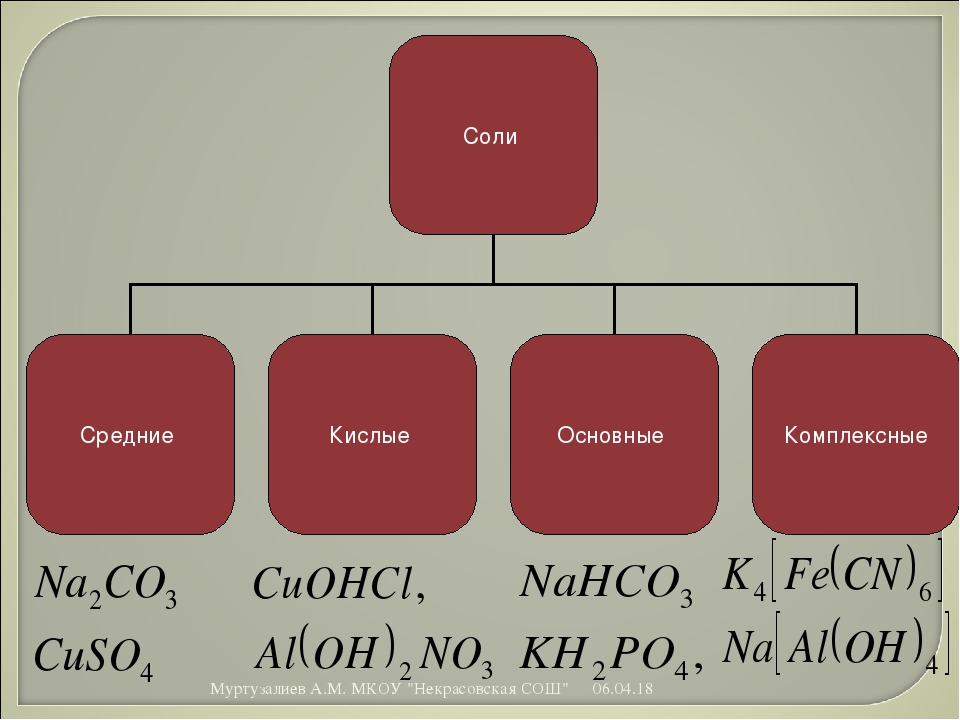
В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит ».Например, Na 2 SO 3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H 2 SO 4) и сернистой кислоты (H 2 SO 3) и в других таких же случаях.
Все соли разделяются на средние, кислые и основные . Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 4-6 являются средними солями.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
Кислые соли
образуются многоосновными кислотами.
Одноосновные кислоты кислых солей не
образуют.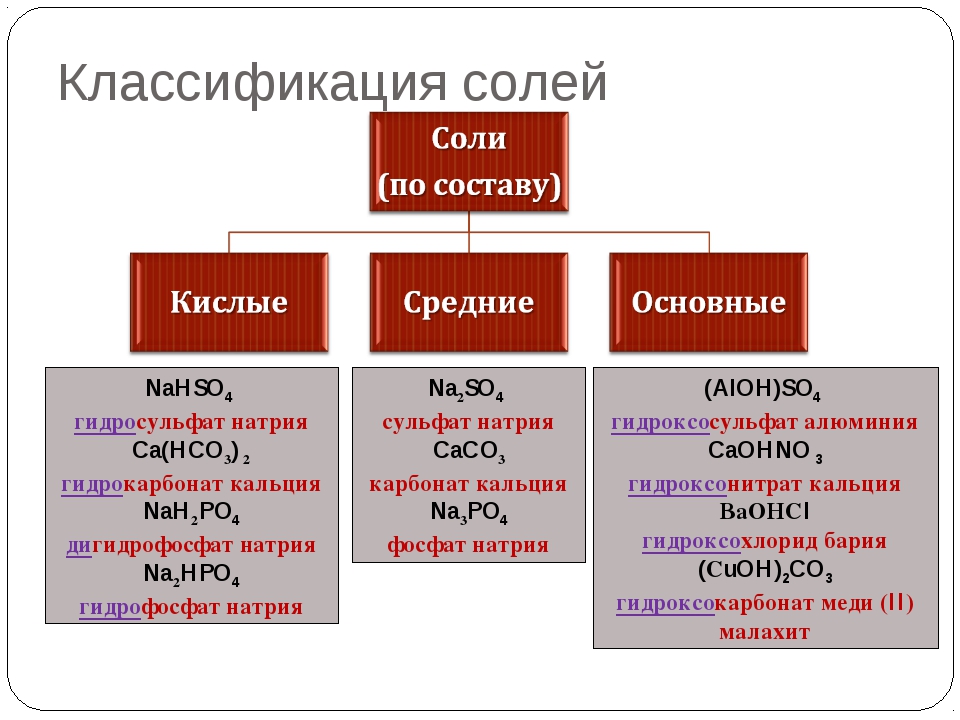
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO 3 – гидрокарбонат натрия,
K 2 HPO 4 – гидрофосфат калия,
KH 2 PO 4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Однокислотные основания таких солей образовать не могут.
В таблице 4.6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 4.7).
Таблица
4. 7. Международные, русские и традиционные
названия некоторых важных солей.
7. Международные, русские и традиционные
названия некоторых важных солей.
Международное название | Русское название | Традиционное название | Применение | |
Карбонат натрия | Натрий углекислый | В быту – как моющее и чистящее средство | ||
Гидрокарбонат натрия | Натрий углекислый кислый | Питьевая сода | Пищевой продукт: выпечка кондитерских изделий | |
Карбонат калия | Калий углекислый | Применяется в технике | ||
Сульфат натрия | Натрий сернокислый | Глауберова соль | Лекарственное средство | |
Сульфат магния | Магний сернокислый | Английская соль | Лекарственное средство | |
Хлорат калия | Калий хлорнова-токислый | Бертолетова соль | Применяется в зажигательных смесях для головок спичек |
Например,
ни в коем случае нельзя
путать соду Na 2 CO 3 и питьевую
соду NaHCO 3 . Если нечаянно использовать в
пищу соду вместо питьевой
соды , можно
получить тяжелый химический ожог.
Если нечаянно использовать в
пищу соду вместо питьевой
соды , можно
получить тяжелый химический ожог.
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода – вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.
Приведем строение и название основной соли, формула которой выглядит: 2 CO 3 – дигидроксокарбонат железа (III). При рассмотрении структурной формулы такой соли становится ясно, что эта соль –продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:
Соли. Названия и классификация солей. химия 11 класс
§8.7 Соли. Названия и классификация солей.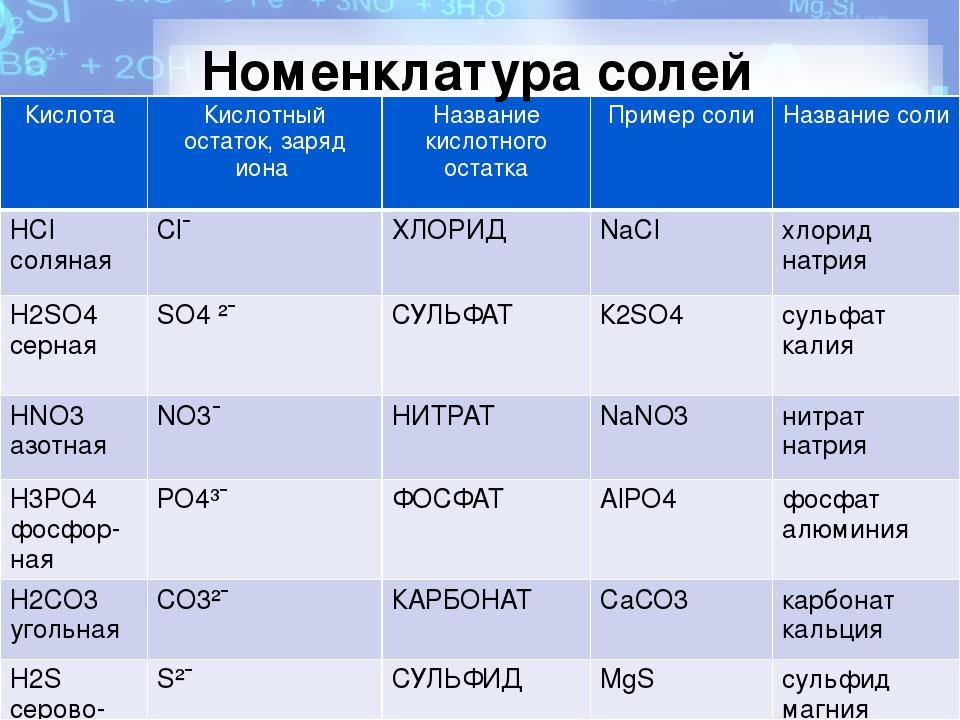 В предыдущих параграфах этой главы вы постоянно встречались с реакциями, в которых образуются соли. Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы Nh5+. Примеры типичных солей приведены ниже. NaCl – хлорид натрия, Na2SO4 – сульфат натрия, СаSO4 – сульфат кальция, СаCl2 – хлорид кальция, (Nh5)2SO4 – сульфат аммония. Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков: Na+Cl– – хлорид натрия Ca2+SO42– – сульфат кальция и т.д. Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6. Таблица 8-6. Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
В предыдущих параграфах этой главы вы постоянно встречались с реакциями, в которых образуются соли. Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы Nh5+. Примеры типичных солей приведены ниже. NaCl – хлорид натрия, Na2SO4 – сульфат натрия, СаSO4 – сульфат кальция, СаCl2 – хлорид кальция, (Nh5)2SO4 – сульфат аммония. Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков: Na+Cl– – хлорид натрия Ca2+SO42– – сульфат кальция и т.д. Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6. Таблица 8-6. Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные. Из таблицы 8-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид». В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит». Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (h3SO4) и сернистой кислоты (h3SO3) и в других таких же случаях. ** Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 8-6 являются средними солями. Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания: h3SO3 + 2 NaOH = Na2SO3 + 2 h3O сульфит натрия (средняя соль) Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия: h3SO3 + NaOH = NaHSO3 + h3O гидросульфит натрия (кислая соль) Кислые соли образуются многоосновными кислотами.
Из таблицы 8-6 видно, что названия кислородсодержащих солей имеют окончания «ат», а названия бескислородных солей – окончания «ид». В некоторых случаях для кислородсодержащих солей может использоваться окончание «ит». Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (h3SO4) и сернистой кислоты (h3SO3) и в других таких же случаях. ** Все соли разделяются на средние, кислые и основные. Средние соли содержат только атомы металла и кислотного остатка. Например, все соли из таблицы 8-6 являются средними солями. Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания: h3SO3 + 2 NaOH = Na2SO3 + 2 h3O сульфит натрия (средняя соль) Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия: h3SO3 + NaOH = NaHSO3 + h3O гидросульфит натрия (кислая соль) Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют. Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например: NaHCO3 – гидрокарбонат натрия, K2HPO4 – гидрофосфат калия, Kh3PO4 – дигидрофосфат калия. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних): Mg(OH)2 + 2 HCl = MgCl2 + 2 h3O 8.24. Напишите уравнения реакций нейтрализации, в которых получаются следующие соли: Na2CO3, NaHCO3, Na3PO4, Na2HPO4, Nah3PO4, AlCl3, Al(OH)Cl2, Al(OH)2Cl. Назовите эти соли. Al(OH)3+3HCl=AlCl3+3h3O 3NaOH+h4PO4=Na3PO4+3h3O Al(OH)2Cl+2HCl=AlCl3+2h3O Na2HPO4+NaOH=Na3PO4+h3O Хлорид алюминия Ортофосфат натрия 1)К раствору серной кислоты прибавили едкий натр.Образовалось 3,6 г гидросульфата и 2,84 г. сульфата натрия.Определите массу серной кислоты в растворе и массу прибавленного едкого натра? 2)Вычислите массу осадка,образующего при сливании растворов, содержащих по 0,06 моль сульфата алюминия и хлорида бария.
Одноосновные кислоты кислых солей не образуют. Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например: NaHCO3 – гидрокарбонат натрия, K2HPO4 – гидрофосфат калия, Kh3PO4 – дигидрофосфат калия. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних): Mg(OH)2 + 2 HCl = MgCl2 + 2 h3O 8.24. Напишите уравнения реакций нейтрализации, в которых получаются следующие соли: Na2CO3, NaHCO3, Na3PO4, Na2HPO4, Nah3PO4, AlCl3, Al(OH)Cl2, Al(OH)2Cl. Назовите эти соли. Al(OH)3+3HCl=AlCl3+3h3O 3NaOH+h4PO4=Na3PO4+3h3O Al(OH)2Cl+2HCl=AlCl3+2h3O Na2HPO4+NaOH=Na3PO4+h3O Хлорид алюминия Ортофосфат натрия 1)К раствору серной кислоты прибавили едкий натр.Образовалось 3,6 г гидросульфата и 2,84 г. сульфата натрия.Определите массу серной кислоты в растворе и массу прибавленного едкого натра? 2)Вычислите массу осадка,образующего при сливании растворов, содержащих по 0,06 моль сульфата алюминия и хлорида бария. К раствору h3SO4 добавили раствор NaOH. Образовалось 3,6 г гидросульфата натрия NaHSO4 и 2,84 г сульфата натрия Na2SO4. Определите, сколько было в растворе серной кислоты и сколько прибавлено едкого натра (в граммах). К раствора h3so4 добавили раствор naoh образовалось 3.8 г гидросульфата натрия. Определите, сколько было в растворе серной кислоты и сколько прибавлено едкого натра (в граммах). К раствору, содержащему 1,96 г фосфорной кислоты h4PO4, прибавили раствор, содержащий 2,8 г гидроксида калия KOH. Какие соли и в каком количестве образовались в результате реакции нейтрализации? пень | ото О
ВОт остатка
Азотистая, НМО, мо; Нитриты кмо,
Азотная, НМО, м05 Нитраты АКМО,),
Хлороводородная с Хлориды Еесь
(соляная), НС
Сернистая, Н.ЗО; 302 Сульфиты к,зо,
Серная, Н-З0, $02 Сульфаты Ма,30,
Сероводородная, Н,8 5 Сульфиды Ее
Фоефорная, Н.РО, Рог Фосфаты Са„(РО,)>
Угольная, НСО: со Карбонаты Сасо;
Кремниевая, Н.513 510} `Силикаты №Ма.510. Средние соли Са(МО;).
К раствору h3SO4 добавили раствор NaOH. Образовалось 3,6 г гидросульфата натрия NaHSO4 и 2,84 г сульфата натрия Na2SO4. Определите, сколько было в растворе серной кислоты и сколько прибавлено едкого натра (в граммах). К раствора h3so4 добавили раствор naoh образовалось 3.8 г гидросульфата натрия. Определите, сколько было в растворе серной кислоты и сколько прибавлено едкого натра (в граммах). К раствору, содержащему 1,96 г фосфорной кислоты h4PO4, прибавили раствор, содержащий 2,8 г гидроксида калия KOH. Какие соли и в каком количестве образовались в результате реакции нейтрализации? пень | ото О
ВОт остатка
Азотистая, НМО, мо; Нитриты кмо,
Азотная, НМО, м05 Нитраты АКМО,),
Хлороводородная с Хлориды Еесь
(соляная), НС
Сернистая, Н.ЗО; 302 Сульфиты к,зо,
Серная, Н-З0, $02 Сульфаты Ма,30,
Сероводородная, Н,8 5 Сульфиды Ее
Фоефорная, Н.РО, Рог Фосфаты Са„(РО,)>
Угольная, НСО: со Карбонаты Сасо;
Кремниевая, Н.513 510} `Силикаты №Ма.510. Средние соли Са(МО;).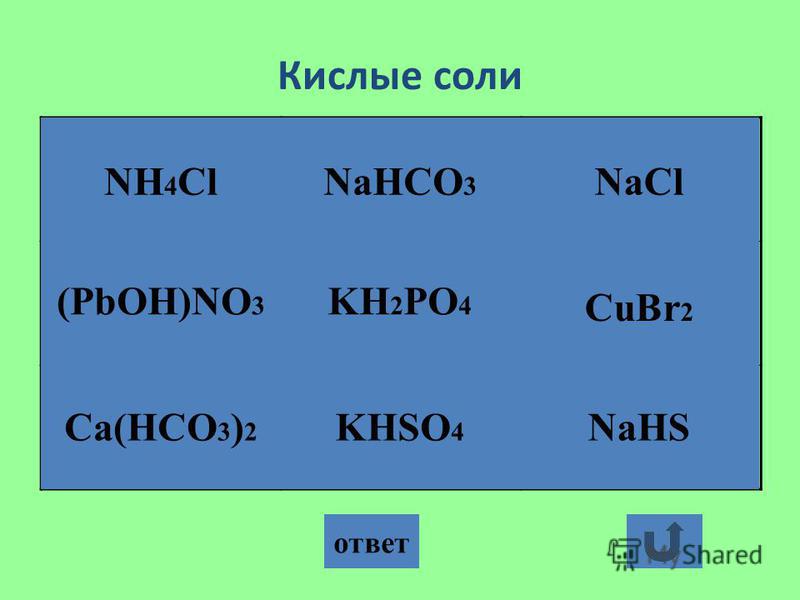 = Са? +2 МО; — нитрат кльция.
МазРО. =3Ма+ +РО;` — фосфат натрия. Кислые соли Са(Н$О,)› = Са?* +2Н$0; — гидросульфат кальция, Ман,РО, = Ма* + Н.РОу натрия. Основные соли
(СаОН).50, = 2СаОН* + $0 — гидроксо- сульфат кальция. МЕОНМО, = М5ОН’ +МО, — гидроксонитрат магния. дигидрофосфат
= Са? +2 МО; — нитрат кльция.
МазРО. =3Ма+ +РО;` — фосфат натрия. Кислые соли Са(Н$О,)› = Са?* +2Н$0; — гидросульфат кальция, Ман,РО, = Ма* + Н.РОу натрия. Основные соли
(СаОН).50, = 2СаОН* + $0 — гидроксо- сульфат кальция. МЕОНМО, = М5ОН’ +МО, — гидроксонитрат магния. дигидрофосфат
Соли многоосновных кислот — Справочник химика 21
Итак, при гидролизе солей, образованных одноосновными кислотами и однокислотными основаниями, единственными продуктами гидролиза будут кислота и основание. Соли многоосновных кислот и многокислотных оснований подвергаются ступенчатому гидролизу и в числе продуктов могут образоваться соответственно кислые и основные соли. [c.275]Средние соли многоосновных кислот. Для вычисления pH растворов средних солей многоосновных кислот можно пользоваться выведенными выше формулами (9) и (10). Необходимо только выбрать константу соответствующей ступени диссоциации кислоты.
 В качестве примера рассмотрим гидролиз углекислого натрия. Можно написать следующие ступени гидролиза [c.297]
В качестве примера рассмотрим гидролиз углекислого натрия. Можно написать следующие ступени гидролиза [c.297]Если гидролизу подвергается соль многоосновной кислоты или многоатомного основания, то продуктами гидролиза являются кислая соль и основание или основная соль и кислота [c.130]
Гидролиз солей, содержащих многозарядные ионы, т. е. солей многоосновных кислот или многокислотных оснований, происходит ступенчато. Наиример, гидролиз карбонат-иона происходит в две ступени [c.180]
III. Гидролиз солей многоосновных кислот и многокислотных оснований также может быть представлен четырьмя вариантами [c.277]
Гидролиз некоторых солей настолько велик, что они практически в растворах существовать не могут, например ацетат аммония, углекислый и сернистый алюминий. Степень гидролиза во многих случаях зависит от искусственного изменения pH среды и от разбавления. Гидролиз солей многоосновных кислот, а также солей с многовалентными катионами большей частью останавливается на первой ступени с образованием кислых или основных солей.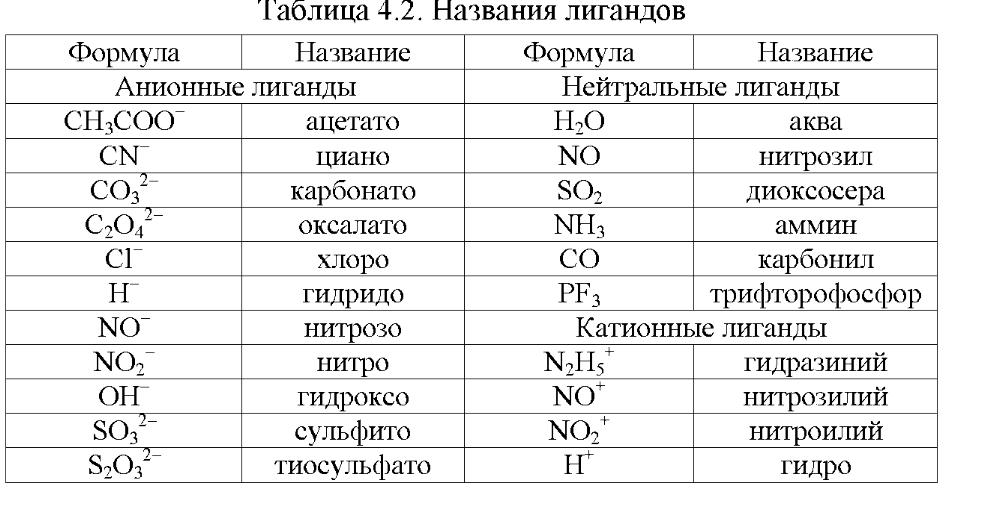 Например, гидролиз хлористого алюминия при комнатной температуре с умеренными концентрациями соли в растворе идет по уравнению / [c.250]
Например, гидролиз хлористого алюминия при комнатной температуре с умеренными концентрациями соли в растворе идет по уравнению / [c.250]
Ступенчатый гидролиз. Многоосновные кислоты диссоциируют по ступеням, поэтому соли многоосновных кислот также гидролизуются по ступеням. Рассмотрим для примера гидролиз карбоната натрия. Угольная кислота диссоциирует по двум ступеням [c.42]
При растворении солей многоосновных кислот или оснований гидролиз протекает ступенчато. Например, при взаимодействии сульфида натрия с водой происходят процессы [c.73]
Тот же принцип используется при изучении характера гидролиза солей многоосновных кислот и оснований. При этом сле- [c.315]
Названия солей кислородных кислот образуют аналогично названиям бинарных соединений. Их образуют из названия кислоты с помощью суффикса —ат в именительном падеже, и названия металла (или иного катиона) в родительном падеже.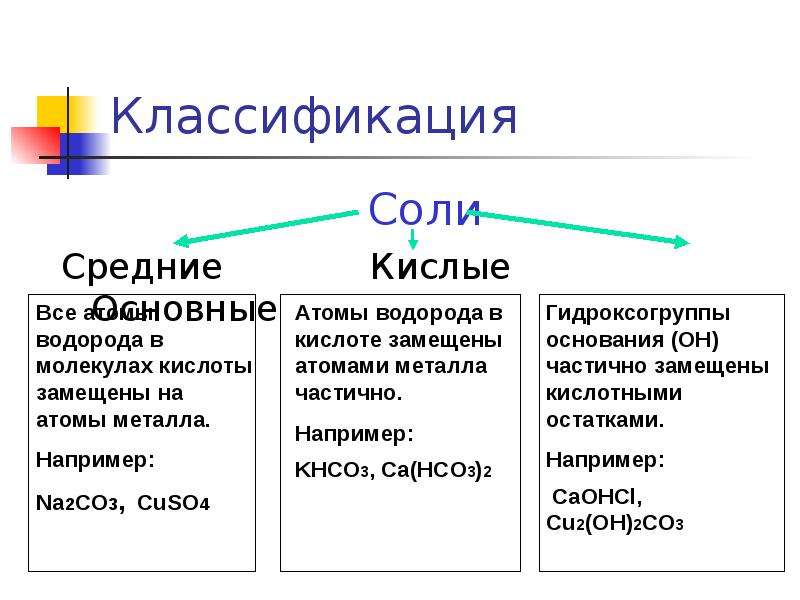 Названия кислых солей многоосновных кислот образуют с помощью приставки гидро- и соответствующего греческого числительного, которое показывает число незамещенных водородов в молекуле соли. [c.28]
Названия кислых солей многоосновных кислот образуют с помощью приставки гидро- и соответствующего греческого числительного, которое показывает число незамещенных водородов в молекуле соли. [c.28]
При растворении солей многоосновных кислот гидролиз протекает ступенчато , например [c.178]
Осадок — соль многоосновной кислоты, способной образовать растворимые кислые соли. Растворяется при прибавлении кислоты. Направляющая реакция — образование кислого аниона. Примеры [c.195]
Ступенчато диссоциируют многоосновные основания, соли многоосновных кислот и оснований. Например [c.94]
Почему гидролиз солей многоосновных кислот или многокислотных оснований оценивается обычно только его первой ступенью [c.228]
Гидролиз солей многоосновных кислот и многокислотных оснований протекает ступенчато (что часто связано с повышением температуры). Пример гидролиз карбоната натрия Naj Oa. [c.217]
Пример гидролиз карбоната натрия Naj Oa. [c.217]
Таким образом, при ступенчатом гидролизе солей многоосновных кислот и однокислотных оснований всегда образуются кислые соли, а полнота гидролиза определяется относительной силой кислоты и основания. [c.276]
Рациональными и экономичными считаются также способы получения на базе коксового газа аммиачной воды или безводного аммиака. В них поглощение Nh4 осуществляется водой, растворами слабых кислот или кислых солей многоосновных кислот. [c.403]
Гидролиз солей многоосновных кислот или многокислотных оснований происходит по ступеням. Известны три типичных случая гидролиза солей. [c.47]
По отношению к воде и водным растворам кислот и оснований в принципе неустойчивы полимеры с гетероатомами в основной или боковой цепи и теоретически устойчивы карбоцепные полимеры, не имеющие двойных связей в основных цепях и гетероатомов в боковых цепях. Однако реакции гидролиза в чистой воде для большинства названных выше полимеров протекают слишком медленно [7, с. 175]. В присутствии кислот, оснований и солей многоосновных кислот реакции гидролиза, как правило, значительно ускоряются и при эксплуатации полимерных изделий в таких средах гидролитическая деструкция является основным фактором, приводящим к выходу полимерных изделий и конструкций из строя. [c.13]
Однако реакции гидролиза в чистой воде для большинства названных выше полимеров протекают слишком медленно [7, с. 175]. В присутствии кислот, оснований и солей многоосновных кислот реакции гидролиза, как правило, значительно ускоряются и при эксплуатации полимерных изделий в таких средах гидролитическая деструкция является основным фактором, приводящим к выходу полимерных изделий и конструкций из строя. [c.13]
Рассмотрим и вопрос о том, как определяется pH раствора, в котором одновременно присутствуют две соли многоосновной кислоты Н В, например MH iB и МаН гВ, где М+ —ион щелочного металла. Способ вычисления [Н3О+] и pH в этом случае аналогичен предыдущему и лучше проиллюстрировать его конкретным примером. [c.57]
Еще более сложные изменения состава происходят при взаимодействии нескольких веществ. Так, нри растворении соли многоосновной кислоты в воде образуются различные гидратированные анионы и катионы. [c.31]
Некоторые труднорастворимые соли многоосновных кислот растворяются в присутствии избытка этой же кислоты благодаря образованию малодиссоциирующего кислого аниона. Вот один пример [c.200]
Вот один пример [c.200]
Для солей многоосновных кислот приняты названия кислый (для двухосновных кислот), одно- , дву- и трехзамещенный . Так, KHSO4 находится в таблице под названием Калнй сернокислый, кислый , К3РО4 — под названием Калий фосфорнокислый (орто), трехзамещенный . [c.9]
Гидролиз в аналитической химии имеет большое значение. Гидролиз солей многоосновных кислот или многокислотных оснований идет ступенчато, обычно преимущественно по первой ступени. Он тем полнее, чем слабее кислота пли основание и чем меньше растворимость продуктов реакции. Например, гидролиз Ре(СОгСН.-,). на холоду дает Ре (ОН) (СОзСН )) , при кипячении раствора выпадает осадок Ре(0Н)2(С02СН. ) ( 78) при кипячении раствора алюминат натрия не разлагается, хромит натрия разлагается, образуя осадок Сг(ОН)з 76). [c.62]
Применение графического способа расчета pH облегчает установление связи между отдельными формулами, а также выбор констант ступенчатой диссоциации при рассмотрении свойств солей многоосновных кислот. Кроме того, при графическом способе легче решить вопрос о выборе индикатора и об ошибке титрования (см. 82 и 84). Для слабых оснований и соответствующих солей можно пользоваться аналогичным графическим методом, если вместо pH и рКкисл применять соответственно значения рОН и рКоб . [c.305]
Кроме того, при графическом способе легче решить вопрос о выборе индикатора и об ошибке титрования (см. 82 и 84). Для слабых оснований и соответствующих солей можно пользоваться аналогичным графическим методом, если вместо pH и рКкисл применять соответственно значения рОН и рКоб . [c.305]
Титрозание многоосновных кислот и их солей. Многоосновные кислоты в большинстве случаев являются слабыми электролитами, которые диссоциируют ступенчато отдельные константы диссоциации часто довольно сильно отличаются друг от друга. Для двухосновных кислот (и их средних солей) наблюдается два перегиба на кривой титрования и две точки эквивалентности одна соответствует образованию кислой соли, другая — образованию средней соли (илн свободной кислоты). Общий диапазон изменения pH остается, очевидно, тем же, что и для слабых кислот поэтому изменение pH вблизи каждой из точек эквивалентности имеет менее резкий характер. [c.317]
В качестве важного примера титрования соли многоосновной кислоты рассмотрим кривую титрования углекислого натрия соляной кислотой. ОЗщие условия титрования можно принять такими же, как в предыдущих примерах объем раствора 100 м.л, концентрация 0,1 М.. На титрование будет затрачено в общем количество соляной кислоты, эквивалентное 200 мл 0,1 н. раствора. Если для титрования применять более концентри- [c.317]
ОЗщие условия титрования можно принять такими же, как в предыдущих примерах объем раствора 100 м.л, концентрация 0,1 М.. На титрование будет затрачено в общем количество соляной кислоты, эквивалентное 200 мл 0,1 н. раствора. Если для титрования применять более концентри- [c.317]
Растворы, содержащие как акцептор протонов (основание В), так и донор протонов (кислоту ВН), проявляют буферные свойства одновременно по отношению к сильным кислотам и основаниям. Свойство быть одновременно акцептором и донором протонов называется амфотерностью. Амфотерностью могут обладать и растворы индивидуальных веществ (например, растворы кислых солей многоосновных кислот — КаНСОз, Ка2НР04, МаНаР04, в которых анионы являются одновременно донорами и акцепторами протонов). Поэтому растворы таких солей обладают буферными свойствами. [c.186]
Реакции гидролиза солей многоосновных кислот и многоосновных оснований составляются аналогично, но их следует писать отдельно для, каждой ступени.
 Эти соли гидролизуются по ступеням соответственно ступенчатой диссоциации кислоты или основания. Так, гидролиз Т ЭгСОз может быть выражен уравнениями [c.130]
Эти соли гидролизуются по ступеням соответственно ступенчатой диссоциации кислоты или основания. Так, гидролиз Т ЭгСОз может быть выражен уравнениями [c.130]Некоторые малорастворимые соли многоосновных кислот растворякггся при избытке этой же кислоты благодаря образованию малодиссоциирующего кислотного аниона, например [c.282]
Процесс (4) отражает гидролиз (NagS) по первой стадии. Чтобы гидролиз соли многоосновной кислоты [c.178]
Гидролиз солей многоосновных кислот или многокислотных оснований идет ступенчато, главным образом по первой стадии. Поэтому при проведении анализа часто получают кислые или основные соли. Например, гидролиз Ге(СНзСОО)з при комнатной температуре дает соединение FeOH (СНзСОО)2, а при кипячении— Ге(ОН)2СНзСОО (бурый хлопьевидный осадок). Аналогично протекает реакция ионов АР с ацетатом натрия. Этой реакцией пользуются для отделения ионов и АР oi [c.126]
Кроме рассмотренных буферных растворов, состоящих из слабых кислот (или оснований) и их солей, на практике часто применяются и другие буферные системы. Значительной буфер ностью обладают растворы солей многоосновных кислот и осно ваний раствор тринатрийфосфата ЫазР04, раствор тетраокса лата калия КНз(С204)2-2Н20 и т. д. Буферное действие таких растворов определяется процессом гидролиза, в результате ко торогО образуется система кислота — соль или основание — соль [c.605]
Значительной буфер ностью обладают растворы солей многоосновных кислот и осно ваний раствор тринатрийфосфата ЫазР04, раствор тетраокса лата калия КНз(С204)2-2Н20 и т. д. Буферное действие таких растворов определяется процессом гидролиза, в результате ко торогО образуется система кислота — соль или основание — соль [c.605]
Многоосновные кислоты при взаимодействии с аммиаком (основанием) тоже образуют аммонийные соли. Поскольку ион аммония Nh5 несет единичный положительный заряд, в формулы солей многоосновных кислот должно входить несколько таких ионов. Для большей ясности обозначения группу Nh5 в формулах солей многоосновных кислот всегда заключают в скобки, записывая как (Nh5). В качестве примера приведем формулу сульфата аммония (Nh5)2S04. [c.329]
Такой же подход можно использовать для расчета pH растворов, содержащих кислые соли многоосновных кислот. Рассмотрим раствор бикарбоната натрия ЫаНСОз. Бикарбонат-ион может как отдавать, так и присоединять протон [c. 321]
321]
Копилка знаний…: Кислые соли
Кислые соли получаются при неполном замещении в кислоте атомов водорода металлом. Они, как правило, образуются многоосновными кислотами, например:Н2SO4 + NaOH = NaHSO4 + Н2O
Са3(PО4)2 + Н3PО4 = Са(Н2PО4)2
Кислые соли — это электролиты, которые в водных растворах диссоциируют на положительно заряженные ионы металлов и водорода и отрицательно заряженные ионы кислотных остатков.
Названия кислых солей, содержащих не полностью замещенный в кислоте водород, образуются по правилу названия простых солей, но с добавлением слова «гидро», чтобы обозначить его в соли. В случае необходимости перед «гидро указывается числовой префикс. За «гидро» без пробела следует название аниона в именительном падеже, затем — название катиона в родительном падеже:
КHSO4 – гидросульфат калия
КН2PО4 – дигидрофосфат калия
Кислые соли при растворении в воде диссоциируют на ионы металлов, водорода и кислотных остатков:
→NaHSO4 ↔Na+ + H+ + SO42-
поэтому они способны к реакциям, в которые вступают средние
соли и кислоты, то есть вступают в реакции с металлами, оксидами, основаниями,
кислотами и солями. Покажем это на примерах:
Покажем это на примерах:
NaHSO4 + Fe = Na2SO4 + FeSO4 + Н2↑
2H++ Fe = Fe2+ + Н2↑
2КHSO4 + СuО = К2SO4 + СuSO4 + Н2O
СuО + 2H+ = Сu2+ + Н2O
2NaHSO4 + 2КOH = Na2SO4 + К2SO4 + 2Н2O
H++ OH— = Н2O
NaHCO3 + HCI = NaCI +CO2↑ +Н2O
HCO3— + H+ = H2CO3— + CO2+Н2O
Следует заметить, что возможность реакций взаимодействия кислых солей, слабых кислот с металлами и оксидами ограничена так как слабая диссоциация ионов (НСО— и др) а также малая растворимость их средних солей препятствуют протеканию реакций.
Автор: задачник А. И. Хохлова
И. Хохлова
Skype – l.hakimova
Ух .ты! Как интересненько!
Щас все кнопочки понажимаю!
Раздел V. Кислородные соли (оксисоли)
Общие замечания. В этом последнем разделе неорганических минералов мы рассмотрим сложные соединения, с химической точки зрения представляющие собой соли различных кислородных кислот. По количественному составу этот раздел является наибольшим — к нему относятся почти две трети всех известных минералов. Этим определяется значение указанных соединений в минералогии.
Господствующее положение среди них занимают силикаты. Весьма многочисленны также сульфаты и фосфаты. Все они в земной коре распространены, естественно, только в твердом состоянии и являются продуктами химических реакций, протекающих в самых различных геологических условиях.
Мы не будем подробно останавливаться на характеристике химических особенностей кислородных солей вообще. Они детально разбираются в курсах химии, и природные соли ничем принципиально от них не отличаются.
Напомним лишь, что среди солей прежде всего различают соли безводные и водные (т. е. содержащие в своем составе молекулы Н2О). Среди тех и других важно также различать:
1) кислые соли (например, NaHCO3 — нахколит, кислый карбонат натрия), т. е. соли, содержащие вместо одного металлического катиона протон Н+1. В природных условиях кислые соли встречаются сравнительно редко;
2) нормальные, или средние, соли, пользующиеся наибольшим распространением в природе. Примеры: Са[СО3] — кальцит (известковый шпат), Ca[SO4] . 2h3O — гипс;
3) основные соли, т. е. соли, содержащие в своем составе ионы гидроксила [ОН]1–, нейтрализующие избыточный положительный заряд катионов. Эти соли широко распространены в природе. Примерами могут служить: Cu2[CO3][OН]2 — малахит и Al2[SO4][ОН]4 . 7Н2О — алюминит.
В основных солях анион [ОН]1–, как это устанавливается на целом ряде примеров, может быть частично или полностью заменен другими анионами, чаще всего равновеликим анионом F1–, иногда O2– и Cl1– (без изменения общей структуры соединения). Все такие соли, включая и соли с OH, мы будем называть солями с добавочными анионами.
Все такие соли, включая и соли с OH, мы будем называть солями с добавочными анионами.
Двойные и более сложные соли как определенные соединения от простых солей отличаются тем, что катионы или анионы или те и другие вместе представлены разными ионами, изоморфно не замещающими или ограниченно замещающими друг друга. Примеры: CaMg[CO3]2 — доломит, Na6Mg2[CO3]4[SO4] — тихит и др.
В солях переменного состава имеет место как изовалентный, так и гетеровалентный изоморфизм. В последнем случае всегда устанавливается уравновешивание положительных и отрицательных зарядов в соединениях. Примеры: (Mn,Fe)[CO3] — Fe-родохрозит, Са5[PO4,SiO4,SO4]3[F,ОН] — силико-сульфатный фторапатит (вилькеит) и др.
Кристаллохимические особенности соединений. Характерной особенностью кристаллохимии кислородных солей является наличие в их кристаллических структурах комплексных анионов: [NO3]1–, [СО3]2–, [SO4]2–, [РО4]3– и т. д. Катионы, располагающиеся в центрах этих групп, обладают малыми размерами ионных радиусов, высокими зарядами (рис.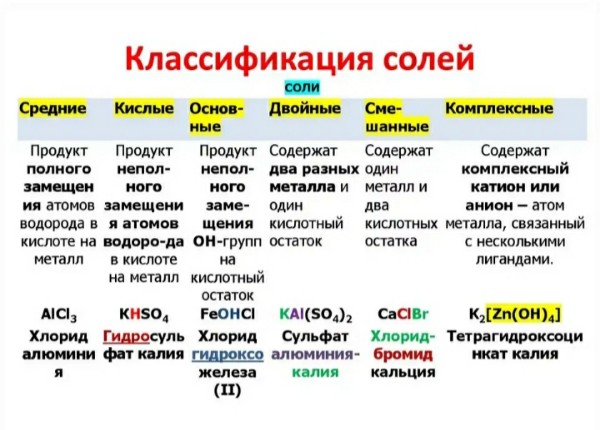 206) и ковалентно связаны с ионами кислорода.
206) и ковалентно связаны с ионами кислорода.
Рис. 206. Диаграмма главнейших катионов,
распространенных в природных соединениях
Очень важно обратить внимание в этих группах на прочность связи ионов кислорода с центральным катионом, определяемую так называемой электростатической валентностью, т. е. величиной заряда, приходящегося от катиона на каждый окружающий его ион кислорода. Так, в комплексном анионе [NO3]1–, состоящем из N5+ и трех окружающих ионов О2–, каждый кислород получает пай заряда 5 : 3, в анионе [СО3]2– эта величина составляет 4 : 3, анионе [SO4]2– — 6 : 4, анионе [РО4]3– — 5 : 4 и т. д.
Как видим, это отношение всюду превышает 1 (т. е. больше половины валентности кислорода уходит на связь с центральным катионом), и только для [ВО3]3– и [SiO4]4– оно равно 1. Это означает, что ионы кислорода прочнее связаны с малыми катионами внутри комплексов, чем с катионами, расположенными в кристаллических структурах вне комплексных анионов. В этом отношении кислородные соли весьма существенно отличаются от сложных окислов, для которых величины электростатической валентности связи между катионами и окружающими их ионами кислорода всегда меньше 1.
В этом отношении кислородные соли весьма существенно отличаются от сложных окислов, для которых величины электростатической валентности связи между катионами и окружающими их ионами кислорода всегда меньше 1.
Таким образом, комплексные анионы представляют собой прочно связанные в одно целое компактные группы, участвующие в кристаллических структурах как самостоятельные структурные единицы. Самостоятельность их подчеркивается тем, что эти группы не распадаются и при растворении солей. От простых анионов они существенно отличаются по форме и, естественно, по размерам. Анионы типа XO4 имеют тетраэдрическую координацию и по форме близки к изометрическим телам. Анионы типа ХO3 обладают формой плоских треугольников (СО3, ВО3), реже тупых пирамид (AsO3 и др.), в которых ионы кислорода «сидят» по углам треугольника, а связывающий их катион — над центром этого треугольника.
Кроме простых по конфигурации комплексных анионов, как мы потом увидим, существуют и более сложные радикалы. Характерно, что они свойственны боратам и силикатам, т. е. солям наиболее слабых кислот.
Характерно, что они свойственны боратам и силикатам, т. е. солям наиболее слабых кислот.
Соли других, более сильных кислот характеризуются кристаллическими структурами с типичной ионной связью, подобно тому, как это имеет место в галогенидах, с той только разницей, что роль простых анионов здесь играют комплексные анионы. Поэтому неудивительно, что они по ряду физических свойств очень близко напоминают минералы, относящиеся к хлоридам и фторидам.
Список главнейших простых по строению комплексных анионов, распространенных в природных кислородных солях, приведен в таблице 10 в порядке увеличения значений ВЭКов или ионных потенциалов. Там же приведены и размеры анионов в виде ионных «радиусов» (по А. Е. Ферсману). Необходимо заметить, что в буквальном смысле о каких-либо радиусах комплексных анионов не может быть и речи. Приведенные в таблице значения получены А. Е. Ферсманом путем расчета и сугубо приблизительны. Однако для общих соображений о свойствах минералов эти ориентировочные величины являются полезными, особенно если учесть, что такие свойства, связанные с энергией кристаллической структуры, как твердость, плавкость, летучесть, относительная растворимость и др. , мы практически расцениваем по очень грубым шкалам.
, мы практически расцениваем по очень грубым шкалам.
Таблица 10. Комплексные анионы важнейших
природных кислородных солей
В более наглядной форме приведенные в таблице значения показаны на диаграмме (рис. 207). Для сравнения нанесены в виде полых кружков также одновалентные простые анионы ранее рассмотренных галогенидов и двухвалентные простые анионы, входящие в состав окислов, сульфидов, селенидов и теллуридов.
Рис. 207. Приблизительные размеры комплексных анионов
(черные кружки) в сравнении с размерами простых анионов,
распространенных в природных соединениях
Так как подавляющая масса кислородных солей представляет собой типичные ионные соединения, то естественно, что устойчивость кристаллических структур в значительной мере должна зависеть от соотношений размеров катионов и анионов как структурных единиц. Для кислородных солей эти соотношения невозможно выразить в каких-либо цифровых значениях, так как размеры комплексных анионов мы не можем выразить в радиусах в силу того, что они по своей конфигурации существенно отличаются от шаровой формы, которую мы условно приписываем простым ионам.
Однако не может быть никакого сомнения в том, что такие изометрические комплексные анионы, как [SO4]2–, [PO4]3– , [SiO4]4– и др., по своим размерам должны быть существенно больше, чем простые анионы (например, O2–). Поэтому не случайно эти анионы в простых соединениях типа АХ (где X представлен комплексным анионом) наиболее устойчивые кристаллические структуры дают только в сочетании с крупными катионами. Эти соединения действительно являются труднорастворимыми, трудноплавкими и труднолетучими. Обратимся к примерам.
Двухвалентный анион [SO4]2– в соединениях типа АХ (т. е. с соотношением катион : анион, равным 1 : 1) образует следующие наиболее устойчивые соединения (сульфаты): BaSO4 — барит и PbSO4 — англезит, т. е. в сочетании с самыми крупными двухвалентными катионами (см. колонку двухвалентных катионов на рис. 206). С этой точки зрения понятной становится также изоморфная примесь Ra2+ и Ва2+, устанавливаемая иногда в баритах (ионный радиус Ra2+ несколько больше, чем Ва2+).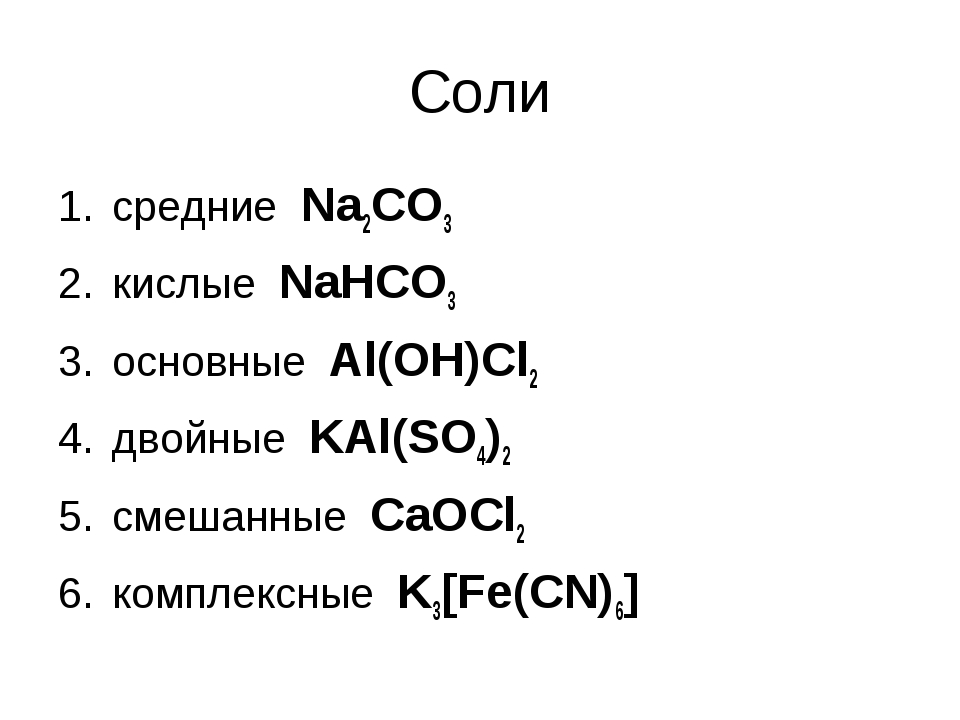 Неудивительно, что в зонах окисления урановых месторождений, содержащих сульфиды в условиях действия сульфатных вод, концентрация радия по отношению к урану выше, чем это имеет место в зоне первичных руд (соединения шестивалентного урана в этих условиях значительно более растворимы по сравнению с сульфатом радия).
Неудивительно, что в зонах окисления урановых месторождений, содержащих сульфиды в условиях действия сульфатных вод, концентрация радия по отношению к урану выше, чем это имеет место в зоне первичных руд (соединения шестивалентного урана в этих условиях значительно более растворимы по сравнению с сульфатом радия).
Что касается двухвалентных катионов с малыми ионными радиусами, то они в природных условиях могут образовывать только водные сульфаты, кристаллизующиеся при низких температурах и притом в последние стадии кристаллизации растворов. В большинстве случаев водные соли содержат 2, 4, 6 и 7 молекул h3O. Рентгенометрические исследования соединения Ni[SO4] . 6h3O показали, что катион Ni2+ в кристаллической структуре непосредственно окружен шестью электрически нейтральными (т. е. не погашающими заряд катиона) молекулами воды. Вследствие этого объем таких гидратированных катионов как бы искусственно увеличивается, благодаря чему и становится возможной постройка кристаллической структуры с участием таких крупных анионов, как [SO4]2–. С кристаллохимической точки зрения формулу этого соединения было бы правильнее писать так: [Ni(h3O)6][SO4]. Такие водные соли обладают явно повышенной или высокой растворимостью и легко подвергаются обезвоживанию, причем кристаллические структуры их претерпевают перестройки или вовсе разрушаются.
С кристаллохимической точки зрения формулу этого соединения было бы правильнее писать так: [Ni(h3O)6][SO4]. Такие водные соли обладают явно повышенной или высокой растворимостью и легко подвергаются обезвоживанию, причем кристаллические структуры их претерпевают перестройки или вовсе разрушаются.
Интересно отметить, что средний по размерам катион Ca2+ (см. рис. 206) хотя и способен в известных условиях образовать безводный сульфат Ca[SO4] (ангидрит), однако в присутствии воды он переходит в более устойчивое водное соединение Ca[SO4] . 2h3O (гипс). Последний, по рентгенометрическим данным, обладает слоистой структурой, в которой молекулы Н2О располагаются между листами, сложенными ионами Са2+ и [SO4]2–. Этим обусловлена весьма совершенная спайность кристаллов гипса в данном направлении.
Если мы перейдем к трехвалентному аниону [РО4]3–, то увидим аналогичную сульфатам картину. Среди трехвалентных катионов (см. рис. 206) наиболее крупными, могущими образовывать с этим ионом устойчивые кристаллические структуры, являются редкие земли (Се.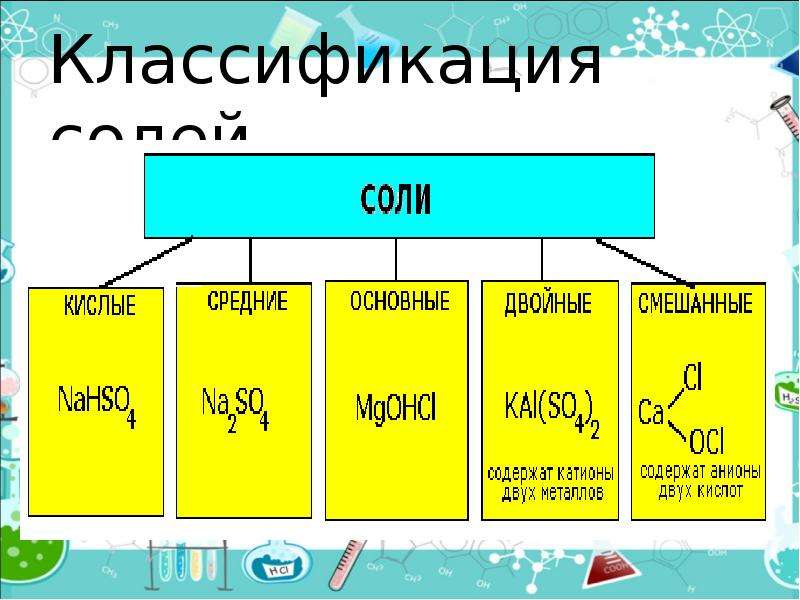 ..) и La. В природе действительно распространен очень стойкий фосфат редких земель — (Ce,La…) [РО4] (монацит). При разрушении горных пород он как весьма устойчивый химически минерал переходит в россыпи. Не случайно главные концентрации редкоземельных элементов связаны именно с этим минералом. Реже встречается другой, менее стойкий фосфат Y[РО4] (ксенотим). Фосфаты малых трехвалентных катионов (Al, Fe3+, Mn3+) в природе представлены водными солями.
..) и La. В природе действительно распространен очень стойкий фосфат редких земель — (Ce,La…) [РО4] (монацит). При разрушении горных пород он как весьма устойчивый химически минерал переходит в россыпи. Не случайно главные концентрации редкоземельных элементов связаны именно с этим минералом. Реже встречается другой, менее стойкий фосфат Y[РО4] (ксенотим). Фосфаты малых трехвалентных катионов (Al, Fe3+, Mn3+) в природе представлены водными солями.
Замечательно, что для аниона [SiO4]4– наиболее стойкими являются соединения с крупными четырехвалентными катионами (Zr4+, Th5+ нередко с изоморфной примесью урана U4+): циркон — Zr[SiO4] и торит — (Th,U)[SiO4].
Кристаллические структуры торита и его разновидностей разрушаются лишь вследствие радиоактивного распада. Циркон, не содержащий радиоактивных элементов, — весьма стойкий минерал, свидетельством чего является широкая распространенность его в виде окатанных зерен в россыпях и осадочных образованиях самых различных возрастов.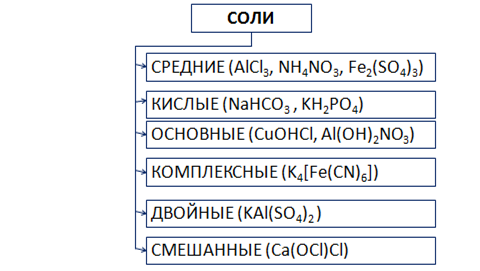 В виде этого минерала выделяется главная масса циркония в земной коре. Лишь в магмах, бедных кремнеземом и богатых щелочами, он способен образовывать другие минералы.
В виде этого минерала выделяется главная масса циркония в земной коре. Лишь в магмах, бедных кремнеземом и богатых щелочами, он способен образовывать другие минералы.
Классификация кислородных солей. Систематику солей принято давать по кислотным радикалам или, что то же самое, по комплексным анионам. Порядок расположения можно принять тот, который намечается по величинам ВЭКов или ионных потенциалов (см. табл. 10). Рассмотрение кислородных солей вслед за окислами, в частности минералами группы кварца, следовало бы начать с более близких к ним в кристаллохимическом отношении силикатов и боратов и кончить иодатами, т. е. в порядке понижения ионных потенциалов анионов. Однако в целях лучшего усвоения материала мы примем обратный порядок изучения относящихся сюда минералов, исходя из принципа «от простого к сложному» (причем карбонаты рассмотрим до сульфатов).
Таким образом, среди минералов, представляющих кислородные соли, выделим следующие классы.
1. Нитраты.
2. Карбонаты.
3. Сульфаты.
4. Хроматы.
5. Молибдаты и вольфраматы.
6. Фосфаты, арсенаты и ванадаты.
7. Бораты.
8. Силикаты и алюмосиликты.
12 видов соли — различные типы соли
Максимилиан Сток Лтд., Getty Images
Одна из приятных особенностей кулинарии — это то, что вас постоянно поощряют бросать вызов себе и пробовать что-то новое. И при этом вы часто изучаете более «общие» ингредиенты, которые оказываются совсем не такими. Это может быть что-то столь же «простое», как разные виды масла. Это может быть информация обо всех видах сквоша, которые вы видите на рынке.Или, может быть, пытаясь приготовить идеальный грибной суп, вы попутно узнаете об ассортименте грибов.
Но независимо от того, является ли ваше варенье сладким или соленым, соль играет важную роль в приготовлении пищи. Он превращает блюда от простых до вкусных, подавляет горечь и помогает сохранить пищу. Технически вся соль — это морская соль, даже поваренная соль, которую добывают из горной породы (также известной как галит), образовавшейся в древних водоемах, которые больше не существуют. Но даже в этом случае не все соли одинаковы, и их нельзя использовать одинаково.Вот 12 разных солей и то, для чего их лучше всего использовать.
Технически вся соль — это морская соль, даже поваренная соль, которую добывают из горной породы (также известной как галит), образовавшейся в древних водоемах, которые больше не существуют. Но даже в этом случае не все соли одинаковы, и их нельзя использовать одинаково.Вот 12 разных солей и то, для чего их лучше всего использовать.
Реклама — продолжить чтение ниже
1 Столовая соль
Поваренная соль, также известная как «йодированная соль», имеет очень мелкие зерна и содержит йодид калия и средство против слеживания, которое помогает предотвратить образование комков. Поскольку средство, предотвращающее слеживание, может иметь металлический привкус при использовании в больших количествах, поваренную соль не следует использовать в рецептах пикантных блюд.Однако его можно использовать при выпечке, потому что в таких рецептах обычно требуется лишь небольшое количество соли.
2 Кошерная соль
Если в трусиках достаточно места для одной соли, выберите кошерную соль. Его текстура легкая, но грубая (что помогает избежать чрезмерного посола) и легко растворяется. Его можно использовать в любом приложении, и он вполне доступен (около 4 долларов за трехфунтовую коробку). Следует помнить об одном: разные марки кошерной соли имеют разный уровень солености.Например, кошерная соль марки Morton примерно в 1,5 раза соленее, чем марка Diamond Crystal. Так что, если по каким-то причинам приходится переключаться между марками, обязательно пробуйте перед засолкой.
Его текстура легкая, но грубая (что помогает избежать чрезмерного посола) и легко растворяется. Его можно использовать в любом приложении, и он вполне доступен (около 4 долларов за трехфунтовую коробку). Следует помнить об одном: разные марки кошерной соли имеют разный уровень солености.Например, кошерная соль марки Morton примерно в 1,5 раза соленее, чем марка Diamond Crystal. Так что, если по каким-то причинам приходится переключаться между марками, обязательно пробуйте перед засолкой.
3 Гималайская розовая соль
Самая чистая из всех солей, розовая гималайская соль, добывается в соляной шахте Хура в Гималаях в Пакистане. Легко узнаваемая по розовому цвету, эта соль содержит все 84 природных минерала, присутствующих в организме человека.Из-за высокой цены и яркого вкуса для отделки блюд используйте розовую гималайскую соль.
4 Морская соль
Морская соль, полученная из испарившейся морской воды, может иметь очень или слегка соленый вкус, в зависимости от места сбора, поэтому обязательно попробуйте ее перед использованием. Морская соль также содержит множество минералов, поэтому она может иметь сложный вкус, но, поскольку она мелкая или среднезернистая, ее можно использовать как в соленых, так и в сладких рецептах.
Морская соль также содержит множество минералов, поэтому она может иметь сложный вкус, но, поскольку она мелкая или среднезернистая, ее можно использовать как в соленых, так и в сладких рецептах.
5 Кельтская соль серого моря
Кельтская морская соль, добываемая в атлантических прудах у побережья Франции, также известна как sel gris (по-французски «серая соль»). Его серый цвет обусловлен минералами, которые остаются после испарения морской воды. Используйте в качестве завершающей соли для жареных овощей, мяса или морепродуктов, приготовленных на гриле.
6 Флер де Сел
Как и кельтская морская соль, fleur de sel (по-французски «цветок соли») собирают из испарившейся морской воды, но именно с побережья Бретани.Эту соль часто называют запахом моря. Это влажная соль, поэтому она довольно липкая, но из-за влажности соленость дольше остается на языке. Лучше всего использовать в качестве финишной соли.
7 Хлопья Соль
Подобно sel gris и f leur de sel , чешуйчатая соль собирается из испарившейся морской воды, хотя ее форма и текстура сильно отличаются. Легкие, тонкие и неправильной формы (часто напоминающие пирамиды) чешуйчатая соль имеет очень яркий вкус и низкое содержание минералов.Из-за высокой цены ее лучше всего использовать в качестве отделочной соли. Попробуйте посыпать им салаты или шоколадное печенье.
Легкие, тонкие и неправильной формы (часто напоминающие пирамиды) чешуйчатая соль имеет очень яркий вкус и низкое содержание минералов.Из-за высокой цены ее лучше всего использовать в качестве отделочной соли. Попробуйте посыпать им салаты или шоколадное печенье.
8 Красная гавайская соль
Красная гавайская соль — это морская соль, смешанная с вулканической глиной, богатой оксидом железа. Его вкус описывается как ореховый. Яркий красный цвет делает его идеальным для украшения готовой посуды.
9 Черная гавайская соль
Черная гавайская соль, сделанная путем добавления активированного угля к морской соли, известна своим сильным вкусом, часто описываемым как «землистый».»Посыпать готовые блюда.
10 Копченая соль
Копченая соль создается путем холодного копчения соли с древесиной (такой как ольха, яблоко, гикори или мескит) в течение до двух недель. Его вкус и цвет могут варьироваться в зависимости от типа древесины и продолжительности копчения. Используйте его, чтобы добавить аромат дыма к пикантным блюдам, таким как соус чили или барбекю.
Используйте его, чтобы добавить аромат дыма к пикантным блюдам, таким как соус чили или барбекю.
11 Гималайская черная соль
Также известная как Кала Намак (что в переводе с непальского означает «черная соль»), эта красновато-коричневая соль создается путем варки каменной соли с древесным углем, травами, семенами и корой в печи в течение 24 часов.У него очень характерный вкус и запах — часто описываемый как яйцо всмятку — и обычно используется в веганских рецептах, чтобы имитировать вкус яиц.
12 Маринованная соль
Используется только для маринования, эта крупная соль не содержит йода, минералов и слеживающихся веществ.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты.Вы можете найти дополнительную информацию об этом и подобном контенте на сайте piano.io.
Реклама — продолжить чтение ниже
Поваренная соль как катализатор окисления ароматических спиртов и аминов до кислот и иминов в водной среде: эффективное проведение реакций окисления в морской воде
rsc.org/schema/rscart38″> Простой, эффективный, устойчивый и экономичный метод окисления спиртов и аминов был разработан на основе хлорида, морского анионного катализатора для практического синтеза широкого спектра карбоновых кислот, кетонов и иминов.Окисление ароматических спиртов проводили, используя NaCl (20 мол.%) В качестве катализатора, NaOH (50 мол.%) И водн. ТБГП (4 экв.) В качестве окислителя с выходами изолированных 55–92%. Окисление ароматических аминов до иминов достигалось с использованием только 20 мол.% NaCl и водн. ТБГП (4 экв.) С выходами 32–93% изолированных. Виды хлора, образующиеся в ходе реакции в качестве активного катализатора окисления, были идентифицированы как ClO 2 — для спиртов и ClO — / ClO 2 — для аминов. контрольными экспериментами.Этот метод практически не требует хроматографической очистки, что делает его пригодным для крупномасштабного синтеза. Мы увеличили до 30 граммов синтез карбоновых кислот и иминов с хорошими выходами, а также эффективно реализовали этот новый метод с использованием фильтрованной морской воды в качестве растворителя и катализатора.
Мы увеличили до 30 граммов синтез карбоновых кислот и иминов с хорошими выходами, а также эффективно реализовали этот новый метод с использованием фильтрованной морской воды в качестве растворителя и катализатора.У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?рекомендаций по диете с низким содержанием натрия | Обучение пациентов
Диета с низким содержанием натрия
Основным источником натрия является поваренная соль. Средний американец съедает пять или более чайных ложек соли каждый день. Это примерно в 20 раз больше, чем нужно организму. Фактически, вашему организму требуется всего 1/4 чайной ложки соли каждый день. Натрий естественным образом содержится в пищевых продуктах, но его много добавляется во время обработки и приготовления. Многие продукты, не имеющие соленого вкуса, могут содержать много натрия. Большое количество натрия может скрываться в консервированных, полуфабрикатах и полуфабрикатах. А натрий можно найти во многих продуктах, которые подают в ресторанах быстрого питания.
Средний американец съедает пять или более чайных ложек соли каждый день. Это примерно в 20 раз больше, чем нужно организму. Фактически, вашему организму требуется всего 1/4 чайной ложки соли каждый день. Натрий естественным образом содержится в пищевых продуктах, но его много добавляется во время обработки и приготовления. Многие продукты, не имеющие соленого вкуса, могут содержать много натрия. Большое количество натрия может скрываться в консервированных, полуфабрикатах и полуфабрикатах. А натрий можно найти во многих продуктах, которые подают в ресторанах быстрого питания.
Натрий контролирует баланс жидкости в нашем организме и поддерживает объем крови и кровяное давление. Употребление слишком большого количества натрия может повысить кровяное давление и вызвать задержку жидкости, что может привести к отекам ног и ступней или другим проблемам со здоровьем.
При ограничении натрия в своем рационе обычно нужно съедать менее 2000 миллиграммов натрия в день.
Читать далееОбщие рекомендации по сокращению потребления соли
- Исключите из своего рациона соленые продукты и уменьшите количество соли, используемой при приготовлении пищи.
 Морская соль ничем не лучше обычной соли.
Морская соль ничем не лучше обычной соли. - Выбирайте продукты с низким содержанием натрия. Доступны многие продукты без соли или с пониженным содержанием соли. При чтении этикеток на пищевых продуктах низкий уровень натрия определяется как 140 мг натрия на порцию.
- Заменители соли иногда делают из калия, поэтому читайте этикетку. Если вы придерживаетесь диеты с низким содержанием калия, посоветуйтесь с врачом, прежде чем использовать эти заменители соли.
- Будьте изобретательны и приправляйте еду специями, зеленью, лимоном, чесноком, имбирем, уксусом и перцем.Уберите солонку со стола.
- Прочтите этикетки ингредиентов, чтобы определить продукты с высоким содержанием натрия. Продукты с содержанием натрия 400 мг и более содержат большое количество натрия. Пищевые добавки с высоким содержанием натрия включают соль, рассол или другие продукты, содержащие натрий, например глутамат натрия.
- Ешьте больше домашних блюд. Продукты, приготовленные с нуля, естественно, содержат меньше натрия, чем большинство растворимых смесей и смесей в коробках.

- Не используйте для приготовления и питья смягченную воду, так как она содержит добавленную соль.
- Избегайте лекарств, содержащих натрий, таких как Alka Seltzer и Bromo Seltzer.
- Для получения дополнительной информации; Существуют книги о составе пищевых продуктов, в которых указано, сколько натрия содержится в пище. Интернет-источники, такие как www.calorieking.com, также указывают суммы.
Мясо, птица, рыба, бобовые, яйца и орехи
Продукты с высоким содержанием натрия
- Копчености, вяленые, соленые или консервированные мясо, рыба или птица, включая бекон, мясное ассорти, ветчину, сосиски, колбасы, сардины, икру и анчоусы
- Замороженное мясо в панировке и обеды, такие как буррито и пицца
- Консервы, такие как равиоли, спам и перец чили
- Орехи соленые
- Фасоль консервированная с добавлением соли
Альтернативы с низким содержанием натрия
- Любая свежая или замороженная говядина, баранина, свинина, птица и рыба
- Яйца и заменители яиц
- Арахисовая паста с низким содержанием натрия
- Горошек и фасоль сушеные (не консервированные)
- Рыбные консервы с низким содержанием натрия
- Сушеные консервы из рыбы или птицы в воде или масле
Молочные продукты
Продукты с высоким содержанием натрия
- Пахта
- Обычные и плавленые сыры, сырные пасты и соусы
- Творог
Альтернативы с низким содержанием натрия
- Молоко, йогурт, мороженое и мороженое с молоком
- Сыры с низким содержанием натрия, сливочный сыр, сыр рикотта и моцарелла
Хлеб, зерно и крупы
Продукты с высоким содержанием натрия
- Хлеб и булочки с соленой начинкой
- Быстрый хлеб, самоподнимающаяся мука, бисквитные, блиновые и вафельные смеси
- Пицца, гренки и соленые крекеры
- Смеси фасованные, обработанные для картофеля, риса, макаронных изделий и начинки
Альтернативы с низким содержанием натрия
- Хлеб, рогалики и булочки без соленой верхушки
- Маффины и готовые к употреблению злаки
- Весь рис и макароны, но без добавления соли при приготовлении
- Кукурузные и мучные лепешки и лапша с низким содержанием натрия
- Крекеры и хлебные палочки с низким содержанием натрия
- Несоленый попкорн, чипсы и крендели
Овощи и фрукты
Продукты с высоким содержанием натрия
- Обычные овощные консервы и овощные соки
- Оливки, соленые огурцы, квашеная капуста и прочие маринованные овощи
- Овощи с ветчиной, беконом или соленой свининой
- Смеси в упаковке, такие как картофель с гребешками или запеканкой, замороженные картофельные оладьи и картофельные оладьи
- Готовые макаронные изделия, томатные соусы и сальса
Альтернативы с низким содержанием натрия
- Овощи свежие и замороженные без соусов
- Овощные консервы, соусы и соки с низким содержанием натрия
- Свежий картофель, замороженный картофель фри и картофельное пюре быстрого приготовления
- Томатный сок с низким содержанием соли или сок V-8.

- Самые свежие, замороженные и консервированные фрукты
- Сухофрукты
Супы
Продукты с высоким содержанием натрия
- Обычные консервированные и обезвоженные супы, бульоны и бульоны
- Чашка лапши и приправленной смеси для рамена
Альтернативы с низким содержанием натрия
- Консервированные и обезвоженные супы, бульоны и бульоны с низким содержанием натрия
- Домашние супы без добавления соли
Жиры, десерты и сладости
Продукты с высоким содержанием натрия
- Соевый соус, соль приправы, другие соусы и маринады
- Заправка для салатов в бутылках, обычная заправка для салатов с кусочками бекона
- Сливочное масло или маргарин
- Пудинг быстрого приготовления и торт
- Большие порции кетчупа, горчицы
Альтернативы с низким содержанием натрия
- Уксус, несоленое масло или маргарин
- Растительные масла и соусы с низким содержанием натрия и заправки для салатов
- Майонез
- Все десерты без соли
Тест на толерантность к соли — Биохимический тест
Объективы- Для определения способности организма расти при высоких концентрациях соли.

- Используется для дифференциации энтерококков от неэнтерококков.
Соль действует как селективный агент и нарушает проницаемость мембраны и осмотическое равновесие. Среда для солеустойчивости — это селективная и дифференцированная среда, в которой солеустойчивые организмы будут давать интенсивный рост в бульоне и на твердом агаре в течение 48 часов. Хайна разработал первую формулировку солеустойчивой среды. Высокая концентрация соли подавляет ряд бактерий, но позволяет солеустойчивым организмам, таким как энтерококки, расти в среде.Состав Quadri включает ферментируемый углевод, декстрозу и цветовой индикатор бромкрезоловый пурпурный. Организмы, способные расти в среде с высоким содержанием соли, утилизируют сахар и выделяют кислоту в качестве побочного продукта своего метаболизма в среде. В результате падения pH индикатор бромкрезолового пурпура меняет цвет с пурпурного на желтый. Энтерококки устойчивы к высокой концентрации соли и показывают рост в среде, содержащей соль. E. faecalis, E. zymogenes, E. liquifaciens и E.durans относятся к видам Enterococcus , которые устойчивы к соли.
E. faecalis, E. zymogenes, E. liquifaciens и E.durans относятся к видам Enterococcus , которые устойчивы к соли.
Можно использовать среду хлорида натрия (NaCl) 6,5% или можно использовать бульон для инфузии мозга и сердца (BHI) вместо отдельных компонентов с добавлением NaCl и индикаторного красителя.
Компоненты: Heart digest (10 г), ферментативный гидролизат животных тканей (10 г), NaCl (65 г), декстроза (1 г), бромкрезол пурпурный (0,016 г), на 1000 мл.
Процедура- Засейте одну или две колонии из 18–24-часовой культуры в 6.Бульон 5% NaCl без индикатора или бульон 6,5% NaCl, содержащий индикатор.
- Инкубируйте пробирку при температуре 35–37 ° C на воздухе в течение 48 часов.
- Проверьте среду на помутнение / рост или наличие колоний на среде без индикатора или проверьте среду с индикатором на изменение цвета с пурпурного на желтый.

Положительный результат теста: Видимая мутность бульона с изменением цвета от пурпурного до желтого или без него
Отрицательный результат: Без мутности и без изменения цвета
Ограничения- Настой отвар с 6.5% NaCl может вызывать медленные реакции, что затрудняет интерпретацию результатов теста.
- Streptococcus agalactiae (группа B) будет расти в среде, однако не вызывает кислой реакции. В среде наблюдается помутнение, но изменения цвета не происходит.
- При инокуляции бульона необходимо использовать светлый посевной материал. Посев тяжелого инокулята может вызвать помутнение, что приведет к ложноположительному результату.
- Рекомендуется проводить биохимические, иммунологические, молекулярные или масс-спектрометрические исследования на колониях из чистой культуры для полной идентификации.

Положительный: Enterococcus faecalis (ATCC29212): рост, изменение цвета на желтый
Отрицательный: Streptococcus bovis (ATCC9809): ингибирование, без изменения цвета
Список литературы- Тилле П.М. 2014. Диагностическая микробиология Бейли и Скотта. Издание тринадцатое. Mosby, Inc., дочерняя компания Elsevier Inc. 3251 Riverport Lane. Святой Луи. Миссури 63043
- Снайдер Дж. В., Атлас, РМ.Справочник средств массовой информации для клинической микробиологии. CRC Press. Группа Тейлор и Фрэнсис. 6000 Broken Sound Parkway NW, Suite 300. Boca Raton, FL 33487-2742.
- Хайна, А.А. и С.А. Перри. 1943. Американский журнал общественного здравоохранения ; 33: 550-58
Salty Science: есть ли в вашей соли йод?
Ключевые концепции
Питательные вещества
Диета
Еда
Здоровье
Химические реакции
Введение
Вы когда-нибудь замечали, что в соли, которую вы используете, написано, что она «йодированная»? Йод — это питательный микроэлемент, а это значит, что он нужен нам в небольших количествах, чтобы быть здоровым. Поскольку йод относительно редко встречается в обычном рационе многих людей, его добавляют в поваренную соль. Затем, когда люди солят пищу, например вкусную индейку, фарш и картофельное пюре, они также получают йод. В этом научном упражнении вы воспользуетесь подходящей для кухни химией, чтобы выяснить, какие типы соли содержат йод, а какие нет. Затем, когда вы садитесь за обед в День Благодарения, вы можете знать, стоит ли также благодарить за то, что вы помогаете бороться с дефицитом йода.
Поскольку йод относительно редко встречается в обычном рационе многих людей, его добавляют в поваренную соль. Затем, когда люди солят пищу, например вкусную индейку, фарш и картофельное пюре, они также получают йод. В этом научном упражнении вы воспользуетесь подходящей для кухни химией, чтобы выяснить, какие типы соли содержат йод, а какие нет. Затем, когда вы садитесь за обед в День Благодарения, вы можете знать, стоит ли также благодарить за то, что вы помогаете бороться с дефицитом йода.
Фон
Микроэлементы, такие как йод, представляют собой типы питательных веществ, которые необходимы людям в небольших количествах.Йод важен для нормального функционирования щитовидной железы человека. (Щитовидная железа — это железа на шее, вырабатывающая ключевые гормоны.) В небольших количествах она содержится в других продуктах, включая морскую рыбу, водоросли, моллюски, йогурт, молоко, яйца, сыр и некоторые другие продукты. Если человек не потребляет достаточное количество йода, у него может возникнуть дефицит йода. Недостаток этого микроэлемента может вызвать различные проблемы со здоровьем (обычно из-за гипотиреоза, вызванного недостаточностью гормонов щитовидной железы).Эти состояния включают зоб (видимый отек щитовидной железы), а также серьезные врожденные дефекты. Фактически, дефицит йода — самая частая предотвратимая причина умственной отсталости.
Недостаток этого микроэлемента может вызвать различные проблемы со здоровьем (обычно из-за гипотиреоза, вызванного недостаточностью гормонов щитовидной железы).Эти состояния включают зоб (видимый отек щитовидной железы), а также серьезные врожденные дефекты. Фактически, дефицит йода — самая частая предотвратимая причина умственной отсталости.
Йод (в форме йодида) добавляют в поваренную соль, чтобы предотвратить дефицит йода. С 80-х годов прошлого века предпринимались попытки повсеместного йодирования соли. Это доступный и эффективный способ борьбы с дефицитом йода во всем мире, однако не вся соль содержит йод.Вы узнаете, есть ли в различных солях йод, смешав их с крахмалом для стирки, который с йодом образует химическое вещество сине-пурпурного цвета. (Уксус и перекись водорода добавляются в солевой раствор, чтобы способствовать протеканию этой химической реакции.)
Материалы
• Одноразовые пластиковые стаканчики размером 10 унций или больше. (В качестве альтернативы вы можете использовать чашки меньшего размера и уменьшить активность. )
)
• Дистиллированная вода
• Мерные стаканы
• Мерные ложки
• Раствор крахмала для стирки, также называемый жидким крахмалом (в качестве альтернативы, вы можете приготовить подходящий раствор крахмала, растворив одну чашку биоразлагаемого упаковочного арахиса на основе крахмала в двух чашках воды.)
• Раствор йодного антисептика (необязательно) (используйте настойку йода или раствор повидон-йода, который можно найти в отделе первой помощи в продуктовых магазинах и аптеках. Если йод не поставляется с пипеткой, вам также понадобится пипетка для лекарств. .)
• Одноразовые пластиковые ложки
• Как минимум три различных типа соли для тестирования — например, обычная (неиодированная) поваренная соль, йодированная поваренная соль, маринованная соль, каменная соль, кошерная соль, «облегченная» соль и морская соль (если вы не используете йод антисептический раствор, включают йодированную поваренную соль.)
• 3-процентная перекись водорода
• Белый уксус
Препарат
• Если вы используете раствор йодного антисептика, вы можете приготовить чашку для положительного контроля, чтобы знать, как должна выглядеть реакция между йодом и крахмалом. Для этого налейте полстакана дистиллированной воды в одноразовую чашку, добавьте половину чайной ложки (чайной ложки) раствора крахмала для стирки, а затем добавьте пять капель раствора йодного антисептика. Будьте осторожны при обращении с йодом, потому что он может испачкать.
Для этого налейте полстакана дистиллированной воды в одноразовую чашку, добавьте половину чайной ложки (чайной ложки) раствора крахмала для стирки, а затем добавьте пять капель раствора йодного антисептика. Будьте осторожны при обращении с йодом, потому что он может испачкать.
• Хорошо перемешайте одноразовой пластиковой ложкой. Что происходит с жидкостью при добавлении йода?
Процедура
• Выберите один из типов соли, которую вы хотите проверить, и отмерьте четыре столовые ложки (столовые ложки) в чистую пластиковую одноразовую чашку. Добавьте к соли один стакан дистиллированной воды и хорошенько перемешайте около минуты чистой одноразовой пластиковой ложкой. Вам не нужно, чтобы вся соль растворялась.
• Затем добавьте одну ст.белого уксуса, одна ст. перекиси водорода и половину чайной ложки. раствора крахмала. Как вы думаете, для чего нужен крахмал?
• Хорошо перемешайте солевой раствор одноразовой пластиковой ложкой и дайте раствору постоять несколько минут. Что происходит с раствором после перемешивания? Стал ли он сине-фиолетовым цветом?
Что происходит с раствором после перемешивания? Стал ли он сине-фиолетовым цветом?
• Повторите этот процесс с другим типом соли, которую вы хотите проверить. Для каждого типа обязательно используйте разные чистые одноразовые стаканчики и ложки. Становятся ли другие солевые растворы сине-пурпурного цвета?
• На основании ваших результатов, какие соли, по вашему мнению, содержат йод (в форме йодида), а какие нет? Согласуются ли ваши результаты с маркировкой на упаковках соли, где часто указано, содержит ли соль йодид или нет?
• Extra: Попробуйте это занятие с еще большим количеством различных видов солей. Некоторые идеи можно найти в списке материалов выше. Какие виды соли содержат йод, а какие нет? Соответствуют ли ваши результаты их маркировке?
• Extra: В этом упражнении вы добавили уксус, потому что он является кислотой и помогает протекать химической реакции.Попробуйте еще раз попробовать раствор йодированной соли, но на этот раз не добавляйте уксус. Реакция все еще идет, в результате чего раствор приобретает сине-пурпурный цвет? Если реакция произошла, прошло ли больше времени?
Реакция все еще идет, в результате чего раствор приобретает сине-пурпурный цвет? Если реакция произошла, прошло ли больше времени?
• Extra: Температура часто влияет на химические реакции. Вы можете попробовать это упражнение еще раз, но протестируйте раствор йодированной соли при разных температурах (путем нагревания или охлаждения дистиллированной воды). Как изменение температуры раствора влияет на протекание реакции изменения цвета?
Наблюдения и результаты
Изменился ли раствор йодированной поваренной соли на сине-фиолетовый цвет, когда вы добавили крахмал? «Облегченная» поваренная соль изменила цвет аналогичным образом, в отличие от большинства других типов соли?
В этом упражнении вы должны были видеть, что йодированная поваренная соль и «облегченные» растворы поваренной соли изменились на сине-пурпурный цвет (как и раствор йодного антисептика, если вы его использовали).Это указывает на то, что йодид присутствует в этих типах солей. Вы, вероятно, не заметили изменения цвета растворов, приготовленных с использованием неиодированной соли, каменной соли, кошерной соли или морской соли, потому что эти разновидности обычно не содержат йодида.
Вы, вероятно, не заметили изменения цвета растворов, приготовленных с использованием неиодированной соли, каменной соли, кошерной соли или морской соли, потому что эти разновидности обычно не содержат йодида.
Раствор крахмала использовался в этой деятельности, потому что он образует химическое вещество сине-пурпурного цвета в сочетании с йодом. Поскольку для эффективной химической реакции необходимо изменить исходный pH раствора, также добавляют уксус (кислоту).Перекись водорода используется для превращения йодида соли в йод, с которым реагирует крахмал.
Очистка
Обязательно тщательно мойте мерные ложки или другую посуду, которые соприкасались с растворами, приготовленными в ходе этого научного занятия. Растворы можно утилизировать, слив их в канализацию.
Больше для изучения
Информационный центр по микронутриентам: йод, от Института Лайнуса Полинга, Университет штата Орегон
Дефицит микронутриентов: расстройства, связанные с дефицитом йода, от Всемирной организации здравоохранения
Тестирование йодида в столовой соли (pdf), от Стивена У. Wright, Journal of Chemical Education
Wright, Journal of Chemical Education
Определение содержания йодида в соли, от Science Buddies
Это мероприятие познакомило вас с партнерством с Science Buddies.
Роль местных средств массовой информации в продвижении потребления йодированной поваренной соли | Исследования в области санитарного просвещения
Аннотация
Йододефицитное расстройство (ЙДЗ) в настоящее время является важной проблемой общественного здравоохранения Турции. Использование йодированной соли — простое и дешевое решение.Целью этого исследования было определить распространенность употребления йодированной соли в регионе Трабзон и влияние местной образовательной программы средств массовой информации на рост ее использования. Общая цель состояла в том, чтобы использовать полученные данные для информирования о будущих мероприятиях по управлению здравоохранением и санитарному просвещению, а также в формировании дальнейшего развития программы IDD.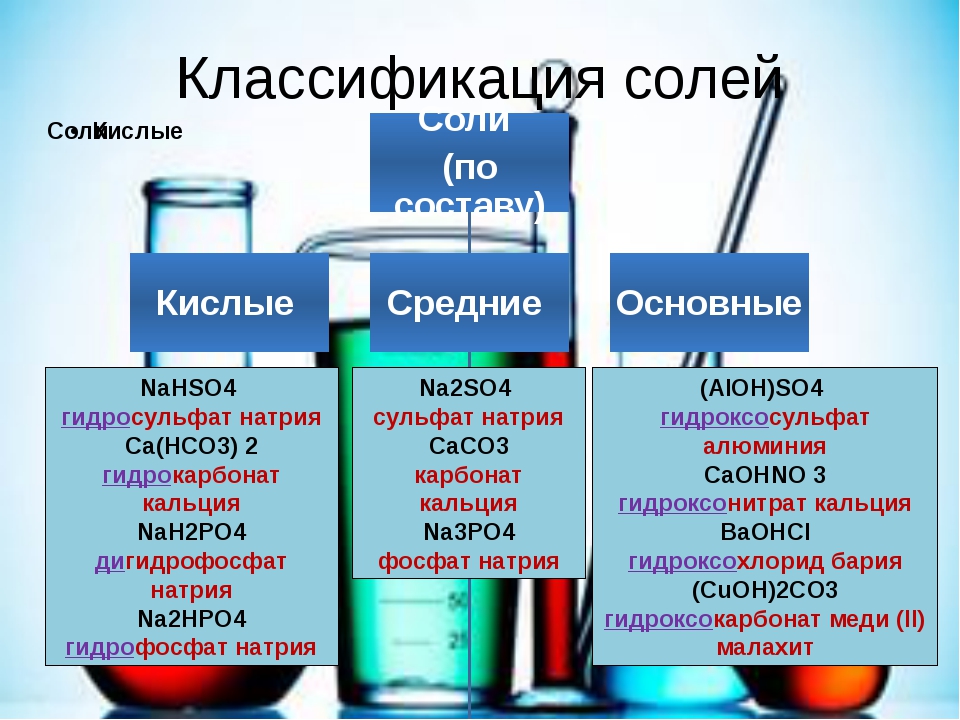 До вмешательства распространенность употребления йодированной соли составляла 54,5%. По итогам 3-х месячной программы обучения он увеличился до 62,4%. Наблюдалась значительная разница в результатах до и после вмешательства (P = 0.00237). Результаты показывают, что использование местных средств массовой информации эффективно для увеличения распространенности употребления йодированной соли. Таким образом, местные средства массовой информации могут использоваться как часть национальной стратегии предотвращения йододефицитных заболеваний.
До вмешательства распространенность употребления йодированной соли составляла 54,5%. По итогам 3-х месячной программы обучения он увеличился до 62,4%. Наблюдалась значительная разница в результатах до и после вмешательства (P = 0.00237). Результаты показывают, что использование местных средств массовой информации эффективно для увеличения распространенности употребления йодированной соли. Таким образом, местные средства массовой информации могут использоваться как часть национальной стратегии предотвращения йододефицитных заболеваний.
Введение
Особая геоморфология Турции вызывает проблемы йодной недостаточности. Согласно критериям, установленным Европейской тироидной ассоциацией (European Thyroid Association, 1985), ни один регион Турции не свободен от проблемы зоба, хотя между регионами есть некоторые различия.Недавние исследования показывают, что во многих регионах распространенность зоба превышает 15%, включая Болу, Бурса, Испарта, Кастамону, Ризе и Трабзон (Mocan and Tokel, 1984; Mocan et al. , 1989).
, 1989).
В Трабзоне, на черноморском побережье северной Турции, проживает 200 000 человек. Исторически распространенность йододефицитного заболевания (ЙДЗ) в этом районе была особенно высокой. Национальное исследование детей в возрасте 6–12 лет, проведенное в 1995 г., показало, что у 30,3% детей зоб был обнаружен при пальпации, а в Трабзоне этот уровень достиг 68% (IDD Data, 1997).Программа борьбы с IDD в настоящее время разрабатывается в Турции. Система ежемесячных отчетов о зобе была создана Министерством здравоохранения для провинциальных управлений здравоохранения. Однако он еще не полностью функционирует, и требуется более сильная поддержка как со стороны политиков, так и со стороны управленческого персонала.
Использование йодированной соли — простое и дешевое решение проблемы йодной недостаточности. В 1999 году была разработана программа, направленная на увеличение распространенности потребления йодированной соли. Он был нацелен на женщин, в частности, из-за их роли в контроле за покупкой и потреблением продуктов питания в семье.
Грин определил санитарное просвещение как «любую комбинацию методов обучения, призванных способствовать добровольной адаптации поведения, способствующего укреплению здоровья» (Green, 1984). Таким образом, санитарное просвещение может быть связано с развитием осведомленности, знаний, мотивации и навыков людей с использованием целого ряда подходов — от индивидуального общения до широкомасштабных мероприятий на уровне сообщества или общенационального уровня (Tones and Tilford, 1994). Принято считать, что средства массовой информации обладают ограниченным потенциалом для значительного изменения поведения (Tones, 1996).Однако недавние исследования по ряду вопросов, таких как сердечно-сосудистые заболевания, табакокурение и диарейные заболевания, показали, что они могут быть эффективными (Miller and Hirshhorn, 1995; Romer and Kim, 1995; Glanz et al. , 1995; Elder et al. al ., 1996; Mudde and de Vries, 1999).
В контексте профилактики ЙДЗ использование средств массовой информации было сочтено целесообразным по ряду причин. Средства массовой информации, как подразумевается в названии, могут охватывать значительную часть населения и группы, к которым невозможно получить доступ по другим каналам.Вмешательство не потребовало серьезных изменений в поведении, а просто заменило употребление соли на употребление йодированной соли. Теория коммуникации инноваций (Rogers and Shoemaker, 1971) предполагает, что характеристики инновации являются важными факторами, влияющими на принятие инновации. В данном случае нововведение простое, не предполагает значительного отхода от существующей практики и не имеет дополнительных затрат — ни финансовых, ни каких-либо других негативных последствий. В обществе уже была осведомленность о ЙДЗ, которая усиливалась через средства массовой информации вместе с информацией о преимуществах йодированной соли для решения этой проблемы.Подкомитет по средствам массовой информации и укреплению здоровья Постоянного комитета Австралийского национального совета здравоохранения и медицинских исследований по вопросам укрепления здоровья и санитарного просвещения определяет одну из ролей средств массовой информации в укреплении здоровья как предоставление информации и действительно подчеркивает права людей на доступ к информации.
Средства массовой информации, как подразумевается в названии, могут охватывать значительную часть населения и группы, к которым невозможно получить доступ по другим каналам.Вмешательство не потребовало серьезных изменений в поведении, а просто заменило употребление соли на употребление йодированной соли. Теория коммуникации инноваций (Rogers and Shoemaker, 1971) предполагает, что характеристики инновации являются важными факторами, влияющими на принятие инновации. В данном случае нововведение простое, не предполагает значительного отхода от существующей практики и не имеет дополнительных затрат — ни финансовых, ни каких-либо других негативных последствий. В обществе уже была осведомленность о ЙДЗ, которая усиливалась через средства массовой информации вместе с информацией о преимуществах йодированной соли для решения этой проблемы.Подкомитет по средствам массовой информации и укреплению здоровья Постоянного комитета Австралийского национального совета здравоохранения и медицинских исследований по вопросам укрепления здоровья и санитарного просвещения определяет одну из ролей средств массовой информации в укреплении здоровья как предоставление информации и действительно подчеркивает права людей на доступ к информации. информация о здоровье, позволяющая им делать осознанный выбор (Постоянный комитет Национального совета по здравоохранению и медицинским исследованиям по укреплению здоровья и Подкомитет по медико-санитарному просвещению по средствам массовой информации и укреплению здоровья, 1984 г.).Tones рассматривает одностороннее общение и отсутствие межличностного взаимодействия как неотъемлемые элементы средств массовой информации как ограничивающие факторы в передаче идей и мотивации людей к изменению поведения (Tones, 1996). Очевидно, что возможность обратной связи и модификации сообщений, предоставляемая индивидуальным общением, предлагает больший потенциал для передачи сложных сообщений и влияния на поведение. Включение сеансов по телефону и телевидению помогло решить некоторые из этих трудностей — напрямую или косвенно.Кроме того, сообщение, передаваемое в этом случае, было относительно простым.
информация о здоровье, позволяющая им делать осознанный выбор (Постоянный комитет Национального совета по здравоохранению и медицинским исследованиям по укреплению здоровья и Подкомитет по медико-санитарному просвещению по средствам массовой информации и укреплению здоровья, 1984 г.).Tones рассматривает одностороннее общение и отсутствие межличностного взаимодействия как неотъемлемые элементы средств массовой информации как ограничивающие факторы в передаче идей и мотивации людей к изменению поведения (Tones, 1996). Очевидно, что возможность обратной связи и модификации сообщений, предоставляемая индивидуальным общением, предлагает больший потенциал для передачи сложных сообщений и влияния на поведение. Включение сеансов по телефону и телевидению помогло решить некоторые из этих трудностей — напрямую или косвенно.Кроме того, сообщение, передаваемое в этом случае, было относительно простым.
В период с февраля по май 1999 г. велось две телевизионных программы, каждая продолжительностью 3 часа поздно вечером с 21:00 до 24:00, и одна утренняя радиопередача в прямом эфире, которая транслировалась с 10:00 до 12:00. : 00. В программах использовался телефонный формат, а затем они повторялись дважды в прайм-тайм с 20:00 до 23:00. Ключевые сообщения были подтверждены исследователями три и четыре раза в течение последующих дневных интервалов, запланированных на разное время суток.Эти дневные интервалы длились по 2–3 часа. Программы были разработаны для следующих областей:
: 00. В программах использовался телефонный формат, а затем они повторялись дважды в прайм-тайм с 20:00 до 23:00. Ключевые сообщения были подтверждены исследователями три и четыре раза в течение последующих дневных интервалов, запланированных на разное время суток.Эти дневные интервалы длились по 2–3 часа. Программы были разработаны для следующих областей:
Что такое IDD?
Причина ЙДЗ.
Как можно контролировать IDD.
Что люди могут делать сами.
Повышение осведомленности о йодированной соли и о том, что это такое.
Как использовать йодированную соль.
Хранилище йодированной соли.
Есть ли разница между йодированной и не йодированной солью?
Включены сообщения:
«Для вашего здоровья используйте йодированную соль»
«Нехватка йода может вызвать умственную отсталость — выбирайте йодированную соль для ваших детей»
«Йодированная соль ничем не отличается от не йодированной; такой же вкус и та же цена »
Целью этого исследования, которое проводилось при поддержке Трабзонского отделения ЮНИСЕФ, было изучение воздействия этой кампании санитарного просвещения с использованием местных средств массовой информации на использование йодированной соли.
Методы
Исследуемая популяция состояла из замужних женщин старше 19 лет из региона Трабзон. Основное внимание в исследовании уделялось замужним женщинам из-за их роли в принятии решений о том, какие продукты и материалы для приготовления пищи используются в доме. Их осведомленность о йодированной соли, источниках информации о ней, использовании йодированной соли и любых причинах ее неиспользования были изучены до кампании в местных средствах массовой информации и еще раз через 1 неделю после кампании. Также была запрошена информация о наличии зоба в семье и осведомленности о ЙДЗ.
Данные были получены путем личного интервью с использованием структурированной анкеты. Тот же вопросник использовался для компонентов исследования до и после вмешательства. Интервью проводились на дому у респондентов.
Исходя из ожидаемого максимального использования йодированной соли 50 и 95% уровней достоверности с 4% отклонением, необходимый размер выборки был рассчитан как 600 (Vaughan et al. , 1989). Выборка была отобрана с помощью двухэтапной случайной выборки — первый этап включал в себя выбор провинциальных семейных центров, за которым следовал выбор семей, идентифицированных по регистрационному номеру семьи.Количество отобранных лиц было пропорционально размеру медицинских центров.
, 1989). Выборка была отобрана с помощью двухэтапной случайной выборки — первый этап включал в себя выбор провинциальных семейных центров, за которым следовал выбор семей, идентифицированных по регистрационному номеру семьи.Количество отобранных лиц было пропорционально размеру медицинских центров.
Всего в феврале 1999 г. было опрошено 672 замужних женщины. После кампании в мае 1999 г. были опрошены еще 768 женщин.
Анализ результатов был проведен с использованием EpiInfo 6.0, а значимость была проверена с использованием χ 2 .
Результаты
Группы женщин в до и после выборки были схожи по основным демографическим характеристикам.Не было значительной разницы в возрасте и образовательном уровне среди выборок женщин, опрошенных до и после кампании в СМИ, как показано в Таблице I.
Общая осведомленность и использование йодированной соли до и после кампании показаны в Таблице II. . Было отмечено значительное увеличение использования йодированной соли с 54,5% до кампании в СМИ до 62,4% после ( P = 0,00237). Был меньший, но все же значительный рост осведомленности о йодированной соли с 67.От 1 до 72,9% ( P = 0,01628).
Был меньший, но все же значительный рост осведомленности о йодированной соли с 67.От 1 до 72,9% ( P = 0,01628).
Из женщин, знавших о йодированной соли до кампании, 81,2% фактически ее употребляли. После кампании этот показатель увеличился, и 85,5% тех, кто знал о йодированной соли, также использовали ее.
Кампания также повысила осведомленность о важности ЙДЗ.
До кампании 52,9% женщин, которые не употребляли йодированную соль, заявили, что это произошло потому, что они не считали ЙДЗ очень важной, и после кампании произошло значительное снижение до 37% ( P = 0.03958). Перед кампанией небольшое меньшинство (три человека) даже считало, что йодированная соль вредна и вызывает рак, но после программы в СМИ не было сообщений о негативных последствиях.
Около половины (50,4%) женщин сообщили, что знают о кампании в СМИ, а 11,2% женщин конкретно указали на нее как на источник информации. Те, кто был осведомлен о кампании, значительно чаще использовали йодированную соль, как показано в Таблице III. Доля женщин, которые сказали, что узнали об использовании йодированной соли от своей матери, оставалась стабильной на протяжении всего исследования и составляла 22 года.4% до вмешательства и 22,8% после.
Доля женщин, которые сказали, что узнали об использовании йодированной соли от своей матери, оставалась стабильной на протяжении всего исследования и составляла 22 года.4% до вмешательства и 22,8% после.
Была сильная связь между общим уровнем образования женщин и осведомленностью о йодированной соли как до, так и после кампании, как показано в Таблице IV.
Сама кампания в средствах массовой информации, по-видимому, оказала большое влияние на уровень осведомленности женщин, получивших образование более 8 лет, увеличив долю осведомленных о йодированной соли с 75,3 до 94,5%. Напротив, это не улучшило осведомленность менее образованных женщин.Женщины с более высоким уровнем образования также чаще использовали свои знания и фактически использовали йодированную соль: ее использовали 89,1% тех, кто знал о йодированной соли, по сравнению с 82,3% женщин, получивших образование менее 8 лет, как показано в Таблице V. .
Обсуждение
Исследование продемонстрировало, что использование средств массовой информации может быть эффективным в борьбе с ЙДЗ за счет повышения осведомленности о йодированной поваренной соли и ее фактическом использовании. Другие исследования также продемонстрировали эффективность просвещения населения через средства массовой информации для этой цели (Pfaff et al., 1997; Агини-Ломбарди и Антонанджели, 1998; Consiglio, 1998; Москателли и Бейкер, 1998). Факторы, способствующие успеху, могли включать относительную простоту сообщения и тот факт, что не потребовалось никаких серьезных изменений в поведении, а просто замена соли йодированной солью. Дизайн программ (в частности, использование сеансов «по телефону») учитывал ограниченные возможности для обратной связи, обычно связанные с использованием средств массовой информации.
Другие исследования также продемонстрировали эффективность просвещения населения через средства массовой информации для этой цели (Pfaff et al., 1997; Агини-Ломбарди и Антонанджели, 1998; Consiglio, 1998; Москателли и Бейкер, 1998). Факторы, способствующие успеху, могли включать относительную простоту сообщения и тот факт, что не потребовалось никаких серьезных изменений в поведении, а просто замена соли йодированной солью. Дизайн программ (в частности, использование сеансов «по телефону») учитывал ограниченные возможности для обратной связи, обычно связанные с использованием средств массовой информации.
Высокая распространенность ЙДЗ в регионах Турции, серьезность проблемы и простое решение, обеспечиваемое йодированной солью, вместе создают настоятельную необходимость информировать людей, чтобы они могли «усилить контроль над своим здоровьем и улучшить его» (ВОЗ, 1986).Средства массовой информации являются важным каналом для достижения этой цели. Тонз и Тилфорд (Tones and Tilford, 1994) отмечают наблюдение де Токвилля (de Tocqueville, 1961) о том, что «. .. ничто, кроме газеты, не может вбросить одну и ту же мысль в тысячу умов в один и тот же момент». Развитие электронных средств массовой информации с тех пор открывает еще больший потенциал.
.. ничто, кроме газеты, не может вбросить одну и ту же мысль в тысячу умов в один и тот же момент». Развитие электронных средств массовой информации с тех пор открывает еще больший потенциал.
Однако результаты исследования показывают, что женщины с более высоким уровнем образования были лучше осведомлены о йодированной соли с самого начала и, кроме того, кампания была более эффективной для этой группы.Кампания в СМИ никак не повлияла на осведомленность женщин с образованием менее 8 лет. Чтобы справиться с этим неравенством, необходимы дальнейшие исследования, чтобы изучить препятствия на пути общения и определить стратегии достижения этой группы. Более 20% женщин сообщают, что узнали о йодированной поваренной соли от своих матерей. Такое общение в семьях — важный способ распространения информации. Коммуникационные сети внутри сообщества также могут служить аналогичной цели.Хотя может оказаться невозможным охватить все сообщество только средствами массовой информации, это исследование продемонстрировало, что с его помощью можно улучшить как знания, так и поведение. Таким образом, средства массовой информации могут способствовать накоплению критической массы населения, которое осведомлено о пользе йодированной соли и использует ее.
Таким образом, средства массовой информации могут способствовать накоплению критической массы населения, которое осведомлено о пользе йодированной соли и использует ее.
Возрастные группы и уровень образования женщин
| . | Первая фаза ( n = 672) . | Вторая фаза ( n = 768) . | ||||||
|---|---|---|---|---|---|---|---|---|
| a P = 0,53233; b P = 0,97974. | ||||||||
| Возрастные группы (лет) a | ||||||||
| ≤19 | 26 | 20 | ||||||
| 20–29 | 206 | 206 307–9029 | 174 | 219 | ||||
| 40–49 | 156 | 184 | ||||||
| 50–59 | 110 | 118 | ||||||
| 9065 ) b | ||||||||
| <8 | 417 | 475 | ||||||
| 8+ | 255 | 293 | ||||||
| Первая фаза ( n = 672) . | Вторая фаза ( n = 768) . | |||||||
|---|---|---|---|---|---|---|---|---|
| a P = 0,53233; b P = 0,97974. | ||||||||
| Возрастные группы (лет) a | ||||||||
| ≤19 | 26 | 20 | ||||||
| 20–29 | 206 | 206 307–9029 | 174 | 219 | ||||
| 40–49 | 156 | 184 | ||||||
| 50–59 | 110 | 118 | ||||||
| 9065 ) b | ||||||||
| <8 | 417 | 475 | ||||||
| 8+ | 255 | 293 | ||||||
Возрастные группы и уровень образования женщин
. | Первая фаза ( n = 672) . | Вторая фаза ( n = 768) . | ||||||
|---|---|---|---|---|---|---|---|---|
| a P = 0,53233; b P = 0,97974. | ||||||||
| Возрастные группы (лет) a | ||||||||
| ≤19 | 26 | 20 | ||||||
| 20–29 | 206 | 206 307–9029 | 174 | 219 | ||||
| 40–49 | 156 | 184 | ||||||
| 50–59 | 110 | 118 | ||||||
| 9065 ) b | ||||||||
| <8 | 417 | 475 | ||||||
| 8+ | 255 | 293 | ||||||
| Первая фаза ( n = 672) . | Вторая фаза ( n = 768)
. | |||||||
|---|---|---|---|---|---|---|---|---|
| a P = 0,53233; b P = 0,97974. | ||||||||
| Возрастные группы (лет) a | ||||||||
| ≤19 | 26 | 20 | ||||||
| 20–29 | 206 | 206 307–9029 | 174 | 219 | ||||
| 40–49 | 156 | 184 | ||||||
| 50–59 | 110 | 118 | ||||||
| 9065 ) b | ||||||||
| <8 | 417 | 475 | ||||||
| 8+ | 255 | 293 | ||||||
Знание и использование йодированной соли
| . | Предварительная кампания [% ( n = 672)] . | После кампании [% ( n = 768)]
. | п. . |
|---|---|---|---|
| Знать о соли | 67,1 | 72,9 | 0,01628 |
| Используйте йодированную соль | 54,5 | 62.4 | 0,00237 |
| . | Предварительная кампания [% ( n = 672)] . | После кампании [% ( n = 768)] . | п. . |
|---|---|---|---|
| Знать о соли | 67,1 | 72,9 | 0,01628 |
| Используйте йодированную соль | 54,5 | 62.4 | 0,00237 |
Знание и использование йодированной соли
| . | Предварительная кампания [% ( n = 672)] . | После кампании [% ( n = 768)]
. | п. . |
|---|---|---|---|
| Знать о соли | 67,1 | 72,9 | 0,01628 |
| Используйте йодированную соль | 54.5 | 62,4 | 0,00237 |
| . | Предварительная кампания [% ( n = 672)] . | После кампании [% ( n = 768)] . | п. . |
|---|---|---|---|
| Знать о соли | 67,1 | 72,9 | 0,01628 |
| Используйте йодированную соль | 54.5 | 62,4 | 0,00237 |
Использование йодированной соли в рамках информационной кампании в СМИ
| . | Йодированная соль использованная . | Йодированная соль не используется
.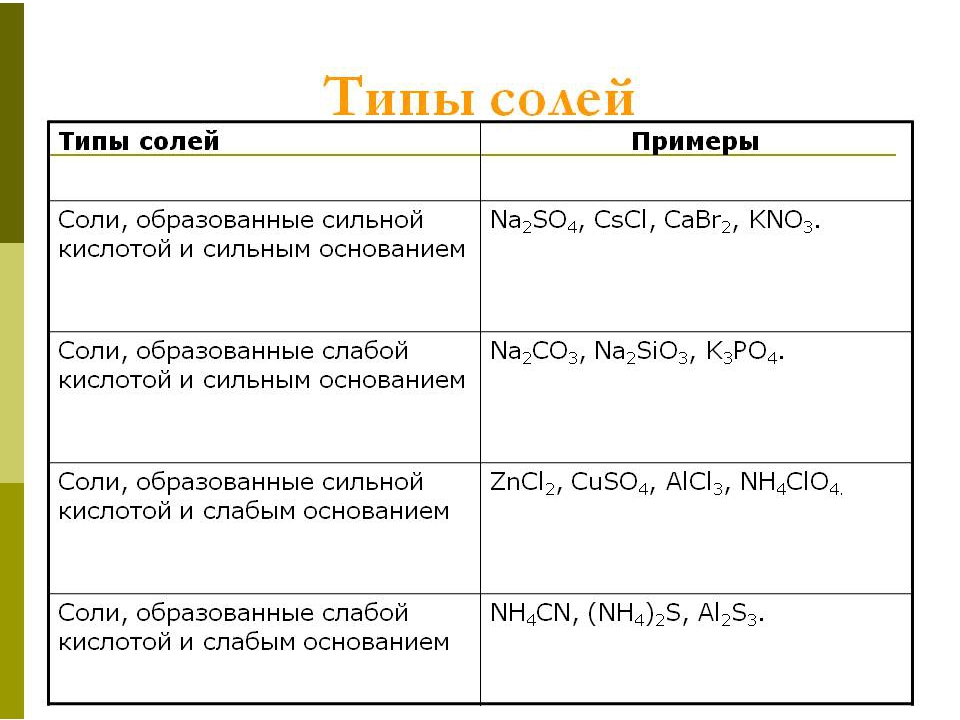 | Итого . |
|---|---|---|---|
| P = 0,01324. | |||
| Информация о кампании | 258 (66.6%) | 129 (33,4%) | 387 (100%) |
| Не знают о кампании | 221 (58,0%) | 160 (42,0%) | 381 (100%) |
| Итого | 479 (62,4%) | 289 (37,6%) | 768 (100%) |
| . | Йодированная соль использованная . | Йодированная соль не используется . | Итого . |
|---|---|---|---|
| P = 0,01324. | |||
| Знают о кампании | 258 (66,6%) | 129 (33,4%) | 387 (100%) |
| Не знают о кампании | 221 (58,0659) | %)381 (100%) | |
| Всего | 479 (62,4%) | 289 (37,6%) | 768 (100%) |

Использование йодированной соли в рамках информационной кампании в СМИ
| . | Йодированная соль использованная . | Йодированная соль не используется . | Итого . |
|---|---|---|---|
| P = 0,01324. | |||
| Знают о кампании | 258 (66,6%) | 129 (33,4%) | 387 (100%) |
| Не знают о кампании | 221 (58,0659) | %)381 (100%) | |
| Итого | 479 (62.4%) | 289 (37,6%) | 768 (100%) |
| . | Йодированная соль использованная . | Йодированная соль не используется . | Итого . |
|---|---|---|---|
| P = 0,01324. | |||
| Знают о кампании | 258 (66,6%) | 129 (33,4%) | 387 (100%) |
| Не знают о кампании | 221 (58. 0%) 0%) | 160 (42,0%) | 381 (100%) |
| Всего | 479 (62,4%) | 289 (37,6%) | 768 (100%) |
Продолжительность образования и осведомленность о йодированной поваренной соли
| Уровень образования . | Предварительная кампания a . | После кампании b . | ||
|---|---|---|---|---|
| . | Неизвестно о йодированной соли . | Известно о йодированной соли . | Неизвестно о йодированной соли . | Известно о йодированной соли . |
| a P = 0,000416; b P = 0,000000. | ||||
| <8 лет | 158 (37,89%) | 259 (62.11%) | 192 (40,42%) | 283 (59,58%) |
| 8+ лет | 63 (24,71%) | 192 (75,29%) | 16 (5,46%) | 266 (94,54 %) |
| Всего | 221 (32,89%) | 451 (67,11%) | 208 (27,08%) | 560 (72,92%) |
Уровень образования
. | Предварительная кампания a . | После кампании b . | ||
|---|---|---|---|---|
| . | Неизвестно о йодированной соли . | Известно о йодированной соли . | Неизвестно о йодированной соли . | Известно о йодированной соли . |
| a P = 0,000416; b P = 0,000000. | ||||
| <8 лет | 158 (37,89%) | 259 (62.11%) | 192 (40,42%) | 283 (59,58%) |
| 8+ лет | 63 (24,71%) | 192 (75,29%) | 16 (5,46%) | 266 (94,54 %) |
| Всего | 221 (32,89%) | 451 (67,11%) | 208 (27,08%) | 560 (72,92%) |
Продолжительность образования и осведомленность о йодированной поваренной соли
Уровень образования
. | Предварительная кампания a . | После кампании b . | ||
|---|---|---|---|---|
| . | Неизвестно о йодированной соли . | Известно о йодированной соли . | Неизвестно о йодированной соли . | Известно о йодированной соли . |
| a P = 0,000416; b P = 0.000000. | ||||
| <8 лет | 158 (37,89%) | 259 (62,11%) | 192 (40,42%) | 283 (59,58%) |
| 8+ лет | 24,71%)192 (75,29%) | 16 (5,46%) | 266 (94,54%) | |
| Всего | 221 (32,89%) | 451 (67,11%) | 208 (27,08%) | 560 (72,92%) |
Уровень образования
. | Предварительная кампания a . | После кампании b . | ||
|---|---|---|---|---|
| . | Неизвестно о йодированной соли . | Известно о йодированной соли . | Неизвестно о йодированной соли . | Известно о йодированной соли . |
| a P = 0,000416; b P = 0.000000. | ||||
| <8 лет | 158 (37,89%) | 259 (62,11%) | 192 (40,42%) | 283 (59,58%) |
| 8+ лет | 24,71%)192 (75,29%) | 16 (5,46%) | 266 (94,54%) | |
| Всего | 221 (32,89%) | 451 (67,11%) | 208 (27,08%) | 560 (72,92%) |
Осведомленность женщин об использовании йодированной поваренной соли
Уровень образования
. | Используйте йодированную соль . | Не используйте йодированную соль . |
|---|---|---|
| P = 0,02264. | ||
| <8 | 242 (82,31%) | 52 (17,69%) |
| 8+ | 237 (89,09%) | 29 (10,91%) |
| 81 (14,46%) | ||
| Уровень образования . | Используйте йодированную соль . | Не используйте йодированную соль . |
|---|---|---|
| P = 0,02264. | ||
| <8 | 242 (82,31%) | 52 (17,69%) |
| 8+ | 237 (89,09%) | 29 (10,91%) |
| 81 (14,46%) | ||
Осведомленность об использовании женщинами йодированной поваренной соли
Уровень образования
. | Используйте йодированную соль . | Не используйте йодированную соль . |
|---|---|---|
| P = 0,02264. | ||
| <8 | 242 (82,31%) | 52 (17,69%) |
| 8+ | 237 (89.09%) | 29 (10,91%) |
| Всего | 479 (85,54%) | 81 (14,46%) |
| Уровень образования . | Используйте йодированную соль . | Не используйте йодированную соль . |
|---|---|---|
| P = 0,02264. | ||
| <8 | 242 (82,31%) | 52 (17,69%) |
| 8+ | 237 (89.09%) | 29 (10,91%) |
| Всего | 479 (85,54%) | 81 (14,46%) |
Ссылки
Aghini-Lombardi, F. и Antonangeli, L. (
и Antonangeli, L. (
1998
) Законодательство Италии о профилактике йода.Annali dell’Istituto Superiore di Sanità
,34
,363
–366.Consiglio, E. (
1998
) Европейский проект структурных фондов: искоренение эндемического зоба и йододефицитных заболеваний в Южной Италии.Annali dell’Istituto Superiore di Sanità
,34
,371
–375.Элдер, Дж. П., Эдвардс, К. К., Конвей, Т. Л., Кенни, Э., Джонсон, К. А. и Бенетт, Э. Д. (
1996
) Независимая оценка Калифорнийской программы обучения табаку.Отчеты общественного здравоохранения
,111
,353
–358.Европейская тироидная ассоциация (
1985
) Зоб и дефицит йода в Европе.Ланцет
,и
,1289
–1293.Гланц, К., Ланкенау, Б., Форестер, С., Темпл, С., Маллис, Р. и Шмид, Т. (
1995
) Экологические и политические подходы к профилактике сердечно-сосудистых заболеваний с помощью питания: возможности для государства и местные действия.
Медицинское просвещение Ежеквартально
,22
,512
–527.Грин, Л. (1984) Модели санитарного просвещения. В Matarazzo, J., Weiss, S., Herd, J. and Miller, N. (eds), Behavioral Health . Wiley, New York, стр. 181–198.
Миллер П.и Hirshhorn, N. (
1995
) Влияние национальной программы борьбы с диарейными заболеваниями на смертность: пример Египта.Социальные науки и медицина
,40
,1
–30.Mocan, M. Z. and Tokel, S. (1984) Doğu Karadeniz bölgesinde görülen endemik guatrın bölge joekimyası ve diğer faktörlerle ilisıkisinin incelenmesi (на турецком языке). TÜBITAK Raporu TAG-489 .
Мокан, М. З., Мокан, Х. и Токел, С. (
1989
) Эпидемиологическое исследование эндемического зоба в Восточном Причерноморье в связи с геохимической средой.Doğa TU Journal of Medical Science
,13
,1
–5.Москателли Р. и Бейкер К. (
1998
) Региональная кампания по продвижению использования йодида натрия: «щепотка здоровья».
Annali dell’Istituto Superiore di Sanità
,34
,393
–394.Mudde, A. N. и de Vries, H. (
1999
) Масштабы и эффективность проводимой национальными СМИ кампании по отказу от курения в Нидерландах.Американский журнал общественного здравоохранения
,89
,346
–350Постоянный комитет Национального совета здравоохранения и медицинских исследований по укреплению здоровья и подкомитет санитарного просвещения по средствам массовой информации и укреплению здоровья (1984) СМИ и общественное здравоохранение (статья аннулирована Национальным советом по здравоохранению и медицинским исследованиям 29.02.2000).http://www.nhmrc.health.gov.au/publicat/archived/ph7.htm
Pfaff, G., Hesse, V., Oehler, K., Georg, T. and Boeing, H. (
1997
) Состояние пищевой йодной обеспеченности в районе Потсдама.Zeitschrift für Ernahrungswissenschaft
,36
,225
–228. Роджерс Э. М. и Шумейкер Ф. Ф. (1971) Коммуникация инноваций . Free Press, New York
(1971) Коммуникация инноваций . Free Press, New York
Ромер Д. и Ким С. (
1995
) Вмешательство в охрану здоровья афроамериканской и латиноамериканской молодежи: потенциальная роль средств массовой информации.Health Education Quarterly
,22
,172
–189Tones, K. (
1996
) Модели СМИ: подкожные, аэрозольные или провокаторские?Просвещение по вопросам наркотиков, профилактика и политика
,3
,29
–37Тонз, К. и Тилфорд, С. (1994) Эффективность и действенность санитарного просвещения . Chapman & Hall, Лондон
Воан, Дж. П. и Морроу, Р. Х. (1989) Руководство по эпидемиологии для районного управления здравоохранением .ВОЗ, Женева.
ВОЗ (1986) Оттавская хартия . ВОЗ, Женева.
© Издательство Оксфордского университета
Источники натрия: Откуда весь этот натрий?
В чем разница между натрием и солью?
Соль и натрий часто используются как синонимы, но это не совсем одно и то же. Натрий — это минерал, который естественным образом встречается в пищевых продуктах, добавляется в процессе производства или и того, и другого. Поваренная соль представляет собой комбинацию натрия и хлорида.По весу это примерно 40 процентов натрия и 60 процентов хлорида.
Натрий — это минерал, который естественным образом встречается в пищевых продуктах, добавляется в процессе производства или и того, и другого. Поваренная соль представляет собой комбинацию натрия и хлорида.По весу это примерно 40 процентов натрия и 60 процентов хлорида.
Вот приблизительное количество натрия в данном количестве поваренной соли:
- 1/4 чайной ложки соли = 575 мг натрия
- 1/2 чайной ложки соли = 1150 мг натрия
- 3/4 чайной ложки соли = 1,725 мг натрия
- 1 чайная ложка соли = 2300 мг натрия
Каковы общие источники натрия?
Натрий естественным образом содержится в некоторых пищевых продуктах и часто добавляется в процессе производства.Конечно, добавляем и во время готовки, и на стол тоже. Сельдерей, свекла и молоко — это лишь некоторые из продуктов, которые вы найдете в естественных условиях. Упакованные и готовые продукты, такие как консервированные супы, мясные обеды и замороженные обеды, часто добавляют натрий во время производства — либо в виде соли, либо в других распространенных формах натрия, таких как пищевая сода.
В целом, более 70 процентов натрия, который мы потребляем, поступает из обработанных, расфасованных и ресторанных продуктов. Гораздо сложнее ограничить натрий, если он уже добавлен до покупки.Употребление менее обработанных продуктов и приготовление большего количества блюд дома — отличные способы контролировать потребление натрия.
Остальная часть натрия в обычном рационе естественным образом содержится в пище (около 15 процентов) или добавляется, когда мы готовим и едим. Эти последние добавки составляют лишь около 11 процентов от общего потребления натрия, поэтому, даже если вы никогда не используете солонку, вы, вероятно, получаете слишком много натрия.
В нашей инфографике Salty Six показаны шесть основных источников натрия в США.С. диета.
Сюда входят:
- Хлеб и булочки
- Пицца
- Бутерброды
- Мясные и колбасные изделия
- Суп
- Буррито и тако
Довольно удивительный список. Некоторые из них даже не имеют соленого вкуса. Имейте в виду, что разные бренды и рестораны могут делать версии одних и тех же продуктов с разным уровнем натрия. Сравните этикетки и выберите продукт с наименьшим содержанием натрия, который вы можете найти в вашем магазине.
Другие малоизвестные тайники натрия — это лекарства, отпускаемые без рецепта и по рецепту. Ознакомьтесь с этикетками и списком ингредиентов лекарств, отпускаемых без рецепта. Что касается лекарств, отпускаемых по рецепту, вам нужно будет спросить у врача или фармацевта, подходит ли вам лекарство, поскольку вы не можете сказать об этом по бутылке.
Следите за своими ингредиентами.
Натрий бывает разных форм. Некоторые из наиболее очевидных способов найти его на этикетках с питанием — это «соль», «сода» и «натрий». А иногда это скрыто в нескольких словах, которые вы можете не узнать.
Вот несколько примеров ингредиентов, содержащих натрий:
- Динатрийгуанилат (GMP)
- Динатрия инозинат (IMP)
- Fleur de sel
- Гималайская розовая соль
- Кошерная соль
- Глутамат натрия (глутамат натрия)
- Соль каменная
- Соль
- Соль морская
- Бикарбонат натрия
- Нитрат натрия
- Цитрат натрия
- Натрия хлорид
- Натрия диацетат
- Натрия эриторбат
- Глутамат натрия
- Натрия лактат
- лаурилсульфат натрия
- натрия метабисульфит
- Натрия фосфат
- Тринатрийфосфат
Морская или кошерная соль полезнее поваренной соли?
Гурманы и повара могут предпочесть кошерные или морские соли из-за их вкуса, текстуры или цвета.Но поваренная соль, кошерная соль и большинство морских солей содержат около 40 процентов натрия по весу. Несмотря на то, что морская соль может содержать следовые количества минералов, таких как магний, калий и кальций, их количество невелико, и вы можете получить их из других здоровых продуктов.
Некоторые разновидности морской соли могут содержать меньше натрия, чем поваренная соль. Вы можете проверить этикетку «Пищевая ценность», чтобы сравнить данную морскую соль с поваренной солью, которая содержит около 575 мг натрия на ¼ чайной ложки.
Почему в пище так много натрия?
Натрий играет в вашей тарелке множество ролей.Добавление аромата, вероятно, является самой известной его функцией. Его также можно использовать в качестве консерванта для обеспечения безопасности пищевых продуктов, улучшения цвета или придания им более плотной текстуры. Например, натрий в виде пищевой соды (бикарбонат натрия) используется для повышения уровня хлеба и других хлебобулочных изделий.

 Морская соль ничем не лучше обычной соли.
Морская соль ничем не лучше обычной соли.




