Разница между гелием и водородом — Разница Между
Водород и гелий — первые два элемента, которые находятся в периодической таблице элементов. Следовательно, они самые маленькие и самые легкие атомы на земле. Оба они являются газообразными веществами
Основное отличие — гелий от водорода
Водород и гелий — первые два элемента, которые находятся в периодической таблице элементов. Следовательно, они самые маленькие и самые легкие атомы на земле. Оба они являются газообразными веществами. Из-за характерных особенностей водорода и гелия, эти газы широко применяются в промышленности. Из-за очень легкого веса этих газов они используются для заполнения воздушных шаров. Основное различие между гелием и водородом состоит в том, что Атом гелия существует как одноатомный газ в атмосфере, тогда как водород существует в атмосфере как двухатомный газ.
Ключевые области покрыты
1. Что такое гелий
— Свойства, изотопы, реакции и приложения
2. Что такое водород
Что такое водород
— Свойства, изотопы, реакции и приложения
3. Каковы сходства между гелием и водородом
— Краткое описание общих черт
4. В чем разница между гелием и водородом
— Сравнение основных различий
Ключевые термины: атомная масса, атомный номер, дейтерий, гелий, водород, изотопы гелия, протий, тритий
Что такое гелий
Гелий — это элемент с атомным номером 2 и газообразное вещество. Химический символ гелия — Он. Электронная конфигурация гелия 1с2, Атомный символ гелия 
Рисунок 1: Химическая структура атома гелия
Температура плавления гелия составляет около -272,2оС, что является очень низким значением. Точка кипения гелия дана как -268оC. Это делает его газом для более широкого диапазона температур. В периодической таблице элементов гелий классифицируется как блочный элемент s, но размещается в правом боковом углу таблицы. Это потому, что гелий является инертным газом, который не будет подвергаться химическим реакциям. Это также неметаллический.
Поскольку гелий является благородным газом, он показывает только нулевую степень окисления. Существует два известных изотопа гелия. Они есть 3Он изотоп и 4Он изотоп. 4Он является наиболее распространенной формой среди них, и его численность составляет 99%. Оба эти изотопа стабильны, и радиоактивного распада не наблюдается. Однако есть и другие изотопы. Они нестабильны и радиоактивны.
Гелий широко используется в воздушных шарах. Кроме того, гелий используется для обеспечения контролируемой атмосферы для многих реакций синтеза (таких как синтез кристаллов кремния) благодаря его высокой инертности. Он также используется в качестве инертного экрана для дуговой сварки. Гелий можно преобразовать в жидкую форму, которая известна как жидкий гелий и используется в качестве важного криогенного материала.
Кроме того, гелий используется для обеспечения контролируемой атмосферы для многих реакций синтеза (таких как синтез кристаллов кремния) благодаря его высокой инертности. Он также используется в качестве инертного экрана для дуговой сварки. Гелий можно преобразовать в жидкую форму, которая известна как жидкий гелий и используется в качестве важного криогенного материала.
Что такое водород
Водород — это химический элемент, имеющий атомный номер 1 и обозначаемый символом H. Атом водорода состоит из одного протона и в ядре нет нейтронов; он имеет один электрон на своей 1-й орбите. Электронная конфигурация водорода дана как 1с1, Водород является блочным элементом в периодической таблице. Атомный вес водорода составляет 1,00794 а.е.м.
При комнатной температуре и давлении водород существует в виде двухатомной газообразной молекулы. Это бесцветный газ без запаха. Температура плавления водорода составляет около -259оC. Температура кипения составляет около -252оC. Водород имеет три степени окисления. Это -1, 0 и +1. Когда водород присоединен к атому металла, он имеет степень окисления -1.
Водород имеет три степени окисления. Это -1, 0 и +1. Когда водород присоединен к атому металла, он имеет степень окисления -1.
Существует три основных изотопа водорода: протий, дейтерий и тритий. Protium является наиболее распространенным изотопом и имеет содержание 99%. Поэтому, когда мы вообще говорим о водороде, мы говорим о Protium. дейтерий также является стабильным изотопом, но менее распространен. В его ядре есть нейтрон, а у Протия — нет. тритий радиоактивный изотоп Кроме того, есть много других изотопов, которые не являются стабильными и высоко радиоактивными.
Рисунок 2: Основные изотопы водорода
Есть много применений газообразного водорода. Большое количество водорода используется при переработке ископаемого топлива. Газообразный водород также используется при производстве аммиака. Кроме того, водород используется в качестве теплоносителя на электростанциях.
Сходство между гелием и водородом
- Гелий и водород являются газообразными веществами при стандартных условиях температуры и давления.

- Оба имеют только 1с орбитали.
- Оба являются маленькими и легкими веществами.
- Оба элемента принадлежат блоку s периодической таблицы.
- Оба являются неметаллами.
Разница между гелием и водородом
Определение
Гелий: Гелий является элементом с атомным номером 2 и представлен символом He.
Водород: Водород представляет собой химический элемент, имеющий атомный номер 1 и обозначенный символом H.
Атомный номер
Гелий: Атомный номер гелия равен 2.
Водород: Атомный номер водорода равен 1.
Атомный вес
Гелий: Атомный вес гелия составляет 4,002602 а.е.м.
Водород: Атомный вес водорода составляет 1,00794 а.е.м.
соединений
Гелий: Гелий существует как одноатомное газообразное вещество.
Водород: Водород существует в виде двухатомной газообразной молекулы.
Окислительные состояния
Гелий: Гелий имеет только 0 степень окисления.
Водород: Водород имеет степени окисления -1, 0 и +1.
Изотопы
Гелий: Гелий имеет два основных изотопа, как 3Он и 4Он.
Водород: Водород имеет три основных изотопа; Протий, дейтерий и тритий.
Температура плавления
Гелий: Температура плавления гелия составляет -272,2оC.
Водород: Температура плавления водорода составляет -259оC.
Заключение
Гелий и водород являются химическими элементами, которые в основном находятся в атмосфере в виде газообразных веществ из-за их очень низких температур плавления и кипения. Основное различие между гелием и водородом состоит в том, что атом гелия существует как одноатомный газ в атмосфере, тогда как водород существует в атмосфере как двухатомный газ.
Рекомендации:
1.
Влияние смеси газов на окислительно-восстановительные процессы при сварке
Влияние смеси газов на окислительно-восстановительные процессы при сварке
В качестве защитных газов при сварке сталей используют углекислый газ, аргон, гелий, азот и их смеси. Преимущественное применение в промышленности получила дуговая сварка в активных или окислительных защитных газах С02 (Аг+С02), (Аг+02), (С02 + 02), и другие.
Сварка в указанных газах сопровождается заметными потерями ряда легирующих элементов, обладающих высоким сродством к кислороду, при переплавлении металла дугой.
При сварке в инертных газах, если обеспечена полная изоляция расплавленного металла от воздуха, химические реакции между металлом и окружающей средой сводятся к минимуму. Потенциальная возможность протекания реакций в этом случае определяется степенью чистоты газа.
Однако при сварке сталей с целью улучшения формирования шва, уменьшения разбрызгивания, применяют смеси аргона с (3 — 5) %02 и С02. В этом случае возможность окисления металла в сварочной ванне возрастает. Например, коэффициент перехода марганца из проволоки Св-18ХГСА при увеличении содержания кислорода в аргоне с 5 % до 20 % уменьшается с 0,85до0,65.
Зависимость степени окисления легирующих элементов при сварке в смеси (Аг + С02) от режима сварки объясняется влиянием последнего на условие взаимодействия металла с газовой фазой. С удлинением дуги, например, увеличивается окисление металла на стадии капли, ухудшаются условия защиты зоны плавления от воздуха. Увеличение силы тока способствует уменьшению окисления металла.
При сварке в углекислом газе металл соприкасается со смесью газов СО, С02,02, С, образующейся при диссоциации С02 в дуге. Эта смесь является довольно активным окислителем по отношению к наплавленному металлу в зоне плавления.
Новожилов Н.М. предложил следующую схему окислительно-восстановительных процессов при дуговой сварке в активных защитных газах.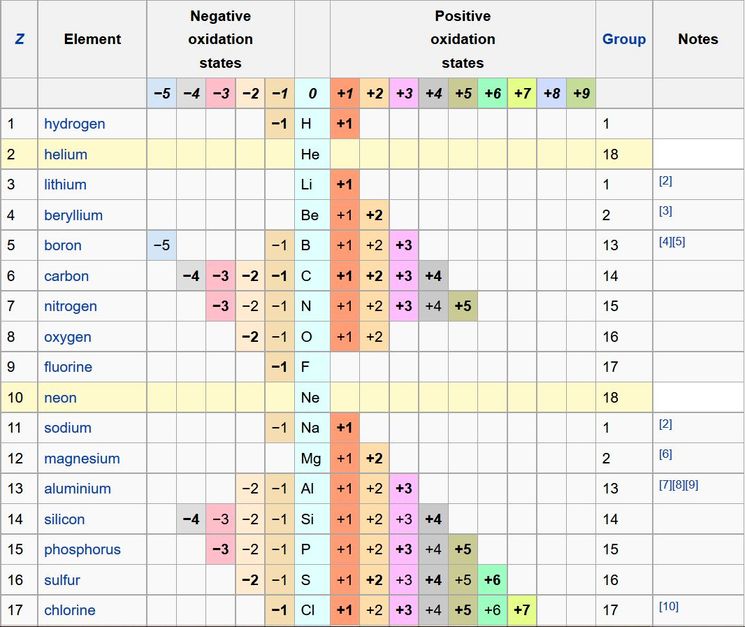
В сварочной ванне одновременно протекают два противоположных процесса: окисление жидкого металла и его паров защитным газом; «осаждающее» раскисление металла сварочной ванны электродным или основным металлом. При этом продукты окисления металла определяют состав выделяющегося на его поверхности шлака, а продукты, раскисления оказывают решающее влияние на состав оксидных включений в металле шва. Т.е. при плавлении металл не только теряет активные элементы-раскислители вследствие окислительной газовой среды, но и одновременно насыщается кислородом. Объясняется это тем, что с повышением температуры уменьшается сродство к кислороду элементов-раскислителей. В результате в высокотемпературной области сварочной ванны кислород может существовать в значительных концентрациях даже с такими активными элементами, как С, Mn, Si, Ti и А1.
С понижением температуры из-за сдвига равновесия в сторону меньших значений сосуществующих концентраций кислорода и элемента-раскислителя происходит их взаимодействие.
Для элементов, образующих нерастворимые в металле оксиды в виде конденсированной фазы, реакции такого вида являются «осадительными», а продуктами их — дисперсные оксидные включения в металле.
Основываясь на работах К.В. Любавского, В.В. Подгаецкого, Н.Н. Потапова можно сделать следующие выводы по влиянию оксидных включений при сварке низкоуглеродистых сталей на свойства металла шва:
- относительно крупные оксидные включения размером более 5 мкм не влияют на свойства металла шва;
- неметаллические оксидные включения размером менее 5 мкм не влияют на пределы прочности и пластичности при статических испытаниях, а также предел выносливости металла швов;
- увеличение количества мелких неметаллических включений размером менее 5 мкм сопровождается значительным понижением ударной вязкости, повышению склонности сварных швов к горячим трещинам, повышением склонности металла к хрупкому разрушению, т.к. такие включения служат барьерами для перемещения дислокаций и могут вызвать зарождение трещин.

Особенно четко влияние оксидных включений проявляется при испытаниях металла швов на низколегированных сталях при отрицательных температурах. Например, металл швов, выполненных на сталях 15Х2НМФА при понижении температуры от 273° до 253 °К при содержании кислорода /О/в 0,03 % снижает ударную вязкость с KCV = 17,8 х 100 до kcv= 14,2 X 100 кДж/м Увеличение содержания кислорода до /О/ — 0,08 % уменьшает ударную вязкость при 253 °К дб KCV= 13 х 100 кДж/м2.
Таким образом, можно заключить, что содержание кислорода в металле швов низколегированных сталях следует ограничивать до /0/= 0,04 %. Такое ограничение по содержанию кислорода гарантируется при сварке в смеси аргона с 20 % углекислого газа.
Источник: http://svarschik . by
Гелия гидрид — Справочник химика 21
Методом угольных реплик на электронном микроскопе было установлено глобулярное строение органополисилоксановых адсорбентов. Порами в таких адсорбентах являются зазоры между глобулами. Этот факт доказал дисперсное строение и наличие развитой пористой структуры в синтезированных полимерных адсорбентах. На основании выявленных закономерностей при исследовании генезиса образования органополисилоксановых гелей нами были разработаны способы синтеза пористых конденсированных структур гелей гидрид-, метил-и этилполисилоксанов [1—3]. Путем гелеобразования, промывки и сушки были получены твердые пористые кремнийорганические полимеры с весьма развитой удельной поверхностью до 500 м /г. Эти адсорбенты гидрофобны, не набухают и не растворяются в органических растворителях.
Этот факт доказал дисперсное строение и наличие развитой пористой структуры в синтезированных полимерных адсорбентах. На основании выявленных закономерностей при исследовании генезиса образования органополисилоксановых гелей нами были разработаны способы синтеза пористых конденсированных структур гелей гидрид-, метил-и этилполисилоксанов [1—3]. Путем гелеобразования, промывки и сушки были получены твердые пористые кремнийорганические полимеры с весьма развитой удельной поверхностью до 500 м /г. Эти адсорбенты гидрофобны, не набухают и не растворяются в органических растворителях. Присоединение электрона приводит к образованию гидрид-иона Н , электронная конфигурация которого соответствует оболочке гелия. Гидрид-ион существует только в кристаллических гидридах самых электроположительных металлов (КаН, СаН ). [c.159]
Атомно-абсорбционный спектрофотометр подготавливают к работе в соответствии с прилагаемой к нему инструкцией. Спектральную ширину щелей устанавливают равной 1,0 нм. На выходную щель выводят излучение резонансной линии мышьяка 193,7 нм. Температуру кварцевой кюветы-атомизатора устанавливают равной 1000—]100°С. Через устройство для выделения и атомизации гидридов пропускают аргон или гелий с расходом 500 мл/мин. [c.175]
Спектральную ширину щелей устанавливают равной 1,0 нм. На выходную щель выводят излучение резонансной линии мышьяка 193,7 нм. Температуру кварцевой кюветы-атомизатора устанавливают равной 1000—]100°С. Через устройство для выделения и атомизации гидридов пропускают аргон или гелий с расходом 500 мл/мин. [c.175]
Присоединение электрона приводит к образованию гидрид-иона Н , электронная конфигурация которого s соответствует оболочке гелия. Гидрид- [c.177]
На воздухе натрий и калий быстро окисляются, поэтому их хранят под слоем керосина. Они легко взаимодействуют со многими неметаллами — галогенами, серой, фосфором и др. Бурно реагируют с водой. С водородо.м при нагревании образуют гидриды металлов (NaH, КН). Если гидрид металла расплавить и подвергнуть электролизу, то водород будет выделяться на аноде, металл—на катоде. Отрицательно заряженный ион водорода Н имеет завершенный уровень, как у атома гелия. Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода [c.
В этих реакциях водород является типичным окислителем. Присоединяя электрон, атом водорода превращается в гидрид-нон, электронная оболочка которого имеет конфигурацию (как у гелия) [c.160]
При высокой температуре водород соединяется со щелочными и щелочноземельными металлами, образуя белые кристаллические вещества — гидриды металлов (LiH, NaH, КН, СаНз и др.
 ). В этих соединениях металл имеет положительную степень окисления, водород — отрицательную. Если гидрид металла расплавить и подвергнуть электролизу, то водород будет выделяться на аноде, металл на катоде. Отрицательно заряженный ион водорода Н» имеет завершенный уровень, аналогичный атому гелия. [c.205]
). В этих соединениях металл имеет положительную степень окисления, водород — отрицательную. Если гидрид металла расплавить и подвергнуть электролизу, то водород будет выделяться на аноде, металл на катоде. Отрицательно заряженный ион водорода Н» имеет завершенный уровень, аналогичный атому гелия. [c.205] Так, атом водорода, обладающий одним электроном, может приобрести структуру гелия, присоединив еще один электрон и образовав гид-рид-анион Н такой анион содержится в соли — гидриде лития Ы+Н». Но атом водорода может достигнуть структуры гелия и в том случае, если будет обладать своим электроном и электроном другого атома водорода, т. е. в случае образования связи за счет поделенной пары электронов. Каждый атом при этом отдает по электрону для образования пары электронов. Такую поделенную пару электронов можно сначала отнести к одному атому водорода, затем к другому легко заметить, что при таком рассмотрении каждый атом в молекуле водорода будет иметь структуру гелия [c. 129]
129]
При обработке водой смеси гидрида и фосфида щелочного металла с равными массовыми долями образовалась газовая смесь с плотностью по гелию 2,2. Установите, какой металл входил в состав соединений. [c.218]
В токе водорода, как и в токе гелия, превращения циклогексена начинаются при 80° С. Согласно литературным данным [7], эта температура соответствует началу выделения водорода из гидрида хрома. При этом происходит интенсивное гидрирование циклогексена до циклогек-сана. Стабильность работы катализатора невысока и зависит от содержания водорода в исходном образце, причем она выше при проведении [c.159]
При температурах выше 80° С гидрид хрома является активным катализатором гидрирования бензола до циклогексана как в токе водорода, так и в токе гелия. Во всех случаях гидрирование сопровождалось незначительным крекингом и образцы катализатора покрывались продуктами уплотнения в большей степени, чем при дегидрировании циклогексена. Анализ на содержание углерода в отработанном катализаторе показал наличие продуктов уплотнения на поверхности катализатора (рис. 5). [c.160]
Анализ на содержание углерода в отработанном катализаторе показал наличие продуктов уплотнения на поверхности катализатора (рис. 5). [c.160]
Реакция изомеризации и гидрирования гексена-1 была изучена в температурном интервале 50—400° С. При исследовании каталитической активности гидрида кальция было установлено, что в интервале 250—400° С при проведении опытов как в токе гелия, так и в токе водорода гидрид кальция практически нацело изомеризует гексен-1 с образованием изомерных гексенов-2 и -3, причем в преобладающем количестве образуется т ранс-гексен-2. [c.161]
Исследованиями каталитической активности гидрида бария было установлено, что без предварительной термической активации гидрид, бария катализирует реакцию изомеризации гексена-1, начиная с температуры 80° С, т. е. при более низкой температуре, чем гидрид кальция. После предварительной активации каталитические превращения гексена-1 наблюдаются и при более низких температурах. При проведении опытов как в токе водорода, так и в токе гелия, при температурах ниже температуры кипения исходного вещества в катализате начинает преобладать (как и в случае гидрида кальция) г ис-гексен-2, а при 60° С наблюдается минимум активности. [c.162]
При проведении опытов как в токе водорода, так и в токе гелия, при температурах ниже температуры кипения исходного вещества в катализате начинает преобладать (как и в случае гидрида кальция) г ис-гексен-2, а при 60° С наблюдается минимум активности. [c.162]
Реакция дегидрирования циклогексена на гидридах с большим содержанием водорода проходит в большей степени при проведении опытов в токе водорода, чем в токе гелия. Это с точки зрения предположенного механизма можно объяснить следующим. В атмосфере инертного газа атомарный водород, выделяющийся из гидрида, может либо непосредственно участвовать в катализируемой реакции, либо рекомбинироваться с образованием молекулы водорода. Последнее является нежелательным для протекания реакции дегидрирования, так как приводит к обрыву цепи, в то время как в атмосфере водорода, кроме рекомбинации, атомарный водород, выделяющийся из гидрида, при столкновении с молекулярным водородом может инициировать диссоциацию молекулы водорода [c. 165]
165]
По мере уменьшения содержания водорода в гидридах кальция и бария не только уменьшается их способность в исследуемом интервале, температур разлагаться с выделением атомарного водорода, но и во все большей степени возрастает их способность поглощать водород с образованием гидрида с более высоким содержанием водорода. При проведении опытов в токе гелия единственным источником водорода может быть сам реагирующий циклоолефин, который при этом будет претерпевать дегидрогенизацию с образованием бензола. Способность металлического бария отщеплять водород от олефинов, подтверждается тем, что при проведении реакции изомеризации гексена-1 в продуктах реакции были обнаружены изомерные гексадиены. При проведении же опытов в токе водорода последний конкурентно реагирует с металлом, насыщая его водородом, что должно приводить к снижению выхода бензола. [c.165]
В настоящее время получила применение в промышленных масштабах плавка и разливка специальных сплавов и сталей в вакууме, а также в среде таких нейтральных газов, как аргон, гелий.
 При плавке и разливке в вакууме при давлении 10 —10 мм рт. ст. получается высокая степень очистки жидкого металла от газов, которые находятся как в виде отдельных включений (пузырей), так и в растворенном состоянии, или в свободном виде или в виде химических соединений (окислы, нитриды, гидриды и т. д.). [c.229]
При плавке и разливке в вакууме при давлении 10 —10 мм рт. ст. получается высокая степень очистки жидкого металла от газов, которые находятся как в виде отдельных включений (пузырей), так и в растворенном состоянии, или в свободном виде или в виде химических соединений (окислы, нитриды, гидриды и т. д.). [c.229]В гидридах бора, так же как гидридах гелия и элементов IV—VII групп, химическая связь ковалентная или полярная. Все многообразие углеводородов — лишь частный случай летучих гидридов. [c.52]
Так, атом водорода, обладающий одним электроном, может приобрести структуру гелия, присоединив один электрон и образовав гидридный анион Н такой анион присутствует в гидриде лития Ь1″ Н и других гидридах металлов [ Ча» Н , Са (Н )г и т. д.]. Атом водорода также может достигнуть структуры гелия, если поделит электронную пару с другим водородным атомом, при этом каждый из двух атомов отдает один из электронов и общая для них пара электронов будет считаться принадлежащей сначала первому атому, а затем второму [c. 176]
176]
Правило о преимущественном 7п./ акс-элиминировании диаксиальных заместителей нашло свое отражение в своеобразной, быстрой перегруппировке г ис-вицинально замещенных циклогексанов в гел -замещенные углеводороды. (Элиминируемые группы в данном случае аксиальный атом водорода — гидрид-ион и мигрирующий метильный заместитель.) В реакциях сушения цикла первым этапом является элиминирование экваториального атома водорода. В реакциях, протекающих без изменения размеров цикла, элиминируется (также в виде гидрид-иона) аксиально ориентированный водород. В реакциях расширения цикла большое значение имеет конформация заместителя в исходной молекуле. Именно эта конформация определяет структурные и стереохимические особенности протекания реакции расширения циклов и. связь между пространственным расположением замещающих групп в исходных и образующихся при изомеризации углеводородах. Для углеводородов со средними размерами циклов характерной реакцией является одностадийное сжатие цикла с образованием изомерных углеводородов ряда циклогексана, имеющих ту же степень замещения, что и исходные углеводороды. [c.246]
[c.246]
Аликвотную часть раствора анализируемой пробы помещают в ячейку 7 вместимостью 50—75 см при снятой крышке 9 и вводят необходимые добавки реагентов, чтобы создать предварительные условия для образования гидридов. Закрывают крышку и включают магнитную мешалку 6. В емкость 3 с помощью дозатора в виде шприца / и гибкого шланга 2 набирают раствор 1 аВН4. Емкость на шлифе 4 присоединяют к реакционной ячейке, и все устройство в сборе продувают инертным газом (аргоном или гелием), после чего Б ячейку по трубкам 5 вводят дозированное количество МаВН . [c.173]
Если расс ютр 1ъ полярность связи водородэле-, иент в пределах периода, то легко можно связать полярность этой связи с положением элемента в периодической системе. От атомов металлов, легко теряющих валентные электроны, атомы водорода принимают эти электроны, образуя устойчивую двухэлектронную оболочку типа оболочки атома гелия, и дают ионно построенные гидриды металлов. [c. 233]
233]
Химическая роль водорода весьма многообразна, п его 1фо 1з-водные — гидриды — известны для многих элементов. Атом водорода может либо отдавать свой единственный электрон с образованием положительного нона (представляющего собой голый протон), либо присоединять один электрон, переходя в отрицательный ион, имеющий электронную конфигурацию гелия (рис. IV- ). Одиако первое в чистом виде не осунгествляется, так II взаимодействии водорода с металло- [c.96]
Металлический плутоний с помощью проволочной щеткн нли напильника в атмосфере инертного газа (сухая камера, заполненная гелием или аргоном) тщательно очищают от оксидной пленки и режут на маленькие кусочки. Pu гидрируют очень чистым Нг прн 150—200 °С. Избыток водорода откачивают во время охлаждения продукта. Образовавшийся РаНг. нагревают в атмосфере очень чистого азота до 1000 °С, повышая температуру со скоростью 150 град/ч. Время от времени систему вакуумируют н впускают свежую порцию азота, что, с одной стороны, способствует полному превращению гидрида в нитрид, а с другой стороны, предупреждает спекание исходного вещества. Полученный порошок PuN прессуют при комнатной температуре под давлением 5,5—6,9 кбар. Приготовленные таблетки обладают плотностью, составляющей 70—75% теоретической. [c.1402]
Полученный порошок PuN прессуют при комнатной температуре под давлением 5,5—6,9 кбар. Приготовленные таблетки обладают плотностью, составляющей 70—75% теоретической. [c.1402]
В ионных гидридах связь между атомом металла и водородом ионная, причем водород образует здесь отрицательный ион H , принимая на ls-орбиталь дополнительный электрон, в результате чего он приобретает конфигурацию электронов инертного газа гелия. В этом отношении поведение атома водорода в гидридах щелочных и щелочноземельных металлов похоже на поведение атомов галогенов в галогенидах с теми же металлами. По физическим свойствам и по строению кристаллических решеток ионные гидриды также схожи с соответствующими галогенидами. Например, гидриды щелочных металлов кристаллизуются по типу каменной соли (Na l),, образуя типично ионную решетку, в которой каждый ион щелочного металла окружен шестью ионами водорода, а каждый ион водорода — шестью ионами щелочного металла. Как и вообще вещества с ионными решетками, ионные гидриды имеют сравнительно высокие температуры плавления. [c.178]
[c.178]
Каталитическую активность полученных образцов гидридов определяли в импульсном нехроматографическом режиме и в проточной установке в интервале температур 50—450° С. Опыты проводили как в токе водорода, так и в токе гелия скорость газа-носителя составляла 30 мл/мин. Навеска катализатора 2,0 г, объем 0,7 см , размер частиц 0,2—0,3 мм. Пробу реагирующего вещества объемом 4-10-з мл вводили микрошприцем. Объемная скорость реагентов в проточной установке 150 ч К В работе использовались хроматографически чистые углеводороды. Активность катализатора оценивали по степени превращения углеводорода при данной температуре, за степень превращения было принято содержание каждого из продуктов в катализате по весу. Удельная поверхность катализатора, определенная по адсорбции аргона, составляла 1 м 1г и в ходе катализа существенно не изменялась. [c.158]
Смеси гидридов бора, состояш ие из диборана, тетраборана и пен-таборана, были полностью разделены при помош,и газо-жидкостной хроматографии. При этом не наблюдалось никакого разложения. Авторы показали, что газообразные гидриды бора могут быть отделены также от небольших примесей углеводородных газов (дибо-ран от этана и этилового эфира значения времени удерживания первого, второго и третьего соответственно равны 2,8, 3,5 и 15 мин). Разделение гидридов бора было проведено авторами на колонке с использованием в качестве неподвижной фазы жидкого парафина на целите при температуре опыта 27° С. Отделение от углеводородных примесей проводилось при 60° С. В качестве газа-носителя использовался гелий с расходом 111 мл1мин. [c.209]
При этом не наблюдалось никакого разложения. Авторы показали, что газообразные гидриды бора могут быть отделены также от небольших примесей углеводородных газов (дибо-ран от этана и этилового эфира значения времени удерживания первого, второго и третьего соответственно равны 2,8, 3,5 и 15 мин). Разделение гидридов бора было проведено авторами на колонке с использованием в качестве неподвижной фазы жидкого парафина на целите при температуре опыта 27° С. Отделение от углеводородных примесей проводилось при 60° С. В качестве газа-носителя использовался гелий с расходом 111 мл1мин. [c.209]
Гидриды алкилолова медленно реагируют с водой, давая белые гели [211]. [c.126]
Способ извлечения гелия и устройство для его осуществления
Предшествующий уровень техники
Для извлечения гелия из газовых потоков применяют различные способы. Одним из наиболее распространенных способов является процесс криогенной дистилляции. Криогенная дистилляция обеспечивает высокую степень извлечения гелия. Для выделения гелия также используется мембранное разделение. Применяются также и процессы адсорбции при переменном давлении (PSA).
Криогенная дистилляция обеспечивает высокую степень извлечения гелия. Для выделения гелия также используется мембранное разделение. Применяются также и процессы адсорбции при переменном давлении (PSA).
Глубина извлечения гелия из технологического потока с использованием процессов PSA, как правило, ограничивается примерно 75-80%, а это означает, что около 20-25% гелия теряется. Указанную степень извлечения можно незначительно повышать посредством рециркуляции некоторого количества хвостового газа PSA. Однако повышение степени извлечения ограничено вследствие того, что рециркуляция большего количества хвостового газа, который имеет низкое содержание гелия, обусловливает понижение концентрации гелия в исходном газе PSA, приводя в результате к более низкой степени извлечения в самой системе PSA.
Существует потребность в усовершенствованных способах, которые обеспечивают высокую степень извлечения гелия из технологических потоков, содержащих водород.
Сущность изобретения
Одним из объектов настоящего изобретения является способ повышения степени извлечения гелия из потока, содержащего гелий. В одном из вариантов осуществления изобретения способ включает введение потока, содержащего гелий, и по меньшей мере один способный окисляться компонент, в зону окисления в присутствии кислорода для окисления по меньшей мере одного окисляющегося компонента с образованием первого потока паров и первого потока жидкости. По меньшей мере, часть первого потока паров вводят в зону адсорбции при переменном давлении для образования потока очищенного гелия и потока хвостового газа, при этом поток хвостового газа содержит гелий. По меньшей мере, часть потока хвостового газа подвергают сжатию. По меньшей мере, часть сжатого потока хвостового газа вводят в зону мембранного разделения для образования обогащенного гелием потока пермеата и потока ретентата. По меньшей мере, часть обогащенного гелием потока пермеата подвергают сжатию. Сжатый обогащенный гелием поток пермеата вводят в систему для окисления. Часть потока хвостового газа может быть удалена, например, перед сжатием по меньшей мере части потока хвостового газа или после сжатия по меньшей мере части потока хвостового газа.
В одном из вариантов осуществления изобретения способ включает введение потока, содержащего гелий, и по меньшей мере один способный окисляться компонент, в зону окисления в присутствии кислорода для окисления по меньшей мере одного окисляющегося компонента с образованием первого потока паров и первого потока жидкости. По меньшей мере, часть первого потока паров вводят в зону адсорбции при переменном давлении для образования потока очищенного гелия и потока хвостового газа, при этом поток хвостового газа содержит гелий. По меньшей мере, часть потока хвостового газа подвергают сжатию. По меньшей мере, часть сжатого потока хвостового газа вводят в зону мембранного разделения для образования обогащенного гелием потока пермеата и потока ретентата. По меньшей мере, часть обогащенного гелием потока пермеата подвергают сжатию. Сжатый обогащенный гелием поток пермеата вводят в систему для окисления. Часть потока хвостового газа может быть удалена, например, перед сжатием по меньшей мере части потока хвостового газа или после сжатия по меньшей мере части потока хвостового газа. Кроме того, часть потока хвостового газа удаляют после сжатия по меньшей мере части обогащенного гелием потока пермеата. Способ дополнительно может включать удаление части обогащенного гелием газового потока пермеата. Указанную часть обогащенного гелием газового потока пермеата предпочтительно удаляют перед сжатием по меньшей мере части обогащенного гелием газового потока пермеата или после сжатия по меньшей мере части обогащенного гелием потока пермеата. Поток пермеата имеет содержание гелия по меньшей мере 70%.
Кроме того, часть потока хвостового газа удаляют после сжатия по меньшей мере части обогащенного гелием потока пермеата. Способ дополнительно может включать удаление части обогащенного гелием газового потока пермеата. Указанную часть обогащенного гелием газового потока пермеата предпочтительно удаляют перед сжатием по меньшей мере части обогащенного гелием газового потока пермеата или после сжатия по меньшей мере части обогащенного гелием потока пермеата. Поток пермеата имеет содержание гелия по меньшей мере 70%.
Способ также может предусматривать дополнительное удаление части потока хвостового газа, который удаляют перед сжатием по меньшей мере части потока хвостового газа. Предпочтительно способ включает удаление части обогащенного гелием газового потока пермеата, который удаляют перед сжатием по меньшей мере части обогащенного гелием газового потока пермеата.
Другой объект данного изобретения представляет собой устройство для извлечения гелия из потока, содержащего гелий. Устройство включает в себя зону окисления, имеющую входной канал для сырья, входной канал для кислорода, выпускной канал для жидкости и выпускной канал для газа; конденсатор, имеющий входной канал и выпускной канал, причем входной канал конденсатора сообщается по текучей среде с выпускным каналом для газа зоны окисления; сепаратор, имеющий входной канал, выпускной канал для жидкости и выпускной канал для газа, при этом входной канал сепаратора сообщается по текучей среде с выпускным каналом конденсатора; зону адсорбции при переменном давлении, имеющую входной канал, выпускной канал для очищенного гелия и выпускной канал для хвостового газа, при этом входной канал зоны адсорбции при переменном давлении сообщается по текучей среде с выпускным каналом сепаратора; первый компрессор, имеющий входной канал и выпускной канал, причем входной канал первого компрессора сообщается по текучей среде с выпускным каналом хвостового газа системы адсорбции при переменном давлении; зону мембранного разделения, имеющую входной канал, выпускной канал для пермеата и выпускной канал для ретентата, при этом входной канал зоны мембранного разделения сообщается по текучей среде с выпускным каналом для хвостового газа зоны адсорбции при переменном давлении; и второй компрессор, имеющий входной канал и выпускной канал, причем входной канал второго компрессора сообщается по текучей среде с выпускным каналом для пермеата зоны мембранного разделения, а выпускной канал второго компрессора сообщается по текучей среде с зоной окисления.
Устройство включает в себя зону окисления, имеющую входной канал для сырья, входной канал для кислорода, выпускной канал для жидкости и выпускной канал для газа; конденсатор, имеющий входной канал и выпускной канал, причем входной канал конденсатора сообщается по текучей среде с выпускным каналом для газа зоны окисления; сепаратор, имеющий входной канал, выпускной канал для жидкости и выпускной канал для газа, при этом входной канал сепаратора сообщается по текучей среде с выпускным каналом конденсатора; зону адсорбции при переменном давлении, имеющую входной канал, выпускной канал для очищенного гелия и выпускной канал для хвостового газа, при этом входной канал зоны адсорбции при переменном давлении сообщается по текучей среде с выпускным каналом сепаратора; первый компрессор, имеющий входной канал и выпускной канал, причем входной канал первого компрессора сообщается по текучей среде с выпускным каналом хвостового газа системы адсорбции при переменном давлении; зону мембранного разделения, имеющую входной канал, выпускной канал для пермеата и выпускной канал для ретентата, при этом входной канал зоны мембранного разделения сообщается по текучей среде с выпускным каналом для хвостового газа зоны адсорбции при переменном давлении; и второй компрессор, имеющий входной канал и выпускной канал, причем входной канал второго компрессора сообщается по текучей среде с выпускным каналом для пермеата зоны мембранного разделения, а выпускной канал второго компрессора сообщается по текучей среде с зоной окисления.
Краткое описание чертежа
Чертеж иллюстрирует один из вариантов осуществления способа настоящего изобретения.
Подробное описание изобретения
Настоящее изобретение относится к улучшенному способу извлечения гелия из газового потока.
Данный способ включает использование зоны окисления, зоны PSA и зоны мембранного разделения. Способные окисляться компоненты сырья окисляются в зоне окисления. Газовый поток направляют в зону PSA, где выделяют очищенный гелий. Хвостовой газ PSA направляют в зону мембранного разделения, где образуется обогащенный гелием поток. Обогащенный гелием поток, который содержит гелий в более высокой концентрации, чем сырье, можно подвергать рециркуляции при отсутствии отрицательного воздействия на извлечение гелия в зоне PSA.
Как показано на чертеже, способ 100 включает введение газового потока 105, содержащего гелий. В дополнение к гелию поток 105 может включать один или несколько компонентов, например водород, метан, оксид углерода, диоксид углерода, азот, аргон и другие благородные газы, но не ограничивается ими. Источник газового потока 105 может представлять собой, например, поток природного газа или поток природного газа, который превращен в водородный поток. В одном из них или обоих можно повышать уровень концентрации гелия с помощью другой предыдущей технологической системы. Исходный поток, как правило, содержит примерно 50-90 об. % или около 55-60 об. % гелия.
Источник газового потока 105 может представлять собой, например, поток природного газа или поток природного газа, который превращен в водородный поток. В одном из них или обоих можно повышать уровень концентрации гелия с помощью другой предыдущей технологической системы. Исходный поток, как правило, содержит примерно 50-90 об. % или около 55-60 об. % гелия.
Газовый поток 105 и кислородный поток 110 вводят в зону 115 окисления. Газовый поток 105 и кислородный поток 110 можно подавать в зону 115 окисления либо раздельно, как показано, либо их можно смешивать вместе перед введением в реакционную зону. Кислородный поток желательно представляет собой очищенный кислород, но также можно использовать потоки, содержащие меньшее количество кислорода, включая воздух. Преимущественно кислородный поток содержит примерно более 50% кислорода, или примерно более 60%, или примерно более 70%, или примерно более 80%, или примерно более 85%, или примерно более 90%, или примерно более 95%, или примерно более 97%, или примерно более 99%.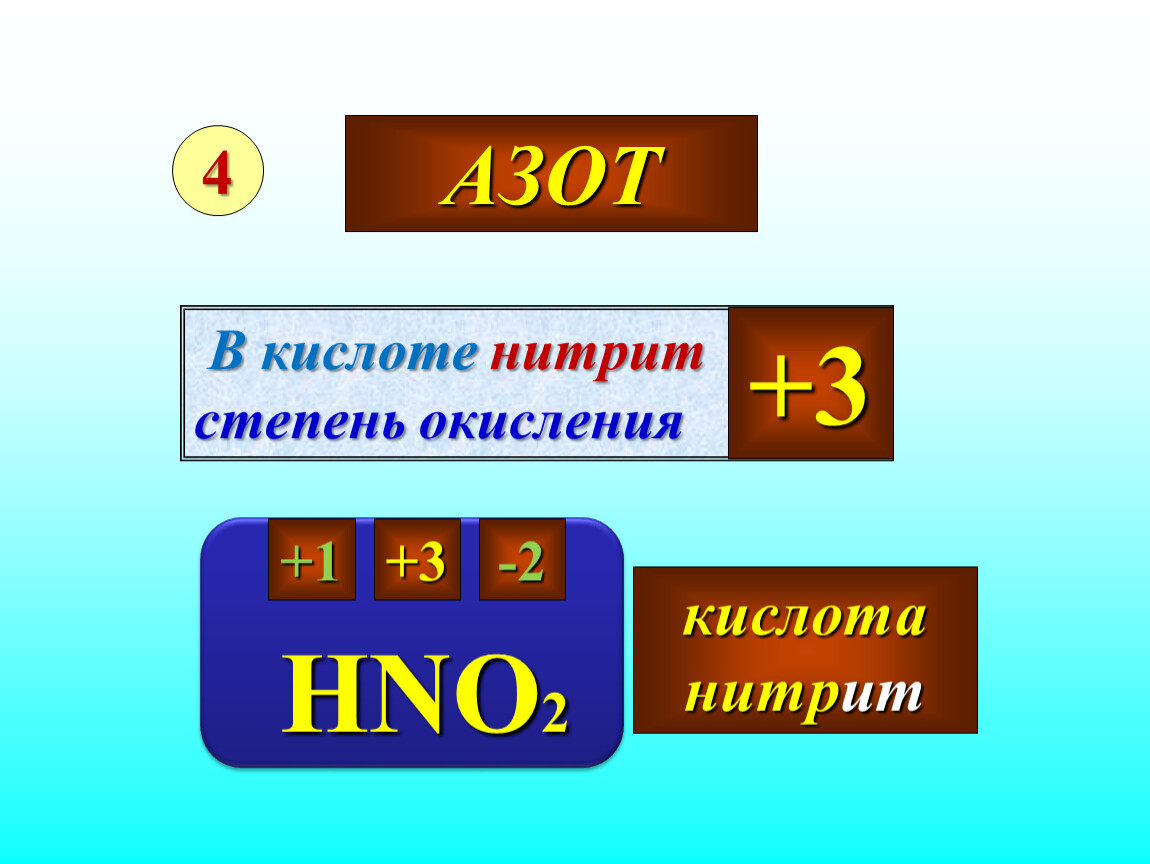
Газовый поток 105 содержит способные окисляться соединения, включая водород, CH4, этан и пропан, оксид углерода и тому подобные, но не ограничивается ими. Способные окисляться соединения окисляются в зоне 115 окисления. В результате реакции окисления образуется первый поток 120 паров и поток 125 жидкости. Первый поток 120 паров содержит гелий, воду, оксид углерода, диоксид углерода и очень низкие концентрации (в диапазоне ч./млн) водорода и углеводородов. Поток 125 жидкости включает воду, которую удаляют из системы.
Способные окисляться соединения окисляются в зоне 115 окисления. Например, водород превращается в воду, углеводороды в диоксид углерода, оксид углерода в диоксид углерода и т.д. Зона окисления может быть любой зоной окисления, известной специалистам в данной области техники. Подходящие зоны окисления включают в себя системы горелок и зоны каталитического окисления, но не ограничиваются ими.
Первый поток 120 паров направляют в конденсатор 130 для охлаждения и конденсации первого потока 120 паров.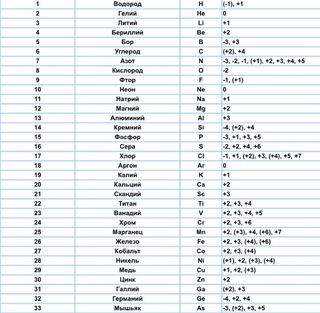 Сконденсированный поток 135 направляют в сепаратор 140, например фильтр-коагулятор или другой тип сепаратора. Сконденсированный поток 135 разделяют на второй поток 145 паров и второй поток 150 жидкости. Второй поток 145 паров содержит гелий, оксид углерода, диоксид углерода и очень низкие концентрации (в диапазоне ч./млн) водорода и углеводородов, а также более низкую концентрацию воды, чем в первом потоке 120 паров. Второй поток 150 жидкости содержит воду.
Сконденсированный поток 135 направляют в сепаратор 140, например фильтр-коагулятор или другой тип сепаратора. Сконденсированный поток 135 разделяют на второй поток 145 паров и второй поток 150 жидкости. Второй поток 145 паров содержит гелий, оксид углерода, диоксид углерода и очень низкие концентрации (в диапазоне ч./млн) водорода и углеводородов, а также более низкую концентрацию воды, чем в первом потоке 120 паров. Второй поток 150 жидкости содержит воду.
Второй поток 145 паров вводят в зону 155 PSA для очистки. При осуществлении операции второй поток 145 паров вводят в слой насадки, и материал адсорбента, содержащийся в нем, удаляет углеводороды, воду, остаточный гелий, и диоксид углерода, известные как сорбат, из потока по мере его прохождения через слой насадки. По истечении заданного периода времени материал адсорбента насыщается сорбатом, и процесс адсорбции необходимо прекращать с целью регенерации адсорбента и удаления сорбата. В процессах PSA используют не находящийся под давлением газ регенерации, который вводят в слой насадки в направлении, противоположном направлению течения технологического потока. По завершении цикла регенерации можно начинать новый цикл адсорбции. Типичные значения степени чистоты потоков гелиевого продукта PSA находятся в диапазоне от 99 до 99,999 % об.
По завершении цикла регенерации можно начинать новый цикл адсорбции. Типичные значения степени чистоты потоков гелиевого продукта PSA находятся в диапазоне от 99 до 99,999 % об.
В процессах PSA, как правило, используют слои насадки из материалов адсорбента. Материалы адсорбента в большинстве случаев находятся в форме сферических гранул или экструдированных гранул цилиндрической формы. В качестве альтернативы его можно формовать в монолитные сотовые структуры. Адсорбент может содержать порошкообразные твердые, кристаллические или аморфные вещества, способные адсорбировать и десорбировать адсорбирующееся соединение. Примеры таких адсорбентов охватывают силикагели, активированные оксиды алюминия, активированный углерод, молекулярные сита и их смеси. Молекулярные сита включают в себя цеолитные молекулярные сита. Материалы адсорбента, как правило, представляют собой цеолиты. В технологической схеме, такой как изображенная на чертеже установка 155 PSA обычно эксплуатируют при давлении подачи, находящемся в диапазоне от около 1,0 МПа (изб. ) примерно до 8,6 МПа (изб.).
) примерно до 8,6 МПа (изб.).
В общем случае такие установки PSA работают в циклическом режиме, при этом осуществляются циклы переключения отдельных емкостей адсорберов между стадиями адсорбции и десорбции. Множественные адсорберы обычно используют с целью обеспечения подачи постоянных потоков продукта и хвостового газа. Адсорбенты выбирают на основании типа и количества примесей, присутствующих в исходном потоке, а также требуемой степени удаления таких примесей. Такие установки PSA и их режим работы более полно описаны, например, в патентах США №№4964888 и 6210466.
Очищенный гелий 160 направляют на извлечение. Поток 165 хвостового газа обычно содержит около 30-60% или около 30-35% гелия. Как правило, он находится под давлением от около 130 кПа примерно до 500 кПа. Поток хвостового газа можно разделять на поток 170 и поток 175. Поток 175 может представлять собой продувочный поток для исключения накапливания различных компонентов в системе.
Поток 170 затем направляют в зону 180 сжатия, где его подвергают сжатию примерно до 3 МПа. Сжатый поток 185 направляют в зону (190) мембранного разделения. Технологии на основе мембран имеют низкие капитальные затраты и обеспечивают высокую энергетическую эффективность по сравнению с традиционными способами разделения.
Сжатый поток 185 направляют в зону (190) мембранного разделения. Технологии на основе мембран имеют низкие капитальные затраты и обеспечивают высокую энергетическую эффективность по сравнению с традиционными способами разделения.
Полимеры обеспечивают определенный диапазон характеристик, включая низкую стоимость, проницаемость, механическую стабильность и технологичность, которые являются важными для разделения газов. Стеклообразные полимеры (т.е. полимеры, находящиеся при температурах ниже их Tg) обладают более жесткими основными цепями и, следовательно, позволяют более мелким молекулам, таким как водород и гелий, проходить быстрее, тогда как более крупные молекулы, такие как углеводороды, проходят медленнее, по сравнению с полимерами, обладающими менее жесткими основными цепями. Мембраны из стеклообразного полимера ацетата целлюлозы (АЦ) широко применяют для разделения газов. В настоящее время такие АЦ-мембраны используют для улучшения качества природного газа, включая удаление диоксида углерода. Несмотря на то, что АЦ-мембраны имеют много преимуществ, они ограничены по ряду характеристик, включая селективность, проницаемость, а также по химической, термической и механической стабильности. Для повышения селективности, проницаемости и термической стабильности мембран были получены высокоэффективные полимеры, такие как полиимиды (ПИ), политриметилсилилпропин и политриазол. Упомянутые полимерные мембранные материалы продемонстрировали присущие им перспективные свойства для разделения пар газов, таких как СО2/СН4, O2/N2, Н2/СН4 и пропилен/пропан (C3H6/C3H8).
Несмотря на то, что АЦ-мембраны имеют много преимуществ, они ограничены по ряду характеристик, включая селективность, проницаемость, а также по химической, термической и механической стабильности. Для повышения селективности, проницаемости и термической стабильности мембран были получены высокоэффективные полимеры, такие как полиимиды (ПИ), политриметилсилилпропин и политриазол. Упомянутые полимерные мембранные материалы продемонстрировали присущие им перспективные свойства для разделения пар газов, таких как СО2/СН4, O2/N2, Н2/СН4 и пропилен/пропан (C3H6/C3H8).
Мембраны, наиболее широко используемые в промышленных вариантах применения для разделения газов и жидкостей, представляют собой асимметричные полимерные мембраны, которые имеют тонкий непористый селективный поверхностный слой, на котором осуществляется разделение. Разделение основано на механизме растворения-диффузии. Данный механизм включает в себя взаимодействия проникающего газа с полимером мембраны на молекулярном уровне. Механизм предполагает, что на мембране, имеющей две противоположных поверхности, каждый компонент сорбируется мембраной на одной из поверхностей, перемещается под действием градиента концентрации газа и десорбируется на противоположной поверхности. Согласно данной модели растворения-диффузии производительность мембраны при разделении данной пары газов (например, СО2/СН4, O2/N2, Н2/СН4,) определяется двумя параметрами: коэффициентом проницаемости (далее в настоящем документе сокращается как проницаемость или PA) и селективностью (αA/B). PA представляет собой произведение расхода газа и толщины селективного поверхностного слоя мембраны, деленное на разность давлений через мембрану. Величина αA/B представляет собой отношение коэффициентов проницаемости для двух газов (αA/B=PA/PB), где PA является проницаемостью газа, обладающего большей проникающей способностью, а PA является проницаемостью газа, обладающего меньшей проникающей способностью.
Данный механизм включает в себя взаимодействия проникающего газа с полимером мембраны на молекулярном уровне. Механизм предполагает, что на мембране, имеющей две противоположных поверхности, каждый компонент сорбируется мембраной на одной из поверхностей, перемещается под действием градиента концентрации газа и десорбируется на противоположной поверхности. Согласно данной модели растворения-диффузии производительность мембраны при разделении данной пары газов (например, СО2/СН4, O2/N2, Н2/СН4,) определяется двумя параметрами: коэффициентом проницаемости (далее в настоящем документе сокращается как проницаемость или PA) и селективностью (αA/B). PA представляет собой произведение расхода газа и толщины селективного поверхностного слоя мембраны, деленное на разность давлений через мембрану. Величина αA/B представляет собой отношение коэффициентов проницаемости для двух газов (αA/B=PA/PB), где PA является проницаемостью газа, обладающего большей проникающей способностью, а PA является проницаемостью газа, обладающего меньшей проникающей способностью.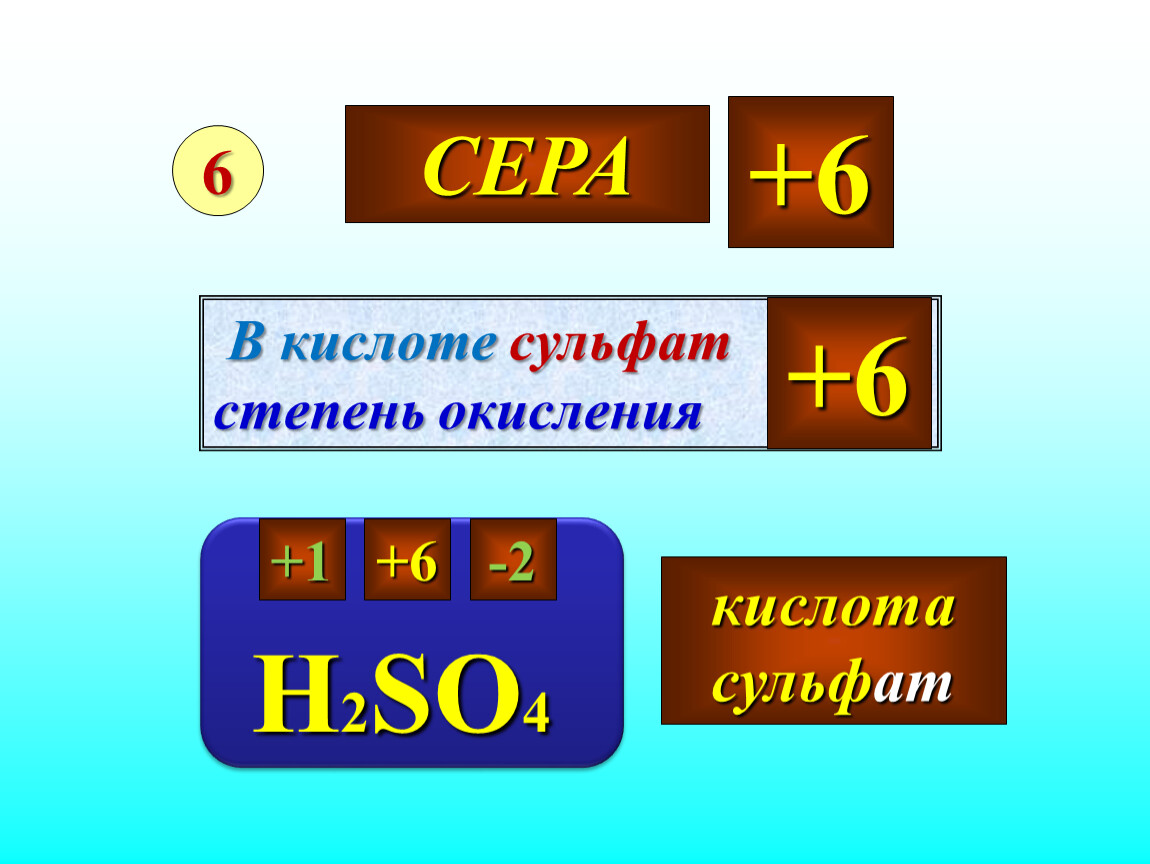 Газы могут иметь высокие коэффициенты проницаемости вследствие высокого коэффициента растворимости, высокого коэффициента диффузии или в связи с тем, что оба коэффициента являются высокими. В общем случае, с увеличением размера молекул газа коэффициент диффузии уменьшается, тогда как коэффициент растворимости повышается. В высокоэффективных полимерных мембранах желательными являются как высокая проницаемость, так и высокая селективность, вследствие того, что повышенная проницаемость обеспечивает уменьшение величины площади мембраны, требуемой для обработки данного объема газа, снижая таким образом капитальные затраты на мембранные блоки, и вследствие того, что повышенная селективность приводит к получению газового продукта более высокой чистоты.
Газы могут иметь высокие коэффициенты проницаемости вследствие высокого коэффициента растворимости, высокого коэффициента диффузии или в связи с тем, что оба коэффициента являются высокими. В общем случае, с увеличением размера молекул газа коэффициент диффузии уменьшается, тогда как коэффициент растворимости повышается. В высокоэффективных полимерных мембранах желательными являются как высокая проницаемость, так и высокая селективность, вследствие того, что повышенная проницаемость обеспечивает уменьшение величины площади мембраны, требуемой для обработки данного объема газа, снижая таким образом капитальные затраты на мембранные блоки, и вследствие того, что повышенная селективность приводит к получению газового продукта более высокой чистоты.
Один из компонентов, подлежащих отделению с помощью мембраны, должен обладать достаточно высокой проникающей способностью в предпочтительных условиях, либо требуется чрезмерно большая площадь поверхности мембраны для обеспечения возможности разделения больших количеств вещества. Проникающая способность, измеряемая в единицах газопроницаемости (GPU, 1 GPU=10-6 см3 (STP)/см2 с (cm Hg)), представляет собой нормированный на давление расход газа и равняется проницаемости, деленной на толщину поверхностного слоя мембраны. Доступные на рынке полимерные мембраны для разделения газов, такие как АЦ, полиимидные и полисульфоновые мембраны, изготовленные способами обращения фаз и обмена растворителями, имеют асимметричную, целиком покрытую оболочкой мембранную структуру. Для таких мембран характерно наличие тонкой, плотной, селективно полупроницаемой поверхностной «кожицы» и менее плотной, содержащей пустоты (или пористой), неселективной области подложки, при этом размеры пор находятся в диапазоне от крупных, в области подложки, до очень мелких, в непосредственной близости от «кожицы». Другой тип доступных на рынке полимерных мембран для разделения газов представляет собой тонкопленочную композитную (или TFC) мембрану, включающую тонкую селективную оболочку, осажденную на пористую подложку.
Проникающая способность, измеряемая в единицах газопроницаемости (GPU, 1 GPU=10-6 см3 (STP)/см2 с (cm Hg)), представляет собой нормированный на давление расход газа и равняется проницаемости, деленной на толщину поверхностного слоя мембраны. Доступные на рынке полимерные мембраны для разделения газов, такие как АЦ, полиимидные и полисульфоновые мембраны, изготовленные способами обращения фаз и обмена растворителями, имеют асимметричную, целиком покрытую оболочкой мембранную структуру. Для таких мембран характерно наличие тонкой, плотной, селективно полупроницаемой поверхностной «кожицы» и менее плотной, содержащей пустоты (или пористой), неселективной области подложки, при этом размеры пор находятся в диапазоне от крупных, в области подложки, до очень мелких, в непосредственной близости от «кожицы». Другой тип доступных на рынке полимерных мембран для разделения газов представляет собой тонкопленочную композитную (или TFC) мембрану, включающую тонкую селективную оболочку, осажденную на пористую подложку. TFC-мембраны могут быть изготовлены из АЦ, полисульфона, сульфона простого полиэфира, полиамида, полиимида, имида простого полиэфира, нитрата целлюлозы, полиуретана, поликарбоната, полистирола и т.д.
TFC-мембраны могут быть изготовлены из АЦ, полисульфона, сульфона простого полиэфира, полиамида, полиимида, имида простого полиэфира, нитрата целлюлозы, полиуретана, поликарбоната, полистирола и т.д.
Сжатый поток 185 разделяют на поток 195 пермеата и поток 200 ретентата в зоне 190 мембранного разделения. Поток 200 ретентата, который содержит гелий, оксид углерода, диоксид углерода, небольшие количества воды и очень низкие концентрации (в диапазоне ч./млн) водорода и углеводородов, отводят из системы.
Имеется значительный перепад давления через мембрану. По этой причине поток 195 пермеата подвергают сжатию в зоне 205 сжатия до давления от около 3 МПа примерно до 4 МПа. Сжатый поток 210 подают в зону 115 окисления в сочетании с исходным потоком 105 и потоком 110 кислорода. Сжатый поток 210 можно подавать в зону окисления отдельно, как показано, или его можно смешивать с исходным потоком 105 до поступления в зону окисления.
Зоны 180 и 205 сжатия могут представлять собой отдельные компрессоры или в любой из зон могут находиться два или более компрессоров.
В качестве альтернативы поток 165 хвостового газа можно сжимать в зоне 180 сжатия до разделения на потоки 170 и 175. Если зона 180 сжатия включает больше одного компрессора, поток 165 хвостового газа можно разделять на потоки 170 и 175 между компрессорами в зоне 180 сжатия.
В другом альтернативном варианте поток 200 ретентата можно удалять из системы после зоны 205 сжатия. Если зона 205 сжатия содержит больше одного компрессора, поток 200 ретентата можно удалять между компрессорами в зоне 205 сжатия.
В еще одном альтернативном варианте часть обогащенного гелием потока 195 пермеата можно удалять из системы до или после зоны 205 сжатия, или, если зона 205 сжатия содержит больше одного компрессора, поток 195 пермеата можно удалять между компрессорами в зоне 205 сжатия. Это можно делать во избежание накапливания различных компонентов в системе.
Пример
Моделирование проводили, исходя из следующих предположений. Исходный газ содержит только водород (10%), азот (30%) и гелий (60%). Поток кислорода представляет собой кислород высокой степени чистоты (100,0%). Концентрация остаточного кислорода после окисления составляет 1,0%. Предполагаемая степень извлечения гелия в результате осуществления PSA составляет 75%. Заданная степень извлечения гелия равна 98%. В таблице 1 представлен материальный баланс системы, в которой достигается степень извлечения гелия, равная 98% мол.
Поток кислорода представляет собой кислород высокой степени чистоты (100,0%). Концентрация остаточного кислорода после окисления составляет 1,0%. Предполагаемая степень извлечения гелия в результате осуществления PSA составляет 75%. Заданная степень извлечения гелия равна 98%. В таблице 1 представлен материальный баланс системы, в которой достигается степень извлечения гелия, равная 98% мол.
Потоки представляют собой следующее:
105: Исходный поток (поток газа)
110: Поток кислорода
120: Поток после окисления (первый поток паров)
145: Исходный поток для PSA (второй поток паров)
150: Жидкий конденсат (второй поток жидкости)
160: Поток чистого гелия, готовый для отгрузки (гелий)
165: Хвостовой газ PSA, подлежащий сжатию перед подачей на мембрану (поток хвостового газа)
175: Продувочный поток, полученный из хвостового газа PSA: отсутствует
185: Исходный поток газа для подачи на мембрану (сжатый поток)
200: Остаточный газовый поток мембранного разделения (покидает установку) (поток ретентата)
210: Сжатый газовый поток пермеата после мембраны, подлежащий возвращению на каталитическое окисление (сжатый поток).
Под термином «около» авторы подразумевают значение в пределах 10% от указанной величины, или в пределах 5%, или в пределах 1%.
Несмотря на то что в изложенном выше подробном описании изобретения представлен по меньшей мере один пример осуществления, следует понимать, что существует очень большое число таких вариантов. Также следует принимать во внимание, что пример осуществления или примеры осуществления являются только примерами и не предназначены для ограничения объема, применимости или конфигурации изобретения каким-либо образом. Скорее, изложенное выше подробное описание обеспечит специалистов в данной области техники удобной картой последовательности операций для воплощения примера осуществления изобретения. При этом предполагается, что можно вносить различные изменения в функциональное назначение и схему расположения элементов, описанные в примере осуществления, в пределах объема изобретения, изложенного в прилагаемой формуле изобретения.
Степени окисления
Степени окисленияТаблица 3. Степени окисления элементов
|
Символ |
Название |
Степени окисления |
Символ |
Название |
Степени окисления |
|
89Ac |
Актиний |
0, +3 |
12Mg |
Магний |
0, +2 |
|
47Ag |
Серебро |
0, +1 |
25Mn |
Марганец |
0, +2, +4, +6, +7 |
|
13Al |
Алюминий |
0, +3 |
42Mo |
Молибден |
0, +4, +6 |
|
95Am |
Америций |
0, +2, +3, +4 |
7N |
Азот |
-3, 0, +1, +2, +3, +4, +5 |
|
18Ar |
Аргон |
0 |
11Na |
Натрий |
0, +1 |
|
33As |
Мышьяк |
-3, 0, +3, +5 |
41Nb |
Ниобий |
0, +4. |
|
85At |
Астат |
-1, 0, +1, +5 |
60Nd |
Неодим |
0, +3 |
|
79Au |
Золото |
0, +1, +3 |
10Ne |
Неон |
0 |
|
5B |
Бор |
-3, 0, +3 |
28Ni |
Никель |
0, +2, +3 |
|
56Ba |
Барий |
0, +2 |
102No |
Нобелий |
0, +2, +3 |
|
4Be |
Бериллий |
0, +2 |
93Np |
Нептуний |
0, +3, +4, +6, +7 |
|
83Bi |
Висмут |
0, +3, +5 |
8O |
Кислород |
-2, -1, 0, +2 |
|
97Bk |
Берклий |
0, +3, +4 |
76Os |
Осмий |
0, +4, +6, +8 |
|
35Br |
Бром |
-1, 0, +1, +5, +7 |
15P |
Фосфор |
-3, 0, +1, +3, +5 |
|
6C |
Углерод |
-4, -3, -2, -1, 0, +2, +3,+4 |
91Pa |
Протактиний |
0, +4, +5 |
|
20Ca |
Кальций |
0, +2 |
82Pb |
Свинец |
0, +2, +4 |
|
48Cd |
Кадмий |
0, +2 |
46Pd |
Палладий |
0. |
|
58Ce |
Церий |
0, +2 |
61Pm |
Прометий |
0, +3 |
|
98Cf |
Калифорний |
0, +3, +4 |
84Po |
Полоний |
0, +3, +4 |
|
17Cl |
Хлор |
-1, 0, +1, +3, +4, +5, +6, +7 |
59Pr |
Празеодим |
0, +3, +4 |
|
96Cm |
Кюрий |
0, +3, +4 |
78Pt |
Платина |
0, +2, +4 |
|
27Co |
Кобальт |
0, +2, +3 |
94Pu |
Плутоний |
0, +3, +4, +5, +6 |
|
24Cr |
Хром |
0, +2, +3, +6 |
88Ra |
Радий |
0, +2 |
|
55Cs |
Цезий |
0, +1 |
37Rb |
Рубидий |
0, +1 |
|
29Cu |
Медь |
0, +1, +2 |
75Re |
Рений |
0, +4, +7 |
|
66Dy |
Диспрозий |
0, +3 |
45Rh |
Родий |
0, +3, +4 |
|
68Er |
Эрбий |
0, +3 |
86Rn |
Радон |
0, +2, +4, +6, +8 |
|
99Es |
Энштейний |
0, +2, +3 |
44Ru |
Рутений |
0, +2, +4, +6, +8 |
|
63Eu |
Европий |
0, +2, +3 |
16S |
Сера |
-2, 0, +4, +6 |
|
9F |
Фтор |
-1, 0 |
51Sb |
Сурьма |
0, +3, +5 |
|
26Fe |
Железо |
0, +2, +3, +6 |
21Sc |
Скандий |
0, +3 |
|
100Fm |
Фермий |
0, +2, +3 |
34Se |
Селен |
-2, 0, +4, +6 |
|
87Fr |
Франций |
0, +1 |
14Si |
Кремний |
-4, 0, +2, +4 |
|
31Ga |
Галлий |
0, +3 |
62Sm |
Самарий |
0, +2, +3 |
|
64Gd |
Гадолиний |
0, +3 |
50Sn |
Олово |
0, +2, +4 |
|
32Ge |
Германий |
0, +2, +4 |
38Sr |
Стронций |
0, +2 |
|
1H |
Водород |
-1, 0, +1 |
73Ta |
Тантал |
0, +4, +5 |
|
2He |
Гелий |
0 |
65Tb |
Тербий |
0, +3, +4 |
|
72Hf |
Гафний |
0, +4 |
43Tc |
Технеций |
0, +4, +7 |
|
80Hg |
Ртуть |
0, +1, +2 |
52Te |
Теллур |
-2, 0, +4, +6 |
|
67Ho |
Гольмий |
0, +3 |
90Th |
Торий |
0, +4 |
|
53I |
Йод |
-1, 0, +1, +5, +7 |
22Ti |
Титан |
0, +2, +3, +4 |
|
49I |
Индий |
0, +3 |
81Tl |
Таллий |
0, +1, +3 |
|
77Ir |
Иридий |
0, +3, +4 |
69Tu |
Тулий |
0, +3 |
|
19K |
Калий |
0, +1 |
92U |
Уран |
0, +3, +4, +6 |
|
36Kr |
Криптон |
0, +2 |
23V |
Ванадий |
0, +2, +3, +4, +5, |
|
57La |
Лантан |
0, +3 |
74W |
Вольфрам |
0, +4, +6 |
|
3Li |
Литий |
0, +1 |
54Xe |
Ксенон |
0, +2, +4, +6, +8 |
|
103Lo |
Лоуренсий |
0, +3 |
39Y |
Иттрий |
0, +3 |
|
71Lu |
Лютеций |
0, +3 |
70Yb |
Иттербий |
0, +2, +3 |
|
101Md |
Менделевий |
0, +2, +3 |
30Zn |
Цинк |
0, +2 |
|
|
|
|
40Zr |
Цирконий |
0, +4 |
| Ответ | Будем поочередно определять степень окисления серы в каждой из предложенных схем превращений, а затем выберем верный вариант ответа.
Изменение степени окисления серы: -2 → 0, т.е. шестой вариант ответа.
Изменение степени окисления серы: 0 → +6, т.е. четвертый вариант ответа.
1×2 +x+ 3×(-2) =0; Изменение степени окисления серы: +4 → 0, т.е. третий вариант ответа. |
| Задание | Валентность III и степень окисления (-3) азот проявляет в соединении: а) N 2 H 4 ; б) NH 3 ; в) NH 4 Cl; г) N 2 O 5 |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем поочередно определять валентность и степень окисления азота в предложенных соединениях. а) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 4-м (1×4 = 4). Разделим полученное значение на число атомов азота в молекуле: 4/2 = 2, следовательно, валентность азота равна II. Этот вариант ответа неверный. б) валентность водорода всегда равна I. Общее число единиц валентности водорода равно 3-м (1×3 = 3). Разделим полученное значение на число атомов азота в молекуле: 3/1 = 2, следовательно, валентность азота равна III. Степень окисления азота в аммиаке равна (-3): Это верный ответ. |
| Ответ | Вариант (б) |
Степень окисления – это условный заряд атома в молекуле, он получает атом в результате полного принятия электронов, его вычисляют из предположения, что все связи представляют собой ионный характер. Как определить степень окисления?
Определение степени окисления
Существуют заряженные частицы ионы, положительный заряд которых равняется количеству электронов, получаемых от одного атома. Отрицательный заряд иона равняется числу электронов, принимаемых одним атомом химического элемента. К примеру, запись такого элемента как Ca2+ значит, что атомы элементов потеряли одного, двух или же трех элементов. Чтобы найти состав ионных соединений и соединений молекул нам необходимо знать, как определить степень окисления элементов. Степени окислений бывают отрицательными, положительными и нулевыми. Если учитывать числа атомов, то алгебраическая степень окисления в молекуле равна нулю.
Отрицательный заряд иона равняется числу электронов, принимаемых одним атомом химического элемента. К примеру, запись такого элемента как Ca2+ значит, что атомы элементов потеряли одного, двух или же трех элементов. Чтобы найти состав ионных соединений и соединений молекул нам необходимо знать, как определить степень окисления элементов. Степени окислений бывают отрицательными, положительными и нулевыми. Если учитывать числа атомов, то алгебраическая степень окисления в молекуле равна нулю.
Чтобы определить степень окисления элемента нужно руководствоваться определёнными знаниями. Например, в соединениях металлов степень окисления положительная. А высшая степень окисления соответствует номеру группы периодической системы, где и находится элемент. У металлов степени окисления могут быть положительными и отрицательными. Это будет зависеть от того фактора, каким именно атомом соединен металл. Например, если соединен с атомом металла, то тогда степень будет отрицательной, если же соединен с неметаллом, то степень будет положительная.
Отрицательную же высшую степень окисления металла определить можно вычитанием из цифры восемь номер группы, где находится необходимый элемент. Как правило, она бывает равна числу электронов, находящихся на внешнем слое. Число этих электронов тоже соответствует номеру группы.
Как рассчитать степень окисления
В большинстве случаев степень окисления атома конкретного элемента не совпадает с числом связей, которые он образует, то есть она не равна валентности этого элемента. Наглядно это можно увидеть на примере органических соединений.
Напомню, валентность углерода в органических соединениях равняется 4 (т.е образует 4 связи), но степень окисления углерода, например, в метаноле CH 3 OH равна -2, в CO 2 +4, в Ch5 -4, в муравьиной кислоте HCOOH +2. Валентность измеряется числом ковалентных химических связей, включая те, которые возникли по донорно-акцепторному механизму.
При определении степени окисления атомов в молекулах, электроотрицательный атом, при смещении в свою сторону одной электронной пары, приобретает заряд -1, если же две электронные пары то -2 будет заряд. На степень окисления не влияет связь между одинаковыми атомами. Например:
На степень окисления не влияет связь между одинаковыми атомами. Например:
- Связь атомов C-C равняется их нулевой степени окисления.
- Связь C-H – здесь, углероду как наиболее электроотрицательному атому будет соответствовать заряд -1.
- Связь C-O заряд углерода, как менее электроотрицательный, будет равняться +1.
Примеры определения степени окисления
- В такой молекуле как CH 3Cl три связи C-HC). Таким образом, степень окисления атома углерода в данном соединении будет равна:-3+1=-2.
- Найдем степень окисления атомов углерода в молекуле уксусного альдегида Cˉ³h4-C¹O-H. В данном соединении три связи C-H будут давать общий заряд на атоме C, который равен (Cº+3e→Cˉ³)-3. Двойная же связь C=O (здесь кислород будет забирать электроны у атома углерода, т.к кислород более электроотрицательный) дает заряд на атоме C, он равен +2 (Cº-2e→C²), связь же C-H заряд -1, значит общий заряд на атоме C равняется: (2-1=1)+1.
- Теперь найдем степень окисления в молекуле этанола: Cˉ³H-Cˉ¹h3-OH.
 Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Теперь Вы знаете, как определить степень окисления элемента. Если Вы имеете хотя бы базовые знания по химии, то для Вас данная задача будет не проблемой.
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Гелий — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: гелий
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец рекламного ролика)
Крис Смит
Здравствуйте, на этой неделе мы почти на вершине таблицы Менделеева, потому что мы рассматриваем гелий, который легче воздуха. Но для этого химика шарик, наполненный гелием, на самом деле является источником боли, а не источником удовольствия. Вот Питер Уотерс.
Но для этого химика шарик, наполненный гелием, на самом деле является источником боли, а не источником удовольствия. Вот Питер Уотерс.
Питер Уотерс
Мы все знакомы с гелием, который легче воздуха, но всякий раз, когда я вижу воздушный шар, парящий на веревке, мне становится немного грустно. Это не потому, что я несчастный старый такой-то — просто, в отличие от счастливого ребенка на другом конце провода, я знаю о ценном ресурсе, который вот-вот будет потерян навсегда.
Гелий — второй по распространенности элемент во Вселенной, но здесь, на Земле, он встречается довольно редко. Большинство людей догадываются, что мы добываем гелий из воздуха, но на самом деле мы добываем его из земли. Гелий можно найти в некоторых частях мира, особенно в Техасе, в качестве второстепенного компонента в некоторых источниках природного газа. Интересно то, как этот газ вообще попадает в землю. В отличие от практически любого другого атома вокруг нас, каждый атом гелия был индивидуально сформирован после образования Земли.
Гелий образуется при естественном радиоактивном распаде таких элементов, как уран и торий. Эти тяжелые элементы образовались до Земли, но они нестабильны и очень медленно распадаются. Одним из способов распада урана является испускание альфа-частиц. Эта альфа-частица на самом деле является сердцевиной атома гелия — его ядром. Как только он захватил пару электронов, родился атом гелия.
Этот процесс распада урана невероятно медленный; время, за которое данное количество урана распадается вдвое, так называемый период полураспада, сравнимо с возрастом Земли.Это означает, что гелий непрерывно генерируется с тех пор, как сформировалась Земля. Часть газа может в конечном итоге просочиться сквозь землю и выйти в атмосферу; к счастью, при подходящих условиях некоторые из них остаются в ловушке под землей и могут быть собраны для нашего использования.
В космосе ситуация совсем другая. Солнце состоит примерно из 75% по массе водорода и 24% гелия. Оставшийся один процент составляют все более тяжелые элементы. При высоких температурах Солнца ядра водорода сливаются вместе, в конечном итоге образуя гелий.Этот процесс синтеза, при котором более тяжелые атомы образуются из более легких, высвобождает огромное количество энергии. Воссоздание процесса на Земле может стать ответом на наши энергетические проблемы в будущем.
При высоких температурах Солнца ядра водорода сливаются вместе, в конечном итоге образуя гелий.Этот процесс синтеза, при котором более тяжелые атомы образуются из более легких, высвобождает огромное количество энергии. Воссоздание процесса на Земле может стать ответом на наши энергетические проблемы в будущем.
Поскольку гелий составляет около четверти массы Солнца, неудивительно, что его присутствие было обнаружено там более 100 лет назад. Что, пожалуй, удивительно, так это то, что гелий был обнаружен в космосе за 26 лет до того, как его нашли на Земле.
Уже сотни лет известно, что определенные элементы придают пламени характерные цвета — факт, имеющий решающее значение для цветных фейерверков, которыми мы наслаждаемся.Медь, например, дает зеленый цвет, тогда как натрий дает желтый цвет. На самом деле можно идентифицировать элементы путем тщательного изучения такого цветного пламени. Свет разделяется на спектр с помощью призмы или дифракционной решетки в приборе, называемом спектроскопом. Вместо того, чтобы видеть непрерывную радугу цветов, формируется серия четких цветных линий. Эта серия линий характерна для конкретного элемента и действует как своего рода отпечаток пальца.
Вместо того, чтобы видеть непрерывную радугу цветов, формируется серия четких цветных линий. Эта серия линий характерна для конкретного элемента и действует как своего рода отпечаток пальца.
В 19 веке ученые направили свои спектроскопы на Солнце и стали обнаруживать там некоторые металлы, в том числе натрий, магний, кальций и железо.В 1868 году два астронома, Янссен и Локьер, независимо друг от друга заметили несколько очень четких линий в солнечном спектре, которые не соответствовали ни одному из известных металлов. В то время как другие астрономы того времени не были уверены, Локьер предположил, что эти неопознанные линии принадлежат новому металлу, который он назвал гелий в честь греческого олицетворения солнца, Гелиос . В течение более 20 лет на Земле не было обнаружено никаких признаков металлического гелия, и Локьера начали высмеивать за его мифический элемент.Однако в 1895 году химик Уильям Рамзи обнаружил гелий в газе, выделяющемся при обработке радиоактивного минерала урана кислотой. Гелий, образовавшийся в результате радиоактивного распада, был захвачен камнем, но высвободился, когда камень растворился в кислоте.
Гелий, образовавшийся в результате радиоактивного распада, был захвачен камнем, но высвободился, когда камень растворился в кислоте.
Наконец, на Земле был открыт элемент Локьера, но это был не металл, а крайне нереакционноспособный газ. По сей день гелий остается единственным неметаллом, название которого заканчивается суффиксом -ium, окончанием, которое в остальном используется исключительно для металлов.
Помимо использования для наполнения воздушных шаров, как для нашего развлечения, так и для более серьезных целей, таких как метеозонды, гелий используется в других целях, которые зависят от его уникальных свойств. Будучи таким легким и при этом совершенно химически инертным, гелий можно смешивать с кислородом, чтобы облегчить дыхание. Эта смесь, известная как гелиокс, может помочь спасти новорожденных детей с проблемами дыхания или помочь подводным ныряльщикам безопасно достичь глубин океана. При температуре минус 269 градусов по Цельсию жидкий гелий имеет самую низкую температуру кипения среди всех веществ. Из-за этого он используется для обеспечения низких температур, необходимых для сверхпроводящих магнитов, таких как те, которые используются в большинстве МРТ-сканеров в больницах.
Из-за этого он используется для обеспечения низких температур, необходимых для сверхпроводящих магнитов, таких как те, которые используются в большинстве МРТ-сканеров в больницах.
На многих объектах, где используется гелий, он улавливается и используется повторно. Если это не так, он убегает в воздух. Но он не просто накапливается в атмосфере. Гелий настолько легок, что может избежать гравитационного поля Земли и навсегда покинуть нашу планету. Такова судьба гелия в наших воздушных шарах. В то время как другие элементы, которые мы использовали и выбрасываем, можно восстановить и переработать, когда мы тратим впустую гелий, он теряется навсегда.Через 100 лет люди будут оглядываться назад с недоверием к тому, что мы потратили впустую этот драгоценный, уникальный элемент, надувая воздушные шары для вечеринок.
Крис Смит
Питер Уотерс из Кембриджского университета рассказывает нам историю об элементе номер два, гелии. В следующий раз мы отправимся в Шотландию 18 -го -го века и элемент, который был не того цвета.
Ричард Ван Ноорден
В 1787 году в Эдинбург из свинцового рудника в небольшой деревне на берегу озера Лох-Сунарт, Аргайл, попал загадочный минерал.В то время считалось, что этот материал представляет собой какое-то соединение бария. Другие химики, такие как Томас Хоуп из Эдинбурга, позже приготовили ряд соединений с этим элементом, отметив, что он заставляет пламя свечи гореть красным, а соединения бария дают зеленый цвет.
Крис Смит
И это потому, что это был вовсе не барий, а стронций, и Ричард Ван Ноорден будет здесь, чтобы объяснить, как, среди прочего, это показало нам, что римские гладиаторы не были мясоедами, а были на самом деле вегетарианцы.Это Химия в своей стихии на следующей неделе, и я надеюсь, что вы сможете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания.
(Акция)
(Конец акции)
Гелий: Электронная конфигурация — Символ — Атомный номер — Атомная масса — Степени окисления — Стандартное состояние — Групповой блок
Свойства гелия
Наименование элемента | Гелий |
Атомный номер | 2 |
Символ | Он |
Атомная масса | 4. |
Степени окисления | 0 |
Стандартное состояние | Газ |
Групповой блок | Благородный газ |
Год открытия | 1868 |
Электронная конфигурация | 1с2 |
Атомные диаграммы | В инфографике |
Download ↓↓
PDF Файл | 0.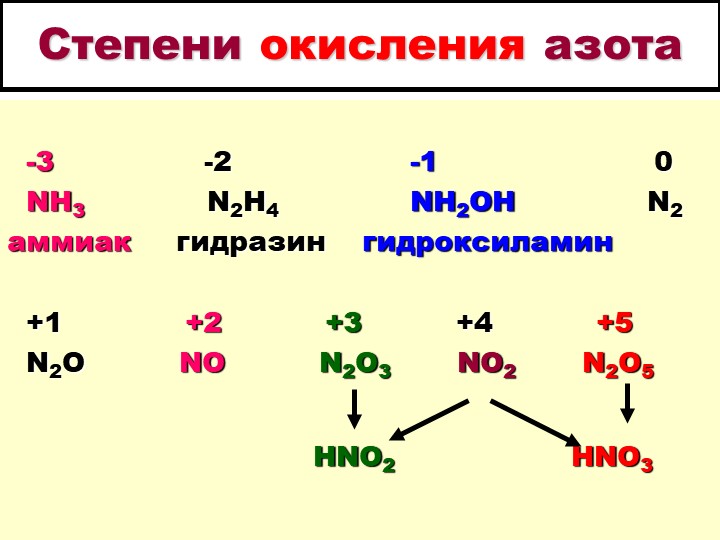 5мб — высокий
разрешение
5мб — высокий
разрешение
JPG файл | Размер: 618 КБ
Фото: 4000×4400 высокое разрешение
Определения
Атомный номер гелия: число или так называемое протонное число для любого химического элемента – это число протоны, присутствующие в ядре каждого атома этого химического элемента. То атомный номер однозначно идентифицирует элемент химически.Это соответствует зарядовое число ядра.
Символ гелия: Символ химического элемента одно- или двухбуквенное сокращение названия химического элемента. И когда символ состоит из двух букв, первая буква всегда заглавная, а вторая буква строчная.
Атомная масса гелия: Атомная масса
Химической Победы — это масса атома. Хотя в СИ единица атомной массы
килограмм, атомная масса часто выражается в дальтонах, отличных от системы СИ, где
масса 1 дальтон определяется как 1/12 массы одного атома углерода-12 в
состояние сна.
Степени окисления гелия: Химическое состояние Степень окисления, иногда называемая степенью окисления, описывает степень окисления атома элемента в химическом соединении.
Стандартное состояние гелия: В химии стандартное состояние вещества – точка отсчета, по которой рассчитывают его свойства в различных условиях. Будь то жидкость, твердое или газообразный.
Электрон конфигурация гелия: В атомной физике и квантовой химии, электронная конфигурация — это распределение электронов атома или молекулы на атомные или молекулярные орбитали.
О положении гелия и неона в Периодической таблице элементов
Антониотти, П., Бронзолино, Н., Грандинетти, Ф.: Стабильные соединения легчайших благородных газов: компьютерное исследование RNBeNg (Ng = He, Около). Дж. Физ. хим. A 107 (16), 2974–2980 (2003)
Артикул Google Scholar
Антониотти П. , Бороччи С., Бронзолино Н., Чекки П., Грандинетти Ф.: Анионы благородных газов: теоретическое исследование FNgBN − (Ng = He–Xe).Дж. Физ. хим. А 111 (40), 10144–10151 (2007)
, Бороччи С., Бронзолино Н., Чекки П., Грандинетти Ф.: Анионы благородных газов: теоретическое исследование FNgBN − (Ng = He–Xe).Дж. Физ. хим. А 111 (40), 10144–10151 (2007)
Артикул Google Scholar
Бартлетт, Н.: гексафторплатинат ксенона (V) Xe + [PtF 6 ] − . проц. хим. соц. Лонд. хим. соц. 6 , 218 (1962)
Google Scholar
Bartlett, N., Žemva, B., Graham, L.: Окислительно-восстановительные реакции в системах XeF 2 /фторид платины и XeF 2 /фторид палладия и превращение XeF 2 в XeF 2 4 и Хе.Дж. Флуор. хим. 7 (1–3), 301–320 (1976)
Артикул Google Scholar
Бартлетт, Н.: Гелий может образовывать прочные связи. Природа 331 , 487–488 (1998)
Статья Google Scholar
Белпасси, Л. , Инфанте, И., Тарантелли, Ф., Вишер, Л.: Химическая связь между Au(I) и инертными газами. Сравнительное исследование NgAuF и NgAu + (Ng = Ar, Kr, Xe) методами функционала плотности и связанных кластеров.Варенье. хим. соц. 130 (3), 1048–1060 (2008)
, Инфанте, И., Тарантелли, Ф., Вишер, Л.: Химическая связь между Au(I) и инертными газами. Сравнительное исследование NgAuF и NgAu + (Ng = Ar, Kr, Xe) методами функционала плотности и связанных кластеров.Варенье. хим. соц. 130 (3), 1048–1060 (2008)
Статья Google Scholar
Бент, Х.: Новые идеи в химии из свежей энергии для периодического закона. AuthorHouse, Блумингтон (2006)
Google Scholar
Бихари З., Чабан Г.М., Гербер Р.Б.: Стабильность химически связанного соединения гелия в твердом гелии высокого давления. Дж. Хим. физ. 117 (11), 5105–5108 (2002)
Артикул Google Scholar
Бороччи, С., Бронзолино, Н., Грандинетти, Ф.: Анионы благородного газа и серы: теоретическое исследование FNgS — (Ng = He, Ar, Kr, Xe). хим. физ. лат. 458 (1–3), 48–53 (2008)
Статья Google Scholar
Бороччи, С. , Бронзолино, Н., Джордани, М., Грандинетти, Ф.: Катионные гидриды благородных газов: теоретическое исследование биядерного HNgFNgH + (Ng = He — Xe). Дж. Физ. хим. А 114 (27), 7382–7390 (2010)
, Бронзолино, Н., Джордани, М., Грандинетти, Ф.: Катионные гидриды благородных газов: теоретическое исследование биядерного HNgFNgH + (Ng = He — Xe). Дж. Физ. хим. А 114 (27), 7382–7390 (2010)
Артикул Google Scholar
Брок Д.С., Шробильген, Г. Дж., Жемва, Б.: Химия благородных газов. В: Reedijk, J., Poeppelmeier, K. (ред.) Комплексная неорганическая химия II (второе издание): From Elements to Applications, vol. 1, стр. 755–822 (2013). http://www.sciencedirect.com/science/referenceworks/9780080965291
Каппеллетти, Д., Барточчи, А., Грандинетти, Ф., Фальчинелли, С., Белпасси, Л., Тарантелли, Ф., Пирани, Ф.: Экспериментальные доказательства химических компонентов в связывании гелия и неон с нейтральными молекулами.хим. Евро. J. 21 (16), 6234–6240 (2015)
Статья Google Scholar
Christe, K. O., Wilson, W.W.: Перфтораммониевые соли и соли щелочных металлов анионов гептафтороксенона (VI) и октафтороксенона (VI). неорг. хим. 21 (12), 4113–4117 (1982)
O., Wilson, W.W.: Перфтораммониевые соли и соли щелочных металлов анионов гептафтороксенона (VI) и октафтороксенона (VI). неорг. хим. 21 (12), 4113–4117 (1982)
Артикул Google Scholar
Кристе, К.О., Кертис, Э.К., Диксон, Д.А., Мерсье, Х.П., Сандерс, Дж. С. П., Шробильген, Г. Дж.: Анион пентафтороксената (IV), XeF 5 — : первый пример пятиугольного плоского вида AX 5 . Варенье. хим. соц. 113 (9), 3351–3361 (1991)
Статья Google Scholar
Christe, K.O.: Ренессанс в химии благородных газов. Ангью. хим. Междунар. Эд. англ. 40 (8), 1419–1421 (2001)
Статья Google Scholar
Крачун Р., Пиконе, Д., Лонг, Р.Т., Ли, С., Диксон, Д.А., Петерсон, К.А., Кристе, К.О.: Гексафториды переходных металлов третьего ряда, экстраординарные окислители и кислоты Льюиса: сродство к электрону, сродство к фториду и теплота образования WF 6 , ReF 6 , OSF 6 , IrF 6 , PtF 6 и AuF 6 . неорг. хим. 49 (3), 1056–1070 (2010)
неорг. хим. 49 (3), 1056–1070 (2010)
Статья Google Scholar
Кунье, А., Баранов В.И., Линг Ю., Хопкинсон А.С., Бёме Д.К. Связывание инертных газов с Si в реакциях инертных газов с SiF 3 + . Дж. Физ. хим. А 105 (49), 11073–11079 (2001)
Артикул Google Scholar
Dewaele, A., Worth, N., Pickard, CJ, Needs, RJ, Pascarelli, S., Mathon, O., Mezouar, M., Irifune, T.: Синтез и стабильность оксидов ксенона Xe 2 O 5 и Xe 3 O 2 под давлением.Нац. хим. 8 (8), 784–790 (2016)
Статья Google Scholar
Dixon, DA, Wang, TH, Grant, DJ, Peterson, KA, Christe, KO, Schrobilgen, GJ: Теплоты образования фторидов криптона и прогнозы стабильности для KrF 4 и KrF 6 с высокого уровня расчет электронной структуры. неорг. хим. 46 (23), 10016–10021 (2007)
неорг. хим. 46 (23), 10016–10021 (2007)
Артикул Google Scholar
Донг, X., Оганов А.Р., Гончаров А.Ф., Ставру Э., Лобанов С., Салех Г., Цянь Г.-Р., Чжу К., Гатти К., Дерингер В.Л., Дронсковски Р. , Чжоу, X.-F., Пракопенко, В., Конопкова, З., Попов, И.А., Болдырев, А.И., Ван, Х.-Т.: Стабильное соединение гелия и натрия при высоком давлении. Нац. хим. 9 , 440–445 (2017)
Статья Google Scholar
Эванс, С.Дж., Джерри, М.С.Л.: Микроволновые спектры и структуры Ar–AgX (X = F, Cl, Br).Дж. Хим. физ. 112 (3), 1321–1329 (2000)
Статья Google Scholar
Francl, M.: Правила поведения за столом. Нац. хим. 1 (2), 97–98 (2009)
Статья Google Scholar
Френкинг Г., Кремер Д.: Химия элементов инертных газов гелия, неона и аргона — экспериментальные факты и теоретические предсказания. Структура Склеивание 73 , 17 (1990)
Структура Склеивание 73 , 17 (1990)
Артикул Google Scholar
Френкинг, Г., Кох В., Гаусс Дж., Кремер Д.: Стабильность и природа взаимодействий притяжения в HeBeO, NeBeO и ArBeO и сравнение с аналогами NGLiF, NGBN и NGLiH (NG = He, Ar). Теоретическое исследование. Варенье. хим. соц. 110 (24), 8007–8016 (1988)
Артикул Google Scholar
Френкинг Г., Кох В., Дикайн К.А., Либман Дж.Ф., Бартлетт Н.: Катион ArF + . Достаточно ли он стабилен, чтобы его можно было выделить в соли? Дж.Являюсь. хим. соц. 111 (1), 31–33 (1989)
Статья Google Scholar
Френкинг, Г., Кох, В., Райхель, Ф., Кремер, Д.: Химия легких инертных газов — структуры, стабильность и связывание соединений гелия, неона и аргона. Варенье. хим. соц. 112 (11), 4240–4256 (1990)
Артикул Google Scholar
Frohn, HJ, Jakobs, S. : Катион пентафторфенилксенона (II): [C 6 F 5 Xe] + ; первая стабильная система со связью ксенон-углерод.Дж. Хим. соц. хим. коммун. 10 , 625–627 (1989)
: Катион пентафторфенилксенона (II): [C 6 F 5 Xe] + ; первая стабильная система со связью ксенон-углерод.Дж. Хим. соц. хим. коммун. 10 , 625–627 (1989)
Статья Google Scholar
Фуртадо Дж., Де Профт Ф., Герлингс П.: Благородные газы: как их электроотрицательность и твердость определяют их химический состав. Дж. Физ. хим. A 119 , 1339–1346 (2015)
Артикул Google Scholar
Гиллеспи, Р.Дж., Сильви, Б.: Правило октетов и гипервалентность: два неправильно понятых понятия.Координ. хим. 233–234 , 53–62 (2002)
Статья Google Scholar
Джордани, М., Антониотти, П., Грандинетти, Ф.: Стабилизация HHeF путем комплексообразования: действительно ли это жизнеспособная стратегия? хим. Евро. J. 16 (21), 6257–6264 (2010)
Статья Google Scholar
Гурски А. В.: Морфологическая классификация химических структурных единиц.пол. Дж. Хим. 75 , 159–207 (2001)
В.: Морфологическая классификация химических структурных единиц.пол. Дж. Хим. 75 , 159–207 (2001)
Google Scholar
Graham, L., Graudejus, O., Jha, N.K., Bartlett, N.: О природе XePtF 6 . Координ. хим. 197 (1), 321–334 (2000)
Статья Google Scholar
Грандинетти, Ф.: Неон за вывесками. Нац. хим. 5 (5), 438 (2013)
Артикул Google Scholar
Грочала, В.: Атипичные соединения газов, которые были названы «благородными». хим. соц. 36 (10), 1632–1655 (2007)
Статья Google Scholar
Грочала, В.: О химической связи между гелием и кислородом. пол. Дж. Хим. 83 (1), 87–122 (2009а)
Google Scholar
Grochala, W.: Quo vadis химия благородных газов? Разговор в Universita de la Tuscia, Витербо, 9 июня (2009b)
Грочала, В.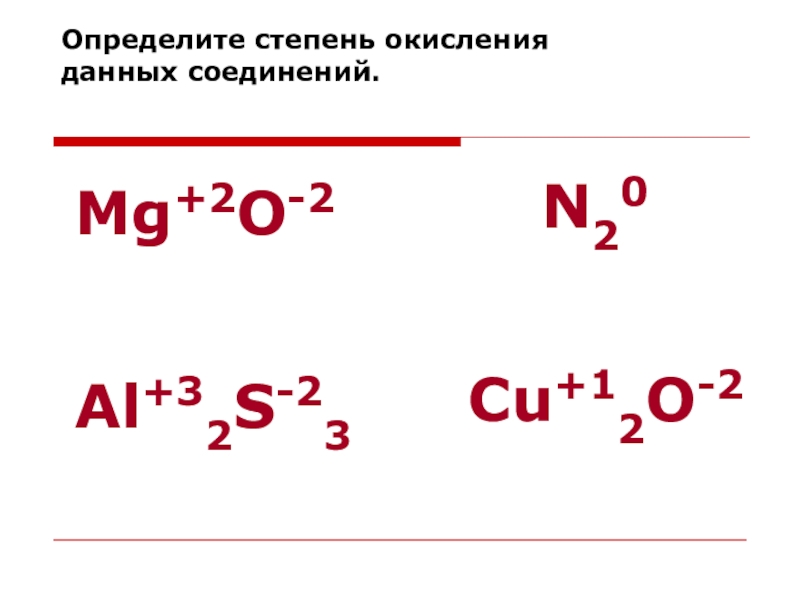 , Хрящев, Л., Расанен, М.: Химия благородных газов. В: Хрячев Л. (ред.) Физика и химия при низких температурах, стр. 421–448. Издательство Pan Stanford, Кейптаун (2011)
, Хрящев, Л., Расанен, М.: Химия благородных газов. В: Хрячев Л. (ред.) Физика и химия при низких температурах, стр. 421–448. Издательство Pan Stanford, Кейптаун (2011)
Google Scholar
Грочала, В.: Метастабильная связь He–O внутри сегнетоэлектрической молекулярной полости: (HeO)(LiF) 2 . физ. хим. хим. физ. 14 , 14860–14868 (2012)
Артикул Google Scholar
Грочала, В.: Может ли элементарный гелий образовывать химические связи в нейтральных молекулах? Wissenschaftsforum Chemie 2013. Дармштадт, Германия (2013)
Google Scholar
Грочала, В.: Неопубликованные периодические результаты ТФП (2014 г.)
Ханер, Дж., Шробильген, Г.Дж.: Химия ксенона (IV). хим. Ред. 115 (2), 1255–1295 (2015)
Статья Google Scholar
Герман А. , Schwerdtfeger, P.: Субоксиды ксенона, устойчивые под давлением. Дж. Физ. хим. лат. 5 (24), 4336–4342 (2014)
, Schwerdtfeger, P.: Субоксиды ксенона, устойчивые под давлением. Дж. Физ. хим. лат. 5 (24), 4336–4342 (2014)
Артикул Google Scholar
Хоуп, Э.Г.: Координационная химия благородных газов и фторидов благородных газов. Координ. хим. Ред. 257 (5–6), 902–909 (2013)
Статья Google Scholar
Хван, И.С., Зайдель, С., Сеппельт, К.: Ксеноновые комплексы золота(I) и ртути(II). Ангью. хим. Междунар. Эд. 42 (36), 4392–4395 (2003)
Артикул Google Scholar
Джанет, К.: Очерк классификации геликоидальных химических элементов. Imprimerie Départementale de l’Oise, Бове (1928a)
Google Scholar
Джанет, К.: Геликоидальная классификация химических элементов. Imprimerie Départementale de l’Oise, Бове (1928b)
Google Scholar
Джанет, К. : Спиральная классификация элементов. хим. Новости 138 (372–374), 388–393 (1929)
: Спиральная классификация элементов. хим. Новости 138 (372–374), 388–393 (1929)
Google Scholar
Хрячев Л., Петтерссон М., Рунеберг Н., Лунделл Дж., Расанен М.: Стабильное соединение аргона. Природа 406 , 874–876 (2000)
Статья Google Scholar
Ким, М., Дебессай, М., Ю, К.-С.: Двумерные и трехмерные протяженные твердые тела и металлизация сжатого XeF 2 .Нац. хим. 2 (9), 784–788 (2010)
Статья Google Scholar
Кох, В., Коллинз, Дж.Р., Френкинг, Г.: Существуют ли нейтральные соединения гелия, которые стабильны в своем основном состоянии? Теоретическое исследование HeBCH и HeBeO. хим. физ. лат. 132 (3), 330–333 (1986)
Статья Google Scholar
Куржидловски Д., Залески-Эйгерд П., Грочала В. , Хоффманн Р.: Замораживание в резонансных структурах для лучшей упаковки: XeF 2 становится (XeF + )(F — ) при большом сжатии. неорг. хим. 50 (8), 3832–3840 (2011)
, Хоффманн Р.: Замораживание в резонансных структурах для лучшей упаковки: XeF 2 становится (XeF + )(F — ) при большом сжатии. неорг. хим. 50 (8), 3832–3840 (2011)
Статья Google Scholar
Куржидловски Д., Залески-Эйгерд П.: Стабилизация фторидов аргона под высоким давлением. физ. хим. хим. физ. 18 (4), 2309–2313 (2016)
Статья Google Scholar
Ласло П., Schrobilgen, GJ: Один или несколько пионеров? Открытие соединений благородных газов. Ангью. хим. Междунар. Эд. англ. 27 (4), 479–489 (1988)
Статья Google Scholar
Ле Корнек, Х.: Распределение потенциалов ионизации атомов обнаруживает неожиданную Периодическую таблицу. physchem/0201007 (2002)
Леманн, Дж.Ф., Мерсье, Х.П.А., Шробильген, Г.Дж.: Химия криптона. Координ. хим. преп. 233–234 , 1–39 (2002)
Координ. хим. преп. 233–234 , 1–39 (2002)
Статья Google Scholar
Леварс, Э. Г.: Чудеса моделирования: вычислительное предвидение новых молекул, глава 5. Springer, Берлин (2008)
Книга Google Scholar
Льюис, Г. Н.: Атом и молекула. Варенье. хим. соц. 38 (4), 762–785 (1916)
Артикул Google Scholar
Льюис Г.Н.: Валентность и строение атомов и молекул. Химический каталог, Нью-Йорк (1923)
Google Scholar
Li, T.-H., Mou, C.-H., Chen, H.-R., Hu, W.-P.: Теоретический прогноз благородных газов, содержащих анионы FNgO − (Ng = Хе, Ар и Кр). Варенье. хим. соц. 127 (25), 9241–9245 (2005)
Артикул Google Scholar
Ли, X., Герман, А. , Peng, F., Lv, J., Wang, Y., Wang, H., Ma, Y.: Стабильные соединения лития и аргона при высоком давлении. науч. 5 , 16675 (2015)
, Peng, F., Lv, J., Wang, Y., Wang, H., Ma, Y.: Стабильные соединения лития и аргона при высоком давлении. науч. 5 , 16675 (2015)
Артикул Google Scholar
Либман, Дж. Ф., Аллен, Л. К.: Химия солей легких соединений благородных газов. Варенье. хим. соц. 92 (12), 3539–3543 (1970)
Артикул Google Scholar
Лю Г., Чжан Ю., Bai, X., He, F., Zhang, X., Wang, Z., Zhang, W.: Теоретическое исследование молекулярных анионов инертных газов XAuNgX − и HAuNgX − (X = F, Cl, Br; Ng = Xe, Kr, Ar). Структура хим. 23 (6), 1693–1710 (2012)
Статья Google Scholar
Лю, Ю.-Л., Чанг, Ю.-Х., Ли, Т.-Х., Чен, Х.-Р., Ху, В.-П.: Теоретическое исследование благородных газовые анионы F − (NgO) n (Ng = He, Ar и Kr).хим. физ. лат. 439 (1–3), 14–17 (2007)
Статья Google Scholar
Локйер, Дж. Ф., Дуглас, К., Прайс, С. Д., Карвовска, М., Фиялковски, К. Дж., Грочала, В., Ремеш, М., Ройтова, Дж., Шредер, Д.: Генерация ArCF 2 2+ обозначение. Дж. Физ. хим. лат. 1 (1), 358–362 (2010)
Ф., Дуглас, К., Прайс, С. Д., Карвовска, М., Фиялковски, К. Дж., Грочала, В., Ремеш, М., Ройтова, Дж., Шредер, Д.: Генерация ArCF 2 2+ обозначение. Дж. Физ. хим. лат. 1 (1), 358–362 (2010)
Статья Google Scholar
Ловалло, К.C., Kłobukowski, M.: Связь переходного металла с благородным газом: следующий рубеж. хим. физ. лат. 368 (5), 589–593 (2003)
Статья Google Scholar
Лунделл, Дж., Чабан, Г.М., Гербер, Р.Б.: Комбинированные расчеты ab initio и ангармонической колебательной спектроскопии для инертных газов, содержащих фторгидриды, HRgF. хим. физ. лат. 331 (2–4), 308–316 (2000)
Статья Google Scholar
Макдауэлл, С.А.К.: Являются ли H–He–Cl и H–Ne–Cl метастабильными частицами? Вычислительное исследование. хим. физ. лат. 342 (5–6), 631–635 (2001)
Статья Google Scholar
Мяо, М.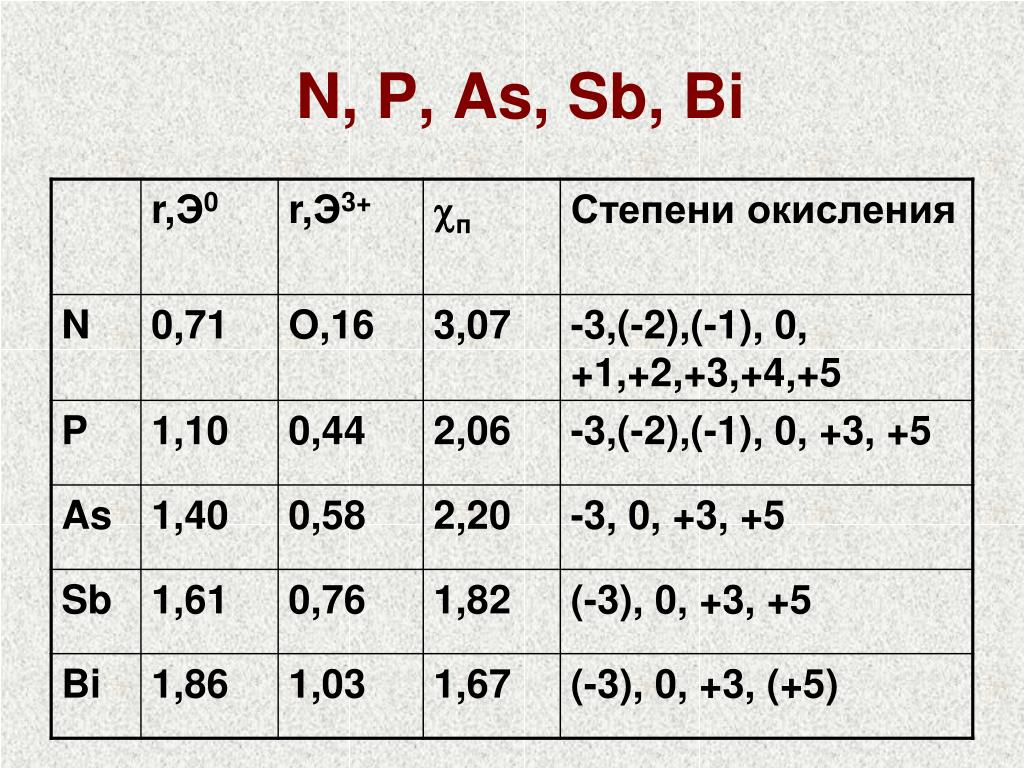 : Реагируйте благородно. Нац. хим. 9 , 409–410 (2017)
: Реагируйте благородно. Нац. хим. 9 , 409–410 (2017)
Статья Google Scholar
Naumann, D., Tyrra, W.: Первое соединение со стабильной ксенон-углеродной связью: 19 F- и 129 Xe-n.Мистер. спектроскопические данные о фторборатах пентафторфенилксенона (II). Дж. Хим. соц. хим. коммун. 1 , 47–50 (1989)
Статья Google Scholar
Новаро, О.: О подобающем Хе месте в периодической таблице. Нашел. хим. 10 , 3–12 (2008)
Статья Google Scholar
Пан С., Морено Д., Гош С., Чаттарадж П.К., Мерино, Г.: Структура и стабильность соединений благородных газов, связанных EX 3 + (E = C, Ge, Sn, Pb; X = H, F, Cl, Br). Дж. Вычисл. хим. 37 (2), 226–236 (2016)
Статья Google Scholar
Пишон, А. : Письмо о «Неоне за вывесками». Блог Nature Chemistry «Скептический химик» (2013). http://blogs.nature.com/thescepticalchymist/2013/12/a-letter-about-neon-behind-the-signs.html
: Письмо о «Неоне за вывесками». Блог Nature Chemistry «Скептический химик» (2013). http://blogs.nature.com/thescepticalchymist/2013/12/a-letter-about-neon-behind-the-signs.html
Пюиккё, П.: Физика, стоящая за химией, и периодическая таблица. хим. Ред. 112 (1), 371–384 (2012)
Статья Google Scholar
Pyykkö, P.: Предлагаемая периодическая таблица до Z ≤ 172, основанная на расчетах Дирака-Фока для атомов и ионов. физ. хим. хим. физ. 13 (1), 161–168 (2011)
Статья Google Scholar
Ренуф, Э.: Благородные газы.Наука 13 (320), 268–270 (1901)
Статья Google Scholar
Roithová, J., Schröder, D.: Кремниевые соединения неона и аргона. Ангью. хим. Междунар. Эд. 48 (46), 8788–8790 (2009)
Артикул Google Scholar
Жепа, Х. : Рациональный дизайн гелиевых связей. Нац. хим. 2 (5), 390–393 (2010)
: Рациональный дизайн гелиевых связей. Нац. хим. 2 (5), 390–393 (2010)
Статья Google Scholar
Саманта, Д.: Прогнозирование соединений благородных газов, стабилизированных супергалогенами. Дж. Физ. хим. лат. 5 (18), 3151–3156 (2014)
Артикул Google Scholar
Шерри, Э.Р.: Представление периодической таблицы с левым шагом. Образовательный хим. 42 , 135–136 (2005а)
Google Scholar
Шерри, Э.: Некоторые аспекты метафизики химии и природы элементов.HYLE-Int. Дж. Фил. хим. 11 , 127–145 (2005б)
Google Scholar
Шерри, Э. Р.: Периодическая таблица: ее история и ее значение. Издательство Оксфордского университета, Оксфорд (2007)
Google Scholar
Шерри, Э. Р.: периодические изменения. хим. Мир 3 , 46–49 (2009)
Р.: периодические изменения. хим. Мир 3 , 46–49 (2009)
Google Scholar
Сиборг, Г.Т.: Перспективы дальнейшего значительного расширения таблицы Менделеева. Дж. Хим. Образовательный 46 (10), 626–634 (1969)
Статья Google Scholar
Сеппельт, К.: Молекулярные гексафториды. хим. 115 (2), 1296–1306 (2015)
Статья Google Scholar
Стюарт, П.Дж.: Чарльз Джанет: непризнанный гений периодической системы. Нашел.хим. 12 (1), 5–15 (2010)
Статья Google Scholar
Schrobilgen, GJ, Moran, MD: Соединения инертных газов. В: Зайдель, А., Бикфорд, М. (ред.) Энциклопедия химической технологии Кирка-Отмера, том. 16. Уайли, Лондон (2003)
Google Scholar
Schwarz, WHE: 100 лет модели атома Бора. Ангью. хим. Междунар. Эд. 52 (47), 12228–12238 (2013)
Ангью. хим. Междунар. Эд. 52 (47), 12228–12238 (2013)
Артикул Google Scholar
Зеппельт, К., Зайдель, С.: Ксенон как сложный лиганд: катион тетраксеноно золота (II) в AuXe 4 2+ (Sb 2 F 11 — ) 2 . Наука 290 (5489), 117–118 (2000)
Статья Google Scholar
Schwarz, WHE (2016) Письмо автору (июль 2016 г.)
Stowe, T.: A Physicist’s Chart of the Chemical Elements. Инструменты Research and Industry Inc., Винкот (1989)
Google Scholar
Шарек, П., Грочала, В.: Моноксиды благородных газов, стабилизированные в диполярной полости: теоретическое исследование. Дж. Физ. хим. А 119 (11), 2483–2489 (2015)
Артикул Google Scholar
Такаянаги, Т. , Вада, А.: Теоретическое предсказание времени жизни метастабильного соединения гелия: HHeF. хим. физ. лат. 352 (1–2), 91–98 (2002)
, Вада, А.: Теоретическое предсказание времени жизни метастабильного соединения гелия: HHeF. хим. физ. лат. 352 (1–2), 91–98 (2002)
Статья Google Scholar
Тарантола, А.: Периодическая таблица элементов, основанная на электронной структуре атомов. (2000) chemistry/0009002
Тарантола, А.: Периодическая таблица элементов и потенциалы ионизации. (2002) physchem/0201017
Томпсон, К.А., Эндрюс, Л.: Комплексы инертных газов с BeO — инфракрасные спектры NG-BeO (NG = Ar, Kr, Xe). Варенье. хим. соц. 116 (1), 423–424 (1994)
Статья Google Scholar
Вос, В.Л., Фингер, Л.В., Хемли, Р.Дж., Ху, Дж.З., Мао, Х.К., Схоутен, Дж.А.: Ван-дер-Ваальсово соединение высокого давления в твердых азотно-гелиевых смесях. Природа 358 , 46–48 (1992)
Статья Google Scholar
Ван, С.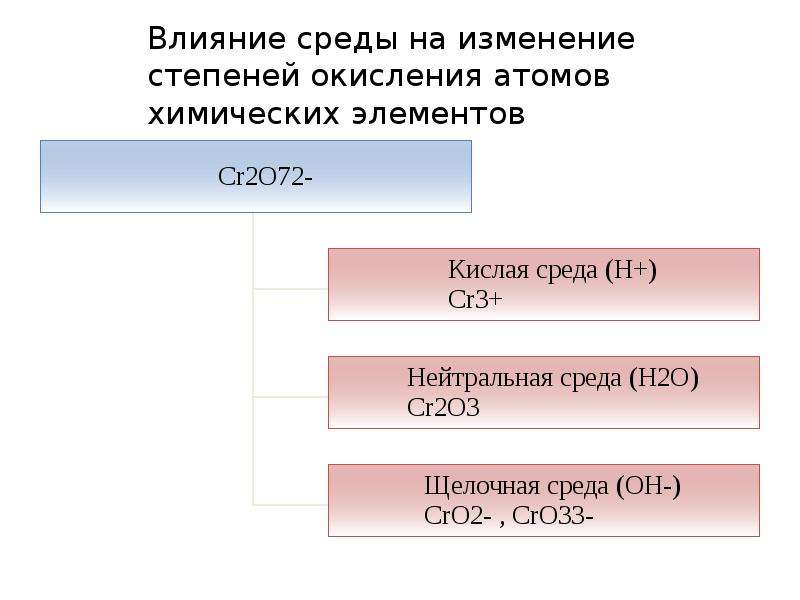 -Г., Шварц, В.Е.: Икона химии: периодическая система химических элементов в новом веке. Ангью. хим. Междунар. Эд. 48 (19), 2–14 (2009)
-Г., Шварц, В.Е.: Икона химии: периодическая система химических элементов в новом веке. Ангью. хим. Междунар. Эд. 48 (19), 2–14 (2009)
Статья Google Scholar
Ван Х., Эндрюс Л., Брози Ф., Ридель С.: Матричная инфракрасная спектроскопия и квантово-химические расчеты для фторидов чеканных металлов: сравнение Ar-AuF, Ne-AuF и молекул MF 2 и MF 3 . хим. Евро. J. 19 (4), 1397–1409 (2013)
Статья Google Scholar
Ван, К., Ван, X.: Инфракрасные спектры NgBeS (Ng = Ne, Ar, Kr, Xe) и BeS 2 в матрицах благородных газов. Дж. Физ.хим. А 117 (7), 1508–1513 (2013)
Артикул Google Scholar
Wilson, DJD, Marsden, CJ, von Nagy-Felsobuki, EI: Ab initio структуры и стабильность двухзарядных двухатомных металлических гелидов для переходных металлов первого ряда. Дж. Физ. хим. A 106 (32), 7348–7354 (2002)
Дж. Физ. хим. A 106 (32), 7348–7354 (2002)
Артикул Google Scholar
Вонг, М.В.: Прогноз метастабильного соединения гелия: HHeF. Варенье. хим. соц. 122 (26), 6289–6290 (2000)
Артикул Google Scholar
Чжу, К., Юнг, Д.Ю., Оганов, А.Р., Гласс, К.В., Гатти, К., Ляхов, А.О.: Стабильность оксидов ксенона при высоких давлениях. Нац. хим. 5 (1), 61–65 (2013)
Статья Google Scholar
Чжу, Л., Лю, Х., Пикард, С.Дж., Зоу, Г., Ма, Ю.: Прогнозируются реакции ксенона с железом и никелем во внутреннем ядре Земли. Нац. хим. 6 (7), 644–648 (2014)
Статья Google Scholar
Цзоу, Л., Лю, Ю., Боггс, Дж. Э.: Теоретическое исследование RgMF (Rg = He, Ne; M = Cu, Ag, Au): связанные структуры гелия. хим. физ. лат. 482 (4–6), 207–210 (2009)
лат. 482 (4–6), 207–210 (2009)
Статья Google Scholar
Цзоу, В., Нори-Шарг, Д., Боггс, Дж. Э.: О ковалентном характере связывающих взаимодействий инертных газов: новый вид слабого взаимодействия. Дж. Физ. хим. А 117 (1), 207–212 (2013)
Статья Google Scholar
Это Элементаль — Элемент Гелий
Скажи что? Гелий произносится как HEE-lee-em .
Гелий, второй по распространенности элемент во Вселенной, был обнаружен на Солнце раньше, чем на Земле.Пьер-Жюль-Сезар Янссен, французский астроном, заметил желтую линию в солнечном спектре, изучая полное солнечное затмение в 1868 году. Сэр Норман Локьер, английский астроном, понял, что эта линия с длиной волны 587,49 нанометров не может быть произведено любым элементом, известным в то время. Была выдвинута гипотеза, что за это загадочное желтое излучение ответственен новый элемент на Солнце. Этот неизвестный элемент Локьер назвал гелием.
Этот неизвестный элемент Локьер назвал гелием.
Охота за гелием на Земле завершилась в 1895 году.Сэр Уильям Рамсей, шотландский химик, провел эксперимент с минералом, содержащим уран, под названием клевит. Он подверг клевит воздействию минеральных кислот и собрал образовавшиеся газы. Затем он отправил образец этих газов двум ученым, Локьеру и сэру Уильяму Круксу, которые смогли идентифицировать в нем гелий. Два шведских химика, Нильс Ланглет и Пер Теодор Клив, независимо друг от друга обнаружили гелий в клевите примерно в то же время, что и Рамзи.
Гелий составляет около 0.0005% земной атмосферы. Это следовое количество гелия не связано гравитацией с Землей и постоянно теряется в космосе. Земной атмосферный гелий заменяется распадом радиоактивных элементов в земной коре. Альфа-распад, один из видов радиоактивного распада, производит частицы, называемые альфа-частицами. Альфа-частица может стать атомом гелия, если захватит два электрона из своего окружения. Этот новообразованный гелий в конечном итоге может попасть в атмосферу через трещины в земной коре.
Гелий добывается в коммерческих целях из месторождений природного газа, в основном из Техаса, Оклахомы и Канзаса. Газообразный гелий используется для надувания дирижаблей, научных шаров и шаров для вечеринок. Он используется в качестве инертного экрана при дуговой сварке, для герметизации топливных баков ракет на жидком топливе и в сверхзвуковых аэродинамических трубах. Гелий в сочетании с кислородом создает безазотную атмосферу для глубоководных дайверов, чтобы они не страдали от состояния, известного как азотный наркоз. Жидкий гелий является важным криогенным материалом и используется для изучения сверхпроводимости и создания сверхпроводящих магнитов.Лаборатория Джефферсона Министерства энергетики использует большое количество жидкого гелия для работы своего сверхпроводящего ускорителя электронов.
Гелий — инертный газ, который трудно сочетается с другими элементами. Нет известных соединений, содержащих гелий, хотя предпринимаются попытки получить дифторид гелия (HeF 2 ).
Ионы | |
| Протоны и электроны | На каждый протон в атомном центре где-то на орбите приходится электрон.Протон несет положительный заряд (+), а электрон несет отрицательный заряд (-), поэтому атомы элементов нейтральны, все положительные заряды компенсируют все отрицательные заряды. Атомы отличаются друг от друга количеством содержащихся в них протонов, нейтронов и электронов. Однако их расположение всегда следует одному и тому же набору принципов. |
| Вопрос стабильности | Водород и гелий иллюстрируют тот факт, что не все атомы обладают одинаковыми свойствами. Оба являются газами, но газообразный водород взрывоопасен, тогда как газообразный гелий полностью инертен и не может подвергаться каким-либо химическим реакциям при нормальных обстоятельствах. Оба являются газами, но газообразный водород взрывоопасен, тогда как газообразный гелий полностью инертен и не может подвергаться каким-либо химическим реакциям при нормальных обстоятельствах.Атомы водорода имеют один протон в центре и один электрон на самом низком энергетическом уровне. Атомы гелия, с другой стороны, имеют два протона и два электрона на самом низком энергетическом уровне. Нижний энергетический уровень заполнен максимальным количеством электронов. Это очень стабильное устройство, и, следовательно, гелий представляет собой инертный газ с небольшими химическими свойствами. Водород имеет только один электрон на самом низком энергетическом уровне. Это очень нестабильное устройство, и газообразный водород подвергается множеству реакций, чтобы достичь стабильной электронной конфигурации, где его энергетический уровень либо пуст от электронов, либо заполнен электронами. Атомы наиболее стабильны, когда их внешний энергетический уровень либо свободен от электронов, либо заполнен электронами. |
| Ионы | Атомы натрия имеют 11 электронов.Два из них находятся на самом низком энергетическом уровне, восемь — на втором энергетическом уровне, а затем один электрон — на третьем энергетическом уровне. Это очень нестабильная структура, а элемент натрия представляет собой высокореактивное, смертоносное белое полутвердое вещество, которое воспламеняется на воздухе или прожигает человеческую плоть при контакте. Реактивное вещество. Атомы хлора имеют 17 электронов. Два на низшем, восемь на втором и 7 на третьем энергетическом уровне. Это тоже очень нестабильная схема.Этот элемент представляет собой газ при комнатной температуре и использовался во время Первой мировой войны в качестве отравляющего оружия из-за его высокой реактивности с легкими человека. Эти два атома были созданы друг для друга. Атомы натрия легко отдают единственный электрон на самой внешней орбитали. Однако за эту стабильность приходится платить. Отдавая электрон, атом натрия теряет отрицательный электрический заряд. У него все еще есть все положительно заряженные протоны, поэтому оставшаяся структура больше не является электрически нейтральной. Он имеет чистый положительный заряд (+). Точно так же атом хлора получил этот дополнительный отрицательный заряд и не имеет дополнительных протонов, поэтому теперь он несет чистый отрицательный заряд (-). Эти новые атомные структуры называются ионами , а процесс электронного обмена называется ионизацией . |
| Ионные связи | Ионные связи представляют собой тип связи, образованный притяжением между противоположно заряженными ионами. Такие связи создаются, когда самые внешние электроны одного атома (например, натрия) постоянно передаются другому атому (например, хлору). Атом, потерявший электрон, становится положительно заряженным ионом (называемым катионом ), а атом, подхватывающий лишний электрон, становится отрицательно заряженным ионом (называемым анионом ). Такие связи создаются, когда самые внешние электроны одного атома (например, натрия) постоянно передаются другому атому (например, хлору). Атом, потерявший электрон, становится положительно заряженным ионом (называемым катионом ), а атом, подхватывающий лишний электрон, становится отрицательно заряженным ионом (называемым анионом ).Разноименные заряды притягиваются друг к другу, а одноименные отталкиваются. Итак, ионы ориентируются таким образом, что каждый положительный ион оказывается окруженным отрицательными ионами, а каждый отрицательный ион оказывается окруженным положительными ионами. Ионы устроены таким образом, что положительные и отрицательные заряды чередуются и уравновешивают друг друга. Хлорид натрия — это твердая пищевая добавка, которая более стабильна, чем любая из ее составляющих, а все потому, что самые внешние энергетические уровни ее атомов заполнены электронами. |
. .. теперь вы исследуете .. теперь вы исследуете ионы для себя. | |
Окислительно-восстановительные реакции
Окислительно-восстановительные реакцииОкислительно-восстановительное (окислительно-восстановительные реакции)
Задача A Зная формулу нейтральной или заряженной молекулы, определите степень окисления для каждого атома в молекуле.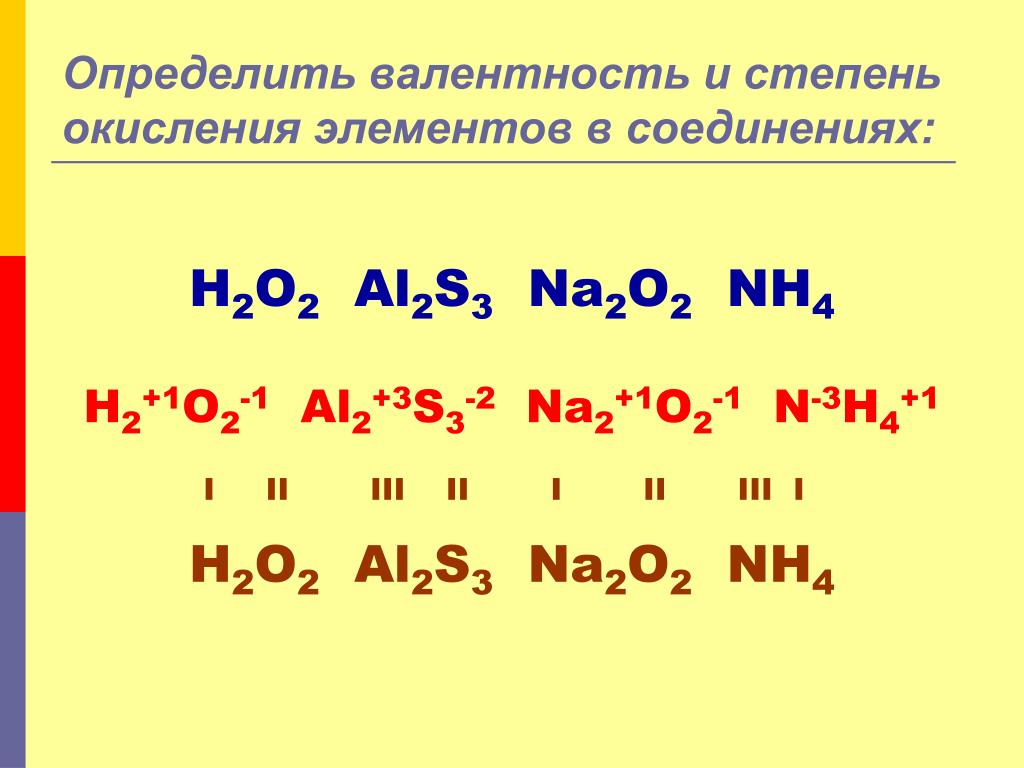
Число окисления: заряд, присвоенный атому в соответствии с набором правил. Его цель — помочь вам отслеживать движение электронов от одного атома или молекулы к другому.
Они не обязательно представляют собой настоящий заряд.Правила:
1. Степень окисления атома любого свободного элемента равна НОЛЬ.
Элемент | Число окисления каждого атома |
металлический натрий, Na | 0 |
газообразный гелий He | 0 |
Си | 0 |
Степень окисления любого атома в молекуле одного элемента также равна НОЛЬ.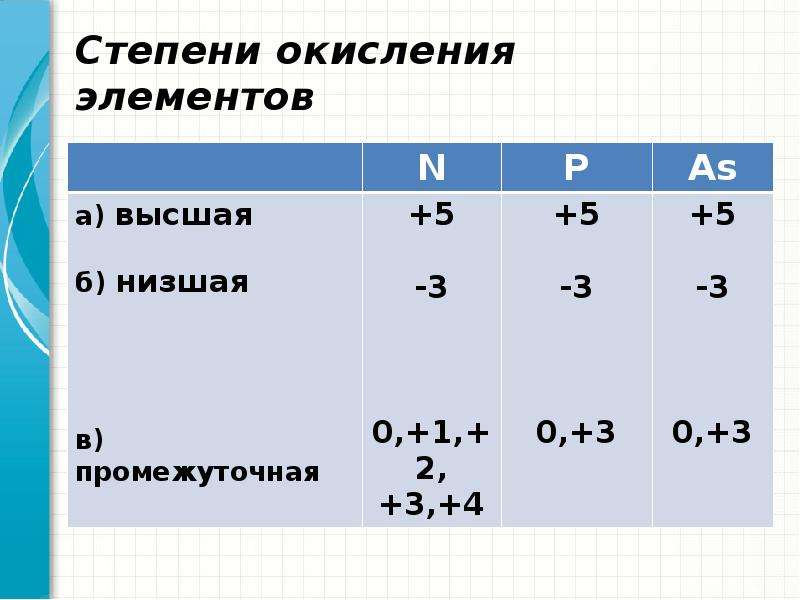
Элемент | Число окисления каждого атома |
хлор, Cl 2 | 0 |
сера, S 8 | 0 |
Фосфор, Р 5 | 0 |
2.Степень окисления водорода в Н-содержащем соединении составляет
+1.
Соединение | Степень окисления каждого атома Н | Итого вклад по H |
Н 2О | +1 | +2 |
HNO 3 | +1 | +1 |
Н 2 О 2 | +1 | +2 |
Исключение: в гидридах металлов степень окисления водорода составляет
-1.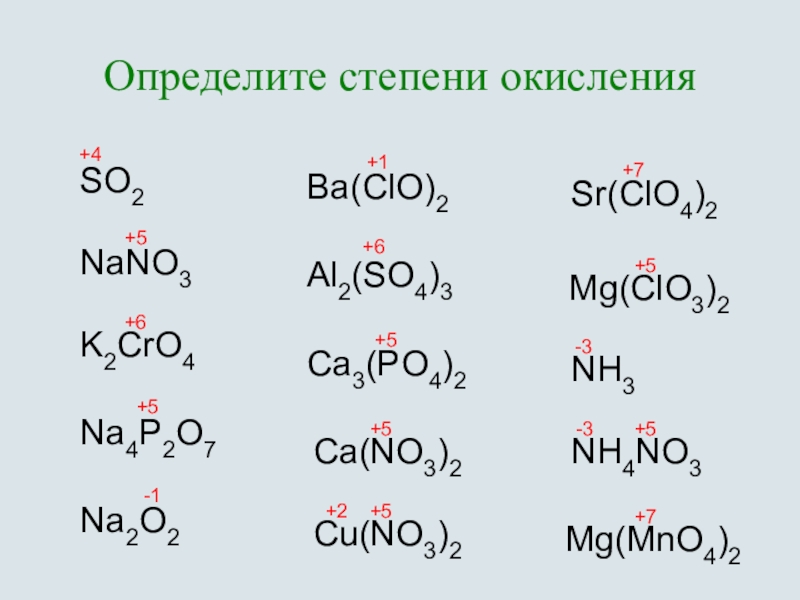
гидрид металла имеет водородную связь с металлом.
Соединение | Число окисления каждого атома Н | Общий вклад H |
CaH 2 | -1 | -2 |
NaH | -1 | -1 |
АлХ 3 | -1 | -3 |
Хорошая смесь того, что мы видели до сих пор:
Соединение | Число окисления каждого атома Н | Общий вклад H |
Х 2С | +1 | +2 |
МгН 2 | -1 | -2 |
Н 2 | 0 | 0 |
3.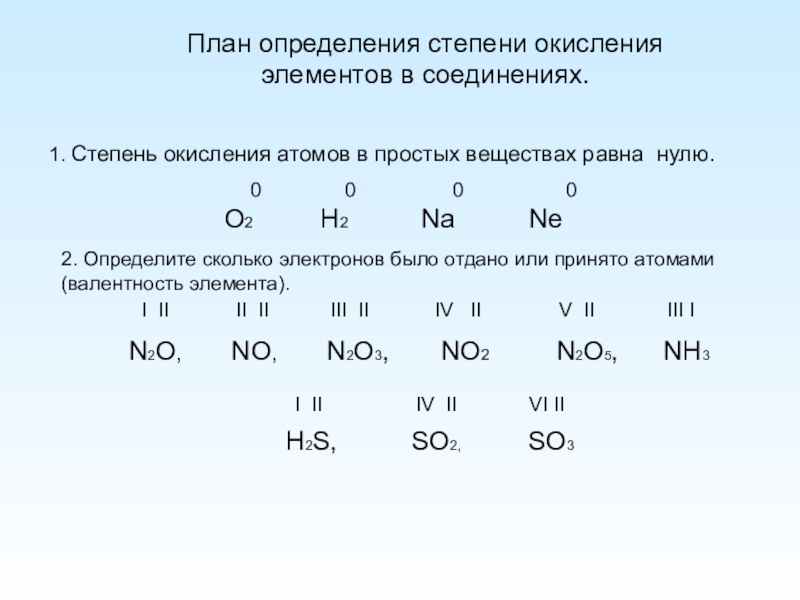 Степень окисления кислорода
Степень окисления кислорода
Соединение | Число окисления каждого атома О | Общий вклад O |
Н 2О | -2 | -2 |
№ 2 | -2 | -4 |
НЕТ 3 -1 | -2 | -6 |
Исключение: в пероксидах, содержащих один дополнительный кислород, каждому кислороду присваивается степень окисления -1.
нормальный оксид: H
2 Oперекись: H
2O2
4. Окисление одноатомного иона равно его заряду. Для членов металлических семейств можно обратиться к периодической таблице. Кроме того, галогениды (металл + галоген) будут -1.
Соединение | Число окисления каждого атома металла | Общий вклад ионов металлов |
На 2О | +1 = Na | +2 |
Ал 2 С 3 | +3 = Ал | +6 |
CaCl 2 | +2 = Ca | +2 |
5. Сумма степеней окисления всех атомов в соединении равна НОЛЬ.
Сумма степеней окисления всех атомов в соединении равна НОЛЬ.
Сумма всех степеней окисления всех атомов в многоатомном ионе равна заряду многоатомного иона.
Пример: Н
2 ОКаждый водород = +1; кислород -2.
2
(1) + (-2) = 0.Пример: SO
4 -2Каждый O = -2; С неизвестно.
х +
4 (-2) = -2.X = 6. Значит, степень окисления серы равна 6.
Дополнительные примеры:
Используйте пять правил для присвоения степеней окисления каждому элементу в следующем:
- НЕТ 2 -1
Каждый O = -2
х +2(-2) = -1
X = 3. Таким образом, степень окисления N равна +3.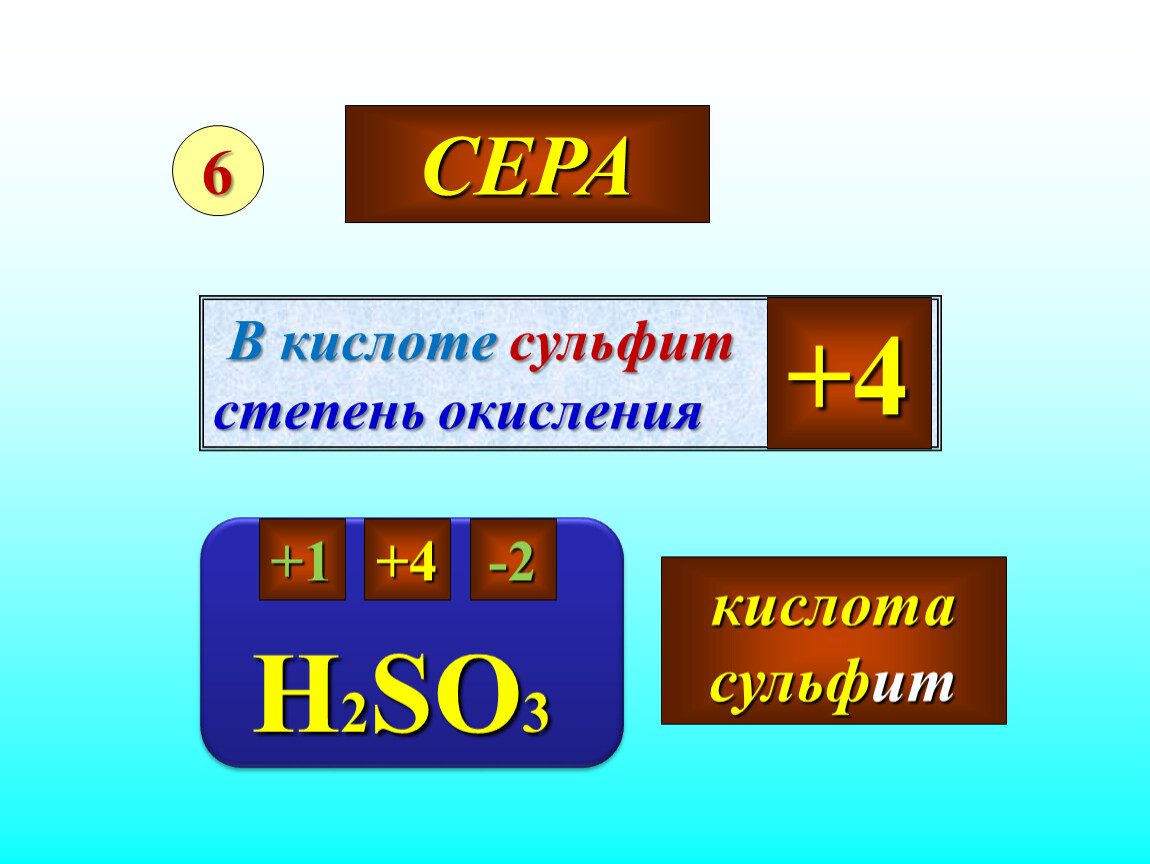
б.КМнО
4К = +1
О = -2
Мн = х
1 + х +
4(-2) =0x = 7 = степень окисления Mn
с. MnO
2х +
2(-2) = 0x = 4. Обратите внимание, как степень окисления Mn может варьироваться от одного соединения к другому.
- С
3
х + 8( + 1) = 0х = -8/3 ( Да.Номера окисления могут быть дробными!)
Упражнения:
1. Используйте пять правил, чтобы присвоить степени окисления каждому элементу в следующем:
а. MnO
MnO
б. С
2H6с. Хе
д. Fe
3O4эл. OF
2 (правило фтора имеет приоритет)ф.Н
2О2г. СН
4час. Кр
2О7-2я. С
2Н6ОДж. С
2х3км. XeOF
4л. Na
2C2O4м. Са(НО
3)2с. УО
2+2о. NaBiO
3р. НХ
3кв. Н
3AsO4р. Ал(ОН)
-1с. №
2
Гелий – написанная экспертом, удобная для пользователя информация об элементе
Химический элемент гелий классифицируется как благородный газ и неметалл.Он был открыт в 1895 году Уильямом Рамзи.
Зона данных
| Классификация: | Гелий — благородный газ и неметалл |
| Цвет: | бесцветный |
| Атомный вес: | 4.00260 |
| Состояние: | газ |
| Температура плавления: | -272,2 или С, 0,95 К |
| Примечание. При нормальном атмосферном давлении гелий не затвердевает и поэтому не имеет точки плавления.Указанная выше температура плавления находится под давлением 25 атмосфер. | |
| Точка кипения: | -268,9 или С, 4,2 К |
| Электроны: | 2 |
| Протоны: | 2 |
| Нейтроны в наиболее распространенном изотопе: | 2 |
| Электронные оболочки: | 2 |
| Электронная конфигурация: | 1с 2 |
| Плотность @ 20 o C: | 0.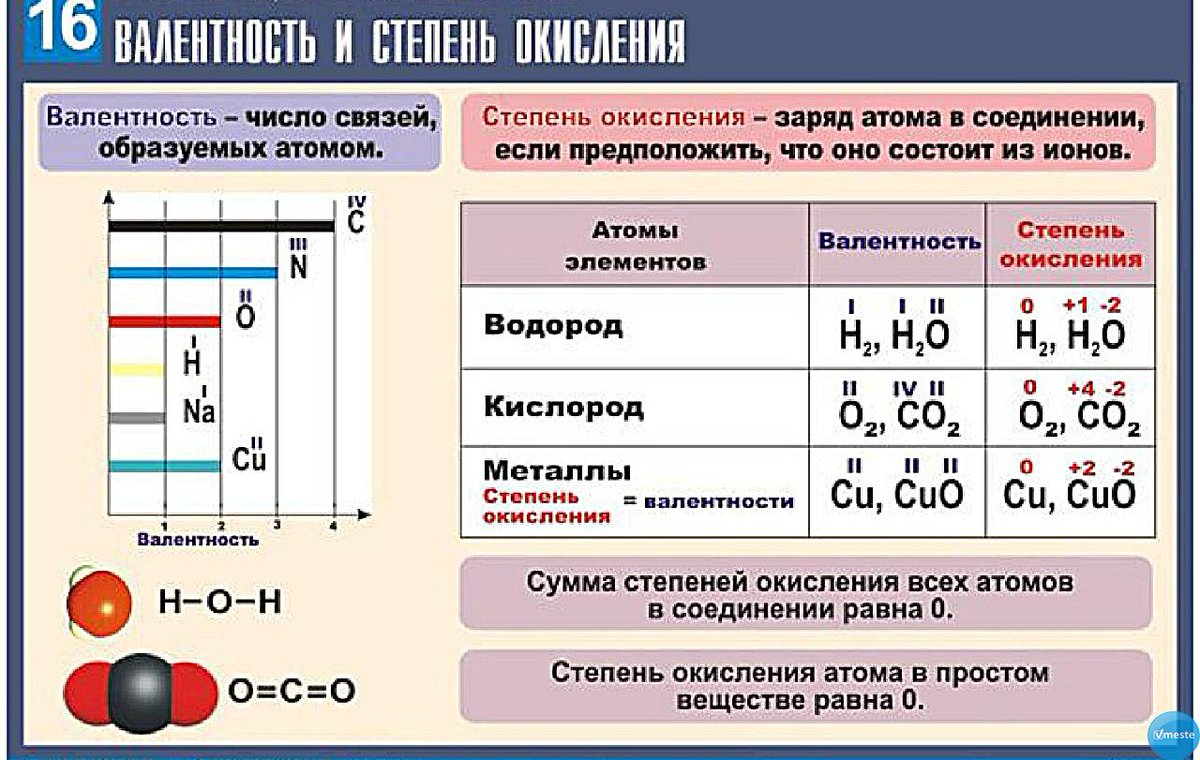 0001787 г/см 3 0001787 г/см 3 |
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 27,2 см 3 /моль |
| Структура: | обычно шестигранная, плотно упакованная |
| (для отверждения гелия требуется высокое давление) | |
| Удельная теплоемкость | 5,193 Дж г -1 К -1 |
| Теплота плавления | 0.0138 кДж моль -1 |
| Теплота распыления | 0 |
| Теплота парообразования | 0,0845 кДж моль -1 |
| 1 ст энергия ионизации | 2372,3 кДж моль -1 |
| 2 nd энергия ионизации | – |
| 3 rd энергия ионизации | – |
| Сродство к электрону | 0 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 0 |
| Макс. общее окисление нет. | 0 |
| Электроотрицательность (шкала Полинга) | – |
| Объем поляризуемости | 0,198 Å 3 |
| Реакция с воздухом | нет |
| Реакция с 15 M HNO 3 | нет |
| Реакция с 6 М HCl | нет |
| Реакция с 6 М раствором NaOH | нет |
| Оксид(ы) | нет |
| Гидрид(ы) | нет |
| Хлорид(ы) | нет |
| Атомный радиус | 31:00 |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ион) | – |
| Ионный радиус (3+ ион) | – |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 0. 15 Вт·м -1 К -1 15 Вт·м -1 К -1 |
| Электропроводность | – |
| Температура замерзания/плавления: | -272,2 или С, 0,95 К |
НАСА: Ионизированные атомы гелия при температуре около 60 000 °C в хромосфере Солнца излучают ультрафиолетовый свет, видимый на этом изображении.
Гелий был создан в первые три минуты существования Вселенной, когда везде температура была достаточно высокой для осуществления ядерного синтеза.Эта короткая высокоэнергетическая фаза представлена в самом низу диаграммы. Гелий также производится ядерным синтезом водорода в звездах, подобных нашей. Изображение: Гниксон
Гелий на Земле образуется в результате ядерного деления радиоактивных элементов, таких как уран. Здесь радиоактивное ядро испускает ядро гелия (также известное как альфа-частица). Изображение: Индуктивная нагрузка
Спектр гелия с заметной желтой линией. Изображение: НАСА
Уильям Рамзи указывает на последний столбец таблицы Менделеева, содержащий благородные (или инертные) газы. Рамзи был удостоен Нобелевской премии по химии в 1904 году за работу по открытию инертных газов. Изображение: Ярмарка тщеславия
Рамзи был удостоен Нобелевской премии по химии в 1904 году за работу по открытию инертных газов. Изображение: Ярмарка тщеславия
Открытие гелия
Доктор Дуг Стюарт
История открытия гелия переплетается с открытием природы звезд.
Когда-то люди считали, что мы никогда не узнаем, из чего состоят звезды. В 1835 году французский философ Огюст Конт заявил: «Мы никогда не сможем никаким образом изучить их химический состав. (1)
Конт думал, что мы сможем узнать, что такое звездное вещество, только если доставим его в лабораторию.
Несмотря на пессимизм Конта, метод для открытия гелия и составов звезд уже был найден. В 1814 году немецкий физик Йозеф Фраунгофер воспользовался методом Исаака Ньютона разделения солнечного света с помощью призмы и сделал важный шаг вперед. Фраунгофер заметил темные линии в радуге цветов, исходящих от солнечного света, разделенного призмой; линии, которые он увидел, были первым в истории наблюдением спектра звезды. (2), (3)
(2), (3)
В 1859–1860 годах немецкие ученые Густав Кирхгоф и Роберт Бунзен совершили огромный скачок в науке о спектроскопии, в том числе открыли, что темные линии, которые видел Фраунгофер, подобны отпечаткам пальцев вещества.
Сцена была создана для того, чтобы Кирхгоф и Бунзен открыли новые элементы, изучая свет от горящих веществ.
В 1860 г. они открыли цезий по его синим спектральным линиям, а в 1861 г. рубидий по двум красным спектральным линиям.Затем Уильям Крукс открыл таллий в 1861 году после наблюдения ярко-зеленой спектральной линии.
Кирхгоф и Бунзен изучили спектр Солнца и смогли сделать вывод, что в его светящейся атмосфере присутствует железо. (4)
Для открытия гелия понадобилось еще несколько лет. В августе 1868 года должно было произойти первое полное затмение после публикации работы Кирхгофа и Бунзена.
Французский астроном Пьер Янссен ждал затмения, чтобы с помощью спектроскопа наблюдать протуберанцы в солнечной короне. В течение двух недель после затмения Янссен разработал метод записи спектров протуберанцев без учета затмения. В этих спектрах он наблюдал желтую линию. (5)
В течение двух недель после затмения Янссен разработал метод записи спектров протуберанцев без учета затмения. В этих спектрах он наблюдал желтую линию. (5)
Линия находилась в том же, но не идентичном положении, что и линии в спектре натрия. Они были названы линиями D 1 и D 2 . Английский ученый Норман Локьер изучал новую желтую линию; позже она будет называться линией D 3 . Он опубликовал свое исследование линии, зная, что она может быть вызвана новым элементом:
.«…так мы тогда знали, что имеем дело не с водородом; следовательно, мы имели дело с элементом, который мы не могли получить в наших лабораториях, и поэтому я взял на себя ответственность за создание слова гелий, в первую очередь для лабораторного использования. (6)
Название гелий произошло от греческого слова, обозначающего солнце, helios.
Локьер и его коллега Эдвард Франкленд имели ряд других идей о возможных причинах желтой линии и поэтому не объявляли о новом элементе.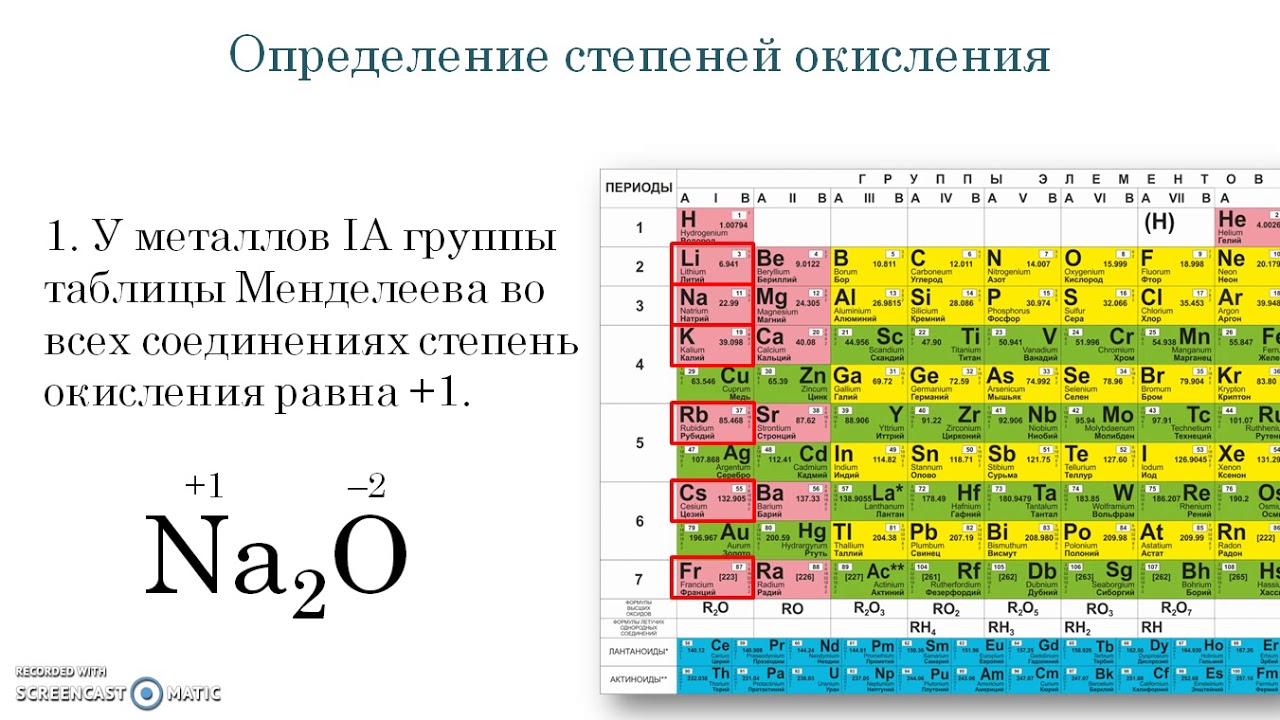
К 1871 году другие ученые знали о ситуации. Лорд Кельвин обсуждал «отражение света светящегося водорода и «гелия» вокруг Солнца». После использования слова «гелий» следует поясняющая сноска:
.«Франкленд и Локьер находят, что желтые протуберанцы дают очень четкую яркую линию недалеко от D, но до сих пор не отождествляемую ни с каким земным пламенем.Кажется, это указывает на новое вещество, которое они предлагают назвать гелием». (7)
Однако существованиеГелия было признано не всеми. (5)
Все сомнения развеялись, когда шотландский химик Уильям Рамзи выделил гелий в 1895 году в Лондоне. Рамзи открыл аргон в 1894 году; аргон был открыт первым из благородных газов. В 1895 году он прочитал статью Уильяма Хиллебранда, в которой описывался нереакционноспособный газ, выделяющийся при добавлении кислоты к урановому минералу, ураниту.Хиллебранд полагал, что газ был азотом. [Теперь мы знаем, что уран выделяет гелий во время радиоактивного распада. Существование радиоактивности не признавалось до 1896 года, когда была опубликована работа Анри Беккереля.]
Существование радиоактивности не признавалось до 1896 года, когда была опубликована работа Анри Беккереля.]
Рамзи, который считал, что газ может содержать аргон, повторил эксперимент Хиллебранда, используя другой урановый минерал, клевеит, и собрал газ.
Его спектроскоп показал присутствие азота, аргона и еще одного газа. Рамзи подозревал, что это мог быть гелий, потому что там была линия D 3 . (8) Зная, что у Локьера и Уильяма Крукса спектроскоп лучше, чем у него, он отправил им образец газа. К сожалению, образец не подходил, поэтому Локьер взял образец уранита, выделил газ и исследовал его с помощью спектроскопа. Он пишет: (8)
«Одна за другой неизвестные линии, которые я наблюдал на Солнце в 1868 году, оказались принадлежащими газу».
Спектр газа был идентичен солнечному «гелию». Новый элемент занял свое место в таблице Менделеева.
Посетите страницу Chemicool с интересными фактами о гелии.
youtube.com/embed/D0ekzbFU8EY?rel=0″ allowfullscreen=»»/>
Большинство людей знают, как звучит речь после вдоха гелия. Если нет, то слушайте сюда. А как насчет гексафторида серы?
При температуре, близкой к абсолютному нулю, гелий становится сверхтекучим. Как он будет себя вести?
Внешний вид и характеристики
Вредное воздействие:
Гелий не является токсичным.
Характеристики:
Гелий — легкий, бесцветный, инертный, одноатомный газ без запаха. Он может образовывать двухатомные молекулы, но слабо и при температурах, близких к абсолютному нулю.
Гелий имеет самую низкую температуру плавления среди всех элементов, а его температура кипения близка к абсолютному нулю.
В отличие от любого другого элемента гелий не затвердевает, а остается жидким вплоть до абсолютного нуля (0 К) при обычном давлении.
Голос человека, вдохнувшего гелий, временно становится высоким.
Использование гелия
Магнитно-резонансная томография (МРТ) является крупнейшим потребителем гелия. Гелий используется для охлаждения сверхпроводящих магнитов МРТ-сканеров.
Гелий используется для наполнения воздушных шаров (дирижаблей) и для наддува ракет на жидком топливе.
Смеси гелия и кислорода используются в качестве искусственного «воздуха» для водолазов и других лиц, работающих под давлением. Гелий используется вместо азота в обычном воздухе, потому что после длительного погружения гелий покидает тело быстрее, чем азот, что обеспечивает более быструю декомпрессию.
Гелий используется в качестве газовой защиты вблизи дуговой сварки, предотвращая, например, любую реакцию сварных швов горячего металла с кислородом. Этот газ используется в полупроводниковой промышленности для создания инертной атмосферы для выращивания кристаллов кремния и германия. Он также используется в качестве высокотемпературного газа в производстве титана и циркония и в качестве газа-носителя в газовой хроматографии.
Изобилие и изотопы
Изобилие земной коры: 8 частей на миллиард по весу, 43 части на миллиард по молям
Изобилие солнечной системы: 23 % по весу, 7.4 % по молям
Стоимость в чистом виде: 5,2 доллара США за 100 г
Стоимость, оптом: $ за 100 г
Источник: Почти весь гелий на Земле является результатом радиоактивного распада. Основными источниками гелия являются месторождения природного газа в скважинах в Техасе, Оклахоме и Канзасе. Гелий получают фракционной перегонкой природного газа, содержащего до 7% гелия.
Изотопы: гелий имеет 8 изотопов, период полураспада которых известен, с массовыми числами от 3 до 10. Встречающийся в природе гелий представляет собой смесь двух своих стабильных изотопов, 3 He и 4 He с естественным содержанием 0.0001% и 99,999% соответственно.
Ссылки
- Огюст Конт, Cours de Philosophie Positive в Project Gutenberg
- Кейт Дж. Лейдлер, Мир физической химии, 1993, стр.
 179.
179. - Эра классической спектроскопии от MIT Spectroscopy.
- Джерард Г. Эмч, Математические и концептуальные основы физики 20-го века., 1984, Elsevier Science Publishers, стр. 211
- Хельге Краг, Солнечный элемент: пересмотр ранней истории гелия., 2009, Анналы науки, 66:2, стр. 157-182.
- Дж. Норман Локьер, Рост наших знаний о гелии., Science Progress, 1896, том 5., стр. 249
- В. Томсон, Обращение президента Британской ассоциации содействия развитию науки, 1871 г. (Адрес. XCIX).
- Сэр Норман Локьер, Место Солнца в природе., 1897, стр. 47-48
Цитировать эту страницу
Для онлайн-ссылки скопируйте и вставьте одно из следующего:
Гелий
или
Факты об элементе гелия
Чтобы процитировать эту страницу в академическом документе, используйте следующую ссылку в соответствии с MLA:
«Гелий».


 +5
+5
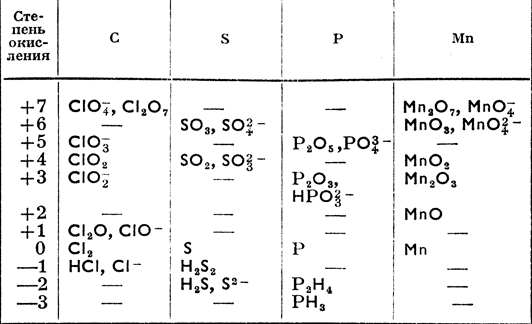 +3
+3
 Определение степени окисления в соединении
Определение степени окисления в соединении При определении степени окисления используют следующие правила:
При определении степени окисления используют следующие правила: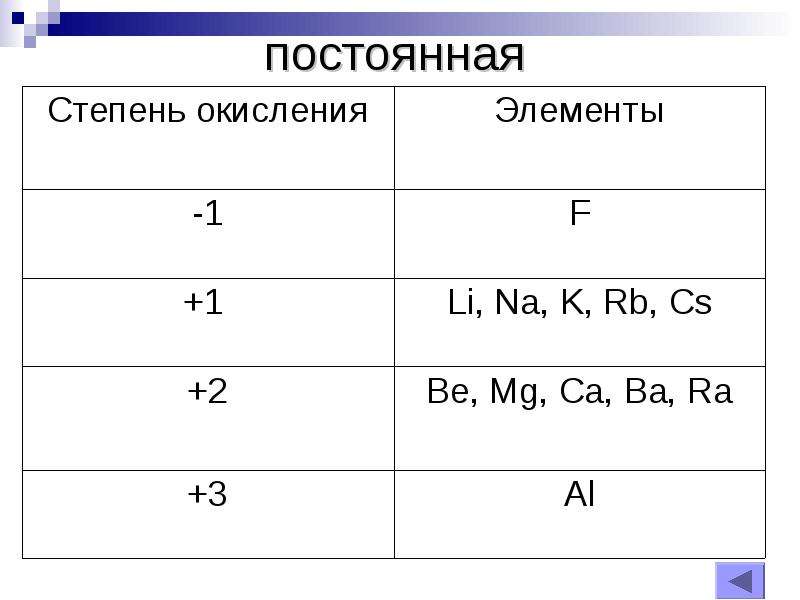 Степень окисления атома серы в ионе SO равна +6.
Степень окисления атома серы в ионе SO равна +6. Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.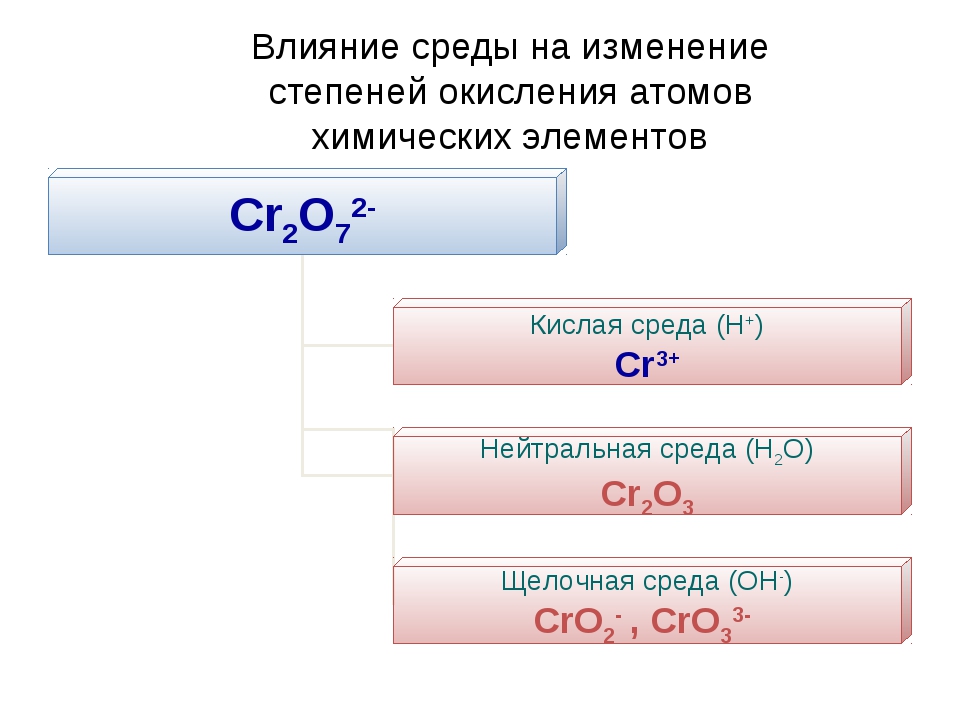
 Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3).
У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе (максимальная положительная степень окисления меди и серебра равна +2, золота +3). Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1.
Здесь три связи C-H дадут общий заряд на атоме C, он равен (Cº+3e→Cˉ³)-3. Две связи C-H дадут заряд на атоме C, который будет равен -2, связь же C→O даст заряд +1, значит общий заряд на атоме C: (-2+1=-1)-1. 2026
2026
 Этот электрон немедленно подхватывается атомом хлора и помещается в последнее пустое место на его самой внешней орбите. Теперь оба атомных устройства гораздо более стабильны. Они оба имеют крайние орбитали, заполненные электронами.
Этот электрон немедленно подхватывается атомом хлора и помещается в последнее пустое место на его самой внешней орбите. Теперь оба атомных устройства гораздо более стабильны. Они оба имеют крайние орбитали, заполненные электронами. 179.
179.