Электронные оболочки атома. Атомные модели Бора. Видеоурок. Химия 9 Класс
Атомное ядро состоит из протонов – положительно заряженных частиц и нейтронов – частиц, не имеющих заряда. На этом уроке мы рассмотрим строение электронной оболочки атома.
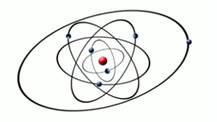
Рис. 1. Планетарная модель атома
В 1913 году датский физик Нильс Бор предположил, что атом по строению похож на строение солнечной системы. Внутри атома, также как и внутри солнечной системы солнце находится массивное ядро, в котором сосредоточена вся масса атома. А вокруг этого ядра, как и планеты вокруг солнца, вращаются электроны. Рис.1. Электрон имеет массу в 1832 раза меньшую, чем протон или нейтрон. Модель Нильса Бора была основана на модели его учителя Эрнеста Резерфорда.
Нильс Бор предположил, что электроны в атоме не хаотично движутся, а движутся по определенным орбитам. Он постулировал, то есть принял без доказательства два положения.
Постулаты Нильса Бора.
1. В атоме существуют орбиты, находясь на которых, электрон не излучает энергию. Эти орбиты называются стационарными.
2. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую.
Согласно квантовой теории строения атома, все электроны в атоме движутся по энергетическим уровням или орбитам. Эти уровни состоят из подуровней. В свою очередь подуровни состоят из атомных орбиталей. Такое строение легко себе представить, если предположить, что электронная оболочка атома – это дом, который стоит на ядре. Дом состоит из многих этажей – уровней. Каждый уровень имеет подуровни – это квартиры. В квартирах есть атомные орбитали, т.е. комнаты. Мы может определить не конкретное местонахождение электрона на орбиталях, а определить вероятность его нахождения на атомных орбиталях.
Уровни.
Электронные орбиты в модели Бора обозначаются целыми числами:1, 2, 3, 4,… и так до n, или латинскими буквами по алфавиту, начиная с буквы K, L, M, N, O P, Q. Начиная от ближайшего к ядру уровня. В дальнейшем мы будем называть такие орбиты — уровни.
Подуровни.
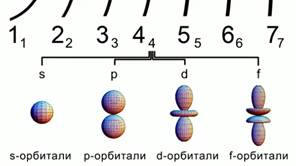
Рис. 2. Формы атомных орбиталей
Уровни в свою очередь состоят из подуровней. Число подуровней на каждом уровне равно номеру уровня. Подуровни имеют названия.
1ый подуровень каждого уровня называется S,
2-ой подуровень каждого уровня называется P,
3-ий подуровень каждого уровня называется d,
4-ий подуровень каждого уровня называется f
Орбитали существуют разной формы.
s- орбиталь сферической формы, p-орбиталь имеет форму объёмной восьмерки.d и f –орбитали еще более сложной формы. Рис 2.
Все эти фигуры очерчивают область наибольшей вероятности нахождения электронов в атоме.
Волновая модель атома – это не физическая модель, а скорое абстрактная или математическая модель строения атома, расположения электронов в нем.
S – элементы.
Это элементы, которые на внешнем уровне содержать только s –электроны.
Если это р – электроны, то тогда это р – элемент.
Чем дальше энергетический уровень расположен от ядра, тем больше на нем может разместиться электронов, потому что каждый последующий энергетический уровень имеет большее количество подуровней. Так на каждом n уровне может быть n2 орбиталей. Следовательно, электронов может разместиться 2n2. Почему мы умножили n2 на 2? Потому что на каждой атомной орбитали может находиться не более 2 х электронов .
Наибольшее число электронов на каждом уровне приведено в таб.1.
|
Электронный уровень (n) |
Сколько может разместиться электронов на данном уровне 2n2 |
|
1 |
2 |
|
2 |
8 |
|
3 |
18 |
|
4 |
32 |
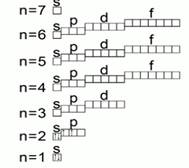
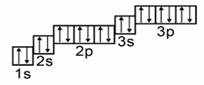
Рис. 3. Орбитальная диаграмма
Все эти сведения нужны нам для того, чтобы научиться расселять электроны по атомным уровням, подуровням и по орбиталям.
Существует условное изображение электронных уровней и подуровней. Это орбитальная или квантовая диаграмма. На такой диаграмме орбитали условно изображаются квадратиками, а электроны стрелочками. Рис. 3. Если в одной клеточке находится две стрелочки, то они будут обозначены стрелочками, направленными в разные стороны. Это свойство электронов называется спином.
После того, как вы заполнили все атомные орбитали электронами, вы должны написать «электронный паспорт» элемента или его электронную формулу. Для этого нужно обозначить каждый энергетический уровень цифрой 1, 2, 3,…, подуровень буквой s, p, d…
В качестве степени выносите число электронов на данном подуровне.
Пример №1.
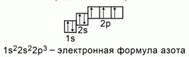
Рис. 4. Электронная формула азота
Запишите электронную формулу химического элемента с порядковым номером 7.
В атоме такого элемента должно быть 7 электронов. Заполним электронами орбитали, начиная с нижнего 1s.
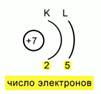
Рис. 5. Схема расположения электронов в атоме
Получится такая электронная конфигурация: 1s22s22p3.Рис.4.
После этого нужно зафиксировать расположение электронов по энергетическим уровням. Для этого нужно схематично изобразить ядро, указать его заряд и определить число энергетических уровней. Напомню, что у азота их всего 2. Рисуем 2 дуги, а под этими дугами пишем число электронов, которые располагаются на них. Тогда мы получим такую схему электронного расположения в атоме. Рис.5.
Пример №2.
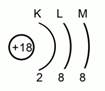
Запишите электронную формулу химического элемента с порядковым номером 18.
Действуя также как и в первом случае, мы расположим электроны по атомным орбиталям. 1s22s22p63s23p6. Это элемент аргон. Рис.6. В переводе с греческого «недеятельный». Это название он получил, потому что не вступает в взаимодействие ни с одним химическим элементом.
|
Рис. 6. Электронная конфигурация аргона |
|
|
Элементы с завершенной внешней электронной оболочкой.
Входит в подгруппу благородных или инертных газов. Их инертность вызвана строением их атома. Эти газы имеют завершенную внешнюю энергетическую оболочку – ns2np6. Инертные газы образуют одноатомную молекулу. Все остальные газы в природе имеют только двухатомную молекулу. Например, О2, Н2.причина устойчивости химических элементов с завершенной электронной оболочкой пока не ясна. Но химики воспринимают это просто как закон природы. Все другие элементы будут стремиться к завершению своей внешней электронной оболочки.
Интересно будет узнать, почему подуровни определенных уровней названы определенными буквами английского алфавита. Любой атом испускает энергию. Эту энергию можно зафиксировать в спектрах испускания атомов. Различные спектры испускания атомов имеют различный вид. Их линии различаются друг от друга. Так наиболее узкие резкие линии были названы буквой s. От английского слова «шар».
s- подуровень назван по «резкой» (sharp) линии
p- подуровень назван по «главной» (principal) линии
d- подуровень назван по «диффузной», «размытой» (diffuse) линии
f- подуровень назван по «фундаментальной» (fundamental) линии


Из-за своей химической инертности благородные газы долго не были известны в химии. Только в 1892 году был получен первый инертный газ аргон. Он был получен Д. Рэлеем. Получил он его при опытах с азотом. Д. Рэлей заметил, что если получать азот из воздуха, то этот газ азот будет иметь массу большую, чем, если получать азот при различных химических опытах. Если 1 литр азота получить из воздуха, то он будет иметь массу 1,2572 г, а если получить азот при разложении азотистых соединений, то масса будет 1,2505 г. Откуда же берется такая разность? Многие ученые подумали, что они просто провели опыт и перестали взвешивать воздух, полученный таким путем. Д. Рэлей со своим другом У. Рамзаем. Провели множество опытов и подтвердили, что газ азот, полученный из воздуха содержит в своем составе еще какой-то газ , который был в 20 раз тяжелее водорода. Так впервые был выделен аргон. До 60-х годов XX столетия ни одно соединение инертных газов не было получено. Сейчас научились получать искусственно соединения инертных газов с фтором и кислородом. Если разобрать обычную лампочку накаливания, то вы столкнетесь с газом аргоном. Но делать этого не следует, потому что вы можете пораниться.
Подведение итога урока
На этом уроке вы узнали об электронных оболочках атома, что такое атомные модели Бора. Вы повторили строение атомного ядра, рассмотрели современные взгляды при изучении электронных оболочек атома, условные изображения электронных уровней и подуровней. Рассмотрели атомные модели Бора. Более подробно строние ядра мы рассмотрим на уроках химии в 11 классе.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
3. Hemi.nsu.ru (Источник).
Рекомендованное домашнее задание
1. №№ 4-6 (с.138) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. На ос
interneturok.ru
Строение атома. Видеоурок. Химия 11 Класс
Тема: Строение атома. Периодический закон Д.И. Менделеева
Урок: Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Табл. 1
|
атом |
||
|
ядро |
электроны |
|
|
протоны |
нейтроны |
|
|
p+ |
no |
e— |
|
Масса протона |
Масса нейтрона |
Масса электрона |
|
1,0073 а.е.м. |
1,0087 а.е.м. |
0,0005 а.е.м. |
|
Заряд протона |
Заряд нейтрона |
Заряд электрона |
|
+1 |
0 |
-1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов. «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12С или С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35Cl и37Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75.35+0,25.37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
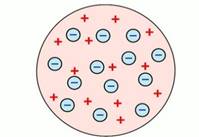
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.

Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
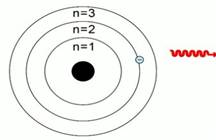
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью. Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода, в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
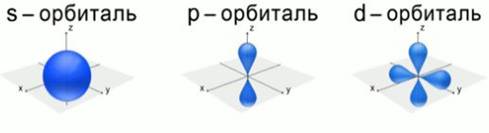
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали: 2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Кроме движения вокруг ядра, электроны обладают еще движением, которое можно представить, как их движение вокруг собственной оси. Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
Табл. 2
|
Энергетический уровень |
N |
Электронная конфигурация |
|
1-ый |
2 |
1s2 |
|
2-ой |
8 |
2s22p6 |
|
3-ий |
18 |
3s23p63d10 |
|
4-ый |
32 |
4s24p64d104f14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы. Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятся d-элементы
Графическая схема строения электронных слоев атомов (электронно-графическая формула).
Для описания расположения электронов на атомных орбиталях используют электронную конфигурацию. Для её написания в строчку пишутся орбитали в условных обозначениях (s-, p-, d-, f-орбитали), а перед ними – числа, обозначающие номер энергетического уровня. Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
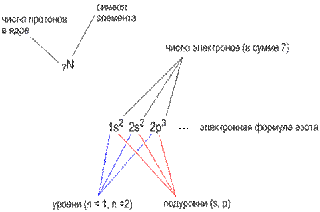
Рис. 5
Графически распределение электронов на атомных орбиталях можно представить в виде ячеек. Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали – семь. В одной ячейке может находиться 1 или 2 электрона. Согласно правилу Гунда, электроны распределяются на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одному, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Такие электроны называют спаренными. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
См. рис. 6 для атома 7N.
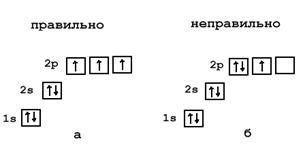
Рис. 6
Электронная конфигурация атома скандия
21Sc: 1s2 2s22p63s23p64s23d1
Электроны внешнего энергетического уровня называются валентными. 21Sc относится к d-элементам.
Подведение итога урока
На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Учащиеся узнали, что такое форма орбиталей (s, p-, d-орбитали), каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s-, p— и d-элементы. Приведена графическая схема строения электронных слоев атомов (электронно-графическая формула).
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных
interneturok.ru
Строение атома. Атомная физика — Класс!ная физика
Строение атома. Атомная физика
Модель атома Томсона
1897 г.- Дж. Томсоном выдвинута модель строения атома.
Атом имеет форму шара. По всему объему атома с постоянной плотностью распределен положительный заряд. Внутри (как изюм в кексе) расположены электроны.
В целом атом электрически нейтрален.
Когда электроны колеблются относительно центра сферы, атом излучает свет.
Опыт Резерфорда по рассеянию альфа-частиц
1906 г. — Э. Резерфорд проводит опыты для проверки состоятельности модели атома Томсона:
В вакууме в свинцовом стакане располагался источник радиоактивного излучения (альфа-частиц) — полоний(Ро).
Тонкая золотая фольга бомбардировалась положительно заряженными альфа-частицами, скорость которых около 20 ООО км /с.
На экране регистрировались вспышки от попадания на него альфа-частиц.
Кроме основного экрана следы от альфа-частиц были зафиксированы и на боковых экранах.
Зная о том, как взаимодействуют одноименно заряженные частицы, а они отталкиваются друг от друга, можно объяснить результаты опыта Резерфорда:
— частицы, которые отклонялись, пролетали недалеко от ядра
— частицы, которые отражались, попадали точно в ядро
— частицы, которые не испытывали отклонений, пролетали далеко от ядра
Понимание причин отклонения альфа-частиц позволило Э.Резерфорду выдвинуть собственную планетарную (иначе ядерную) модель строения атома.
Атом по Резерфорду
— это положительно заряженное ядро в центре атома и электроны на орбитах вокруг ядра
— характер движения электронов определяется действием кулоновских сил со стороны ядра
— диаметр ядра в 100000 раз меньше диаметра атома
— масса ядра составляет 99,4% от массы всего атома
— заряд ядра составляет 99,4% от заряда всего атома
— заряд ядра по модулю равен сумме зарядов электронов, поэтому атом в целом нейтрален.
Однако, возникли противоречия между законами классической механики и электродинамики и предложенной Резерфордом моделью атома:
Согласно классической механике по модели атома Резерфорда атомы должны быть неустойчивы, т.к.:
электроны движутся по орбитам с ускорением, поэтому должны излучать электромагнитные волны излучая, должны терять энергию
в результате должны упасть на ядро
тогда атом должен прекратить свое существование.
Однако, реальные атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, не излучая электромагнитные волны.
2. По законам классической электродинамики, электрон, приближаясь к ядру, должен двигаться все быстрее, излучая все более короткие электромагнитные волны, поэтому спектр излучения атома должен быть сплошным.
Однако, у реальных атомов спектр излучения является линейчатым.
Вспомни тему «Атомная физика» за 9 класс:
Радиоактивность — Радиоактивные превращения — Состав атомного ядра. Ядерные силы — Энергия связи. Дефект масс — Деление ядер урана — Ядерная цепная реакция — Ядерный реактор — Термоядерная реакция
class-fizika.ru
Строение атома — Всё для чайников
Строение атома
- Подробности
- Категория: Документальные учебные фильмы. Серия «Физика».
Документальные учебные фильмы. Серия «Физика».
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойства вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.).
Масса атома определяется массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A-Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом.
Перед изучением свойств электрона и правил формирования электронных уровней, необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее «верных» представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества, предположили еще древнегреческие философы. После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов «упасть» на ядро и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей проявляя корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускула) и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам — способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля.
forkettle.ru
1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Видеоурок: Строение атома: Строение электронных оболочек
Лекция: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
 Строение атома
Строение атома XX столетие является временем изобретения «модели строения атома». Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
XX столетие является временем изобретения «модели строения атома». Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
 Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) — 15.
Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) — 15.
Итак, атом состоит из протонов (p+), нейтронов (n0) и электронов (e—). Протоны и нейтроны образуют ядро атома, оно имеет положительный заряд. А электроны, совершающие перемещения вокруг ядра, «конструируют» электронную оболочку атома, имеющую отрицательный заряд.

Сколько электронов в атоме? Это легко узнать. Достаточно посмотреть порядковый номер элемента в таблице.

Так, число электронов фосфора равно 15. Количество электронов, содержащихся в оболочке атома, строго равно числу протонов, содержащихся в ядре. Значит и протонов в ядре атома фосфора 15.
Масса протонов и нейтронов, составляющих массу ядра атома, одинакова. А электроны меньше в 2000 раз. Это означает что вся масса атома сосредоточена в ядре, массой электронов пренебрегают. Массу ядра атома мы также можем узнать из таблицы. Посмотрите изображение фосфора в таблице. Внизу мы видим обозначение 30, 974 – это и есть масса ядра фосфора, его атомная масса. При записи мы округляем эту цифру. Исходя из сказанного, запишем строение атома фосфора следующим образом:

(внизу слева написали заряд ядра – 15, вверху слева округленное значение массы атома – 31).
Ядро атома фосфора:

(внизу слева пишем заряд: протоны имеют заряд равный +1, а нейтроны не заряжены, то есть заряд 0; вверху слева масса протона и нейтрона, равная 1 – условная единица массы атома; заряд ядра атома равен числу протонов в ядре, значит р=15, а число нейтронов нужно посчитать: из атомной массы вычесть заряд, т.е. 31 – 15 = 16).
Электронная оболочка атома фосфора включает в себя 15 отрицательно заряженных электронов, уравновешивающих положительно заряженные протоны. Поэтому, атом – электронейтральная частица.
 Энергетические уровни
Энергетические уровниРис.1
 Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие — то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие — то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Вы можете заметить, как по мере удаления от ядра увеличивается объем слоя. Следовательно, чем дальше слой от ядра, тем больше в нем электронов.
Электронный слой, содержит в себе электроны, сходные по показателям энергии. Из – за этого, такие слои нередко именуют энергетическими уровнями. Сколько же уровней может содержать атом? Количество энергетических уровней равно номеру периода в таблице Менделеева Д.И. в котором находится элемент. К примеру, фосфор (Р) находится в третьем периоде, значит атом фосфора имеет три энергетических уровня.Рис. 2
 Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня.
Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня. Получим, что первый уровень содержит всего 2 электрона, второй – 8, третий – 18, четвертый – 32.
Каждый энергетический уровень содержит в себе подуровни. Их буквенные обозначения: s-, p-, d- и f-. Посмотрите на рис. 2:Здесь изображены подуровни. Е – это энергия (вспомните, что она возрастает по мере удаления электрона от ядра).
Разным цветом обозначены энергетические уровни, а полосками разной толщины подуровни.
Самый тонкий подуровень обозначается буквой s. 1s – это s-подуровень первого уровня, 2s – это s-подуровень второго уровня и так далее.
На втором энергетическом уровне появился p-подуровень, на третьем – d-подуровень, а на четвертом f-подуровень.
Запомните увиденную закономерность: первый энергетический уровень включает одну s-подуровень, второй два s- и p- подуровня, третий три s-, p- и d-подуровня, а четвертый уровень четыре s-, p-, d- и f-подуровня.
На s-подуровне могут находится только 2 электрона, на p-подуровне- максимум 6 электронов, на d-подуровне — 10 электронов, а на f-подуровне до 14 электронов.
 Электронные орбитали
Электронные орбиталиОбласть (место) где может находится электрон называется электронным облаком или орбиталью. Имейте ввиду, что говорится о вероятной области нахождении электрона, поскольку скорость его движения в сотни тысяч раз больше скорости движения иглы швейной машинки. Графически эта область изображается в виде ячейки:

В одной ячейке может находится два электрона. Судя по рисунку 2 можно сделать вывод о том, что s-подуровень, включающий не более двух электронов может содержать только одну s-орбиталь, обозначается одной ячейкой; p-подуровень имеет три р-орбитали (3 ячейки), d-подуровень пять d-орбиталей (5 ячеек), а f-подуровень семь f-орбиталей (7 ячеек).
Форма орбитали зависит от орбитального квантового числа (l — эль) атома. Атомный энергетический уровень, берет начало с s – орбитали, имеющей l = 0. Представленная орбиталь имеет сферическую форму. На уровнях, идущих после s — орбитали, образуются p – орбитали с l = 1. P — орбитали напоминают форму гантели. Орбиталей, имеющих данную форму, всего три. Каждая возможная орбиталь содержит в себе не больше 2 – ух электронов. Далее располагаются более сложного строения d-орбитали (l = 2), а за ними f-орбитали (l = 3).
Рис. 3 Форма орбиталей Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Если же в орбитали два электрона, то они имеют два направления: стрелкой вверх и стрелкой вниз, т.е. электроны разнонаправленны:
Такое строение электронов называется валентным.
Существуют три условия наполнения атомных орбиталей электронами:
1 условие: Принцип минимального количества энергии. Заполнение орбиталей начинается с подуровня, имеющего минимальную энергию. Согласно данному принципу подуровни заполняются в таком порядке: 1s22s22p63s23p6 4s23d104p65s24d105р66s25d14f14… Как мы видим, в некоторых случаях электрону энергетически выгоднее занять место в подуровне вышележащего уровня, хотя подуровень нижележащего уровня не заполнен. Например, валентная конфигурация атома фосфора выглядит так:
Рис. 4

2 условие: Принцип Паули. Одна орбиталь включает 2 электрона (электронную пару) и не больше. Но возможно и содержание всего одного электрона. Его именуют неспаренным.
3 условие: Правило Хунда. Каждую орбиталь одного подуровня сначала заполняют по одному электрону, затем в них добавляются по второму электрону. В жизни мы видели аналогичную ситуацию, когда незнакомые пассажиры автобуса сначала занимают по одному все свободные сидения, а потом рассаживаются по два.
 Электронная конфигурация атома в основном и возбужденном состоянии
Электронная конфигурация атома в основном и возбужденном состоянии
Энергия атома, находящегося в основном состоянии, наименьшая. Если атомы начинают получать энергию из вне, к примеру, когда вещество нагревается, то они из основного состояния переходят в возбужденное. Этот переход возможен при наличии свободных орбиталей, на которые могут переместиться электроны. Но это временно, отдавая энергию, возбужденный атом возвращается в своё основное состояние.
Закрепим полученные знания на примере. Рассмотрим электронную конфигурацию, т.е. сосредоточение электронов по орбиталям атома фосфора в основном (невозбужденном состоянии). Еще раз обратимся к рис. 4. Итак, вспомним, что атом фосфора имеет три энергетических уровня, которые изображаются полудугами: +15)))
Распределим, имеющиеся 15 электронов на эти три энергетических уровня:
Такие формулы называются электронными конфигурациями. Есть еще электронно – графические, они иллюстрируют размещение электронов внутри энергетических уровней. Электронно – графическая конфигурация фосфора выглядит так: 1s2 2s2 2p6 3s2 3p3 (здесь большие цифры – это номера энергетических уровней, буквы – это подуровни, а маленькие цифры – количество электронов подуровня, если их сложить, получится число 15).
В возбужденном состоянии атома фосфора 1 электрон переходит с 3s-орбитали на 3d-орбиталь, а конфигурация выглядит так: 1s2 2s2 2p6 3s1 3p33d1.cknow.ru
Атомная теория » HimEge.ru
Модель атома азота
Все тела окружающие нас, несмотря на их разнообразие, состоят из мельчайших частиц — атомов, состоящих, в свою очередь, из еще меньших частиц — протонов, нейтронов и электронов. Это стало известно относительно недавно, атом долгое время считался неделимой частицей, т.е простейшей (см историю развития представлений об атоме).
В основе современной теории строения атома лежат следующие основные положения:
- Атом состоит из ядра и электронной оболочки
- Электронная оболочка – совокупность движущихся вокруг ядра электронов
- Ядра атомов заряжены положительно, они состоят из протонов p и нейтронов n (вместе носят название нуклоны).Заряд ядра равен сумме протонов (обозначены красным цветом на рисунке).
- Атом в целом электронейтрален, число электронов е– равно числу протонов p+ , равно порядковому номеру элемента в таблице Менделеева. Именно заряд ядра является основной характеристикой атома и определяет его положение в таблице Менделеева. Хими́ческийэлеме́нт — совокупность атомов с одинаковым зарядом ядра.
Например, водород, первый элемент таблицы, имеет самое простое строение – его ядро представляет собой одни протон, а электронная оболочка состоит из одного электрона. Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.
- Если атом присоединяет или отдает электроны (несущие отрицательный заряд) то его электронейтральность нарушается, он превращается в отрицательно или положительно заряженный ион соответственно.
При образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Э0-ne—=Эn+
Э0+ne—=Эn-
В атомах имеются небольшие тяжелые ядра, в состав которых входят протоны и нейтроны и в которых сосредоточена почти вся масса атома. Большая часть атома заполнена электронами и представляет собой почти пустое пространство.
Помимо заряда ядра, ещё одной важной характеристикой атома является его масса или массовое число. Вся масса атома сосредоточена в маленьком ядре, массой электронов пренебрегают, тк масса электрона почти в 2000 раз меньше массы протона. Массовое число равно сумме числа протонов и нейтронов в ядре. Например, у кислорода, массовое число = 16, тк его ядро содержит 8 протонов (красные кружочки) и 8 нейтронов (белые кружочки).
В природе существуют атомы одного элемента, т.е имеющие одинаковый заряд ядра, но разные массовые числа — изотопы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место», занимают одно и то же «место» в таблице Менделеева). У них число протонов одинаково, но разное число нейтронов. У элемента водорода существует три изотопа: протий – с массовым числом 1, Дейтерий – с массовым числом 2 (D2O – тяжелая вода), и радиоактивный тритий с массовым числом 3.
В таблице Менделеева приведена относительная атомная масса — среднее арифметическое масс изотопов с учетом их % содержания в земной коре.
Количество нейтронов не указывается в таблице, поэтому чтобы рассчитать число нейтронов, нужно из массы атома (указывается в задании) вычесть порядковый номер (число протонов).
В химических реакциях состав ядер атомов не изменяется (искл. ядерные реакции – не рассматриваются в данном курсе, область изучения физики), изменяться может только состав электронной оболочки (количество электронов). Поэтому нам важно знать, каким образом располагаются электроны в атоме, т.е строение электронных оболочек атомов.
Электроны расположены в трехмерном пространстве вокруг ядра атома. Внутри этого пространства имеются области, в которых могут располагаться электроны. Эти области называются орбиталями. Каждая орбиталь характеризуется размером, формой и ориентацией внутри атома, и каждой присвоено буквенно-цифровое обозначение.
Хотя в атоме имеется большое число орбиталей, в обычных условиях только сравнительно малая их часть занята электронами. Ниже приводится список общепринятых обозначений первых (т. е. ближайших к ядру) восемнадцати орбиталей. Цифра (номер) характеризует размер или средний диаметр орбитали, а буква — форму орбитали. s-Орбиталь представляет собой сферу, центр которой совпадает с центром (ядром) атома, а три р-орбитали напоминают объемные восьмерки, оси которых перпендикулярны друг другу. Таким образом, 1s-орбиталь — сферическая и наименьшая по размерам; 2s-орбиталь — также сферическая, но большего размера; 2р-орбитали имеют форму восьмерок и по размеру сопоставимы с 2s-орбиталью. d-Орбитали имеют более сложную форму.
Орбитали группируются в соответствии с их размерами и эти группы называются слоями или оболочками или энергетическими уровнями. В первой электронной оболочке имеется лишь одна орбиталь — 1s. На второй оболочке их уже четыре, а на третьей — девять. Каждая орбиталь может быть свободной (пустой) или занятой одним или двумя электронами. Заметим, что в каждой оболочке (кроме первой) существует три р-орбитали и пять d-орбиталей (во всех оболочках, кроме двух первых). Поскольку на каждой орбитали может находиться по 2 электрона, группу р-орбиталей могут занимать не более 6 электронов, а группу d-oрбиталей — 10 электронов.
Электроны сначала занимают орбитали низших слоев и только затем — орбитали более высоких уровней. Легкость заполнения орбиталей уменьшается от начала к концу списка. Иными словами, электроны, занимающие более высокие орбитали, имеют большую энергию.
Ниже приведены электронная конфигурация атомов кислорода и серы.
Подробнее про Строение электронных оболочек атомов
himege.ru
Модели строения атома
Модель Томсона
Первая модель строения атома была предложена Дж. Томсоном в 1904 г., согласно которой атом – положительно заряженная сфера с вкрапленными в нее электронами. Несмотря на свое несовершенство томсоновская модель позволяла объяснить явления испускания, поглощения и рассеяния света атомами, а также установить число электронов в атомах легких элементов.

Рис. 1. Атом, согласно модели Томсона. Электроны удерживаются внутри положительно заряженной сферы упругими силами. Те из них, которые находятся на поверхности, могут легко «выбиваться» , оставляя ионизированный атом.
2.2 Модель Резерфорда
Модель Томсона была опровергнута Э. Резерфордом (1911 г.), который доказал, что положительный заряд и практически вся масса атома сконцентрированы в малой части его объема – ядре, вокруг которого двигаются электроны (рис. 2).
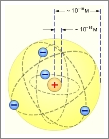
Рис. 2. Эта модель строения атома известна как планетарная, т. к. электроны вращаются вокруг ядра подобно планетам солнечной системы.
Согласно законам классической электродинамики, движение электрона по окружности вокруг ядра будет устойчивым, если сила кулоновского притяжения будет равна центробежной силе. Однако, в соответствии с теорией электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро. Однако атом устойчив.
К тому же при непрерывном излучении энергии у атома должен наблюдаться непрерывный, сплошной спектр. На самом деле спектр атома состоит из отдельных линий и серий.
Таким образом, данная модель противоречит законам электродинамики и не объясняет линейчатого характера атомного спектра.
2.3. Модель Бора
В 1913 г. Н. Бор предложил свою теорию строения атома, не отрицая при этом полностью предыдущие представления. В основу своей теории Бор положил два постулата.
Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию (рис.3).
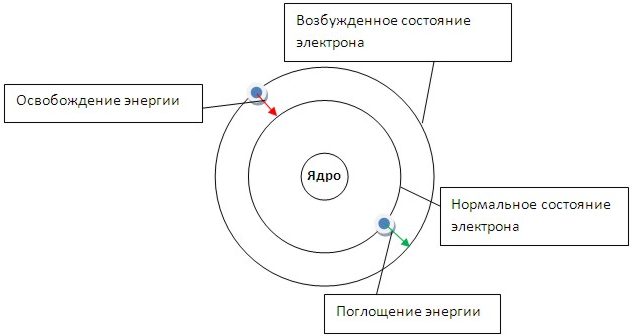
Рис. 3. Модель строения атома Бора. Изменение состояния атома при переходе электрона с одной орбиты на другую.
При движении по любой стационарной орбите запас энергии электрона (Е1, Е2 …) остается постоянным. Чем ближе к ядру расположена орбита, тем меньше запас энергии электрона Е1 ˂Е2 …˂ Еn . Энергия электрона на орбитах определяется уравнением:
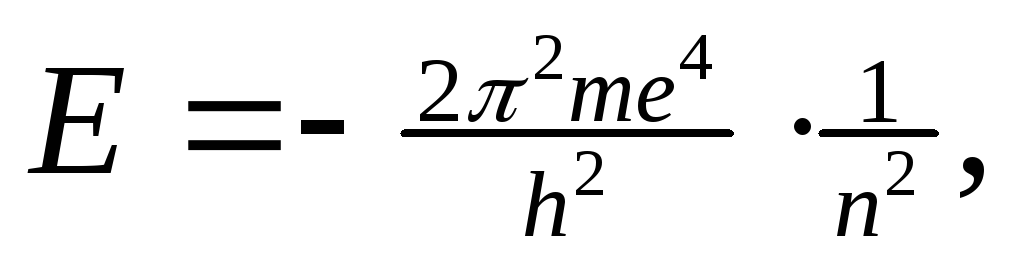
где m – масса электрона, h – постоянная Планка, n – 1, 2, 3… (n=1 для 1-ой орбиты, n=2 для 2-ой и т.д.).
Второй постулат говорит о том, что при переходе с одной орбиты на другую электрон поглощает или выделяет квант (порцию) энергии.
Если подвергнуть атомы воздействию (нагреванию, облучению и др.), то электрон может поглотить квант энергии и перейти на более удаленную от ядра орбиту (рис. 3). В этом случае говорят о возбужденном состоянии атома. При обратом переходе электрона (на более близкую к ядру орбиту) энергия выделяется в виде кванта лучистой энергии – фотона. В спектре это фиксируется определенной линией. На основании формулы
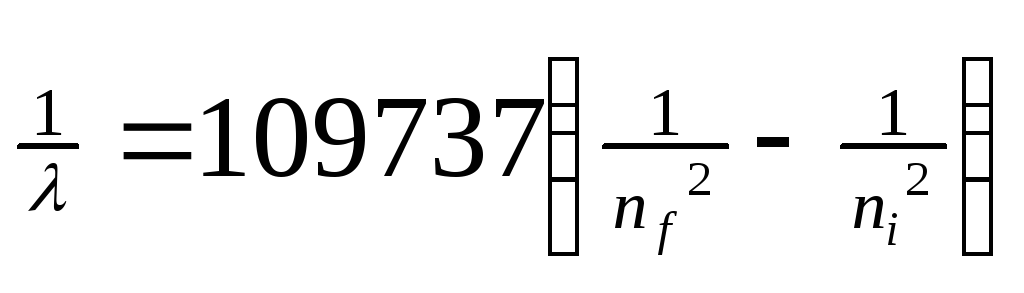 ,
,
где λ – длина волны, n = квантовые числа, характеризующие ближнюю и дальнюю орбиты, Бор рассчитал длины волн для всех серий в спектре атома водорода. Полученные результаты соответствовали экспериментальным данным. Стало ясным происхождение прерывистых линейчатых спектров. Они – результат излучения энергии атомами при переходе электронов из возбужденного состояния в стационарное. Переходы электронов на 1-ю орбиту образуют группу частот серии Лаймана, на 2-ю – серию Бальмера, на 3-ю серию Пашена (рис. 4,табл. 1).
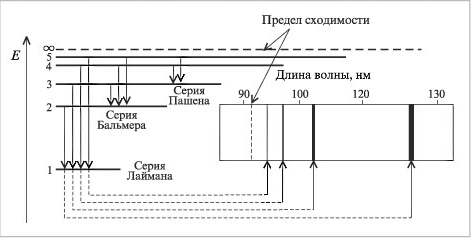
Рис. 4. Соответствие между электронными переходами и спектральными линиями атома водорода.
Таблица 1
Проверка формулы Бора для серий водородного спектра
Название серии | λ, А Экспериментальная | λ, А Вычисленная Бором |
Пашена | 18751,3 12817,5 10938,0 10049,8 | 18756 12822 10941 10052 |
Бальмера | 6564,66 4862,71 4102,91 3971,20 3799,00 3712,70 | 6564,70 4862,80 4341,70 4102,93 3971,23 3799,01 3712,62 |
Лаймана | 1216 1028 972 | 1215,68 1025,73 972,5 |
Однако, теория Бора не смогла объяснить расщепление линий в спектрах многоэлектронных атомов. Бор исходил из того, что электрон – это частица, и использовал для описания электрона законы, характерные для частиц. Вместе с тем накапливались факты, свидетельствующие о том, что электрон способен проявлять и волновые свойства. Классическая механика оказалась не в состоянии объяснить движение микрообъектов, обладающих одновременно свойствами материальных частиц и свойствами волны. Эту задачу позволила решить квантовая механика – физическая теория, исследующая общие закономерности движения и взаимодействия микрочастиц, обладающих очень малой массой (табл. 2).
Таблица 2
Свойства элементарных частиц, образующих атом
Частица | Заряд | Масса | ||
Кл | Условн.ед. | г | А.е.м. | |
Электрон | — 1,6·10-19 | -1 | 9,10·10-28 | 0,00055 |
Протон | 1,6·10-19 | +1 | 1,67·10-24 | 1,00728 |
Нейтрон | 0 | 0 | 1,67·10-24 | 1,00866 |
studfile.net