Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn 3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6
H5OH = 2C6H5OK + H2Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
| Металл (название происходит от лат. metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий. | |
| Металлы — суть светлые тела, которые ковать можно. (Михаил Васильевич Ломоносов) | |
| Некоторые металлы | |
| Щелочные металлы: Литий, Натрий, Калий | |
| Щелочноземельные металлы: Бериллий, Магний, Кальций | |
| Переходные металлы: Железо, Платина | |
| Другие металлы: Алюминий, Свинец, Медь, Цинк | |
Металлургия — совокупность связанных между собой отраслей и стадий производственного процесса от добычи сырья до выпуска готовой продукции — черных и цветных металлов и их сплавов. К черным металлам относят железо, марганец и хром. Все остальные — цветные. По физическим свойствам и назначению цветные металлы условно делят на тяжелые (медь, свинец, цинк, олово, никель) и легкие (алюминий, титан, магний). | |
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды черных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Исключением можно назвать около 16 элементов: т. н. благородные металлы (золото, серебро и др.), и некоторые другие (например, ртуть, медь), которые присутствуют без примесей. Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль). Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль). | |
| Характерные свойства металлов | |
| Физические свойства металла | |
| Все металлы (кроме ртути) тверды при нормальных условиях. Температуры плавления лежат в диапазоне от 39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на легкие (плотность 0,53 ч 5 г/смі) и тяжелые (5 ч 22,5 г/смі). Металлы тонут | |
Это способность металлов подвергаться различным способам механической обработки. | |
| Микроскопическое строение металла | |
| Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решетке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решетки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твердость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.). Из-за легкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твердых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешенные зоны, причем зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для ее полного заполнения. Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течет электрический ток. Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придает металлам характерный блеск). | |
| Применение металлов | |
| Конструкционные материалы | |
| Металлы и их сплавы — один их главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах. | |
| Электротехнические материалы | |
| Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.). | |
| Инструментальные материалы | |
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика. В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика. |
Физические и химические свойства металлов
Металлы широко распространены в природе и могут встречаться в различном виде: в самородном состоянии (Ag, Au, Rt, Cu), в виде оксидов (Fe3O4, Fe2O3, (NaK)2O×AlO3), солей (KCl, BaSO4, Ca3(PO4)2), а также сопутствуют различным минералам (Cd – цинковые руды, Nb, Tl – оловянные и т.д.).
Физические свойства металлов
Всем металлам присущи металлический блеск (однако In и Ag отражают свет лучше других металлов), твердость (самый твердый металл – Cr, самые мягкие металлы
– щелочные), пластичность (в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe наблюдается уменьшение пластичности), ковкость, плотность (самый легкий металл – Li, самый тяжелый – Os), тепло – и электропроводность, которые уменьшаются в ряду Ag, Cu, Au, Al, W, Fe.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип > 1000С) и легкоплавкие (Tкип < 1000С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns1, ns2), р-
элементы – металлы, расположенные в группах III – VI (ns2np1-4). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d1-10ns2. Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f1-14(n-1)d0-1ns2.
Химические свойства металлов
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
2Al + 3/2 O2 = Al2O3 (оксид алюминия)
2Na + Cl2 = 2NaCl (хлорид натрия)
6Li + N2 = 2Li3N (азид лития)
2Li+2C = Li2C2 (карбид лития)
2K +S = K2S (сульфид калия)
2Na + H2 = NaH (гидрид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
Ba + 2H2O = Ba(OH)2 + H2↑
2Na + 2H2O = 2NaOH + H2↑
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
2Al + 6HCl = 2AlCl3 + 3 H2↑
Zn + 2HCl = ZnCl2 + 2H2↑
Fe + H2SO4 = FeSO4 + H2↑
Получение металлов
Щелочные, щелочноземельные металлы и алюминий получают электролизом расплавов солей или оксидов этих элементов:
2NaCl = 2Na + Cl2↑
CaCl2 = Ca + Cl2↑
2Al2O3 = 4Al + 3O2↑
Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
Cu2O + C = 2Cu + CO (1)
CuSO4 + Fe = Cu + FeSO4 (2)
Некоторые металлы получают термическим разложением их неустойчивых соединений:
Ni(CO)4 = Ni + 4CO
Примеры решения задач
Химические свойства металлов
Химические свойства металлов
Сегодня
мы с вами изучим общие химические свойства металлов.
В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
Сначала разберём реакции металлов с простыми веществами – неметаллами.
Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В
реакции кальция с кислородом, кальций также повышает свою степень
окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли
окислителя, при этом два атома кальция отдают по два электрона молекуле
кислорода. В результате реакции образуется оксид кальция.
Металл кальций выступает в роли восстановителя, а кислород – в роли
окислителя, при этом два атома кальция отдают по два электрона молекуле
кислорода. В результате реакции образуется оксид кальция.
Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска. Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2. В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.
Многие
металлы взаимодействуют с кислородом при нагревании: например, медь
при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного
оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.
А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний
также является восстановителем, потому что повышает свою степень окисления с 0 до
+2, а кислород понижает свою степень окисления с 0 до -2 и является
окислителем. В результате реакции образуется оксид магния, а два атома магния
отдают по два электрона молекуле кислорода.
В результате реакции образуется оксид магния, а два атома магния
отдают по два электрона молекуле кислорода.
Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В
реакции натрия с серой образуется сульфид натрия, натрий повышает
свою степень окисления с 0 до +2, он является восстановителем, сера является
окислителем и понижает свою степень с 0 до -2. В результате
взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.
Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий
выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а
сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой
реакции два атома алюминия отдают по три электрона молекуле серы.
В этой
реакции два атома алюминия отдают по три электрона молекуле серы.
Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким
образом, в реакциях с галогенами, металлы являются восстановителями и повышают
свою степень окисления, а сами галогены являются окислителями и понижают свою
степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В
результате этих реакций образуются галогениды.
В
результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые
металлы взаимодействуют с водой при определённых условиях, например, цинк
– при нагревании, железо – в раскалённом виде с парами воды. При этом
образуются оксиды металлов и выделяется водород.
При этом
образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода. Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0. В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким
образом, щелочные и щелочноземельные металлы реагируют с водой с образованием
щелочей, при этом выделяется водород, некоторые металлы реагируют с водой
только при нагревании, при этом образуются оксиды и выделяется водород, а
металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих
реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли
окислителя.
В этих
реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли
окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
Следует учитывать и следующее металл реагирует с кислотой:
· металл должен стоять в ряду активности до водорода
· если образуется растворимая соль
· концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
· на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
Например,
в реакции магния с раствором серной кислоты, магний выступает в роли
восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк
в обеих реакциях является восстановителем, он повышает свою степень окисления с
0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая
в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам
водорода.
В этих двух реакциях атом цинк отдаёт по два электрона ионам
водорода.
Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если
в две пробирки налить раствора сульфата меди (II) и поместить в первую
кусочек железа, а во вторую гранулу цинка, то реакция будет у нас
идти в двух пробирках. На кусочке железа и грануле цинка оседает медь
и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на
жёлтую, во второй – с голубой на более светлую.
На кусочке железа и грануле цинка оседает медь
и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на
жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
Следовательно,
металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл
вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений
металлов, при этом должна образоваться растворимая соль и щелочные металлы
брать нельзя, так как они реагируют с водой.
Сделаем вывод:
· металлы реагируют с простыми веществами, такими, как:
· кислород
· сера
· галогены
· со сложными:
· вода
· кислоты
· соли
ЕГЭ. Химические свойства металлов
Химические свойства металлов
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li + O2 → 2Li2O
2Na + O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 + 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg + 2P → Mg3P2 (t)
2Na + Cl2 → 2NaCl
Ca + 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 + 2Mg → 2MgO + C
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg + TiCl4 → 2MgCl2 + Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al + 3Cl2 → 2AlCl3
4Al + 3C → Al4C3
2Al + N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al + H2SO4 (р) → Al2(SO4)3 + H2
8) Вытесняет менее активные металлы из их солей:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода:
При нагревании реагирует без выделения водорода:
Al + 4HNO3(конц.) → Al(NO3)3 + NO + 2H2O (только при нагревании)
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 3NH4NO3 + 9H2O (при любой температуре, возможно образование N2O)
2Al + 6H2SO4(конц.) → Al2(SO4)3 + 3SO2 + 6H2O (только при нагревании)
2Al + 3H2SO4(разб.) → Al2(SO4)3 + 3H2
3. Железо
1) Реагирует с кислородом:
3Fe + 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O  → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe + 4H2O → Fe3O4 + 4H2 (t)
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
Fe + I2 → FeI2 (образуется соль Fe+2)
Fe + S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe + H2SO4 (разб. ) → FeSO4 + H2 (образуется соль Fe+2)
) → FeSO4 + H2 (образуется соль Fe+2)
Fe + 2HCl → FeCl2 + H2
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O (при нагревании, образуется соль Fe+3)
Fe + 4HNO3(разб.) → Fe(NO3)3 + NO + 2H2O (образуется соль Fe+3)
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O (при нагревании, образуется соль Fe+3)
9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
2FeCl3 + Fe → 3FeCl2
Fe3O4 + Fe → 4FeO
Fe2O3 + Fe  → 3FeO
4.
 Хром
Хром1) Реагирует с кислородом:
4Cr + 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr + 3H2O → Cr2O3 + 3H2 (t)
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
Cr + S → Cr2S3 (образуется соль Fe+3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + H2SO4 (разб. ) → CrSO4 + H2 (образуется соль Cr+2)
) → CrSO4 + H2 (образуется соль Cr+2)
Cr + 2HCl → CrCl2 + H2 (образуется соль Cr+2)
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает)
Cr + HNO3(конц.) → реакция не идет
Cr + HNO3(разб.) → реакция не идет
Cr + H2SO4(конц.) → реакция не идет.
5. Медь
1) Реагирует с кислородом:
2Cu + O2 → 2CuO
2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
CuO + Cu → Cu2O
CuCl2 + Cu → 2CuCl
3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cu + H2 → реакция не идет
4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
Cu + H2O → реакция не идет
5) Не реагирует с щелочами
Cu + NaOH → реакция не идет
6) Реагирует с кислородом, серой, галогенами при нагревании:
Cu + Cl2 → CuCl2 (образуется соль Cu+2)
Cu + Br2 → CuBr2 (образуется соль Cu+2)
2Cu + I2 → 2CuI (образуется соль Cu+1)
Cu + S → CuS (образуется соль Cu+2)
7) Не реагирует с N2, C, Si.
8) Не реагирует с кислотами-неокислителями, так как находится правее водорода в ряду напряжений:
Cu + H2SO4(р) → реакция не идет.
9) Реагирует с кислотами-окислителями как слабый восстановитель:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
7. Цинк
1) Реагирует с кислородом: 2Zn + O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
Zn + H2O → ZnO + H2
4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
Zn + 2NaOH(тв. ) → Na2ZnO2 + H2 (t)
) → Na2ZnO2 + H2 (t)
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5) Реагируют с галогенами, серой при нагревании:
Zn + Cl2 → ZnCl2
Zn + S → ZnS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Zn + H2SO4 (разб.) → ZnSO4 + H2
8) Реагирует с кислотами-окислителями:
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S + 4H2O
Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты:
Zn+4HNO3(конц.) → Zn(NO3)2 + 2NO2 + 2H2O
4Zn + 10HNO3(разб.) → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Химические свойства металлов
Цели урока:
- обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания химических свойств металлов;
- привести учащихся к умению создавать проблемные ситуации и видеть пути их решения;
- формировать исследовательские навыки учащихся;
- продолжить формирование информационной, кооперативной компетентностей.
Задачи для учащихся:
- знать важнейшие химические свойства металлов;
- уметь записывать уравнения химических реакций, характеризующих химические свойства металлов;
- уметь проводить химический эксперимент и объяснять его результаты;
- уметь находить информацию, обрабатывать и преподносить.
Оборудование: штатив с пробирками, кристаллизатор, химическая ложка для сжигания веществ, спиртовка, спички.
Реактивы: дистиллированная вода, натрий, магний, железо, медь, раствор сульфата меди (II), раствор соляной кислоты, раствор сульфата железа (II).
Ход урока
I. Стадия «Вызова». Актуализация знаний учащихся.
Что мы изучали на прошлом уроке?
Ответы учащихся: положение металлов в ПСХЭ, строение их атомов, физические свойства металлов.
Ребята, я предлагаю вам вспомнить материал предыдущего урока, выполнив следующие задания:
- Найдите ошибки в тексте:
- Металлы в ПСХЭ расположены правее диагонали бор-астат и в четных рядах больших периодов.
- У атомов металлов на внешнем уровне 4-7 электронов.
- По сравнению с атомами неметаллов, у атомов металлов радиус атомов больше.
- Щелочные металлы в ПСХЭ расположены в IA группе. К ним относят: литий, натрий, калий, медь, рубидий, серебро, цезий, золото, франций.
- Щелочноземельные металла в ПСХЭ расположены во IIA группе. К ним относят: бериллий, магний, кальций, стронций, барий, радий.
- Металлы проявляют окислительные свойства.
 (приложение 1)
(приложение 1) - Самый – самый… . Допишите предложения:
- Самый легкий металл …
- Самый тяжелый металл …
- Самые электропроводные металлы…
- Самый пластичный металл …
- Самый тугоплавкий металл …
- Самый легкоплавкий металл …
- Самые блестящие металлы …
- Самый твердый металл …
- Самые мягкие металлы … (приложение 1)
Самопроверка, выставление баллов (до 15). (приложение 1)
Мы приступаем к изучению химических металлов. Что-то вы уже знаете из практической жизни, изученного материала. Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти.
Задание № 1. Ребята, зная, что металлы в химических реакциях проявляют восстановительные свойства, предположите, в какие химические реакции они будут вступать. Свои гипотезы запишите в тетради.
Свои гипотезы запишите в тетради.
Озвучивание написанного.
А теперь я предлагаю проверить выдвинутые вами гипотезы.
II. Стадия «Осмысление».
См. опорный конспект.
Идёт работа с текстом и его маркировка.
V — уже известно
+ абсолютно новое, неожиданное;
— противоречит твоим представлениям;
? хочется узнать что-то больше.
1. Опорный конспект.
1) Металлы реагирую с неметаллами.
Большинство металлов при нагревании на воздухе окисляются – превращаются в оксиды. Не реагируют с кислородом лишь наименее активные металлы: серебро, платина, золото. С наиболее активными неметаллами – галогенами – реагируют практически все металлы. Реакции с другими неметаллами протекают не во всех случаях и, как правило, при нагревании.
2) Более активные металлы вытесняют менее активные из растворов их солей.
3) С водой при комнатной температуре с образованием щелочи и водорода реагируют лишь наиболее активные металлы – щелочные и щелочноземельные. Менее активные металлы реагируют с перегретым водяным паром, при этом образуются оксиды металлов и водород. Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, с водой не реагируют.
Менее активные металлы реагируют с перегретым водяным паром, при этом образуются оксиды металлов и водород. Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, с водой не реагируют.
4) Металлы, стоящие в электрохимическом ряду напряжений металлов левее водорода, вытесняют его из растворов кислот. Взаимодействие металлов с азотной кислотой и концентрированной серной кислотой протекает иначе. [2]
На данной стадии идёт соотношение уже известного с тем, «что узнал». Происходит структурная организация информации в памяти.
Далее идет экспериментальная проверка выдвинутых предположений с нанизанным на них теоретическим материалом.
Демонстрация опытов, выполнение лабораторных опытов и заполнение таблицы.
Задание №2.
1) Просмотр видеофрагментов «Взаимодействие железа с хлором», «Горение железа в кислороде», «Взаимодействие натрия с серой». (приложение 1)
2) Демонстрационный опыт «Взаимодействие натрия и магния с водой».
3) Лабораторный опыт «Взаимодействие магния, железа, меди с соляной кислотой».
4) Лабораторный опыт «Взаимодействие железа с раствором сульфата меди (II) и меди с раствором сульфата железа (II)».
Цель: экспериментально проверить гипотезу и теорию о химических свойствах металлов.
Инструкция:
- Внимательно прочитайте задание и цель исследования.
- Выскажите предложения о возможности протекания реакции.
- Пронаблюдайте (проведите) опыт.
- Результаты опыта оформите в виде таблицы.
- Запишите уравнения реакций.
- Сформулируйте выводы.
Название опыта |
Наблюдения |
Уравнения реакций |
Выводы |
Взаимодействие железа с хлором. |
|
|
|
Горение железа в кислороде. |
|
|
|
Взаимодействие натрия с серой. |
|
|
|
Взаимодействие натрия и магния с водой. |
|
|
|
Взаимодействие магния, железа, меди с соляной кислотой. |
|
|
|
Взаимодействие железа с раствором сульфата меди (II) и меди с раствором сульфата железа (II). |
|
|
|
Самопроверка записи уравнений реакций, выставление баллов (до 10). [приложение1]
III. Стадия «размышления» (рефлексия).
Учащиеся должны попробовать выразить информацию, которую получили, своими словами. Они озвучивают сформулированные ими выводы о химических свойствах металлов.
Выставление оценок в зависимости от количества набранных баллов:
- 22 – 25 баллов – оценка «5»;
- 18 – 21 баллов – оценка «4»;
- 13 – 17 баллов – оценка «3». (приложение 1)
Спасибо большое за проделанную работу. А теперь еще один демонстрационный эксперимент «Взаимодействие натрия с раствором сульфата меди (II).
Я прошу вас записать уравнение этой реакции. Что должно получиться? (Медь и раствор сульфата натрия).
Что наблюдаем? (Синий осадок гидроксида меди (II)).
Домашнее задание: объяснить результаты опыта, § 8, № 5, 7 (с. 37).
Список литературы:
- Габриелян О.С. Химия. 9 класс. Москва, Издательский дом «Дрофа», 2008.
- Еремин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В. Химия. 9 класс. Москва, Оникс, Мир и образование, 2006.
- Видеофрагменты Единой Коллекции ЦОР (http://school-collection.edu.ru).
Химические свойства металлов
Строение атомов металлов определяет не только характерные физические свойства простых веществ – металлов, но и общие их химические свойства.
При большом многообразии все химические реакции металлов относятся к окислительно-восстановительным и могут быть только двух типов: соединения и замещения. Металлы способны при химических реакциях отдавать электроны, то есть быть восстановителями, проявлять в образовавшихся соединениях только положительную степень окисления.
В общем виде это можно выразить схемой:
Ме0 – ne → Me+n,
где Ме – металл – простое вещество, а Ме0+n – металл химический элемент в соединении.
Металлы способны отдавать свои валентные электроны атомам неметаллов, ионам водорода, ионам других металлов, а поэтому будут реагировать с неметаллами – простыми веществами, водой, кислотами, солями. Однако восстановительная способность металлов различна. Состав продуктов реакции металлов с различными веществами зависит и от окислительной способности веществ и условий, при которых протекает реакция.
При высоких температурах большинство металлов сгорает в кислороде:
2Mg + O2 = 2MgO
Не окисляются в этих условиях только золото, серебро, платина и некоторые другие металлы.
С галогенами многие металлы реагируют без нагревания. Например, порошок алюминия при смешивании с бромом загорается:
2Al + 3Br2 = 2AlBr3
При взаимодействии металлов с водой в некоторых случаях образуются гидроксиды. Очень активно при обычных условиях взаимодействуют с водой щелочные металлы, а также кальций, стронций, барий. Схема этой реакции в общем виде выглядит так:
Ме + HOH → Me(OH)n + H2↑
Другие металлы реагируют с водой при нагревании: магний при её кипении, железо в парах воды при красном кипении. В этих случаях получаются оксиды металлов.
В этих случаях получаются оксиды металлов.
Если металл реагирует с кислотой, то он входит в состав образующейся соли. Когда металл взаимодействует с растворами кислоты, он может окисляться ионами водорода, имеющимися в этом растворе. Сокращённое ионное уравнение в общем виде можно записать так:
Me + nH+ → Men+ + H2↑
Более сильными окислительными свойствами, чем ионы водорода, обладают анионы таких кислородосодержащих кислот, как например, концентрированная серная и азотная. Поэтому с этими кислотами реагируют те металлы, которые не способны окисляться ионами водорода, например, медь и серебро.
При взаимодействии металлов с солями происходит реакция замещения: электроны от атомов замещающего – более активного металла переходят к ионам замещаемого – менее активного металла. То сеть происходит замещение металла металлом в солях. Данные реакции не обратимы: если металл А вытесняет металл В из раствора солей, то металл В не будет вытеснять металл А из раствора солей.
В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг друга из водных растворов их солей, металлы располагаются в электрохимическом ряду напряжений (активности) металлов:
Li → Rb → K → Ba → Sr → Ca → Na→ Mg → Al → Mn → Zn → Cr → → Fe → Cd→ Co → Ni → Sn → Pb → H → Sb → Bi → Cu → Hg → Ag → Pd → Pt → Au
Металлы, расположенные в этом ряду левее, более активны и способны вытеснять следующие за ними металлы из растворов солей.
В электрохимический ряд напряжений металлов включён водород, как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы. Поэтому водород замещает некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Zn + 2 HCl = ZnCl2 + H2↑ + Q
Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов многих кислот (соляной, серной и др.), а все следующие за ним, например, медь не вытесняют.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Химические свойства металлов и неметаллов
Введение
Металлы и неметаллы – это элементы, которые нас окружают. Итак, важно знать, является ли тот или иной элемент металлом или неметаллом. Материалы можно разделить на металлы и неметаллы. Характерной особенностью металлов, таких как алюминий и медь, является высокая электрическая и теплопроводность, тогда как неметаллы, такие как сера и металлический фосфор, являются изоляторами. Элементы различаются как металлы или неметаллы в зависимости от их свойств.
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из них любым обычным химическим или физическим методом. Металлы и неметаллы являются неотъемлемой частью нашей жизни. Мы не можем выжить без некоторых неметаллов, таких как кислород, и без существования металлов наше выживание было бы трудным.
Мы не можем выжить без некоторых неметаллов, таких как кислород, и без существования металлов наше выживание было бы трудным.
[Изображение скоро будет загружено]
Что такое металлы?
Большинство элементов периодической таблицы представляют собой металлы. К ним относятся переходные металлы, лантаноиды, щелочные металлы, актиниды и щелочноземельные металлы.В периодической таблице металлы разделены неметаллами зигзагообразной линией, начинающейся от углерода до радона. Между ними находятся селен, фосфор и йод.
Элементы этих видов и элементы справа от них в периодической таблице являются неметаллами. Элементы, находящиеся слева от линии, известны как полуметаллы или металлоиды. Они будут иметь смешанные свойства металлов и неметаллов.
Что такое неметаллы?
Неметаллы являются очень немногими числами в таблице Менделеева.Они расположены в правой части периодической таблицы. К элементам, относящимся к неметаллам, относятся сера, углерод, фосфор, все галогены, водород, кислород, азот, селен и инертные газы.
В периодической таблице неметаллы расположены слева от галогенов и справа от металлоидов. Поскольку галогены и благородные газы также являются неметаллами, эти элементы часто называют неметаллами.
Химические свойства металлов
Некоторые химические свойства металлов перечислены ниже.
Обычно плотность металлов высока.
Металлы пластичны и ковки.
Металлы образуют сплавы с другими металлами или неметаллами.
Некоторые металлы, такие как железо, вступают в реакцию с воздухом и вызывают коррозию.
Металлы, за исключением свинца, являются хорошими проводниками тепла и электричества.
В целом, за исключением ртути, все остальные металлы находятся в твердом состоянии при комнатной температуре.
 Но Меркурий принадлежит к жидкому состоянию.
Но Меркурий принадлежит к жидкому состоянию.Другие металлы производят оксид металла при горении в кислороде воздуха. Высокореакционноспособные металлы бурно реагируют при сгорании в кислороде.
Такие металлы, как калий и натрий, накапливаются в масле, поскольку они реагируют с воздухом за считанные секунды. Они относятся к высокореактивным металлам.
Менее активные металлы, такие как серебро, золото, платина и другие родственные металлы, не тускнеют. Они остаются блестящими и блестящими.
Металлы выделяют газообразный водород и оксид металла при взаимодействии с водой.
Растворимые оксиды металлов растворяются в воде и образуют гидроксид металла.
Не каждый металл вступает в реакцию с водой.
 Однако высокореактивные металлы, такие как натрий и калий, бурно реагируют с водой, и происходит экзотермическая реакция, при которой водород немедленно воспламеняется.
Однако высокореактивные металлы, такие как натрий и калий, бурно реагируют с водой, и происходит экзотермическая реакция, при которой водород немедленно воспламеняется.Когда металл реагирует с кислотой, образуются водород и соль
Металл обычно вытесняет менее реакционноспособный металл в растворе соли металла.
Химические свойства неметаллов
Ниже перечислены некоторые химические свойства неметаллов.
Неметаллы, кроме газообразного углерода и графита, являются плохими проводниками тепла и электричества.
В отличие от металлов неметаллы не пластичны и не податливы.
Неметаллы сильнее реагируют с металлами, чем с неметаллами.
Неметаллы обычно реагируют с другими неметаллами при высоких температурах.

Большинство неметаллов не реагируют с воздухом при комнатной температуре.
Единственным неметаллом является белый фосфор, который реагирует с воздухом с образованием оксида при горении.
Неметаллы обычно не реагируют с водой. За исключением хлора, хлор растворяется в воде с образованием кислого раствора.
Неметаллы имеют низкую плотность по сравнению с металлами.
Неметаллы не образуют сплавов. Однако некоторые из них, такие как углерод, кремний и фосфор, могут образовываться.
При комнатной температуре неметаллы существуют во всех агрегатных состояниях.
Различные неметаллы всегда имеют разные реакции.

В семействе галогенов наиболее активным металлом является хлор, то есть бром (Br), йод (I), хлор (Cl) и фтор (F). Порядок реакционной способности семейства галогенов: Cl > Br > I.
Таким образом, хлор (Cl) может вытеснять бром (Br) и йод (I) из растворов йодидов (NaI) и бромидов (NaBr).
Ионные твердые вещества образуются при взаимодействии неметаллов с высокой электроотрицательностью с щелочноземельными металлами и щелочью.
Различия между химическими свойствами металлов и неметаллов приведены в таблице ниже.
Разница между химическими свойствами металла и неметаллов
Metals | |
Металлы легко оформляются. | Неметаллы плохо поддаются коррозии. |
Имеют 1, 2 или 3 электрона на валентной оболочке. Поэтому они могут легко терять электроны. | Неметаллы имеют более 4 электронов на своей валентной оболочке. Поэтому они могут легко получить электроны. |
Металлы образуют основные оксиды | Они образуют кислотные оксиды. |
Они электроположительны по своей природе | Они электроотрицательны по своей природе. |
Они действуют как хороший восстановитель. | Они действуют как отличный окислитель. |
Металлы и неметаллы | Физические и химические свойства металлов и неметаллов
Введение
Каждый объект вокруг нас можно разделить на два типа элементов: металлы и неметаллы. Ваши книги, одежда, карандаш, бутылка с водой, сумка, стол, дверь — все это примеры неметаллов. Поэтому важно знать свойства металлов и неметаллов и как их различать.
Ваши книги, одежда, карандаш, бутылка с водой, сумка, стол, дверь — все это примеры неметаллов. Поэтому важно знать свойства металлов и неметаллов и как их различать.
Периодическая таблица
Периодическая таблица представляет собой расположение элементов на основе определенных химических свойств, которые они проявляют. Металлы расположены слева, а неметаллы справа в периодической таблице. Строки таблицы называются периодами, а столбцы — группами. Известно, что в природе встречаются в общей сложности 92 элемента, из которых 70 — металлы и 22 — неметаллы.
Металлы
В приведенном выше изображении периодической таблицы большинство элементов представляют собой металлы.Есть различные виды металлов:
щелочноземельные металлы
щелочных металлов
переходные металлы
актиниды и
лантанидов
Металлы, расположенные в левой части таблицы Менделеева, отделены от неметаллов зигзагообразной линией, которая начинается от углерода (C) и проходит вниз по фосфору (P), селену (Se), йоду (I) , до Радона (Рн). Следовательно, эти химические элементы и все, что находится справа от них, являются неметаллами, а ряд слева от них известен как полуметаллы или металлоиды. Они обладают свойствами, общими как для металлов, так и для неметаллов.
Следовательно, эти химические элементы и все, что находится справа от них, являются неметаллами, а ряд слева от них известен как полуметаллы или металлоиды. Они обладают свойствами, общими как для металлов, так и для неметаллов.
(Изображение будет добавлено в ближайшее время)
Физические свойства
Металлы существуют в твердом состоянии. Все металлы твердые, за исключением ртути, которая в естественном состоянии находится в жидком состоянии.
Металлы по своей природе пластичны.Их можно растолочь в тонкие листы. Например, такие элементы, как алюминий, золото и серебро, могут быть выкованы в тонкие листы для общего использования.
Металлы пластичны. Это означает, что металлы можно растянуть в тонкую проволоку. Мы можем сделать медные провода и алюминиевые провода. Все металлы одинаково пластичны.
 Только то, что некоторые металлы более пластичны, чем другие, для которых они используются в повседневных целях.
Только то, что некоторые металлы более пластичны, чем другие, для которых они используются в повседневных целях.Металлы проводят тепло и электричество. Именно благодаря этому свойству металлов через них может проходить тепло и электричество.Каждый металл является хорошим проводником тепла и электричества.
Примечание: Серебро является лучшим проводником тепла и электричества, медь также является хорошим проводником. Худшим проводником тепла является свинец, тогда как железо и ртуть плохо проводят электричество.
Металлы блестят. Именно благодаря этому свойству металлов они блестят и отражают свет, падающий на их поверхность. Кроме того, металлы можно полировать, и это одна из причин, почему металлы используются для изготовления украшений и востребованы как женщинами, так и мужчинами.
Металлы очень прочные и твердые, за исключением натрия и калия.
 Их можно порезать ножом.
Их можно порезать ножом.Также известно, что металлы тяжелые.
Металлы тоже звонкие. Они издают звук, когда в них звонят или ударяют каким-либо предметом.
Металлы имеют высокую температуру плавления и высокую температуру кипения.
Металлы имеют высокую плотность.
Металлы в виде предметов непрозрачны и никогда не бывают прозрачными или полупрозрачными.
Химические свойства
Металлы легко и быстро подвергаются коррозии.
Металлы легко теряют электроны. Их внешняя оболочка имеет 1, 2 или 3 электрона.
Большинство металлов образуют оксиды металлов при контакте с кислородом.

Металлы имеют низкую электроотрицательность, являются электроположительными элементами.
Металлы также являются хорошими восстановителями.
Неметаллы
Неметаллические элементы – это элементы, не обладающие свойствами металлов.Количество неметаллов в периодической таблице очень меньше по сравнению с металлами. Неметаллы расположены в правой части периодической таблицы. Некоторыми примерами неметаллов являются водород, углерод, азот, фосфор, кислород, сера, селен, все галогены и благородные газы.
(Изображение будет добавлено в ближайшее время) (Изображение будет добавлено в ближайшее время)
Физические свойства
Неметаллы являются хрупкими и распадаются на куски при ударе. Пример: сера и фосфор.
Неметаллы не пластичны, поэтому из них нельзя сделать тонкую проволоку.

Неметаллы являются изоляторами или плохими проводниками электричества и тепла, поскольку они не теряют электронов при передаче энергии.
При комнатной температуре они могут находиться в твердом, жидком или газообразном состоянии.
Незвонкие.
Могут быть прозрачными.
Химические свойства
Неметаллы обычно имеют от 4 до 8 электронов на внешней оболочке.
Неметаллы склонны приобретать или принимать валентные электроны.
При контакте с кислородом неметаллы реагируют с кислородом с образованием кислотных оксидов.
Неметаллы обладают высокой электроотрицательностью; они являются электроотрицательными элементами.

Неметаллические элементы являются хорошими окислителями.
Эти элементы не вступают в реакцию с водой.
Сравнение физических свойств металлов и не металлов
Металлы | 160157||
Физическое состояние | Твердый при комнатной температуре.Исключение составляют ртуть и галлий. | Существуют в виде твердых и газообразных веществ, за исключением брома. |
Плотность | Высокая плотность | Низкая. |
Температура плавления и кипения | Высокая температура плавления и кипения Исключение составляют галлий и цезий. | Низкая температура плавления и кипения. Исключение составляют алмаз и графит. |
Пластичность и ковкость | ковкий и пластичный | не ковкий и не пластичный. |
Проводимость | Проводит тепло и электричество | Плохо/плохо проводит тепло и электричество, за исключением графита. |
Блеск | Сияющий блеск | Они не имеют блеска, кроме йода. |
Звонкий звук | Звонкий. | Незвонкие. |
Твердость | Вообще сложное исключение Na, K | Вообще мягкие, кроме Diamond |
Сравнение химических свойств металлов и не металлов
Тип реакции | Металлы | 157|
Реакция с H3O | Металлы на взаимодействие с водными оксидами металлов или гидроксидов металла и выброс газа H3. | Неметаллы не могут отдавать электроны водороду в воде, который выделяется в виде газа h3. Неметаллы не реагируют с водой. |
Реакция с O2 | Металлы реагируют с кислородом с образованием основных оксидов. Zn и Al образуют амфотерные оксиды, которые проявляют свойства как кислотных, так и основных оксидов. Большинство оксидов металлов нерастворимы в воде. Некоторые из них растворяются с образованием щелочи. | Неметаллы реагируют с кислородом с образованием оксидов.Оксиды неметаллов растворимы в воде. Они растворяются в воде с образованием кислот. |
Реакция с кислотами | Металлы реагируют с кислотой с образованием соли и выделением водорода. Когда металлы реагируют с HNO3, h3 не выделяется. HNO3 — сильный окислитель. | Не происходит реакции с кислотами с выделением газа h3. Неметаллы не отдают электроны, чтобы отдать их водородным ионам кислот. |
Реакция с растворами солей | Когда металлы реагируют с раствором соли, более активные металлы вытесняют менее активные металлы из раствора соли. | Здесь более реакционноспособные неметаллы вытесняют менее реакционноспособные неметаллы из раствора соли. |
Реакция с хлором | Металлы реагируют с хлором с образованием хлорида металла. Это ионная связь. Мы получаем ионное соединение | Неметаллы реагируют с хлором с образованием хлорида неметалла. Он образует ковалентную связь. То, что мы получаем, является ковалентным соединением. |
Реакция с h3 | Только высокореактивные металлы реагируют с водородом с образованием гидрида металла. | Неметаллы реагируют с водородом с образованием гидридов. |
Таблица ряда реакционной способности показывает порядок, в котором металлы расположены на основе их сравнительной реакционной способности.
Этапы извлечения металлов из руды
прокаливание и обжаривание
Прокаливание | Обжалование | |||
В этом процессе образуются руды в отсутствие кислорода, где образовывается оксид металла и выбросы CO2.Это делается для карбонатных рудCaCO3 → CaO + CO2(g) | В этом процессе серная руда нагревается в присутствии кислорода. Образуется оксид металла и выделяется газ SO2. Это делается для сульфидных руд. ZnS+ 3O2 нагрев 3ZnO+ SO2 |
Вопросы
1. Возьмите образцы Fe, Cu, Al, Mg и отметьте внешний вид каждого образца.
2. Приведите пример каждого:
i. Металл, который является жидким при комнатной температуре.
Металл, который является жидким при комнатной температуре.
ii. Металл, который легко режется ножом.
iii. Металл, который является хорошим проводником тепла.
3. Объясните значение слов податливый и пластичный.
4. Что вы понимаете под реакцией смещения?
5. Приведите пример реакции смещения.
6. Видели ли вы когда-нибудь кузнеца, отбивающего кусок железа? Какие изменения вы обнаружили в форме этих кусочков при отбивании? Обнаружите ли вы подобное изменение в деревянном бревне при ударе?
7. Назовите два наиболее ковких металла.
8.Докажите, что металлы являются хорошими проводниками электричества.
9. Перечислите некоторые физические свойства металлов.
10. Напишите некоторые физические свойства неметаллов.
11. Что происходит при взаимодействии натрия и воды.
12. Почему неметаллы не реагируют с водой?
13. Заполните пропуски:
Заполните пропуски:
i. Оксиды неметаллов ……………… в воде.
ii. Неметаллы не отдают электроны, чтобы отдать их ионам водорода ……….
iii. При таком обжиге руды нагреваются в отсутствие кислорода, при этом образуется оксид металла и выделяются ………………….
iv. При обжиге в этом процессе образуется оксид металла и ……………….. выделяются газы.
v. При взаимодействии металлов с раствором соли более реакционноспособные металлы …………………. менее реакционноспособные металлы из его солевого раствора.
VI. Неметаллы …………… и при ударе распадаются на куски.
vii. Неметаллы не …………… поэтому из них нельзя сделать тонкую проволоку.
14. Назовите три причины следующего:
(i) Почему сера является неметаллом?
(ii) Почему магний является металлом?
(iii) Вам даются три разных образца металлов. Натрий, магний и медь. Напишите любые два действия, чтобы расположить их в порядке убывания активности.
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.
Металлы находятся в центре и слева в периодической таблице. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок по металлургии
Свойства металлов
Элемент – это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.
- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму. На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком.Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода. Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы претерпевают химические изменения (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они находятся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не реагируют с другими металлами.Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются в виде чистых металлов, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений.
Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах.Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Бедные металлы довольно мягкие, и большинство из них сами по себе мало используются. Однако они становятся очень полезными при добавлении к другим веществам. К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные комбинации
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называют сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются формовке и красивы на вид. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения.Чистота золота измеряется в карат. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов рафинирования железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать, чтобы сформировать кованое железо .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Учитывая процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: процесс и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже дыры в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом.Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такого рода химическому разрушению, или коррозии .
Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
С другой стороны, железо и сталь имеют серьезные проблемы, если они не обработаны для предотвращения коррозии.Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другой метод гальванизация : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии.Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Технология: фейерверки и химия
Если вы посмотрите на фейерверк Четвертого июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (тех, которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, которая при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездочками , и сделаны из того же соединения, что и бенгальский огонь.
Металлы как красители
Разные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Соединения с меньшей реакционной способностью не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Дополнительные материалы по металлам:
Свойства металлов — Металлическая структура и связь — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Физические свойства
Типичные физические свойства металлов:
Некоторые металлы обладают нетипичными свойствами. Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- элементы в группе 1 имеют низкие температуры плавления, но также и низкие плотности, например, натрий менее плотный, чем вода и поэтому оно плавает
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.Например, объем жидкости в банке с напитком равен 330 см 3 . Если бы банка была наполнена натрием (плотность = 0,97 г/см 3 ), то масса банки была бы около 320 г. Однако если бы банка была наполнена свинцом (плотность = 11,34 г/см 3 ), то масса банки была бы около 3,75 кг!
Податливые вещества можно согнуть или придать им форму без разрушения, в то время как хрупкие вещества рассыпаются при сгибании или ударе.
Металлы считаются пластичными, поскольку их можно вытягивать в тонкую проволоку.
Точка плавления и точка кипения
Когда металл плавится или кипит, это изменение физического состояния.
Энергия передается веществу для его плавления или кипения. Эта энергия необходима для преодоления сил притяжения между ионами металла и делокализованными электронами в металле. Чем больше энергии требуется, тем выше температура плавления или кипения.
Поскольку металлы представляют собой гигантские решетчатые структуры, количество электростатических сил, которые необходимо разрушить, чрезвычайно велико, поэтому металлы имеют высокие температуры плавления и кипения.Это означает, что температура плавления и температура кипения металлов больше похожи на таковые для ионных соединений, чем для ковалентных веществ.
Например, в таблице приведены данные для магния, хлора и хлорида магния.
| вещество | Формула | Палаты на | кипит на | Bond Type | ||
|---|---|---|---|---|---|---|
| Magnesium | MG | 650 ° C | 1091 ° C | Metallic | ||
| Chreine | CL 2 2 | -101 ° C | -34 ° C | 9094 -34 ° CПростые молекулярные | ||
| 9095 | ||||||
| MGCL 2 | 714 ° C | 1412 ° C | IONIC |
Объяснение свойств металлов
Пластичность и пластичность
Структура металлов состоит из слоев ионов металлов.Эти слои могут скользить друг по другу при приложении силы. Это означает, что слои металла можно расплющить молотком, а также скользить друг по другу, образуя тонкие провода.
Металлическое соединение позволяет металлу изменять форму без разрушения.
Проводимость электричества
Вещества проводят электричество, потому что они содержат заряженные частицы, способные двигаться.
Когда к металлу прикладывается напряжение, делокализованные электроны проходят через структуру решетки.Движение этих заряженных частиц образует электрический ток. Обратите внимание, что ионы металлов в металлической решетке удерживаются в фиксированных положениях и не могут двигаться.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
металлоидных элементов периодической таблицы: определение и свойства — видео и расшифровка урока
Металлоиды представляют собой уникальную группу элементов, которые обладают свойствами как металлов, так и неметаллов.Их также называют полуметаллами из-за общих свойств этих элементов вдоль разделительной линии между металлами и неметаллами. Элементы, которые могут быть классифицированы как металлоиды, включают:
- Бор _ (B)
- Кремний (Si)
- Германий (Ge)
- Мышьяк (As)
- Сурьма (Sb)
- Теллур (Te)
- Полоний (Po)
- Астатин (В)
Как бы вы узнали, если бы смотрели на металлоид? Большинство металлоидов являются твердыми при комнатной температуре.Если бы вы могли наблюдать металлоид вблизи, он мог бы показаться хрупким, как этот образец бора.
Некоторые также имеют блестящий металлический вид, как этот образец кремния.
Некоторые металлоиды пластичны, что означает, что их можно легко растянуть в тонкую проволоку. Некоторые металлоиды также податливы, а это означает, что они легко принимают новые формы, не ломаясь.
В зависимости от температуры, в которой они обнаружены, металлоиды могут действовать как электрический изолятор или электрический проводник. Изолятор представляет собой материал, который останавливает поток электронов, например пластиковый материал, окружающий провода. Проводник представляет собой материал, через который легко проходят электроны. Ученые часто называют металлоиды полупроводниками, потому что они хорошо проводят электричество. При умеренных температурах металлоиды действуют как хорошие изоляторы.Когда температура становится выше и они нагреваются, они гораздо лучше проводят электричество.
Некоторые из химических свойств металлоидов включают в себя то, как они реагируют с другими элементами. Металлоиды могут образовывать сплавы с другими металлами, а также сжиматься при плавлении. Они также могут образовывать соединения с галогенами, еще одной группой элементов периодической таблицы.
Металлоиды можно найти в качестве материалов во многих электрических устройствах, таких как компьютеры, схемы и калькуляторы.Их полупроводниковые свойства делают эти материалы хорошим выбором для электроники. Инновации в технологии позволили полупроводникам включать и выключать электронику с помощью изменения температуры, поскольку металлоиды имеют разные электропроводящие свойства при разных температурах. Германий и кремний являются металлоидами, наиболее часто используемыми в электронике. Кремний является вторым наиболее распространенным элементом в земной коре после кислорода и содержится в кремнеземе и силикатных минералах, из которых состоят горные породы, песок и почва.
Резюме урока
Элементы периодической таблицы могут быть сгруппированы как металлы, неметаллы или металлоиды. Все металлоидов обладают некоторыми свойствами как металлов, так и неметаллов и расположены непосредственно между двумя группами периодической таблицы. Металлоиды твердые, и большинство из них блестящие на вид. Некоторые из них имеют хрупкую текстуру, а другие пластичные, что означает, что их можно легко растянуть в тонкую проволоку. Металлоиды также являются полупроводниками, что делает их хорошим материалом для использования в электронных устройствах, таких как компьютеры.
Металлы и неметаллы — определение, 16 ключевых различий, примеры
Главная » Различия между » Металлы и неметаллы — определение, 16 ключевых различий, примеры
Определение металловМеталлы — это группа элементов, которые характеризуются определенными физическими и химическими свойствами, такими как ковкость, пластичность, электрическая и теплопроводность.
- Металлы в основном присутствуют под поверхностью Земли и встречаются в различных горных породах и структурах, называемых рудами.Некоторые металлы могут существовать в свободной форме, так как они не реагируют с другими элементами.
- На их долю приходится около трех четвертей всех известных элементов, открытых на сегодняшний день. Около 25% земной коры состоит из химических металлов природного происхождения.
- Термин «металл» может использоваться для обозначения любого вещества, способного проводить электричество, и было замечено, что элементы, не относящиеся к категории металлов, могут становиться металлическими при высоком давлении и температуре.
- Большинство металлов существуют в твердой кристаллической структуре, где каждый металл может иметь характерную кристаллическую структуру, отличающуюся определенной упаковкой атомов и симметрией.
- В атомном отношении металлы обычно имеют менее половины электронов на внешней оболочке, что необходимо для завершения стабильной конфигурации.
- Атомная конфигурация металлов не позволяет им образовывать соединения с другими металлами. Они легко реагируют с неметаллами, образуя различные соединения.
- Большинство характерных свойств металлов являются результатом присутствия свободных электронов на самой внешней оболочке.
- Механические свойства металлов, такие как твердость, ковкость и пластичность, являются результатом их плотно упакованной кристаллической структуры.
- Химические элементы расположены в правой части таблицы Менделеева, где они расположены в зависимости от их атомной структуры.
- Металлические элементы можно разделить на разные группы в периодической таблице; щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, лантаниды и актиноиды.
- Разные металлы могут соединяться друг с другом для образования сплавов, в которых используются разные характеристики разных металлов для требуемой цели.
- Металлы веками использовались пещерными людьми в качестве инструментов для еды и жилья для частей космических кораблей и ракет, запускаемых в космос.
- Поскольку многие металлы имеют блеск или блеск, они также используются в декоративных целях.
Неметаллы — это группа веществ, которые не обладают характерными свойствами металлов и обычно не поддаются ковке, не пластичны и плохо проводят тепло и электричество.
- Неметаллы могут существовать в твердом, жидком или газообразном состояниях и, в отличие от металлов, обладают более широким набором свойств.
- Неметаллы имеют более высокое сродство к электрону и электроотрицательность, поскольку они имеют более половины числа электронов на их самой внешней оболочке, которое требуется для достижения стабильной конфигурации.
- Существует семнадцать элементов, которые классифицируются как неметаллы, большинство из которых представляют собой газы, некоторые — твердые вещества, а бром — жидкость.
- Эти газообразные неметаллы в основном находятся в атмосфере, тогда как твердые и жидкие неметаллы можно найти на поверхности Земли.
- Твердые неметаллы обычно мягкие и аморфные, без определенной структуры или решетки и, таким образом, обычно хрупкие.
- Неметаллы обладают более широким диапазоном механических и оптических свойств, поскольку они могут быть от хрупких до пластичных и от прозрачных до непрозрачных.
- Несмотря на то, что неметаллы предпочтительно реагируют с металлами с образованием соединений, некоторые неметаллы также могут реагировать друг с другом, в зависимости от разницы в их энергиях ионизации и электроотрицательности.
- Неметаллы расположены в правой части периодической таблицы в зависимости от их атомной структуры; однако водород — это неметалл, присутствующий слева.
- Неметаллы можно разделить на две категории; химически активные неметаллы и благородные газы. Реакционноспособные неметаллы, такие как углерод и сера, обладают неметаллическими свойствами от умеренных до слабых и, таким образом, могут образовывать ковалентные соединения с металлами.
- Более реакционноспособные неметаллы, такие как фтор и кислород, обычно обладают сильными неметаллическими свойствами и могут образовывать ионные соединения с металлами.
- Благородные газы представляют собой нереакционноспособные стабильные неметаллы, которые не реагируют с другими элементами, поскольку имеют стабильную электронную конфигурацию.
- Неметаллы необходимы для различных целей, поскольку неметаллы, такие как углерод, кислород и водород, составляют основу живых существ.
- Кислород является одним из наиболее важных неметаллов, который необходим всем живым существам для выживания.
- Кроме того, другие неметаллы, такие как сера, фосфор и йод, считаются микроэлементами для различных живых существ.
| Характеристики | Металлы | Неметаллы |
| Определение | Металлы — это группа элементов, которые характеризуются определенными физическими и химическими свойствами, такими как ковкость, пластичность, электрическая и теплопроводность. | Неметаллы — это группа веществ, которые не обладают характерными свойствами металлов и обычно не поддаются ковке, не пластичны и плохо проводят тепло и электричество. |
| Периодическая таблица | Металлы расположены в левой части таблицы Менделеева. | Неметаллы расположены в правой части таблицы Менделеева. |
| Металлы присутствуют в блоках s, p, d и f таблицы. | Неметаллы присутствуют в блоках s и p таблицы. | |
| Физические свойства | Металлы блестят или имеют блеск. | Неметаллы тусклые, без блеска. |
| Металлы обычно твердые и твердые. | Неметаллы могут быть твердыми, жидкими и газообразными. Твердые неметаллы обычно мягкие. | |
| Металлы обычно существуют в кристаллической структуре. | Неметаллы обычно существуют в аморфной структуре. | |
| Металлы ковкие. | Неметаллы не поддаются ковке. | |
| Металлы пластичны. | Неметаллы непластичны. | |
| Тепло- и электропроводность металлов достаточно высока. | Неметаллы не обладают слабой тепло- и электропроводностью. | |
| Электроотрицательность | Металлы имеют более низкую электроотрицательность. | Неметаллы имеют более высокую электроотрицательность. |
| Энергия ионизации | Металлы имеют более низкую энергию ионизации. | Неметаллы имеют более высокую энергию ионизации. |
| Прочность на растяжение | Металлы обладают высокой прочностью на растяжение из-за более прочной связи притяжения между молекулами. | Неметаллы имеют низкую прочность на растяжение из-за более слабой связи притяжения между молекулами. |
| Температура плавления и кипения | Металлы имеют высокую температуру кипения и плавления. | Неметаллы имеют низкую температуру кипения и плавления. |
| Электроны на валентной оболочке | Металлы обычно имеют менее половины электронов на внешней оболочке, что необходимо для завершения стабильной конфигурации. | У них более половины числа электронов на внешней оболочке, необходимого для достижения стабильной конфигурации. |
| Изобилие | Металлов больше, чем неметаллов. | Неметаллов меньше, чем металлов. |
| Примеры | Некоторыми примерами металлов являются железо, золото, натрий, цинк и т. д. | Некоторыми примерами неметаллов являются кислород, азот, сера, хлор, бром и т. д. |
- Алюминий является наиболее распространенным металлическим элементом на поверхности Земли, обычно используемым в качестве цветного металла.
- Алюминий не встречается в природе в металлическом виде и извлекается в виде соединений из горных пород, растительности и животных.
- Алюминий имеет большое сродство к кислороду, поэтому на его поверхности обычно имеется слой оксида. Алюминий
- обычно мягкий, ковкий и пластичный и поэтому используется для производства проволоки и листов.
- Считается мягким металлом, принадлежащим к группе бора щелочноземельных металлов в периодической таблице.
- Атом алюминия состоит из 13 электронов с тремя электронами на самой внешней оболочке. Атомы имеют низкую энергию ионизации и высокую электроотрицательность. Алюминий
- все чаще используется в автомобильной и текстильной промышленности, поскольку он не ржавеет и легче железа.
- Азот является наиболее распространенным элементом на поверхности Земли и одним из основных компонентов всего живого.
- Азот на Земле также встречается в виде аммиака, азотной кислоты и солей аммония. Некоторое количество азота может встречаться и в месторождениях полезных ископаемых.
- Азот является самым легким элементом семейства азота и присутствует в р-блоке периодической таблицы.
- Атомы азота имеют семь электронов, из которых пять электронов находятся на самой внешней орбите.
- Азот легко реагирует с такими металлами, как алюминий и натрий, и образует ковалентные связи.
- Азот — это макроэлемент, который содержится в основных биомолекулах, таких как аминокислоты и нуклеиновые кислоты.
- Кроме того, жидкий азот используется в криогенике для сохранения хрупких соединений.
- Gautum SD, Pant M и Adhikari NR (2016). Всесторонняя химия, часть 2. Шестое издание. Издатели и дистрибьюторы наследия Pvt. ООО
- Такай, Кен. «Азотный цикл: большой, быстрый и загадочный цикл». Микробы и окружающая среда vol. 34,3 (2019): 223-225. дои: 10.1264/jsme2.ME3403rh
- Клотц, Катрин и др. «Влияние на здоровье воздействия алюминия». Deutsches Arzteblatt international vol.114,39 (2017): 653-659. doi:10.3238/arztebl.2017.0653
- https://en.wikipedia.org/wiki/Polyatomic_nonmetal — 12%
- https://en.wikipedia.org/wiki/Металл — 9%
- https://www.yourarticlelibrary.com/science/metals-and-nonmetals-physical-properties-chemical-behaviour-and-uses-with-diagram/31645 — 3%
- https://www.ducksters.com/science/chemistry/nitrogen.php — 1%
- https://www.britannica.com/science/nonmetal — 1%
- https://www.britannica.связь/наука/химия металлов – 1%
- https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Descriptive_Chemistry/Periodic_Trends_of_Elemental_Properties/Periodic_Properties_of_the_Elements — 1%
- https://www.ausetute.com.au/spdfblocks.html — 1%
- https://www.answers.com/Q/Do_non_metals_have_high_melting_or_points — 1%
 Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
 (приложение 1)
(приложение 1)

 Но Меркурий принадлежит к жидкому состоянию.
Но Меркурий принадлежит к жидкому состоянию. Однако высокореактивные металлы, такие как натрий и калий, бурно реагируют с водой, и происходит экзотермическая реакция, при которой водород немедленно воспламеняется.
Однако высокореактивные металлы, такие как натрий и калий, бурно реагируют с водой, и происходит экзотермическая реакция, при которой водород немедленно воспламеняется.


 Только то, что некоторые металлы более пластичны, чем другие, для которых они используются в повседневных целях.
Только то, что некоторые металлы более пластичны, чем другие, для которых они используются в повседневных целях. Их можно порезать ножом.
Их можно порезать ножом.


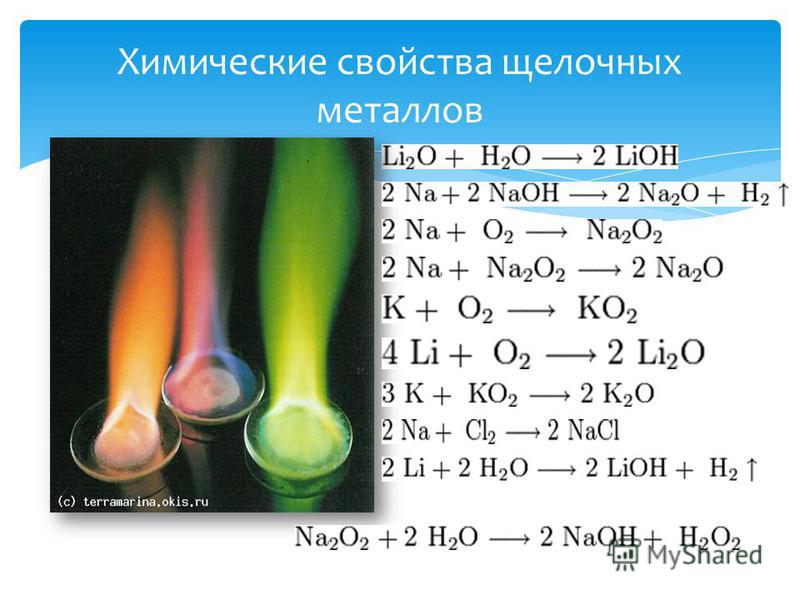


 Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.