Методическая разработка по химии (8 класс) по теме: План – конспект урока. Тема: «Химические свойства оснований»
Поэтому исходя из темы сразу же 1 вопрос: (Фронтальная беседа.)
Вопрос 1. Какой класс веществ называется «Основания»? (дать определение).
Ответ: Основаниями, называют сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими гидроксогруппами.
Вопрос 2. Какова валентность гидроксогруппы?
Ответ; Валентность гидроксогруппы постоянная и ровна I.
Вопрос 3. Что означает число, стоящее после гидроксогруппы?.
Ответ: Это индекс, показывающий, число групп ОН входящих в данное соединение, он равен валентности металла образовавшего данный гидроксид.
Задача 1. Составьте и произнесите формулы следующих гидроксидов: гидроксид натрия, гидроксид кальция, гидроксид железа (III), гидроксид калия, гидроксид аммония, гидроксид магния.
.Ответ: NaOH Ca(OH)2 Fe(OH)3 KOH Al(OH)3 Mg(OH)2
Раз существует в химии целый класс веществ называемых основаниями, значит известно большое количество различных оснований, для которых характерны свои свойства, обычно в химии вещества с одинаковыми свойствами объединяют в одну группу, или говоря другими словами классифицируют.
Вопрос 4. Есть ли такая классификация у оснований?
Ответ: Да есть.
Задача 2. Согласно известной вам классификации приведите примеры оснований, на каждую группу по 2 примера.
Ответ: Щелочи: NaOH – гидроксид натрия, KOH – гидроксид калия.
Нерастворимые: Cu(OH)2 гидроксид меди, Fe(OH)3 – гидроксид железа
Обратите внимание на демонстрационном столе находятся некоторые из представителей класса оснований, все они в твердом виде, а рядом с растворимыми основаниями – щелочами, представлены и их растворы.
Вопрос 5. Какие физические свойства характерны для оснований?.
Ответ: Основания в основном твердые вещества с различной растворимостью в воде.
Конспект урока по химии «Основания, их классификация и свойства» (8 класс)
Муниципальное бюджетное общеобразовательное учреждение
«Средняя школа № 2» города Велижа Смоленской области
Методическая разработка урока
«Основания»
(8класс)
Провела: Нахаева М.И., учитель химии
2017
Тема урока: «Основания, их классификация и свойства»
Цели
Дидактическая: создать условия для осознания и осмысления новой учебной информации, ее применение в новой учебной ситуации. Образовательная: познакомить учащихся с химическими свойствами оснований.
Развивающая: развивать критическое мышление через чтение информационного текста, логическое мышление, умение работать в группе.
Воспитательная: поддерживать дух толерантности; воспитывать умение внимательно слушать и слышать, уважать другое мнение.
Планируемые результаты
Предметные: научиться объяснять, делать выводы и заключения о свойствах оснований;
Метапредметные:
познавательные – научиться устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы;
смысловое чтение: формирование навыков самостоятельного приобретения, пополнения, переноса и интергации знаний; регулятивные – умение самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учебе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности; умение соотносить свои действия с планируемыми результатами; умение оценивать правильность выполнения учебной задачи, собственные возможности ее решения; коммуникативные:
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками; работать в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов; формулировать, аргументировать и отстаивать свое мнение.Оборудование: мультимедиапроектор, презентация, ЦОР «Химические свойства оснований».
Основные этапы организации учебной деятельности: стадия вызова, стадия осмысления, рефлексия.
ХОД УРОКА
Стадия вызова
Цели этапа: актуализировать и обобщить имеющиеся знания; пробудить интерес к изучаемой теме, мотивировать ученика к учебной деятельности; пробудить ученика к активной деятельности на уроке.
Содержание педагогического взаимодействия. Деятельность учителя. Зачитывает информацию для осмысления. Организует повторение изученного материала и прогнозирование задач урока.
Деятельность обучающихся. Осмысливают информацию. Предлагают свои варианты.
Учитель. Добрый день!
Сегодня мы будем работать в группах. Для этого необходимо распределить роли. А во время урока соблюдать правила для работы в группе (см. приложение).
На обсуждение каждого задания отводится определенное время, после окончания которого ведущий дает ответ.
Урок я хочу начать с информации.
Вещества этого класса:
употребляются в химической промышленности, в мыловарении, для протравливания дерева, для очистки металлов (при гальванопластике), в текстильном производстве (отбелка, ситцепечатание) и во многих других;
растворяют жир;
предотвращают коррозию стали;
некоторые растворяют растительные и животные ткани;
взаимодействуют с определенными металлами;
эти вещества даже при умеренной концентрации могут вызывать «прижоги», болезненные язвы небольшого размера, носящие название «птичьих глазков».
Как вы думаете, о каком классе веществ идет речь? (Основания.)
Чтобы проверить свою догадку, выполните задание 1.
З а д а н и е 1 (2 мин.) Найдите связь между понятиями во второй паре понятий, аналогичную той, что приведена в первой паре. Объясните свое решение.
Гидроксид натрия : щелочь / гидроксид меди(II): нерастворимое основание*. Гидроксид натрия: электролит / гидроксид меди(II): неэлектролит.
Учитель. Какую информацию вы вспомнили, выполняя это задание? (Классификация оснований: растворимые и нерастворимые, электролиты и неэлектролиты.) Как называются растворимые основания? Какие щелочи вы знаете? Что такое электролиты? Какие основания относятся к электролитам? (Учащиеся отвечают.)
З а д а н и е 2 (2 мин.) Найдите связь между понятиями и впишите недостающее понятие, выбрав из предложенных: двухкислотные, щелочи, сильные, слабые. Объясните свой выбор.
Учитель. Какая информация содержится в этом задании? (Классификация оснований: однокислотные и многокислотные.)
Как определяется кислотность оснований? Какие вы знаете однокислотные основания, многокислотные? (Учащиеся отвечают.)
Выполните задание 3.
З а д а н и е 3 (2 мин.) Что лишнее и почему? Объясните свое решение.
1. NaOH; NaCl; Na2SO4; Na3PO4. (Единственное основание.)
2. NaOH; Ba(OH)2; KOH; Fe(OH)2. (Единственное нерастворимое основание.) 3. Cu(OH)2; Ca(OH)2; Ba(OH) 2; Fe(OH)3. (Единственное трехкислотное основание.)
Планируемые результаты.
Познавательные: умения устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы; навык смыслового чтения.
Коммуникативные: формирование навыков сотрудничества.
Личностные: формирование личного смысла учения и начальных форм рефлексии.
Регулятивные: умение самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учебе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности.
Стадия осмысления
Цель этапа.
Получение новой информации, ее осмысление и соотнесение с собственными знаниями.
Содержание педагогического взаимодействия. Деятельность учителя. Организует работу с текстом и другими образовательными ресурсами. Предлагает ответить на вопросы.
Деятельность обучающихся. Читают текст и решают проблему урока. Проводят самопроверку по образцу.
Учитель. Как вы думаете, что мы сегодня будем изучать? (Основания.)
Что именно про основания мы сегодня должны узнать? (Химические свойства.)
Сформулируйте и запишите тему сегодняшнего урока. (Основания, их классификация и химические свойства.)
Определите для себя цель урока. Для того чтобы выяснить, какие химические свойства характерны для оснований, выполните задание 4.
З а д а н и е 4 (5 мин.)
Ученикам восьмого класса для исследования химических свойств оснований были предложены следующие реактивы и оборудование: гидроксид натрия, гидроксид меди(II), оксид калия, оксид серы(VI), соляная кислота, серная кислота, хлорид меди(II), хлорид натрия, пробирки, пробиркодержатели, горелка, спички. Ваня и Саша распределили реактивы и оборудование следующим образом (см. табл. 1).
Какие опыты смогут провести мальчики? Составьте план решения задачи, используя следующие слова-подсказки: сложные вещества; реакции обмена; условия, при которых реакции идут до конца; реакции разложения.
Составьте схемы реакций.
Учитель. Какие трудности у вас возникли? Изучите правила. (На выполнение задания отводится 15 мин.)
Правила
1. Все основания реагируют с кислотами с образованием соли и воды.
2. Щелочи реагируют с оксидами неметаллов (кислотными оксидами) с образованием воды и соли той кислоты, которая соответствует кислотному оксиду (см. табл. 2).
3. Щелочи реагируют с солями с образованием нового основания и новой соли, если основание или соль выпадают в осадок.
4. Нерастворимые основания разлагаются при нагревании на оксид металла и воду.
Учитель. Определите, с какими веществами будет взаимодействовать щелочь и гидроксид меди(II)? Запишите уравнения возможных реакций, используя изученные правила. (Учащиеся пишут уравнения реакций.)
Ваня
2NaOH + SO3 = Na2SO4 + H2O,
2NaOH + CuCl2 = 2NaCl + Cu(OH)2,
NaOH + HCl = NaCl + H2O.
Саша
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O,
Cu(OH)2 = t CuO + 2H2O.
Учитель. С какими веществами основания вступают в химические реакции? В чем отличие свойств щелочей от свойств нерастворимых оснований? (Самопроверка по слайду презентации. 8 мин.)
Проверим, как вы усвоили новый материал. Выполните задания 5 и 6.
З а д а н и е 5 (1 мин.) Между первым, пятым и третьим понятиями (см. схему) существует такая же связь, как между четвертым, вторым и шестым. Определите связь и запишите недостающее понятие. Объясните свое решение.
З а д а н и е 6 (1 мин.) Установите связь между понятиями, назовите нужный термин. Объясните свое решение.
Гидроксид натрия : кислотный оксид / гидроксид меди(II): кислота.
Планируемые результаты.
Познавательные: формирование навыков самостоятельного приобретения, пополнения, переноса и интеграции знаний; разрешения проблем и проблемных ситуаций; смыслового чтения.
Коммуникативные: умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками; работать в группе: находить общее решение.
Регулятивные: умение соотносить свои действия с планируемыми результатами; умение оценивать правильность выполнения учебной задачи.
Рефлексия
Цели этапа.
Целостное осмысление, присвоение и обобщение полученной информации. Выработка собственного отношения к изучаемому материалу. Анализ всего процесса изучения материала.
Содержание педагогического взаимодействия.
Деятельность учителя. Предлагает систематизировать знания с помощью составления денотатного графа*. Предлагает оценить работу группы. Деятельность обучающихся. По-новому осмысливают информацию. Оценивают свою работу на уроке.
Учитель. А сейчас попробуйте обобщить всю имеющуюся у вас информацию об основаниях – выполните задания 7 и 8.
З а д а н и е 7 (5 мин.) Составьте таблицу по теме «Основания» (см. табл. 3).
Все основания с кислотами -образованием соли и воды;щелочи –с кислотными оксидами с образованием соли и воды;
щелочи с солями с образованием
нового основания и новой соли. Нерастворимые основания разлагаются при нагревании на оксид металла и воду
З а д а н и е 8 (1 мин.) Оцените свою работу в группе.
Все ли члены группы работали активно?
Комфортно ли было работать в этой группе?
Вернитесь к теме урока. Все ли вы выполнили?
Что было на уроке для вас самым неожиданным?
Осталось ли что-то непонятным?
Планируемые результаты.
Познавательные: формирование навыков переноса и интеграции знаний. Личностные: формирование личного смысла учения и начальных форм рефлексии.
Коммуникативные: формирование навыков сотрудничества; умения формулировать, аргументировать.
Домашнее задание: по учебнику О.С.Габриеляна «Химия. 8 класс» (М.: Дрофа, 2010) § 40, задания № 1–5 (2 задания на выбор).
Правила совместной работы
1) Работать дружно: быть внимательными, вежливыми, не отвлекаться на посторонние дела, не мешать друг другу.
2) Работать по плану.
3) Своевременно выполнять задание, следить за временем, доводить начатое дело до конца.
состав, номенклатура, классификация, свойства, получение» (8 класс)









































 Тема урока: Основания: состав, номенклатура, классификация, свойства, получение.
Тема урока: Основания: состав, номенклатура, классификация, свойства, получение.
Цель урока: Сформировать представления учащихся об основных классах неорганических соединений.
Задачи урока:
Сформировать представления и обеспечить в ходе урока усвоение следующих основных понятий об основных классах неорганических соединений: основания – состав, номенклатура, классификация, свойства, получение.
Развивать внимание, память, логическое мышление, умение анализировать, сравнивать, обобщать, выделять главное, делать выводы, познавательно излагать свои мысли.
Воспитывать ответственное отношение к учению, дисциплину и культуру поведения на уроке, активность, самостоятельность, устойчивый интерес к предмету.
Оборудование:
таблицы, оборудование и реактивы для лабораторной работы
Ход урока:
Оргмомент
Содержательная часть
Повторение:
Задание №1 Какие из названных веществ реагируют с раствором соляной кислоты: Ag, AI(OH)3, Fe(OH)2, Cu, Cu(OH)2, CuO. Напишите уравнения осуществимых реакций.
Ag + HCI →
AI(OH)3 + 3HCI → AICI3 + 3H2O
Fe(OH)2 + 2HCI → FeCI2 + 2H2O
Cu + HCI →
Cu(OH)2 + 2HCI → CuCI2 + 2H2O
CuO + 2HCI → CuCI2 + H2O
Задание №2 Закончите уравнения следующих реакций:
Na2CO3 + HCI →
Au + H2SO4 →
NaOH + HCI →
NaCI + HCI →
Fe(OH)3 + HNO3 →
Mg + H2SO4 →
Na2CO3 + 2HCI → 2NaCI + CO2↑ + H2O
NaOH + HCI → NaCI + H2O
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Mg + H2SO4 → MgSO4 + H2↑
Задание №3 Сколько молей хлорида натрия образуется при взаимодействии сульфита натрия массой 12,6 г с соляной кислотой?
Дано:
m(Na2SO3) = 12,6 г
Найти:
ν(NaCI) — ?
М(Na2SO3) = 126 г/моль
Решение:
Na2SO3 + 2HCI → 2NaCI + SO2↑ + H2O
1 моль 2 моль
M 12,6 г
ν(Na2SO3) = = = 0,1 моль
M 126 г/моль
ν(NaCI) = ν(Na2SO3) ∙ 2 = 0,1 моль ∙ 2 = 0,2 моль
Актуализация:
Какие классы неорганических соединений вам известны?
Какие неорганические соединения называются основаниями?
Приведите примеры известных вам оснований.
Из приведенных ниже формул соединений выберите те, которые соответствуют основаниям: AI(OH)3, MgO, HCI,H2O, Ca(OH)2, NaOH, H2SO4, Fe2O3, KOH, H2SiO3, CuO, CaCI2, CO2, ZnO, Fe(OH)3.
Объяснение:
Состав, классификация и номенклатура оснований.
Основания – это сложные вещества, в состав которых входят атомы металла и гидрооксогруппы OН—
Исключением является основание NH4OН (гидроксид аммония), которое не содержит атомов металла
ОСНОВАНИЯ
Растворимые
в воде — щелочи
Амфотерные
Нерастворимые
в воде – нерастворимые основания
LiOH, KOH, NaOH
RpOH, CsOH, Ca(OH)2,
Sr(OH)2, Ba(OH)2
Be(OH)2, Zn(OH)2,
Sn(OH)2, Pb(OH)2,
Al(OH)3, Cr(OH)3
Cu(OH)2 – гидроксид меди (II),
Fe(OH)2 – гидроксид железа (II),
Fe(OH)3 – гидроксид железа (III)
Химические свойства оснований.
Действие на индикаторы:
фенолфталеин – малиновый цвет
метилоранж – желтый цвет
лакмус – синий цвет
Основание + кислота → соль + вода
2KOH + 2HCl → 2KCl + H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Щелочь + кислотный оксид → соль + вода
Ba(OH)2 + CO2 → BaCO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
Щелочь + соль 1(р) → соль 2 + основание(н)
2KOH + CuSO4 → K2SO4 + Cu(OH)2↓
NaOH + FeCI3 → 3NaCI + Fe(OH)3↓
Основание
 оксид + вода
оксид + вода
2Fe(OH)3 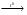 Fe2O3 + 3H2O
Fe2O3 + 3H2O
Cu(OH)2 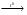 CuO + H2O
CuO + H2O
Амфотерный гидроксид + кислота → соль + вода
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
2AI(OH)3 + 3H2SO4 → AI2(SO4)3 + 6H2O
Амфотерный гидроксид + щелочь → соль + вода
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
AI(OH)3 + 3NaOH → Na3AIO3 + 3H2O
Получение оснований.
Активный металл + вода → щелочь + водород: (только металлы Li, Na, K, Rb, Cs, Ca, Sr, Ba)
2Na + 2H2O → 2NaOH + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
б) Основной оксид + вода → щелочь: (только оксиды Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, SrO, BaO)
K2O + H2O → 2KOH
BaO + H2O → Ba(OH)2
в) Соль1(р) + щелочь(р) → соль2(р) + нерастворимое основание(н)
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
FeCl3 + 3KOH → 3KCl + Fe(OH)3↓
Самостоятельная работа с учебником и дополнительным материалом.
Что называют основаниями?
Как отмечается в название гидроксида переменная валентность металла, входящего в его состав? Приведи примеры.
Какие существуют виды оснований? 1). __________________ например ____________
2). __________________ например ____________
3). __________________ например ____________
4. Какими способами получают основания?
1). ____________________________ уравнение реакции __________________________
2). ____________________________ уравнение реакции __________________________
3). ____________________________ уравнение реакции __________________________
Докажи, что амфотерные основания обладают специфическими химическими свойствами.
Сравни химические свойства растворимых и нерастворимых оснований. Приведите примеры уравнений химических реакций:
Растворимые
основания
Признаки для сравнения химических свойств
Нерастворимые основания
1.Взаимодействие с кислотными оксидами.
2.Взаимодействие с кислотами.
3.Взаимоействие с солями.
4.Разложение при нагревании.
Лабораторная работа «Изучение химических свойств оснований на примере гидроксида натрия»
Аналитическая часть
Закрепление:
Дифференцированные разноуровневые задания.
уровень
Какие вещества называют основаниями? Как классифицируют основания? Приведите примеры оснований и назовите их.
Основания – это _________________________________________________________
_______________________________________________________________________
Основания классифицируют на ____________________________________________
________________________________________________________________________________________________________________________________________________________________
Приведите по три уравнения реакций, при помощи которых можно получить:
а). растворимые основания; б). нерастворимые основания. Напишите их названия.
а). Получение растворимых оснований:
б). получение нерастворимых оснований:
1). ___________________________________
2). ___________________________________
3). ___________________________________
1). ___________________________________
2). ___________________________________
3). ___________________________________
Какие из веществ, формулы которых приведены, реагируют с раствором гидроксида натрия: CaO, Cu(OH)2, H2SO4, CO2, CuSO4, KCI, CuO, HCI? Напишите уравнения практически осуществимых реакций.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
1 2 3
а). Ca → CaO → Ca(OH)2 → CaCI2
1 2 3 4
б). Zn → ZnCI2 → Zn(OH)2 → ZnO → Zn(NO3)2
1 2 3 4
в). Cu → CuO → CuCI2 → Cu(OH)2 → CuO
Напиши уравнения реакций разложения при нагревании:
а). гидроксида меди (II) __________________________________________________
б). гидроксида железа (III) ________________________________________________
в). гидроксида алюминия _________________________________________________
уровень
Назовите химические свойства нерастворимых оснований и щелочей, которые:
а). являются для них общими; б). позволяют отличить друг от друга эти группы оснований. Ответ иллюстрируйте записью уравнений химических реакций.
Характерные химические свойства
Общие химические свойства нерастворимых оснований и щелочей
нерастворимых оснований
щелочей
Вычислите массу гидроксида натрия, который потребуется для реакции с 50 г
40%-ного раствора сульфата меди (II) с целью получения нерастворимого основания.
уровень
В кристаллизатор с водой добавили несколько капель лакмуса. При опускании в него магниевой
ленты индикатор не изменяет окраску. При поджигании магниевой ленты, укрепленной на
штативе (см. рисунок), и опускании ее в воду магний продолжает гореть. Раствор индикатора приобретает синюю окраску. Почему? Ответ поясните записью уравнений химических реакций.
В двух химических стаканах находятся красные растворы, оставшиеся после демонстрационных опытов. Предполагают, что в одном – подкисленный раствор индикатора метилового оранжевого, в другом – лакмуса. Можно ли воспользоваться одним реактивом, чтоб установить, в каком из сосудов находится раствор каждого из указанных индикаторов? Что это за реактив?
Если на лицо или в глаза попали брызги щелочи, их необходимо смыть большим количеством вод, а глаза промыть раствором борной кислоты НВО2. Какую роль выполняет борная кислота в данном случае?
Домашнее задание: §
Приложение №1
Основания: состав, номенклатура, классификация, свойства, получение.
Что называют основаниями?
Как отмечается в название гидроксида переменная валентность металла, входящего в его состав? Приведи примеры.
Какие существуют виды оснований? 1). __________________ например ____________
2). __________________ например ____________
3). __________________ например ____________
4. Какими способами получают основания?
1). ____________________________ уравнение реакции __________________________
2). ____________________________ уравнение реакции __________________________
3). ____________________________ уравнение реакции __________________________
5. Докажи, что амфотерные основания обладают специфическими химическими свойствами.
6. Сравни химические свойства растворимых и нерастворимых оснований. Приведите примеры
уравнений химических реакций:
Растворимые
основания
Признаки для сравнения химических свойств
Нерастворимые основания
1.Взаимодействие с кислотными оксидами.
2.Взаимодействие с кислотами.
3.Взаимоействие с солями.
4.Разложение при нагревании.
Приложение №2
Дифференцированные разноуровневые задания.
уровень
Какие вещества называют основаниями? Как классифицируют основания? Приведите примеры оснований и назовите их.
Основания – это _________________________________________________________
_______________________________________________________________________
Основания классифицируют на ____________________________________________
________________________________________________________________________________________________________________________________________________________________
Приведите по три уравнения реакций, при помощи которых можно получить:
а). растворимые основания; б). нерастворимые основания. Напишите их названия.
а). Получение растворимых оснований:
б). получение нерастворимых оснований:
1). ___________________________________
2). ___________________________________
3). ___________________________________
1). ___________________________________
2). ___________________________________
3). ___________________________________
Какие из веществ, формулы которых приведены, реагируют с раствором гидроксида натрия: CaO, Cu(OH)2, H2SO4, CO2, CuSO4, KCI, CuO, HCI? Напишите уравнения практически осуществимых реакций.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
1 2 3
а). Ca → CaO → Ca(OH)2 → CaCI2
1 2 3 4
б). Zn → ZnCI2 → Zn(OH)2 → ZnO → Zn(NO3)2
1 2 3 4
в). Cu → CuO → CuCI2 → Cu(OH)2 → CuO
Напиши уравнения реакций разложения при нагревании:
а). гидроксида меди (II) __________________________________________________
б). гидроксида железа (III) ________________________________________________
в). гидроксида алюминия _________________________________________________
уровень
Назовите химические свойства нерастворимых оснований и щелочей, которые:
а). являются для них общими; б). позволяют отличить друг от друга эти группы оснований. Ответ иллюстрируйте записью уравнений химических реакций.
Характерные химические свойства
Общие химические свойства нерастворимых оснований и щелочей
нерастворимых оснований
щелочей
Вычислите массу гидроксида натрия, который потребуется для реакции с 50 г 40%-ного раствора сульфата меди (II) с целью получения нерастворимого основания.
уровень
В кристаллизатор с водой добавили несколько капель лакмуса. При опускании в него магниевой
ленты индикатор не изменяет окраску. При поджигании магниевой ленты, укрепленной на
штативе (см. рисунок), и опускании ее в воду магний продолжает гореть. Раствор индикатора приобретает синюю окраску. Почему? Ответ поясните записью уравнений химических реакций.
В двух химических стаканах находятся красные растворы, оставшиеся после демонстрационных опытов. Предполагают, что в одном – подкисленный раствор индикатора метилового оранжевого, в другом – лакмуса. Можно ли воспользоваться одним реактивом, чтоб установить, в каком из сосудов находится раствор каждого из указанных индикаторов? Что это за реактив?
Если на лицо или в глаза попали брызги щелочи, их необходимо смыть большим количеством вод, а глаза промыть раствором борной кислоты НВО2. Какую роль выполняет борная кислота в данном случае?
Приложение №3
Лабораторная работа
Изучение химических свойств оснований на примере гидроксида натрия.
Цель работы: Опытным путем изучить химические свойства оснований.
Оборудование и реактивы: NaOH, CuSO4, HCI, набор пробирок, горелка, лабораторный штатив, лакмус, метилоранж, фенолфталеин.
Ход работы:
Опыт №1 Действие оснований на индикаторы.
В три пробирки внести по 1 мл раствора гидроксида натрия к одной добавьте каплю лакмуса, к другой метилоранжа, к третьей фенолфталеина. Как изменяется окраска индикатора от действия щелочей.
лакмус
NaOH
Наблюдение:
метилоранж
NaOH
Наблюдение:
фенолфталеин
NaOH
Наблюдение:
Опыт №2 Взаимодействие щелочей с кислотами.
В пробирку внесите 1 мл раствора гидроксида натрия и 1-2 капли фенолфталеина. Какого цвета получился раствор? К раствору добавьте 2 – 3 капли раствора соляной кислоты. Почему исчезла окраска?
ф/фт HCI
NaOH + HCI →
NaOH Наблюдение:
Опыт №3 Взаимодействие щелочей с солями.
Налейте в пробирку 1 мл раствора сульфата меди (II) и добавьте 1 мл гидроксида натрия. Образовавшийся осадок разделите на две равные части.
NaOH
CuSO4 + NaOH →
CuSO4 Наблюдение:
1). К осадку в первой пробирке прилейте 1 мл раствора соляной кислоты. Отметьте наблюдения, напишите уравнение реакции.
HCI
Cu(OH)2 + HCI →
Cu(ОН)2 Наблюдение:
2). Укрепите вторую пробирку наклонно в лапке штатива. Вначале прогрейте всю пробирку, а затем, то место, где находится вещество. Что наблюдаете на стенках пробирки? Какого цвета получается твердое вещество.
t
Cu(OH)2 →
Cu(ОН)2 Наблюдение:
Конспект урока по химии на тему «Основания,их классификация и свойства» (8 класс)
Муниципальное бюджетное общеобразовательное учреждение
«Основная общеобразовательная школа № 39» г. Калуги
«Основания, их классификация и свойства»
8 класс
Автор:
Алленова Елена Анатольевна
Тема урока: Основания, их классификация и свойства.
Ход урока
1. Ориентировочно-мотивационный этап (стадия вызова). (1мин.)
«Продолжай успешно идти по дороге, на которой хорошо начал свой путь»
(Из античной мудрости) (Слайд 1).
— Ребята, на каждом уроке вы стремитесь получить новые знания, совершить открытие. И сегодня мы постараемся углубить уже имеющиеся знания и узнать новое.
-Давай те вспомним, с чем мы уже знакомы?
1. Игра « Крестики – нолики» — найдите выигрышный путь – кислоты (Слайд 2).
2.Дать определение кислотам в свете ТЭД (электролиты, которые при диссоциации распадаются на катионы водорода и анионы кислотного остатка).3. Дайте характеристику H3РO4 по всем признакам классификации (кислородосодержащая, двухосновная, растворимая, нелетучая, стабильная, сильная).
4. . Что называют электролитической диссоциацией? (Процесс распада электролита на ионы).
5. Какие вещества называют электролитами? (Вещества, проводящие электрический ток)
6. Игра «Третий лишний». Дать название выбранным веществам. (Слайд 3).
а) HCl, NaOH, HNO3
б) Ba(OH)2, HNO3, H2SO4
в) HCl, H2SiO3, КОН
-Как же мы сформулируем тему урока? Основания с точки зрения ТЭД (Слайд 4).
-Какие задачи предстоит решить нам в ходе урока, исходя из темы? (Слайд 5).
2.Операционно-исполнительный этап (стадия осмысления).
— Давайте вспомним, что нам уже известно об основаниях. Что такое основания?
— Почему соединения NaOH, Ca(OH)2, Fe(OH)3, Al(OH)3 являются основаниями? (Слайд 6).
— На какие группы их можно разделить? (Слайд 7).(по растворимости, по основности)
— Давайте посмотрим, как будут вести себя эти вещества.(?)
— Предположите окраску раствора, если к NaOH, КOH, Ca(OH)2 мы добавим фенолфталеин? (окрасится в малиновый цвет).
— Подумайте, почему разные основания одинаково действуют на индикатор?
— Что в растворе определяет щелочную среду? (наличие в растворе гидроксогруппы)
— Что объединяет все основания? (наличие гидроксогруппы)
— Какими же химическими свойствами обладают основания?
(поставленные задачи решаются через фронтальную лабораторную работу выполняемую учащимися. Необходимо вспомнить правила техники безопасности. (Слайд 8).)
— Давайте обратимся к учебнику стр. 215 и определим, какими же свойствами обладают основания.
-Все кислоты взаимодействуют с щелочами, при этом образуются соль и вода. (Слайд 9).
-Как называться эта реакция? (нейтрализации)
— Проведем опыт, добавим к раствору щелочи с индикатором раствор соляной кислоты. Что наблюдаете? Составьте молекулярное и ионное уравнения проделанной реакции.
2NaOH + H2SO4→Na2SО4 + 2H2O
2Na ++2OH — + 2H + + SO42- → 2Na ++ SO42-+ 2H2O;
H++ OH— → H2O;
— Рассмотрим следующую реакцию. Здесь происходит взаимодействие оснований с кислотными оксидами (Слайд 10).
— Давайте свами вспомним, какие оксиды называют кислотными? (оксиды образующие соответствующие кислородосодержащие кислоты)
— При взаимодействии кислотных оксидов и оснований образуется соль соответствующая этим оксидам и вода.
— Проведем опыт. Берем раствор известковой воды, пропускаем через нее углекислый газ. Какие изменения произошли? (выпал осадок)
— Запишем уравнение реакций.
Ca(OH)2 + CO2→ CaCO3 + H2O;
Ca2++2OH —+CO2→CaCO3 ↓ +H2O;
— Следующее свойство оснований. С чем реагируют основания? (Слайд 11).
— Щелочи взаимодействуют с солями, при этом образуются новая соль и новое основание.
— К какому типу реакций относиться данная реакция? (реакции обмена)
— При каких условиях будет происходить эта реакция. (Если образовался осадок или выделился газ)
— Рассмотрим взаимодействие гидроксида натрия с раствором сульфата меди (II).
— Что наблюдаем? (выпал осадок)
— Запишем уравнение реакциисначала в молекулярном, а затем в ионном виде.
2NaOH + CuSO4 →Na2SO4 + Cu(OH)2
2Na ++ 2 OH — +Cu 2+ + SO4 2-→Na ++ SO4 2-+ Cu(OH)2 ↓
Cu2+ +OH—→ Cu(OH)2↓
— Мы выяснили, что реакция идет, если образовался осадок или выделился газ. Образование газа наблюдается только в том случае, если в реакции участвуют соли аммония.
— Для нерастворимых оснований характерно еще одно свойство (Слайд 12).
— При нагревании над пламенем спиртовки осадок Cu(OH)2 разлагается на оксид и воду.
-Составьте уравнение реакции разложения гидроксида меди (II).
Cu(OH)2→CuO + 2H2O
— И так почему же основания обладают сходными свойствами?
Основания обладают сходными свойствами потому, что в растворах при их диссоциации всегда образуются гидроксид анионы
-Физкультминутка
3.Рефлексивно – оценочный этап.
1.«Третий лишний». (Слайд 13).
А) КОН, H2CO3, Ba(OH) 2
Б) КОН, NaOH, Ba(OH) 2
В) КОН, Сu(OH) 2, Ba(OH) 2
2.С какими из перечисленных веществ будет реагировать КОН? (Слайд 14).
а)Na3РО4, б) Fe(OH)2, в) СаО г) СО2, д) Н2SO4, е)CаSO4
-Для закрепления знаний и проверки уровня усвоения материала предлагаю выполнить самостоятельную работу по вариантам (приложение 1).
— Какие задачи ставили? (Слайд 15, 16).
— Удалось решить поставленные задачи? Каким способом?
— Какие получили результаты?
Поднятые 2 руки – всё понятно, урок понравился.
1 рука – есть вопросы.
Опущенные руки – много непонятного, урок не понравился.
Д\З
§39, упр.1-3; упр.5 или 4 (по желанию)
Составьте молекулярные и ионные уравнения реакций, характеризующих химические свойства гидроксида лития.
Урок химии «Основания, их классификация и свойства» (8 класс)
Виктор Владимирович Жарких, учитель химии
8 КЛАСС.
РАЗДЕЛ 7. РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ.
Тема урока. Основания, их классификация и свойства.
Цели урока.
Образовательная. Расширить и углубить знания учащихся об основаниях. Активизировать знания учащихся о принципах классификации оснований и правилах составления их названий. Ознакомить учащихся с физическими и химическими свойствами оснований, а также с их применением.
Воспитательная. Реализация ВПС и МПС. Продолжить расширение политехнического кругозора учащихся на основе знаний об использовании щелочей и оснований в быту, промышленности и сельском хозяйстве.
Развивающая. Продолжить развитие умений учащихся самостоятельно пополнять и систематизировать свои знания, пользоваться приёмами сравнения и обобщения, делать выводы.
Тип урока. Комбинированный.
Оборудование: Таблица «Растворимость кислот, оснований и солей в воде».
Оборудование и вещества: NaOH, KOH, HCl, HNO3, H2SO4, CuCl2, NH4Cl, Fe2(SO4)3. Индикаторы лакмус, метиловый оранжевый, фенолфталеин. Лабораторный штатив с лапкой, пробирки, держатель пробирочный, покровное стекло, спиртовка, спички.
Ход урока.
I. Организационный момент.
II. Проверка домашнего задания.
Вопросы:
Самостоятельная работа.
1) кислота + основание →2) кислота + металл низкой активности →
3) соль + кислота →
4) кислотный оксид + кислота →
1) кислота + вода →
2) основный оксид + кислота →
3) кислота + кислота →
4) металл активный + кислота →
№2. Закончить уравнения реакций, записать одно из них в ионном виде
1) HNO3 + Ca(OH)2 → нитрат кальция + вода
2) NaOH + CuSO4 → … + …
1) BaCO3 + HCl → … + …↑ + …
2) H2SO4 + KOH → сульфат калия + вода
№4 стр. 214, №6 стр. 214, №5 стр. 214 Ответ: 109,2 л.
(Проверить выполнение во время написания самостоятельной работы)
III. Изучение нового материала.
1. Основание (определение смотри §19).
2. Классификация оснований.
1) растворимость в воде;
2) степень электролитической диссоциации;
3) кислотность (количество гидроксогрупп).
3. Физические свойства.
а) Щёлочи. Твёрдые, кристаллические вещества. Имеют высокие температуры плавления и кипения. Нелетучие вещества, без запаха. Хорошо растворяются в воде, электролиты, мылкие на ощупь.
б) Нерастворимые основания. Твёрдые, кристаллические вещества. Нелетучие вещества, без запаха. Не растворяются в воде, неэлектролиты. При нагревании разлагаются.
4. Химические свойства.
Растворимые основания,щелочи.
Нерастворимые основания.
1) изменение окраски индикаторов.
Фиолетовый лакмус → синий.
Метиловый оранжевый → желтый.
Бесцветный фенолфталеин → малиновый.
1) изменение окраски индикаторов.
Отсутствует.
2) диссоциация.
NaOH → Na+ + OH¯
Ca(OH)2 → Ca2+ + 2OH¯
2) диссоциация.
Отсутствует.
3) реакция с кислотными оксидами (образуется соль и вода).
щёлочь + кислотный оксид = соль + вода
Ca(OН)2 + CO2 → CaCO3↓ + H2O
3) реакция с кислотными оксидами.
Отсутствует.
4) реакция с кислотами (образуется соль и вода).
щёлочь + кислота = соль + вода
2NaOH + H2SO4 → Na2SO4 + 2H2O
4) реакция кислотами (образуется соль и вода).
основание + кислота = соль + вода
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
5) реакция с солями металлов средней и малой активности (образуется новая соль и нерастворимое основание).
щёлочь + соль = новая соль + нерастворимое основание
2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓
5) реакция с солями.
Отсутствует.
6) реакция разложения при нагревании.
6) реакция разложения при нагревании (образуется основный оксид и вода).
основание →t° основный оксид + вода
Cu(OH)2 →t° CuO + H2O
5. Применение щелочей.
IV. Закрепление знаний полученных на уроке.
Вопросы:
1. Что такое основание?
2. Поясните классификацию оснований на примерах.
3. Каковы физические свойства оснований и щелочей?
4. Перечислите химические свойства оснований и щелочей. С какими веществами они реагируют, каковы продукты этих реакций?
5. Укажите известные вам способы применения щелочей.
V. Д/з. §39; №1, 2, 3(а-г) с.217
Урок химии в 8 классе по теме «Основания, их классификация и свойства»
Урок химии в 8 классе
УМК: О.С. Габриелян
Тема. Основания, их классификация и свойства.
Цель: создание условий для формирования представлений у учащихся о классификации оснований, их химических свойствах в свете теории электролитической диссоциации.
Задачи:
Образовательные: познакомить с основаниями как классом электролитов, рассмотреть их классификацию по различным признакам, охарактеризовать общие свойства оснований в свете ионных представлений.
Развивающие: развивать творческие и аналитические способности учащихся, умение систематизировать и обобщать информацию, развивать практические навыки, познавательный интерес к изучаемому предмету.
Воспитательные: формировать умение работать в группе и индивидуально, воспитывать чувство ответственности, взаимоподдержки.
Тип урока: урок изучения нового материала.
Технология: технология развития критического мышления (ТРКМ)
Оборудование: таблица растворимости кислот, оснований и солей, спиртовка, лабораторный штатив, пробирки, лотки с набором реактивов: гидроксид натрия, гидроксид кальция, соляная кислота, серная кислота, индикаторная бумага (фенолфталеин), сульфат меди (II).
ХОД УРОКА
Вызов
— Добрый день, я рада приветствовать вас на уроке химии. Сегодня перед вами откроются новые тайны этого удивительного предмета. Надеюсь, что наша работа на уроке будет интересной и плодотворной.
— Ребята, какую тему мы проходим уже несколько уроков?
— Растворение. Растворы. Свойства растворов электролитов.
— Со свойствами, каких веществ вы уже познакомились?
— Со свойствами кислот.
— Сегодня на уроке мы познакомимся ещё с одним классом электролитов, а с каким вы узнаете, выполнив задание.
Игра «Третий лишний».
Посмотрите на доску. Вычеркните лишние вещества из строчек?
KOН | Cu(OH)2 | CаO |
ZnCl2 | Mg(OH)2 | Cа(OH)2 |
h3SO4 | Fe(OH)2 | LiOH |
Al(OH)3 | Ca | NaOH |
— Что за вещества остались в таблице? Дайте определение классу в свете теории электролитической диссоциации.
— Основания. Основаниями называют электролиты, которые при диссоциации образуют катионы металла и гидроксид — анионы ОН.
— Определите тему нашего урока?
— Основания, их классификация и свойства.
— Откройте тетради, запишите число и тему урока.
Приём «Знаю — хочу узнать — узнал»
— Заполните в тетради таблицу, отвечая на вопросы:
— Что вы знаете по данной теме? Что хотите узнать?
Знаю | Хочу узнать | Узнал |
— (Учащиеся самостоятельно заполняют две первые колонки)
— Итак, что вы уже знаете по теме урока?
— (Учащиеся должны назвать: определение класса, привести примеры оснований растворимых и нерастворимых, назвать их физические свойства)
— Что бы вы хотели узнать?
(- По каким признакам ещё классифицируются основания.
— С какими веществами реагируют основания (химические свойства).
— Где применяются в быту.)
Осмысление
Приём «Инсерт»
— Откройте учебник на странице 214, параграф 39 и, используя приём «Инсерт» прочитайте текст, расставляя на полях учебника карандашом следующие значки:
«V» – уже знал
«+» – новое
«?» – не понял, есть вопросы.
— После прочтения текста вернитесь к своим пометкам и заполните таблицу:
Уже знал «V». | Узнал новое «+». | Не понял. Есть вопрос. |
(Самостоятельная индивидуальная работа учащихся с текстом: чтение с пометками, заполнение таблицы)
Физкультминутка
— Расскажите друг другу, что нового вы узнали по теме урока?
— Заполните колонку «Узнал» таблицы.
— Какие вопросы у вас возникли по новой теме?
(Могут возникнуть вопросы:
— С какими веществами реагируют растворимые основания?
— С какими веществами реагируют нерастворимые основания?
— При каких условиях протекают данные реакции?)
— Чтобы ответить на ваши вопросы, проведём лабораторную работу. Работать будем в группах. Каждая группа будет работать по своей инструктивной карте. Вам необходимо выполнить опыты, занести наблюдения в таблицу, написать уравнения реакций в молекулярном и ионном виде. Перед работой вспомним правила техники безопасности.
Учащиеся выполняют лабораторную работу, используя инструктивные карты (Приложение). Первая группа изучает химические свойства растворимых оснований, вторая группа – нерастворимых.
— Запишите на доске в молекулярном и ионном виде уравнения проведённых реакций.
(От каждой группы выходят по три представителя и записывают уравнения реакций в молекулярном и ионном виде)
— Сделайте вывод, с какими веществами реагируют основания?
(Вывод: основания изменяют окраску индикаторов, взаимодействуют с кислотами, с оксидами неметаллов, которым соответствуют кислоты, реагируют с солями, если в результате реакции образуется осадок или выделяется газ. Нерастворимые основания разлагаются при нагревании.)
— Запишите полученный вывод в таблицу.
Рефлексия
— Что нового узнали на уроке?
— Что особенно запомнилось?
— С какими трудностями столкнулись?
— Какие вопросы у вас возникли в связи с этим?
— Над чем нужно ещё поработать.
— Что больше всего понравилось?
— Ребята, проявите своё творчество и составьте синквейн по теме урока.
— (Учащиеся составляют и зачитывают синквейны).
— Ребята, вы сегодня очень хорошо поработали. Выставление оценок.
— Как вы думаете, мы изучили свойства всех веществ? Я надеюсь, что и следующий урок химии принесёт вам много открытий.
Домашнее задание.
На оценку «5» — § 39, подготовить сообщение о применении оснований в быту;
На оценку «4» — § 39, упражнение 3 стр. 217.
На оценку «3» — § 39, знать химические свойства оснований.
ПРИЛОЖЕНИЕ
Инструктивная карта № 1
Химические свойства щелочей
Налейте в пробирку немного гидроксида натрия, опустите небольшой кусочек фенолфталеиновой бумаги. Что наблюдаете? Почему фенолфталеин принял такую окраску? Добавляйте к раствору гидроксида натрия по каплям раствор соляной кислоты до изменения окраски индикатора. Результаты наблюдения занесите в таблицу. Запишите уравнение реакции взаимодействия гидроксида натрия и соляной кислоты в молекулярном и ионном виде.
В пробирку налейте раствор гидроксида кальция. С помощью газоотводной трубки сделайте несколько выдохов через раствор. Что вы наблюдаете? Почему происходит помутнение раствора? Какой газ вы выдыхали?
В пробирку с раствором сульфата меди (II) добавьте раствор гидроксида натрия. Запишите свои наблюдения в таблицу и составьте уравнения соответствующих реакций в молекулярном и ионном виде.
Химические свойства | Что наблюдали, вывод | Уравнения реакции |
Взаимодействие с кислотами | ||
Взаимодействие с оксидами неметаллов | ||
Взаимодействие с солями |
Инструктивная карта № 2
Химические свойства нерастворимых оснований
В пробирку налейте раствор гидроксида натрия и такое же по объему количество раствора сульфата меди(II). Что вы наблюдаете? Результаты наблюдения занесите в таблицу и составьте уравнения соответствующих реакций в молекулярном и ионном виде. Содержимое пробирки разделите на две части.
В одну пробирку с осадком нерастворимого основания добавьте несколько капель раствора серной кислоты. Содержимое пробирки встряхните, при этом помните о правилах техники безопасности. Если осадок не растворился, добавьте еще немного кислоты. Растворение осадка – это признак химической реакции. Сделайте вывод. Результаты наблюдения занесите в таблицу и составьте уравнения соответствующих реакций в молекулярном и ионном виде.
Закрепите вторую пробирку с осадком Cu(OH)2 в держателе. Зажгите спиртовку. Равномерно нагрейте всю пробирку. Через некоторое время нагревайте только то место пробирки, где находится голубой осадок гидроксида меди(II). Результаты наблюдения занесите в таблицу и составьте уравнения соответствующих реакций в молекулярном и ионном виде.
Химические свойства | Что наблюдали, вывод | Уравнения реакции |
Получение нерастворимого основания | ||
Взаимодействие с кислотами | ||
Разложение нерастворимых оснований при нагревании |
Тест по химии для 8 класса «Основания и их химические свойства»
Всероссийский дистанционный конкурс для педагогов на лучшую методическую разработку «Тест по химии»
Тест по химии 8 класс «Основания и их химические свойства»
Тест по химии предназначен для текущей проверки знаний учащихся 8 класса по теме «Основания и их химические свойства». Тесты включают в себя 20 заданий, на выполнение которых отводится 45 минут. Тест представлен в формате ОГЭ, где к каждому заданию даны варианты ответов, из которых нужно выбрать правильный.
Тест способствует развитию умений анализировать, исследовать. При ответе на вопросы учащиеся развивают аналитическое мышление, совершенствуют умения обобщать и делать выводы.
Данный материал Вы можете использовать не только на уроке, но и при подготовке учащихся к ОГЭ
Инструкция по выполнению работы
Тестовая работа состоит из двух частей, включающих в себя 20 вопросов.
Часть первая 18 заданий, вторая 2 задания на соответствие.
18 вопросов с выбором одного ответа-оцениваются в 1 балл, 2 вопроса на соответствие -оцениваются в 2 балла. Ответы к заданиям 1-18 записываются одной цифрой, 19-20 последовательностью цифр и соответствующих им букв.
Ответы к заданиям 19-20 записываются в виде последовательности цифр, которые переносятся в поле ответа в тексте работы.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжённости металлов и непрограммируемым калькулятором.
Баллы, полученные за правильные ответы, суммируются. В случае ошибочного ответа аккуратно зачеркните и напишите рядом правильный ответ.
Контрольно — измерительные материалы
Инструкция по выполнению работы
Тестовая работа состоит из двух частей, включающих в себя 20 вопросов.
Часть первая 18 заданий, вторая 2 задания на соответствие.
18 вопросов с выбором одного ответа-оцениваются в 1 балл, 2 вопроса на соответствие оцениваются в 2 балла. Ответы к заданиям 1-18 записываются одной цифрой, 19-20 последовательностью цифр и соответствующих им букв
Ответы к заданиям 19-20 записываются в виде последовательности цифр, которые переносятся в поле ответа в тексте работы.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжённости металлов и непрограммируемым калькулятором.
Баллы, полученные за правильные ответы, суммируются. В случае ошибочного ответа аккуратно зачеркните и напишите рядом правильный ответ.
Часть 1
Ответом к заданиям 1-18 является одна цифра, соответствующая номеру правильного ответа. Запишите ее в бланк ответов.
Соединение состава Сu(OH)2 называется:
А) гидроксид меди (I)
Б) гидрид меди (II)
В) гидроксид меди (II)
Г) медный купорос
2. В щелочной среде малиновую окраску приобретает индикатор:
А) метиловый оранжевый
Б) лакмус
В) фенолфталеин
3. Какое из приведенных ниже веществ является основанием:
А) СuCl2
Б) Fe(OH)2
B) Na2SO4
Г) СаО
4. При нагревании разлагается:
А) гидроксид натрия
Б) гидроксид меди (II)
В) гидроксид аммония
Г) гидроксид лития
5. Щелочь не взаимодействует с:
А) основным оксидом
Б) кислотой
В) солью
Г) кислотным оксидом
6. Формулы только оснований записаны в ряду:
А) К2О, КОН, Fe(OH)2
Б) Li2O, Na2O, Cu(OH)2
В) NaOH, KOH, Al(OH)3
Г) Fe(OH)2, Mg(OH)2, Zn(OH)2
7. В щелочах окраска лакмуса меняется на:
А) красную
Б) малиновую
В) желтую
Г) синюю
8.С какими веществами реагирует раствор NaOH:
А) СО2, Сu, Cu(OH)2
Б) h3SO4, SO2, K2SO4
В) HCl, CO2, AlCl3
Г) S, SO2, Na2S
9. Что образуется при взаимодействии NaOH с СО2
А) основание и оксид
Б) соль и вода
В) соль и кислота
Г) соль и водород
10. Основание диссоциирует на:
А) катионы металла и гидроксид анионы
Б) катионы водорода и анионы кислотного остатка
В) катионы металла и анионы кислотного остатка
Г) не подвергаются диссоциации
11. Формулы только щелочей записаны в ряду:
А) NaОH, КОН, Fe(OH)2
Б) Cu(OH)2, Al(OH)3, Zn(OH)2
В) NaOH, KOH, Ba(OH)2
Г) FeO, CuO, SO3
12. Гидроксиду натрия соответствует формула:
А) ZnO
Б) Zn(OH)2
В) ZnOH
Г) Zn2O
13. Малорастворимым основанием является:
А) Cu(OH)2
Б) Са(OH)2
В) Ba(OH)2
Г) Pb(OH)2
14. Какой гидроксид применяется в строительстве, для побелки деревьев, получения хлорной извести:
А) KOH
Б) Са(OH)2
В) Nh5OH
Г) Fe(OH)3
15. Верны ли следующие суждения об основаниях:
1. Основания взаимодействуют с основными и кислотными оксидами
2. Реакции щелочей с основаниями называется реакций нейтрализации
А) верно только 1
Б) верно только 2
В) верны оба суждения
Г) оба суждения не верны
16. Какое уравнение соответствует реакции нейтрализации?
А) НСl + Zn = ZnCl2 + h3
Б) h3 + S = h3S
В) НСl + KOH =KCl + h3O
Г) НСl + AgNO3 = AgCl + HNO3
17. Какой гидроксид соответствует оксиду серы (VI):
А) Н2SO3
Б) Н2SO4
В) Н2S
Г) SO3
18. С какими из нижеперечисленных веществ взаимодействует гидроксид натрия:
А) СО2 и К2SO4
Б) Н2SO4 и СО2
В) HNO3 и Al(OH)3
Г) ZnO и СuCl2
Часть 2
19. Установите соответствие между названием оксида и его формулой:
Название основания | Формула основания |
Гидроксид алюминия | А. Ba(OH)2 |
Гидроксид железа (III) | Б. Fe(OH)3 |
Гидроксид натрия | В. Al(OH)3 |
Гидроксид бария | Г. Al2O3 |
Д. NaOH | |
Е. Fe(OH)2 |
20. Установите соответствие между формулой гидроксида и продуктами его взаимодействия с избытком соляной кислоты:
Название основания | Формула основания |
Гидроксид аммония | А. LiCl + h3O |
Гидроксид железа (III) | Б. Nh5Cl + h3O |
Гидроксид натрия | В. FeCl3 +h3O |
Гидроксид лития | Г. NaCl + h3 |
Д. NaCl + h3O | |
Е. FeCl2 + h3O |
Ответы:
1. в
2. в
3. б
4. б
5. а
6. в
7. г
8. в
9. б
10. а
11. в
12. б
13. б
14.б
15. б
16. в
17. б
18. б
19. 1-в 2-б 3-д 4-а
20. 1-б 2-в 3-д 4-а