Свойства металлов (стр. 1 из 2)
Свойства металлов.
1.Основные свойства металлов.
Свойства металлов делятся на физические, химические, механические и технологические.
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, расширяемость при нагревании.
К химическим – окисляемость, растворимость и коррозионная стойкость.
К механическим – прочность, твердость, упругость, вязкость, пластичность.
К технологическим – прокаливаемость, жидкотекучесть, ковкость, свариемость, обрабатываемость резанием.
1. Физические и химические свойства.
Цвет. Металлы непрозрачны, т.е. не пропускают сквозь себя свет, и в этом отраженном свете каждый металл имеет свой особенный оттенок – цвет.
Из технических металлов окрашенными являются только медь (красная) и ее сплавы. Цвет остальных металлов колеблется от серо- стального до серебристо – белого. Тончайшие пленки окислов на поверхности металлических изделий придают им дополнительные окраски.
Удельный вес. Вес одного кубического сантиметра вещества, выраженный в граммах, называется удельным весом.
По величине удельного веса различают легкие металлы и тяжелые металлы. Из технических металлов легчайшим является магний ( удельный вес 1,74), наиболее тяжёлым – вольфрам (удельный вес 19,3). Удельный вес металлов в некоторой степени зависит от способа их производства и обработки.
Плавкость. Способность при нагревании переходить из твердого состояния в жидкое является важнейшим свойством металлов. При нагревании все металлы переходят из твердого состояния в жидкое, а при охлаждении расплавленного металла – из жидкого состояния в твердого. Температура плавления технических сплавов имеет не одну определённую температуру плавления, а интервал температур, иногда весьма значительный.
Электропроводность. Электропроводность заключается в переносе электричества свободными электронами. Электропроводность металлов в тысячи раз выше электропроводности неметаллических тел. При повышении температуры электропроводность металлов падет, и при понижении – возрастает. При приближении к абсолютному нулю (- 2730С) электропроводность беспредельно металлов колеблется от +2320 (олово) до 33700 (вольфрам). Большинство увеличивается (сопротивление, падает почти до нуля).
Электропроводность сплавов всегда ниже электропроводности одного из компонентов, составляющих сплавов.
Магнитные свойства. Явно магнитными (ферромагнитьными) являются только три металла: железо, никель, и кобальт, а также некоторые их сплавы. При нагревании до определённых температур эти металлы также теряют магнитные свойства. Некоторые сплавы железа и при комнатной температуре не являются ферромагнитными. Все прочие металлы разделяются на парамагнитные (притягивают магнитами) и диамагнитные (отталкиваются магнитами).
Теплопроводность. Теплопроводность называется переход тепла в теле от более нагретого места к менее нагретому без видимого перемещения частиц этого тела. Высокая теплопроводность металлов позволяет быстро и равномерно нагревать их и охлаждать.
Из технических металлов наибольшей теплопроводностью облает медь. Теплопроводность железа значительно ниже, а теплопроводность стали меняется в зависимости от содержания в ней компонентов. При повышении температуры теплопроводность уменьшается, при понижении – увеличивается.
Теплоёмкость. Теплоёмкость называется количество тепла, необходимое для повышения температуры тела на 10.
Удельной теплоемкостью вещества называется то количество тепла в килограмм – калориях, которое нужно сообщить 1кг вещества, чтобы повысить его температуру на 10.
Удельная теплоёмкость металлов в сравнении с другими веществами невелика, что позволяет относительно легко нагревать их до высоких температур.
Расширяемость при нагревании. Отношение приращения длины тела при его нагревании на 10 к первоначальной его длине называется коэффициентом линейного расширения. Для различных металлов коэффициентом линейного расширения колеблется в широких пределах. Так, например, вольфрам имеет коэффициент линейного расширения 4,0·10-6 , а свинец 29,5 ·10-6.
Коррозионная стойкость. Коррозия есть разрушение металла вследствие химического или электрохимического взаимодействия его с внешней средой. Примером коррозии является ржавление железа.
Высокая сопротивляемость коррозии (коррозионная стойкость) является важным природным свойством некоторых металлов: платины, золота и серебра, которые именно поэтому и получили название благородных. Хорошо сопротивляются коррозии также никель и другие цветные металлы. Черные металлы коррозируют сильнее и быстрее, чем цветные.
2. Механические свойства.
Прочность. Прочностью металла называют его способность сопротивляться действию внешних сил, не разрушаясь.
Твердость. Твердостью называется способность тела противостоять проникновению в него другого, более твердого тела.
Упругость. Упругостью металла называется его свойство востонавливать свою форму после прекращения действия внешних сил, вызывавших изменение формы(деформацию.)
Вязкость. Вязкость называется способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость – свойство, обратное хрупкости.
Пластичность. Пластичностию называется свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность – свойство, обратное упругости.
В табл. 1 приведены свойства технических металлов.
Таблица 1.
Свойства технических металлов.
3. Значение свойств металлов.
Механические свойства. Первое требование, предъявляемое ко всякому изделию, — это достаточная прочность.
Металлы обладают более высокой прочностью по сравнению с другими материалами, поэтому нагруженные детали машин, механизмов и сооружений обычно изготовляются из металлов.
Многие изделия, кроме общей прочности, должны обладать ещё особыми свойствами, характерными для работы данного изделия. Так, например, режущие инструменты должны обладать высокой твердостью. Для изготовления режущих других инструментов применяются инструментальные стали и сплавы.
Для изготовления рессор и пружин применяются специальные стали и сплавы, обладающие высокой упругостью
Вязкие металлы применяются в тех случаях, когда детали при работе подвергается ударной нагрузке.
Пластичность металлов дает возможность производить их обработку давлением (ковать, прокатывать).
Физические свойства. В авиа-, авто- и вагоностроении вес деталей часто является важнейшей характеристикой, поэтому сплавы алюминия и особенно магния являются здесь незаменимыми. Удельная прочность( отношение предела прочности к удельному весу) для некоторых, например алюминиевых, сплавов выше, чем для мягкой стали.
Плавкость используется для получения отливок путём заливки расплавленного металла в формы. Легкоплавкие металлы(например, свинец) используются в качестве закалочной среды для стали. Некоторые сложные сплавы имеют столь низкую температуру плавления, что расплавляется в горячей воде. Такие сплавы применяются для отливки типографических матриц, в приборах, служащих для предохранения от пожаров.
Металлы с высокой электропроводностью (медь, алюминий) используются в электромашиностроении, для устройства линий электропередач, а сплавы с высоким электросопротивлением – для ламп накаливания, электронагревательных приборов.
Магнитные свойства металлов играют первостепенную роль в электромашиностроении (динамомашины, мотора, трансформаторы),для приборов связи ( телефонные и телеграфные аппараты) и используются во многих других видах машин и приборов.
Теплопроводность металлов дает возможность производить их физические свойства. Теплопроводность используется также при производстве пайки и сварки металлов.
Некоторые сплавы металлов имеют коэффициент линейного расширения, близкий к нулю; такие сплавы применяются для изготовления точных приборов, радиоламп. Расширение металлов должно применяться во внимание при постройке длинных сооружений, например, мостов. Нужно также учитывать,что две детали, изготовленные из металлов с различным коэффициентом расширения и скрепленные между собой, при нагревании могут дать изгиб и даже разрушение.
Химические свойства. Коррозионная стойкость особенно важна для изделий, работающих в сильно окислительных средах (колосниковые решётки, детали химических машин и приборов). Для достижения высокой коррозионной стойкости производят специальные нержавеющие, кислостойкие и жаропрочные стали, а также применяются защитные покрытия.
mirznanii.com
Назовите 4 главных свойства металлов?
Хорошая электропроводность Возможность лёгкой механической обработки (однако некоторые металлы, например германий и висмут, непластичны) Высокая плотность (обычно металлы тяжелее неметаллов) Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы) Большая теплопроводность
Активный или нет, блеск металлический, амфотерный или основный, и что то еще….
Свойства металлов подразделяются на физические, химические, механические и технологические. Физические свойства металлов. К физическим свойствам относятся плотность, плавление (температура плавления) , теплопроводность, тепловое расширение. Плотность — количество вещества, содержащееся в единице объема. Плавление — способность металла переходить из кристаллического (твердого) состояния в жидкое с поглощением теплоты. Теплопроводность — способность металла с той или иной скоростью проводить теплоту при нагревании. Электропроводность — способность металла проводить электрический ток. Тепловое расширение — способность металла увеличивать свой объем при нагревании. Химические свойства металлов. Химические свойства металлов характеризуют отношение их к химическим воздействиям различных активных сред. Каждый металл обладает определенной способностью сопротивляться этим воздействиям. Основными химическими свойствами металлов являются окисляемость и коррозионная стойкость. Окисляемость — способность металла вступать в реакцию в кислородом под воздействием окислителей. Коррозионная стойкость —способность металла сопротивляться коррозии. Механические свойства металлов. К механическим свойствам металлов относят твердость, прочность, вязкость, упругость и пластичность. Твердость — способность металла сопротивляться проникновению в него более твердого тела. Прочность — способность металла сопротивляться разрушению под действием внешних сил. Вязкость — способность металла сопротивляться быстро возрастающим ударным нагрузкам. Упругость — способность металла восстанавливать свою первоначальную форму и размеры после снятия действующей нагрузки. Пластичность — способность металла, не разрушаясь, изменять свою форму под действием нагрузки и сохранять полученную форму после снятия нагрузки.
1. Плотная кристаллическая структура. 2. Характерный металлический блеск. 3. Высокая теплопроводность и электрическая проводимость. 4. Уменьшение электрической проводимости с ростом температуры. 5. Низкие значения потенциала ионизации, т. е. способность легко отдавать электроны. 6. Ковкость и тягучесть. 7. Способность к образованию сплавов.
К физическим свойствам металлов относят их вес, теплоемкость, способность проводить электрический ток и другие подобные показатели. Всем понятно, что применение, например, чугуна невозможно в авиастроении, а любой металл, отлично проводящий электричество не применим в производстве изоляторов. Механические свойства определяются способностью противостоять различным нагрузкам, к ним относятся твердость, пластичность, упругость и многие другие качества. Эксплуатационные качества характеризуют возможность применения металла для эксплуатации в различных условиях — стойкость к истиранию, воздействию высоких и низких температур, и так далее. Химические свойства металлов и сплавов определены способностью элементов, входящих в их состав, вступать в реакции с другими веществами. Так, например, всем известно, что золото не поддается воздействия кислот, чего не скажешь о других видах металла. Технологические свойства материала определяют перечень производственных процессов, которые применимы к металлу в последующей обработке.
touch.otvet.mail.ru
Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Тема: Основные металлы и неметаллы
Урок: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
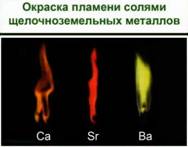

Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см
3.Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S 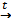 Na2S
Na2S
2Na + H2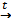 2NaH
2NaH
3Na + P 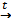 Na3P
Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3H2O → 3LiOH + NH3↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
NaOH |
Едкий натр (каустическая сода) |
|
NaCl |
Поваренная соль |
|
NaNO3 |
Чилийская селитра |
|
Na2SO4∙10H2O |
Глауберова соль |
|
Na2CO3∙10H2O |
Сода кристаллическая |
|
KOH |
Едкое кали |
|
KCl |
Хлорид калия (сильвин) |
|
KNO3 |
Индийская селитра |
|
K2CO3 |
Поташ |
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S 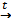 СaS
СaS
Сa + H2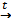 СaH2
СaH2
3Сa + 2P 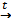 Сa3 P2-
Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 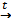 3Ba + Al2O3
3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
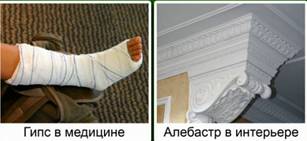
Рис. 2
СaO + H2O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.

Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 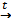 CaCO3↓ + СО2↑ + Н2О
CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов H2PO4— ,Cl—, NO3— и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.

Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2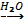 2AlI3
2AlI3
2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2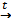 2Al2O3 + Q . При этом может развиваться температура до 35000С.
2Al2O3 + Q . При этом может развиваться температура до 35000С.
3. Реакция с неметаллами
2Al + 3S 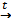 Al2S3
Al2S3
2Al + N2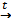 2AlN
2AlN
4Al + 3С 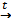 Al4С3
Al4С3
4. Взаимодействует с водой
2Al + 6H2O → 2Al(OH)3 +3H2↑ Если снять амальгамированием или механически пленку.
Амальгамирование – это нанесение на поверхность небольшого количества ртути.
5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
6. Взаимодействует с кислотами-неокислителями
2Al + 6HCl →2AlCl3 + 3H2↑
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
8Al + 30HNO3 →8Al(NO3)3 + 3NH4NO3 + 9H2O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ (амфотерные свойства).
Al2O3 + 2NaOH = 2NaAlO2 + H2O
8. Реагирует с растворами солей
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Применение алюминия

Рис. 6
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия. Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов. Используется как конструкционный материал в авиа- и машиностроении.
Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
Na2O2 + CO2 → Na2CO3 + 1/2O2
KO2 + CO2 → K2CO3 + 3/2O2
Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды. Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик.ру (Источник).
Домашнее задание
1. №№3, 4, 5-а (с. 173) Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
2. Какую реакцию среды имеет водный раствор сульфида калия? Ответ подтвердите уравнением реакции гидролиза.
3. Определите массовую долю натрия в морской воде, которая содержит 1,5% хлорида натрия.
interneturok.ru
Классификация металлов. Характеристика металлов и области применения :: SYL.ru
Несколько научных дисциплин (материало- и металловедение, физика, химия) занимаются изучением свойств и характеристик металлов. Существует их общепринятая классификация. Однако каждая из дисциплин при их изучении опирается на особые специализированные параметры, находящиеся в сфере ее интересов. С другой стороны, все науки, изучающие металлы и сплавы, придерживаются одной точки зрения, что существует две основные группы: черные и цветные.
Признаки металлов
Различают следующие основные механические свойства:
- Твердость – определяет возможность одного материала противодействовать проникновению другого, более твердого.
- Усталость – количество, а также время циклических воздействий, которое может выдержать материал без изменения целостности.
- Прочность. Заключается в следующем: если приложить динамическую, статическую или знакопеременную нагрузку, то это не приведет к изменению формы, строения и размеров, нарушению внутренней и наружной целостности металла.
- Пластичность – это способность удерживать целостность и полученную форму при деформации.
- Упругость – это деформация без нарушения целостности под воздействием определенных сил, а также после избавления от нагрузки возможность к возращению первоначальной формы.
- Стойкость к трещинам – под влиянием внешних сил в материале они не образуются, а также сохраняется наружная целостность.
- Износостойкость – способность сохранять наружную и внутреннюю целостность при продолжительном трении.
- Вязкость – сохранение целостности при увеличивающихся физических воздействиях.
- Жаростойкость – противостояние изменению размера, формы и разрушению при воздействии высоких температур.
Классификация металлов
К металлам относятся материалы, обладающие совокупностью механических, технологических, эксплуатационных, физических и химических характерных свойств:
- механические подтверждают способность к сопротивлению деформации и разрушению;
- технологические свидетельствуют о способности к разному виду обработки;
- эксплуатационные отражают характер изменения при эксплуатации;
- химические показывают взаимодействие с различными веществами;
- физические указывают на то, как ведет себя материал в разных полях – тепловом, электромагнитном, гравитационном.
 По системе классификации металлов все существующие материалы подразделяются на две объемные группы: черные и цветные. Технологические и механические свойства также тесно связаны. К примеру, прочность металла может являться результатом правильной технологической обработки. Для этих целей используют так называемую закалку и «старение».
По системе классификации металлов все существующие материалы подразделяются на две объемные группы: черные и цветные. Технологические и механические свойства также тесно связаны. К примеру, прочность металла может являться результатом правильной технологической обработки. Для этих целей используют так называемую закалку и «старение».Химические, физические и механические свойства тесно взаимосвязаны между собой, так как состав материала устанавливает все остальные его параметры. Например, тугоплавкие металлы являются самыми прочными. Свойства, которые проявляются в состоянии покоя, называются физическими, а под воздействием извне – механическими. Также существуют таблицы классификации металлов по плотности — основному компоненту, технологии изготовления, температуре плавления и другие.
Черные металлы
Материалы, относящиеся к этой группе, обладают одинаковыми свойствами: внушительной плотностью, большой температурой плавления и темно-серой окраской. К первой большой группе черных металлов принадлежат следующие:
- Железные – кобальт, марганец, никель, железо. Применяются в качестве основы или добавок к сплавам.
- Тугоплавкие – хром, вольфрам, молибден, титан. Все они имеют температуру плавления, превышающую уровень, при котором плавится железо. Используются как основа или добавка для получения легированных сталей.

- Урановые – актиноиды и металлы, полученные в результате синтеза. Большое применение находят в атомной энергетике.
- Редкоземельные – неодим, церий, лантан. Все металлы обладают родственными химическими свойствами, но совершенно разными физическими параметрами. Находят свое применение как присадки к сплавам.
- Щелочноземельные – кальций, натрий, литий. В свободном виде практического применения не имеют.
Цветные металлы
Вторая по величине группа имеет небольшую плотность, хорошую пластичность, невысокую температуру плавления, преобладающие цвета (белый, желтый, красный) и состоит из следующих металлов:
- Легкие – магний, стронций, цезий, кальций. В природе встречаются только в прочных соединениях. Применяются для получения легких сплавов разного назначения.
- Благородные. Примеры металлов: платина, золото, серебро. Они обладают повышенной устойчивостью к коррозии.
- Легкоплавкие – кадмий, ртуть, олово, цинк. Имеют невысокую температуру плавления, участвуют в производстве разных сплавов.
 Низкая прочность цветных металлов не позволяет их использовать в чистом виде, поэтому в промышленности их применяют в виде сплавов.
Низкая прочность цветных металлов не позволяет их использовать в чистом виде, поэтому в промышленности их применяют в виде сплавов.Медь и сплавы с медью
В чистом виде имеет розовато-красный цвет, маленькое удельное сопротивление, небольшую плотность, хорошую теплопроводность, отличную пластичность, обладает стойкостью к коррозии. Находит широкое применение как проводник электрического тока. Для технических нужд используют два вида сплавов из меди: латуни (медь с цинком) и бронзы (медь с алюминием, оловом, никелем и другими металлами). Латунь используется для изготовления листов, лент, труб, проволоки, арматуры, втулок, подшипников. Из бронзы изготавливают плоские и круглые пружины, мембраны, разную арматуру, червячные пары.
Алюминий и сплавы
Этот очень легкий металл, имеющий серебристо-белый цвет, обладает высокой коррозийной стойкостью. У него хорошая электропроводность и пластичность. Благодаря своим характеристикам нашел применение в пищевой, легкой и электропромышленности, а также в самолетостроении. Сплавы из алюминия очень часто используются в машиностроении для изготовления особо ответственных деталей.
Магний, титан и их сплавы
Магний неустойчив к коррозии, зато не существует легче металла, используемого для технических нужд. В основном его добавляют в сплавы с другими материалами: цинком, марганцем, алюминием, которые прекрасно режутся и являются достаточно прочными. Из сплавов с легким металлом магнием изготавливают корпусы фотоаппаратов, различных приборов и двигателей. Титан нашел свое применение в ракетной отрасли, а также машиностроении для химической промышленности. Титаносодержащие сплавы имеют небольшую плотность, прекрасные механические свойства и стойкость к коррозии. Они хорошо поддаются обработке давлением.
Антифрикционные сплавы
Такие сплавы определены для увеличения срока службы поверхностей, испытывающих трение. Они сочетают в себе следующие характеристики металла – хорошую теплопроводность, маленькую температуру плавления, микропористость, слабый коэффициент трения. К антифрикционным относят сплавы, основой которых является свинец, алюминий, медь или олово. К самым применяемым относятся:
- баббит. Его изготовляют на основе свинца и олова. Используют в производстве вкладышей для подшипников, которые работают на больших скоростях и при ударных нагрузках;
- алюминиевые сплавы;
- бронза;
- металлокерамические материалы;
- чугун.
Мягкие металлы
По системе классификации металлов это золото, медь, серебро, алюминий, но среди самых мягких выделяют цезий, натрий, калий, рубидий и другие. Золото сильно распылено в природе. Оно есть в морской воде, организме человека, а также его можно встретить практически в любом осколке гранита. В чистом виде золото имеет желтый с оттенком красного цвет, так как металл мягкий — его можно поцарапать даже ногтем. Под влиянием окружающей среды золото достаточно быстро разрушается. Этот металл является незаменимым для электрических контактов. Несмотря на то что серебра в двадцать раз больше, чем золота, он также является редким.
 Используется для производства посуды, ювелирных украшений. Легкий металл натрий также получил широкое распространение, востребован практически в каждой отрасли промышленности, в том числе химической — для производства удобрений и антисептиков.
Используется для производства посуды, ювелирных украшений. Легкий металл натрий также получил широкое распространение, востребован практически в каждой отрасли промышленности, в том числе химической — для производства удобрений и антисептиков.Металлом является ртуть, хоть и находится в жидком состоянии, поэтому считается одним из самых мягких в мире. Этот материал используется в оборонной и химической промышленности, сельском хозяйстве, электротехнике.
Твердые металлы
В природе практически нет самых твердых металлов, поэтому добыть их очень сложно. В большинстве случаев их находят в упавших метеоритах. Хром принадлежит к тугоплавким металлам и является самым твердым из чистейших на нашей планете, к тому же он легко поддается механической обработке.
 Вольфрам – это химический элемент. Считается самым твердым при сравнении с другими металлами. Имеет чрезвычайно высокую температуру плавления. Несмотря на твердость, из него можно выковывать любые нужные детали. Благодаря теплоустойчивости и гибкости это наиболее подходящий материал для выплавки небольших элементов, используемых в осветительных приборах. Тугоплавкий металл вольфрам – основное вещество тяжелых сплавов.
Вольфрам – это химический элемент. Считается самым твердым при сравнении с другими металлами. Имеет чрезвычайно высокую температуру плавления. Несмотря на твердость, из него можно выковывать любые нужные детали. Благодаря теплоустойчивости и гибкости это наиболее подходящий материал для выплавки небольших элементов, используемых в осветительных приборах. Тугоплавкий металл вольфрам – основное вещество тяжелых сплавов.Металлы в энергетике
Металлы, в состав которых входят свободные электроны и положительные ионы, считаются хорошими проводниками. Это довольно востребованный материал, характеризующийся пластичностью, высокой электропроводностью и способностью легко отдавать электроны.
 Из них делают силовые, радиочастотные и специальные провода, детали для электрических установок, машин, для бытовых электроприборов. Лидерами применения металлов для изготовления кабельной продукции считаются:
Из них делают силовые, радиочастотные и специальные провода, детали для электрических установок, машин, для бытовых электроприборов. Лидерами применения металлов для изготовления кабельной продукции считаются:- свинец — за большую устойчивость к коррозии;
- медь — за высокую электропроводность, легкость в обработке, стойкость к коррозии и достаточную механическую прочность;
- алюминий — за небольшой вес, устойчивость к вибрациям, прочность и температуру плавления.
Категории черных вторичных металлов
К отходам черных металлов предъявляют определенные требования. Для отправки сплавов в сталеплавильные печи потребуются определенные операции по их обработке. Перед подачей заявки на перевозку отходов необходимо ознакомиться с ГОСТом черных металлов для определения его стоимости. Черный вторичный лом классифицируют на стальной и чугунный. Если в составе присутствуют легирующие добавки, то его относят к категории «Б». В категорию «А» включены углеродистые: сталь, чугун, присад.
Металлурги и литейщики из-за ограниченности первичной сырьевой базы проявляют активный интерес к вторичному сырью. Использование лома черных металлов вместо металлической руды – это ресурсное, а также энергосберегающее решение. Вторичный черный металл используют как охладитель конвертерной плавки.

Диапазон применения металлов невероятно широк. Черные и цветные неограниченно используются в строительной и машинной индустрии. Не обойтись без цветных металлов и в энергетической промышленности. Редкие и драгоценные идут на изготовление украшений. В искусстве и медицине находят применение как цветные, так и черные металлы. Невозможно представить жизнь человека без них, начиная от хозяйственных принадлежностей и до уникальных приборов и аппаратов.
www.syl.ru
