Теория электрической диссоциации
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Основные положения ТЭД (Теории электролитической диссоциации):
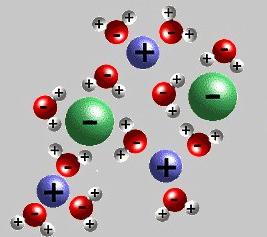
Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные).
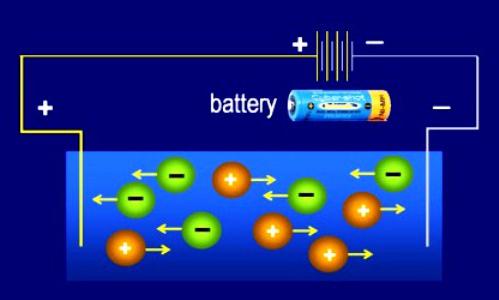
Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+)
Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры.
Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ.
Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”.
Примеры сильных электролитов:
NaOH, K2SO4, HClO4
Уравнения диссоциации:
NaOH⇄Na++OH—
K2SO4⇄2K++SO42-
HClO4⇄H++ClO4—
Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе.
Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%.
α = 0% относится к неэлектролитам (диссоциация отсутствует)
0% <α < 100% относится к слабым электролитам (диссоциация неполная)
α = 100% относится к сильным электролитам (полная диссоциация)
Так же стоит помнить про количество ступеней диссоциации, например:
Диссоциация раствора H2SO4
H2 SO4⇄H++HSO4—
HSO4—⇄H++SO42-
У каждой ступени диссоциации своя степень диссоциации.
Например, диссоциация солей CuCl2, HgCl2:
CuCl2⇄Cu2++2Cl—
диссоциация протекает полностью
А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца.
HgCl2
⇄HgCl++Cl—Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4—.
У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности).
Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена:
Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7)
Слабые кислоты (HF, H2S, H2Se, HClO, HBrO, H2SeO3, HNO2,H3PO4, H
Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена.
Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода).
Реакции ионного обмена принято писать в три стадии:
1. Молекулярное уравнение
2. Полное ионное уравнение
3. Сокращенное ионное уравнение
При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости.
Реакции, где все реагенты и продукты получились растворимые в воде, не протекают.
Несколько примеров:
Na2 CO3+H2SO4→Na2 SO4+CO2↑+H2O
2Na++CO32-+2H++SO42-→2Na++SO42-+CO2↑+H2O
CO32-+2H+→CO2↑+H2O
Сокращённое ионное уравнение получается с помощью вычёркивания одинаковых ионов из обеих частей полного ионного уравнения.
Если реакция ионного обмена идёт между двумя солями с образованием осадка, то следует брать два хорошо растворимых реагента. То есть, реакция ионного обмена пойдёт если растворимость реагентов будет выше, чем у одного из продуктов.
Ba(NO3 )2+Na2 SO4→BaSO4↓+2NaNO3
Иногда при написании реакций ионного обмена пропускают полное ионное уравнение и сразу пишут сокращенное.
Ba2++SO42-→BaSO4↓
Для получения осадка малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты в их концентрированных растворах.
Например:
2KF+FeCl2→FeF2↓+2KCl
Fe2++2F—→FeF2↓
Данные правила подбора реагентов для осаждения продуктов справедливы только для солей.
Примеры реакций с выпадением осадков:
1.Ba(OH)2+H2 SO4→BaSO4↓+2H2O
Ba2++SO42-→BaSO4↓
2. AgNO3+KI→AgI↓+KNO3
Ag++I—→AgI↓
3.H2S+Pb(NO3
)2→PbS↓+2HNO3H2S+Pb2+→PbS↓+2H+
4. 2KOH+FeSO4→Fe(OH)2↓+K2 SO4
Fe2++2OH—→Fe(OH)2↓
Примеры реакций с выделением газов:
1.CaCO3+2HNO3→Ca(NO3 )2+CO2↑+H2O
CaCO3+2H+→Ca2++CO2↑+H2O
2. 2NH4Cl+Ca(OH)2→2NH3↑+CaCl2+2H2O
NH4++OH—→NH3↑+H2O
3. ZnS+2HCl→H2 S↑+ZnCl2
ZnS+2H+→H2S↑+Zn2+
Примеры реакций с образованием слабых электролитов:
1.Mg(CH3COO)2+H2
CH3COO—+H+→CH3COOH
2. HI+NaOH→NaI+H2O
H++OH—→H2O
Рассмотрим применение изученного материала на конкретных заданиях, встречающихся на экзаменах:
№1.Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют)
1) толькоNa2S
2) NaCl и Na2S
3) Na2Sи Na2SO4
4) NaCl и Na2SO4
Под словом “вступают” подразумевается “протекает реакция”, а как было сказано выше, реакция протекает если образовалось нерастворимое или малорастворимое вещество, выделился газ или образовался слабый электролит (вода).
Разберём варианты по очереди.
2)NaCl+Cu(NO3 )2↛CuCl2+2NaNO3 все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
Протекает только реакция с Na2S с образованием осадка
3)С Na2S так же будет образование осадка как и в первых двух примерах.
Na2 SO4+Cu(NO3 )2↛CuSO4+2NaNO3
Все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
4) С Na2SO4 реакция не протекает как в прошлом варианте ответа
NaCl+Cu(NO3 )2↛CuCl2+2NaNO3
Все продукты являются хорошо растворимыми электролитами, это не газы, следовательно, реакция не протекает.
Следовательно, подходит 1 вариант ответа.
№2. Газ выделяется при взаимодействии
1) MgCl2и Ba(NO3)2
2) Na2CO3и CaCl2
3) NH4ClиNaOH
4) CuSO4 и KOH
Слово “газ” в таких заданиях обозначает именно газы и легколетучие соединения.
В заданиях в качестве таких соединений обычно встречаются NH3·H2O, H2CO3 (в нормальных условиях проведения реакции разлагается на CO2и H2O, принято не писать полную формулу угольной кислоты, а сразу расписывать на газ и воду), H2S.
Из представленных веществ выше мы не сможем получить H2S, потому что отсутствует сульфид-ион во всех веществах. Так же не сможем получить углекислый газ, ибо для его получения из соли нужно добавить кислоту, а в паре с карбонатом натрия находится другая соль.
Мы можем получить газ в 3 варианте ответа.
NH4Cl+NaOH→NH3↑+NaCl+H2O
Выделился газ с резким запахом.
Следовательно, подходит 3 вариант ответа.
№3.В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
Среди реагентов есть два электролита, чтобы прошла реакция, нужно, чтоб выделился осадок.
С оксидом кремния соляная кислота не прореагирует, а серебро не вытеснит водород из соляной кислоты.
Ba(NO3 )2+2HCl→BaCl2+2HNO3 реакция не будет протекать, так как все продукты – растворимые электролиты
AgNO3+HCl→AgCl↓+NaNO3
Выпадет белый творожистый осадок нитрата серебра
Следовательно, подходит 1 вариант ответа.
Следующий пример задания, в отличие от первых трёх, взят из КИМа ЕГЭ 2017.
Первые три взяты из КИМа ОГЭ 2017
№4.
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ РЕАГЕНТ
А) HNO3 и H2O 1) CaCO3
Б)KClи NaOH 2) KOH
В)NaClи BaCl2 3) HCl
Г) AlCl3и MgCl2 4) KNO3
5) CuSO4
Чтобы выполнить это задание, следует сначала понять, что под каждой буквой указаны два вещества, которые находятся в одном растворе и нужно подобрать вещество так, чтоб хотя бы одно из них вступило в качественную реакцию с веществом-реагентом, который дан под цифрой.
К раствору азотной кислоты добавим карбонат кальция, углекислый газ станет признаком реакции:
2HNO3+CaCO3→Ca(NO3 )2+CO2↑+H2O
Ещё, по логике, карбонат кальция не растворяется в воде, значит, во всех остальных растворах тоже не растворится, следовательно, к признакам реакции можно добавить растворение карбоната кальция, помимо выделения газа.
Раствор под буквой Б можно было бы различить с помощью соляной кислоты под цифрой 3, но только в случае, если было бы разрешено воспользоваться индикатором (фенолфталеин), который бы обесцветился после реакции, ибо произойдёт нейтрализация щёлочи.
Поэтому, можем различитьв растворе OH—ион только при помощи 5 раствора (CuSO4)
2NaOH+CuSO4→Cu(OH)2↓+Na2 SO4
Образовались кристаллики голубого цвета на две раствора.
Раствор под буквой В можем различить так же с помощью реактива под номером 5, ибо сульфат-ионы, соединяясь с барием сразу выпадут в белый кристаллический осадок, который не растворим в избытке даже самых сильных кислот.
BaCl2+CuSO4→CuCl2+BaSO4↓
Раствор под буквой Г нетрудно различить с помощью любой щелочи, т.к основания магния и алюминия при протекании реакции сразу выпадут в осадок. Щелочь представлена под цифрой 2
AlCl3+3KOH→Al(OH)3↓+3KCl
MgCl2+2KOH→Mg(OH)2↓+2KCl
Автор статьи: Симкин Егор Андреевич
Редактор: Харламова Галина Николаевна
Теория электролитической диссоциации — одна из основных в химии :: SYL.ru
Вещества-электролиты при растворении в воде распадаются на заряженные частицы — ионы. Обратное явление — моляризация, или ассоциация. Образование ионов объясняет теория электролитической диссоциации (Аррениус, 1887). На механизм распада химических соединений при расплавлении и растворении влияют особенности типов химических связей, строение и характер растворителя.
Электролиты и непроводники
В растворах и расплавах происходит разрушение кристаллических решеток и молекул — электролитическая диссоциация (ЭД). Распад веществ сопровождается образованием ионов, появлением такого свойства, как электропроводность. Не каждое соединение способно диссоциировать, а только вещества, которые изначально состоят из ионов либо сильно полярных частиц. Присутствием свободных ионов объясняется свойство электролитов проводить ток. Обладают такой способностью основания, соли, многие неорганические и некоторые органические кислоты. Непроводники состоят из малополярных или неполяризованных молекул. Они не распадаются на ионы, являясь неэлектролитами (многие органические соединения). Переносчики зарядов — положительные и отрицательные ионы (катионы и анионы).
Роль С. Аррениуса и других химиков в изучении диссоциации
Теория электролитической диссоциации обоснована в 1887 году ученым из Швеции С. Аррениусом. Но первые обширные исследования свойств растворов были проведены еще русским ученым М. Ломоносовым. Внесли вклад в изучение заряженных частиц, возникающих при растворении веществ, Т. Гротгус и М. Фарадей, Р. Ленц. Аррениус доказал, что электролитами являются многие неорганические и некоторые органические соединения. Шведский ученый объяснил электропроводность растворов распадом вещества на ионы. Теория электролитической диссоциации Аррениуса не придавала значения непосредственному участию молекул воды в этом процессе. Русские ученые Менделеев, Каблуков, Коновалов и другие считали, что происходит сольватация — взаимодействие растворителя и растворенного вещества. Когда идет речь о водных системах, то применяется название «гидратация». Это сложный физико-химический процесс, о чем свидетельствует образование гидратов, тепловые явления, изменение цвета вещества и появление осадка.

Основные положения теории электролитической диссоциации (ТЭД)
Многие ученые работали над уточнением теории С. Аррениуса. Потребовалось ее усовершенствование с учетом современных данных о строении атома, химической связи. Сформулированы основные положения ТЭД, отличающиеся от классических тезисов конца XIX века:
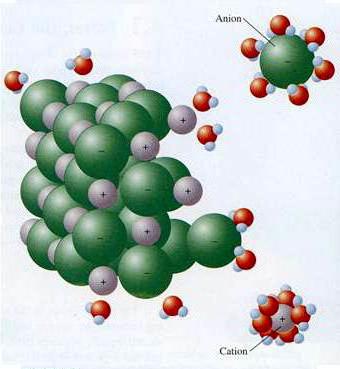
- Процесс расплавления либо растворения сопровождается диссоциацией электролита на ионы. Так (по предложению Фарадея) называют частицы, обладающие зарядом («+» или «–») Они отличаются от нейтральных атомов строением валентных оболочек и устойчивостью, бывают окрашенными и бесцветными. Ионы могут быть простыми: Na+, Cl—, S2-, Al3+. Есть заряженные частицы, состоящие из групп атомов: CO2-, NH4+. С греческого языка название «ион» переводится как «странствующий», что указывает на хаотичность распространения этих частиц.
- Воздействие внешнего электрического поля приводит ионы в упорядоченное движение внутри пространства электролита. Каждая отрицательная частица направляется к аноду (положительному электроду). Ионы со знаком «+» начинают движение в сторону катода (отрицательного электрода).
- Одновременно в растворах происходит распад на ионы и соединение этих частиц, поэтому диссоциация относится к обратимым физико-химическим процессам.

Происходящие явления необходимо учитывать при составлении уравнений: применить специальный знак обратимого процесса, подсчитать отрицательные и положительные заряды: они в сумме должны совпадать.
Механизм ЭД ионных веществ
Современная теория электролитической диссоциации учитывает строение веществ-электролитов и растворителей. При растворении связи между разноименно заряженными частицами в ионных кристаллах разрушаются под воздействием полярных молекул воды. Они буквально «вытягивают» ионы из общей массы в раствор. Распад сопровождается образованием вокруг ионов сольватной (в воде — гидратной) оболочки. Кроме воды, повышенной диэлектрической проницаемостью обладают кетоны, низшие спирты. При диссоциации хлорида натрия на ионы Na+ и Cl— регистрируется начальная стадия, которая сопровождается ориентацией диполей воды относительно поверхностных ионов в кристалле. На заключительном этапе гидратированные ионы освобождаются и диффундируют в жидкость.
Механизм ЭД соединений с ковалентной сильнополярной связью
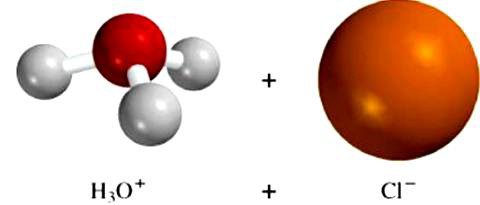
Молекулы растворителя влияют на элементы кристаллического строения неионных веществ. Например, воздействие диполей воды на хлороводородную кислоту приводит к изменению типа связи в молекуле с ковалентной полярной на ионную. Вещество диссоциирует, в раствор поступают гидратированные ионы водорода и хлора. Этот пример доказывает важность тех процессов, которые возникают между частицами растворителя и растворенного соединения. Именно это взаимодействие приводит к образованию ионов электролита.
Теория электролитической диссоциации и основные классы неорганических соединений
В свете основных положений ТЭД кислотой можно назвать электролит, при распаде которого из положительных ионов можно обнаружить только протон Н+. Диссоциация основания сопровождается образованием или освобождением из кристаллической решетки только аниона ОН— и катиона металла. Нормальная соль при растворении дает положительный ион металла и отрицательный — остатка кислоты. Основная соль отличается наличием двух видов анионов: ОН-группы и кислотного остатка. В кислой соли из катионов присутствуют только водород и металл.
Сила электролитов
Для характеристики состояния вещества в растворе используется физическая величина — степень диссоциации (α). Находят ее значение из отношения количества распавшихся молекул к общему их числу в растворе. Глубину диссоциации определяют разные условия. Важны диэлектрические показатели растворителя, структура растворенного соединения. Обычно степень диссоциации понижается с ростом концентрации и увеличивается при повышении температуры. Зачастую степень диссоциации конкретного вещества выражают в долях от единицы.
Классификация электролитов
Теория электролитической диссоциации в конце XIX века не содержала положения о взаимодействии ионов в растворе. Несущественным казалось Аррениусу влияние молекул воды на распределение катионов и анионов. Представления Аррениуса о сильных и слабых электролитах были формальными. Исходя из классических положений, можно получить значение α = 0,75–0,95 для сильных электролитов. В экспериментах доказана необратимость их диссоциации (α →1). Практически полностью распадаются на ионы растворимые соли, серная и соляная кислоты, щелочи. Частично диссоциируют сернистая, азотистая, плавиковая, ортофосфорная кислоты. Слабыми электролитами считаются кремниевая, уксусная, сероводородная и угольная кислоты, гидроксид аммония, нерастворимые основания. Воду также относят к слабым электролитам. Диссоциирует небольшая часть молекул Н2О, одновременно происходит моляризация ионов.
Теория электролитической диссоциации (ТЭД)
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
В процессе растворения вещество распадается в растворителе на мельчайшие частицы и равномерно распределяется по всему объему раствора. Что собой представляют эти частицы?
Одни вещества при растворении в воде распадаются на отдельные молекулы, которые окружены связанными с ними молекулами воды — гидратной оболочкой. Растворы таких веществ не проводят электрический ток, поскольку в них нет заряженных частиц, способных перемещаться в электрическом поле. В этом легко убедиться с помощью прибора для определения электропроводности растворов.
Вещества, растворы которых не проводят электрический ток, называют неэлектролитами. Если раствор вещества проводит электрический ток, следовательно в нем содержатся заряженные частицы. Молекулы электронейтральны, а значит такими частицами могут быть ионы, которые несут электрический заряд. Следовательно, вещества, растворы которых проводят электрический ток, распадаются при растворении не на молекулы, а на ионы.
Процесс распада вещества на ионы называют электролитической диссоциацией.
Если с помощью прибора для определения электропроводности испытать раствор хлорида натрия, лампочка ярко загорится. Между электродами находится жидкость, которая выполняет роль проводника, цепь замкнута.
Вещества, растворы которых проводят электрический то{| называют электролитами.
К электролитам в первую очередь относятся растворимые воде вещества с ионным и ковалентным полярным типом связи. Как же происходит распад вещества на ионы; иными словам] каков механизм электролитической диссоциации?
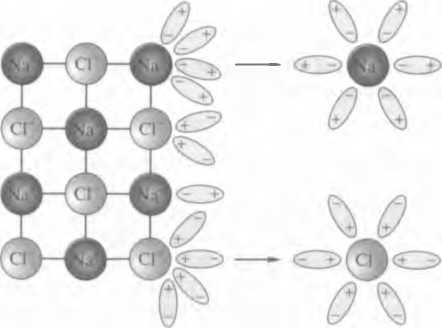
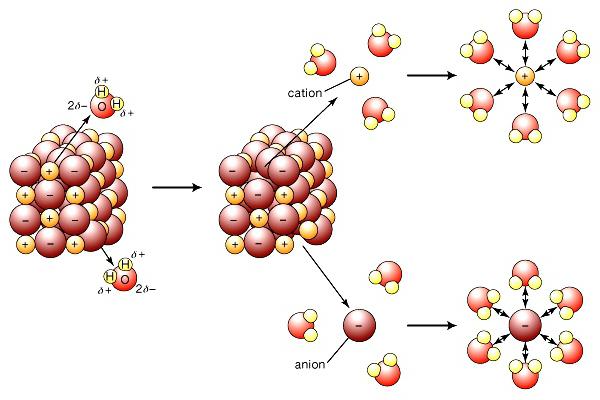
Рис. 3.3. Схема электролитической диссоциации вещества с ионным типом связи
Вещества с ионным типом связи образуют ионную кристаллизую решетку. В узлах такой решетки находятся катионы и анионы, которые притягиваются друг к другу за счет сил электростатического взаимодействия. При погружении вещества в растворитель, например в воду, поверхностный слой ионов сразу же окружают полярные молекулы воды — диполи. Суммарная сила взаимодействия между диполями воды и ионом становится больше силы его притяжения в кристалле, и гидратированный ион переходит в раствор.
Процесс электролитической диссоциации выражают уравнением в левой части которого указывают формулу электролита, в правой — те ионы, на которые он диссоциирует, например:
NaCl → Na+ + Cl—
Сульфат меди(II) в водном растворе распадается (диссоциирует) на простой катион меди Сu2+ и сложный анион SO42-. В отличие от катиона натрия и хлорид-аниона это двухзарядные ионы. Уравнение электролитической диссоциации имеет вид
CuSO4 = Cu2+ + SO42-
Подобным образом диссоциируют вещества с ковалентными полярными связями. Полярная молекула электролита окружается диполями воды, которые «растаскивают» частицу в разные стороны. Длина ковалентной полярной связи увеличивается, возрастает ее полярность. В какой-то момент эта связь превращается в ионную. Наконец, молекула электролита распадается на гидратированные ионы.

Уравнение электролитической диссоциации хлороводорода в водном растворе имеет вид
НС1 = Н+ + Cl—
Повторим известные вам из курса основной школы положения теории электролитической диссоциации.
По способности проводить электрический ток в растворах все вещества можно разделить на электролиты и неэлектролиты.
К электролитам относятся все соли, щелочи, многие кислоты. К неэлектролитам относится подавляющее большинство органических веществ, простые вещества, некоторые двухэлементны соединения неметаллов (например, оксид кремния(IV) SiО2).
В растворах электролиты диссоциируют, т.е. распадаются на ионы — катионы и анионы.
Разные электролиты по-разному диссоциируют на ионы.
Эту способность электролитов количественно характеризует степенью электролитической диссоциации.
Отношение количества вещества, распавшегося на ионы, общему количеству растворенного вещества, называют степенью электролитической диссоциации.
По степени диссоциации все электролиты можно условно разделить на сильные (степень диссоциации стремится к единице) и слабые (степень диссоциации стремится к нулю).
Сильные электролиты в растворах почти полностью распадаются на ионы, и уравнение диссоциации для таких электролитов принято записывать как необратимый процесс:
NaOH = Na+ + ОН—
A12(SО4)3 = 2А13- + 3 SO42-
К сильным электролитам относятся щелочи, все соли, некоторые кислоты (НСl, HNО3, H2SО4, НСlO4, НВг, HI и др.).
Слабые электролиты в растворах диссоциируют незначительно, причем этот процесс обратим:
HNO3 = Н+ + NO3+
Помимо приведенной азотистой кислоты к слабым электролитам относятся многие другие неорганические (H2S, H2CО3, HCl и почти все органические кислоты, а также гидрат аммиака (гидроксид аммония):
4 Пo природе образующихся в результате диссоциации ионов различают три типа электролитов: кислоты, основания и соли.
Кислоты — это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка:
НС1 = Н+ + С1—
Основания — это электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп:
КОН = К+ + ОН—
Соли — это электролиты, диссоциирующие на катионы металла и анионы кислотного остатка:
ВаС12 = Ва2+ + 2Сl—
Теория электролитической диссоциации
Проводимость веществами электрического тока или отсутствие проводимости можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара ,то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли.
К неэлектролитам относятся большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи .
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Сильные электролиты при растворении вводе полностью диссоциируют на ионы.
К ним относятся:
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH 3∙H 2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид-ионы Cl —.
Вода образует ионы водорода Н+ и гидроксид-ионы ОН— лишь в очень незначительных количествах.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации . В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современное содержание этой теории можно свести к следующим трем положениям :
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы ( Na +, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3—, SO2-4 , РОЗ-4 и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами , вторые — анионами .
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы ( диссоциация ) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А— в общем виде записывается так:
КА ↔ K + + A —
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие о степени диссоциации.
Степенью диссоциации (а) называется отношение числа молекул, распавшихся на ионы (n’), к общему числу растворенных молекул (n):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
СН3СООН ↔ СН3СОO—+ Н+
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Из этого выражения очевидно, что α может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы:
Диссоциация полярных молекул может быть полной или частичной.
Таким образом , электролитами являются соединения с ионной или полярной связью — соли , кислоты и основания . И диссоциировать на ионы они могут в полярных растворителях.
Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
A K → A— + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как:
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции
означает, что если в раствор, содержащий ионы серебра Ag+,внести металлическую медь, то в момент достижения равновесия концентрация ионов меди [Cu2+] намного больше, чем квадрат концентрации ионов серебра [Ag+]2. Напротив, низкое значение Кв реакции
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия. Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия (такие константы обозначаются К1).
Так, для реакции меди с серебром неправильным будет выражение:
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI
Произведение растворимости. Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
выражение константы будет:
, а не
Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация [Н2О] остается постоянной и вводится в константу равновесия.
Кислоты, основания и соли с позиций электролитической диссоциации.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Например:
НCl ↔ Н++ С l — ;
СН3СООН ↔ Н+ + СН3СОО—
Диссоциация многоосновной кислоты протекает главным образом по первой ступени , в меньшей степени по второй и лишь в незначительной степени — по третьей . Поэтому в водном растворе , например , фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4
Н3РО4 ↔ Н+ + Н2РО—4 (первая ступень)
Н2РО—4 ↔ Н+ + НРO2-4 (вторая ступень)
НРО2-4 ↔ Н+ PОЗ-4 (третья ступень)
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации.
Так , НCl, HNO3 — одноосновные кислоты — образуется один катион водорода;
Н2S, Н2СО3, Н2SO4 — двухосновные,
Н3 РО4, Н3 АsО4 — трехосновные , так как образуются соответственно два и три катиона водорода.
Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН3СООН , только один , входящий в карбоксильную группу — СООН, способен отщепляться в виде катиона Н+, — уксусная кислота одноосновная.
Двух — и многоосновные кислоты диссоциируют ступенчато (постепенно).
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH ↔ K+ + OH—;
NH4OH ↔ NH+4 + OH—
Основания,растворимые в воде называются щелочами . Их немного . Это основания щелочных и щелочноземельных металлов : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН . Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп ( гидроксогрупп ). Например, NН4ОН — однокислотное основание , Са(ОН)2— двухкислотное , Fе(ОН)3 — трехкислотное и т . д . Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2 ↔ Са(ОН)+ + OH— (первая ступень)
Ca(OH)+ ↔ Ca2++ OH— (вторая ступень)
Однако имеются электролиты , которые при диссоциации одновременно образуют катионы водорода, и гидроксид — ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН— (в незначительных количествах):
Н2O ↔ Н+ + ОН—
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН—.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН— + Zn2+ + 2Н 2О ↔ Zn(ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH4) и анионы кислотных остатков
Например:
(NH4)2SO4 ↔ 2NH+4 + SO2-4;
Na3PO4 ↔ 3Na+ + PO3-4
Так диссоциируют средние соли . Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4 ↔ K++ HSO—4
И далее:
HSO —4 ↔ H+ + SO 2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы .
Mg(OH)Cl ↔ Mg(OH)++ Cl—
И далее:
Mg(OH)+ ↔ Mg2++ OH—
Напишите, пожалуйста, правила для уравнений диссоциации веществ. Или ссылку киньте, пожалуйста.
При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации) . Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+). Электролитическая диссоциация — процесс обратимый (обратная реакция называется моляризацией) . Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы к общему числу молекул, введенных в раствор . Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (h3O), хотя он является основным участником. Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю. С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н3РО4 → Н (+) + Н2РО4(-)(первая ступень) Н2РО-4→ Н (+) + НРO4(2-) (вторая ступень) НРО2-4→ Н (+) PО4(З-) (третья ступень) Диссоциация многоосновной кислоты протекает главным образом по первой ступени. Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH→ K(+) + OH(-) Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп) . Например, NН4ОН — однокислотное основание, Са (ОН) 2 — двухкислотное, Fе (ОН) 3 — трехкислотное и т. д. Двух- и многокислотные основания диссоциируют ступенчато Ca(ОН) 2 ↔Са (ОН) + + OH(-) (первая ступень) Ca(OH)(+) ↔Ca(2+)+OH(-) (вторая ступень) Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением 2ОН (-) + Zn(2+) + 2Н2О ↔ Zn(ОН) 2 + 2Н2О ↔ [Zn(ОН) 4](2-)+ 2Н (+) Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония Nh5(+) и анионы кислотных остатков. Кислые и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода KHSO4 ↔ K(+) + HSO4(-) а затем: HSO4(-)↔ H(+)+SO4(2-) У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl ↔ Mg(OH)(+)+Cl(-) и потом Mg(OH)(+) ↔ Mg(2+)+OH(-) Теорию электролитической диссоциации изложил С. Аррениус. Удачи!
Составить уравнение реакций, характеризующих химические свойства Са. Реакции рассмотреть в свете теории ОВР и ТЭД. Да
Кальций — легкий серебристо-белый металл. По химическим свойствам кальций близок к соседним с ним элементам главной подгруппы I группы — щелочным металлам. При нагревании кальция он загорается и горит с образованием белого дыма, окрашивая пламя в кирпично-красный цвет. Дым состоит из мельчайших твердых частичек оксида кальция: 2Са + O2 = 2СаО + Q Кальций реагирует с водой, превращаясь в гидроксид кальция и вытесняя из воды водород: Са + 2Н2О = Са (ОН) 2 + Н2 + Q Фенолфталеин в полученном растворе окрашивается в малиновый цвет. Это доказывает сходство кальция с щелочными металлами: как и щелочные металлы, кальций взаимодействует с холодной водой с выделением водорода. Однако реакция кальция с водой протекает значительно медленнее, чем, например, натрия или калия, это связано стем, что на внешнем электронном слое атома кальция находятся два спаренных s-электрона. Гидроксид кальция растворим в воде, т. е. представляет собой щелочь. Растворимость гидроксида кальция значительно выше, чем гидроксида магния, но ниже, чем гидроксидов щелочных металлов — натрия или калия. Кальций хранят под слоем керосина, так как этот металл реагирует с водяными парами, содержащимися в воздухе. 2Са + О2 = 2СаО С холодной водой с образованием гидроксида кальция (с горячей водой реакция протекает более энергично) Са + 2Н2О = Са (ОН) 2 + Н2 При нагревании реагирует со многими неметаллами — водородом, азотом, серой, фосфором, углеродом и др. Са + Н2 = СаН2 (гидрид кальция) 3Са + N2 = Са3N2 (нитрид кальция) Са + S = СаS (сульфид кальция) Восстанавливает менее активные металлы из их оксидов и галогенидов 2Са + ТiO2 = 2СаО + Тi
Как решать уравнения по химии по теме электрическая диссоциация?
<a rel=»nofollow» href=»http://chemi.org.ru/html/index59.php» target=»_blank»>http://chemi.org.ru/html/index59.php</a> <a rel=»nofollow» href=»http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/ELEKTROLITICHESKAYA_DISSOTSIATSIYA_ELEKTROLITI.html» target=»_blank»>http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/ELEKTROLITICHESKAYA_DISSOTSIATSIYA_ELEKTROLITI.html</a> Cd и h3SO4 K (-) H+ 2h3O +2e —> h3+2OH A(+) Cd, SO4 Cd0(cтепень) — 2e—> Cd 2+
Во-первых не электрическая, а электролитическая, то есть процесс распада электролита на ионы при растворении его в воде или при плавлении. Лучше бы видеть пример задачи.. . Но несколько общих понятий: Диссоциация на ионы происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость. Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества) , когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы. Например: HCl + h3O <—> h4O(+) + Cl(-) Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 80-х гг. XIX в. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа: Константа диссоциации Kd определяется активностями катионов, анионов и недиссоциированных молекул следующим образом: Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения: где f+/- — средний коэффициент активности электролита. <img src=»//content.foto.my.mail.ru/mail/irfedotev/_answers/i-141.jpg» ><img src=»//content.foto.my.mail.ru/mail/irfedotev/_answers/i-142.jpg» ><img src=»//content.foto.my.mail.ru/mail/irfedotev/_answers/i-143.jpg» >