Учебно-методический материал по химии (8 класс) на тему: ОВР
Муниципальное образовательное учреждение
«Средняя общеобразовательная школа № 1 г.Пугачева Саратовской области им.Т.Г.Мазура»
Урок по химии
«Окислительно-восстановительные реакции»
8 класс
г.Пугачев
Тема урока: Окислительно-восстановительные реакции (ОВР).
Цели урока:
Обучающие:
- Рассмотреть сущность окислительно-восстановительных процессов , научить применять «степени окисления» для определения процессов окисления и восстановления.
- научить учащихся уравнивать записи окислительно-восстановительные реакции методом электронного баланса.
Развивающие:
- Совершенствовать умения высказывать суждение о типе химической реакции, анализируя степень окисления атомов в веществах;
- делать выводы, работать с алгоритмами, формировать интерес к предмету.
Воспитательные:
- Формировать научное мировоззрение учащихся; совершенствовать трудовые навыки;
- научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, оценивать себя и других, вести беседу.
Тип урока: Урок изучения нового материала.
Вид урока: Урок – исследование.
Понятия, вновь вводимые на уроке: окислительно-восстановительные реакции; окислитель; восстановитель; процесс окисления; процесс восстановления.
Педагогические технологии: Технология интенсификации обучения на основе схемных и знаковых моделей учебного материала. В. Ф. Шаталов, игровые технологии. Селевко С.А, технология проблемного обучения (Дж. Дьюи, И. Лернер).
Оборудование и реактивы: соляная кислота, серная кислота, цинк в гранулах, магниевая стружка, раствор сульфата меди, железный гвоздь.
Ход урока
Кто-то теряет, а кто-то находит…
- Организационный момент. Актуализация опорных знаний:
Играет музыка. Слова из песни Эдиты Пьехи –«Кто-то теряет, а кто-то находит…».
Учитель говорит: «Запомните эти слова. В конце урока мы вернемся к ним». А сейчас – ваши версии . Что это означает. Учащиеся высказывают свои предположения.
2. Понятие об окислительно-восстановительных реакциях
Давайте вспомним классификацию химических реакций, которая вам известна.
- По числу и составу реагентов и продуктов,
- По тепловому эффекту,
- По направлению,
- Участию катализатора.
Есть еще одна классификация, основанная на изменении или сохранении степеней окисления атомов химических элементов, образующих реагенты и продукты реакции. По этому признаку различают реакции
Химические реакции
Реакции, протекающие с изменением реакции, протекающие без изменения степени
степени окисления элементов, образую- окисления
щихся вещества, участвующих в реакции (ОВР)
Учитель просит учащихся вспомнить,
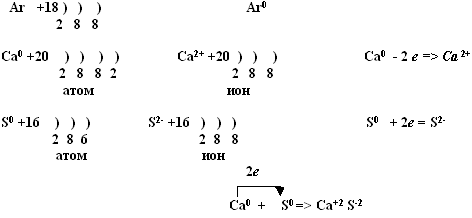
Что называется степенью окисления (с.о.) и как она рассчитывается по формулам соединений?
Степенью окисления называется условный заряд атомов в химическом соединении, вычисленный исходя из предположения, что это соединение состоит из простых ионов.
Для того, чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:
- Степень окисления кислорода почти всегда равна -2.
- Степень окисления водорода почти всегда равна +1.
- Степень окисления металлов всегда положительна и в максимальном значении почти всегда равна номеру группы.
- Степень окисления свободных атомов и атомов в простых веществах всегда равна 0.
- Суммарная степень окисления атомов всех элементов в соединении равна 0.
Здесь учитель предлагает ученикам устно посчитать — найти степень окисления элементов.
Какая будет степень окисления серы и фосфора
В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0.
h3+1SxO4-2 Н3РО4
(+1) . 2 +X + (-2) . 4 = 0
X = +6
h3+1S+6O4-2
Какие типы химических реакций вы знаете?
Учащиеся отвечают.
К ОВР относятся все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
Дать определение ОВР.
ОВР – это реакции, в ходе которых меняются степени окисления.
И еще одно определение. «Химические реакции, которые протекают с изменением степеней окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными».
Почему эти реакции так называются?
Рассмотрим примеры таких химических реакций.
В качестве примеров ОВР учитель демонстрирует следующий опыт.
h3SO4 + Mg =MgSO4+h3
Обозначим степень окисления всех элементов в формулах веществ – реагентов и продуктов этой реакции:
Как видно из уравнения реакции, атомы двух элементов магния и водорода, изменили свои степени окисления.
Что с ними произошло?
Магний из нейтрального атома превратился в условный ион в степени окисления +2, то есть отдал 2е:
Mg 0 – 2е Mg +2
Запишите в свой конспект:
Элементы или вещества, отдающие электроны называются восстановителями; в ходе реакции они окисляются.
Условный ион Н в степени окисления +1 превратился в нейтральный атом, то есть каждый атом водорода получил по одному электрону.
2Н+1 +2е Н2
Элементы или вещества, принимающие электроны, называются окислителями; в ходе реакции они восстанавливаются.
Эти процессы можно представить в виде схемы:
Соляная кислота + магний сульфат магния + водород
CuSO4 +Fe (железный гвоздь) = Fe SO4 +Cu (красивый красный гвоздь)
Fe 0 – 2е Fe +2
Cu+2 +2е Cu0
Кто-то теряет, а кто-то находит…
Процесс отдачи электронов называется окислением, а принятия – восстановлением.
В процессе окисления степень окисления повышается, в процессе восстановления – понижается.
Эти процессы неразрывно связаны между собой.
3. Метод электронного баланса как способ составления уравнений ОВР
Далее рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. Затем расставляются коэффициенты. В основе метода электронного баланса лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
После объяснения учащиеся под руководством учителя составляют уравнения ОВР по планам, которые составил учитель к этому уроку (см. Приложение). Планы находятся у каждого ученика на парте.
Учитель: Среди изученных нами реакций к окислительно – восстановительным реакциям относятся:
- Взаимодействие металлов с неметаллами.
2Mg + O2 =2MgO
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль O2 +4e —2O-2 1 восстановление
2. Взаимодействие металлов с кислотой.
h3SO4 + Mg =MgSO4+h3
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль 2O-2 +4e — O20 1 восстановление
3. Взаимодействие металлов с солью.
CuSO4 + Mg =MgSO4+Cu
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль Cu+2 +2e — Cu0 1 восстановление
Диктуется реакция, один учащийся самостоятельно составляет схему реакции у доски:
h3 + O2 → h3O
Определим, атомы каких элементов изменяют степень окисления.
( h3° + O2° → h3 O2).
Составим электронные уравнения процессов окисления и восстановления.
(h3° -2e → 2H+ – процесс окисления,
O2° +4e → 2O-² — процесс восстановления,
Н2 – восстановитель, О2 — окислитель)
Подберём общее делимое для отданных и принятых е и коэффициенты для электронных уравнений.
(∙2| Н2°-2е → 2Н+ — процесс окисления, элемент – восстановитель;
∙1| O2° +4e → 2O-² — процесс восстановления, элемент – окислитель).
Перенесём эти коэффициенты в уравнение ОВР и подберём коэффициенты перед формулами других веществ.
2h3 + O2 → 2h3O.
План составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать коэффициенты перед формулами других веществ.
Упражнения для закрепления материала
- Процесс отдачи электронов – это … (процесс окисления).
- Атомы, ионы или молекулы, принимающие электроны, — это… (окислители).
- Процесс принятия электронов – это … (процесс восстановления).
- Алюминий в реакции
3h3SO4 + 2Al = Al2(SO4)3 + 3h3↑
является … (восстановителем).
- Хлор в реакции
2Fe + 3Cl2 = 2FeCl3
является… (окислителем).
Схема
Степени окисления атомов и процессы окисления-восстановления
— отдача электронов, окисление
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
— присоединение электронов, восстановление
Игра «Найди пару»
Даны химические реакции: на одной половине – исходные вещества, а на другой – продукты реакции. Необходимо найти правильную половинку для каждой из предложенных реакций, затем определить, к какому типу эта реакция относится. Если ОВР, то необходимо расставить коэффициенты в реакциях методом электронного баланса. (Работа в парах).
1 | KOH + HCl | ? | 1 | h3SO3 |
2 | CaCO3 | 2 | KCl + h3O | |
3 | Н2 + О2 | 3 | Al 2O 3 | |
4 | Al + O2 | 4 | CaO+ CO2 | |
5 | SO2+h3O | 5 | h3O |
Подведение итогов работы с карточкой. Проверка выполненных заданий. Формулировка выводов.
Делаем вывод: «В чем же заключается суть ОВР?»
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов: окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
В тетрадях запишите вывод: весь окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции, в основном окислительно-восстановительные.
Домашнее задание.
§ 43, упр.1, 3, 7, выписать типичные окислители и восстановители (стр.234-235).
Приложение 1.
План составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать коэффициенты перед формулами других веществ.
Схема
Степени окисления атомов и процессы окисления-восстановления
— отдача электронов, окисление
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
— присоединение электронов, восстановление
Приложение 2.
Игра «Найди пару»
Даны химические реакции: на одной половине – исходные вещества, а на другой – продукты реакции. Необходимо найти правильную половинку для каждой из предложенных реакций, затем определить, к какому типу эта реакция относится. Если ОВР, то необходимо расставить коэффициенты в реакциях методом электронного баланса. (Работа в парах).
1 | KOH + HCl | ? | 1 | h3SO3 |
2 | CaCO3 | 2 | KCl + h3O | |
3 | Н2 + О2 | 3 | Al 2O 3 | |
4 | Al + O2 | 4 | CaO+ CO2 | |
5 | SO2+h3O | 5 | h3O |
Урок по химии «Окислительно-восстановительные реакции»
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа №2»
г.Енисейска Красноярского края
Методическая разработка
урока химии в 11 классе
в контексте подготовки к ЕГЭ
по теме
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»
Выполнила:
учитель химии и биологии
первой категории
Боярченко Мария Владимировна
2016 год
Цель: актуализировать, систематизировать и углубить знания учащихся об окислительно–восстановительных реакциях.
Задачи:
— повторить понятия степени окисления;
—
— совершенствовать умение учащихся расставлять коэффициенты в уравнениях реакций методом электронного баланса;
-рассмотреть классификацию окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные, дисмутации;
— совершенствовать практические навыки при выполнении лабораторных опытов;
— познакомить учащихся с заданиями ЕГЭ (4,28,36).
Тип урока: комбинированный.
Оборудование и реактивы: растворы KMnO4, H2SO4, Na2SO3, КOH(конц). Пробирки лабораторные,штатив для пробирок, спиртовка, держатель, лучина, ПСХЭ Д.И.Менделеева, проектор, ноутбук.
План урока.
Организационный момент
Актуализация знаний
Повторение и обобщение изученного ранее материала.
Объяснение новой темы.
Закрепление.
Домашнее задание.
Форма организации работы с учащимися: фронтальная, индивидуальная
Методы обучения:
Словесный (рассказ, беседа, дискуссия)
Практический (лабораторные опыты)
Наглядный (иллюстративный (работа с ПСХЭ), демонстрационный)
Ход урока
Организационный момент (cообщение темы, постановка цели и задач урока)
Актуализация
Окислительно-восстановительные реакции чрезвычайно распространены. Окислительно-восстановительные реакции сопровождают многие процессы, осуществляемые в промышленности и в различных сферах быта: горение газа в газовой плите, приготовление пищи, стирка, чистка предметов домашнего обихода, изготовление обуви, парфюмерных, текстильных изделий. Зажигаем ли мы спичку, горят ли в небе причудливые фейерверки – все это окислительно-восстановительные процессы.
Таким образом, тема урока «Окислительно-восстановительные реакции» интересна своей практической направленностью. И является важным компонентом знаний выпускников средних школ, проверяемых заданиями теста ЕГЭ.
Повторение и обобщение изученного ранее материала
Учитель проецирует на экран демонстрационный вариант ЕГЭ по химии 2016 года. И организует беседу, направленную на актуализацию важнейших опорных знаний о степени окисления, понятий теории ОВР.
4. Степень окисления +7 хлор имеет в соединении
1) Ca(ClO2)2 2) HClO3 3) NH4Cl 4) HClO4
— Что такое степень окисления?
Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. (Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.)
— Вспомните алгоритм определения степени окисления химического элемента в неорганических соединениях.
(на примере выполнение задания 4 учащиеся вспоминают правила определения степени окисления элемента в неорганических соединениях)
Затем для закрепления умения определять степень окисления элементов по формулам соединений, учитель организует самостоятельную работу.
Самостоятельная работа (письменная работа, 1 ученик выполняет задание у доски)
Задание 1. Определите степени окисления элементов в заданных формулах бинарных соединений. Назовите вещества, формулы которых: P2O5,MnCl2, NO 2, Al2O3,H2S, H2O2, SiH4, Ca3P2, FeCl3, SO2, KBr, NO, P2S3, AlH3, CO2.
Задание 2
Определите степени окисления элементов в соединениях, формулы которых: NH4Cl, K2Cr2O7, Fe(OH)2, KMnO4, Al2(SO4)3 , K2CrO4, KClO3, H3PO3, CH3NH2, NaNO2, Ca(HCO3)2, HClO4, H2SO4, NaHS, Al(OH)2NO3.
Учитель напоминает, что в сложном ионе алгебраическая сумма степеней окисления атомов равна заряду иона, и предлагает учащимся выполнить следующее задание.
Задание 3.
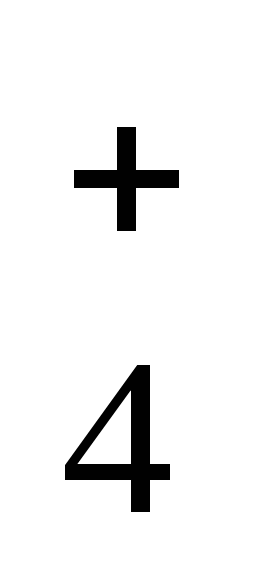 , H3O+, ClO3—, CrO
, H3O+, ClO3—, CrO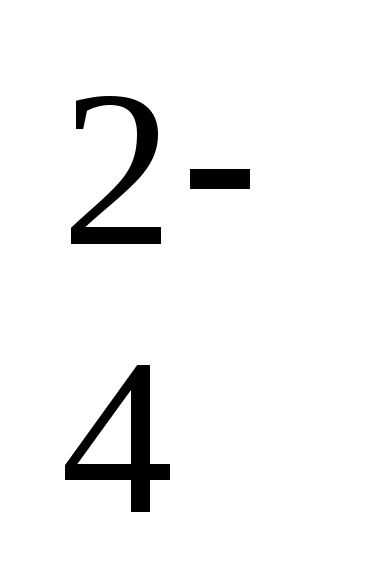 , AsO
, AsO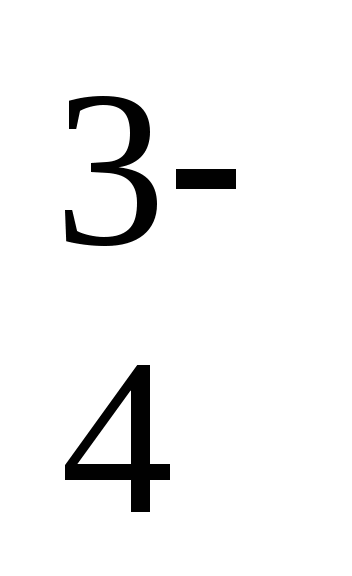 ,Cr2O
,Cr2O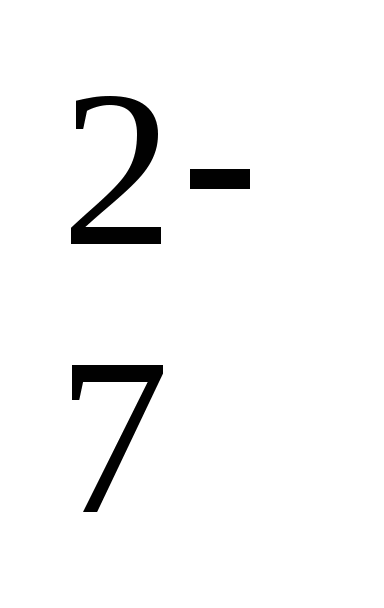 , OH—, SO42-
, OH—, SO42-28. Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в ходе которой это изменение происходит
СХЕМА ИЗМЕНЕНИЯ
СТЕПЕНИ ОКИСЛЕНИЯ УРАВНЕНИЕ РЕАКЦИИ
А) P-3 → P+5 1) Ca2Si+6H2O →2Ca(OH)2+ SiO2 +4H2
Б) Si+4 → Si0 2) SiO2 +4HF → SiF4 + 2H2O
В) P0 → P+5 3) PH3+ 2O2 → H3PO4
Г) Si-4 → Si+4 4) SiO2 +2C → Si + 2CO
5) 5HNO3 + P → H3PO4 + 5NO + H2O
28. Установите соответствие между уравнением реакции и формулой вещества,являющегося восстановителем в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) H 2 S + I 2 =S + 2HI 1) NO 2
Б) S + 2HI=I 2 + H 2 S 2) HI
В) 2SO 3 + 2KI=I 2 + SO 2 + K 2 SO 4 3) S
Г) S + 3NO 2 =SO 3 + 3NO 2) H 2 S 4) KI
6) H2S
— Определите понятие «окислитель».
Окислитель – частица, принимающая электроны.
— Определите понятие «восстановитель».
Восстановитель – частица, отдающая электроны.
— Что называется процессом восстановления? Как изменяется степень окисления элемента при восстановлении?
Восстановление – процесс принятия электронов, при этом степень окисления элемента понижается.
— Что называется процессом окисления? Как изменяется степень окисления элемента при окислении?
Окисление — процесс отдачи электронов, при этом степень окисления элемента повышается.
Задание 4 .
(Учащиеся выполняют задание по вариантам, после выполнения – самопроверка с ответами, показанными учителем на экране).
Какие из перечисленных ниже процессов представляют собой: окисление (О), какие – восстановление (В)? Определите число отданных или принятых электронов.
Вариант I Вариант II Вариант III Вариант IV
Cl
 2Cl-1 1. Se0→Se-2 1. 2H+1→H
2Cl-1 1. Se0→Se-2 1. 2H+1→H 1. Fe0→ Fe+3
1. Fe0→ Fe+3S-2 → S0 2. Cu+2 → Cu0 2. Fe0→ Fe+2 2. N+5 → N+3
Cs0 → Cs+1 3. Cr0 → Cr+3
Sn+2 → Sn+4 4. H
 → 2H+1 4. S+4 → S0 4. Cu+2 → Cu0
→ 2H+1 4. S+4 → S0 4. Cu+2 → Cu0 Fe+3→ Fe+2 5. 2O-2 → O
 5. S+4 → S+6 5. Sn+4 → Sn+2
5. S+4 → S+6 5. Sn+4 → Sn+2Ni0 → Ni+2 6. Cr+6 → Cr+3 6. S0 → S+4 6. H
 → 2H+1
→ 2H+1
В результате выполнения этой работы учитель предлагает учащимся сформулировать
Правила определения функции соединения в ОВР (записывают в тетрадь).
Если элемент проявляет в соединении высшую степень окисления, то это соединение может быть окислителем.
Если элемент проявляет в соединении низшую степень окисления, то это соединение может быть восстановителем.
Если элемент проявляет в соединении промежуточную степень окисления, то это соединение может быть как восстановителем, так и окислителем.
Задание 5.
Предскажите функции веществ в окислительно-восстановительных реакциях: H2SO4, SO2, S, H2S.
Ответ.
H2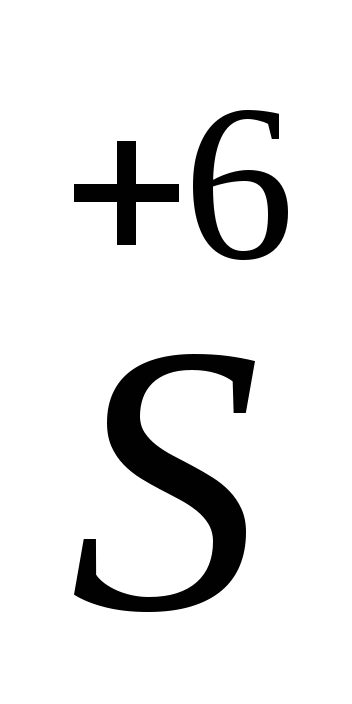 O4 – окислитель, так как элемент сера проявляет в данном соединении высшую степень окисления (+6).
O4 – окислитель, так как элемент сера проявляет в данном соединении высшую степень окисления (+6).
H2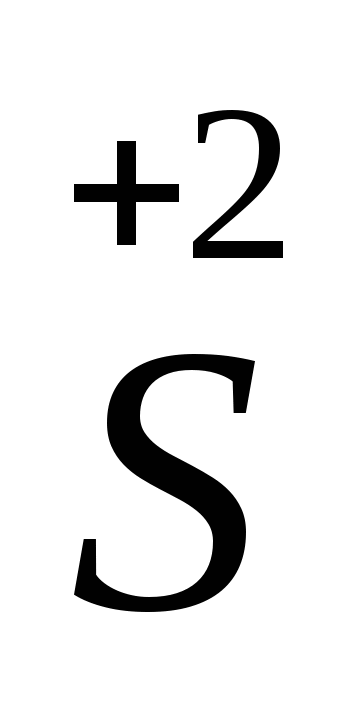 — восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
— восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
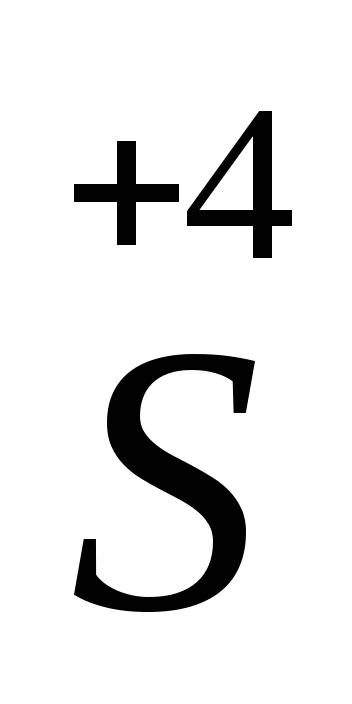 O2,
O2, 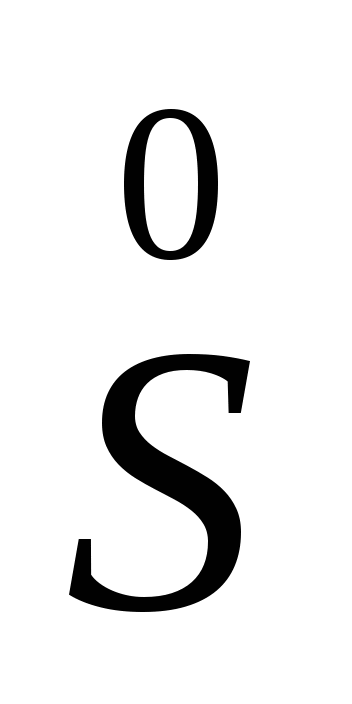 — окислитель и восстановитель, так как элемент сера проявляет в данном соединении промежуточную степень окисления
— окислитель и восстановитель, так как элемент сера проявляет в данном соединении промежуточную степень окисления
Углубление и расширение знаний.
Учитель знакомит учащихся с некоторыми важнейшими восстановителями и окислителями, предлагает провести лабораторный опыт, предварительно вспомнив правила техники безопасности).
Важнейшие восстановители: HCl; HBr; NH3; H2S; MnSO4; из простых веществ – С, Н2, металлы.
Важнейшие окислители: H2SO4; HNO3; KMnO4; K2MnO4; HClO4; K2Cr2O7; K2CrO4 и др.; некоторые простые вещества O2; F2; Cl2; Br2;S
Лабораторный опыт (инструкция для учащихся)
Опыт 1. Налейте в пробирку немного раствора KMnO4, добавьте к нему концентрированный раствор щелочи, затем раствор сульфита натрия и взболтайте. Что наблюдаете? Обратите внимание на изменение цвета раствора. Составьте схему проведенной реакции.
KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O
Учитель:
— Как уравнять данную реакцию? Как называются реакции, в которых степень окисления элементов изменяется?
— Окислительно-восстановительные реакции.
(Учитель демонстрирует на экран задание С1 и предлагает учащимся сравнить его со схемой составленной ими реакции)
36. Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + … + KOH → K2MnO4 + … + H2O
Определите окислитель и восстановитель.
Учитель:
— в отличие от заданий базового и повышенного уровня (частей А и В), выполнение которых основано на умении определять степени окисления элементов и знании ОВР, в заданиях высокого уровня (задание 36) предлагается составить достаточно сложное уравнение ОВР методом электронного баланса.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Учитель:
— Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции и на балансировании числа электронов, смещенных от восстановителя к окислителю. Применяется метод для составления уравнений реакций, протекающих в любых фазах. В этом универсальность и удобство метода.
Учитель предлагает учащимся рассмотреть алгоритм составления уравнений ОВР методом электронного баланса (приложение 1).
Учащиеся уравнивают схему реакции
2K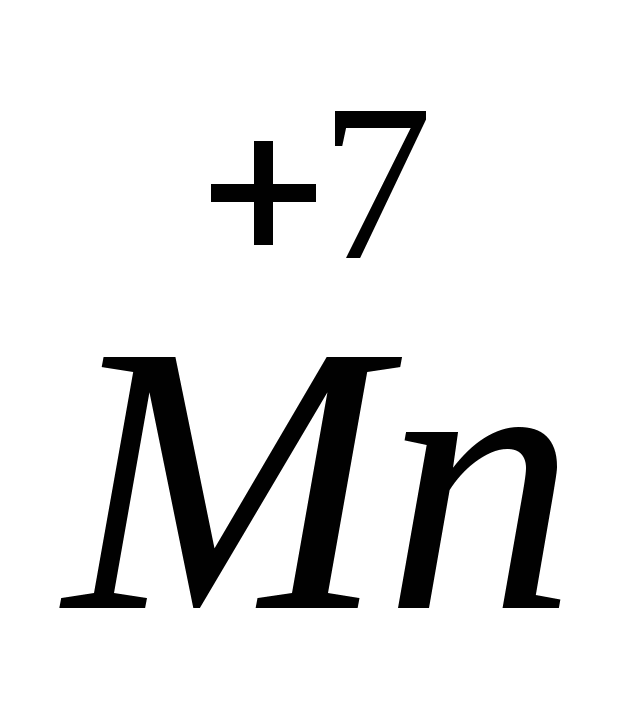 O4 + 2KOH + Na2
O4 + 2KOH + Na2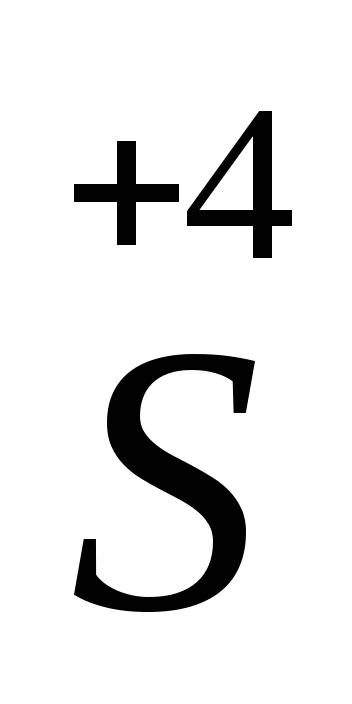 O3 → 2K2
O3 → 2K2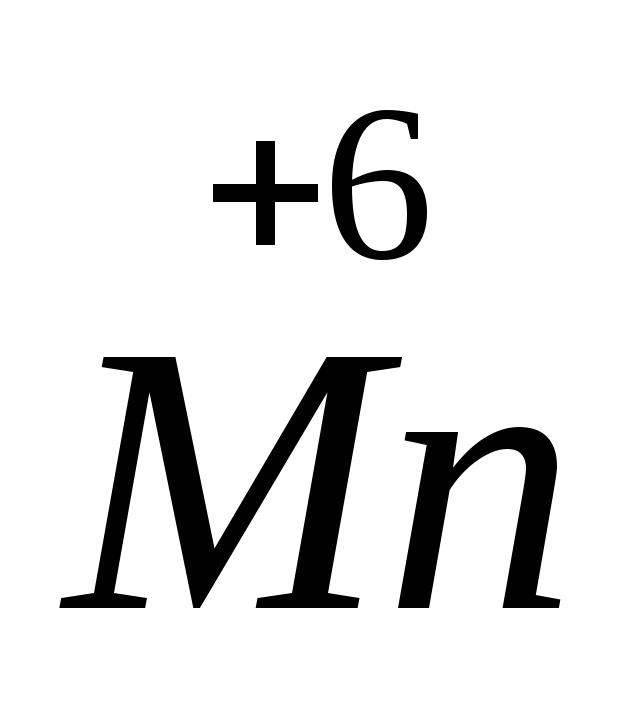 O4 + Na2
O4 + Na2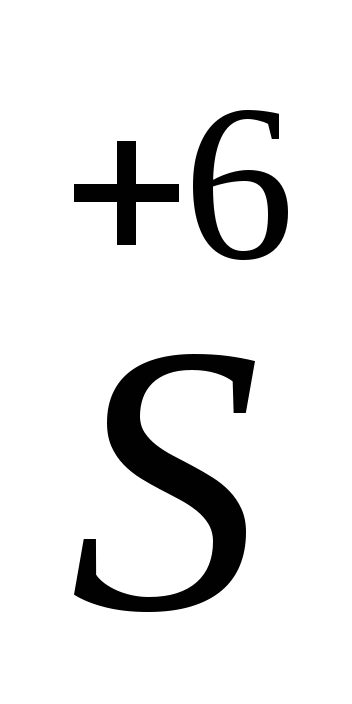 O4 + H2O
O4 + H2O

 Mn+7 + 1
Mn+7 + 1 → Mn+6 2 вос-ся, ок-тель
→ Mn+6 2 вос-ся, ок-тель
2
S+4 — 2  → S+6 1 ок-ся, вос-тель
→ S+6 1 ок-ся, вос-тель
и выполняют следующий лабораторный опыт.
Лабораторный опыт (инструкция для учащихся)
Опыт 2. К 1-2 мл раствора KMnO4 добавьте воду и затем раствор сульфита натрия. Что наблюдаете? Как изменился цвет раствора? Составьте уравнение реакции методом электронного баланса.
2K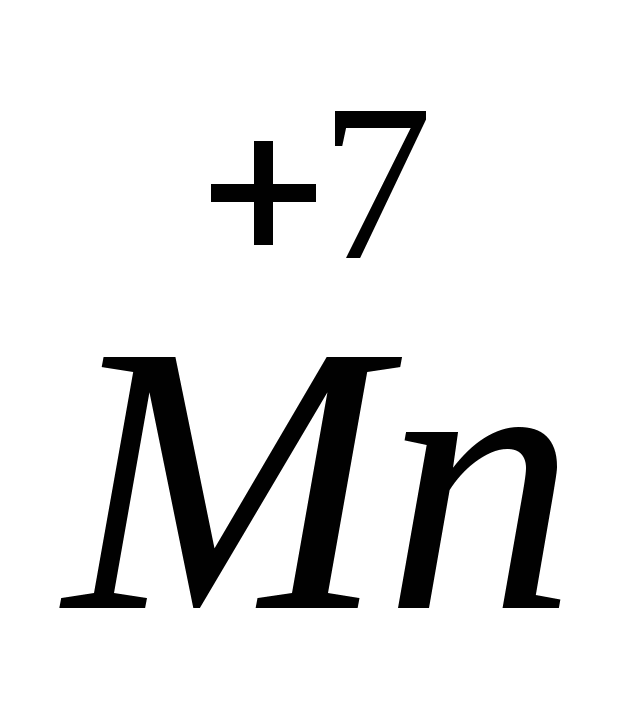 O4 + H2О + 3Na2
O4 + H2О + 3Na2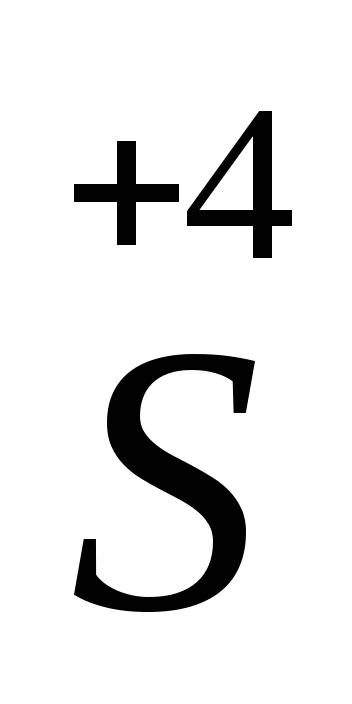 O3 → 2
O3 → 2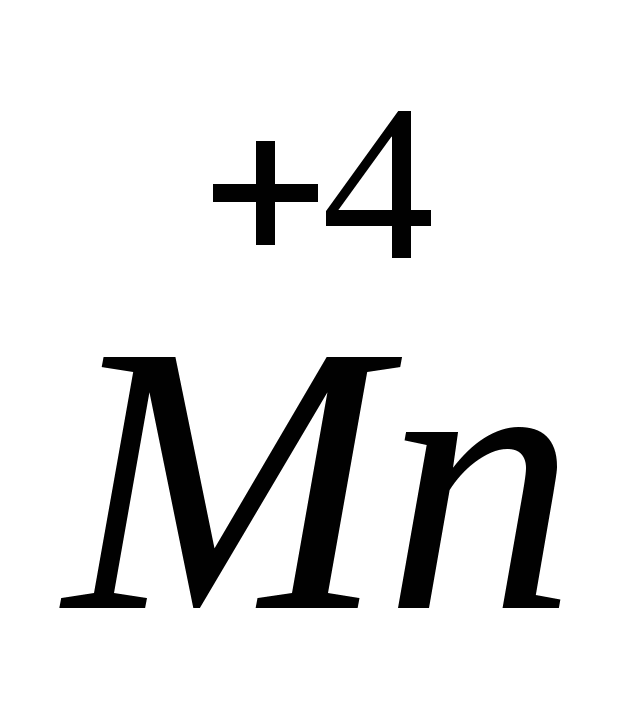 O2↓+ 3Na2
O2↓+ 3Na2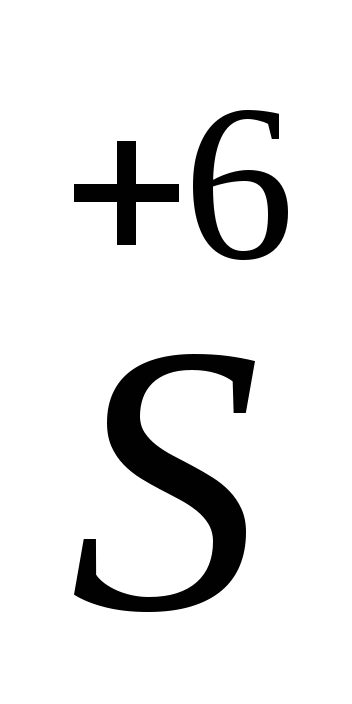 O4 + 2КОH
O4 + 2КОH

 Mn+7 + 3
Mn+7 + 3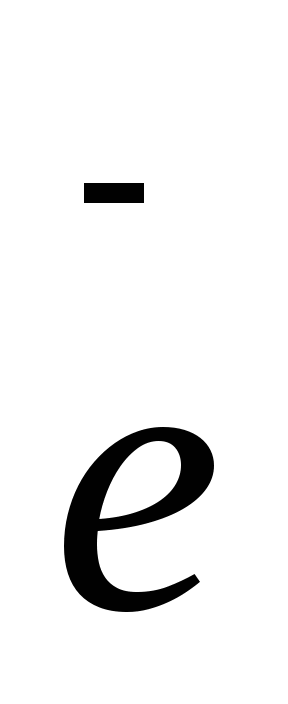 → Mn+4 2 вос-ся, ок-тель
→ Mn+4 2 вос-ся, ок-тель
6
S+4 — 2 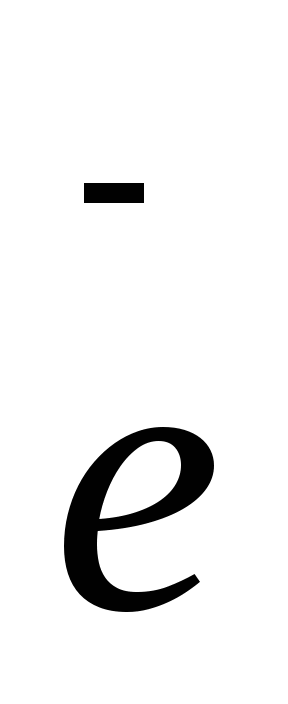 → S+6 3 ок-ся, вос-тель
→ S+6 3 ок-ся, вос-тель
Опыт 3. К 1-2 мл раствора KMnO4 добавьте несколько капель серной кислоты, затем осторожно взбалтывая раствор сульфита натрия. Что наблюдаете? Обратите внимание на изменение цвета раствора. Составьте уравнение реакции методом электронного баланса.
2K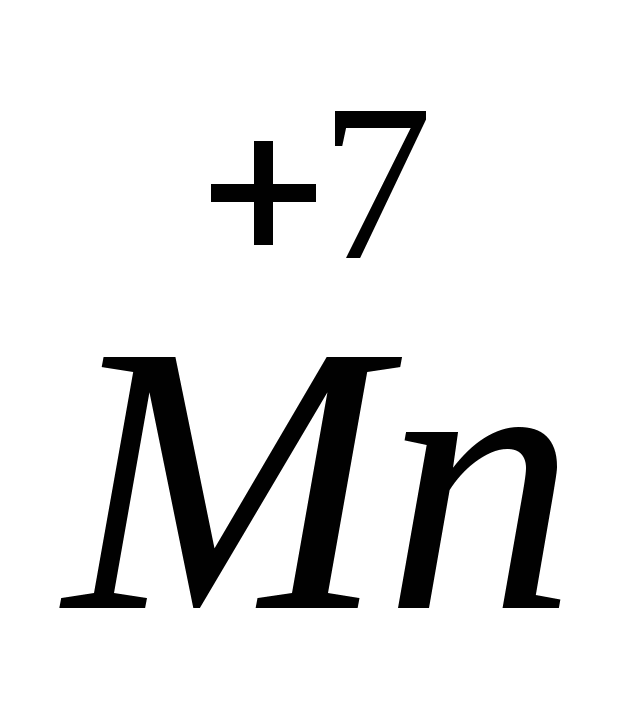 O4 + 3H2SO4 + 5Na2
O4 + 3H2SO4 + 5Na2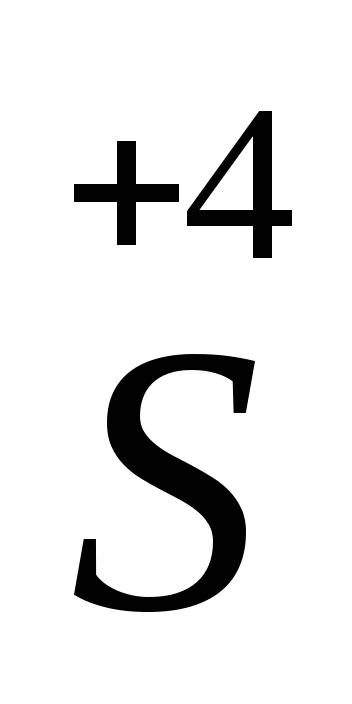 O3 → 2
O3 → 2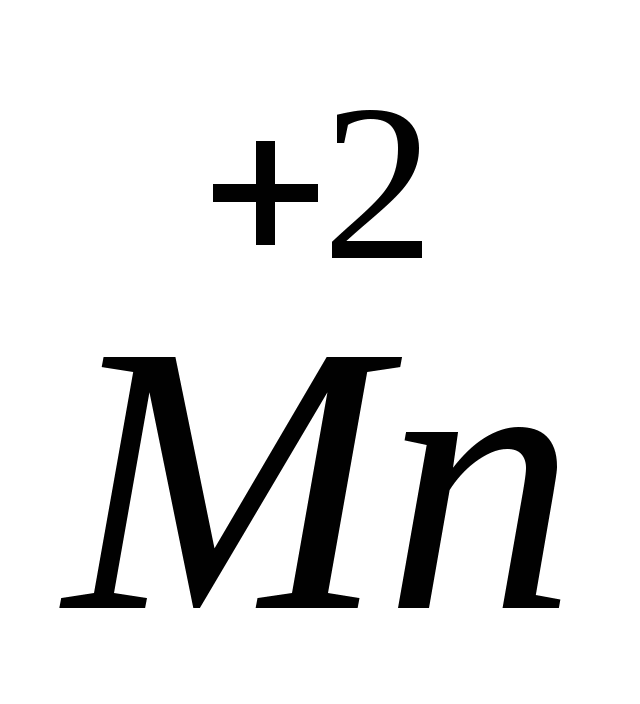 SO4 + 5Na2
SO4 + 5Na2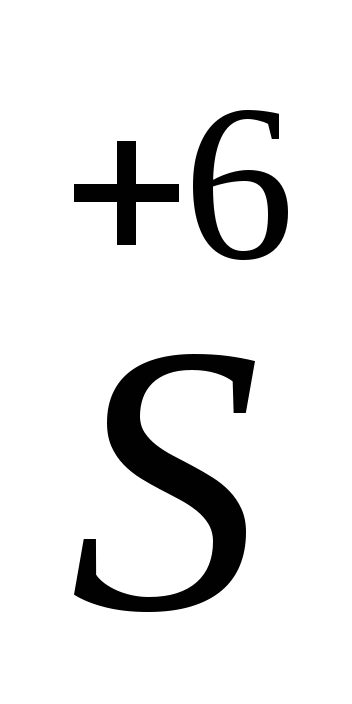 O4 + К2SO4 + 3H2O
O4 + К2SO4 + 3H2O

 Mn+7 + 5
Mn+7 + 5 → Mn+2 2 вос-ся, ок-тель
→ Mn+2 2 вос-ся, ок-тель
10
S+4 — 2  → S+6 5 ок-ся, вос-тель
→ S+6 5 ок-ся, вос-тель
Также для уверенного составления уравнений ОВР необходимо знать их классификацию. Различают три типа окислительно-восстановительных реакций.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции


межмолекулярные внутримолекулярные реакции
реакции реакции диспропорционирования
Межмолекулярные ОВР – это такие реакции, в которых обмен электронами происходит между различными атомами, молекулами, ионами (окислитель и восстановитель находятся в разных молекулах, частицах).
C0 + O = C+4O
= C+4O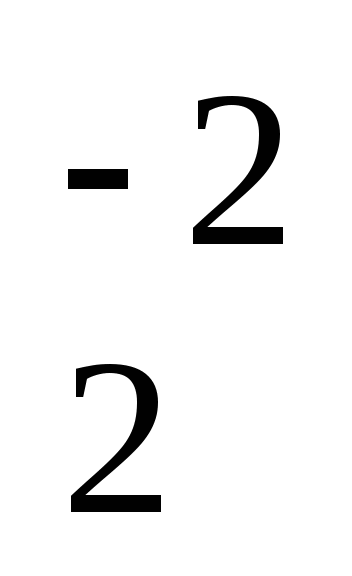 Cl
Cl + 2KBr— = Br
+ 2KBr— = Br + 2KCl—
+ 2KCl—
C0 – восстановитель; O — окислитель Cl
— окислитель Cl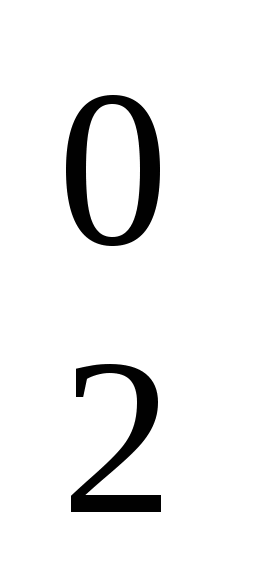 — окислитель; Br—– восстановитель
— окислитель; Br—– восстановитель
Внутримолекулярные ОВР – реакции, в которых окислитель и восстановитель находятся в одном и том же веществе (молекуле, частице).
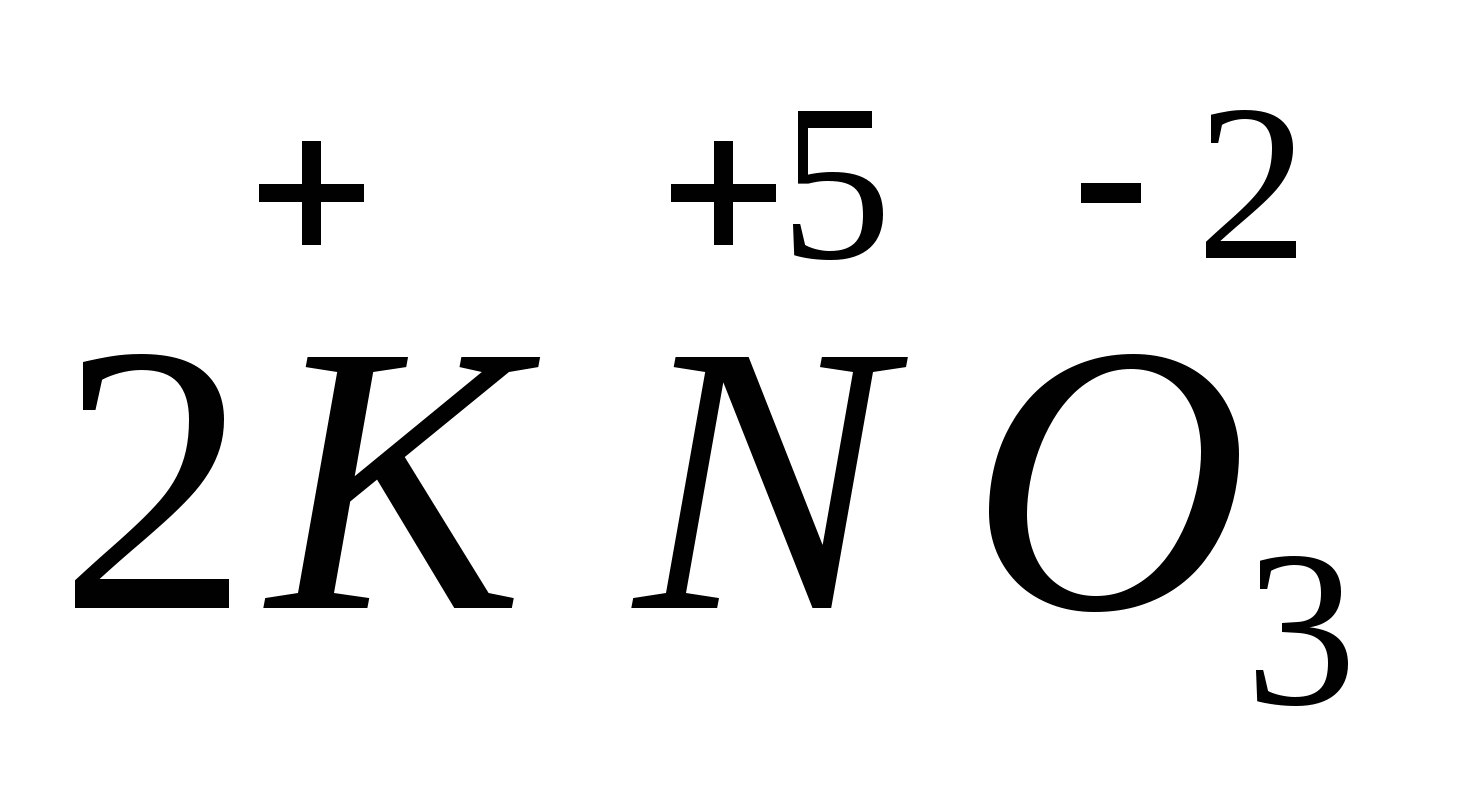 = O
= O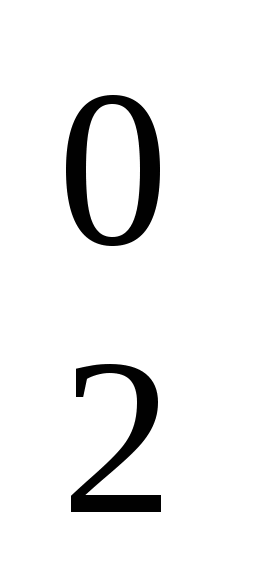 ↑ +
↑ + 
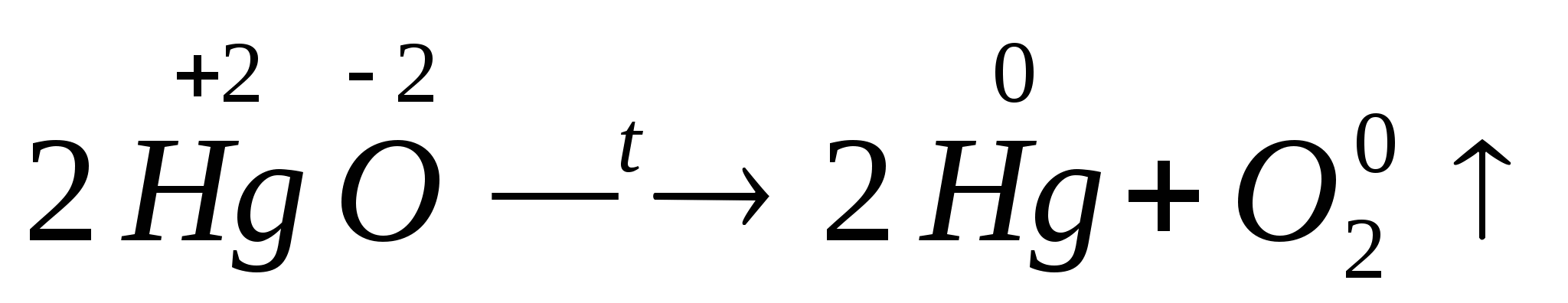
N+5— окислитель; O-2 – восстановитель Hg+2— окислитель; O-2 – восстановитель
Реакции диспропорционирования – реакции, где молекулы или ионы одного и того же вещества реагируют друг с другом как восстановитель и окислитель, вследствие того что содержащиеся в них атомы с переменными (промежуточными) степенями окисления отдаю и принимают электроны переходя в состояния – один с низшей с.о., другой с высшей с.о.
Легкость реакции диспропорционирования связана с близостью внешнего энергетического уровня в состоянии атома.
Сl2 + 2KOH → KCl + KClO + h3O. 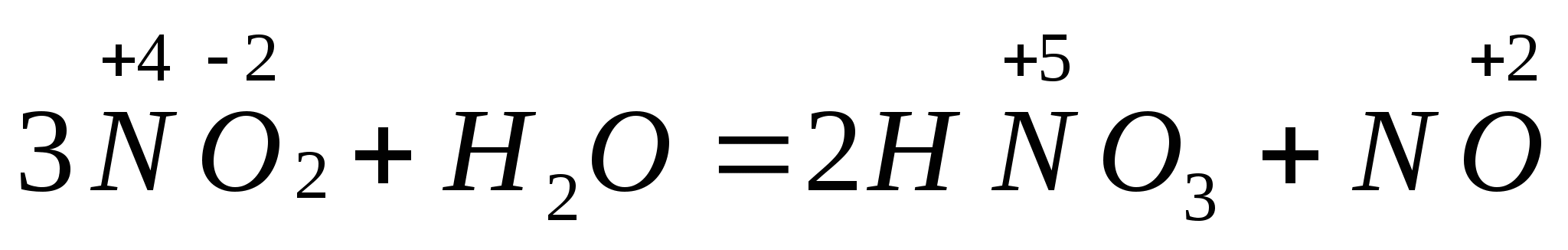
Cl20— окислитель, восстановитель 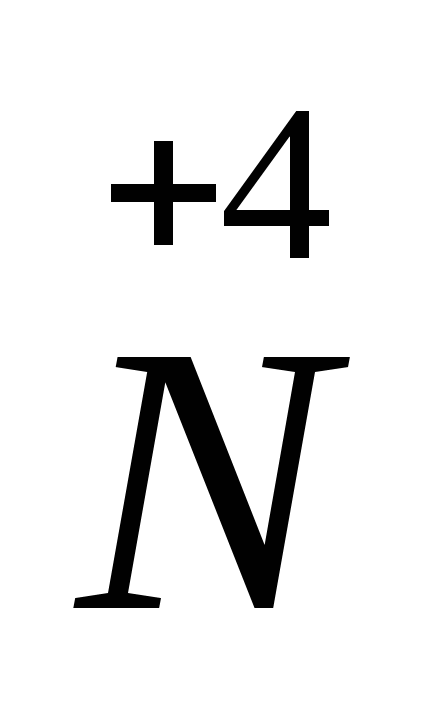 — окислитель, восстановитель
— окислитель, восстановитель
Закрепление изученного материала.
Учащиеся предлагается выполнить задания, подобранные из контрольно-измерительных материалов ЕГЭ, открытого банка заданий ЕГЭ.
1. Только окислительные свойства способен проявлять
1) кислород
2) фтор
3) хлор
4) азот
2. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
3. Сера является окислителем в реакции с
1) кислородом
2) металлами
3) хлором и фтором
4) азотной кислотой
4. Только восстановительные свойства проявляет
1) фосфор
2) бром
3) цинк
4) сера
5. В окислительно-восстановительной реакции Cu+HNO3(разб)→Cu(NO3)2+NO+H2O коэффициент перед окислителем
1) 8 2) 10 3) 6 4) 4
6. Окислительно-восстановительной не является реакция
1) 2Na + Cl2 = 2NaCl
2) 2NaCl + H2SO4 = Na2SO4
3) Zn + 2HCl = ZnCl2 + Н2
4) Н2C = O + 2Ag2O = 4Ag + CO2 + H2O
7. Азот является восстановителем в реакции
1) N2 + O2
2) N2 + H2
3) N2 + Mg
4) N2 + C
28. Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем.
УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ
А) H2S + I2 = S + 2HI 1) I2
Б) 2S + С = СS2 2) SO3
В) 2SO3 + 2KI = I2 + SO2 + K2SO4 3) S
Г) S + 3NO2 = SO3 + 3NO 4) HI
5) H2S
6) NO2
Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7 + … + H2SO4→ I2 + Cr2(SO4)3+ …+H2O
Определите окислитель и восстановитель.
(допущены ошибки при указании окислителя и восстановителя)
Домашнее задание. § 19; упр. 1-3, с. 161
Составить ОВР методом электронного баланса; для учащихся, выбравших ЕГЭ по химии — двумя методами:
KMnO4 + H2S + … → MnSO4 + Na2SO4 + …+ …+ S
Ответ:
а) электронный баланс:

 Mn+7 + 5
Mn+7 + 5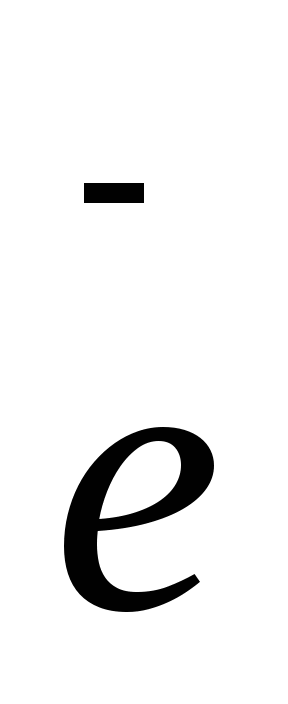 → Mn+2 2 вос-ся, ок-тель
→ Mn+2 2 вос-ся, ок-тель
10
S-2 — 2 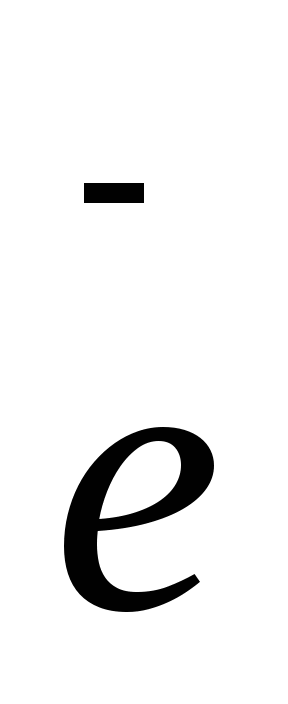 → S0 5 ок-ся, вос-тель
→ S0 5 ок-ся, вос-тель
2KMnO4 +5Na2S + 8H2SO4 → 2MnSO4 + 5Na2SO4 + К2SO4 + 8H2O+ 5S
ПРИЛОЖЕНИЕ.
Приложение 1.
Алгоритм составления уравнений окислительно-восстановительных реакций.
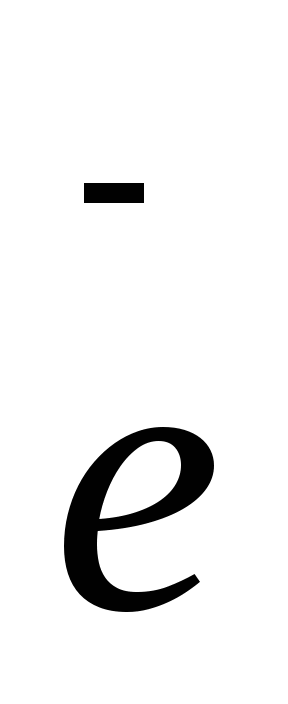 =
= 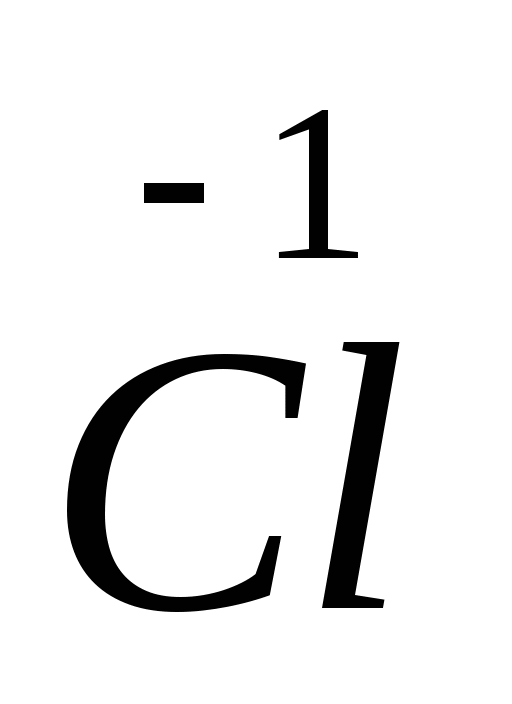
2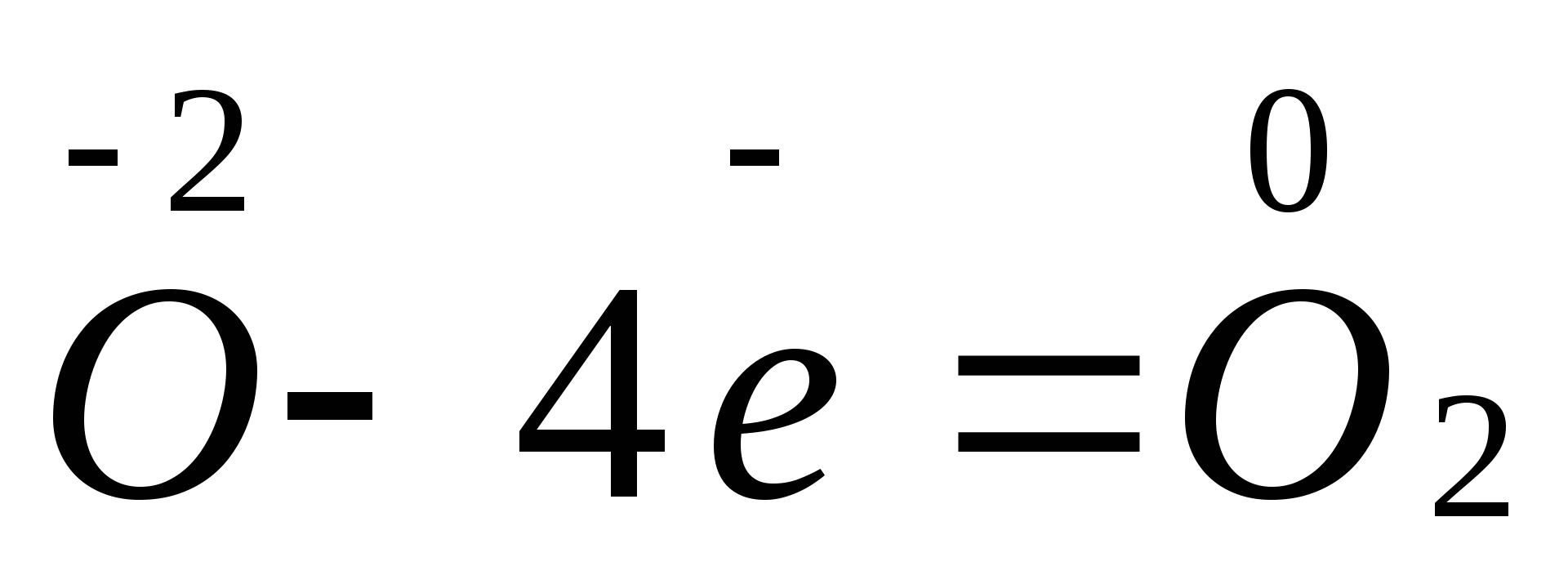
Найти наименьший общий множитель и определить коэффициенты перед окислителем и восстановителем
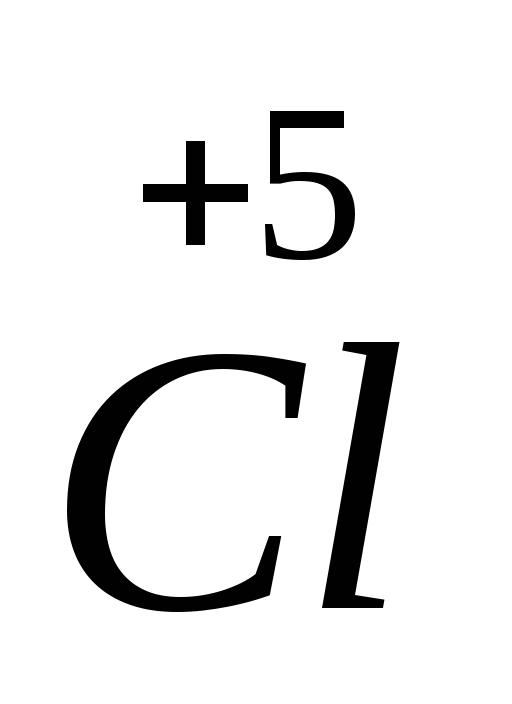

 + 6
+ 6 =
= 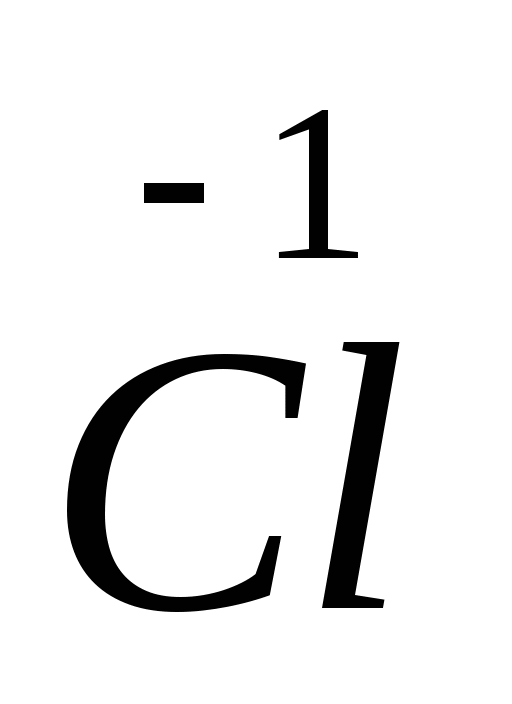 2 вос-ся, ок-ль
2 вос-ся, ок-ль
6
2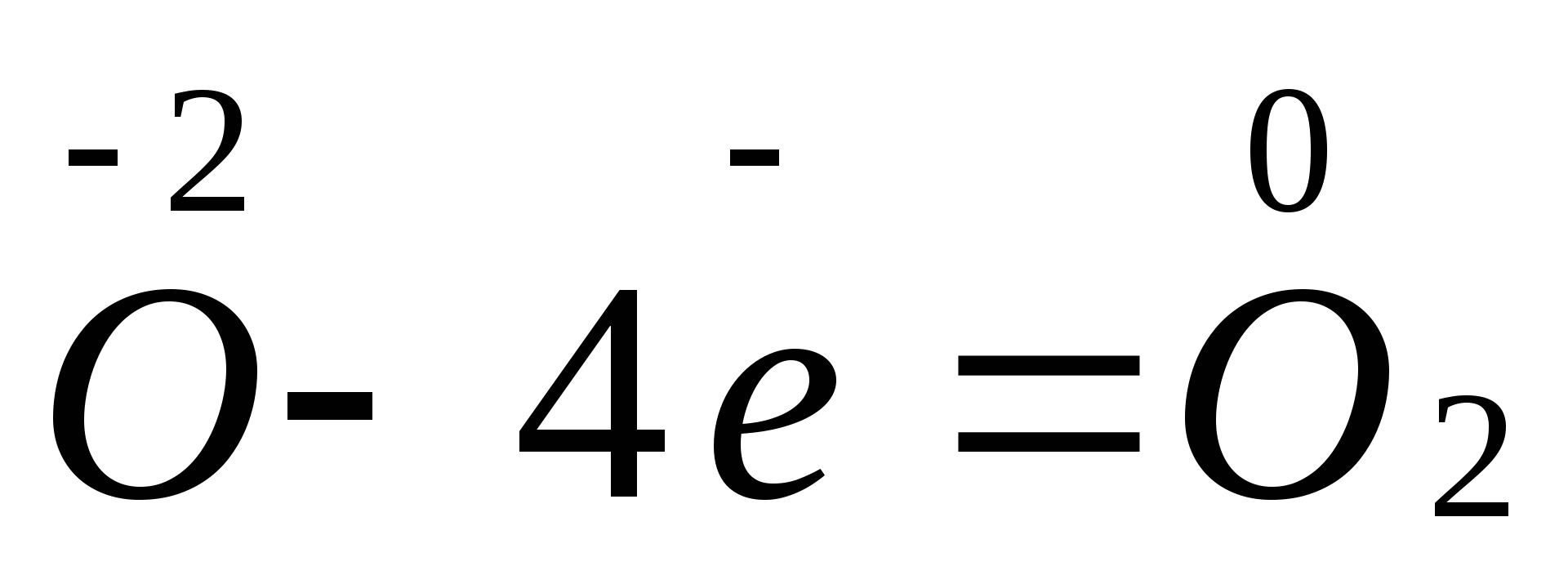 3 ок-ся, вос-тель
3 ок-ся, вос-тель
Расставить коэффициенты из электронного баланса.
2KClO3→2KCl + 3O2
Сравнением числа атомов каждого элемента в правой и левой части уравнения реакции определить и проставить недостающие коэффициенты.
Анализ проведенного урока.
В результате проведения данного урока удалось достичь поставленной цели. Урок построен на основе разбора заданий ЕГЭ по теме «Окислительно-восстановительные реакции». Во время занятия учащиеся повторили основные понятия об окислении и восстановлении, степени окисления, окислителях и восстановителях, совершенствовали умение составлять ОВР методом электронного баланса, познакомились c классификацией ОВР.
Урок получился достаточно насыщенным и объемным, как теоретическим материалом, так и практическим, с использование химического эксперимента.
Закрепление также было построено на примере заданий ЕГЭ, подобранных из контрольно-измерительных материалов ЕГЭ 2015 года и тренировочных вариантов 2016года, открытого банка заданий ЕГЭ.
Практически со всеми заданиями базового и повышенного уровня учащиеся справились успешно. Затруднения вызвали задания 36 с пропусками веществ. Считаю, что для отработки навыка составления уравнений ОВР с участием неорганических веществ, особенно электронно-ионным методом недостаточно 1-2 уроков. Поэтому задания подобного рода (высокого уровня) мы отрабатываем на факультативных занятиях дополнительно.
Конспект урока по химии на тему ;»Окислительно-восстановительные реакции»
Тема :»Окислительно-восстановительные реакции».
Цели урока:
Рассмотреть сущность окислительно-восстановительных процессов , научить применять «степени окисления» для определения процессов окисления и восстановления.
научить учащихся уравнивать записи окислительно-восстановительные реакции методом электронного баланса.
Совершенствовать умения высказывать суждение о типе химической реакции, анализируя степень окисления атомов в веществах;
делать выводы, работать с алгоритмами, формировать интерес к предмету.
Формировать научное мировоззрение учащихся; совершенствовать трудовые навыки;
научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, оценивать себя и других, вести беседу.
Оборудование и реактивы: соляная кислота, серная кислота, цинк в гранулах, магниевая стружка, раствор сульфата меди, железный гвоздь.
Ход урока
Организационный момент.
Понятие об окислительно-восстановительных реакциях
Давайте вспомним классификацию химических реакций, которая вам известна.
По числу и составу реагентов и продуктов,
По тепловому эффекту,
По направлению,
Участию катализатора.
Есть еще одна классификация, основанная на изменении или сохранении степеней окисления атомов химических элементов, образующих реагенты и продукты реакции. По этому признаку различают реакции
Химические реакции
Реакции, протекающие с изменением реакции, протекающие без изменения степени
степени окисления элементов, образую- окисления
щихся вещества, участвующих в реакции (ОВР)
Учитель просит учащихся вспомнить,
Что называется степенью окисления (с.о.) и как она рассчитывается по формулам соединений?
Степенью окисления называется условный заряд атомов в химическом соединении, вычисленный исходя из предположения, что это соединение состоит из простых ионов.
Для того, чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:
Степень окисления кислорода почти всегда равна -2.
Степень окисления водорода почти всегда равна +1.
Степень окисления металлов всегда положительна и в максимальном значении почти всегда равна номеру группы.
Степень окисления свободных атомов и атомов в простых веществах всегда равна 0.
Суммарная степень окисления атомов всех элементов в соединении равна 0.
Здесь учитель предлагает ученикам устно посчитать — найти степень окисления элементов.
Какая будет степень окисления серы и фосфора
В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0.
H2+1SxO4-2 Н3РО4
(+1) . 2 +X + (-2) . 4 = 0
X = +6
H2+1S+6O4-2
Какие типы химических реакций вы знаете?
Учащиеся отвечают.
К ОВР относятся все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество.
Дать определение ОВР.
ОВР – это реакции, в ходе которых меняются степени окисления.
И еще одно определение. «Химические реакции, которые протекают с изменением степеней окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными».
Почему эти реакции так называются?
Рассмотрим примеры таких химических реакций.
В качестве примеров ОВР учитель демонстрирует следующий опыт.
H2SO4 + Mg =MgSO4+H2
Обозначим степень окисления всех элементов в формулах веществ – реагентов и продуктов этой реакции:
Как видно из уравнения реакции, атомы двух элементов магния и водорода, изменили свои степени окисления.
Что с ними произошло?
Магний из нейтрального атома превратился в условный ион в степени окисления +2, то есть отдал 2е:
Mg 0 – 2е Mg +2
Запишите в свой конспект:
Элементы или вещества, отдающие электроны называются восстановителями; в ходе реакции они окисляются.
Условный ион Н в степени окисления +1 превратился в нейтральный атом, то есть каждый атом водорода получил по одному электрону.
2Н+1 +2е Н2
Элементы или вещества, принимающие электроны, называются окислителями; в ходе реакции они восстанавливаются.
Эти процессы можно представить в виде схемы:
Соляная кислота + магний сульфат магния + водород
CuSO4 +Fe (железный гвоздь) = Fe SO4 +Cu (красивый красный гвоздь)
Fe 0 – 2е Fe +2
Cu+2 +2е Cu0
Кто-то теряет, а кто-то находит…
Процесс отдачи электронов называется окислением, а принятия – восстановлением.
В процессе окисления степень окисления повышается, в процессе восстановления – понижается.
Эти процессы неразрывно связаны между собой.
3. Метод электронного баланса как способ составления уравнений ОВР
Далее рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. Затем расставляются коэффициенты. В основе метода электронного баланса лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
После объяснения учащиеся под руководством учителя составляют уравнения ОВР по планам, которые составил учитель к этому уроку (см. Приложение). Планы находятся у каждого ученика на парте.
Учитель: Среди изученных нами реакций к окислительно – восстановительным реакциям относятся:
Взаимодействие металлов с неметаллами.
2Mg + O2 =2MgO
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль O2 +4e —2O-2 1 восстановление
2. Взаимодействие металлов с кислотой.
H2SO4 + Mg =MgSO4+H2
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль 2O-2 +4e — O20 1 восстановление
3. Взаимодействие металлов с солью.
CuSO4 + Mg =MgSO4+Cu
Вос-ль Mg0 -2e —Mg+2 2 окисление
Ок исл-ль Cu+2 +2e — Cu0 1 восстановление
Диктуется реакция, один учащийся самостоятельно составляет схему реакции у доски:
H2 + O2 → H2O
Определим, атомы каких элементов изменяют степень окисления.
( h3° + O2° → h3 O2).
Составим электронные уравнения процессов окисления и восстановления.
(h3° -2e → 2H+ – процесс окисления,
O2° +4e → 2O—² — процесс восстановления,
Н2 – восстановитель, О2 — окислитель)
Подберём общее делимое для отданных и принятых е и коэффициенты для электронных уравнений.
(∙2| Н2°-2е → 2Н+ — процесс окисления, элемент – восстановитель;
∙1| O2° +4e → 2O—² — процесс восстановления, элемент – окислитель).
Перенесём эти коэффициенты в уравнение ОВР и подберём коэффициенты перед формулами других веществ.
2H2 + O2 → 2H2O.
План составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать коэффициенты перед формулами других веществ.
Делаем вывод: «В чем же заключается суть ОВР?»
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов: окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
Домашнее задание.
§ 43, упр.1, 3, 7
План-конспект урока по химии (11 класс) по теме: урок по теме Окислительно-восстановительные реакции.
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
МУНИЦИПАЛЬНАЯ СРЕДНЯЯ ШКОЛА №5 г. Пыть-Ях
Урок по теме:
Окислительно-восстановительные реакции.
учитель химии: Кисакова Ольга Александровна
Муниципального образовательного учреждения
средняя общеобразовательная школа № 5,
первая категория
г. Пыть- Ях, 2010
Тема урока: Окислительно-восстановительные реакции.
Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
Задачи:
- Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
- Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
- Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца.
- Показать разнообразие и значение ОВР в природе и повседневной жизни.
- Продолжить подготовку к ЕГЭ по химии.
Ход урока
1. Организационный момент
Добрый день! Хорошего вам настроения!
Тема нашего урока: «Окислительно – восстановительные реакции» (Презентация. слайд 1)
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Первый вопрос: «Что такое степень окисления?». Без этого понятия и умения расставлять степени окисления химических элементов не возможно рассмотрение данной темы.
/Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы — А1+3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н20, О20, F20, Cl20, Br20.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
- Степень окисления калия +1, кислорода -2.
- Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
- Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
- Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
- + 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, h3SO4, K2SO3, h3S, KMnO4.
Что же представляют собой окислительно – восстановительные реакции с точки зрения понятия «степень окисления химических элементов»? (слайд 2)
/ Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
- Окислительно — восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
- Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
- Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
- Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями. - Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
- Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
MnO2 + h3SO4 → MnSO4 + O2 + h3O (2MnO2 + 2h3SO4 → 2MnSO4 + O2 +2h3O)
Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 — 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN+5O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно – восстановительным свойствам вещества можно разделить на три группы:
- окислители
- восстановители
- окислители — восстановители
Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
- 2MnO2 + O2 + 4KOH = 2K2MnO4 + 2h3O (MnO2 – восстановитель)
- MnO2 + 4HCI = MnCI2 + CI2 + 2h3O (MnO2 – окислитель)
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота — Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4 (слайд 3)
Какой ион является окислителем в данной реакции? (H+)
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является h3.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: h3S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления — 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3-. Окислительная способность нитрат – иона значительно выше иона H+, и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
Золото и платина не реагируют с HNO3, но эти металлы растворяются в «царской водке» — смеси концентрированных соляной и азотной кислот в соотношении 3 : 1.
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2h3O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Создание проблемной ситуации: Я готовила к уроку раствор перманганата калия («марганцовка»), пролила стакан с раствором и испачкала свой любимый химический халат. Предложите (проделав лабораторный опыт) вещество, с помощью которого можно очистить халат.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8)
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4-):
- в кислой среде – Mn+2 (соль), бесцветный раствор;
- в нейтральной среде – MnO2, бурый осадок;
- в щелочной среде — MnO42- , раствор зеленого цвета. (слайд 9,)
К схемам реакций:
KMnO4 + Na2SO3 + h3SO4 → MnSO4 + Na2SO4 + K2SO4 + h3O
KMnO4 + Na 2SO 3 + h3O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + h3O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
(слайд 11)
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9h3O2 + 6Ch4COOH = 2Mn(Ch4COO)2 +2Ch4COOK + 7O2 + 12h3O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3h3O2 + 2Ch4COOH = Mn(Ch4COO)2 + 2O2 + 4h3O (слайд 12)
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Закрепление изученного материала
Тест:
- В кислой среде KMnO4 восстанавливается до:
- соль Mn+2
- MnO2
- K2MnO4
- Концентрированная h3SO4 при обычной температуре пассивирует:
- Zn
- Сu
- AI
- Концентрированная HNO3 не реагирует с металлом:
- Ca
- Au
- Mg
- Разбавленная HNO3 с активными металлами восстанавливается до:
- NO
- N2
- N2O
- Какой продукт восстановления KMnO4 пропущен: 2KMnO4 + 3K2SO 3 + h3O = + 3K2SO4 + 2KOH
- MnO2
- 2MnSO4
- K2MnO4
(взаимопроверка тестов в парах)
5. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты методом электронного баланса:
- AI + h3SO4 (конц.) →
- Ag + HNO3 (конц.) →
- KBr + KMnO4 + h3SO4 → …….. + Br2 + K2SO4 + h3O (слайд 13)
6.Подведение итогов урока
Инструктивная карта
I. Повторение и обобщение изученного ранее материала
Задание 1: Рассчитайте степени окисления элементов в соединениях:
MnO2, h3SO4, K2SO3, h3S, KMnO4 .
Задание 2: Методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно – восстановительной реакции:
MnO2 + h3SO4 → MnSO4 + O2 + h3O
Задание 3: В какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
А) 2MnO2 + O2 + 4KOH = 2K2MnO4 + 2h3O Б) MnO2 + 4HCI = MnCI2 + CI2 + 2h3O
II. Углубление и расширение знаний:
Лабораторный опыт: (соблюдайте правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксида калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия.
Отметьте как изменяется окраска раствора в каждой пробирке:
1 пробирка —
2 пробирка –
3 пробирка –
4 пробирка — контроль
Задание: К схемам реакций:
KMnO4 + Na2SO3 + h3SO4 → MnSO4 + Na2SO4 + K2SO4 + h3O
KMnO4 + Na 2SO 3 + h3O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + h3O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
III. Закрепление изученного материала
Тест:
1.В кислой среде KMnO4 восстанавливается до:
А) соль Mn+2 Б) MnO2 В) K2MnO4
2.Концентрированная h3SO4 при обычной температуре пассивирует:
А) Zn Б) Сu В) AI
3.Концентрированная HNO3 не реагирует с металлом:
А) Ca Б) Au В) Mg
4.Разбавленная HNO3 с активными металлами восстанавливается до:
А)NO Б) N2 В) N2O
5. Какой продукт восстановления KMnO4 пропущен:
2KMnO4 + 3K2SO 3 + h3O = + 3K2SO4 + 2KOH
А) MnO2 Б) 2MnSO4 В) K2MnO4
Оценка за тест (по результатам взаимопроверки)
IV. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты:
1. AI + h3SO4 (конц.) →
2. Ag + HNO3 (конц.) →
3. KBr + KMnO4 + h3SO4 → …….. + Br2 + K2SO4 + h3O
Урок химии «Окислительно-восстановительные реакции»
Цели урока:
познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, дать понятие “окислитель”, “восстановитель”, “окисление”, “восстановление”; охарактеризовать единство и неразрывность процессов окисления и восстановления; систематизировать знания о типах химических реакций, о степени окисления химических элементов;Тип урока: усвоения новых знаний.
Форма урока: урок-исследование с элементами проблемного обучения.
Методы и методические приемы: рассказ, беседа, демонстрация средств наглядности, самостоятельная работа обучающихся.
Межпредметные связи: биология, физика, математика.
Средства обучения: комплект инструктивных карт, комплект карточек с терминами, мультимедиопроектор, презентация урока, экспонаты музея
Учебник: Габриелян О.С. Химия.8 класс: учеб. для общеобразоват. учреждений / О.С.Габриелян. – 15-е изд., стереотип. – М.: Дрофа, 2009. – 270, [2] с.: ил.
Структура урока:
| № п/п | Этап урока | Примерное время |
| I. | Организационный этап | 1 мин |
| II. | Мотивация учебной деятельности | 3 мин |
| III. | Актуализация знаний обучающихся | 5 мин |
| IV. | Первичное усвоение новых знаний | 20 мин |
| V. | Первичное закрепление знаний | 4 мин |
| VI. | Первичная проверка понимания изученного | 7 мин |
| VII. | Информация о домашнем задании | 2 мин |
| VIII. | Рефлексия | 3 мин |
Конспект урока.
I. Организационный этап.
Подготовка обучающихся к работе на уроке. Приветствие, эмоциональный настрой, проверка отсутствующих и готовности к уроку.
II. Мотивация учебной деятельности.
Презентация. Слайд 1. Информация учителя. Ребята, вокруг нас протекает множество химических реакций, без которых наша жизнь невозможна, некоторые из них приносят вред, без некоторых наша жизнь невозможна. Сегодня на урок я принесла экспонаты нашего музея. Как вы считаете в хорошем ли они состоянии? А что с ними произошло? 67 лет назад закончилась ВОВ. Они заржавели. А как вы думаете, почему? Какие процессы лежат в основе разрушения металлов, в частности железа? Чтобы ответить на этот вопрос вы должны познакомиться с новой классификацией химических реакций, определить признак новой классификации. Тема сегодняшнего урока “ОВР”, что означают эта абривиатура мы расшифруем позднее.
III. Актуализация знаний обучающихся.
Слайд 2. Фронтальный опрос. Давайте вместе с вами вспомним все известные вам классификации химических реакций и признаки, которые лежат в основе каждой классификации. Признаки (на доске).
Повторение. “Типы химических реакций”.
| По числу и составу реагирующих и образующихся веществ |
Признак классификации химической реакции |
По использованию катализатора | ||
| По агрегатному состоянию веществ | По тепловому эффекту | |||
| По направлению | ? |
Задание. Записать уравнения реакций горения угля и разложения карбоната кальция, охарактеризовать реакции (устно) по всем известным классификациям.
Слайд 3.
Неизвестный признак реакции?
ІV. Первичное усвоение новых знаний
Информация учителя. Беседа. Ребята, одним из свойств атомов является способность отдавать или принимать электроны, участвуя в образовании химической связи. Как называется условный заряд, который приобретают атомы отдавая или принимая электроны? Степень окисления. Какие значения может иметь степень окисления? +, 0, -. Предельное число электронов на внешнем энергетическом уровне 8. Каким образом элементы могут достичь этого состояния? Давайте вспомним с вами, что происходит с атомами химических элементов, когда они отдают или принимают электроны. Для этого рассмотрим строение электронных оболочек атомов. Тенденцию к отдаче электронов имеют атомы металлов, к приему электронов атомы неметаллов. Вспомните, как изменяются эти свойства в периоде, группе?
Слайд 4.
Скажите, ребята, а можем ли мы в основу классификации химических реакций положить признак: изменение степени окисления?
Слайд 6.
Давайте вернемся к рассмотренным ранее химическим реакциям и расставим степени окисления всех элементов для каждой формулы.
Признак классификации? Изменение степени окисления.
Слайд 7.
Тип реакций? Окислительно-восстановительная реакция и не окислительно-восстановительная реакция.
Слайд 8.
не окислительно-восстановительная реакция
Обучающиеся формулируют тему урока (расшифровывают абривиатуру ОВР).
Слайд 9.
V. Первичное закрепление знаний.
Рассмотрим пример окислительно-восстановительной реакции. Почему данная реакция является окислительно-восстановительной? Обучающиеся определяют тип реакции по разным классификациям. Проверяем.
Слайд 10.
2Н20 + O20= 2Н+12O-2
Н20– 2е →2 Н+1– процесс окисления, молекула отдает 2 электрона,
Н20– восстановитель.
O20 +4е →2О-2 – процесс восстановления, молекула принимает два электрона,
O20 – окислитель
Слайд 11. Работа с терминами. Обучающиеся сами формулируют определения.
Окисление – это процесс отдачи электронов атомами, молекулами, ионами.
Восстановитель– это частица (атом, молекула или ион), которая отдает электроны.
Восстановление – процесс присоединения электронов атомами, молекулами, ионами
Окислитель– это частица (атом, молекула или ион), которая принимает электроны.
Обучающиеся смотрят определения в учебнике с. 229–231, сравнивают.
Окислительно-восстановительная реакция – это единство процессов окисления и восстановления.
Слайд 12. Физкультминутка.
Слайд 13.
VI. Первичная проверка понимания изученного
Слайды 14-17.
Выполнение тестового задания (Приложение 1)
Слайд 18.
Взаимоконтроль. Самоконтроль. Обсуждение ошибок.
Слайд 19.
VII. Информация о домашнем задании.
Учебник: §43, стр.229–230.
Информация учителя. В качестве домашнего задания я предлагаю вам познакомиться с химической сказкой и выполнить задание к тексту (Приложение 2).
Задание:
1. Внимательно прочтите текст, вставьте пропущенные слова.
2. Составьте уравнение химической реакции образования хлорида натрия. Является ли данная реакция окислительно-восстановительной? Если да, то укажите окислитель и восстановитель.
3. Сочините сказку, стихотворение о любом окислительно-восстановительном процессе.
VIII. Рефлексия. Решение проблемы, поставленной в начале урока.
Слайд 20.
4Fe0 + 3O02 + 6H2O = 4Fe+3(O-2H)3
Данное уравнение химической реакции отражает процесс ржавления железа или коррозию железа. Скажите ребята, по признаку изменение степени окисления это будет какая реакция? Окислительно-восстановительная. В чем же заключается суть процесса коррозии? Окислитель? Восстановитель?
Слайд 21.
Окислительно-восстановительные реакции многообразны, они лежат в основе очень важных реакций: фотосинтез, дыхание, гниение, брожение, коррозия, электролиз, горение.
Синквейн. Окислительно-восстановительная реакция.
Приложение 1.
Приложение 2.
Приложение 3.
Урок +презентация химии 8 класс тема: «Окислительно- восстановительные реакции»
Лямасова Елена Анатольевна
учитель химии и биологии
МОУ Старомайнская СОШ №2
Ульяновской области
Конспект урока химии в 8-м классе по теме: «Окислительно-восстановительные реакции»
Цели урока:
формирование общеучебных умений и навыков, носящих в современных условиях общенаучный и общеинтеллектуальный характер;
развитие у обучающихся теоретического, творческого, логического и операционного мышления.
Задачи урока:
1) Деятельностные – расширить и закрепить:
– знания обучающихся о свойствах металлов и неметаллов, типах химических реакций;
– умения показывать электронные переходы в ОВР, определять значение степени окисления химических элементов;
– навыки составления электронного баланса и расстановки коэффициентов в уравнениях окислительно-восстановительных реакциях.
2) Личностные – воспитывать чувство патриотизма.
3) Метапредметные– расширение кругозора обучающихся, развитие умений и навыков применения полученных знаний для объяснения явлений окружающего мира.
Ход урока
Проблемная тема урока: “Кто-то теряет, а кто-то находит”.(слайд 1)
I. Организационный момент
II. Введение в тему
Летом 2007 года в Европе были подведены итоги конкурса «Семь новых чудес света». Голосование проходило по Интернету, и отдать свой голос «за чудо» мог каждый желающий. Можно только догадываться, почему в список победителей не вошел ни один российский памятник, даже московский собор Василия Блаженного.
Газета «Известия», телеканал «Россия» и радиостанция «Маяк» выдвинули инициативу дать свой ответ «Семи новым чудесам света». Цель проекта “Семь чудес России” – возрождение чувства патриотизма и любви к своему Отечеству, а также привлечение внимания к восстановлению и сохранению исторических, культурных и природных объектов на территории нашей Родины. Итоги голосования по долгосрочному федеральному общероссийскому проекту были объявлены во время праздничного концерта на Красной площади по случаю Дня России. К “Чудесам” России относятся:
Долина гейзеров на Камчатке, озеро Байкал, дворцовый комплекс Петергоф под Санкт-Петербургом, природный памятник “Столбы выветривания” в Коми, собор Василия Блаженного в Москве, Мамаев курган и статуя Родины-матери в Волгограде, гора Эльбрус.
Результатом проекта стало составление нового “Золотого маршрута по России”, по которому, при желании, вы можете отправиться в путешествие.
Воображение правит миром
Наполеон 1
А если бы объявили конкурс “Семь чудес науки химии”? Какое, всем вам известное вещество возглавило бы список претендентов?
– Конечно же, вода. Я нисколько не сомневаюсь, что вы приведете массу доказательств того, что это удивительное вещество достойно первого места в списке. А вот на второе место я бы поставила окислительно-восстановительные процессы. Почему? На этот вопрос мы и постараемся ответить с вами в процессе урока.
Тема нашего урока: “Окислительно-восстановительные реакции”
III. Основная часть урока. Формирование новых знаний(слайд 2)
Представьте себе, что Вы стоите перед домом, где живут удивительные существа (Ме, НеМе). Каждый житель имеет свою квартиру, живет на определенном этаже и в определенном подъезде. Представители высшего общества занимают элитный 8 подъезд, они держатся особняком, в контакты ни с кем не вступают и очень самодостаточны (Почему?). Все остальные жители очень хотят быть похожими на них. Для этого одни отдают, а другие принимают электроны. В этом случае атомы превращаются в ионы, которые имеют такую же электронную конфигурацию, как ближайшие к ним инертные газы.
Электрон давно завоевал физику и химию, став для них почти что идолом. Все окислительно-восстановительные реакции находятся во власти электронных переходов от одного атома к другому как внутри молекулы, так и между ними. Перемещение электронов сопровождается изменением степени окисления атомов, участвующих в этих процессах.
Просмотр творческой работы обучающегося и его комментарии к ней:
Свойство металлов – отдавать электроны: у магния на последнем энергетическом уровне два электрона, которые он легко отдает, превращаясь в положительно заряженный ион. Свойство неметаллов – присоединять электроны: у серы на последнем энергетическом уровне 6 электронов, до завершения уровня не хватает двух электронов, которые она присоединяет, образуя анион.
Просмотр творческой работы обучающегося и его комментарии к ней:
“Окислитель, как грабитель, забирает электрон”. Хлор более сильный окислитель, чем сера, поэтому при взаимодействии железа с хлором образуется хлорид железа (+3)
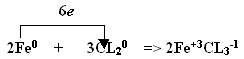
Вторая тема нашего урока: “Кто-то теряет, а кто-то находит”. (Почему?)(слайд 2,3,4)
ОВР – это такие реакции, при которых происходит переход электронов от одних атомов, ионов или молекул к другим.(слайд5)
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
Окисление всегда сопровождается восстановлением, а восстановление окислением.
ОВР – это единство двух противоположных процессов: окисления и восстановления(слайд6,7,).
IV. Закрепление полученных знаний
1. Покажите электронные переходы в следующих ОВР.
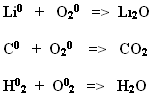
2. Назовите окислитель и восстановитель.
V. Расширение и развитие полученных знаний(слайд 8)
Во многих ОВР очень трудно расставить коэффициенты, для этого используют метод электронного баланса, который основан на сравнении степеней окисления в исходных и конечных веществах.
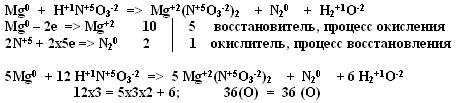
VI. Закрепление знаний(слайд9)
1. Из приведенных схем выпишите уравнения реакций, которые можно отнести к ОВР
2. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР
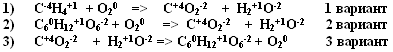
Определите окислитель, восстановитель, процесс окисления и восстановления.
3. Проверка выполнения задания (2)с помощью интерактивной доски (функция “штора”), или презентации
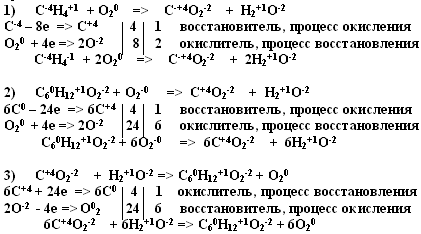
VII. Значение и применение ОВР(слайд10-17)
Вопросы к учащимся:
– Какой процесс отражает первое уравнение реакции?
– Какое значение имеют реакции горения?
– Какой процесс отражает второе уравнение реакции?
Первый вдох новорожденного говорит о начале новой жизни.
– Каковы функции дыхания?
Дыхание — основная форма диссимиляции у человека, животных, растений и многих микроорганизмов. При дыхании богатые энергией вещества, принадлежащие организму, полностью разлагаются до бедных энергией неорганических конечных продуктов (диоксида углерода и воды), используя для этого молекулярный кислород. Под внешним дыханием понимают газообмен между организмом и окружающей средой, включающий поглощение кислорода и выделение углекислого газа, а также транспорт этих газов внутри организма.
– Какой процесс отражает третье уравнение реакции?
– Какова функция фотосинтеза. Его значение?
Фотосинтез – процесс образования органических веществ из углекислого газа и воды на свету в зеленых листьях. Фотосинтез, является одним из самых распространенных процессов на Земле, он обуславливает природные круговороты углерода, кислорода и других элементов и обеспечивает материальную и энергетическую основу жизни на нашей планете. Фотосинтез является единственным источником атмосферного кислорода. К тому же фотосинтез снабжает человечество топливом (древесина, уголь, нефть), волокнами (целлюлоза) и бесчисленными полезными химическими соединениями. Процесс фотосинтеза является также основой питания всех живых существ, так как связанный из воздуха в процессе фотосинтеза углекислый газ и вода, образуют около 90-95% сухого веса урожая. Остальные 5-10% приходятся на минеральные соли и азот, полученные из почвы.
Как вы считаете, возможно, ли было возникновение жизни на нашей планете без участия окислительно-восстановительных процессов?
Поведение итогов
Итак, приступаем к голосованию. Кто считает окислительно-восстановительные процессы, в основе которых лежат электронные переходы, “чудом” науки? Кто не согласен? Кто сомневается? Обсудить.
VIII. Домашнее задание(слайд 19)
§17, §43.
Рефлексия(слайд 20)
Маршрутный лист обучающихся к уроку по теме «ОВР»
Проблемная тема урока: «Кто-то теряет, а кто-то находит»
Почему?
ОВР – это такие реакции, при которых происходит переход электронов от одних атомов, ионов или молекул к другим.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
Окисление всегда сопровождается восстановлением, а восстановление окислением.
ОВР — это единство двух противоположных процессов: окисления и восстановления.
1. Покажите электронные переходы в следующих ОВР.
Li0 + O20 => Li2O
C0 + O20 => CO2
H02 + O02 =>H2O
2. Назовите окислитель и восстановитель.
3. Mg + HNO3 => Mg(NO3)2 + N2 + H2O
— Расставим степень окисления химических элементов
— Выпишем те из них, в которых произошло изменение степени окисления
— Составим электронный баланс
— Определим окислитель и восстановитель
— Укажем процесс окисления и восстановления
— Расставим коэффициенты (уравнивая металлы, затем неметаллы, последним – водород)
— Проверяем правильность расстановки коэффициентов по кислороду
Ваши вопросы, которые требуют дополнительного объяснения
_________________________________________________________
_________________________________________________________
_________________________________________________________
4. С-4Н4+1+ О20 =>C+4О2-2 + H2+1O-2 1 вариант
С60Н12+1О6-2+ О20 =>С+4О2-2+ H2+1O-22 вариант
С+4О2-2+ H2+1O-2=> С60Н12+1О6-2+ О20 3 вариант
Кто считает окислительно-восстановительные процессы, в основе которых лежат электронные переходы, «чудом» науки? Почему?
________________________________________________________________________________
Кто не согласен? Почему
________________________________________________________________________________
Кто сомневается? Почему?
________________________________________________________________________________
Домашнее задание
1. §17, §43
Разработка урока по химии на тему «Окислительно — восстановительные реакции. Значение окислительно
Урок химии в 9 классе.
Тема: «Окислительно – восстановительные реакции. Значение окислительно – восстановительных реакций в природе и технике»
Цели урока.
Обучающая цель: способствовать формированию знаний о классификации химических реакций в свете электронной теории, о месте окислительно – восстановительных реакций среди основных типов реакций, о процессах окисления, восстановления, «окислитель», «восстановитель»
Развивающая цель: создать условия для развития образного мышления, развития умений определять степени окисления в формулах веществ, навыков составления уравнений окислительно – восстановительных реакций на основе метода электронного баланса.
Воспитательная цель: способствовать формированию кругозора раскрывая роль окислительно – восстановительных реакций в природе, технике, жизни человека, интереса к предмету химии.
Основные понятия: окислительно – восстановительные реакции, окислитель, восстановитель, процессы окисления и восстановления, алгоритм, схема электронного баланса.
Оборудование и материалы к уроку: таблица «Классификация химических реакций», репродукция К.Брюллова «Гибель Помпеи», коробка спичек, презентация в редакторе POWER POINT
Использованная литература и ресурсы сети Интернет:
1.Учебник Г.Е.Рудзитис, Ф.Г. Фельдман. Химия 9 класс. – М.: Просвещение, 2014.
2. Единая коллекция цифровых образовательных ресурсов (http://school-collection.edu.ru/catalog/pupil/)
Тип урока: урок по закреплению и совершенствованию знаний и способов действий
Структура урока:
Организационный момент
Ориентировочно – мотивационный
Информационно – поисковый
Обобщение и систематизация
Рефлексия
Домашнее задание
Содержание этапов урока
1.Организационный момент (2 мин.)
Посмотреть эмоциональный настрой учеников и их готовность к уроку (они предварительно объединились в группы и получили задания)
2. Ориентировочно – мотивационный этап (2 мин.)
Знания по данной теме необходимы для понимания и объяснения тех процессов, которые мы будем изучать в дальнейшем в неорганической , органической химии, биологии, экологии. Круговорот веществ в природе, сгорание топлива, гниение, брожение, фотосинтез, дыхание, коррозия металлов. Что же лежит в основе всех этих преобразований? Понять механизм этих процессов – это и будет цель нашего урока.
Постановка проблемного вопроса:
Что было бы в мире без окислительно – восстановительных реакций?
3.Информационно – поисковый этап (23 мин.)
Технология «Круг идей»
Химическая реакция – это такое изменение веществ, при которых разрушаются старые и образуются новые химические связи между частицами (атомами, ионами) из которых построены вещества. Поражает многообразие химических реакций. Однако есть и признаки, по которым можно более правильно дать классификацию химических реакций. Кто из вас используя таблицу, охарактеризует классификацию химических реакций по определенным признакам и определит место окислительно – восстановительных реакций в этой классификации? (так формируется первая группа или идет индивидуальная работа)
Классификация химических реакций по определенным признакам
1.Число и состав реагирующих веществ и продуктов реакции:1)с изменением состава веществ
2) без изменения состава веществ
2. Тепловой эффект
а) реакции соединения
б) реакции разложения
в) реакции замещения
г) реакции обмена
д) реакции изомеризации
а) экзотермические
б) эндотермические
А+ВС=АВС
А+В=АВ
АВС=АВ+С
А+ВС=В+АС
АВ+СД=АД+СВ
АВСД→А=С-Д
│В
А+В=СД+Q
А+В=СД-Q
3. Агрегатное состояние реагирующих и образовавшихся веществ
а) гомогенные
б) гетерогенные
все вещества одного агрегатного состояния
вещества разных агрегатных состояний
4. Использование катализатора
а) каталитические
б) некаталитические
5. Направление реакции
а) обратимые реакции
б) необратимые реакции
А+В=АВ
6.Изменение С.О. элементов, входящих в состав реагирующих веществ и образовавшихся соединений:
1) с изменением С.О.
2) без изменения С.О.
окислительно – восстановительные реакции
реакции не являются ОВР
nА0+ mB0=Am+n B-m
Задание №1 Дать характеристику химической реакции по признакам классификации 2Pb(NO3)2тв.→2PbOТВ.+4NO2↑+O2↑
У элементов в соединении определяется не только валентность, но и степень окисления. Давайте вспомним одно ли это понятие? Валентность атома – это количество общих электронных пар, которые данный атом образует с другими атомами в данном соединении. Степень окисления – условный заряд, который приобретает атом в соединении в случае смещения электронов от атома – положительный заряд и, наоборот, смещение электронов к атому – отрицательный заряд, если считать все связи в веществе ионными.
Задание №2. В составе каких соединений Марганец может быть только окислителем; только восстановителем, и окислителем и восстановителем:Mn, MnO, MnO2, K2MnO4, KMnO4, Mn2O7? Обобщить знания о возможных степенях окисления металлов и неметаллов разных групп.
Задание№3.Изучить алгоритм составления уравнений окислительно – восстановительных реакций с помощью метода электронного баланса (воспользоваться стр.6 учебника)
Важнейший процесс на Земле. Фотосинтез.
Объяснение выполнения задания учителем:
6CO2+6H2O→C6H12O6+ 6O2↑
C+4+4e—→C0 1 окислитель
2O-2-4e—→O2 0 1 восстановитель
Задание № 4.Составить уравнения ОВР методом электронного баланса и обсудить тему «Окислительно – восстановительные реакции – это добро или зло?» (работа в группах по карточкам).
Задания для I группы.
1.Во время грозовых разрядов происходит связывание азота по схемам:
N2+O2→NO
NO+O2→NO2
NO2+H2O→HNO3+HNO2
Кислоты, которые образуются, попадают с осадками в грунт, где преобразуются в нитраты и нитриты. Так в грунте оказывается от 4 до 15 кг азота на одном гектаре.
Задания для II группы.
1.Трудно переоценить значение металлов для промышленности. Металлы получают из руд. В основном содержание металлических элементов в рудах невысокое. Поэтому руды обогащают, то есть подвергают обработке, вследствие которой содержание полезного соединения металла увеличивается. Полученный после обогащения продукт называют концентратом. Из концентрата металл восстанавливают различными восстановителями:
а) оксидные руды восстанавливают чаще коксом или оксидом углерода(II), реже – водородом
MoO3+H2→Mo+H2O
Выполнение задания учениками:
MoO3+3H2→Mo+3H2O
Mo+6+6e—→Mo0 1
H2 0-2e—→2H+1 3
б) сульфидные руды сначала обжигают: PbS+O2→PbO+SO2
в) потом полученный оксид восстанавливают коксом
PbO+C→Pb+CO2
Выполнение задания учениками:
2PbO+C→2Pb+CO2
Pb+2+2e—→Pb0 2 окислитель
4
C0-4e—→C+4 1 восстановитель
2.На памятниках Петру I в Санкт – Петербурге, названному «Медным всадником», Тарасу Шевченко, Богдану Хмельницкому в Киеве сделанных из бронзы (сплав меди с оловом) образуется зеленый налет, который периодически счищают. Медь реагирует сразу с тремя веществами, которые есть в воздухе с: кислородом, водяным паром, углекислым газом:
Cu+O2+H2O+CO2→ (CuOH)2CO3
Выполнение задания учениками:
2Cu+O2+H2O+CO2→ (CuOH)2CO3
Сu0 -2e—→Cu+2 2
O2 0+4e—→2O-2 1
Химическим изменениям подвергается даже такой малоактивный металл как серебро. Все знают, что со временем серебряные предметы темнеют. Причиной потемнения серебра является реакция с кислородом и сероводородом, небольшие примеси которого содержатся в воздухе.
Ag0+O2 0+H2S→ Ag2 +1S+H2O
Выполнение задания учениками:
4Ag0+O2 0+2H2S→ 2Ag2 +1S+2H2O
Ag0-1e—→Ag+1 4 восстановитель
O2 0+4e—→2O-2 1окислитель
Но наибольшему влиянию кислорода на открытом воздухе при повышенной влажности подвержено железо. Ржавчина съедает не менее 20% всего производимого железа, а это – миллионы тонн.
Fe+O2+H2O→Fe (OH)3
Явление разрушения металлов вследствие химических реакций с веществами окружающей среды называют коррозией.
Задания для III группы.
В 79 году н.э. «заговорил» вулкан Везувий. До этого времени он был красочной горой, которая на 1300 м возносилась над Неаполитанским заливом. Но 24 августа над Везувием поднялась туча необычной формы, которая становилась всё темней. Посыпался пепел, тяжелые камни, в воздухе чувствовался запах сожженной серы. Извержение вулкана полностью уничтожило город Помпею, город исчез под слоем пепла, который достигал 3 метров. (Демонстрация репродукции Карла Брюллова «Последний день Помпеи»).
«Жизнь вулкана» сопровождается окислительно – восстановительными процессами. Например:
H2S+O2→S+H2O
H2S+O2→SO2 +H2O
H2S+SO2→H2O+ S
Каждый день мы сталкиваемся с чудом, которое титан Прометей принес людям, за что был наказан разгневанными богами – это огонь. Сейчас огонь мы получаем чаще всего обычными спичками. В состав коричневой замазки коробочки спичек входит красный фосфор. Под действием тепла в результате трения, красный фосфор переходит в белый. Частицы белого фосфора воспламеняются на коробочке и поджигают головку спички. В течение доли секунды в спичечной головке происходит настоящий ураган химических реакций. При температуре 2000С сера, перешедшая в жидкое состояние, начинает взаимодействовать с бертолетовой солью:
KClO3+S→KCl+SO2↑
При 370-4000С начинает разлагаться бертолетовая соль
KClO3→KCl+O2↑
Выделившийся кислород вступает в реакцию с серой
S+O2→SO2↑
При 4410С сера закипает, переходит в пары. В это время разлагается дихромат калия и горят клеи. С головки огонь переходит на осиновую соломку, спичка загорается.
4.Обобщение и систематизация.
Давайте обобщим: Окислительно – восстановительные реакции – это добро или зло? Что было бы в мире без окислительно – восстановительных реакций?
Окислительно – восстановительные реакции широко распространены.
ОВР играют огромную роль в природе и жизни человека.
1.Фотосинтез растений2.Процессы дыхания у растений, животных, человека
3.Круговорот веществ и энергии в природе
4.Обмен веществ и энергии в живых организмах
1.Горение топлива
2.Получение металлов, галогенов, щелочей, кислот, солей
3.Получение органических веществ
4.Коррозия металлов
5.Очистка веществ (природных вод, сточных вод, выхлопных газов)
6. Спички
7.Зеркало
8.Аккумуляторы
5.Рефлексия: используется методика незаконченного предложения.
Например: Окислительно – восстановительными называются реакции…
Если в соединении элемент находится в минимальной С.О.- соединение (частица) выступает в роли… (восстановителя).
Если в соединении элемент находится в максимальной С.О. – соединение (частица) выступает в роли …(окислителя).
При восстановлении – С.О. …(понижается).
При окислении – С.О….(повышается).
6.Домашнее задание: Параграф 1(алгоритм),упр.4-6 стр.7
 2Cl-1 1. Se0→Se-2 1. 2H+1→H
2Cl-1 1. Se0→Se-2 1. 2H+1→H