Презентация «Тепловой эффект химической реакции»
Содержание урока: Закон сохранения энергии. Превращение энергии в ходе химических реакций.
Тепловой эффект химической реакции. Экзо– и эндотермические реакции.
Термохимические уравнения. Определение теплового эффекта химической
реакции.
Цели урока: Обеспечить развитие представлений учащихся о законе сохранения энергии.
Организовать деятельность учащихся по применению знаний закона сохранения
энергии в разнообразных ситуациях.
Актуализировать личностный смысл учащихся к изучению темы, помочь осознать
практическую направленность учебного материала.
Содействовать развитию у школьников научных методов познания (наблюдение,
эксперимент), химически правильной речи.
Требования к уровню подготовки учащихся:
Знать:
* закон сохранения энергии;
* термины: тепловой эффект химической реакции, экзотермические и эндотермические реакции, термохимическое уравнение.
Понимать: причину появления теплового эффекта химической реакции.
Уметь:
* определять тип химических реакций по тепловому эффекту;
* составлять уравнения реакций;
* проводить вычисления теплового эффекта химической реакции.
* использовать приобретенные знания и умения в практической деятельности и повседневной жизни
для: критической оценки информации о веществах, используемых в быту;
Оценивать:
* значимость представлений о тепловом эффекте реакции для прогнозирования ее практического осуществления;
* экологические последствия протекания экзотермических реакций;
Понимать: личную ответственность за качество приобретаемых знаний и умений.
Проявлять:
* уверенность в личных возможностях, самостоятельность в работе;
* способность к самоанализу, самодиагностике.
Оборудование:Учебно-электронное пособие «Химия (8-11 классы). Виртуальная лаборатория»,
«Химия для всех – XXI», «Репетитор по химии Кирилла и Мефодия», компьютер,
проектор, экран.
Тепловой эффект реакции. Справочный лист. — 9 класс — Уроки химии — Классная комната
Справочник
Тепловой эффект реакции Q – количество теплоты, которое поглощается или выделяется в ходе реакции.
Чтобы вычислить числовую величину теплового эффекта находят разность между выделившейся и затраченной энергией.
Тепловой эффект включается в химическое уравнение со знаком «+», если тепло выделяется (экзотермическая реакция) и со знаком «-», если тепло поглощается (эндотермическая реакция). Его величина рассчитывается на один моль полученного или разложившегося вещества.
Q =Δ E 2 — Δ E 1
Рассчитайте тепловой эффект и заполните энергетические диаграммы:
1. 2P + 5 Cl 2 = 2 PCl 5 ( +/_Q ) ?
исходные 2P + 5 Cl 2
активное состояние 2P + 10 Cl
продукты 2 PCl 5
ΔE 1 = 238 кДж ΔЕ 2 = 1568 кДж
2. CuO + H 2 = Cu + H2 O ( +/_Q ) ?
исходные CuO + H 2
активное состояние Cu + O + 2H
продукты Cu + H2 O
ΔE 1 = 1668 кДж ΔЕ 2 = 1020 кДж
| 1. | Экзотермические реакции | 1 Б. |
| 2. | Тепловой эффект реакций | 2 Б. |
| 3. | Термохимические уравнения экзотермических реакций | 2 Б. |
| 4. | Запись термохимических уравнений | 4 Б. |
| 5. | Расчёт количества теплоты по известному тепловому эффекту | 4 Б. |
| 6. | Расчёт объема газа по теплоте, выделившейся в ходе реакции | 5 Б. |
Конспект урока «Тепловые эффекты химических реакций»
Дата ______________ Класс_____
Тема урока «Тепловые эффекты химических реакций»
Задачи:
1. Познакомить учащихся с тепловыми явлениями, сопровождающими химические процессы; провести классификацию химических реакций на основе теплового эффекта
2. Продолжить формирование умения наблюдать, описывать наблюдения и делать выводы по результатам эксперимента
3. Развивать у учащихся умение выделять главное, анализировать и сравнивать информацию, аргументировано отвечать на вопросы
Тип урока: изучение нового материала
Оборудование: мультимедийная доска, презентация, компьютер.
Планируемые результаты обучения:
Личностные. Формировать мировоззрение, соответствующее современному уровню развития науки, умение организовывать сотрудничество с учителем и одноклассниками.
Метапредметные. Развивать умения делать обобщения, устанавливать аналогии, строить логические рассуждения и выводы.
Предметные. Знать термохимические уравнения реакции, чем отличаются от химических. Знать экдотермический и экзотермические эффекты. Уметь решать задачи.
Ход урока:
I. Организационный момент
II.Актуализация знаний
Химиков всегда интересует вопрос о том, пойдет ли та или иная химическая реакция в нужном направлении. И если пойдет, то когда она
Как вы думаете какая область науки отвечает на этот вопрос?
III. Объяснение нового материала
Один из главных законов природы – закон сохранения энергии. Вещества обладают разным запасом энергии, поэтому в результате превращения одних веществ в другие,часть энергии превращается или поглощается в виде теплоты.
Реакции, протекающие с выделением теплоты , называются экзотермическими.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции.
Химическое уравнение, в котором указывается тепловой эффект, называется термохимическим уравнением.
Тепловые эффекты различных химических реакций выражаются количеством теплоты, выделяемой или поглощаемой при образовании 1 моля продукта.
Выбрав энергию простых веществ в качестве стандарта, тепловые эффекты реакций выражают через теплоты образования продуктов и реагентов.
Теплотой образования веществ называют теплоту реакции, в которой 1 моль вещества образуется из простых веществ.
Такие расчеты выполняют с использованием термохимических уравнений, которые отличаются от обычных химических уравнений следующими особенностями:
1. Коэффициенты в термохимических уравнениях указывают не число атомов и молекул, участвующих во взаимодействии, а количества вещества. В силу этого в подобных уравнениях допустимо использование дробных коэффициентов, которые обычно подбирают таким образом, чтобы коэффициент перед целевым продуктом реакции равнялся единице.
2. В термохимических уравнениях указывается тепловой эффект реакции (обычно величина ΔН). Тепловой эффект при этом относят к числу молей реагентов и продуктов реакции, определяемых коэффициентами уравнения, и выражают в кДж.
3. В термохимических уравнениях обязательно указывают агрегатное состояние реагентов и продуктов реакции, поскольку фазовые переходы сопровождаются выделением или поглощением энергии. Агрегатное состояние вещества обозначают сокращениями: к — кристаллическое, ж — жидкое, г — газообразное, р — растворенное.
IV. Закрепление
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Дано:
m (Mg0) = 120г
Найти:
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моля MqO — 1204 кДж
По условию 3 моля MqO — Q1
Отсюда
3 моль* 1204кДж
Q1
=
————————
= 1803 кДж
2моль
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_———- 2610 кДж
По условию х моль ———- 652,5 кДж
Решаем пропорцию
2 моль* 652,5кДж
х
=
————————
= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано:
m(CH4)= 48г
Q1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж
По уравнению 1 моль CH4 — Q
Решаем пропорцию
1 моль* 2406 кДж
х
=
————————
= 802 кДж
3 моля
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
Задача 4. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Дано:
Q1 = 91 кДж
Найти:
V (O2)-?
Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ———- 91 кДж
По условию х моль ———- 182 кДж
Решаем пропорцию
3 моль* 182 кДж
х
=
————————
= 6 моль
91 кДж
2) Вычислим объем кислорода, согласно закону Авогадро
(Vm = 22б4 л.моль) V = n * Vm
V(O2) = 6 моль * 22,4 л/моль = 134,4 л
Ответ: объем выделившегося кислорода равен 134,4 л.
V. Домашнее задание
§ 2, упр…
1. Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
| 1. | Экзотермические реакции | 1 вид — рецептивный | лёгкое | 1 Б. | Знать определение экзотермических реакций, понятие о тепловом эффекте реакции. |
| 2. | Эндотермические реакции | 1 вид — рецептивный | лёгкое | 1 Б. | Знать определение эндотермических реакций, понятие о тепловом эффекте реакции. |
| 3. | Тепловой эффект реакций | 2 вид — интерпретация | среднее | 2 Б. | Знать определение теплового эффекта реакций, условия, от которых он зависит. |
| 4. | Термохимические уравнения экзотермических реакций | 2 вид — интерпретация | среднее | 2 Б. | Знать определение экзотермических реакций, термохимических уравнений реакций, их важнейших отличительных особенностей. |
| 5. | Термохимические уравнения эндотермических реакций | 2 вид — интерпретация | среднее | 2 Б. | Знать определение эндотермических реакций, термохимических уравнений реакций, их важнейших отличительных особенностей. |
| 6. | Запись термохимических уравнений | 3 вид — анализ | сложное | 4 Б. | Уметь анализировать запись термохимических уравнений. |
| 7. | Расчёт количества теплоты по известному тепловому эффекту | 3 вид — анализ | сложное | 4 Б. | Уметь проводить расчёт количества теплоты по известному тепловому эффекту реакции. |
| 8. | Расчёт теплового эффекта реакции по количеству выделившейся теплоты | 3 вид — анализ | сложное | 4 Б. | Уметь проводить расчёт теплового эффекта реакции по количеству выделившейся теплоты. |
| 9. | Расчёт объема газа по теплоте, выделившейся в ходе реакции | 3 вид — анализ | сложное | 5 Б. | Уметь проводить расчёт объёма газа по теплоте, выделившейся в ходе реакции. |
| 10. | Расчёт массы вещества по теплоте, выделившейся в ходе реакции | 3 вид — анализ | сложное | 5 Б. | Уметь проводить расчёт объёма газа по теплоте, выделившейся в ходе реакции. |
Тепловой эффект химической реакции и его значение.
Тема: Тепловой эффект химической реакции и его значение.
Оборудование: компьютер, презентация “Тепловой эффект химических реакций” .
I. Организационно-мотивационный этап
II. Актуализация знаний учащихся
Отработка понятий: химические реакции, признаки химических реакций.
III. Изучение новой темы
1. Лабораторный эксперимент.
Опыт 1. Взаимодействие Mg с кислотой.
1) В пробирку с порошком магния (Mg) прилить осторожно, по каплям! 0,5 мл раствора кислоты HCl, что наблюдаете?
2) Аккуратно! потрогайте нижнюю часть пробирки. Наблюдения и уравнение реакции записать в таблицу:
Опыт 2. Растворение азотного удобрения в воде
1) В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните
2) потрогайте пробирку; наблюдения запишите в соответствующую графу таблицы:
2. Понятие тепловой эффект химических реакций 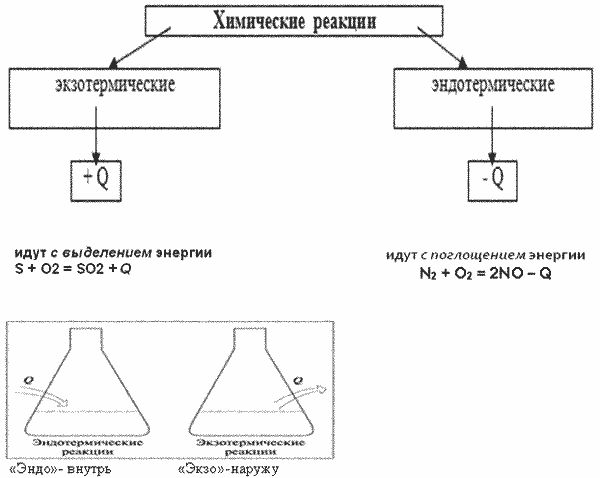
Причина теплового эффекта — разница внутренней энергии продуктов реакции и внутренней энергии реагентов.
(работа с учебником стр. 65 –определение )
3. Термохимия, термохимические уравнения.
Термохимия — раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
Кратко записать условия задачи (“дано”).
Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
Провести вспомогательные вычисления (корень квадратный, Мr, М, m).
Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
Записать ответ.
Пример задачи
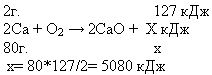
Ответ: 2Са + О2 —> 2СаО + 5080 кДж
Решение задач учениками.
1.
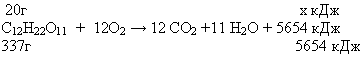
х= 20* 5654/337 = 38,81 кДж
Ответ: 38,81 кДж.
2. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
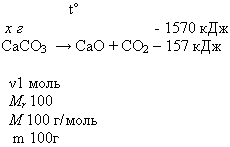
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 — 157 кДж —
х г СаСО3 — 1570 кДж
100г : 157 кДж = х г : 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV. Закрепление изученного материала
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
…. Это реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) горения;
в) эндотермические;
г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
г) H2 + O2 —> H2О + 572 кДж
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Установите соответствие между схемой реакции и её типом:
А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 – 572 кДж
1. Эндотермическая реакция
2. Экзотермическая реакция
5. Приведены уравнения реакций:
А. СаО + Н2О = Са(ОН)2
Б. 2HgO = 2Hg + O2
V. Итог по уроку:
— Как классифицируются реакции по тепловому эффекту?
— Что такое тепловой эффект реакции?
— Чем отличаются термохимические уравнения
VI. Д/з