Непредельные углеводороды. Алкины
Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
структурная формула
Н — С ≡ С — Н
или
электронная формула
Н:С:::С:Н
По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной σ — и двух π -связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль.
Номенклатура
Простейшим алкином является этин (ацетилен С2Н2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH-C- называется «этинил».
Гомологический ряд
Этин:C2H2 Пропин: C3H4 Бутин: C4H6 Пентин: C5H8 Гексин: C6H10 Гептин: C7H12 Октин: C8H14 Нонин: C9H16 Децин: C10H18
Изомерия
Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
(такая же как у алканов и алкенов)
З-метилбутин-1
Н — С ≡ С — СН2 — СН2 — СН3 пентин-1
Н3С — С ≡ С — СН2 — СН3 пентин-2
Алкины являются изомерами с алкадиенами.
Физические свойства алкинов
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
Плохо растворимы в воде.
Химические свойства
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, — в одинарную.
Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем — алканы:
HC ≡ CH + H2 → H2C = CH2 + H2 → H3C—CH3
ацетилен → этилен → этан
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
HC ≡ CH + Br2 → CHBr = CHBr + Br2 → CHBr2 — CHBr2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HC ≡ CH + HCl → H2C = CHCl → H3C — CHCl2
ацетилен → хлорэтен → 1,1-дихлорэтан
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
Образуется ацетальдегид в случае С2Н2 и кетоны — в случае гомологов ацетилена.
Катализатор — соль ртути: HgSO4
HC ≡ CH + HCN кат.→ H2C = CH — CN (акрилонитрил)
Акрилонитрил — ценный продукт. Он используется в качестве мономера для получения синтетического волокна — нитрон.
В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
HC ≡ CH + HO — C2H5KOH→ H2C = CH — O — C2H5 (этилвиниловый эфир)
Присоединение спиртов в присутствии алкоголятов — типичная реакция нуклеофильного присоединения.
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена — ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
d+ d- d- d+
H→C≡C←H
Образуются нерастворимые соли — ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
HC ≡ CH + 2CuCl → Cu — C ≡ C — Cu↓ + HCl
этин → ацетиленид меди(I) двузамещенный
CH3 — C ≡ CH + CuCl → CH3 — C ≡ C- Cu↓ + HCl
пропин → метилацетиленид меди (I)
Образование темно-красных осадков ацетиленидов меди — качественная реакция на этинильную группу, позволяющая отличить терминальные алкины от других непредельных углеводородов.
С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:
Н3С — СН2— С ≡ СН Na(спирт р-р)→ Н3С — С ≡ С — СН3
бутин-1 → бутин-2
Из винилацетилена присоединением HCl получают хлоропрен, при полимеризации которого образуется хлоропреновый каучук:
Полимеризация для алкинов малохарактерна.
Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается. Эта реакция является качественной на кратные (двойные и тройные) связи:
3НC ≡ СН + 10KMnO4 + 2H2O → 6CO2 + 10КОН + 10MnO2
Ацетилен горит коптящим пламенем.
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НС ≡ СН + 5O2 → 4СO2 + 2Н2O
При неполном сгорании образуется углерод (сажа):
НС ≡ СН + O2 → С + СО + Н2О
Способы получения
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C→ CaC2 + CO
СаС2 + 2Н2O → НС ≡ СН + Са(ОН)2
2СН41500°C→ НС ≡ СН + 3Н2
или этана:
С2Н61200°C→ НС ≡ СН + 2Н2
Из дигапогеналканов, содержащих атомы галогена у двух соседних атомов углерода, например:
Из дигалогеналканов, содержащих два атома галогена у одного атома углерода, например:
Качественные реакции
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди.
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии.
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применяют:
— для сварки и резки металлов;
— как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды;
— в производстве взрывчатых веществ ацетиленидов (соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод;
Ацетилениды тяжелых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом. Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag
— для получения уксусной кислоты, этилового спирта;
— для получения растворителей — индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов;
— для получения пластических масс — органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять после охлаждения или отвердения заданную форму. Процесс формования сопровождается переходом пластически деформируемого (вязкотекучего) состояния в стеклообразное состояние.
— для получения каучука — натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.
Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Алкины — номенклатура, получение, химические свойства » HimEge.ru
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле С
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π — связи. Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости л-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура алкинов
Для алкинов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений. Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства алкинов
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
1) p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2) Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2- 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н+.
Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли
Получение алкинов
Применение алкинов
Наибольшее практическое значение имеют ацетилен и винилацетилен. Ацетилен используется для получения самых разнообразных веществ: уксусной кислоты, поливинилхлорида, синтетического каучука. Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука.
Углеводороды с тройными связями — Справочник химика 21
Вот пример соединения, название которого не соответствует женевской номенклатуре. По ее правилам названия углеводородов с тройной связью должны были бы оканчиваться на ни . Обычно так оно и есть, И ацетилен надо бы называть этин , только его так никто не называет, и не будет называть, и ничего с этим уж не поделаешь. [c.48]Углеводороды с тройной связью могут быть и более и менее склонными к детонации, чем парафиновые углеводороды того же строения смещение тройной связи к центру молекулы ослабляет детонацию. [c.418]
Постройте модель молекулы углеводорода с тройной связью между атомами углерода (С С, или С=С). Это — модель вещества, относящегося к классу алкинов. Напишите структурные формулы этина, называемого обычно ацетиленом, и бутина 2. [c.215]
Избирательность адсорбции на цеолитах еще более резко выражена для углеводородов с тройной связью в молекуле, например ацетилена, особенно при низких концентрациях его в газе. При обычных производственных температурах (20° С) активность цеолитов в 2—3 раза выше активности угля СКТ. С повышением температуры разница в адсорбционной способности цеолитов и активированного угля еще более увеличивается, что является отличительной особенностью адсорбции на синтетических цеолитах колебания температур перерабатываемого газа не играют столь существенной роли, как в случае применения активированного угля. В незначительном числе случаев ацетилен приходится извлекать из смесей, содержащих этилен. Высокий коэффициент разделяющей способности цеолитов по смеси этилен — ацетилен указывает на возможность их применения для целей очистки этилена от примесей ацетилена. [c.113]
Существуют непредельные углеводороды с тройной связью. [c.11]
Ацетилен — единственный углеводород с тройной связью, который получают из нефтяного сырья в более или менее значительном количестве. При производстве дивинила пиролизом нефтяного сырья (гл. 12, стр. 215) в С4-фракции было обнаружено присутствие следов метил-, этил-, винил-ацетилена и высших алкилацетиленов. Из всех алкилацетиленов этилаце-тилен, по-видимому, содержится в наибольшем количестве (до 0,1 %). Больших концентраций вряд ли можно ожидать, поскольку для образования алкилацетиленов из более насыщенных углеводородов требуется такая высокая температура, которая влечет за собой почти полное разложение алкилацетиленов на ацетилен и другие простейшие углеводороды. Поэтому, если в будущем возникнет потребность в таких замещенных ацетиленах, их придется получать синтетически, а не разложением углеводородов нефти. [c.283]
К полимеризации склонны все ненасыщенные углеводороды, имеющие одну (олефины) или несколько двойных связей, углеводороды с тройными связями и др. [c.38]
АЛ КИНЫ — углеводороды с тройной связью, или ацетиленовые углеводороды (см. Ненасыщенные углеводороды). [c.16]
Непредельные углеводороды с тройной связью. [c.312]
Непредельные углеводороды с тройной связью. Алкины 312 [c.383]
Углеводороды с тройной связью содержат атомы углерода, связанные между собой тремя ковалентными связями [c.267]
Алкины — углеводороды с тройной связью с общей формулой С Н2я-2. Простейший алкин НС=СН, называемый этином или ацетиленом, широко используется в кислородно-ацетиленовых горелках, в которых пламя имеет очень высокую температуру (3200 К). Алкины, будучи ненасыщенными соединениями, обладают высокой реакционной способностью. Они легко вступают в реакцию присоединения, превращаясь в алкены или алканы и их производные, например [c.304]
Почти все лиганды обладают одной или несколькими неподеленными парами электронов (ЫНз, Н2О, Р , ОН ), и многие из них имеют к тому же вакантные орбитали для принятия л-связываю-щих электронов от металла по дативному механизму (СЫ , МОг , СО, РКз, где К — алкильная группа, и др.). Иногда роль лигандов играют молекулы, не содержащие неподеленных пар электронов, но имеющие электроны, участвующие в л-связи, например бензол, алкены (углеводороды с двойной связью) и алкины (углеводороды с тройной связью). [c.108]
Номенклатура ацетиленовых углеводородов. Женевская номенклатура. Ацетиленовые углеводороды называют по женевской номенклатуре так же, как предельные (стр. 48), с той лишь разницей, что наличие тройной связи обозначают путем замены в женевском названии предельного углеводорода окончания -ан на окончание -ш. Поэтому углеводороды с тройной связью по женевской номенклатуре и объединяют общим названием алкины. После окончания -ин в названии ставят цифру, соответствующую номеру углеродного атома в цепи молекулы, за которым следует тройная связь. Принцип нумерации атомов цепи такой же, как в случае этиленовых углеводородов (стр. 67). Таким образом, ацетиленовые углеводороды, формулы которых написаны выше, называют так (1) — бутин-1 и (2) — бутин-2. Углеводород строения [c.84]
Исходные в этих реакциях дигалогенпроизводные с атомами галогена при соседних атомах углерода могут быть получены присоединением галогенов к этиленовым углеводородам (стр. 69). Следовательно, углеводороды с двойной связью через дигалогенпроизводные могут быть превращены в ацетиленовые углеводороды (с тройной связью). [c.89]
Гидратация ацетиленовых углеводородов. Как было указано, присоединение воды к углеводородам с тройной связью (реакция Кучерова, стр. 86) приводит к образованию карбонильных соединений. Из ацетилена при этом образуется альдегид (уксусный), а из его гомологов получаются кетоны. [c.148]
Большое значение в промышленности имеет простейший углеводород с тройной связью — ацетилен. Для его получения сущест- [c.139]
Углеводороды с тройной связью, называемые ацетиленовыми углеводородами или алкинами, имеют общую формулу С Н5 -2. Названия составляются так же, как и у олефинов, но по рациональной номенклатуре за основу берется ацетилен, по международной номенклатуре окончание предельных углеводородов -ан заменяется на -ин [c.24]
Алкинами называются алифатические углеводороды с тройной связью С С. Их общая формула С Н2п-2. Названия алкинов получаются из названий алканов заменой окончания ан на ин . Некоторые члены гомологического ряда алкинов приводятся ниже. [c.593]
Углеводороды с тройной связью (алкины) 35. Строение ацетиленовых углеводородов и их получение. [c.90]
Простейшим представит
Непредельные углеводороды с тройными связями (алкины)
Ацетиленовыми углеводородами, или алкинами, называются непредельные углеводороды с открытой углеродной цепью, в молекулах которых между атомами углерода имеется одна тройная связь. Эти углеводороды отвечают общей формуле ряда С Н2п-2- [c.40]Непредельные углеводороды с двойной связью называют алкенами, с тройной — алкинами. В номенклатуре ИЮПАК их названия образуют от названий соответствующих алканов с заменой суффикса ан на -ен (этиленовые углеводороды) и на -ин (ацетиленовые углеводороды). Кратная связь обязательно включается в главную цепь. Нумерация цепи начинается с того конца, к которому ближе эта связь. Атомам углерода у Кратной связи отдается предпочтение даже в том случае, если другие насыщенные углеродные атомы имеют заместители [c.57]
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (алкины) — непредельные углеводороды с открытой цепью обш,ей формулы С Н2 2, в молекулах которых между атомами углерода имеется одна тройная связь. Простейшим представителем А. в. является ацетилен. [c.36]
Под формулами в скобках даны названия непредельных кислот по международной заместительной номенклатуре. Эти названия производятся как прилагательные от заместительного названия непредельного углеводорода с таким же углеродным скелетом (цифрой 1 обозначается углерод карбоксильной группы). Кислоты с одной двойной связью в цепи (производные алкенов) объединяют общим названием алкеновые кислоты, с двумя двойными связями (производные алкадиенов) — алкадиеновые кислоты, а содержащие тройную связь (прризводные алкинов) — алкиновые кислоты. [c.185]
Ал кины — непредельные углеводороды алифатического строения с тройной связью С = С. Общая формула алкинов nHzn-z- Наибольшее значение из углеводородов этого класса имеет ацетилен НС = СН. Связи между атомами у алкинов Н—С, С—С и С=С. [c.29]
Реакция окисления. Алкины окисляются еще легче, чем алкены, и обычно с распадом молекулы по месту тройной связи. Фиолетовая окраска раствора перманганата калия КМПО4 при действии его на ацетиленовые углеводороды быстро исчезает, что служит качественной реакцией на эти непредельные соединения. [c.90]
IV. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ С ТРОЙНОЙ СВЯЗЬЮ (АЛКИНЫ, ИЛИ АЦЕТИЛЕНЫ) [c.288]
Непредельные углеводороды ряда ацетилена (алкины) со-j epжaт тройную связь С=С. Общая формула гомологического ряда алкинов С Н2 2. Простейший углеводород этого ряда С2Н2 носит название ацетилена (бесцветный газ). [c.207]
Непредельные углеводороды (алкены, алкины). Выбор главной цепи и ее нумерация определяются прежде всего наличием и положением алкильных групп, как это указано для алканов. Если это не определяет выбор главной цепи или начало нумерации, то в главную цепь включают участок с кратной связью и нумерацию ведут с того конца, к которому ближе кратная связь. При равных положениях двойной и тройной связи выбор главной цепи и начало нумерации определяет тройная связь. [c.18]
В настоящем обзоре систематизированы реакции, представляющие собой наиболее важные методы синтеза алкинов и алкадиинов. Эти методы можно разделить на две основные группы ппринципу первая группа включает те методы получения алкинов и алкадиинов, которые характеризуются тем, что тройная связь вводится в заранее синтезируемое предельное или непредельное (с двойной связью) соединение отщеплением от него галоидоводорода или галоида вторая группа включает прямой синтез алкинов и алкадиинов, в котором сами компоненты реакции являются соединениями, содержащими тройную связь. Специфическим методом получения ацетиленовых углеводородов является окисление дигидразонов а-дикетонов окисью ртути. [c.9]
Непредельные углеводороды с тройной связью. Алкины 312 [c.383]
Для ацетиленовых углеводородов характерны реакции элек-трофилъного присоединения (Вгз, Н2, ННа1, Н2О), многие из которых могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения к несимметричным ацетиленовым углеводородам протекают по правилу Марковникова. Многие реакции присоединения протекают в присутствии катализаторов. Так, присоединение воды к алкинам (реакция Кучерова) происходит в присутствии солей ртути (II) в кислой среде. На первой стадии реакции образуется непредельный спирт, в котором группа —ОН находится у атома углерода при двойной связи. Такие спирты неустойчивы, и в момент образования они изомеризуются в более стабильные карбонильные соединения (ацетальдегид или кетоны). [c.307]
Ответ. Непредельными называют углеводороды, молекулы которых содержат кратные (двойные или тройные) связи. Общая формула углеводородов, содержащих одну двойную связь (алке-нов), — С Н2 . Общая формула углеводородов с двумя двойными связями (диенов) — С Н2 2- Такую же формулу имеют углеводороды с одной тройной связью (алкины). [c.21]
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов [c.327]
А. с водой в присутствии солей ртути и других катализаторов образует уксусный альдегид (реакция Кучерова). При сжигании А. выделяется большое количество теплоты. А. может полимеризироваться в бензол и другие органические соединения. В промышленности А. получают действием воды на карбид кальция (Ф. Велер, 1862 г.), а также при крекинге метана. А. используют для сварки и резки металлов, для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов. Ацетиленовые углеводороды (алкины) СлНгл—2 — непредельные углеводородное открытой цепью, в молекулах которых между атомами углерода имеется одна тройная связь. [c.22]
При sp-гибридизации у атома углерода возникают две гибридные орбитали под углом 180° относительно друг друга и сохраняются две негибридные р-орбитали, расположенные под углом 90° друг к другу. Атом углерода образует две ст-связи с атомом углерода и (или) с атомом водорода и две л-связи с атомом углерода. В результате образуется алкин — непредельный углеводород с тройной связью. [c.303]
Непредельные углеводороды — соединения с кратными (двойными или тройными) связями в молекулах олефины, ил
Двойные и тройные связи атомов углерода
|
|
Если от молекулы метана отнять два атома водорода, то получится остаток, или радикал, метилен=СН2. Этот радикал двухвалентен, так как он может, соответственно валентности углерода, присоединить два атома водорода или иного одновалентного элемента. Поэтому вполне естественно предположить, что два метилена, соединившись друг с другом, могут образовать молекулу. Строение вещества этилена С2Н4, представляющего собой два связанных друг с другом метилена, выражается формулой СН2=СН2. Такая формула означает, что в молекуле этого вещества атомы углерода связаны между собой двумя валентностями. Поэтому такая связь называется двойной связью, в отличие от простой, или ординарной, связи. Путем таких же рассуждений, которые применялись для вывода гомологического ряда метана, т. е. последовательным замещением атомов водорода на метил, можно вывести другой гомологический ряд — ряд гомологов этилена. Второй член этого ряда С3Н6 будет иметь строение СН3—СН=СН2, а третий C4H8 уже может’существовать в трех изомерных формах: Весь жегомологический ряд этилена будет иметь состав, выражаемый общей формулой СnН2n . Аналогичным образом, соединяя два трехатомных остатка ≡СН (метин),получаем соединение С2Н2, называемое ацетиленом, которому обычно придается строение СН≡СН с тройной связью между атомами углерода. Замещением в ацетилене ато-ма водорода на метил получается его первый гомолог СН3—С≡СН и далее новый гомологический ряд углеводородов, имеющих общий состав CnH2n-2. Каждый из этих гомологических рядов, как и ряд метана, может быть мысленно продолжен до бесконечности, причем для высших гомологов возможна изомерия; число возможных изомеров с увеличением числа атомов в молекуле все увеличивается и в пределе может дойти до бесконечности. В цепи из трех атомов углерода каждый атом углерода может быть соединен с другими атомами углерода двойной связью. Присоединяя необходимое для удовлетворения валентности углерода число атомов водорода, получим углеводород С3Н4 строения СН2=С=СН2, от которого также можно вывести бесконечный гомологический ряд с возрастающим до бесконечности числом изомеров. Этот гомологический ряд будет иметь общую формулу CnH2n-2 тождественную формуле гомологов ацетилена. Сочетая в молекуле двойную и тройную связь, можно полупить углеводород строения СН2=СН—С≡СН и от него гомологический ряд CnH2n-4, при двух тройных связях — углеводород строения СН≡С—С≡СН и его гомологический ряд общей формулы СnH2n-6. Сочетая в более длинных цепях три двойные связи, получим второй гомологический ряд формулы CnH2n-4; при четырех двойных связях — второй гомологический ряд формулы CnH2n-6 и сочетанием еще большего числа двойных и тройных связей — гомологические ряды CnH2n-8, CnH2n-10 и т. д. со все меньшим и меньшим числом атомов водорода при разном числе атомов углерода. Предыдущая страница | Сдедующая страница СОДЕРЖАНИЕ Еще по теме: |
Углеводороды только с одинарными связями между атомами углерода называются насыщенными, или предельными
Общая химическая формула алканов имеет вид
СnН2n+2 , где n — Целое число.
Алканы не взаимодействуют между собой и не растворяются в воде. При высокой температуре и под действием ультрафиолетового излучения они вступают в реакцию с хлором и бромом с образованием галогенных углеводородов.
Хлоропроизводные метана широко используются в промышленности. Хлорметан — газ, который легко сжижается и при последующем испарении поглощает значительное количество теплоты. Этот газ получил широкое применение в холодильных установках.
Алкены. Следующей важной группой углеводородов, которые не встречаются в природе в свободном состоянии, но могут быть получены из нефти в процессе крекинга, являются алкены. Все названия непредельных углеводородов ряда этилена оканчиваются суффиксом ен.
|Алкенами называют непредельные углеводороды, которые содержат одну двойную связь меяду атомами углерода, т. е. количество атомов водорода в составе непредельных углеводородов всегда меньше, чем в предельных.
Общая формула алкенов СnН2n, где n — целое число. Простейший из алкенов — этилен (этен):
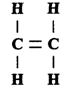
Двойная связь между атомами углерода непрочная, поэтому алкены химически более активны, чем алканы. Как и алканы, алкены образуют целый ряд изомеров, причем такие изомеры отличаются как структурой молекулы, так и расположением двойной связи между атомами углерода, а также пространственным расположением атомов элементов. Из-за наличия двойных связей алкены могут присоединять еще один атом водорода и поэтому могут вступать в реакцию с алканами.
| Углеводороды, содержащие одну или несколько двойных или тройных связей между б атомами углерода, называются непредельными, или ненасыщенными.
Алкадиеиы также являются ненасыщенными углеводородами и содержат в составе молекулы две двойные связи между атомами углерода. Названия диеновых углеводородов образуются от соответствующих названий предельных углеводородов с суффиксомдиен. Общая формула диеновых углеводородов СnHn+2.
Так же как и все остальные углеводороды, алкадиены образуют изомеры, начиная с 5-го атома углерода. Изомеры, образующиеся при этом, различаются по скелетному расположению атомов углерода, расположению двойных связей и ориентации элементов молекулы в пространстве. Простейшим представителем диеновых углеводородов являетсябутадиен: С4Н6, структура которого имеет вид

Большинство алкадиенов используются как сырье для получения синтетических пластмасс, в частности, бутадиен — для получения синтетического каучука.
Алкины, или, как их еще называют, ацетиленовые углеводороды также являются непредельными углеводородами и содержат в структурной формуле молекул одну тройную связь между атомами углерода.
Все названия непредельных углеводородов ряда ацетилена оканчиваются суффиксомин. Общая формула для алкинов СnН2n-2, т. е. точно такая же, как и для алкадиенов.
Простейшими представителями этой группы являются
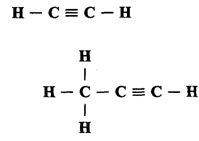 ацетилен (этан) СН ≡ СН и
ацетилен (этан) СН ≡ СН и
пропин СНз – С ≡ СН
Характерными реакциями являются реакции присоединения, окисления и полимеризации. При взаимодействии ацетилена с соляной кислотой (НСl) образуется винилхлоридмономер (VCM), который может полимеризовываться в поливинилхлорид. Данный продукт широко используется для получения пластмасс.
Винилхлорид (хлорвинил, хлорэтилен) используется при изготовлении диэлектрических пластмасс, искусственной кожи и т. д.
Циклоалканы. Некоторые молекулы предельных углеводородов могут соединяться таким образом, что каждый из атомов углерода в молекуле будет иметь по две свободные валентные связи. В таком случае молекулы углеводородов имеют цикличную (замкнутую) форму.
Названия циклопарафинов образуются от соответствующих названий предельных углеводородов с добавлением префиксацикло-. Простейшие представители циклопарафинов — циклопропан и циклобутан, однако наиболее часто встречаются циклопарафины более высокого порядка, например циклопентан или циклогексан. Общая химическая формула циклоалканов выглядит следующим образом: Сnh3n.
Структурное строение молекулы можно представить на примере циклопропана:
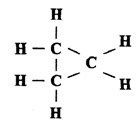
В подавляющем большинстве циклопарафины нашли применение как растворители в химической промышленности и в медицине. Чаще всего используются галогенопроизводные циклопарафинов.
Ароматические углеводороды. Если молекула углеводорода содержит более трех атомов углерода, то они могут объединяться, образуя соединения ‘ в форме бензольного кольца. Углеводороды, молекулы которых содержат бен-зольные кольца, называются цикличными, или ароматическими, углеводородами. Общая формула для этих углеводородов Сnh3n-6
.
Простейшие представители этой группы:  бензол C 6H6 и толуол С6H5 -СНз.
бензол C 6H6 и толуол С6H5 -СНз.
Изомерия в ряду бензола обусловлена взаимным расположением органических радикалов в ядре (метильной группы СНз). При этом образуются 3 изомера, расположение заместителей в которых указывается приставкамиорто-, мета- и пара-.
Шесть атомов углерода образуют правильный шестиугольник. Бензольные кольца обычно очень устойчивы и являются составной частью больших молекул. Характерными реакциями для аренов являются реакции замещения.
Связь тройная углеродная — Справочник химика 21
Простейший представитель ряда алкинов — ацетилен СгНа- Тот же подход, что был использован при построении этилена (разд. 5.2), приводит к строению, в котором атомы углерода имеют три общие электронные пары, т. е. связаны тройной связью. Тройная углерод-углеродная связь является отличительной особенностью строения алкинов. [c.228]К структурной изомерии относят также изомерию положения двойной и тройной связи в углеродной цепи, изомерию положения функциональных групп. [c.252]
Наименьшее число валентных электронов у атома, необходимое для создания цепи, равно двум. Атом углерода обладает четырьмя электронами и поэтому цепи из его атомов могут стать элементом плоской, или трехмерной, конструкции практически неограниченных размеров. Углерод образует также кратные — двойные и тройные — связи цепи углеродных атомов часто замыкаются в циклы, способные, в свою очередь, вступать в реакции конденсации друг с другом или присоединять длинные боковые цепи. Во многих случаях п-связи в углеродсодержащих молекулах объединяются в [c.160]
При образовании кратных связей состояние углеродного атома существенно изменяется и изменяется различно в случае двойных н тройных связей. Известно, что кратные связи образуются с выделением большего количества энергии. Атомы углерода, связанные кратной связью, располагаются на более близком расстоянии в образовании этих связей принимают участие электроны, легче [c.66]
Единственный невзрывчатый ацетиленид — карбид кальция. Его молекула содержит два атома углерода, связанные между собой тройной связью, а остальные связи обоих углеродных атомов присоединены к одному и тому же атому кальция. (Кальций — это металл серебристого цвета его атомы входят в состав известняка и костей. Вещества, содержащие кальций, широко распространены в природе.) [c.49]
По характеру связи между углеродными атомами различают углеводороды с ординарными связями, в которых все атомы углерода связаны одной ковалентной связью, и углеводороды с кратными (двойными или тройными) связями, в углеводородах с двойными связями два углеродных атома связаны между собой двумя ковалентными связями. Простейшим из этих углеводородов является этилен [c.266]
НЫХ восстанавливающих агентов (природа которых связана с природой замедленной стадии выделения водорода на данном металле) позволяет истолковать значительное число опытных данных. В частности, она дает возможность объяснить существование избирательного электровосстановления (см. табл. 21.1). По-видимому, восстановление органических соединений на платиновых и никелевых катодах совершается за счет адсорбированных атомов водорода, присоединяющихся к неполярным связям (типа двойных или тройных связей) между углеродными атомами. На катодах из ртути и свинца восстановление совершается за счет ионов водорода, присоединяющихся с большей легкостью к отрицательным полярным группам (типа карбонильных или карбоксильных групп). [c.441]
Таким образом, тройная связь в молекуле ацетилена складывается из одной а- и двух я-связей. Тройная связь прочнее двойной, а расстояние между углеродными атомами в ацетилене меньше, чем в этилене. [c.328]
По характеру связей между углеродными атомами органические соединения подразделяются на 1) предельные — соединения, в которых атомы углерода связаны между собой только простыми связями, и 2) непредельные — соединения, в которых имеются между атомами углерода кратные, т. е. двойные или тройные связи. [c.74]
В молекулах с тройными и кумулированными двойными связями, где углеродный атом имеет двух соседей, он образует ст-связи с помощью. / -гибридных АО. Кроме того, возникают две л-связи с электронными облаками, ориентированными во взаимно перпендикулярных плоскостях (рис. 10.16). Особенно интересная ситуация возникает [c.392]
Они имеют более сложное электронное строение. Тройная связь представляет собой сочетание о-связи и двух простых тг-связей, локализованных в одном межъядерном пространстве. Алкины вносят в химию углеводородов по сравнению с алкенами новые свойства, такие как миграция кратной связи вдоль углеродной цепи [c.315]
Ненасыщенные углеводороды легко присоединяют галогены, кислород, кислоты и т. п. В молекулах ненасыщенных углеводородов имеются кратные двойные или тройные связи между углеродными атомами в них, помимо о-связи, имеется одна или две я-связи таковы Н2С = СН2 — этилен НС = СН — ацетилен и т. д. [c.465]
Углеводородами ряда ацетилена или ацетиленовыми углеводородами называют непредельные углеводороды, в молекулах которых имеется тройная связь между углеродными атомами, т. е. группировка, [c.83]
Характерная особенность непредельных углеводородов — наличие в их молекулах кратных связей между углеродными атомами — двойных п тройных. Атомы углерода, участвующие в образовании кратных связей, находятся в особых состояниях гибридизации (см. 1.12). [c.244]
При образовании тройной связи между углеродными атомами — (а + 2я)-связи — в гомологическом ряду непредельных углеводородов типа ацетилена увеличивается энергия связи и уменьщается расстояние между атомами С (0,12 нм). [c.444]
| Рис. 8.3. Молекула ацетиле- Рис. 8.4. Молекула ацетилена тройная углеродна перекрывание р-орбиталей углеродная связь. п-Облако имеет цилиндрическую дает две л-связи. форму. |