Примеры компетентностных заданий по теме «Способы изменения внутренней энергии»
Примеры компетентностных заданий
по теме «Способы изменения внутренней энергии»
Автор-составитель: Громова М.Н.
(для учащихся 8 класса, учебник: Физика. 8 класс.: учеб. для общеобразоват. учреждений/Н.С.Пурышева, Н.Е.Важеевская. – 4-е изд., стереотип. – М.: Дрофа, 2008. – 255 с.: ил.)
Ознакомление:
Прочитайте параграф 24, составьте план.
Назовите известные вам способы изменения внутренней энергии.
Сгруппируйте все известные вам способы изменения внутренней энергии по параметру «(не) совершение работы над телом или самим телом».
Вспомните и запишите определение теплопередачи (теплопроводности, конвекции, излучения).

Используя знания, полученные при изучении параграфов 24-27, составьте список понятий, относящихся к способу изменения внутренней энергии без совершения работы над телом или самим телом.
Изложите в форме текста понятия теплопроводности (конвекции, излучения).
Расположите вещества в порядке от малой к более хорошей (от наибольшей к наименьшей) теплопроводности: газ, твердое тело, жидкость.
Понимание:
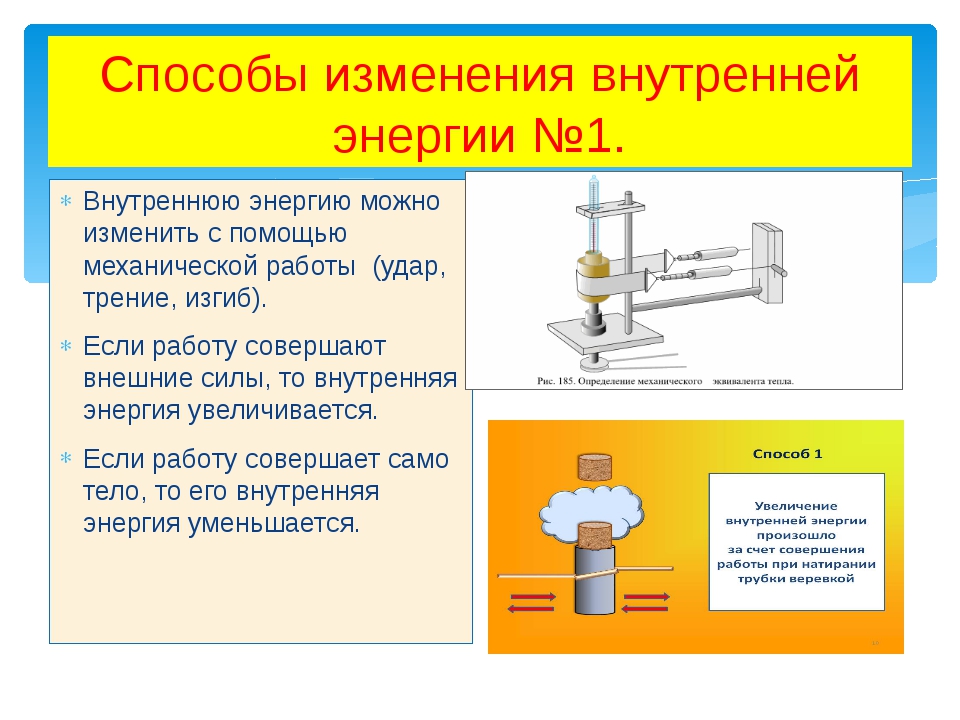
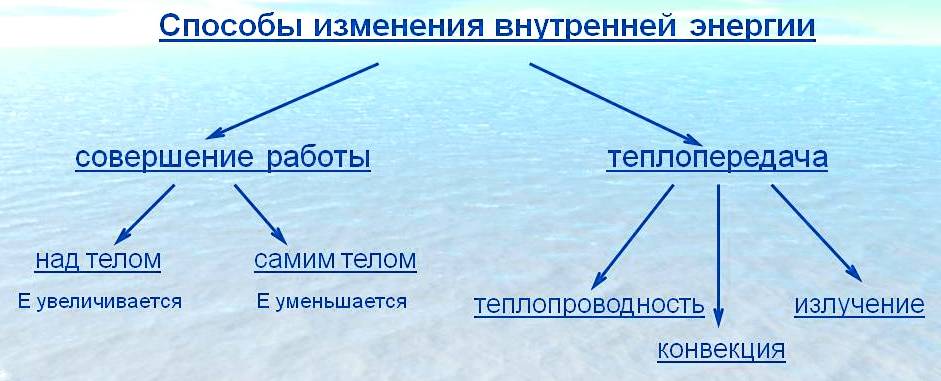
Объясните причину увеличения внутренней энергии при совершении работы над телом (уменьшения внутренней энергии при совершении работы самим телом).
Объясните малую (большую) теплопроводность газов (твердых тел).
Покажите связи, которые существует между явлениями теплопроводность, конвекция, излучения.
Прокомментируйте положение о том, что разные вещества обладают разной теплопроводностью.

Прокомментируйте положение о том, что конвекция связана с переносом вещества.
Приведите примеры, иллюстрирующие разную теплопроводность различных веществ.
Расположите вещества в порядке от малой к более хорошей (от наибольшей к наименьшей) теплопроводности: вата, сухая пробка, алюминий.
Применение:
Сделайте эскиз схемы, на котором изобразите способы изменения внутренней энергии.
Объясните назначение двойных оконных рам. Почему двойные оконные рамы лучше сохраняют тепло в наших домах?
В прошлом году в некоторых регионах страны выпало снега ниже нормы. Может ли это повлиять на урожай озимых посевов? Если может, то как?
Какой кирпич (пористый или сплошной) вы рекомендуете выбрать в северных регионах страны при строительстве зданий для обеспечения лучшей теплоизоляции? Почему?
В районах разлива нефти в зимние морозы находят погибших птиц и животных.
 С чем это связано? Какую роль при этом играет теплопроводность меха, пера, подкожного жира?
С чем это связано? Какую роль при этом играет теплопроводность меха, пера, подкожного жира?Объясните, почему стеклянный баллон электрической лампочки нагревается сильнее в том случае, когда он загрязнен, покрыт пылью или копотью.
В сезоне «осень-зима» дизайнеры предложили модели клатчей достаточно маленьких размеров. Среди основных цветов можно назвать черный, оранжевый, бежевый и коричневый. Какие вы порекомендуете выбрать цвета для жителей северных регионов? Почему?
Анализ:
- Раскройте особенности видов теплопередач (теплопроводности, конвекции, излучения).
Объясните механизм передачи энергии путем теплопроводности в твердом, жидком и газообразном состоянии вещества.
Сравните механизм конвекции и теплопроводности.
Найдите в тексте доказательство того, что тела обладают внутренней энергией и могут ее изменять.

Постройте классификацию видов теплопередачи на основе молекулярно-кинетической теории строения вещества.
Сравните теплопроводность газов, жидкостей и твердых тел и объясните причину ее различия.
Сравните излучение и поглощение энергии светлыми и темными поверхностями тел.
Синтез:
Составьте кроссворд (ребус) по теме «Способы изменения внутренней энергии».
Подберите фрагменты из литературных произведений, в которых приводятся примеры разных видов теплопередачи. Оформите в электронном виде (по возможности).
У вашего знакомого нет холодильника, а ему нужно сохранить как можно дольше замороженные продукты. Предложите различные способы хранения продуктов.
 Принимаются все идеи!
Принимаются все идеи!Придумайте проекты теплоизоляции зданий, построенных в тундре и лесопосадочной зоне. Подготовьте проект к защите на следующий урок.
Соберите и оформите в виде презентации (реферата) материал по теме «Теплопередача в природе и технике».
Сочините сказку по теме «Путешествие в страну ТеКоИз».
Оценка:
Наука не стоит на месте, и постоянно появляются изобретения, способные значительно облегчить нашу жизнь. Такие изобретения пополняют и коллекцию кухонной техники. В число недавно появившейся техники, способной облегчить нашу жизнь и сделать ее комфортнее входит термопот. Термопот – это своеобразный гибрид чайника и термоса. Это японское изобретение позволяет кипятить воду и сохранять ее горячей в течение суток, а некоторые модели и неограниченное количество времени. Это позволяет не только в любой момент получить горячую воду, но и сэкономить электроэнергию, так как не нужно будет кипятить ее снова и снова.
 Температура воды в термопоте остается на уровне 95-98 градусов в течение пяти-шести часов после кипячения, а после – около 80 градусов. Назовите преимущества и недостатки использования термопотов в быту. Объясните явления, позволяющие сохранять воду горячей длительное время.
Температура воды в термопоте остается на уровне 95-98 градусов в течение пяти-шести часов после кипячения, а после – около 80 градусов. Назовите преимущества и недостатки использования термопотов в быту. Объясните явления, позволяющие сохранять воду горячей длительное время.Отечественный производитель чайников «Фея» (Воткинск) предлагает чайники емкостью от 1,7 л до 2,5 л. Материал корпуса: у одних — пластик голубоватого цвета, у других — светлый блестящий металл. Остальные характеристики одинаковые. Оцените, в каком из чайников вода дольше не остывает.
Для изготовления теплиц, парников и зимних садов используют разные материалы: стекло, поликарбонат, акрил, полиэтиленовую пленку.
Стекло используют чаще других материалов, прежде всего, из-за его прозрачности: стекло хорошего качества пропускает до 90 % солнечного света. Кроме того, стекло неплохо удерживает тепло: даже в морозную погоду в необогреваемой остекленной теплице температура будет примерно на4°С выше, чем снаружи.
Поликарбонат — восходящая звезда среди заменителей стекла; благодаря своей легкости и прочности поликарбонат стал самым распространенным материалом для крыш зимних садов. Чаще всего используют сотовый поликарбонат, который обладает более низкой по сравнению со стеклом теплопроводностью и рассеивает свет, при этом пропуская до 80 % света.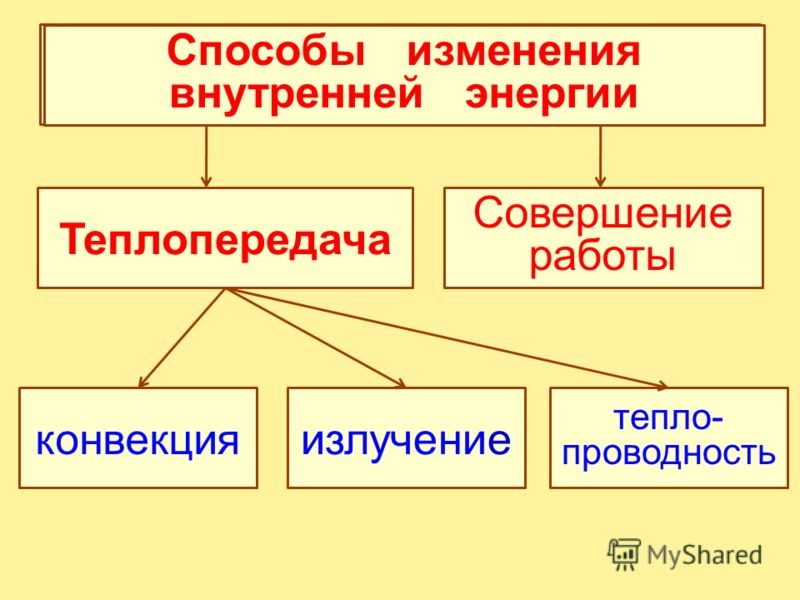
Акрил — листы толщиной 2 мм и 2,5 мм по светопроводности практически не уступают стеклу. Это не такой прочный материал, как поликарбонат, а служит примерно столько же (минимум 12-15 лет). Его легко согнуть, благодаря чему акрил применяют при изготовлении объемных сводчатых элементов зимних садов. Акрил режут ножовкой и сверлят в нем отверстия ручной (не электрической!) дрелью, предварительно наметив линии отреза и места для просверливания отверстий на защитной полиэтиленовой пленке. Неровные края обрабатывают наждачной бумагой, после чего защитную пленку снимают.
Полиэтиленовую пленку используют в виде покрытия туннельных парников и для утепления застекленных теплиц. Это самый популярный материал для покрытия парников. Современные типы пленки доступны по цене, устойчивы к солнечному свету и служат три-четыре сезона. К сожалению, пленка плохо держит тепло и рвется при сильном ветре.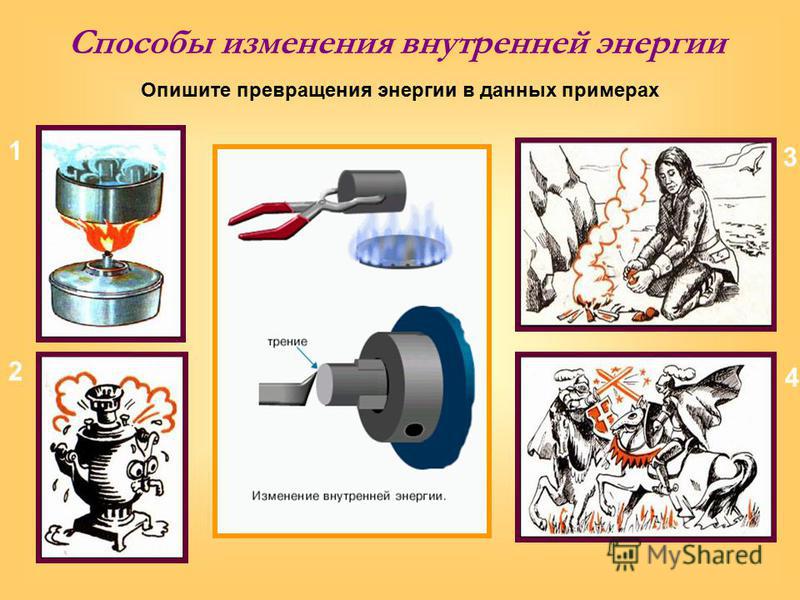
Оцените плюсы и минусы этих материалов для изготовлении теплиц, парников, зимних садов с позиции инженера-технолога теплоизоляционных материалов.
«Мы готовы изготовить для Вас теплицы из сотового поликарбоната по индивидуальным размерам…Теплицы обладают следующими положительными характеристиками:
хорошая светопроводность;
теплопроводность;
надежность;
легкий вес;
невысокая цена.
…Город, где производятся наши теплицы, — Березовский ХМАО. Приобретая теплицы из поликарбоната у производителя, вы можете быть уверены, что покупаете товар по оптимальной цене…Города, где можно приобрести наши теплицы, — Екатеринбург, Березовский, Сургут, Нижневартовск и другие города Свердловской области и ХМАО».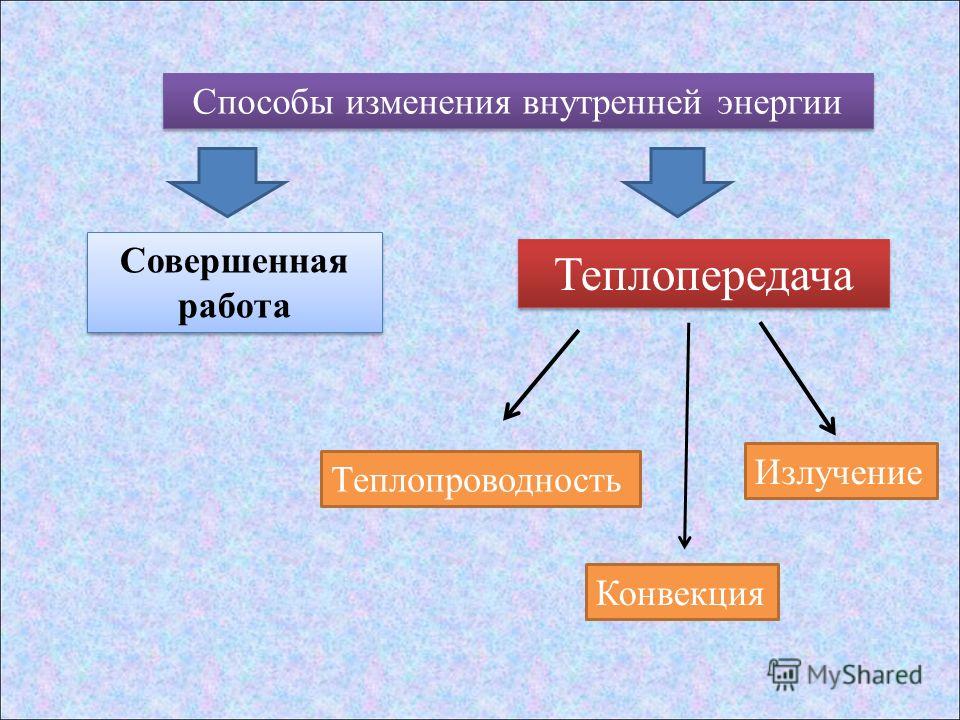 http://www.сталь-технологии.рф/sad/hothouses/
http://www.сталь-технологии.рф/sad/hothouses/
Определите, все ли тепловые явления, лежащие в основе действия теплиц из сотового поликарбоната, перечислены в положительных характеристиках. Если нет, то укажите их и опишите принцип действия парников и теплиц.
PS: Сотовый поликарбонат — высококачественный прозрачный пластик с неограниченной сферой применения. Он представляет собой пустотелый полимерный лист с внутренней многослойной структурой, заполненной продольными перемычками — ребрами жесткости. http://www.teskom.ru/contents.asp?id=228
«Шуба из бобра – для практичных женщин. Красивые, уютные, тёплые и износостойкие шубы из стриженого бобра — это лучшее сочетание легкости, красоты и практичности в одной одежде. В такой шубе можно не бояться влаги, они отлично подходят для тех, кто не переносит зимних морозов и в поисках одежды, которая и согреет и позволит выглядеть превосходно».
 http://bigcost.ru/moda-i-krasota/skolko-stoit-shuba-iz-bobra.html
http://bigcost.ru/moda-i-krasota/skolko-stoit-shuba-iz-bobra.html
«Особо стоит сказать о виде меха. Наиболее теплые шубы из меха лисы, соболя и мутона. Затем идут шубки из песца, бобра, норки, енота, котика, шиншиллы, нутрии, каракульчи. Самые холодные – это изделия из меха горностая и сурка. И еще пара полезных советов:
— стриженый мех это конечно интересно, но не практично, он греет намного хуже;
— …опасайтесь подделок. Нутрию выдают за бобровый мех, но у нее коротка ость и совсем негустой подпушек, а мех бобра очень густой, плотный и пушистый». http://lady.webnice.ru/beauty/?act=article&v=198
«Будущей зимой 2012 года возвращается мода на бобра, и это не удивительно – мягкий, пушистый и очень теплый мех ценился на Руси с давних времен. Струящийся мех, переливающийся на солнце, смотрится дорого и роскошно. Бобер – идеальный вариант для российских морозных зим. Все прочие меха после дождя и снегопада выглядят плачевно, а бобровый мех от влаги оживает, становится еще более красивым и пушистым, потому что бобры живут в воде. Шубки из бобра очень легкие, уютные, их так приятно носить – не страшны ни ветра, ни 40-градусные морозы, ни проливные дожди». http://furfest.ru/index.php?option=com_content&view=article&id=4:novost-2&catid=1:novosti&Itemid=3
Шубки из бобра очень легкие, уютные, их так приятно носить – не страшны ни ветра, ни 40-градусные морозы, ни проливные дожди». http://furfest.ru/index.php?option=com_content&view=article&id=4:novost-2&catid=1:novosti&Itemid=3
Какой точки зрения (первой, второй или третьей) вы придерживаетесь. Почему? Какую шубу вы посоветовали бы приобрести своим знакомым? Объясните с точки зрения знаний, полученных при изучении видов теплопередач.
«Свет оказывает на живые организмы смешанное влияние: лучи красной части спектра обеспечивают тепловое действие, синей и фиолетовой частей — химическое. Температуру тела хорошо сохраняет густой волосяной покров, а различная скульптура кожных покровов (бугорки, шипики, гребни) способствует усилению теплоотдачи. Окраска покровов тела имеет огромное значение в регулировании температуры тела насекомого. В прохладном и влажном климате насекомые имеют обычно темную окраску (черная, коричневая или темно-серая), в сухом и жарком — более светлую (белая, желтая, оранжевая, светло-серая).
 Серебристые или золотистые волоски усиливают отражение сильных потоков лучей. Экспериментально доказано, что светлая форма поглощает больше тепла и меньше влаги, а темная (например, у озимой совки) при более низких температурах — меньше, что объясняет явление сезонного диморфизма». http://insects-world.org.ru/page6.php
Серебристые или золотистые волоски усиливают отражение сильных потоков лучей. Экспериментально доказано, что светлая форма поглощает больше тепла и меньше влаги, а темная (например, у озимой совки) при более низких температурах — меньше, что объясняет явление сезонного диморфизма». http://insects-world.org.ru/page6.php
Оцените значимость на живые организмы процессов, в основе которых лежат явления молекулярно-кинетической теории (теплопроводность, конвекция, излучение).
«Чтобы продемонстрировать свою готовность к решительным действиям в борьбе за самку, кузнечики-хамелеоны меняют цвет с чёрного на бирюзовый. Смена происходит в дневное время суток, и чем интенсивнее «боевая раскраска», тем агрессивнее самец. Многие животные в течение жизни обретают новый цвет (например, становясь взрослыми или повинуясь меняющимся условиям среды), но далеко не все способны проделывать это быстро и обратимо. Самые выдающиеся примеры — хамелеон и каракатица.
 Среди насекомых, похоже, единственным видом, который обладает такой способностью, является кузнечик-хамелеон Kosciuscola tristis, обитающий в Австралийских Альпах. Когда температура вокруг превышает 10 ˚C, кузнечик начинает менять цвет с чёрного на бирюзовый — и полностью перекрашивается при 25 ˚C. Объяснение у всего этого, казалось бы, простое: терморегуляция. В холод кузнечику нужно поглощать больше тепла и дольше оставаться активным в вечернее время, а при повышении температуры, наоборот, защищаться от перегрева, отражая часть солнечного света. К таким резким изменениям окраски способны только самцы». http://science.compulenta.ru/618010/
Среди насекомых, похоже, единственным видом, который обладает такой способностью, является кузнечик-хамелеон Kosciuscola tristis, обитающий в Австралийских Альпах. Когда температура вокруг превышает 10 ˚C, кузнечик начинает менять цвет с чёрного на бирюзовый — и полностью перекрашивается при 25 ˚C. Объяснение у всего этого, казалось бы, простое: терморегуляция. В холод кузнечику нужно поглощать больше тепла и дольше оставаться активным в вечернее время, а при повышении температуры, наоборот, защищаться от перегрева, отражая часть солнечного света. К таким резким изменениям окраски способны только самцы». http://science.compulenta.ru/618010/
Согласны ли вы с предложенным объяснением? О каких видах теплопередачи идет речь? Приведите примеры, доказывающие, что температура окружающей среды связана с цветом живого объекта, изменением состояния волосяного покрова.
Громова Марина Николаевна, учитель физики
Муниципальное общеобразовательное учреждение «Лянторская средняя общеобразовательная школа №3»
Внутренняя энергия тела и способы её изменения
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!
Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!Список вопросов теста
Вопрос 1
Внутренняя энергия — это
Варианты ответов
- сумма кинетической энергии теплового движения частиц, из которых состоит тело, и потенциальной энергии их взаимодействия.

- разность между кинетической энергии теплового движения частиц, из которых состоит тело, и потенциальной энергии их взаимодействия.
- сумма кинетической энергии тела и его потенциальной энергии.
- такой энергии не существует
Вопрос 2
Внутренняя энергия тела зависит от
Варианты ответов
- температуры тела
- агрегатного состояния вещества
- массы тела
- расположения молекул в теле
- скорости движения тела
Вопрос 3
Внутренняя энергия тела не зависит:
Варианты ответов
- от его механического движения.

- от его взаимодействия с другими телами.
- от температуры тела.
- от скорости движения молекул в теле.
Вопрос 4
Может ли у тела отсутствовать внутренняя энергия? В ответе запишите да или нет.
Вопрос 5
Сопоставьте утверждения и их истинность.
Варианты ответов
- внутренняя энергия тела не изменяется при совершении работы;
- если тело совершает работу, то его внутренняя энергия уменьшается;
- если тело совершает работу, то его внутренняя энергия увеличивается;
- если над телом совершается работа, то его внутренняя энергия увеличивается.
Вопрос 6
Это способ изменения внутренней энергии тела, при котором энергия передаётся от одной части тела к другой или от одного тела к другому без совершения работы.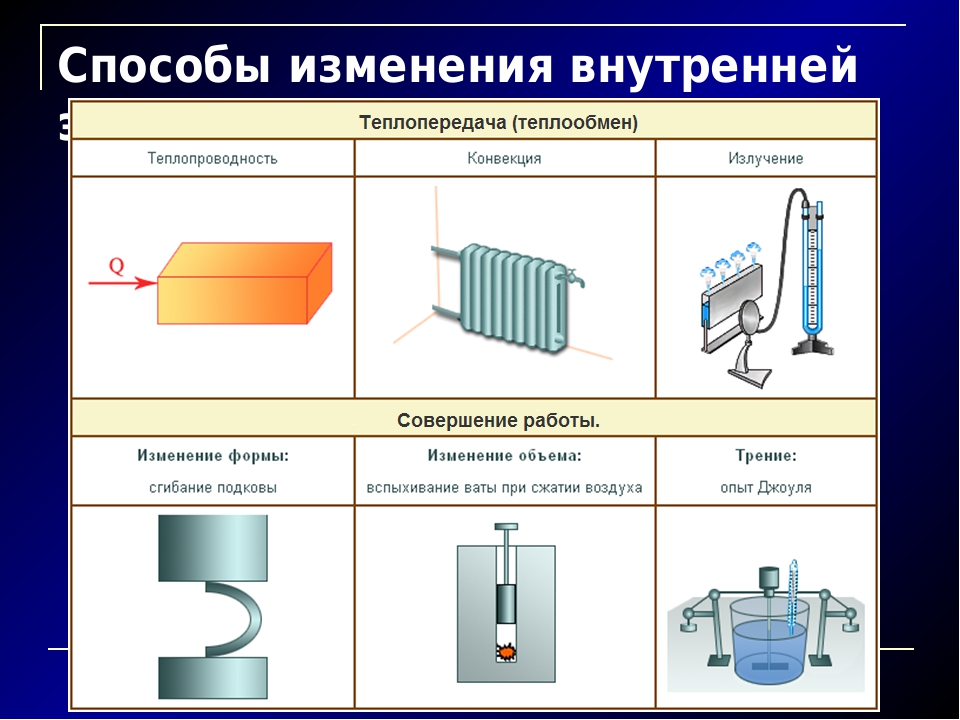 В ответе запишите слово.
В ответе запишите слово.
Вопрос 7
Укажите истинность или ложность высказываний.
Варианты ответов
- Процесс теплопередачи происходит в определённом направлении — от более нагретых тел к менее нагретым.
- Процесс теплопередачи происходит в неопределённом направлении.

- При выравнивании температуры тел теплопередача прекращается.
- При выравнивании температуры тел теплопередача продолжается в обратном направлении.
Вопрос 8
Единица измерения внутренней энергии в системе СИ.
Варианты ответов
- Джоуль
- Ньютон
- Ватт
- метр в секунду
Вопрос 9
Изменить внутреннюю энергию тела можно.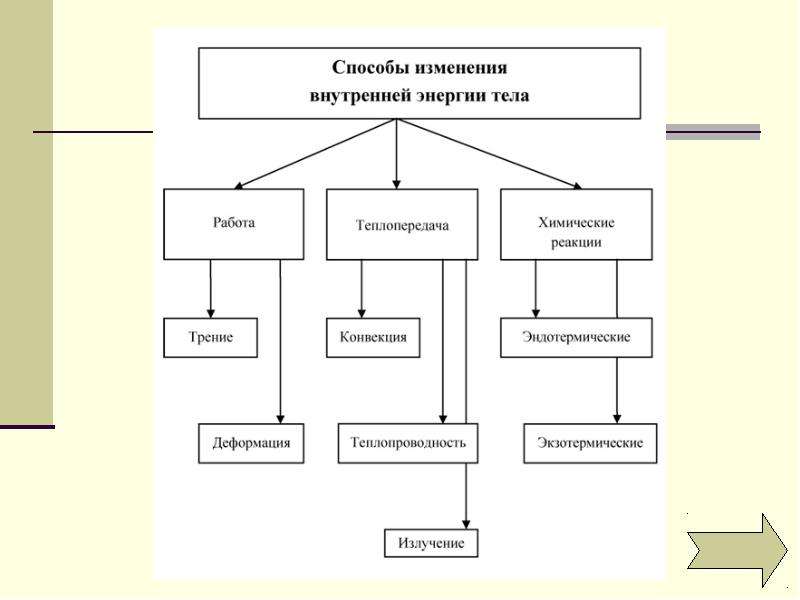 ..
..
Варианты ответов
- путём совершения механической работы.
- теплопередачей.
- среди ответов нет правильного.
- внутреннюю энергию тела изменить нельзя.
Вопрос 10
На рисунке изображён процесс изменения внутренней энергии тела путём.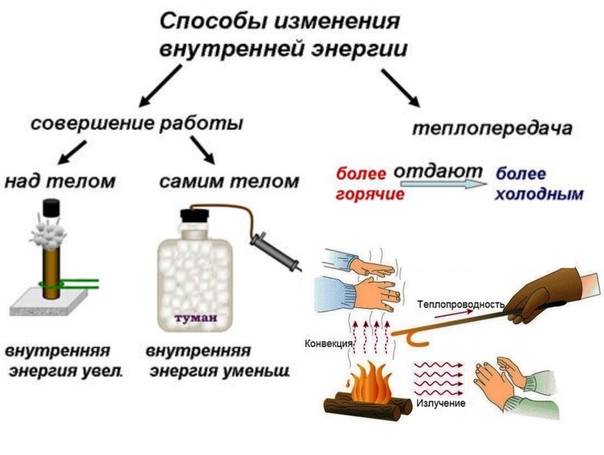 ..
..
Варианты ответов
- совершения механической работы.
- теплопередачи.
- совершения механической работы и теплопередачей.
- среди ответов нет правильного
Физические диктанты.
 Зачеты по физике. 8 класс — Соломонова Раиса Николаевна — Методические разработки учителей — Методические разработки
Зачеты по физике. 8 класс — Соломонова Раиса Николаевна — Методические разработки учителей — Методические разработки
Физический диктант по физике
8 класс
Тепловые явления
- Температура- это…
- Прибор для измерения температуры…
- Единицы измерения температуры…
- Тепловое движение- это…
- Два вида механической энергии:
- Единицы измерения энергии:
- Кинетическая энергия вычисляется по формуле:
- Потенциальная энергия вычисляется по формуле:
- Внутренняя энергия- это…
10. Внутренняя энергия зависит от…
11. Два способа изменения внутренней энергии…
12. Теплопередача- это…
13. Виды теплопередачи…
14. Конвекция — это…
15. Излучение — это
16. Передача энергии от одного тела к другому или от одной молекулы к другой…
17. Плохой теплопроводностью обладают…
18. Хорошой теплопроводностью обладают…
19. Закон сохранения энергии…
Закон сохранения энергии…
20 . Деформация – это…
Зачет №1: “Внутреняя энергия. Теплопередача”
I. Записать условное обозначение, единицу измерения ФВ:
- Кинетическая энергия.
- Потенциальная энергия.
- Внутренняя энергия.
- Изменение внутренней энергии.
- Количество теплоты.
- Работа сил.
II. Записать формулы (условия):
- Изменение внутренней энергии.
- Способы изменения внутренней энергии (2).
- Возрастание внутренней энергии.
- Убывание внутренней энергии.
III. Записать по определениям фв, понятия:
- Сформулируйте основные положения МКТ (3).
- Беспорядочное движение всех частиц, из которых состоит тело.
- СФВ, энергия движения и взаимодействия всех частиц вещества.
- Процесс изменения внутренней энергии без совершения работы над телом или самим телом.

- Передача тепла в результате движения и взаимодействия частиц вещества.
- Передача тепла струями жидкости или газа.
- Передача тепла в результате испускания, переноса и поглощения лучистой энергии.
IV. Укажите способы изменения внутренней энергии (А, Q):
- После обработки на точильном круге зубило становится горячим.
- Деталь перед закалкой нагревают в печи.
- Спичка при трении о коробок воспламеняется.
- Земля ночью обязательно охлаждается.
- При длительном пробеге автомашины резина колес заметно нагревается.
- После сильного шторма вода в море нагревается.
- Спичка вспыхивает при внесении её в пламя горелки.
- При резком расширении газа образуется туман.
- Отогреть озябшие руки можно с помощью нагретого тела или перчаток.
- Продукты хранят в холодильнике.
V. Укажите вид теплопередачи (т, и, к), которым обьясняется явление:
- Осмотрщик вагонов для проверки наличия смазки подшипников касается буксы вагона рукой.

- Черноземные почвы сильнее нагреваются на солнце, чем подзолистые.
- Парусные суда уходят в плавание по ночам.
- Перед заморозками рекомендуют рыхлить почву.
- Цвет кожи у людей, живущих на приэкваториальных территориях, более темный, чем у северян.
- При строительстве домов для обогрева используют кирпичные печи с высокими трубами.
- Южные жители носят шапки- папахи и ватные халаты….
- Из старых чайников всегда удаляют накипь….
- Под мостами в реках вода зимой почти не замерзает…
- Полярные обитатели-киты и тюлени имеют толстый слой подкожного жира.
- Оконные стекла начинают чаще замерзать снизу, чем сверху.
- Дачные участки никогда не разбивают в низинах.
- Форточки всегда расположены вверху окон, а батареи под ними ближе к полу.
- Рамы двойные и тройные позволяют сохранить тепло в жилище.
- Ранней весной в ясные, безоблачные ночи всегда наблюдаются заморозки.
- При изготовлении парников и теплиц используют стеклянные (пленочные) укрытия.

- Летом лед сохраняют под слоем опилок или сена.
- На нефтебазах баки для хранения топлива красят “серебряной” краской.
- Листья осины колеблются даже в безветренную погоду.
- Пористый кирпич обеспечивает лучшую теплоизоляцию здания.
- Ручки кранов с горячей водой делают деревянными.
Зачет №2: “Количество теплоты. Закон сохранения энергии”
I. Записать условное обозначение, единицу измерения ФВ:
- Внутренняя энергия.
- Изменение внутренней энергии.
- Количество теплоты.
- Масса вещества.
- Начальная температура.
- Конечная температура.
- Изменение температуры.
- Удельная теплоёмкость вещества.
- Удельная теплота сгорания топлива.
II. Записать формулы (условия):
- Изменение внутренней энергии.
- Способы изменения внутренней энергии (2).
- Условие получения тепла.

- Условие выделения тепла.
- Количество теплоты, необходимое для нагревания.
- Удельная теплоёмкость вещества.
- Реакция горения (окисления).
- Количество теплоты, выделяющееся при сгорании топлива.
III. Записать по определениям ФВ, понятия:
- СФВ, мера изменения внутренней энергии при теплопередаче.
- СФВ, показывающая какое количество теплоты необходимо сообщить телу массой 1 кг для изменения его температуры на 1 °С.
- СФВ, показывающая какое количество теплоты выделится при полном сгорании 1 кг топлива
- Сформулируйте закон сохранения энергии.
IV. Построить графики для следующих процессов:
- Процесс нагревания.
- Процесс охлаждения.
V. Указать какие превращения произошли в следующих случаях:
- При слабом морозе снег на дорогах с интенсивным автомобильным движением размягчается и подтаивает.
- При строительстве гидроэлектростанций возводят плотины.

- Принцип действия различных машин (паровая и газовая турбины, двигатель внутреннего сгорания, паровая машина, реактивный двигатель) основан на законе сохранения энергии.
- Пружина механических часов закручивается.
- Металлическая деталь нагревается при обработке её напильником.
- Черноземные почвы сильнее прогреваются днем солнечными лучами.
- Частыми ударами молотка можно разогреть кусок металла.
- Железнодорожный состав затормозил и остановился.
- Крышка чайника побрякивает, когда вода кипит в нем.
- Метеориты сгорают в нижних слоях атмосферы.
- Мяч, падая на Землю, несколько раз подпрыгивает.
- Ветер является причиной сильного волнения на море.
- Качели являются любой русской забавой.
- Если опустить холодную ложку в горячий чай, она нагревается.
- Комнатный воздух обогревается за счет воды, протекающей через отопительные батареи.
- После отливки чугунной болванки её температура постепенно понижается.

- На Землю энергия поступает от Солнца.
- Паровоз приводится в движение энергией пара.
- Пища нужна человеку, чтобы двигаться.
- При нагревании паров эфира в трубке, закрытой пробкой, она вылетает из трубки.
Итоговый диктант по теме: “Тепловые явления”
I. Записать условное обозначение физической величины и единицу измерения физической величины в системе СИ:
- Кинетическая энергия.
- Потенциальная энергия.
- Количество теплоты.
- Масса вещества.
- Начальная температура.
- Конечная температура.
- Изменение температуры.
- Удельная теплоёмкость вещества.
- Удельная теплота сгорания топлива.
- Удельная теплота плавления.
- Удельная теплота парообразования.
- Абсолютная влажность воздуха.
- Относительная влажность воздуха.
- КПД теплового двигателя.
II.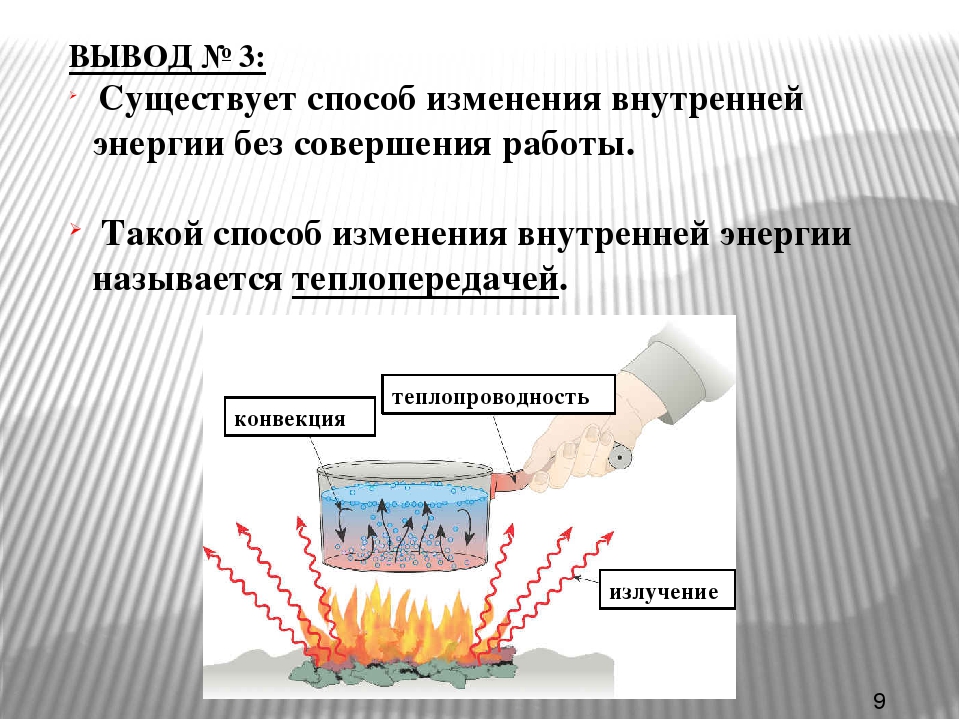 Записать формулы или условия:
Записать формулы или условия:
- Способы изменения внутренней энергии (2).
- Условие получения тепла.
- Условие выделения тепла.
- Количество теплоты, необходимое для нагревания.
- Количество теплоты, выделяющееся при сгорании топлива.
- Количество теплоты, необходимое для плавления.
- Количество теплоты, выделяющееся при отвердевании.
- Количество теплоты, необходимое для парообразования.
- Количество теплоты, выделяющееся при конденсации.
- Формула для расчета относительной влажности воздуха.
- Работа газа в тепловом двигателе.
- КПД теплового двигателя.
III. Записать определения:
- Тепловое движение —
- Внутренняя энергия —
- Теплопередача —
- Теплопроводность —
- Конвекция –
- Излучение —
- Удельная теплоёмкость —
- Удельная теплота сгорания топлива —
- Плавление —
- Кристаллизация —
- Температура отвердевания —
- Удельная теплота плавления —
- Парообразование —
- Конденсация —
- Испарение —
- Влажность воздуха —
- Насыщенный пар —
- Ненасыщенный пар —
- Точка росы —
- Перечислите известные вам приборы для измерения влажности воздуха.

- Кипение —
- Температура кипения —
- Удельная теплота парообразования —
- Тепловые двигатели —
- Назовите основные элементы теплового двигателя.
- Перечислите основные такты работы теплового двигателя.
VI. Построить графики для следующих процессов:
- Процесс нагревания.
- Процесс охлаждения.
- Процесс плавления.
- Процесс отвердевания.
- Процесс парообразования.
- Процесс конденсации.
Внутренняя энергия и способы ее изменения – методическая разработка для учителей, Свиридова Ирина Викторовна
|
Цель урока: |
изучить понятие внутренней энергии, рассмотреть на опытах способы ее изменения. |
|
Задачи урока:
|
Образовательная: — создать условия для понимания новой физической величины и самостоятельного опытного доказательства основных способов изменения данной величины. Развивающая: развивать умения анализировать выделять главное, обобщать, объяснять и доказывать свою точку зрения на основе эксперимента и видео доказательств. Воспитательная: способствовать развитию диалогического обучения, умения работать в группах, воспитывать в учениках средствами урока уверенности в своих силах. |
|
Тип урока: |
комбинированный (повторение пройденного материала +изучение нового + первичное закрепление нового материала) |
|
Методы обучения: |
словесный, наглядный, практический |
|
Форма работы: |
индивидуальная, групповая. |
|
Технология: |
РКМ, ИКТ, проблемное обучение. |
|
Основные модули: |
1.Обучение критическому мышлению.2.Оценивание для обучения и оценивание обучения 3.Новые подходы в преподавании и обучении.4.Использование ИКТ. 5.Преподавание о обучение в соответствии с возрастными особенностями учеников 6.Управление и лидерство в обучении. 7.Обучение талантливых и одаренных детей Ресурсы: материалы сайта bilimland.kz (основной курс физика + iTest), проектор, учебник, оборудование для проведения опытов, ватман, фломастеры, карточки. |
План урока.
1.Орг момент
- деление на группы
- психологический настрой
2.АБЗ
- самостоятельная работа с использованием взаимопроверки по шаблону
- доклад ученика о проведении домашнего эксперимента + выводы
3. Изучение нового материала
Изучение нового материала
- вступительное слово учителя
- постановка цели основного этапа урока
- экспериментальное доказательство способов изменения внутренней энергии- работа в группах
- представление проведенной работы
4..Проверка понимания новой темы: фронтальный опрос групп
5.Д/з
6.Рефлексия
|
№ |
Этапы урока |
Задачи этапа |
Модули |
Виды деятельности |
Оценивание |
Ресурсы |
|
1 |
Орг. 2 мин.
|
-Создание коллаборативной среды. -Подготовка учащихся к активной учебной деятельности. |
Новые подходы в преподавании и обучении. |
Установка на положительную и плодотворную работу. |
Похвала учителя |
|
|
2 |
АБЗ 8 мин |
-Контроль степень усвоения пройденного материала -Развитие КМ -Развитие одаренных детей |
1.1. Обучение критическому мышлению. 2. Оценивание для обучения и оценивание обучения. 3. 4. Обучение талантливых и одаренных детей |
1. вопрос — ответ 2. Устный опрос (на местах) 3. Разбор графика (у доски) |
1. Взаимопроверка (правильный ответ – +) 2. Оценивание учителем 3. Оценивание учителем |
Презентация Учебник доска |
|
3 |
Изучение нового материала и первичное осмысление. 25 мин
|
-Развитие функциональной грамотности |
1. 2.Преподавание о обучение в соответствии с возрастными особенностями учеников 3.Управление и лидерство в обучении. 4. Использование ИКТ. |
1. читают; 2. проводят опыт 3. самостоятельно у доски демонстрируют опыт и видео доказательства, объясняют основные особенности, записывают в тетрадь; 4. анализируют полученный ОК;
|
Взаимооценивание группы, формативное оценивание
|
Учебник, оборудование для проведения опытов материалы сайта bilimland.kz (основной курс физика, ватман |
|
4 |
Проверка понимания новой темы: 5 мин |
-Закрепить ЗУН по данной теме. -Выявить проблемы ученика с усвоением новой темы |
1. Обучение критическому мышлению. 2. Новые подходы в преподавании и обучении. 3. Обучение талантливых и одаренных детей |
Разбор ситуаций |
Формативное,
|
Учебник, bilimland.kz
(iTest)
|
|
5 |
Итог урока. Дом.задание 3 мин |
— Оценить работу учащихся — Инструктаж к выполнению дом. |
1. Использование ИКТ. |
Запись в дневниках |
Оценивание учителем |
Учебник |
|
6 |
Рефлексия 2 мин. |
-Оценить урок |
Новые подходы в преподавании и обучении, развитие саморегуляции учащихся |
Создание кластера |
Самооценивание |
Составление кластера из карточек. |
Ход урока
План урока:
1.Орг момент — создание коллаборативной среды.
- деление на группы — при входе каждый учащийся вытягивает жетон в виде бабочки, цветка, облака, солнца, травки, тем самым формируются группы.

- психологический настрой — здравствуйте ребята наш урок я бы хотела начать со слов «В каждом человеке заключается целый ряд способностей и наклонностей, которые стоит лишь пробудить и развивать, чтобы они, при приложении к делу, произвели самые превосходные результаты. Лишь тогда человек становится настоящим человеком»
А. Бебель
Пусть эти слова станут нашем девизом!
2.АБЗ Для того чтобы приступить к новой теме нам необходимо проверить знание прошлого материала.
- самостоятельная работа с использованием взаимопроверки по шаблону
Вам предлагаются вопросы на которые необходимо дать ответ или произвести расчеты. Какие критерии оценивания вы предлагаете?Хорошо каждый правильныйответ будет оцениваться в 1 балл и того 8 баллов.
Вопросы
1.Температура это…..
2.Какие шкалы вам известны? на чем основаны данные шкалы?
3. Что произойдет, если ртутный термометр показывающий 380С не встряхивая поставить здоровому человеку с температурой 36,60С? Почему?
Что произойдет, если ртутный термометр показывающий 380С не встряхивая поставить здоровому человеку с температурой 36,60С? Почему?
4.Переведите температуры из 0С в К
450С, 200С.
5. Переведите температуры из К в 0С
5К, 730К
Проведите взаимопроверку и выставите оценки, листочки с оценками сдать.
Ответы:
1.Температура — это мера средней кинетической энергии движения молекул.
2.Шкала Цельсия — основана на агрегатных состояниях воды. Шкала Кельвина — основана на понятии абсолютный ноль.
3.Термометр будет показывать 380С, так как его не встряхнули, особенность ртути.
4.318К, 293К
5.-2680С, 4570С.
- доклад ученика о проведении домашнего эксперимента + выводы — на доске ученик оформляет результаты проведенного опыта в виде графика зависимости температуры от времени, комментирует полученный результат.

3.Изучение нового материала — итак переходим к изучению нового материала.
- вступительное слово учителя (начала составления ОК совместно с учениками) — Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Если тело упало с 5 этажа что можно сказать о его энергии? — верно потенциальная перешла в кинетическую, а она во внутреннюю энергию тела. А как можно изменить внутреннюю энергию тела??? Это именно тот вопрос на который вам предстоит найти ответ.
- постановка цели основного этапа урока — А как можно изменить внутреннюю энергию тела??? Вам предстоит поработать в группах, у каждой группы будет свое задание. Вам необходимо поставить цель и найти пути решения данной проблемы. После выступления мы обобщим полученный результат в виде ОК.
- экспериментальное доказательство способов изменения внутренней энергии- работа в группах — каждая группа получает свое задание — там только одно слово, вам необходимо раскрыть суть данного слова использую учебник и оборудование для проведения опыта, видео доказательства.

- представление проведенной работы — использование видео фрагментов из коллекции bilimland.kz
1группа — совершение работы — проведение опыта с колбой и насосом
2группа — теплопроводность
предполагаемый ответ — Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела + опыт +
видео фрагмент из урока (физика — молекулярная физика — термодинамика — теплообмен — 7слайд — 1 видео)
3группа — конвекция
предполагаемый ответ — Конвекция — это перенос внутренней энергии в жидкостях или газах в результате цирку- ляции потоков и перемешивания вещества + опыт +
видео фрагмент из урока (физика — молекулярная физика — термодинамика — теплообмен — 7слайд — 2 видео)
4группа — излучение
предполагаемый ответ — Излучение — перенос энергии электромагнитными волнами + особенности +
видео фрагмент из урока (физика — молекулярная физика — термодинамика — теплообмен — 8 слайд — 1 видео)
5группа — составление ОК на ватмане.
предполагаемый ответ — защита кластера.
4.Проверка понимания новой темы: фронтальный опрос групп (весь класс)+
дополнительное тестирование одаренных детей на опережение (индивидуальное задание — iTest — физика — термодинамика — внутренняя энергия, теплоемкость).
- Какие существуют способы изменения внутренней энергии?
- В каких случаях меняется внутренняя энергия при совершении работы?
- Что такое теплопередача?
- В каком направление происходит переход внутренней энергии при теплопередаче?
- Какие способы теплопередачи существуют?
5.Д/з выучить тему используя учебник и тетрадь, ответить на вопросы в конце параграфа. Индивидуально — создание видео ролика по теме Изменение внутренней энергии.
6.Рефлексия — Каждый из вас сегодня хорошо поработал в группе — лидеры группы сдайте листы контроля с оценками каждого учащегося вашей команды. Сегодня мы с вами подтвердили слова А. Бабеля
Сегодня мы с вами подтвердили слова А. Бабеля
«В каждом человеке заключается целый ряд способностей и наклонностей, которые стоит лишь пробудить и развивать, чтобы они, при приложении к делу, произвели самые превосходные результаты. Лишь тогда человек становится настоящим человеком»
А. Бебель
У вас на столах лежат жетоны которые вы выбирали в начале урока, я хочу чтобы каждый из вас дал оценку нашему уроку, а из получившихся жетонов составим картину. Спасибо за урок!
Дополнительные материалы к уроку
Карточка для учащегося.
1.Темпиратура это…..
2.Какие шкалы вам известны? на чем основаны данные шкалы?
3.Что произойдет, если ртутный термометр показывающий 380С не встряхивая поставить здоровому человеку с температурой 36,60С? Почему?
4.Переведите температуры из 0С в К
450С, 200С.
5. Переведите температуры из К в 0С
5К, 730К
Карточки для групп
1группа — совершение работы
2группа — теплопроводность
3группа — конвекция
4группа — излучение
5группа — составление ОК на ватмане.
Материалы для деления на группы и составления кластера рефлексии (размеры регулирует учитель при распечатке).
Самоанализ урока
Класс 8м1 кол-во присутствующих 25 кол-во по списку 25
Тема урока Внутренняя энергия. Способы изменения внутренней энергии.
Тип урока комбинированный.
Данный урок это 3 урок в разделе, имеет большое отношение к прошлой теме Температура, так как понимание новой темы опирается на знание прошлого материала. Данный урок проводился в сильном классе, где активность учеников, организаторские способности и интеллектуальный фон находятся на хорошем высоком уровне.
На мой взгляд все этапы урока продуманы, формы и методы соответствуют комбинированному уроку и способствовали достижению основных целей урока. Модули программы и материалы сайта bilimland.kz (основной курс физика + iTest), способствовали более продуктивной работе учеников, осмыслению, пониманию и запоминанию новой темы.
Время на уроке было распределено рационально. Дидактический материал был подобран с учетом возрастных особенностей учащихся. Контроль знаний проводился самими учащимися по критериям.
Психологическая атмосфера настраивала учащихся на достижении поставленных целей, творчество и сотрудничество.
Я считаю, что урок достиг своей цели. В перспективе я постараюсь чтобы каждый урок был запоминающимся как и этот.
Внутренняя энергия и способы ее изменения
ВНУТРЕННЯЯ ЭНЕРГИЯ И СПОСОБЫ ЕЕ ИЗМЕНЕНИЯ.
Достаточный уровень
1. В один стакан налита холодная вода, в другой — столько же горячей воды. Одинакова ли внутренняя энергия воды в этих стаканах?
Ответ: внутренняя энергия горячей воды больше
выше
температура, больше скорость молекул,
больше
кинетическая энергия, больше внутренняя
энергия
2.
На столе в кухне стоят стакан и графин
с водой.
Одинаковы ли внутренние
энергии воды в этих сосудах?
Ответ:
внутренняя энергия воды в графине
больше
в графине молекул воды больше,
чем в стакане,
а внутренняя энергия
воды равна сумме энергий всех молекул
3. Как будет изменяться внутренняя энергия воды в кастрюле по мере ее подогревания?
Ответ: внутренняя энергия воды в кастрюле по мере ее подогревания увеличивается
выше
температура, больше скорость молекул,
больше
кинетическая энергия, больше внутренняя
энергия
4. Продукты положили в холодильник. Как изменилась их внутренняя энергия?
Ответ:
внутренняя энергия продуктов стала
меньше
ниже температура, меньше
скорость молекул,
меньше кинетическая
энергия, меньше внутренняя энергия
5. Укажите, в каких из перечисленных ниже случаях внутренняя энергия воды не меняется:
а) воду несут в ведре; б) переливают ее из ведра в чайник; в) нагревают до кипения.
Ответ: а) воду несут в ведре; б) переливают ее из ведра в чайник;
6. Как можно отогреть озябшие руки, не
используя нагретых предметов или теплых
перчаток?
Как можно отогреть озябшие руки, не
используя нагретых предметов или теплых
перчаток?
Ответ:
сила трения совершает работу по увеличению
внутренней энергии
и температуры рук
7. Каким способом — совершением работы или теплопередачей — изменялась внутренняя энергия детали при ее нагревании в печи перед закалкой? При сверлении в ней отверстия?
Ответ: внутренняя энергия детали при ее нагревании в печи изменялась путем теплопередачи, а при сверлении в ней отверстия путем совершения работы
8. Почему при быстром скольжении вниз по шесту или канату можно обжечь руки?
Ответ: при быстром скольжении вниз по шесту поверхность рук сильно нагревается за счет работы силы трения
9.
Почему и как изменяется внутренняя
энергия пилы при распиливании бревна?
На основании чего вы об этом судите?
Ответ:
сила трения совершает работу по увеличению
внутренней энергии
и температуры
пилы
10.
Спичку можно зажечь, если поместить ее
в пламя свечи или при ее трении о коробок. Одинаковы ли способы изменения внутренней
энергии спички при ее возгорании?
Одинаковы ли способы изменения внутренней
энергии спички при ее возгорании?
Ответ:
в первом случае нагревание спички
происходит путем теплопередачи,
во
втором – за счет работы силы трения
Средний уровень
1.Как
изменится внутренняя энергия газа при
его внезапном сжатии?
Что будет
свидетельствовать об изменении его
внутренней энергии?
Ответ:
при внезапном сжатии газа расстояние
между молекулами уменьшается,
при
этом увеличивается потенциальная
энергия молекул,
внутренняя энергия
газа увеличивается
2.Растяните слегка резиновую нить. Как надо поступить (отпустить нить или растянуть сильнее), чтобы ее внутренняя энергия увеличилась?
Ответ:
если растянуть нить сильнее расстояние
между молекулами увеличивается,
при
этом увеличивается потенциальная
энергия молекул,
внутренняя энергия
газа увеличивается
3.В
одном сосуде находится вода, в другом
— лед. Массы воды и льда одинаковы.
Вода
или лед имеет больший запас внутренней
энергии? Почему?
Ответ:
вода имеет больший запас внутренней
энергии потому,
что у нее больше
скорость молекул,
больше кинетическая
энергия, больше внутренняя энергия
4. Чем
объяснить, что при вколачивании гвоздя
его шляпка почти не нагревается, но,
когда гвоздь вбит, достаточно нескольких
ударов, чтобы шляпка сильно нагрелась?
Чем
объяснить, что при вколачивании гвоздя
его шляпка почти не нагревается, но,
когда гвоздь вбит, достаточно нескольких
ударов, чтобы шляпка сильно нагрелась?
Ответ:
при забивании гвоздя его шляпка
нагревается слабо,
поскольку энергия
удара расходуется на преодоление силы
трения
при перемещении гвоздя в
дереве.
Когда гвоздь уже заколочен,
при ударах его шляпка нагревается
сильнее, так как энергия удара расходуется
главным образом на увеличение внутренней
энергии гвоздя
5.
Изменится ли внутренняя энергия воды
в море с наступлением ночи?
Ответ: с
наступлением ночи температура воды в
море мало изменяется
и поэтому ее
внутренняя энергия не измениться (?)
6. Может ли повыситься температура газа вследствие его взаимодействия с твердым телом, которое имеет меньшую температуру, чем газ?
Ответ: при
движении тела в газе сила трения совершает
работу по увеличению внутренней энергии
и температуры газа (?) Пример:
метеорит, падая на землю начально имеет
температуру меньше температуры воздуха.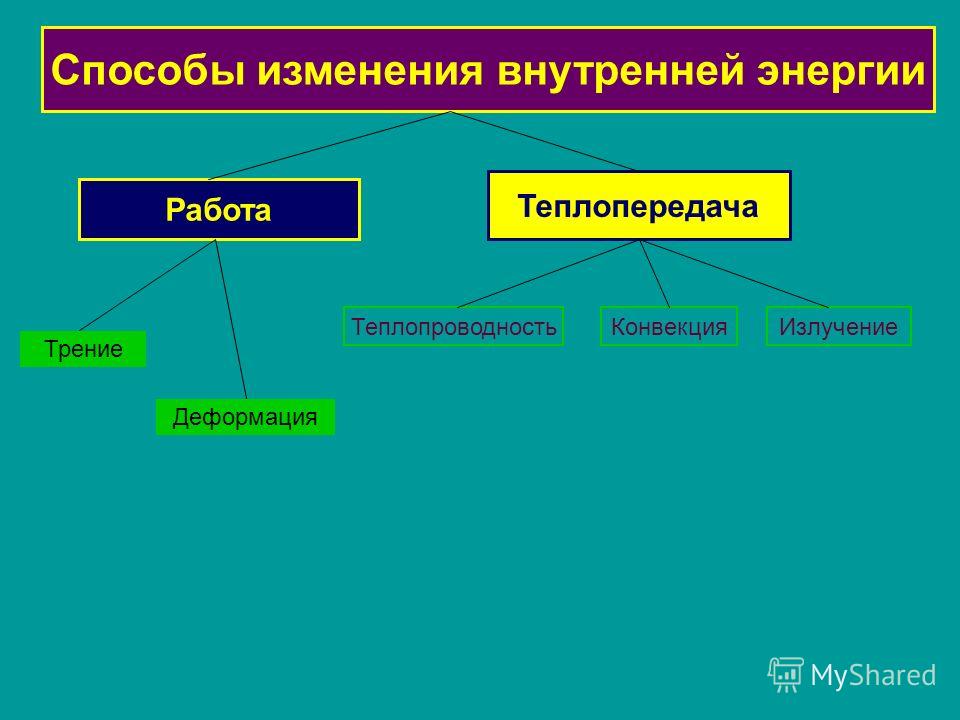 В результате того, что кинетическая
энергия падающего тела переходит во
внутреннюю нагревается и воздух и тело.
В результате того, что кинетическая
энергия падающего тела переходит во
внутреннюю нагревается и воздух и тело.
7. Одна молекула кислорода в воздухе движется в данный момент со скоростью 900 м/с, а другая — со скоростью 1200 м/с. Правильно ли будет сказать, что температура второй молекулы выше?
Ответ: нет (?) О температуре молекулы не имеет смысла говорить—это понятие макроскопическое и может относится только к газу в целом.
Высокий уровень
1. Из чайника выкипела почти вся вода. В некоторый момент массы воды и пара оказались равными. Их температура 100°С. Можно ли утверждать, что внутренние энергии пара и воды одинаковы?
Ответ:
внутренняя энергия пара больше потому,
что у него больше скорость молекул,
больше
кинетическая энергия, больше внутренняя
энергия
2. В каком случае шина автомобиля при его движении больше нагреется: когда она слабо надута или надута хорошо?
Ответ: если
шина автомобиля слабо надута при его
движении сила трения больше
а значит
больше внутренняя энергия
3. Два
одинаковых медных шарика упали с одной
и той же высоты. Первый упал в глину, а
второй, ударившись о камень, отскочил
и был пойман рукой на некоторой высоте.
Два
одинаковых медных шарика упали с одной
и той же высоты. Первый упал в глину, а
второй, ударившись о камень, отскочил
и был пойман рукой на некоторой высоте.
Который из шариков изменил больше
свою внутреннюю энергию?
Ответ: внутренняя энергия шарика который упал в глину изменилась больше (?). После отскока кинетическая энергия шарика превратилась в потенциальную с небольшими потерями.. Шарик, упавший в глину потерял всю свою механическую энергию, при торможении она преобразовалась во внутреннюю энергию шарика и глины.
4.Если жидкость, находящуюся в закупоренной бутылке, энергично встряхнуть, то ее температура повышается. Почему нагревается жидкость?
Ответ: если
жидкость, находящуюся в закупоренной
бутылке, энергично встряхнуть
станет
больше скорость молекул, больше
кинетическая энергия, больше внутренняя
энергия (?)
5. Представьте себе случай, когда какое-либо тело не имеет механической энергии.
Реальна
ли такая ситуация? Поясните это на
примере.
Ответ:
на земле лежит кирпич, его потенциальная
энергия равна нулю,
кирпич находится
в состоянии покоя , значит его кинетическая
энергия тоже равна нулю
6.
Возможно ли отсутствие у какого-нибудь
тела внутренней энергии?
Что для этого
должно произойти?
Ответ: нет, должно прекратиться движение молекул (?) и молекулы должны перестать друг с другом взаимодействовать—должны исчезнуть силы притяжения и отталкивания.
7. Изменится ли потенциальная энергия медного шара, лежащего на горизонтально расположенной поверхности стола, если повысить его температуру?
Ответ: потенциальная энергия медного шара при этом не изменится (?), но изменится потенциальная и кинетическая энергия молекул его составляющих.
8. Со дна водоема всплывает пузырек воздуха. За счет чего увеличивается его потенциальная энергия? Меняется ли при этом его внутренняя энергия?
Ответ: увеличение
потенциальная энергии пузырька воздуха
происходит за счет уменьшения потенциальной
энергии воды, при этом его внутренняя
энергия не изменится (?)Внутренняя
энергия меняется незначительно. На
большей глубине давление больше и воздух
сжат сильнее, при подъеме размер пузырька
увеличивается, изменяются промежутки
между молекулами—а значит и потенциальная
энергия взаимодействия молекул. Но в
газе расстояния между молекулами
настолько велики даже в сжатом состоянии,
что это изменение несущественно.
На
большей глубине давление больше и воздух
сжат сильнее, при подъеме размер пузырька
увеличивается, изменяются промежутки
между молекулами—а значит и потенциальная
энергия взаимодействия молекул. Но в
газе расстояния между молекулами
настолько велики даже в сжатом состоянии,
что это изменение несущественно.
22.Когда автомобиль больше расходует горючее: при езде без остановок или с остановками?
Горючее будет расходоваться по разному из-за разных энергетических затрат. При езде без остановок энергия топлива тратится на совершение механической работы по перемещению автомобиля, увеличение внутренней энергии трущихся детали и выхлопных газов. При езде с остановками к этим расходам добавляются затраты по преодолению силы трения покоя, которая всегда выше трения качения, и увеличению внутренней энергии тормозных дисков, шин и дороги при торможении.
44.За счет какой энергии совершается механическая работа при повышении столбика ртути в термометре?
Столбик
ртути в термометре поднимается, когда
температура жидкости возрастает. Это
значит, что увеличилась скорость движения
молекул и промежутки между ними,
следовательно увеличилась внутренняя
энергия. Часть ее тратится на совершение
механической работы.
Это
значит, что увеличилась скорость движения
молекул и промежутки между ними,
следовательно увеличилась внутренняя
энергия. Часть ее тратится на совершение
механической работы.
55.Верно ли утверждение: при теплообмене энергия всегда переходит от тел с большей внутренней энергией к телам с меньшей внутренней энергией?
Нет. При теплообмене энергия переходит от тела с большей температурой к менее нагретому телу, т.е. выравнивается кинетическая энергия молекул их составляющих. Но внутренняя энергия тела равна суммарной кинетической и потенциальной энергии всех молекул этого тела. Литр воды имеет большую внутреннюю энергию, чем капля, но при равной температуре теплообмен не происходит.
66.По
озеру на большой скорости плывет катер.
Изменяется ли при этом внутренняя
энергия воды в озере? Как? Почему?
Объясните. Конечно
же внутренняя энергия воды в озере будет
увеличиваться как и при любом процессе,
связанном с трением. Если бы катер не
терял постоянно энергию на совершение
работы по преодолению силы трения, то
при движении с выключенным двигателем
его скорость оставалась бы неизменной. Энергия топлива расходуется на увеличение
внутренней энергии деталей двигателя,
окружающего воздуха, воды и корпуса
катера.
Энергия топлива расходуется на увеличение
внутренней энергии деталей двигателя,
окружающего воздуха, воды и корпуса
катера.
.
3. Сжатую пружину поместили в сосуд с кислотой и растворили ее. Куда «исчезла» потенциальная энергия сжатой пружины?
4. Что можно сказать о внутренней энергии тела, температура которого понизилась?
5. Два медных бруска имеют одинаковую температуру, но масса одного 1 кг, а другого — 0,5 кг. Какой из двух данных брусков обладает большей внутренней энергией? Внутренняя энергия равна суммарной потенциальной и кинетической энергии молекул составляющей тело, в первом теле молекул больше, а значит и внутренняя энергия его больше.
1.
Можно ли ртутным медицинским термометром
измерить температуру капли? Нет.
Измерение температуры термометром
основано на теплообмене между термометром
и измеряемым телом. При этом, для
достоверности измерения необходимо,
чтобы внутренняя энергия измеряемого
тела менялась незначительно.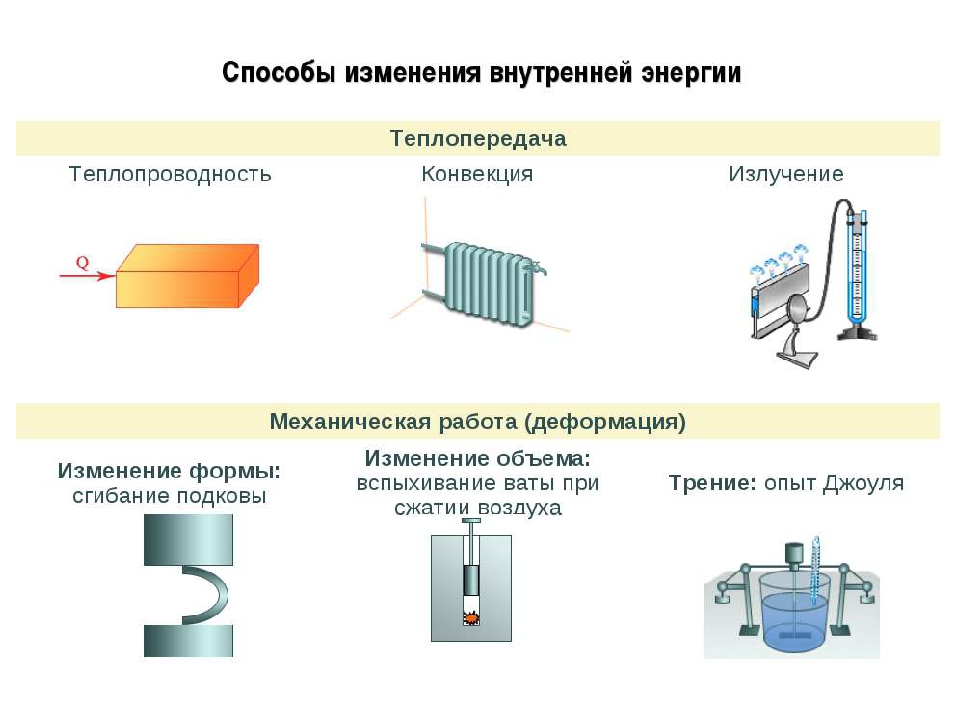 Внутренняя
энергия термометра значительно больше
энергии капли, при теплообмене между
термометром и каплей температура капли
изменится существенно.
Внутренняя
энергия термометра значительно больше
энергии капли, при теплообмене между
термометром и каплей температура капли
изменится существенно.
11. Кусок сахара раздробили на мелкие кусочки, а потом растерли в порошок. В каком случае внутренняя энергия сахара больше? Почему?
2. Дотронувшись рукой до поверхности двух тел, вам показалось, что одно из них более холодное. Можно ли из этого сделать вывод, что поверхность каждого из тел имеет разную температуру? Нет. Наше ощущение холодного и горячего связано не столько с температурой, сколько с интенсивностью теплообмена между рукой и телом. При одинаковой температуре, разные вещества имеют разную теплопроводность и теплоемкость. Поэтому при комнатной температуре металл ощущается более холодным, чем, например, дерево.
5.
Два ртутных термометра с различной
массой ртути в них опустили в горячую
воду. Одинаковую ли температуру покажут
термометры? Да.
Если термометры имеют разные массы
ртути, то увеличение объема ртути при
нагревании будет сильнее заметно у
большего термометра, что позволит
сделать для него более чувствительную
шкалу, но температура будет одинаковой.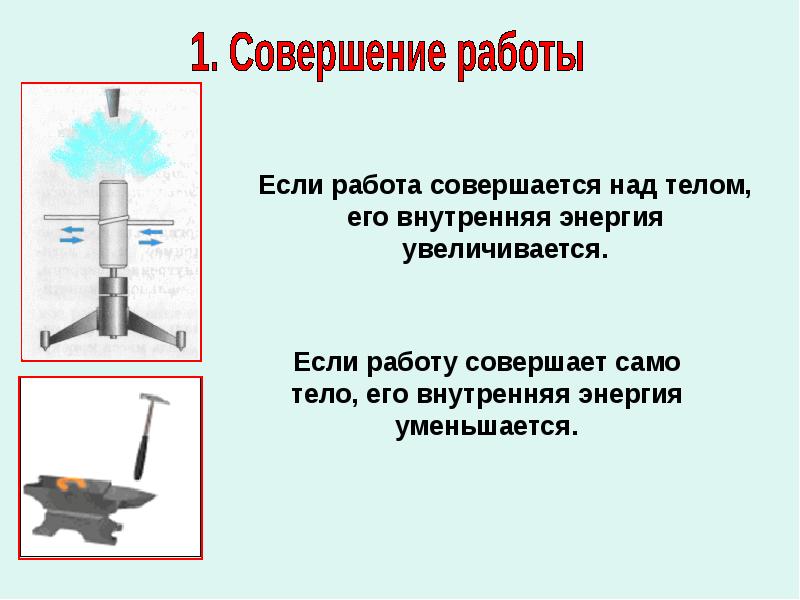
6. Известно, что чем больше скорость движения молекул тела, тем выше его температура. Почему же не нагревается пуля, выстрелянная в тире из пневматического ружья, хотя все ее молекулы движутся к мишени с большей скоростью?
keepslide.com — Внутренняя энергия (обобщение) 1. Дайте… | Facebook
Внутренняя энергия (обобщение)
1. Дайте определение внутренней энергии. (обозначение, единицы измерения)
2. От чего зависит величина внутренней энергии тела?
3. Укажите способы изменения внутренней энергии. Приведите примеры.
4. Дайте определение теплопередачи. Опишите молекулярный механизм теплопередачи.
5. Перечислите виды теплопередачи.
6. Дайте определение каждому виду и укажите его основные свойства.
Уч. Физика 8 А. В. Перышкин стр. 6
Уч. Физика 8 А. В. Перышкин стр. 6, 7
Уч. Физика 8 А. В. Перышкин стр. 8,9
Уч. Физика 8 А. В. Перышкин стр. 9
Уч. Физика 8 А. В. Перышкин стр. 10 — 17
Уч. Физика 8 А. В. Перышкин стр. 10-17, конспект в тетради
ВНУТРЕННЯЯ ЭНЕРГИЯ — тела, включает кинетическую энергию составляющих тело молекул, атомов, электронов, ядер, а также энергию взаимодействия этих частиц друг с другом. U, [Дж]
U, [Дж]
— от температуры телаот агрегатного состояния вещества от массы вещества
совершение механической работы- теплопередача
Теплопередача – процесс изменения внутренней энергии без совершения работы над телом или самим телом
— теплопроводность- конвекция- излучение
Т – явление передачи U от одного тела к другому, от одной его части к другойК — вид теплопередачи, при котором энергия переносится струями жидкости или газа. И — явление передачи U посредством э/м волн
КОЛИЧЕСТВО ТЕПЛОТЫ. УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ВЕЩЕСТВА.
Цели урока
Определить что такое количество теплотыВыяснить от чего зависит количество теплотыВвести понятие удельной теплоемкостиЭкспериментально получить вычислительную формулу количества теплоты для процессов нагревания-охлаждения
Количество теплоты – энергия, которую тело получает или теряет при теплопередаче.
?U >0
?U <0
?U = Q
?U = Aмех.
?U >0 (нагревание) ?U <0 (охлаждение)
Обозначение – QЕдиница измерения – 1 Дж
1.
tн1 = tн2 tк1 = tк2m1?m2
Выводы:
2.
tн1 = tн2 tк1?tк2m1=m2
Q зависит от m
3.
Q зависит от ?t
Q зависит от рода вещества
tн1 = tн2 tк1?tк2m1=m2
Удельная теплоемкость
Обозначение – СЕдиница измерения – ?U 1кг вещества при ?t =1 градус.
Физическая величина, численно равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1 градус, называется удельной теплоемкостью вещества.
Количество теплоты при нагревании и охлаждении.
Внесистемная единица количества теплотыКалория – это ?U 1кг воды при ?t =1 градус.1 кал = 4.19=4.2 Дж1ккал=1000кал1ккал=4190Дж=4200Дж
В алюминиевой кастрюле массой 400 г находится 2 л воды при температуре 20 градусов Цельсия. Какое количество теплоты требуется для нагревания воды в кастрюле до 100 градусов Цельсия?
Ключи правильных ответов
Домашнее задание
Уч. А.В. Перышкин Физика 8, стр.18-22. Составить таблицу ДЭЗ Составить рабочую структурную схему «Теплопередача.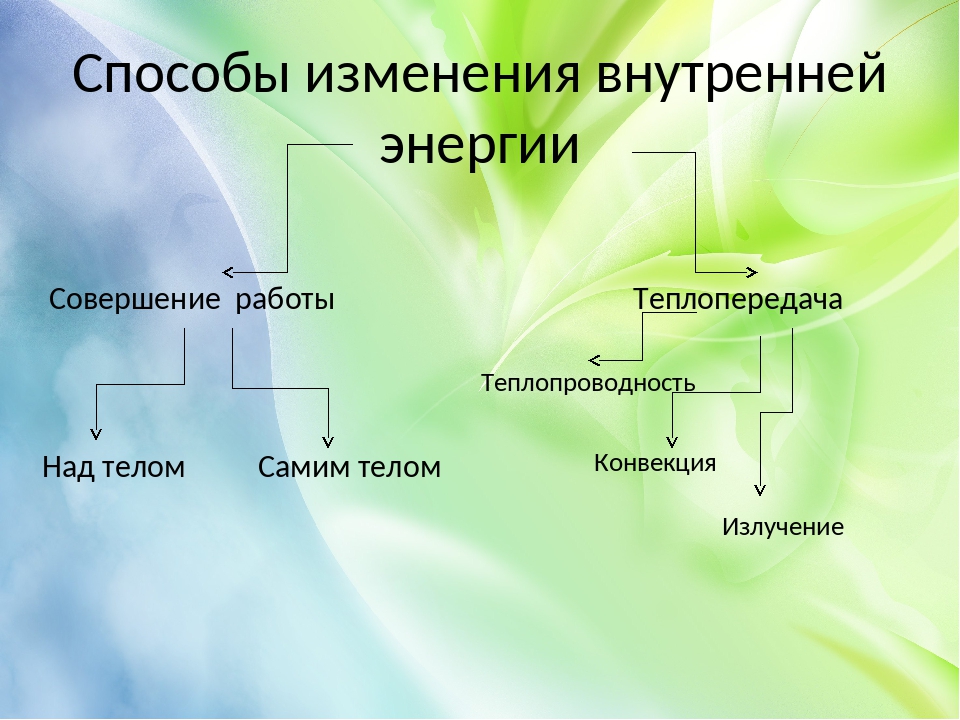 Нагревание-охлаждение» Лист задач № 3Творческое задание:Разработать авторскую схему эксперимента по определению удельной теплоемкости вещества и предложить форму бланка отчетности по этой работе.
Нагревание-охлаждение» Лист задач № 3Творческое задание:Разработать авторскую схему эксперимента по определению удельной теплоемкости вещества и предложить форму бланка отчетности по этой работе.
Термодинамика — Физика — Теория, тесты, формулы и задачи
Оглавление:
Основные теоретические сведения
Теплоемкость вещества
К оглавлению…
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
При этом в этой формуле абсолютно не важно в каких единицах подставлена температура, так как нам важно не ее абсолютное значение, а изменение. Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
- Если t2 > t1, то Q > 0 – тело нагревается (получает тепло).
- Если t2 < t1, то Q < 0 – тело охлаждается (отдает тепло).
Произведение массы тела на удельную теплоемкость вещества, из которого оно изготовлено называется теплоемкостью тела (т.е. просто теплоемкостью без слова «удельная»):
Если в условии задачи сказано про теплоемкость тела, то количество теплоты, отданное или полученное этим телом, можно рассчитать по формуле:
Итак, запомните:
- Удельная теплоемкость обозначается маленькой буквой с, и является характеристикой вещества.
- (Просто) Теплоемкость обозначается большой буквой С, и является характеристикой данного тела.
Напомним, что количество теплоты Q отданное каким–либо источником (нагревателем) рассчитывается по формуле: Q = Pt, где: P – мощность источника, t – время, в течение которого источник отдавал тепло.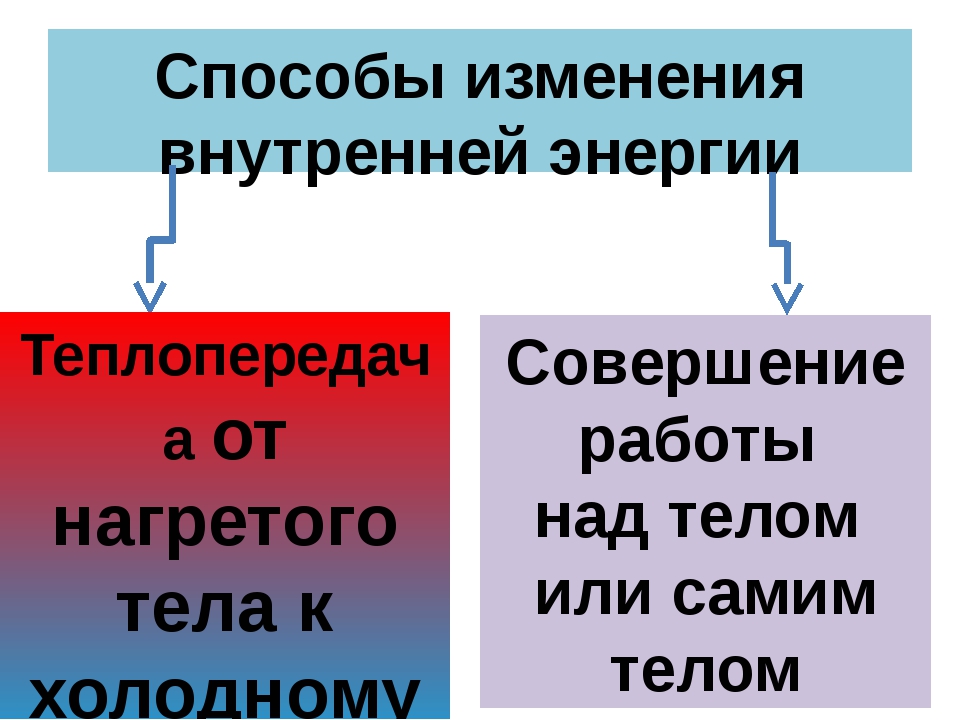 При решении задач не путайте время работы источника и температуру.
При решении задач не путайте время работы источника и температуру.
Фазовые превращения
К оглавлению…
Фазой вещества называется однородная система, например, твердое тело, физические свойства которой во всех точках одинаковые. Между различными фазами вещества при обычных условиях существует четко выраженная граница (поверхность) раздела. При изменении внешних условий (температуры, давления, электрических и магнитных полей) вещество может переходить из одной фазы в другую. Такие процессы называются фазовыми превращениями (переходами).
Процесс фазового перехода из жидкого состояния в газообразное (парообразование) или из твердого в жидкое (плавление) может происходить только при сообщении веществу некоторого количества теплоты. Обратные фазовые переходы (конденсация и кристаллизация, или отвердевание) сопровождаются выделением такого же количества теплоты.
Количество теплоты, поступающее в систему или выделяющееся из нее, изменяет ее внутреннюю энергию. Это означает, что внутренняя энергия пара при 100°С больше, чем жидкости при той же температуре. Указанные фазовые переходы идут при постоянных температурах, которые называются соответственно температурой кипения и температурой плавления. Количество теплоты, необходимое для превращения жидкости в пар или выделяемое паром при конденсации, называется теплотой парообразования:
где: r – удельная теплота парообразования. Единица измерения [r] = 1 Дж/кг. Физический смысл удельной теплоты парообразования: она равна количеству теплоты, необходимому для превращения в пар 1 кг жидкости, находящейся при температуре кипения. Превращение жидкости в пар не требует доведение жидкости до кипения. Вода может превратиться в пар и при комнатной температуре. Такой процесс называется испарением.
Количество теплоты, необходимое для плавления тела или выделяемое при кристаллизации (отвердевании), называется теплотой плавления:
где: λ – удельная теплота плавления.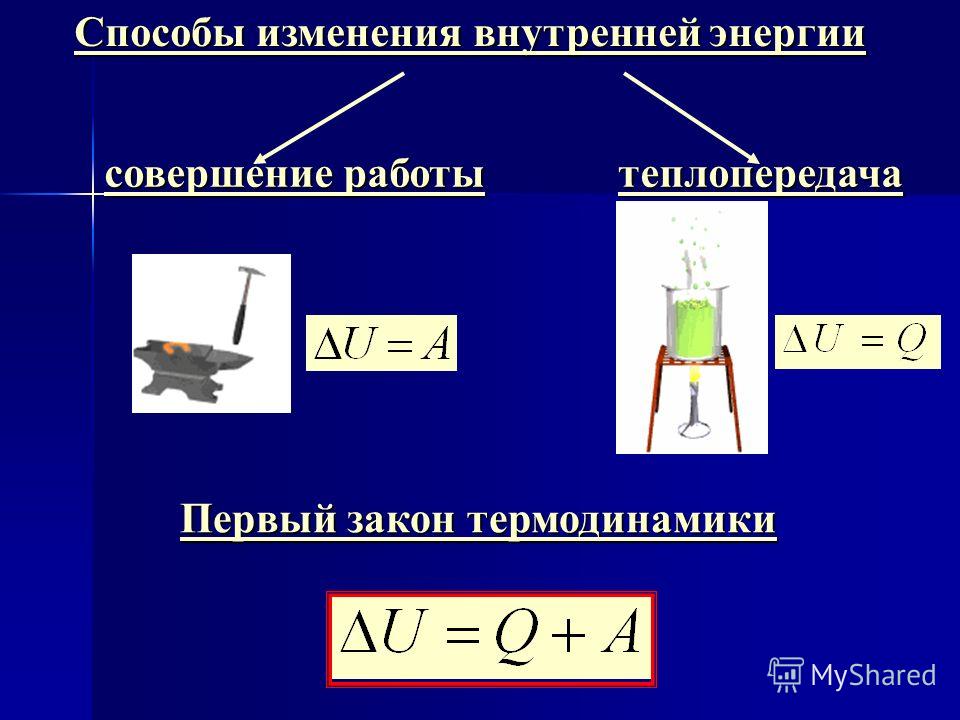 Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Единица измерения [λ] = 1 Дж/кг. Физический смысл удельной теплоты плавления: теплота, необходимая для плавления 1 кг вещества, находящегося при температуре плавления. Удельные теплоты парообразования и плавления называются также скрытыми теплотами, поскольку при фазовых переходах температура системы не меняется, несмотря на то, что теплота к ней подводится.
Обратите внимание: что во время фазовых переходов температура системы не изменяется. А также на то, что сами фазовые переходы начинаются только после достижения необходимой температуры.
Наиболее распространенным источником энергии для нужд человека является топливо – вещество, при сгорании которого выделяется некоторое количество теплоты. Количество теплоты, выделяемое при сгорании топлива массой m, называется теплотой сгорания топлива:
где: q – удельная теплота сгорания (теплотворная способность, калорийность) топлива. Единица измерения [q] = 1 Дж/кг.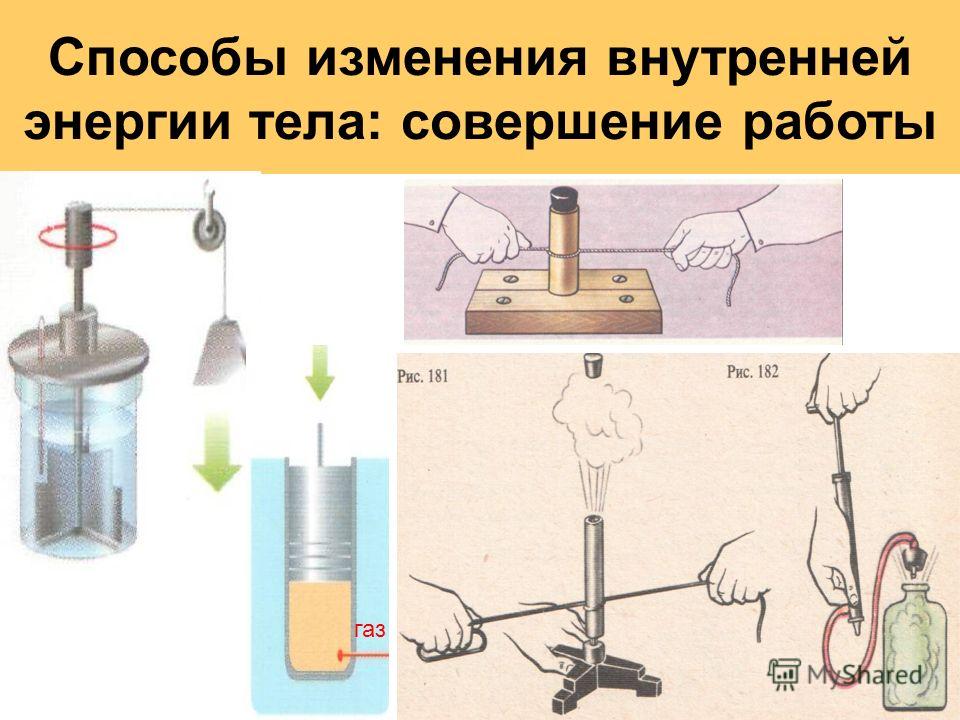 Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Физический смысл удельной теплоты сгорания топлива: величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива.
Уравнение теплового баланса
К оглавлению…
В соответствии с законом сохранения энергии для замкнутой системы тел, в которой не происходит никаких превращений энергии, кроме теплообмена, количество теплоты, отдаваемое более нагретыми телами, равно количеству теплоты, получаемому более холодными. Теплообмен прекращается в состоянии термодинамического равновесия, т.е. когда температура всех тел системы становится одинаковой. Сформулируем уравнение теплового баланса: в замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующими в теплообмене, равна нулю:
При использовании такой формы записи уравнения теплового баланса, чтобы не сделать ошибку, запомните: когда Вы будете считать теплоту при нагревании или охлаждении тела, нужно из большей температуры вычитать меньшую, чтобы теплота всегда была положительной.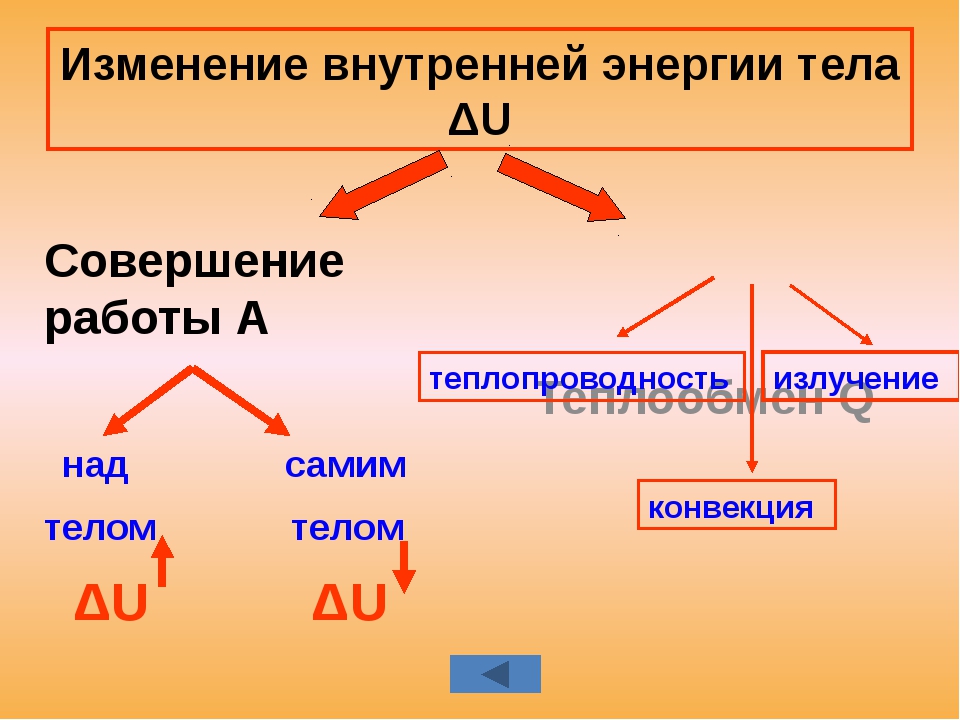 Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
Если все теплоты записывать с учетом знака, где «+» соответствует получению энергии телом, а «–» выделению, то уравнение теплового баланса можно записать в виде:
При использовании такой формы записи, нужно всегда от конечной температуры отнимать начальную. При таком подходе знак их разности сам «покажет» отдаёт тело теплоту или получает.
Запомните, что тело поглощает теплоту если происходит:
- Нагревание,
- Плавление,
- Парообразование.
Тело отдает теплоту если происходит:
- Охлаждение,
- Кристаллизация,
- Конденсация,
- Сгорание топлива.
Именно в этой теме, имеет смысл не решать задачи в общем виде, а сразу подставлять числа.
Взаимные превращения механической и внутренней энергии
При неупругих ударах механическая энергия частично или полностью переходит во внутреннюю энергию тел, то есть тела могут нагреваться и плавится.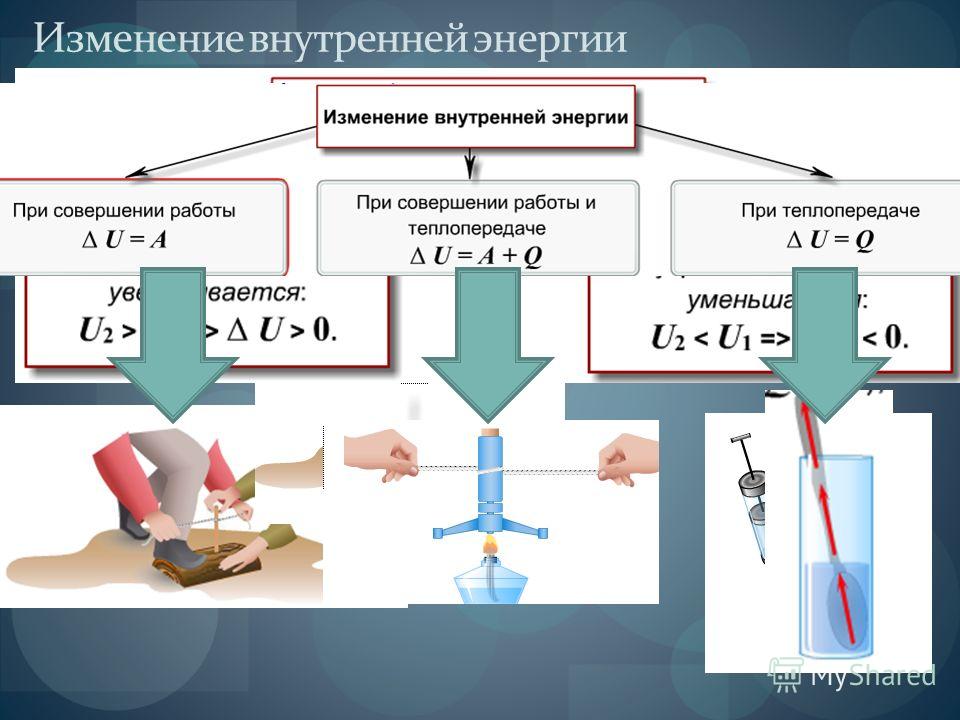 В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
В общем случае изменение механической энергии равно выделяющемуся количеству теплоты.
Работа идеального газа
К оглавлению…
Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно–кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно–кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими (или квазистационарными, еще одно название таких процессов — равновесные).
В изобарном процессе работу идеального газа можно рассчитывать по формулам:
Подчеркнем еще раз: работу газа по расширению можно считать по этим формулам только если давление постоянно. Согласно данной формуле, при расширении газ совершает положительную работу, а при сжатии – отрицательную (т.е. газ сопротивляется сжатию и над ним нужно совершать работу чтобы оно состоялось).
Если давление нельзя считать постоянным, то работу газа находят, как площадь фигуры под графиком в координатах (p, V). Очевидно, что в изохорном процессе работа газа равна нулю.
Ввиду того, что работа газа численно равна площади под графиком, становится понятно, что величина работы зависит от того, какой именно процесс происходил, ведь у каждого процесса свой график, а под ним своя площадь. Таким образом, работа зависит не только и не столько от начального и конечного состояний газа, сколько от процесса, с помощью которого конечное состояние было достигнуто.
Внутренняя энергия
К оглавлению…
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно–кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Внутренняя энергия одноатомного идеального газа рассчитывается по формулам:
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Это значит, что изменение внутренней энергии не зависит от того, как система была переведена из одного состояния в другое (а зависит лишь от характеристик первоначального и конечного состояний) и всегда, в любых процессах для одноатомного идеального газа определяется выражением:
Обратите внимание: эта формула верна только для одноатомного газа, зато она применима ко всем процессам (а не только к изобарному, как формула для работы).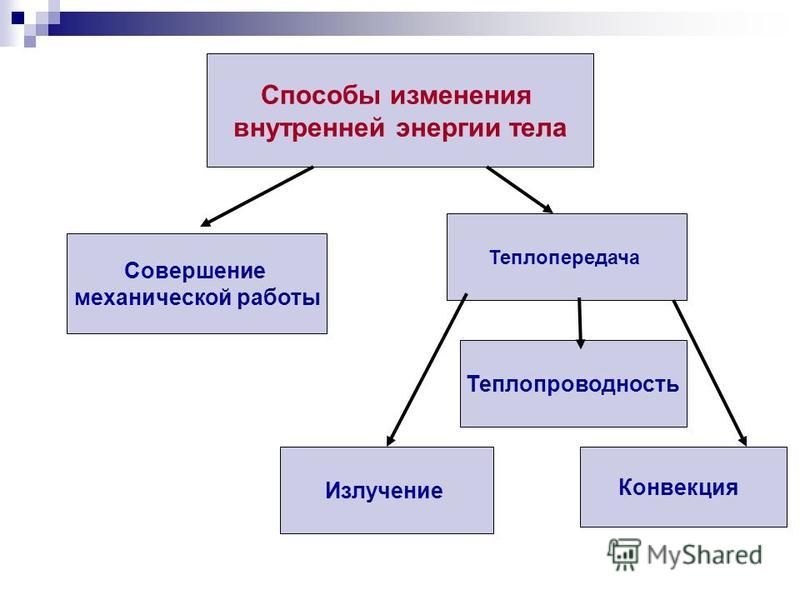 Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Как видно из формулы, если температура не изменялась, то внутренняя энергия остаётся постоянной.
Первый закон термодинамики
К оглавлению…
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон (начало) термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Однако, соотношение, выражающее первый закон термодинамики, чаще записывают в немного другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами (такая формулировка более удобна и понятна, в таком виде совсем очевидно, что это просто закон сохранения энергии).
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких–либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Адиабатным (адиабатическим) называют процесс, в ходе которого система не обменивается теплотой с окружающей средой. При адиабатном процессе Q = 0. Поэтому: ΔU + A = 0, то есть: A = – ΔU. Газ совершает работу за счет уменьшения собственной внутренней энергии.
Первое начало термодинамики и изопроцессы
К оглавлению…
Для различных изопроцессов можно выписать формулы по которым могут быть рассчитаны полученная теплота Q, изменение внутренней энергии ΔU и работа газа A. Изохорный процесс (V = const):
Изобарный процесс (p = const):
Изотермический процесс (T = const):
Адиабатный процесс (Q = 0):
Если в задаче явно не сказано, что газ одноатомный (или не назван один из инертных газов, например, гелий), то применять формулы из этого раздела нельзя.
Циклы. Тепловые машины
К оглавлению. ..
..
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т.д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0.
КПД тепловой машины может быть рассчитан по формуле:
где: Q1 – количество теплоты полученное рабочим телом за один цикл от нагревателя, Q2 – количество теплоты переданное рабочим телом за один цикл холодильнику. Работа совершенная тепловой машиной за один цикл:
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1).
Наибольший КПД при заданных температурах нагревателя T1 и холодильника T2, достигается если тепловая машина работает по циклу Карно. Цикл Карно состоит из двух изотерм и двух адиабат. КПД цикла Карно равен:
Второе начало (второй закон) термодинамики
К оглавлению…
Первый закон термодинамики не устанавливает направление протекания тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
При этом сама система и окружающие тела возвращаются к исходному состоянию.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из–за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т.д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У.Кельвин дал в 1851 году следующую формулировку второго закона: В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.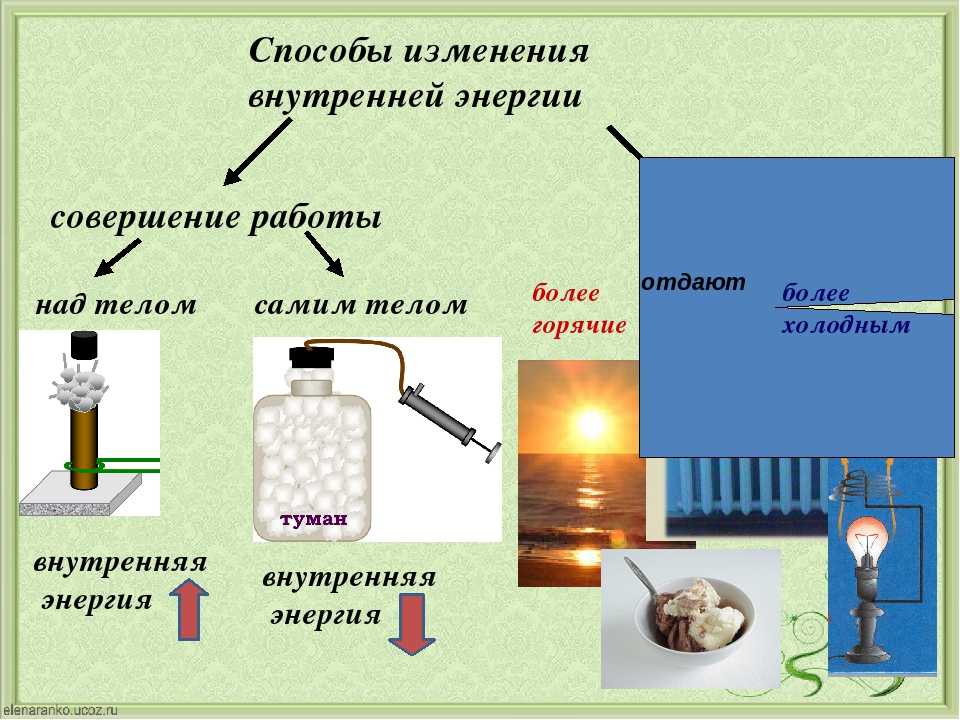
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». Как уже должно было стать понятно, второе начало термодинамики запрещает существование такого двигателя.
Немецкий физик Р.Клаузиус дал другую формулировку второго закона термодинамики: Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой. Следует отметить, что обе формулировки второго закона термодинамики эквивалентны.
Сложные задачи по термодинамике
К оглавлению…
При решении различных нестандартных задач по термодинамике необходимо учитывать следующие замечания:
- Для нахождения работы идеального газа надо построить график процесса в координатах p(V) и найти площадь фигуры под графиком. Если дан график процесса в координатах p(T) или V(T), то его сначала перестраивают в координаты p(V).
 Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V). - Для нахождения работы смеси газов используют закон Дальтона.
- При объединении теплоизолированных сосудов не должна изменяться внутренняя энергия всей системы, т.е. на сколько джоулей увеличится внутренняя энергия газа в одном сосуде, на столько уменьшится в другом.
- Вообще говоря, давление и температуру газа можно измерять только в состоянии термодинамического равновесия, когда давление и температура во всех точках сосуда одинаковы. Но бывают ситуации, когда давление одинаково во всех точках, а температура нет. Это может быть следствием разной концентрации молекул в разных частях сосуда (проанализируйте формулу: p = nkT).
- Иногда приходится в задачах по термодинамике использовать знания из механики.
Расчет КПД циклов по графику
К оглавлению. ..
..
Задачи данной темы по праву считаются одними из самых сложных задач в термодинамике. Итак, для решения Вам придется, во-первых, перевести график процесса в p(V) – координаты. Во-вторых, надо рассчитать работу газа за цикл. Полезная работа равна площади фигуры внутри графика циклического процесса в координатах p(V). В-третьих, необходимо разобраться, где газ получает, а где отдает теплоту. Для этого вспомните первое начало термодинамики. Внутренняя энергия идеального газа зависит только от его температуры, а работа – от объема. Поэтому, газ получает теплоту, если:
- Увеличиваются и его температура, и объем;
- Увеличивается объем, а температура постоянна;
- Увеличивается температура, а объем постоянен.
Газ отдает теплоту, если:
- Уменьшаются и его температура, и объем;
- Уменьшается объем, а температура постоянна;
- Уменьшается температура, а объем постоянен.

Если один из параметров увеличивается, а другой уменьшается, для того, чтобы понять, отдает газ теплоту или получает ее, необходимо «в лоб» по первому началу термодинамики рассчитать теплоту и посмотреть на ее знак. Положительная теплота – газ ее получает. Отрицательная – отдает.
Первый тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ получает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, полученная газом за один цикл, то есть теплота только в тех процессах, в которых газ получал ее.
Второй тип задач. В p(V) – координатах график цикла представляет собой фигуру с легко вычисляемой площадью, и газ отдает теплоту в изохорных и изобарных процессах. Применяйте формулу:
Обратите внимание, что в знаменателе стоит только теплота, отданная газом за один цикл, то есть теплота только в тех процессах, в которых газ отдавал ее.
Третий тип задач. Газ получает теплоту не в удобных для расчета изохорных или изобарных процессах, в цикле есть изотермы или адиабаты, или вообще «никакие» процессы. Применяйте формулу:
Свойства паров. Влажность
К оглавлению…
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно–кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, т.е. число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, это значит, что скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Насыщенный пар имеет максимальные: давление, концентрацию, плотность при данной температуре. Они зависят только от температуры насыщенного пара, но не от его объема.
Это означает, что если бы мы сосуд закрыли не крышкой, а поршнем, и после того, как пар стал насыщенным, стали бы его сжимать, то давление, плотность и концентрация пара не изменились бы. Если быть более точным, то давление, плотность и концентрация на небольшое время увеличились бы, и пар стал бы перенасыщенным.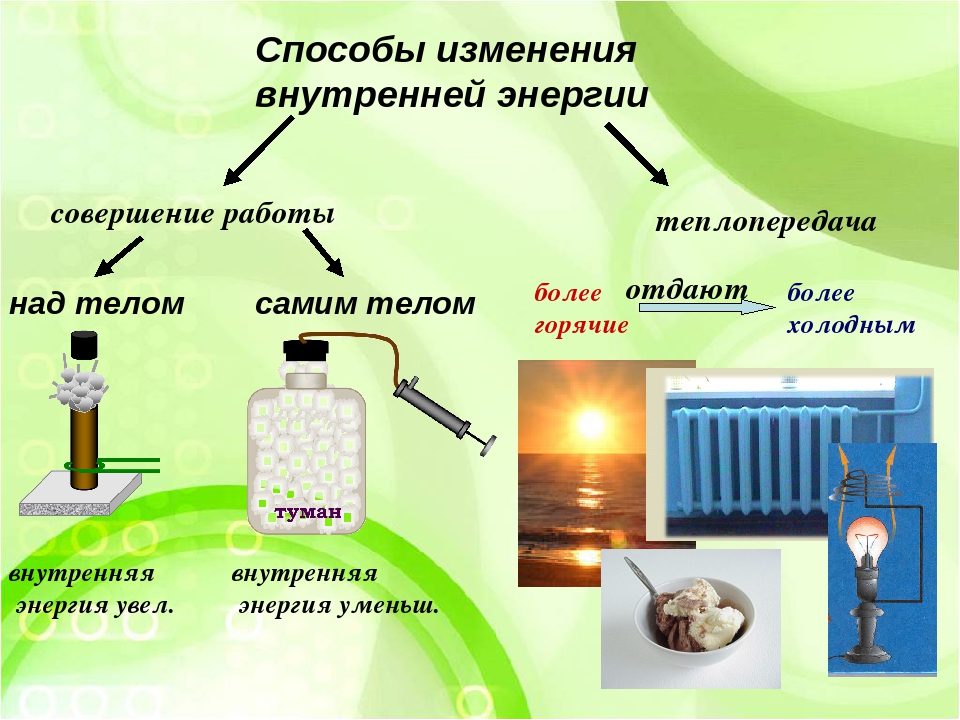 Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
Но сразу же часть пара превратилась бы в воду, и параметры пара стали бы прежними. Если поднять поршень, то пар перестанет быть насыщенным. Однако за счёт испарения через некоторое время снова станет насыщенным. Здесь следует учесть, что если воды на дне сосуда нет или её немного, то это испарение может оказаться недостаточным, чтобы пар снова стал насыщенным.
- Фраза: «В закрытом сосуде с водой…» – означает, что над водой насыщенный пар.
- Выпадение росы означает, что пар становится насыщенным.
Абсолютной влажностью ρ называют количество водяного пара, содержащегося в 1 м3 воздуха (т.е. просто плотность водяных паров; из уравнения Клапейрона-Менделеева выражается отношение массы к объему и получается следующая формула):
где: р – парциальное давление водяного пара, М – молярная масса, R – универсальная газовая постоянная, Т – абсолютная температура. Единица измерения абсолютной влажности в СИ [ρ] = 1 кг/м3, хотя обычно используют 1 г/м3.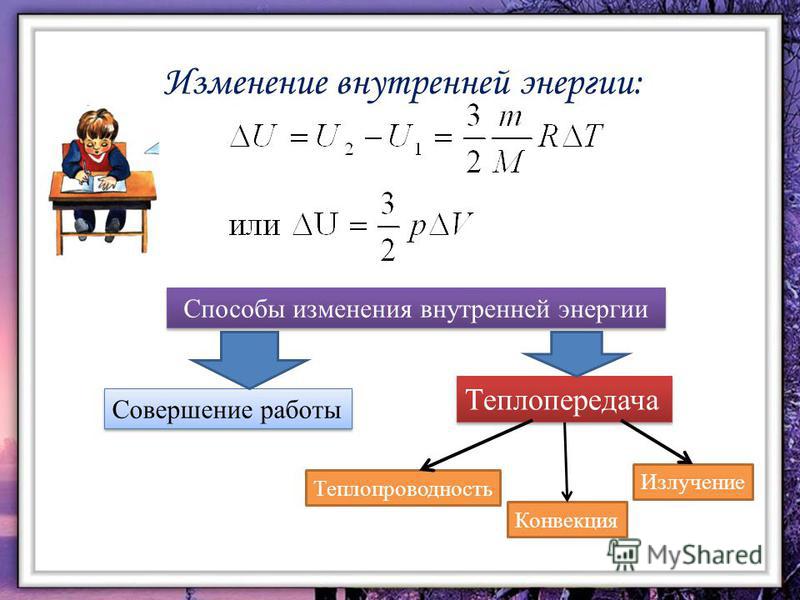
Относительной влажностью φ называется отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м3 воздуха при данной температуре:
Относительную влажность можно также определить как отношение давления водяного пара р к давлению насыщенного пара р0 при данной температуре:
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.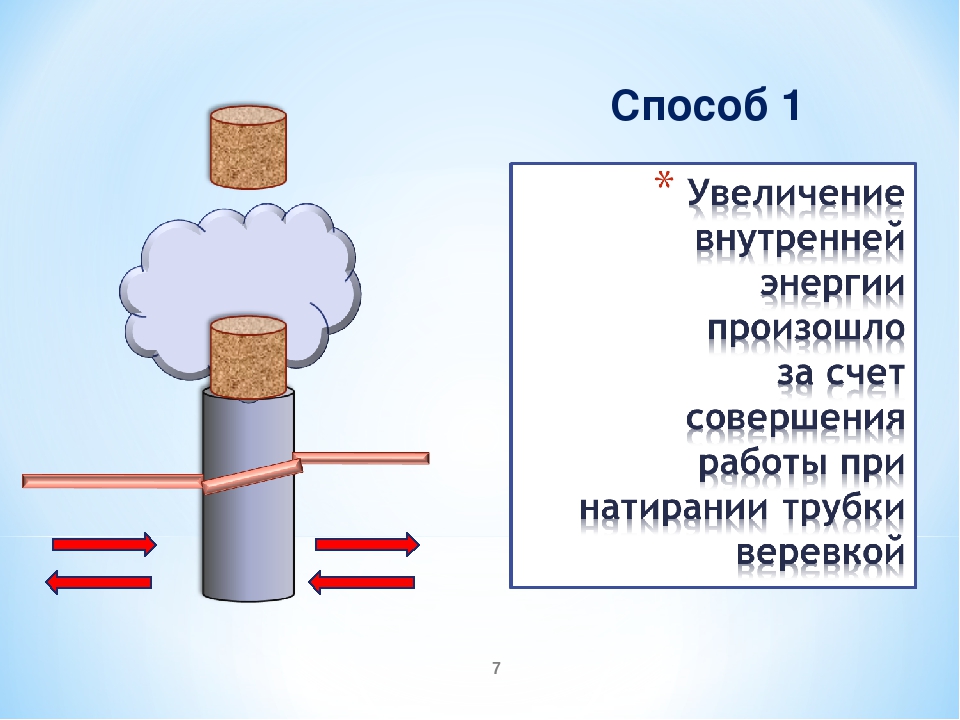
В частности, при нормальном атмосферном давлении вода кипит при температуре 100°С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. Важно знать, что температура кипения жидкости зависит от давления. В герметически закрытом сосуде жидкость кипеть не может, т.к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
Поверхностное натяжение
К оглавлению…
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может скачком переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Ep поверхности жидкости пропорциональна ее площади:
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости на единицу при постоянной температуре. В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии (любое тело всегда стремится скатиться с горы, а не забраться на нее). Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку. Сила поверхностного натяжения, действующая на участок границы жидкости длиной L вычисляется по формуле:
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. При этом высота столба жидкости в капилляре:
где: r – радиус капиляра (т.е. тонкой трубки). При полном смачивании θ = 0°, cos θ = 1. В этом случае высота столба жидкости в капилляре станет равной:
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жидкости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр.
| 1 Газы 2 Микроскопические энергии 3 Первый закон 4 2-й и 3-й законы 5 Фазовые переходы 6 Смеси 7 Фазовые диаграммы 8 Равновесие 9 Молекулярные | Внутренняя энергия |
Энтальпия |
Термохимия | Функции изменения Для изучения термодинамики нам необходимо определить несколько основных идей.
Внутренняя энергия В предыдущем разделе мы видели, что можем рассчитать энергию
вклады поступательных, колебательных и вращательных мод
движения отдельных молекул в образце. Вместо этого мы полагаемся на
тот факт, что U был определен как состояние
функции, и поэтому мы всегда можем измерить различия в U при изменении системы с
некоторого начального состояния в конечное состояние. Напоминаем, что функция состояния — это функция, которую можно вычислить из
параметры состояния системы, такие как температура, объем, давление, число молей,
масса и т.д… Мы можем написать уравнение для внутренней энергии при начальная или конечная энергия как
Вклад во внутреннюю энергию этих три формы кинетической энергии составляют примерно 1/2 кТл на градус Свобода. Когда мы подсчитываем степени свободы, мы ограничиваем себя к тем, которые имеют энергетические уровни, которые доступны. Как правило, это перемещение (3 степени свободы) и вращение. (2 градуса, если линейно, и 3 градуса, если нелинейно). Таким образом, мы есть следующие Для одноатомных (идеальных) газов внутренняя энергия равна просто Таким образом, мы видим, что внутренняя энергия растет линейно с температурой с наклоном 3/2R . Для линейных молекул внутренняя энергия равна сумме поступательной кинетической энергии и вращательной энергии (два градуса свободы)
Таким образом, мы видим, что внутренняя энергия растет линейно
с температурой с наклоном 5/2R . Для нелинейных молекул внутренняя энергия равна сумма поступательной кинетической энергии и вращательной энергии (три степеней свободы)
Таким образом, мы видим, что внутренняя энергия растет линейно с температурой с наклоном 2R . Ясно, что количество тепла, необходимое для
температура системы зависит от этих различных режимов и нелинейных
молекулам потребуется больше тепла, чем линейным, что, в свою очередь,
потребовало бы больше тепла, чем атомарные виды для данного роста
температура. Например, окна «low E» содержат аргон.
впрыскивается между двумя (или даже тремя) стеклами (также покрытыми для
уменьшить лучистую передачу ИК). Этот газ имеет низкую
способность поглощать тепло (без вибраций и вращений) и, следовательно,
будет переносить небольшое количество тепла между холодным стеклом и теплым
панель по сравнению с воздухом, которая состоит в основном из многоатомных
такие молекулы, как O 2 или N 2 . Первый закон термодинамикиПервый закон термодинамики обычно утверждается во многом. «Энергия не может быть ни создана, ни уничтожена», «энергия Вселенной постоянна», и, пожалуй, наиболее полезным является «Энергия изолированной системы постоянна». Из практических соображений лучше ограничиться нашими измерениями. малые системы. Измерения, которые мы можем сделать, не связаны с U напрямую. Мы измеряем такие вещи, как температура, давление, объем и из этого мы можем рассчитать изменение энергии в результате теплопередачи и работы. Таким образом, мы можем написать Это выражение заключает в себе первый закон
термодинамика в том смысле, что единственными двумя способами обмена энергией
между системой и вселенной через теплопередачу, q , или работа, ш . Например, изменение внутренней энергии пружину можно рассчитать, зная работу, совершенную при ее взводе, скажем, 100 Дж , и измеряя потери тепла в окружающую среду, 15 Дж как
Внимательно следя за соглашением о знаках, мы можем теперь определите, что есть чистое изменение внутренней энергии пружина +85 Дж после он намотан, по сравнению с до намотки. Работы по расширению При измерении работы у нас может быть несколько форм.
Мы можем измерить механическую работу, |w|
= f×d , из простых физических понятий мы могли бы также
измерять работу электричества как произведение переданного заряда
и напряжение, при котором он перемещался, скажем, через электрическую
мотор. давайте рассмотрим бесконечно малое изменение энергии для процесс выполняется очень маленькими шагами. Мы хотим ограничиться работой, проделанной устранение теплообмена (адиабатический процесс). Мы можем определить функцию проделанной работы, начиная с простыми физическими понятиями.Рассмотрим работу, совершенную при перемещении объект на расстоянии дз против сила величиной F .
Итак, теперь нам нужно проинтегрировать общее давление и изменение объема, чтобы найти полную выполненную работу. IЕсли мы сможем создать условия, чтобы внешнее давление постоянно, а изменение объема происходит за один «мгновенный» шаг, тогда интеграция становится легкой
Так как расширение было выполнено против константы давление, интеграл решается как
Поскольку PV постоянна для идеального газа, она невозможно изменить V, сохраняя P постоянным, если либо T, либо n изменения. Таким образом, это уравнение полезно либо специально эксперименты с контролируемым изменением температуры или в случаях, когда изменение объема вызвано химической реакцией, которая либо создает или использует чистое количество молекул газа. Как правило, если меняется V, меняется и P, поэтому простой функция не всегда работает.Мы можем исследовать идею обратимую работу, рассматривая расширение и сжатие идеальный газ в цилиндре, температура которого всегда постоянна (изотермический): Первоначально мы находимся в состоянии A, удерживая газ в
объем В А в цилиндре с давлением р А .
Обратите внимание, что работа проделанная работа по сжатию газа была больше, чем проделанная работа газом в окрестностях. Таким образом, мы теряют энергию в этом циклическом процессе.
Теперь рассмотрим
снова тот же процесс, но где мы бесконечно сбрасываем давление
медленно, так что мы всегда следуем точному
изотерма pV .В этом случае мы идем по пути 3 в
любом направлении, и мы отмечаем, что работа, проделанная над окружающей средой
системой в фазе расширения точно так же, как работа
выполняется средой в системе на этапе сжатия. Обратите внимание, что в течение всего этого процесса система и вселенная находятся в равновесии друг с другом. Уравнение для этого очень медленного процесса слегка отличается от уравнения 3.8 потому что под обратимых условиях, которые мы описываем здесь, давление в системе и давление окружающей среды всегда равны. Таким образом, мы можем написать Если наша система содержит идеальный газ, уравнение которого состояния p=nRT/V , мы получить:
Если конечный объем больше начального
объема, то интеграл будет положительным, а работа будет
отрицательный.Другими словами, система действительно работала (теряла энергию) за счет
отталкивая окружающих. Если конечный объем меньше начального объем, то интеграл будет отрицательным и, следовательно, работа будет положительный. Окружение проделало работу над системой (которая теперь у него больше энергии). Пример: какая работа будет совершена, если 50 г железо реагирует с избытком соляной кислоты; а) в закрытом сосуде фиксированного объема и б) в открытом контейнере при 25ºC. В химической реакции между кислотой Бренстеда-Лоури и металл, металл окисляется и выделяется газообразный водород. Таким образом, сбалансированная реакция Fe(т) + 2 H + (водн.) → Fe 2+ (водн.) + Н 2 (г) а) это просто, так как нет изменения объема, нет выполненной работы. ш = 0 . б) в этом случае выделяется газ, который
занимает значительно больший объем, чем твердое и кислотное.
Таким образом, ΔV = V f – V i . ΔV = V h3 = nRT/p ex . Таким образом, выполненная работа, согласно уравнение 3.9 это w = –p ex (nRT/p ex ) = nRT Итак, все, что нам нужно сделать, это определить количество родинок газа выделилось, n , и мы можно вычислить совершенную работу.
Процессы постоянного объемаВ общем случае можно написать уравнение изменения внутреннего энергия системы для любого процесса как
, где два рабочих термина предназначены для работы по расширению (exp) и любых других форма работы (e для дополнительной), которая может быть задействована в процессе, например, электрические работы. Итак, если предположить, что в системе нет электрических или других pV работают и предполагают объем не изменится, мы можем переписать это уравнение как Интегрируя, мы получаем макроскопическую измеримую Итак, мы можем написать (надеюсь) знакомое уравнение
для изменения внутренней энергии системы, совершающей процесс
при постоянном объеме. Как мы намекали ранее, если энергия системы изменяется через изменение температуры у нас может возникнуть соблазн определить количество изменения энергии, связанного с изменением температуры, по уравнению
где С это теплоемкость. Теплоемкость – экстенсивное свойство
в том, что это зависит от количества материала. Тем не мение,
теплоемкости часто заносят в таблицы как интенсивные свойства, основанные на
либо по массе (удельная теплоемкость), либо по количеству молей (молярная теплоемкость
емкость). Уравнение 3.15 представляет собой
прямолинейное уравнение, которое делает предположение, что значение для
теплоемкость (наклон) постоянна с температурой.
Это не всегда верно. Лучшее определение теплоемкости
учитывает это и допускает, что теплоемкость
наклон принимается за бесконечно малый шаг по температуре. Пример. Какова теплоемкость одноатомный идеальный газ? Уравнение энергии моля одноатомного
идеальный газ это уравнение 3.3, U м = U м (0)+ 3/2 RT . Очевидно, что одноатомный идеальный газ обладает теплотой емкость, не зависящая от температуры. Жара изменение емкости при изменении температуры для многоатомных газов потому что статистические суммы зависят от температуры (уравнение 2.33) и, таким образом, само уравнение энергии для этих газы меняются с температурой.
В общем, определяющее уравнение для теплоемкости
(уравнение 3.16 при постоянном объеме) должно быть
используется, поскольку C v на самом деле является функцией T и должна быть
рассматривается при интегрировании, а не как константа. Чтобы получить измеримые числа, нам нужно интегрировать. Если мы можем с уверенностью предположить, что теплоемкость постоянна в течение диапазон температур, который мы используем, тогда мы можем использовать упрощенный версия
Нижний индекс V указывает, что эти уравнения применимы только в условиях постоянного объема. Дополнительный пример: Мы видели, что если мы снабжаем систему теплом, она имеет разные способы обращения с ним. Иногда система температура изменяется по мере того, как тепло идет на увеличение кинетической энергии но в других случаях кажется, что температура практически не меняется (например, изменение фазы) Давайте посмотрим на наш статистический подход для некоторых ответы: Уравнение 2. Мгновенный наклон относительно Температура дает нам Помните: ν рот равен 0 для одноатомного, 2 для двухатомного (линейного) и 3 для нелинейного и нам нужно проверить режимы вибрации, чтобы увидеть, активны ли они на основе . Что такое C ν,m для воды при 100ºC?. Три частоты колебаний воды равны .
поэтому мы заключаем, что колебательные моды не вклад в теплоемкость воды при этой температуре. Таким образом, Помните, что поскольку вода нелинейна, ν рот = 3. Экспериментальное значение для С ν,м 26.1 Дж/моль.К. Учитывая, что мы проигнорировали вибрации вполне, не плохо. |
Глава 3а — Первый закон — Замкнутые системы
Глава 3а — Первый закон — Замкнутые системы — Энергия (обновлено 17.01.11)Глава 3: Первый закон термодинамики для Закрытые системы
а) Уравнение энергии для закрытых систем
Мы считаем, что первый закон термодинамики применяется
к стационарным замкнутым системам как закон сохранения энергии. Таким образом, энергия передается между системой и окружающей средой в
форма теплоты и работы, в результате которой происходит изменение внутренней энергии
системы. Изменение внутренней энергии можно рассматривать как меру
молекулярной активности, связанной с изменением фазы или температуры
системы и уравнения энергии представляется следующим образом:
Таким образом, энергия передается между системой и окружающей средой в
форма теплоты и работы, в результате которой происходит изменение внутренней энергии
системы. Изменение внутренней энергии можно рассматривать как меру
молекулярной активности, связанной с изменением фазы или температуры
системы и уравнения энергии представляется следующим образом:
Тепло (Q)
Энергия, передаваемая через границу системы в форма теплоты всегда возникает из-за разницы температур между системой и ее ближайшим окружением.Мы не будем рассмотреть способ передачи тепла, будь то теплопроводность, конвекция или излучением, таким образом, количество тепла, переданного во время любого процесс будет либо задан, либо оценен как неизвестное уравнение энергии. По соглашению положительная теплота – это теплота, переданная из окружающей среды в систему, что приводит к увеличению внутренняя энергия системы
Работа (Вт)
В этом курсе мы рассматриваем три режима работы передача через границу системы, как показано в следующем схема:
В этом курсе мы прежде всего занимаемся Граничные работы из-за сжатия или расширения системы в
цилиндро-поршневое устройство, как показано выше. Во всех случаях мы предполагаем
идеальное уплотнение (отсутствие массового потока в системе и из нее), отсутствие потерь из-за
трения, а квазиравновесные процессы в том, что для каждого
пошаговое движение поршня условия равновесия
поддерживается. По соглашению положительная работа — это работа, совершаемая системой на
окружение, а отрицательная работа совершается окружением
на систему, Таким образом, поскольку отрицательная работа приводит к увеличению
внутренней энергии системы, этим и объясняется отрицательный знак
приведенное выше уравнение энергии.
Во всех случаях мы предполагаем
идеальное уплотнение (отсутствие массового потока в системе и из нее), отсутствие потерь из-за
трения, а квазиравновесные процессы в том, что для каждого
пошаговое движение поршня условия равновесия
поддерживается. По соглашению положительная работа — это работа, совершаемая системой на
окружение, а отрицательная работа совершается окружением
на систему, Таким образом, поскольку отрицательная работа приводит к увеличению
внутренней энергии системы, этим и объясняется отрицательный знак
приведенное выше уравнение энергии.
Граничная работа оценивается интегрированием силы F умножается на приращение расстояния, пройденного d x между начальное состояние (1) в конечное состояние (2). Обычно мы имеем дело с устройство поршень-цилиндр, при этом сила может быть заменена поршнем площадь A, умноженная на давление P, что позволяет нам заменить A. d x изменением объема d V, следующим образом:
Это показано на следующей принципиальной схеме.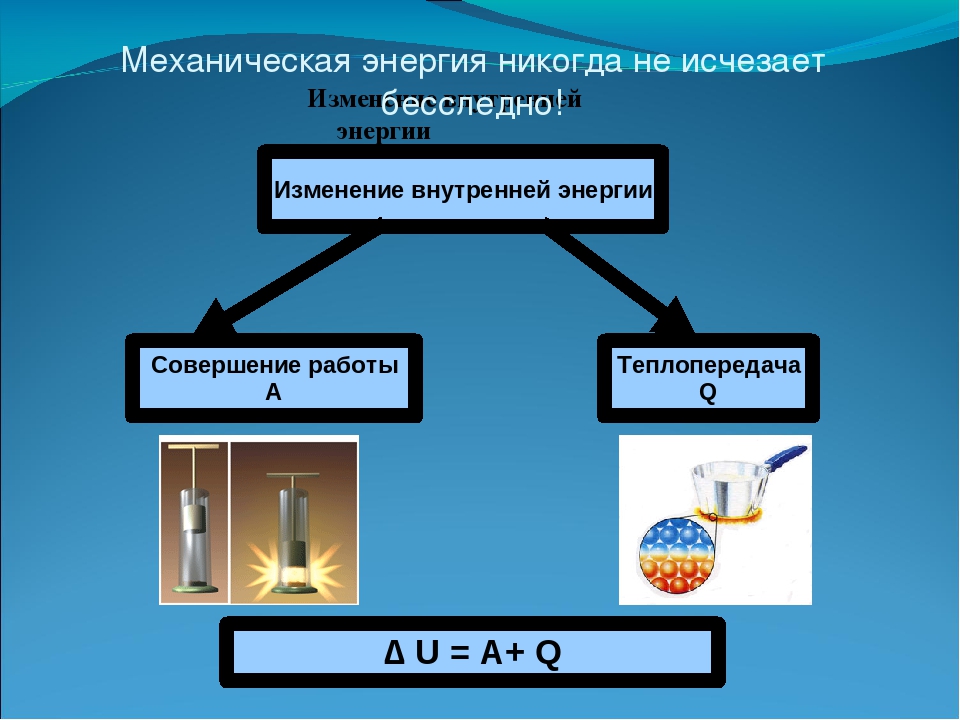 где мы напомним, что интегрирование может быть представлено площадью под
Кривая.
где мы напомним, что интегрирование может быть представлено площадью под
Кривая.
Обратите внимание, что выполненная работа представляет собой путь . Функция , а не свойство, поэтому она зависит от пути процесса между начальным и конечным состояния. Напомним в главе 1 что мы ввели какой-то типовой процесс маршруты интереса:
Изотермический (процесс с постоянной температурой)
Изохорный или Изометрический (процесс постоянного объема)
Изобарический (процесс постоянного давления)
Адиабатический (отсутствие потока тепла в систему или из системы во время процесса)
Иногда бывает удобно оценить конкретное проделанная работа, которая может быть представлена диаграммой P-v , таким образом, если масса системы m [кг] окончательно имеем:
Заметим, что работа, проделанная системой на
окружение (процесс расширения) является положительным, и то, что делается на
системы окружающей средой (процесс сжатия) отрицательна.
Наконечник для закрытой системы Вал Работа (из-за гребного колеса) и Электромонтажные работы (из-за напряжения, приложенного к электрическому резистору или двигатель, приводящий в движение крыльчатку) всегда будет отрицательным (работа, выполненная на система). Положительные формы работы вала, например, из-за турбины, будут рассмотрены в главе 4, когда мы будем обсуждать открытые системы.
Внутренняя энергия (у)
Третий компонент нашей Замкнутой Системы Энергии Уравнение представляет собой изменение внутренней энергии в результате передачи тепла или работы.Поскольку удельная внутренняя энергия является свойством системы, она обычно представлена в таблицах свойств, таких как пар Таблицы . Рассмотрим, например, следующая решенная проблема.
Решенная проблема 3.1 — Отзыв Решенная задача 2.2 в главе 2a , в котором мы представили константу процесс давления. Мы хотим расширить задачу, включив в нее энергию взаимодействия процесса, поэтому мы переформулируем его следующим образом:
Два килограмма воды при температуре 25°C помещают в
поршневой цилиндр устройства под 3. давление 2 МПа, как показано на диаграмме
(Состояние (1)). К воде при постоянном давлении добавляется тепло до тех пор, пока
температура пара достигает 350°С (состояние (2)). Определять
работа, совершаемая жидкостью (W), и теплота, передаваемая жидкости (Q)
во время этого процесса.
давление 2 МПа, как показано на диаграмме
(Состояние (1)). К воде при постоянном давлении добавляется тепло до тех пор, пока
температура пара достигает 350°С (состояние (2)). Определять
работа, совершаемая жидкостью (W), и теплота, передаваемая жидкости (Q)
во время этого процесса.
Подход к решению:
Сначала мы рисуем схему процесса, включая все соответствующие данные следующим образом:
Обратите внимание на четыре вопроса справа от
диаграмму, которую мы всегда должны спрашивать, прежде чем пытаться решить какую-либо
термодинамическая задача.С чем мы имеем дело — с жидкостью? чистая жидкость,
например, пар или хладагент? идеальный газ? В данном случае это пар.
таким образом, мы будем использовать паровые таблицы для определения различных свойств
в различных штатах. Масса или объем даны? Если да, то мы будем
укажите и оцените уравнение энергии в килоДжоулях, а не
удельные количества (кДж/кг). Что насчет энтропии? Не так быстро — мы
еще не рассматривали энтальпию (ниже) — терпеливо ждите, пока Глава
6 .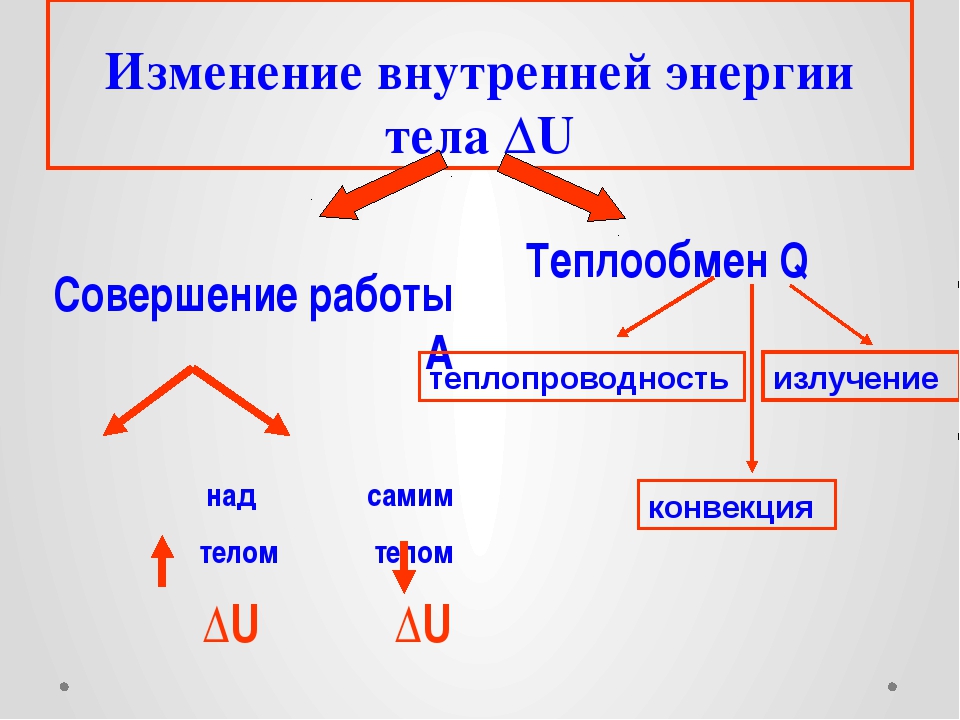
Поскольку в работе участвует интеграл от P. д в мы сочтут удобным набросать схему P-v задачи как следует:
Обратите внимание на диаграмму P-v , как мы определяем удельная работа, выполненная как площадь под кривой процесса. Мы тоже обратите внимание, что в области сжатой жидкости постоянная температура линия практически вертикальная. Таким образом, все значения свойств в State (1) (сжатая жидкость при 25°C) можно определить по насыщенному жидкостные табличные значения при 25°C.
Энтальпия (h) — новое свойство
В следующих тематических исследованиях мы обнаруживаем, что один из
основные приложения уравнения энергии замкнутой системы находятся в
процессы теплового двигателя, в которых система аппроксимируется идеальной
газа, таким образом, мы будем развивать соотношения для определения внутренней энергии
для идеального газа.Мы также обнаружим, что появилось новое свойство, называемое Энтальпия будет полезен как для закрытых систем, так и в частности
для открытых систем, таких как компоненты паровых электростанций или
холодильные системы. Энтальпия не является фундаментальным свойством,
однако представляет собой комбинацию свойств и определяется следующим образом:
Энтальпия не является фундаментальным свойством,
однако представляет собой комбинацию свойств и определяется следующим образом:
В качестве примера использования в закрытых системах, рассмотрим следующий процесс постоянного давления:
Применяя уравнение энергии, получаем:
Однако, поскольку давление постоянно процесс:
Подстановка в уравнение энергии и упрощение:
Значения удельной внутренней энергии (u) и удельной энтальпии (ч) доступны в Steam Таблицы , однако для идеальных газов это необходимо разработать уравнения для Δu и Δh в терминах удельных Теплоемкости.Разработаем эти уравнения в терминах дифференциальная форма уравнения энергии на следующей веб-странице:
Специальный Теплоемкость идеального газа
Мы предоставили значения свойств для различных идеальных газов, включая газовую постоянную и удельную теплоемкость в следующая веб-страница:
Свойства различных идеальных газов (при 300 К)
________________________________________________________________________________
К Части б) Первый закон — двигатели с циклом Стирлинга
К Части c) Первый закон — дизельные двигатели
К Части d) Первый закон — двигатели цикла Отто
____________________________________________________________________________________
Инженерная термодинамика Израиля
Уриэли находится под лицензией Creative
Commons Attribution-Noncommercial-Share Alike 3. 0 США
Лицензия
0 США
Лицензия
Центральная наука, глава 5, раздел 2
Химия: основная наука, глава 5, раздел 2Мы видели, что потенциальная энергия системы может быть преобразована в кинетическую энергию и наоборот. Мы также видели, что энергия может передаваться туда и обратно между системой и ее окружением в виде работы и тепла. В общем, энергия может быть преобразована из одной формы в другую и передана из одной части Вселенной в другую.Как связаны все эти изменения в энергии? Одно из самых важных научных наблюдений заключается в том, что энергию нельзя ни создать, ни уничтожить: Энергия сохраняется. Любая энергия, потерянная системой, должна быть восполнена окружающей средой, и наоборот. Это важное и фундаментальное наблюдение известно как первый закон термодинамики . Чтобы применить этот закон количественно, давайте сначала более точно определим энергию системы.
Внутренняя энергия Мы будем использовать первый закон термодинамики для анализа энергетических изменений химических систем.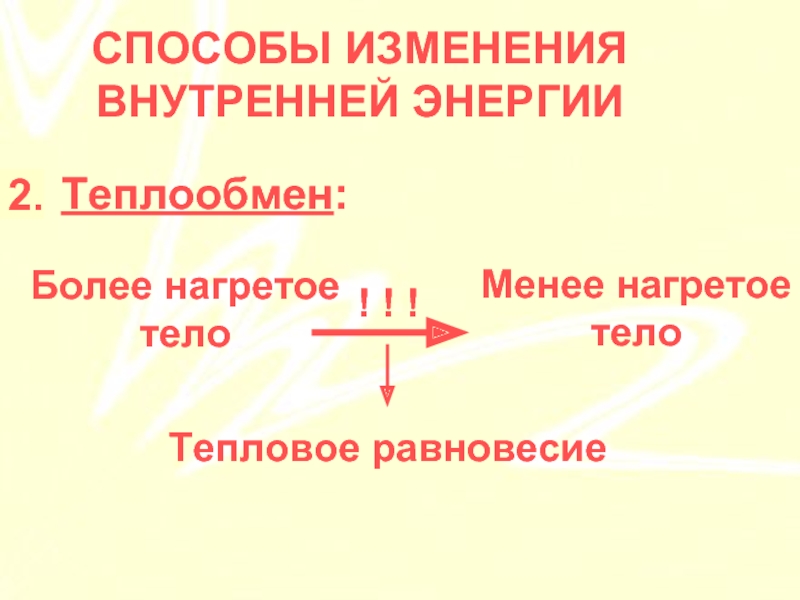 Для этого мы должны рассмотреть все источники кинетической и потенциальной энергии в системе. Нам будет удобно определить внутреннюю энергию системы как сумму всех кинетической и потенциальной энергии всех компонентов системы. Например, для системы на рис. 5.3 внутренняя энергия включает в себя не только движения и взаимодействия самих молекул H 2 и O 2 , но и составляющих их ядер и электронов.Обозначим внутреннюю энергию символом E.
Для этого мы должны рассмотреть все источники кинетической и потенциальной энергии в системе. Нам будет удобно определить внутреннюю энергию системы как сумму всех кинетической и потенциальной энергии всех компонентов системы. Например, для системы на рис. 5.3 внутренняя энергия включает в себя не только движения и взаимодействия самих молекул H 2 и O 2 , но и составляющих их ядер и электронов.Обозначим внутреннюю энергию символом E.
Теперь представьте, что мы начинаем с системы с начальной внутренней энергией, E , начальной . Затем система претерпевает изменения, которые могут включать в себя выполнение работы или передачу тепла. После изменения конечная внутренняя энергия системы равна E final . Мы определяем изменение внутренней энергии, обозначаемое E (читай «дельта E»), как разность между E конечным и E начальным .(Этот символ обычно используется для обозначения изменения . Например, изменение объема может быть представлено как В. ):
Например, изменение объема может быть представлено как В. ):
Мы не можем определить фактические значения E final или E initial ни для какой системы, представляющей практический интерес. Однако одним из прекрасных аспектов первого закона термодинамики является то, что нам нужно только значение E , чтобы применить закон. Мы можем определить значение E , даже если мы не знаем конкретных значений E final и E initial .
Термодинамические величины, такие как E , состоят из трех частей: число и единица, обозначающие величину изменения, и знак, указывающий направление. Положительное значение E получается, когда E final > E initial , что указывает на то, что система получает энергию из своего окружения. отрицательное значение E получается, когда E final < E initial , что указывает на то, что система потеряла энергию в своем окружении.
В химической реакции начальное состояние системы относится к реагентам, а конечное состояние — к продуктам. Когда водород и кислород образуют воду, система отдает энергию окружающей среде в виде тепла; поскольку система теряет тепло, внутренняя энергия продуктов меньше, чем у реагентов, и E для процесса отрицательна. Мы видим, что внутренняя энергия смеси H 2 и O 2 больше, чем у H 2 O, как показано на энергетической диаграмме на рисунке 5.5.
Рисунок 5.5 Система, состоящая из H 2 (g) и O 2 (g) , имеет большую внутреннюю энергию, чем система, состоящая из H 904 O 2 9045. Система теряет энергию ( E < 0), когда H 2 и O 2 преобразуются в H 2 O. Она получает энергию ( E > 908 H 0) O разлагается на H 2 и O 2 .
Относящийся E к теплу и работе Как мы отмечали в разделе 5. 1, любая система может обмениваться энергией с окружающей средой двумя основными способами: в виде тепла или в виде работы. Внутренняя энергия системы изменяется по величине по мере того, как к системе добавляется теплота или отводится от нее, или по мере того, как над ней или ею совершается работа. Мы можем использовать эти идеи, чтобы написать очень полезное алгебраическое выражение первого закона термодинамики. Когда система претерпевает какое-либо химическое или физическое изменение, соответствующее изменение ее внутренней энергии, E, , определяется теплотой, присоединенной к системе или выделившейся из нее, q, , плюс работа, совершенная над системой или системой, ш:
1, любая система может обмениваться энергией с окружающей средой двумя основными способами: в виде тепла или в виде работы. Внутренняя энергия системы изменяется по величине по мере того, как к системе добавляется теплота или отводится от нее, или по мере того, как над ней или ею совершается работа. Мы можем использовать эти идеи, чтобы написать очень полезное алгебраическое выражение первого закона термодинамики. Когда система претерпевает какое-либо химическое или физическое изменение, соответствующее изменение ее внутренней энергии, E, , определяется теплотой, присоединенной к системе или выделившейся из нее, q, , плюс работа, совершенная над системой или системой, ш:
Когда тепло передается из окружающей среды в систему, q имеет положительное значение.Точно так же, когда над системой работает окружение, w имеет положительное значение (рис. 5.6). Другими словами, как теплота, сообщаемая системе, так и работа, совершаемая над системой, увеличивают ее внутреннюю энергию.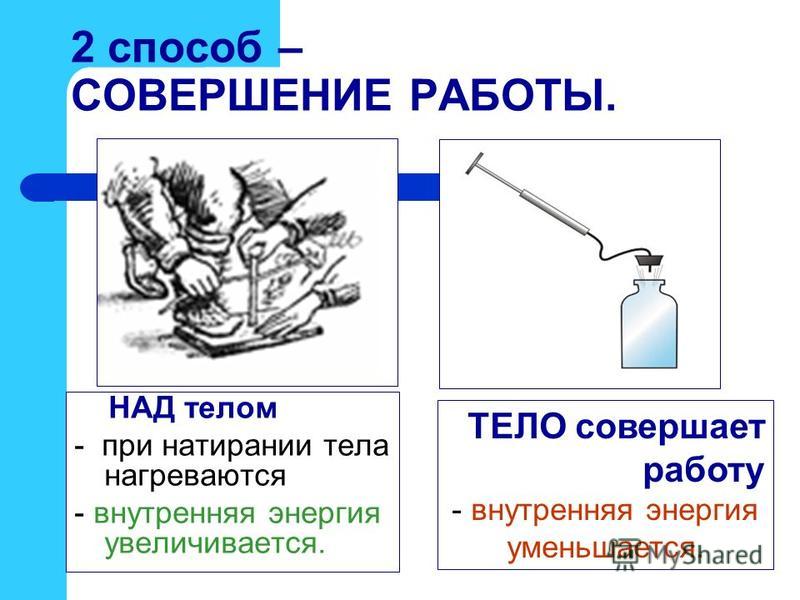 И наоборот, как тепло, отдаваемое системой в окружающую среду, так и работа, совершаемая системой над окружающей средой, имеют отрицательные значения; то есть они снижают внутреннюю энергию системы. Связь между знаками q и w и знаком E представлена в табл. 5.1. (Уравнение 5.4 иногда записывается как E = q — w. . В этом случае работа, совершаемая системой над окружающей средой, определяется как положительная. Это соглашение используется, в частности, во многих инженерных приложениях, которые сосредоточены на работа, совершаемая машиной над окружающей средой.)
И наоборот, как тепло, отдаваемое системой в окружающую среду, так и работа, совершаемая системой над окружающей средой, имеют отрицательные значения; то есть они снижают внутреннюю энергию системы. Связь между знаками q и w и знаком E представлена в табл. 5.1. (Уравнение 5.4 иногда записывается как E = q — w. . В этом случае работа, совершаемая системой над окружающей средой, определяется как положительная. Это соглашение используется, в частности, во многих инженерных приложениях, которые сосредоточены на работа, совершаемая машиной над окружающей средой.)
Рисунок 5.6 Теплота, q, , поглощаемая системой, и работа, w, , совершаемая системой, являются положительными величинами.Оба служат для увеличения внутренней энергии, E, системы: E = q + w.
ОБРАЗЕЦ УПРАЖНЕНИЯ 5.2 Газы водорода и кислорода в цилиндре, показанном на рис.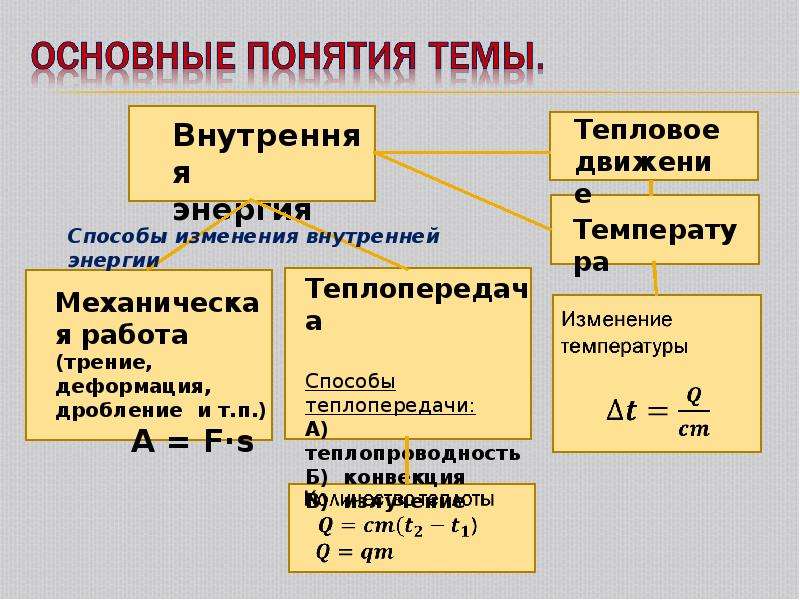 5.4, воспламеняются. При протекании реакции система теряет в окружающую среду 1150 Дж тепла. Реакция также заставляет поршень подниматься по мере расширения горячих газов. Расширяющийся газ совершает над окружающей средой работу 480 Дж, толкая атмосферу.Как изменится внутренняя энергия системы?
5.4, воспламеняются. При протекании реакции система теряет в окружающую среду 1150 Дж тепла. Реакция также заставляет поршень подниматься по мере расширения горячих газов. Расширяющийся газ совершает над окружающей средой работу 480 Дж, толкая атмосферу.Как изменится внутренняя энергия системы?
РЕШЕНИЕ Нам говорят, что тепло передается от системы к окружающей среде и что система совершает работу над окружающей средой. Из правил знаков для q и w (таблица 5.1) мы видим, что и q , и w отрицательны: q = -1150 Дж и w = -480 Дж. Мы можем вычислить изменение внутренней энергии, E, при использовании уравнения 5.4:
Мы видим, что из системы в окружающую среду передано 1630 Дж энергии.
ПРАКТИЧЕСКИЕ УПРАЖНЕНИЯ Рассчитайте изменение внутренней энергии системы для процесса, при котором система поглощает 140 Дж тепла из окружающей среды и совершает над окружающей средой работу 85 Дж.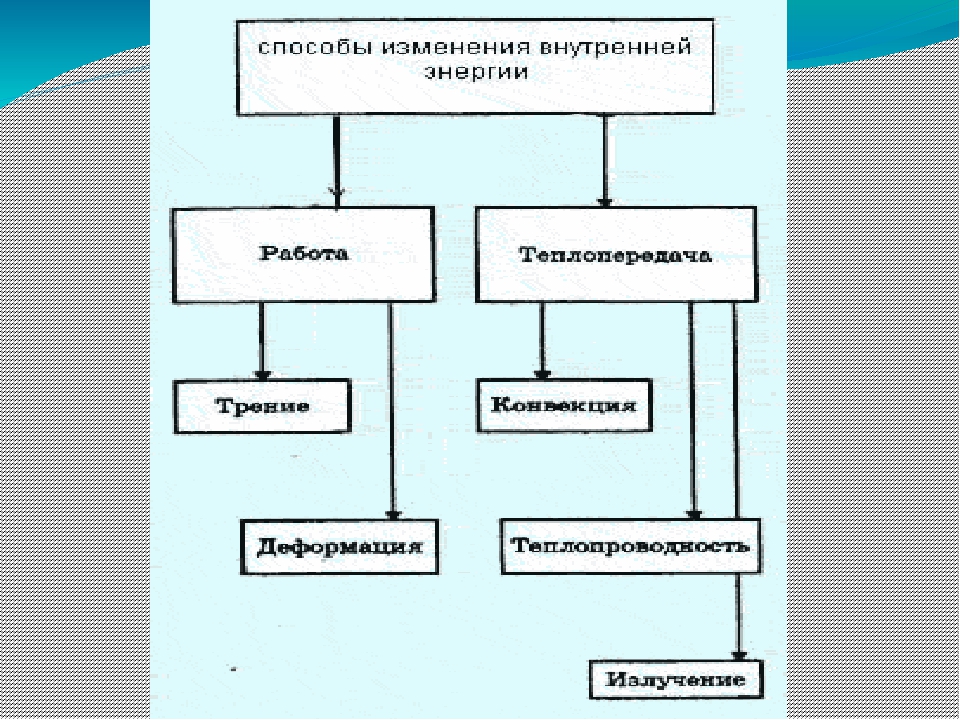 Ответ: +55 J
Ответ: +55 J
По мере развития этой главы мы увидим, что передача тепла в систему и из нее занимает центральное место в нашем обсуждении.Таким образом, у нас есть специальная терминология для обозначения направления теплопередачи. Когда происходит процесс, при котором система поглощает тепло, мы говорим, что этот процесс является эндотермическим ( эндо- — приставка, означающая «в»). Во время эндотермического процесса тепло поступает в систему из окружающей среды. Например, таяние льда — эндотермический процесс. Если мы, как часть окружения, касаемся сосуда, в котором тает лед, он кажется нам холодным, потому что от наших рук к сосуду перешло тепло.
Процесс, в результате которого выделяется тепло, называется экзотермическим ( экзо- — приставка, означающая «из»). Во время экзотермического процесса тепло течет из системы в ее окружение.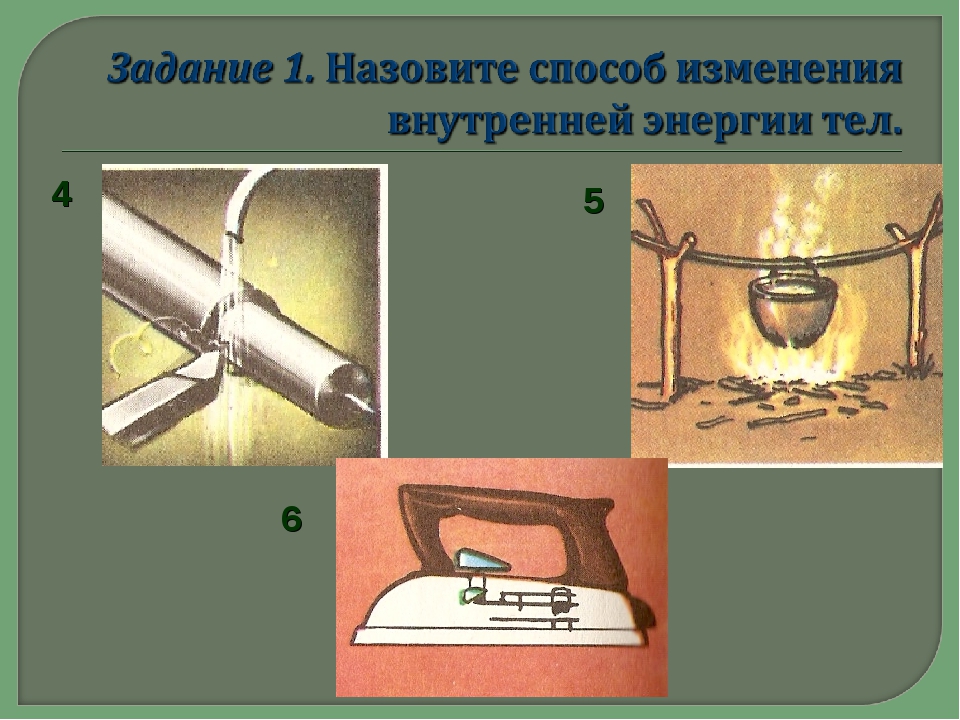 Сгорание бензина является примером экзотермического процесса. На рис. 5.7 показаны другие примеры эндотермических и экзотермических процессов.
Сгорание бензина является примером экзотермического процесса. На рис. 5.7 показаны другие примеры эндотермических и экзотермических процессов.
Хотя у ученых обычно нет возможности узнать точное значение внутренней энергии системы, они знают, что она имеет фиксированное значение для данного набора условий.Условия, влияющие на эту энергию, включают температуру и давление. Кроме того, полная внутренняя энергия системы пропорциональна общему количеству вещества в системе; энергия является экстенсивным свойством.
Предположим, мы определяем нашу систему как 50 г воды при 25°C, как показано на рис. 5.8. Наша система могла бы прийти в это состояние, если бы мы охладили 50 г воды от 100°С или растопили 50 г льда и впоследствии нагрели воду до 25°С. Внутренняя энергия воды при 25°С одинакова в обоих случаях.Внутренняя энергия системы — это функция состояния , свойство системы, которое определяется указанием ее состояния или ее состояния (с точки зрения температуры, давления, местоположения и т.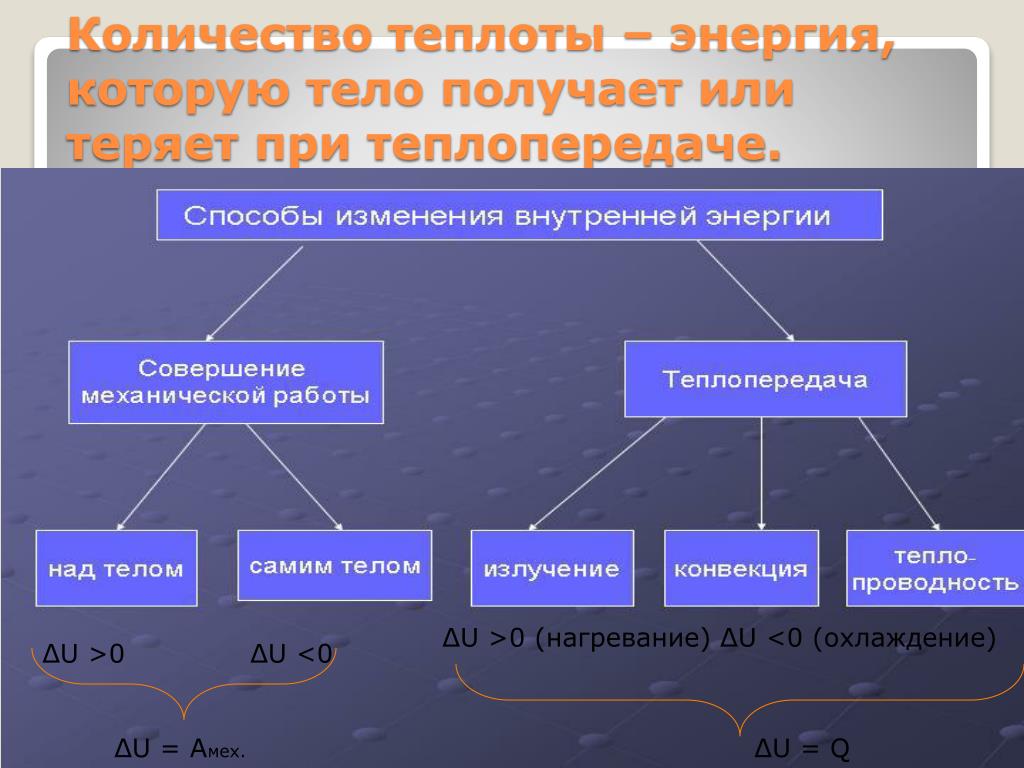 д.). Значение функции состояния не зависит от конкретной истории образца, а только от его текущего состояния. Поскольку E является функцией состояния, E зависит только от начального и конечного состояний системы, а не от того, как происходит изменение.
д.). Значение функции состояния не зависит от конкретной истории образца, а только от его текущего состояния. Поскольку E является функцией состояния, E зависит только от начального и конечного состояний системы, а не от того, как происходит изменение.
Рис. 5.8 Внутренняя энергия, функция состояния, зависит только от настоящего состояния системы, а не от пути, по которому она пришла к этому состоянию. Внутренняя энергия 50 г воды при 25°С одинакова, если воду охладить от более высокой температуры до 25°С или получить путем растапливания 50 г льда и последующего нагревания до 25°С.
Аналогия может объяснить разницу между величинами, которые являются функциями состояния, и теми, которые ими не являются. Предположим, вы путешествуете между Чикаго и Денвером.Чикаго находится на высоте 596 футов над уровнем моря; Денвер находится на высоте 5280 футов над уровнем моря. Независимо от того, какой маршрут вы выберете, изменение высоты будет составлять 4684 фута. Однако расстояние, которое вы проедете, будет зависеть от вашего маршрута. Высота аналогична функции состояния, потому что изменение высоты не зависит от выбранного пути. Пройденное расстояние не является функцией состояния.
Однако расстояние, которое вы проедете, будет зависеть от вашего маршрута. Высота аналогична функции состояния, потому что изменение высоты не зависит от выбранного пути. Пройденное расстояние не является функцией состояния.
Некоторые термодинамические величины, такие как E, , являются функциями состояния. Другие нет. Особый интерес при обсуждении первого закона представляют q и w, , которые связаны с E в уравнении 5.4. Нам важно понять, что q и w не являются функциями состояния, хотя E = q + w является функцией состояния. Другими словами, удельные количества тепла и работы, произведенные при изменении состояния системы, зависят от способа, которым осуществляется это изменение, аналогично выбору различных маршрутов движения между Чикаго и Денвером. Хотя отдельные значения q и w не являются функциями состояния, их сумма является функцией состояния; если изменение пути из начального состояния в конечное увеличивает значение q, , оно также уменьшает значение w точно на ту же величину и так далее.
Мы можем проиллюстрировать этот принцип на простом примере, показанном на рис. 5.9, в котором мы рассматриваем два возможных способа разрядки батареи фонарика при постоянной температуре. Если батарея замкнута накоротко катушкой провода, работа не совершается, потому что ничто не движется против силы. Вся энергия батареи теряется в виде тепла (катушка проволоки нагревается и отдает тепло окружающему воздуху). Напротив, если батарея используется для вращения небольшого двигателя, разряд батареи производит работу.Также будет выделяться некоторое количество тепла, хотя и не так много, как при коротком замыкании аккумулятора. Звездные величины q и w различны для этих двух случаев. Однако если начальное и конечное состояния батареи одинаковы в обоих случаях, то E = q + w должны быть одинаковыми в обоих случаях, поскольку E является функцией состояния.
Рисунок 5.9 Количество тепла и работы, передаваемых между системой и окружающей средой, зависит от того, каким образом система переходит из одного состояния в другое. а) батарея, закороченная проводом, отдает энергию окружающей среде в виде тепла; никакая работа не выполняется. (b) Батарея, разряженная через двигатель, теряет энергию в виде работы (чтобы заставить вентилятор вращаться), а также тепла. Значение E одинаково для обоих процессов, но значения q и w различны.
а) батарея, закороченная проводом, отдает энергию окружающей среде в виде тепла; никакая работа не выполняется. (b) Батарея, разряженная через двигатель, теряет энергию в виде работы (чтобы заставить вентилятор вращаться), а также тепла. Значение E одинаково для обоих процессов, но значения q и w различны.
Разница между энтальпией и внутренней энергией
Основное отличие — энтальпия против внутренней энергии
Энергия может обмениваться между системами и их окружением по-разному.Энтальпия и внутренняя энергия являются термодинамическими терминами, которые используются для объяснения этого обмена энергией. Энтальпия представляет собой сумму видов внутренней энергии. Внутренняя энергия может быть либо потенциальной энергией, либо кинетической энергией. Основное различие между энтальпией и внутренней энергией состоит в том, что энтальпия — это тепло, поглощаемое или выделяемое во время химических реакций, происходящих в системе , тогда как внутренняя энергия — это сумма потенциальной и кинетической энергии в системе.
Ключевые области охвата
1.Что такое энтальпия? Энтальпия и внутренняя энергия
– Сравнение основных различий
Ключевые термины: энтальпия, теплота, внутренняя энергия, теплота плавления, теплота испарения, джоули, кинетическая энергия, потенциальная энергия, система, термодинамика
Что такое энтальпия
Энтальпия — это тепловая энергия, которая поглощается или выделяется при протекании химической реакции.Энтальпия обозначается символом H. H указывает на количество энергии. Изменение энтальпии задается как ∆H, где символ ∆ указывает на изменение энтальпии. Энтальпия выражается в джоулей (дж) или в килоджоулях (кдж) .
Можно сказать, что энтальпия есть сумма внутренней энергии системы. Это связано с тем, что внутренняя энергия изменяется во время химической реакции, и это изменение измеряется как энтальпия. Энтальпия процесса, протекающего при постоянном давлении, может быть выражена следующим образом.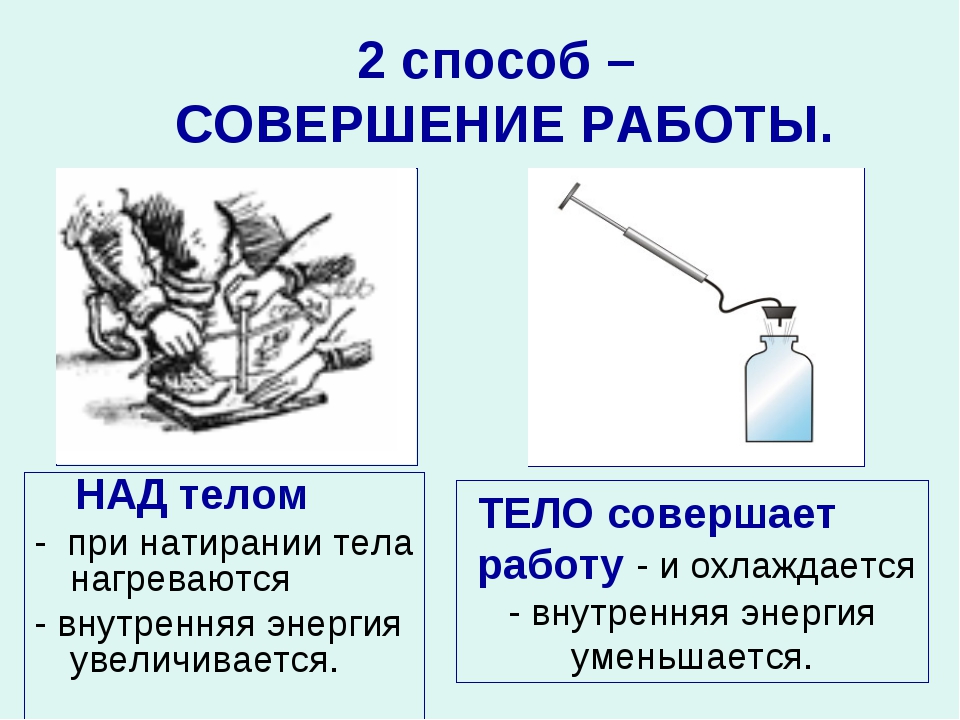
Н = У + ПВ
Где,
H H — энтальпия,
U — сумма внутренней энергии
P — это давление системы
V — объем системы
Таким образом, энтальпия представляет собой сумму внутренней энергии и энергии, необходимой для поддержания объема системы при заданном давлении. Термин «PV» указывает на работу, которую необходимо выполнить в среде, чтобы освободить место для системы.
Изменение энтальпии показывает, является ли конкретная реакция эндотермической или экзотермической реакцией. Если значение ∆H положительное, реакция эндотермическая. Это означает, что энергия должна быть передана этой системе извне, чтобы произошла реакция. Но если ∆H имеет отрицательное значение, это указывает на то, что реакция высвобождает энергию наружу.
Кроме того, изменение энтальпии происходит при изменении фазы или состояния веществ. Например, если твердое тело переходит в жидкую форму, энтальпия изменяется.Это называется теплотой плавления . Когда жидкость переходит в газообразную форму, изменение энтальпии называется теплотой парообразования .
Например, если твердое тело переходит в жидкую форму, энтальпия изменяется.Это называется теплотой плавления . Когда жидкость переходит в газообразную форму, изменение энтальпии называется теплотой парообразования .
Рисунок 01: Изменение состояния или фазы веществ
На изображении выше показано изменение состояния или фазы вещества в системе. Здесь каждый переход имеет свою собственную энтальпию, указывающую, является ли эта реакция эндотермической или экзотермической.
Температура системы оказывает большое влияние на энтальпию.Согласно уравнению, приведенному выше, энтальпия изменяется при изменении внутренней энергии. При повышении температуры внутренняя энергия увеличивается, поскольку увеличивается кинетическая энергия молекул. Тогда энтальпия этой системы также увеличивается.
Что такое внутренняя энергия
Внутренняя энергия системы представляет собой сумму потенциальной энергии и кинетической энергии этой системы. Потенциальная энергия – это накопленная энергия, а кинетическая энергия – это энергия, генерируемая за счет движения молекул.Внутренняя энергия обозначается символом U, а изменение внутренней энергии обозначается как ∆U.
Потенциальная энергия – это накопленная энергия, а кинетическая энергия – это энергия, генерируемая за счет движения молекул.Внутренняя энергия обозначается символом U, а изменение внутренней энергии обозначается как ∆U.
Изменение внутренней энергии при постоянном давлении равно изменению энтальпии в этой системе. Изменение внутренней энергии может происходить двумя путями. Один из них связан с теплопередачей – система может поглощать тепло извне или отдавать тепло в окружающую среду. Оба пути могут привести к изменению внутренней энергии системы. Другой способ — работа. Следовательно, изменение внутренней энергии можно представить следующим образом.
∆U = q + w
Где,
∆U — изменение внутренней энергии,
q — переданная теплота,
w — работа, совершенная системой
Однако в изолированной системе не может быть члена ∆U, поскольку внутренняя энергия постоянна, передача энергии равна нулю и работа не совершается. Положительное значение ∆U указывает на то, что система поглощает тепло извне и в системе совершается работа.Когда ∆U имеет отрицательное значение, система выделяет тепло и совершает работу.
Положительное значение ∆U указывает на то, что система поглощает тепло извне и в системе совершается работа.Когда ∆U имеет отрицательное значение, система выделяет тепло и совершает работу.
Однако внутренняя энергия может существовать как потенциальная энергия или кинетическая энергия, но не как теплота или работа. Это связано с тем, что теплота и работа существуют только тогда, когда система претерпевает изменения.
Разница между энтальпией и внутренней энергией
Определение
Энтальпия: Энтальпия — это тепловая энергия, которая поглощается или выделяется в ходе химической реакции.
Внутренняя энергия: Внутренняя энергия системы представляет собой сумму потенциальной энергии и кинетической энергии этой системы.
Уравнение
Энтальпия: Энтальпия определяется как H = U + PV.
Внутренняя энергия: Внутренняя энергия определяется как ∆U = q + w.
Система
Энтальпия: Энтальпия определяется как отношение между системой и окружающей средой.
Внутренняя энергия: Внутренняя энергия определяется как полная энергия в системе.
Заключение
Энтальпия относится к системам, которые находятся в контакте с окружающей средой, а внутренняя энергия представляет собой полную энергию, из которой состоит конкретная система. Однако изменение энтальпии и изменение внутренней энергии очень важны для определения типа и характера химических реакций, протекающих в системе. Поэтому важно четко понимать разницу между энтальпией и внутренней энергией.
Каталожные номера:
1.«Энтальпия». Британская энциклопедия. Британская энциклопедия, Inc., nd Веб. Доступно здесь. 17 июля 2017 г.
2. «Как отличить внутреннюю энергию от энтальпии?» Физическая химия — СпросиСеть по химии. н.п., н.д. Веб. Доступно здесь. 17 июля 2017 г.
Изображение предоставлено:
1. «Переход состояния физической материи 1 en» Автор ElfQrin — собственная работа, GFDL) через Commons Wikimedia
«Переход состояния физической материи 1 en» Автор ElfQrin — собственная работа, GFDL) через Commons Wikimedia
Как изменяется внутренняя энергия при изменении температуры? – М.В.Организинг
Как меняется внутренняя энергия с температурой?
Внутренняя энергия – это сумма кинетической и потенциальной энергии всех частиц в системе.Когда для повышения температуры дается энергия, частицы ускоряются и приобретают кинетическую энергию.
Влияет ли температура на внутреннюю энергию?
Внутренняя энергия — это НЕ вся энергия в системе, это кинетическая и потенциальная энергия, связанные со случайным движением молекул объекта. Если вы нагреете предмет, вы увеличите его внутреннюю энергию. По мере охлаждения объекта его внутренняя энергия будет уменьшаться.
Как рассчитать изменение внутренней энергии?
Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистой передаче тепла системе за вычетом чистой работы, совершаемой системой.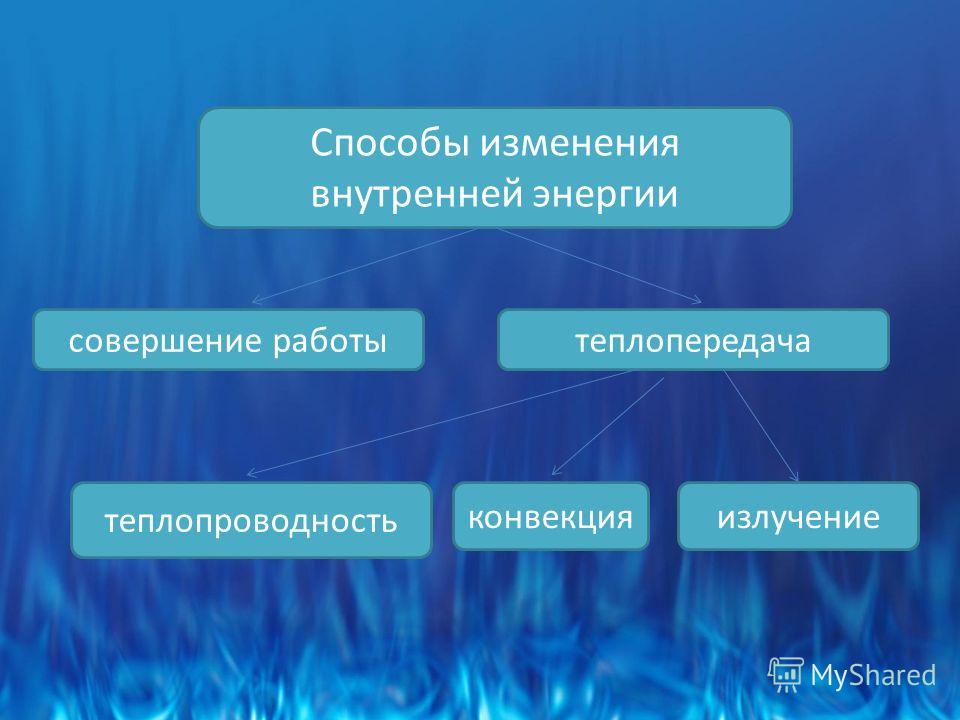 В форме уравнения первый закон термодинамики имеет вид ΔU = Q — W. Здесь ΔU — изменение внутренней энергии U системы.
В форме уравнения первый закон термодинамики имеет вид ΔU = Q — W. Здесь ΔU — изменение внутренней энергии U системы.
Как изменится внутренняя энергия газа?
Давление и объем изменяются, а температура остается постоянной. Поскольку никакая работа или теплота не обмениваются с окружающей средой, внутренняя энергия в этом процессе не изменится. Таким образом, внутренняя энергия идеального газа зависит только от его температуры.
Каково изменение внутренней энергии за весь цикл?
Изменение внутренней энергии для любого цикла всегда равно нулю, потому что система возвращается в исходное состояние, а площадь замкнутой области на PV-диаграмме представляет собой чистую работу, выполненную газом в цикле.
Как найти изменение внутренней энергии газа?
Согласно первому закону термодинамики u=q+w, где u — изменение внутренней энергии, q — выделяющееся тепло, а w — работа, совершенная в процессе. Теперь при постоянном объеме w=0, следовательно, u=q.
Являются ли внутренняя энергия и тепловая энергия одним и тем же?
«Тепловая» энергия и «Тепловая» энергия означают одно и то же. «Внутренняя» энергия и «Тепловая» энергия не означают одно и то же, но они связаны. Внутренняя энергия определяется как сумма случайного распределения кинетической и потенциальной энергий молекул/атомов в веществе.
Как изменится внутренняя энергия газа при изотермическом сжатии?
Ответ. Ответ: Изменение внутренней энергии газа равно нулю. Пояснение: Изотермический процесс: Это процесс, при котором температура системы остается постоянной.
При изотермическом сжатии идеального газа его давление?
Полный ответ: В вопросе сказано, что при изотермическом сжатии идеального газа давление увеличивается. Нас спрашивают, что вызывает повышение давления в такой ситуации.Мы знаем, что при изотермическом сжатии газа его температура остается постоянной, а объем газа уменьшается.
Как изменяется внутренняя энергия системы при адиабатическом процессе?
При адиабатическом расширении газ теряет внутреннюю энергию, равную работе, совершаемой газом. При этом температура газа снижается. При адиабатическом сжатии газ приобретает внутреннюю энергию, равную работе, совершенной над газом. При этом температура газа повышается.
При этом температура газа снижается. При адиабатическом сжатии газ приобретает внутреннюю энергию, равную работе, совершенной над газом. При этом температура газа повышается.
На сколько изменится внутренняя энергия в изотермическом процессе?
В изотермическом процессе температура постоянна. Внутренняя энергия является функцией состояния, зависящей от температуры. Следовательно, изменение внутренней энергии равно нулю. Для описываемого вами процесса работа совершается системой, но если бы вы не подвели тепло, то температура упала бы.
Можно ли преобразовать внутреннюю энергию в работу?
Решение: Да. Например, при взрыве бомбы химическая энергия (которая является формой внутренней энергии) преобразуется в кинетическую энергию.
Изменяется ли внутренняя энергия идеального газа в изотермическом процессе?
В изотермическом процессе температура постоянна. Следовательно, внутренняя энергия постоянна, а чистое изменение внутренней энергии равно НУЛЮ.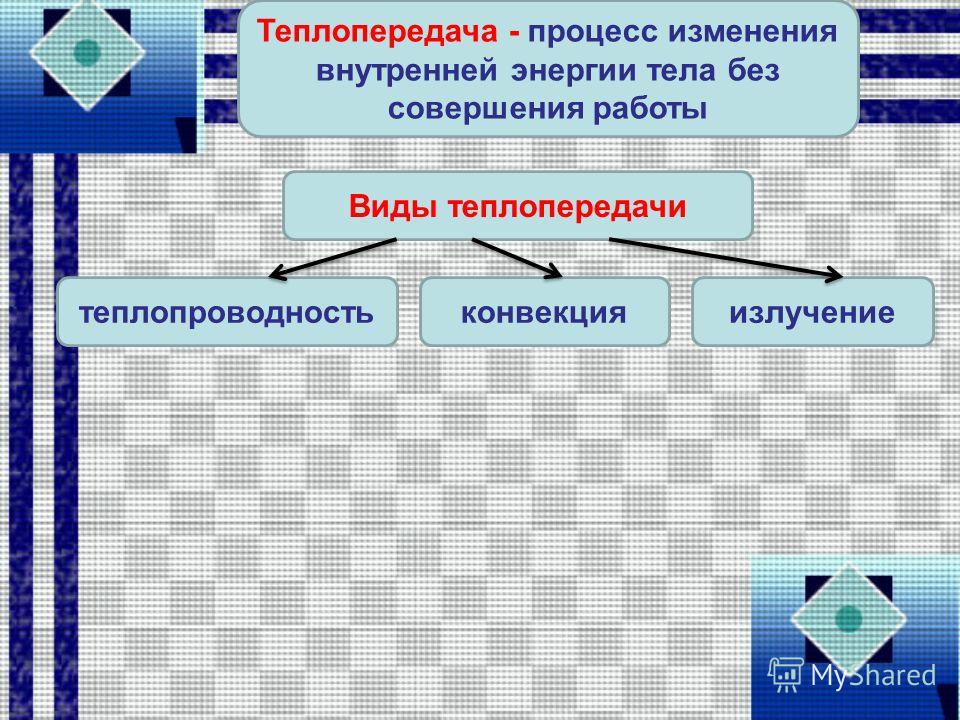 В идеальном газе по определению нет взаимодействий между частицами, межмолекулярных сил, поэтому изменение давления при постоянной температуре не меняет внутреннюю энергию.
В идеальном газе по определению нет взаимодействий между частицами, межмолекулярных сил, поэтому изменение давления при постоянной температуре не меняет внутреннюю энергию.
Всегда ли внутренняя энергия системы равна нулю?
Уравнения изменения внутренней энергии Изолированная система не может обмениваться теплом или работать с окружающей средой, что делает изменение внутренней энергии равным нулю.
Что влияет на внутреннюю энергию системы?
Внутренняя энергия является экстенсивным свойством: она зависит от размера системы или от количества содержащегося в ней вещества. При любой температуре выше абсолютного нуля микроскопическая потенциальная энергия и кинетическая энергия постоянно превращаются друг в друга, но сумма остается постоянной в изолированной системе (ср.
).Чему равна внутренняя энергия?
Внутренняя энергия представляет собой сумму потенциальной энергии системы и кинетической энергии системы.Изменение внутренней энергии (ΔU) реакции равно полученному или потерянному теплу (изменение энтальпии) в реакции, когда реакция протекает при постоянном давлении.
Зависит ли внутренняя энергия от массы?
В термодинамике полная энергия конкретной системы называется внутренней энергией. В целом, внутренняя энергия системы увеличивается по мере добавления массы в систему, что делает внутреннюю энергию экстенсивным свойством, поскольку она прямо пропорциональна количеству материала в системе в это время.
Зависит ли внутренняя энергия от размера или количества вещества?
Внутренняя энергия является экстенсивным свойством, т. е. ее величина зависит от количества вещества в данном состоянии.
Как найти внутреннюю энергию?
Таким образом, в уравнении ΔU=q+w w=0 и ΔU=q. Внутренняя энергия равна теплоте системы. Окружающее тепло увеличивается, поэтому тепло системы уменьшается, потому что тепло не создается и не разрушается.
Как объем влияет на внутреннюю энергию?
Внутренняя энергия не меняется.Если газ сжать так, что его давление остается постоянным, то по закону идеального газа температура падает пропорционально объему. В этом случае больше энергии покидает систему в виде тепла, чем то, что вы вкладываете в нее в виде работы. Внутренняя энергия уменьшается.
В этом случае больше энергии покидает систему в виде тепла, чем то, что вы вкладываете в нее в виде работы. Внутренняя энергия уменьшается.
Как получить энергию от давления?
Обратите внимание, что давление P также имеет единицы энергии на единицу объема. Поскольку P = F/A, его единицами измерения являются Н/м2. Если мы умножим их на м/м, мы получим N ⋅ м/м3 = Дж/м3, или энергию на единицу объема.
Давление связано с энергией?
Давление в жидкости можно рассматривать как меру энергии на единицу объема посредством определения работы. Эта энергия связана с другими формами энергии жидкости уравнением Бернулли.
Является ли сила энергией?
Слова энергия и сила не взаимозаменяемы – они не совпадают друг с другом. Сила — это толчок или притяжение, которые легко продемонстрировать и почувствовать, а энергия — несколько более абстрактное понятие.Они измеряются в разных единицах: сила в ньютонах, энергия в джоулях.
Является ли давление энергией?
Давление — это ограниченная кинетическая энергия. Согласно кинетической теории идеальных газов [181], атмосферное давление может быть определено как средний импульс, передаваемый единице площади в единицу времени за счет молекулярных столкновений между замкнутым газом и его границей.
Согласно кинетической теории идеальных газов [181], атмосферное давление может быть определено как средний импульс, передаваемый единице площади в единицу времени за счет молекулярных столкновений между замкнутым газом и его границей.
Внутренняя энергия, теплота, работа и знаковое соглашение | Химия
6.3: Внутренняя энергия
Совокупность всех возможных видов энергии, присутствующих в веществе, называется внутренней энергией ( U ), иногда обозначаемой как E .Предположим, что система с начальной внутренней энергией U начальная претерпевает изменение энергии (перенос работы или теплоты), а конечная внутренняя энергия системы равна U конечная . Изменение внутренней энергии равно разнице между U конечной и U начальной .
Хотя значения для U конечного и U начального нельзя определить для системы, первый закон термодинамики требует только значения Δ U , которое можно определить, даже не зная значений U окончательный и U начальный . Положительное значение Δ U получается, когда U конечное > U начальное , и указывает на то, что система получает энергию из окружающей среды. Отрицательное значение Δ U получается, когда U конечное < U начальное , и указывает на то, что система потеряла энергию в окружающую среду.
Положительное значение Δ U получается, когда U конечное > U начальное , и указывает на то, что система получает энергию из окружающей среды. Отрицательное значение Δ U получается, когда U конечное < U начальное , и указывает на то, что система потеряла энергию в окружающую среду.
Теплота (тепловая энергия) и работа (механическая энергия) — это два разных способа, которыми система может обмениваться энергией с окружающей средой.Энергия передается системе, когда она поглощает тепло ( q ) из окружающей среды или когда окружающая среда совершает работу ( w ) над системой.
Например, энергия передается металлической проволоке комнатной температуры, если ее поместить в горячую воду (проволока поглощает тепло из воды), или когда проволоку быстро изгибают взад и вперед (проволока нагревается из-за проделанной работы). в теме). Оба процесса увеличивают внутреннюю энергию проволоки, что отражается на повышении температуры проволоки. И наоборот, энергия передается из системы, когда тепло теряется из системы или когда система воздействует на окружающую среду. Например, при сгорании ракетного топлива выделяется огромное количество тепла, а также выполняется работа с окружающей средой путем приложения силы на расстоянии (заставляя космический шаттл отрываться от земли). Оба процесса уменьшают внутреннюю энергию системы.
И наоборот, энергия передается из системы, когда тепло теряется из системы или когда система воздействует на окружающую среду. Например, при сгорании ракетного топлива выделяется огромное количество тепла, а также выполняется работа с окружающей средой путем приложения силы на расстоянии (заставляя космический шаттл отрываться от земли). Оба процесса уменьшают внутреннюю энергию системы.
Связь между внутренней энергией, теплотой и работой может быть представлена уравнением:
Это одна из версий первого закона термодинамики, и она показывает, что внутренняя энергия системы изменяется за счет притока тепла в систему или из нее или работы, совершаемой над системой или системой.Знаки теплоты и работы зависят от того, получает или теряет система энергию. Положительное q — это приток тепла в систему из окружающей среды, а отрицательное q — это приток тепла из системы. Работа w положительна, если она выполняется в системе, и отрицательна, если она выполняется системой.
Когда q и w оба положительны (>0), Δ U всегда положительна (>0), и внутренняя энергия системы увеличивается.Когда q и w оба отрицательны (<0), Δ U всегда отрицательна (<0), и внутренняя энергия системы уменьшается. Если q и w имеют разные знаки, то знак Δ U зависит от относительных величин q и w .
Единицей измерения энергии, тепла и работы в системе СИ является джоуль (Дж).
Этот текст взят из OpenStax Chemistry 2e, Раздел 5.3: Энтальпия.
Учебное пособие по физике
Урок 1 этой главы посвящен значению температуры и тепла. Особое внимание уделялось разработке корпускулярной модели материи, способной объяснить макроскопические наблюдения. Были предприняты усилия для разработки прочного концептуального понимания темы в отсутствие математических формул. Мы узнали, что тепло передается от одного объекта к другому (между системой и окружающей средой), когда между системой и окружающей средой существует разница температур. Теперь в этом разделе мы исследуем тему измерения количества тепла, которое передается между системой и окружающей средой. Этот урок посвящен калориметрии – науке, связанной с определением изменения энергии системы путем измерения теплообмена с окружающей средой. Прежде чем мы сможем понять математику калориметрии, мы должны ответить на критический вопрос, который, по крайней мере частично, был рассмотрен в Уроке 1. Вопрос заключается в следующем: что делает тепло? Когда тепло теряется или приобретается объектом, что он делает?
Теперь в этом разделе мы исследуем тему измерения количества тепла, которое передается между системой и окружающей средой. Этот урок посвящен калориметрии – науке, связанной с определением изменения энергии системы путем измерения теплообмена с окружающей средой. Прежде чем мы сможем понять математику калориметрии, мы должны ответить на критический вопрос, который, по крайней мере частично, был рассмотрен в Уроке 1. Вопрос заключается в следующем: что делает тепло? Когда тепло теряется или приобретается объектом, что он делает?
Для некоторых студентов сам вопрос что делает тепло? сбивает с толку.Подумайте о вопросе на мгновение. Вас смущает вопрос (не только ответ)? Путаница в этом вопросе иногда вызывается неверными представлениями о том, что такое теплота . Причина длительных дискуссий в Уроке 1 заключалась в том, чтобы обеспечить прочную концептуальную основу для понимания математики Урока 2. Если вопрос сбивает с толку, вы можете просмотреть Урок 1 или, по крайней мере, просмотреть обсуждение, относящееся к тому, что такое тепло? В Уроке 1 подчеркивалось, что тепло — это не то, что содержится в объекте. Объекты не содержат тепла . Объекты, состоящие из атомов, молекул и ионов, содержат энергию. Тепло – это передача энергии от объекта к его окружению или к объекту из его окружения. Итак, вопрос, который задают на этой странице, заключается в том, что это тепло делает с объектом и с окружающей средой, когда оно передается? Как и многие вопросы в физике, это простой ответ с глубоким смыслом. Простые ответы с глубоким смыслом всегда тренируют мозг. Так что наденьте шапку мышления и давайте перейдем к ответу.
Объекты не содержат тепла . Объекты, состоящие из атомов, молекул и ионов, содержат энергию. Тепло – это передача энергии от объекта к его окружению или к объекту из его окружения. Итак, вопрос, который задают на этой странице, заключается в том, что это тепло делает с объектом и с окружающей средой, когда оно передается? Как и многие вопросы в физике, это простой ответ с глубоким смыслом. Простые ответы с глубоким смыслом всегда тренируют мозг. Так что наденьте шапку мышления и давайте перейдем к ответу.
Тепло изменяет температуру объектов
Что делает тепло? Во-первых, он изменяет температуру объекта. Если тепло передается от объекта к окружающей среде, то объект может остыть, а окружающая среда может нагреться. Когда тепло передается объекту его окружением, то объект может нагреваться, а окружение охлаждаться. Тепло, когда-то поглощенное как энергия, вносит свой вклад в общую внутреннюю энергию объекта.Одной из форм этой внутренней энергии является кинетическая энергия; частицы начинают двигаться быстрее, что приводит к большей кинетической энергии.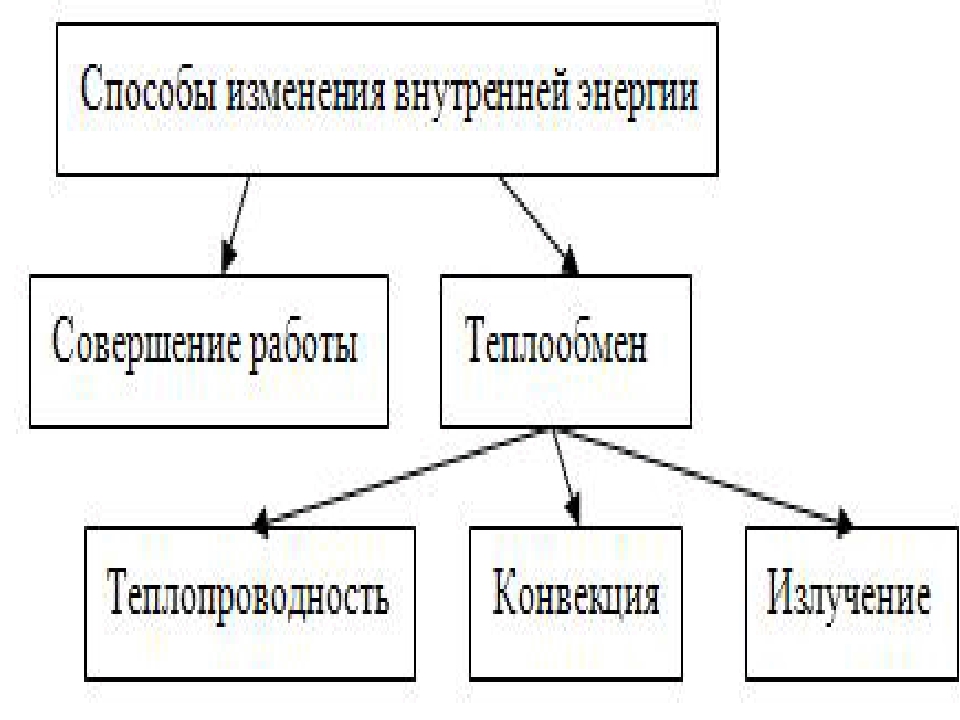 Это более энергичное движение частиц отражается повышением температуры. Применяется и обратная логика. Энергия, выделившаяся в виде тепла, приводит к уменьшению общей внутренней энергии объекта. Так как кинетическая энергия является одной из форм внутренней энергии, выделение тепла от объекта вызывает уменьшение средней кинетической энергии его частиц.Это означает, что частицы движутся медленнее и температура объекта снижается. Высвобождение или поглощение объектом энергии в виде тепла часто связано с изменением температуры этого объекта. Это было в центре внимания Термометров как Спидометров в Уроке 1. То, что можно сказать об объекте, можно также сказать и об окружающей среде. Выделение или поглощение окружающей средой энергии в виде тепла часто связано с изменением температуры окружающей среды.Мы часто обнаруживаем, что передача тепла вызывает изменение температуры как в системе, так и в окружающей среде. Один согревает, а другой охлаждает.
Это более энергичное движение частиц отражается повышением температуры. Применяется и обратная логика. Энергия, выделившаяся в виде тепла, приводит к уменьшению общей внутренней энергии объекта. Так как кинетическая энергия является одной из форм внутренней энергии, выделение тепла от объекта вызывает уменьшение средней кинетической энергии его частиц.Это означает, что частицы движутся медленнее и температура объекта снижается. Высвобождение или поглощение объектом энергии в виде тепла часто связано с изменением температуры этого объекта. Это было в центре внимания Термометров как Спидометров в Уроке 1. То, что можно сказать об объекте, можно также сказать и об окружающей среде. Выделение или поглощение окружающей средой энергии в виде тепла часто связано с изменением температуры окружающей среды.Мы часто обнаруживаем, что передача тепла вызывает изменение температуры как в системе, так и в окружающей среде. Один согревает, а другой охлаждает.
Но всегда ли поглощение или выделение энергии в виде тепла вызывает изменение температуры? Удивительно, но нет. Чтобы проиллюстрировать это, рассмотрим следующую ситуацию, которую часто демонстрируют или даже экспериментируют на уроке теплофизики в школе.Пара-дихлорбензол, основной ингредиент многих форм нафталиновых шариков, имеет температуру плавления около 54 °C. Предположим, что образец химического вещества собран в пробирку и нагрет примерно до 80°C. Пара-дихлорбензол будет в жидком состоянии (хотя большая его часть сублимируется и будет наполнять комнату весьма заметным ароматом). Теперь предположим, что в пробирку вставлен термометр, а сама пробирка помещена в стакан с водой комнатной температуры. Данные о температуре и времени можно собирать каждые 10 секунд.Вполне ожидаемо можно заметить, что температура пара-дихлорбензола постепенно снижается. По мере того как тепло передается от пробирки с высокой температурой к воде с низкой температурой, температура жидкого пара-дихлорбензола снижается. Но затем совершенно неожиданно можно было заметить, что это устойчивое снижение температуры прекращается примерно при 54°С.
Чтобы проиллюстрировать это, рассмотрим следующую ситуацию, которую часто демонстрируют или даже экспериментируют на уроке теплофизики в школе.Пара-дихлорбензол, основной ингредиент многих форм нафталиновых шариков, имеет температуру плавления около 54 °C. Предположим, что образец химического вещества собран в пробирку и нагрет примерно до 80°C. Пара-дихлорбензол будет в жидком состоянии (хотя большая его часть сублимируется и будет наполнять комнату весьма заметным ароматом). Теперь предположим, что в пробирку вставлен термометр, а сама пробирка помещена в стакан с водой комнатной температуры. Данные о температуре и времени можно собирать каждые 10 секунд.Вполне ожидаемо можно заметить, что температура пара-дихлорбензола постепенно снижается. По мере того как тепло передается от пробирки с высокой температурой к воде с низкой температурой, температура жидкого пара-дихлорбензола снижается. Но затем совершенно неожиданно можно было заметить, что это устойчивое снижение температуры прекращается примерно при 54°С. Как только температура жидкого пара-дихлорбензола понизится до 54°C, уровень термометра внезапно остановится на . Судя по показаниям термометра, можно подумать, что тепло не передается.Но взгляд в пробирку показывает, что происходят кардинальные изменения. Жидкий пара-дихлорбензол кристаллизуется с образованием твердого пара-дихлорбензола. Как только последний след жидкого пара-дихлорбензола исчезает (а он находится в твердой форме), температура снова начинает снижаться с 54°С до температуры воды. Как эти наблюдения могут помочь нам понять вопрос о том, что делает тепло?
Как только температура жидкого пара-дихлорбензола понизится до 54°C, уровень термометра внезапно остановится на . Судя по показаниям термометра, можно подумать, что тепло не передается.Но взгляд в пробирку показывает, что происходят кардинальные изменения. Жидкий пара-дихлорбензол кристаллизуется с образованием твердого пара-дихлорбензола. Как только последний след жидкого пара-дихлорбензола исчезает (а он находится в твердой форме), температура снова начинает снижаться с 54°С до температуры воды. Как эти наблюдения могут помочь нам понять вопрос о том, что делает тепло?
Во-первых, снижение температуры с 80°C до 54°C легко объяснимо.В Уроке 1 мы узнали, что тепло передается между двумя соседними объектами, имеющими разные температуры. Пробирка и пара-дихлорбензол имеют более высокую температуру, чем вода, окружающая стакан. Тепло из пробирки с пара-дихлорбензолом будет поступать в воду, в результате чего пара-дихлорбензол охлаждается, а вода нагревается. И понижение температуры от 54°С до температуры воды в стакане тоже легко объяснимо. Два соседних объекта с разной температурой будут передавать тепло между собой до тех пор, пока не будет достигнуто тепловое равновесие.Сложное объяснение включает в себя объяснение того, что происходит при 54°C. Почему температура больше не снижается, когда жидкий пара-дихлорбензол начинает кристаллизоваться? Существует ли передача тепла между пробиркой с пара-дихлорбензолом и стаканом с водой, даже если температура не меняется?
Два соседних объекта с разной температурой будут передавать тепло между собой до тех пор, пока не будет достигнуто тепловое равновесие.Сложное объяснение включает в себя объяснение того, что происходит при 54°C. Почему температура больше не снижается, когда жидкий пара-дихлорбензол начинает кристаллизоваться? Существует ли передача тепла между пробиркой с пара-дихлорбензолом и стаканом с водой, даже если температура не меняется?
Ответ на вопрос Передается ли тепло? — это громкое да! Ведь принцип заключается в том, что тепло всегда передается между двумя соседними объектами, имеющими разную температуру.Термометр, помещенный в воду, показывает, что вода все еще нагревается, хотя температура пара-дихлорбензола не меняется. Так что тепло определенно передается от пара-дихлорбензола к воде. Но почему температура пара-дихлорбензола остается постоянной в течение этого периода кристаллизации? Прежде чем пара-дихлорбензол сможет продолжать снижать свою температуру, он должен сначала перейти из жидкого состояния в твердое. Кристаллизация пара-дихлорбензола происходит при 54°С — температуре замерзания вещества.При этой температуре энергия, которую теряет пара-дихлорбензол, связана с изменением другого вида внутренней энергии — потенциальной энергии. Вещество обладает не только кинетической энергией из-за движения своих частиц, но и потенциальной энергией из-за межмолекулярного притяжения между частицами. Поскольку пара-дихлорбензол кристаллизуется при 54°C, потеря энергии отражается уменьшением потенциальной энергии пара-дихлорбензола при изменении его состояния. Как только весь пара-дихлорбензол переходит в твердое состояние, потеря энергии еще раз отражается уменьшением кинетической энергии вещества; его температура снижается.
Кристаллизация пара-дихлорбензола происходит при 54°С — температуре замерзания вещества.При этой температуре энергия, которую теряет пара-дихлорбензол, связана с изменением другого вида внутренней энергии — потенциальной энергии. Вещество обладает не только кинетической энергией из-за движения своих частиц, но и потенциальной энергией из-за межмолекулярного притяжения между частицами. Поскольку пара-дихлорбензол кристаллизуется при 54°C, потеря энергии отражается уменьшением потенциальной энергии пара-дихлорбензола при изменении его состояния. Как только весь пара-дихлорбензол переходит в твердое состояние, потеря энергии еще раз отражается уменьшением кинетической энергии вещества; его температура снижается.
Итак, второй ответ на вопрос Что делает тепло? заключается в том, что он способствует изменению состояния вещества. Большинство учащихся знакомы как минимум с тремя агрегатными состояниями вещества – твердым, жидким и газообразным. Добавление тепла к образцу вещества может привести к тому, что твердые тела превратятся в жидкости, а жидкости — в газы. Точно так же отвод тепла от образца вещества может привести к тому, что газы превратятся в жидкости, а жидкости — в твердые тела.Каждый из этих переходов между состояниями происходит при определенных температурах, обычно называемых температурой точки плавления, температурой точки замерзания, температурой точки кипения и температурой точки конденсации.
Добавление тепла к образцу вещества может привести к тому, что твердые тела превратятся в жидкости, а жидкости — в газы. Точно так же отвод тепла от образца вещества может привести к тому, что газы превратятся в жидкости, а жидкости — в твердые тела.Каждый из этих переходов между состояниями происходит при определенных температурах, обычно называемых температурой точки плавления, температурой точки замерзания, температурой точки кипения и температурой точки конденсации.
Чтобы дополнительно проиллюстрировать взаимосвязь между теплопередачей, изменением температуры и изменением состояния, рассмотрим следующий мысленный эксперимент . Предположим, что образец воды был помещен в чашку из пенопласта с цифровым термометром. И предположим, что вода помещена в морозильную камеру (температура = -20°С) и заморожена.Предположим, что термометр можно подключить к компьютеру с программным обеспечением, способным собирать данные о температуре во времени. После того, как вода замерзнет и останется в морозильной камере на несколько часов, ее извлекают и помещают в химический стакан на электроплитку . Плитка включается, нагревается и начинает передавать энергию в виде тепла стакану и воде. Какие изменения будут наблюдаться в температуре и вещественном состоянии воды с течением времени?
Плитка включается, нагревается и начинает передавать энергию в виде тепла стакану и воде. Какие изменения будут наблюдаться в температуре и вещественном состоянии воды с течением времени?
На приведенной ниже диаграмме показана так называемая кривая нагрева воды.Кривая нагрева представляет изменения температуры во времени для образца вещества (например, воды), которому передается тепло.
Обратите внимание, что на графике зависимости температуры от времени есть три наклонных и два горизонтальных участка. Первый наклонный участок соответствует изменению температуры льда от -20°С до 0°С. Вода в твердом состоянии нагревается до точки плавления — температуры, при которой вода переходит из твердого состояния в жидкое.Тепло, переданное льду, вызывает изменение температуры. Как только достигается температура перехода (точка плавления) 0°C, подводимое к воде тепло заставляет воду переходить из твердого состояния в жидкое. Это называется плавлением.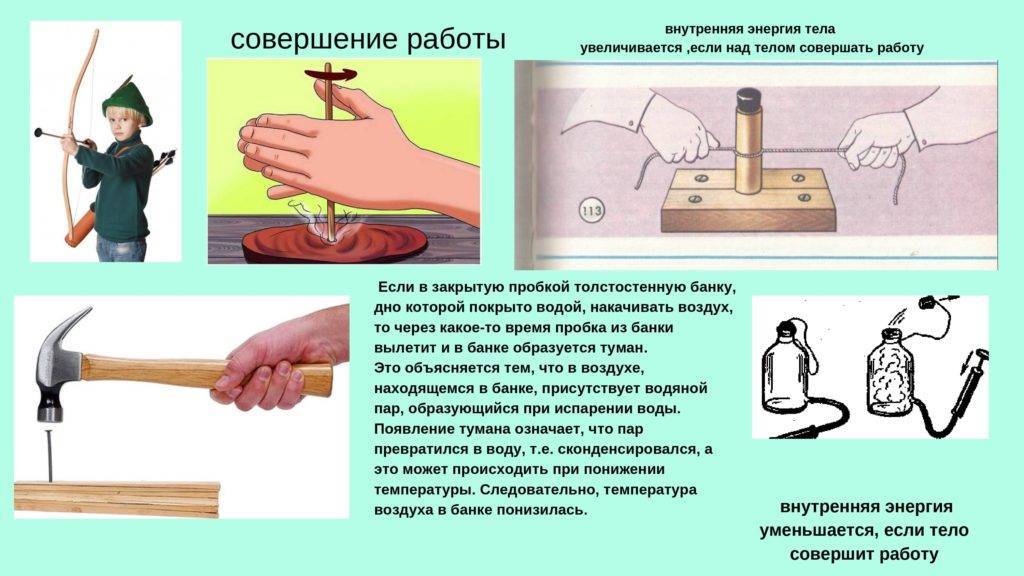 Плавление происходит при постоянной температуре. На этом этапе эксперимента энергия, поглощаемая водой, используется для ослабления притяжения, удерживающего одну ледяную частицу от другой. Как только все эти притяжения ослабнут, лед будет полностью таять.Содержимое стаканчика из пенополистирола полностью жидкое. Следующий участок кривой нагрева представляет собой наклонный участок. Жидкая вода повышает свою температуру от 0°C до 100°C. Температура кипения воды 100°С; это температура, при которой вода переходит из жидкого состояния в газообразное. Как только образец воды достигает этой температуры, происходит кипение. По всему объему жидкости будут наблюдаться большие пузырьки газа. Тепло, добавляемое к жидкости на этом этапе мысленного эксперимента, вызывает ослабление притяжения, удерживающего частицы воды в жидком состоянии.Температура остается постоянной, а состояние воды меняется. Как только вся вода переходит из жидкого состояния в газообразное, образец воды (теперь уже в газообразном состоянии) снова начинает повышать свою температуру.
Плавление происходит при постоянной температуре. На этом этапе эксперимента энергия, поглощаемая водой, используется для ослабления притяжения, удерживающего одну ледяную частицу от другой. Как только все эти притяжения ослабнут, лед будет полностью таять.Содержимое стаканчика из пенополистирола полностью жидкое. Следующий участок кривой нагрева представляет собой наклонный участок. Жидкая вода повышает свою температуру от 0°C до 100°C. Температура кипения воды 100°С; это температура, при которой вода переходит из жидкого состояния в газообразное. Как только образец воды достигает этой температуры, происходит кипение. По всему объему жидкости будут наблюдаться большие пузырьки газа. Тепло, добавляемое к жидкости на этом этапе мысленного эксперимента, вызывает ослабление притяжения, удерживающего частицы воды в жидком состоянии.Температура остается постоянной, а состояние воды меняется. Как только вся вода переходит из жидкого состояния в газообразное, образец воды (теперь уже в газообразном состоянии) снова начинает повышать свою температуру.
Таким образом, три наклонных участка представляют собой тепло, вызывающее изменение температуры вещества, которое его поглощает. И два участка плато представляют собой тепло, вызывающее изменение состояния вещества, которое его поглощает. Любознательный студент может спросить: «Каково объяснение этих изменений на уровне частиц?» (Спасибо за вопрос.) Изменения температуры являются результатом дополнительной энергии, заставляющей частицы воды двигаться более энергично. Либо твердые частицы сильнее колеблются вокруг своего фиксированного положения, либо частицы жидкости и газа быстрее перемещаются вокруг своего сосуда. В любом случае добавление тепла вызывает увеличение средней кинетической энергии частиц в образце воды. Изменения состояния являются результатом добавленной энергии, вызывающей изменения силы притяжения между частицами.Притяжение, которое удерживает воду в твердом или жидком состоянии, преодолевается. Энергия используется для того, чтобы ослабить эти влечения и перейти в состояние большей потенциальной энергии.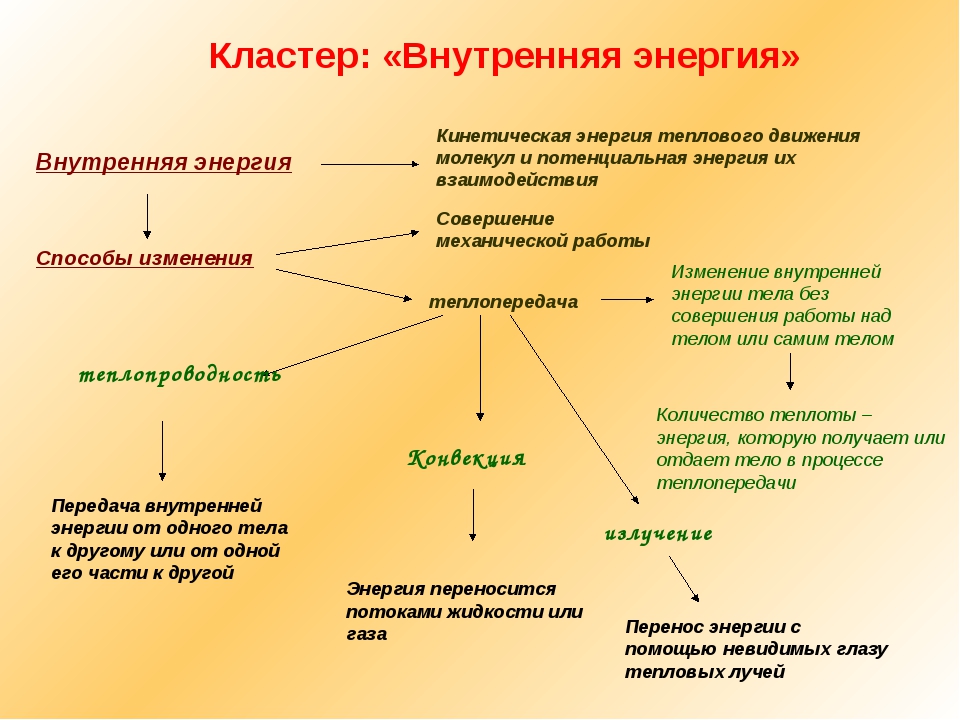
Фото физики Flickr
а) Вода в колбе нагрета до температуры кипения. Газ, выходящий из колбы, охлаждается при прохождении через медную трубку. Видны капли конденсированной воды, выходящие из конца медной трубки.
(b) Температура этой конденсированной воды намного меньше 100°C. Он недостаточно горячий, чтобы вызвать ожог.
(c) Пламя горелки Бунзена используется для нагрева змеевиков конденсатора медной трубы. Это повышает температуру выходящей воды выше точки кипения. Это газообразная вода с температурой выше 100°C, которая выходит из медной трубки.
г) Этот водяной пар настолько горяч, что мгновенно воспламеняет спичку, поднесенную к его горлышку.
(e) Все еще нагреваясь пламенем бунзеновской горелки, выходящий водяной пар достаточно горячий, чтобы обжечь лист бумаги…
(f) … и это означает phun для людей, которые делают и смотрят демонстрацию! Тепло делает Работает
Итак, передача энергии в виде тепла связана с изменением температуры или изменением состояния образца вещества. Но это все? Может ли тепло сделать что-нибудь еще? Еще раз, ответ Да! Перенос энергии в виде тепла может привести к совершению работы над системой или окружающей средой.Устройства, которые используют тепло для выполнения работы, часто называют тепловыми двигателями. В общем, двигатель — это устройство, которое работает. Тепловой двигатель — это устройство, использующее теплопередачу в качестве источника энергии для выполнения работы.
Но это все? Может ли тепло сделать что-нибудь еще? Еще раз, ответ Да! Перенос энергии в виде тепла может привести к совершению работы над системой или окружающей средой.Устройства, которые используют тепло для выполнения работы, часто называют тепловыми двигателями. В общем, двигатель — это устройство, которое работает. Тепловой двигатель — это устройство, использующее теплопередачу в качестве источника энергии для выполнения работы.
Двигатель внутреннего сгорания автомобиля является примером теплового двигателя. В большинстве двигателей внутреннего сгорания используется четырехтактный процесс, показанный на анимации справа. Когда топливо сгорает (вступает в реакцию с кислородом) в двигателе, из системы химических веществ выделяется энергия.Происходит передача тепла от горячей системы к окружающему цилиндру воздуху. Эта передача тепла воздуху в цилиндре воздействует на поршень, толкая его вниз. Поршень соединен с коленчатым валом автомобиля. Возвратно-поступательное движение поршня внутри цилиндра приводит к вращательному движению коленчатого вала и выработке энергии, необходимой для приведения автомобиля в движение. Двигатель внутреннего сгорания является примером теплового двигателя. В этом случае внутренняя энергия, запасенная в химическом веществе (бензине), преобразуется в тепловую энергию (поток тепла), что приводит к совершению работы.Тепловые двигатели будут обсуждаться более подробно в главе «Термодинамика» учебника «Физический класс». (Особая благодарность UtzOnBike и WikiMedia Commons за анимацию четырехтактного двигателя Отто, использованного выше.)
Двигатель внутреннего сгорания является примером теплового двигателя. В этом случае внутренняя энергия, запасенная в химическом веществе (бензине), преобразуется в тепловую энергию (поток тепла), что приводит к совершению работы.Тепловые двигатели будут обсуждаться более подробно в главе «Термодинамика» учебника «Физический класс». (Особая благодарность UtzOnBike и WikiMedia Commons за анимацию четырехтактного двигателя Отто, использованного выше.)
Тепло – это поток энергии из места с высокой температурой в место с низкой температурой. Этот поток энергии всегда связан с изменениями в системе и окружающей среде. Могут быть изменения температуры, изменения состояния вещества и изменения, происходящие в результате выполнения работы.В следующем разделе мы рассмотрим науку калориметрии. Мы обнаружим, что с этими изменениями связан очень предсказуемый математический набор. На самом деле они настолько предсказуемы, что ученые могут использовать их для измерения количества потока энергии.


 С чем это связано? Какую роль при этом играет теплопроводность меха, пера, подкожного жира?
С чем это связано? Какую роль при этом играет теплопроводность меха, пера, подкожного жира?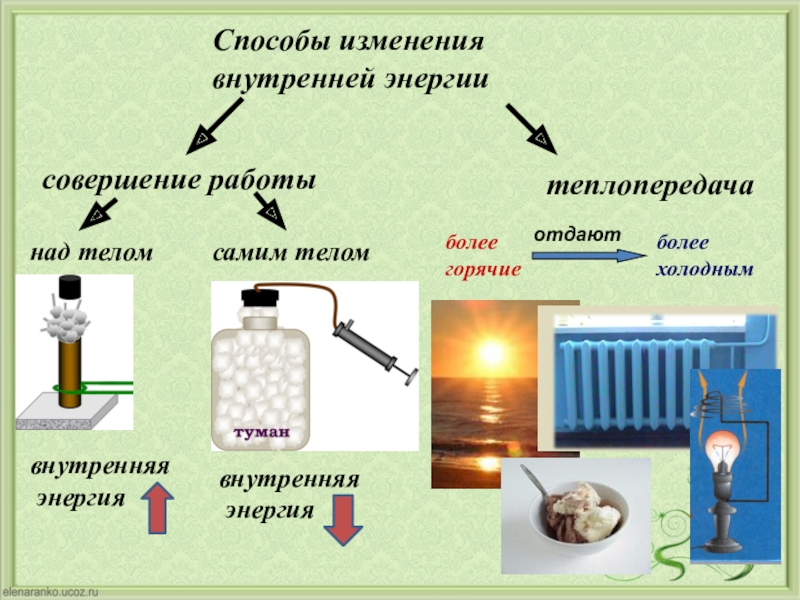
 Принимаются все идеи!
Принимаются все идеи!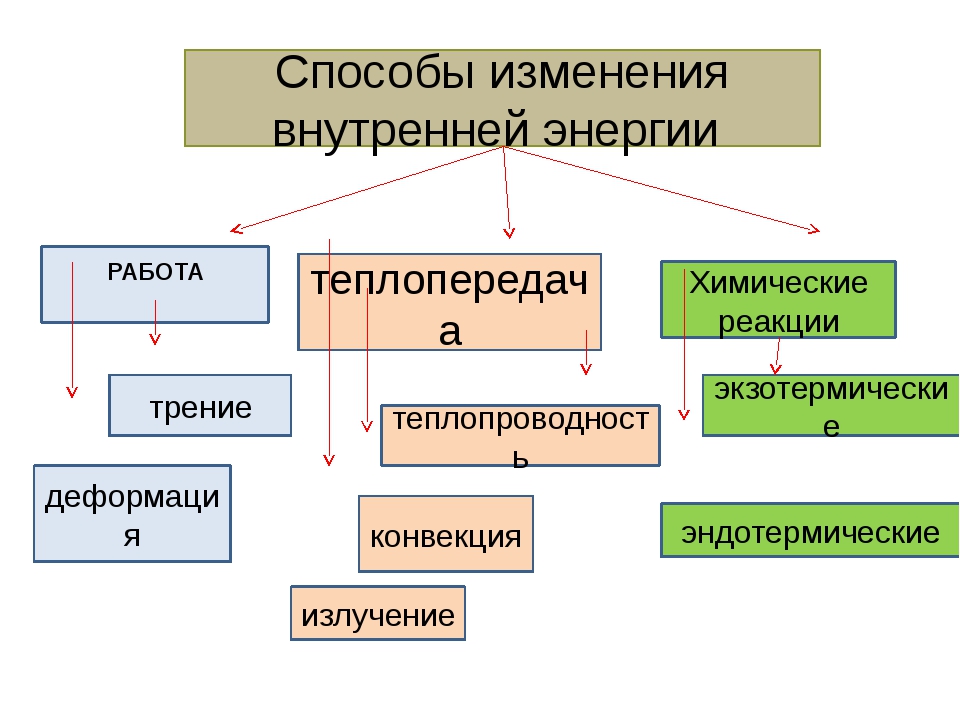 Температура воды в термопоте остается на уровне 95-98 градусов в течение пяти-шести часов после кипячения, а после – около 80 градусов. Назовите преимущества и недостатки использования термопотов в быту. Объясните явления, позволяющие сохранять воду горячей длительное время.
Температура воды в термопоте остается на уровне 95-98 градусов в течение пяти-шести часов после кипячения, а после – около 80 градусов. Назовите преимущества и недостатки использования термопотов в быту. Объясните явления, позволяющие сохранять воду горячей длительное время. http://bigcost.ru/moda-i-krasota/skolko-stoit-shuba-iz-bobra.html
http://bigcost.ru/moda-i-krasota/skolko-stoit-shuba-iz-bobra.html Серебристые или золотистые волоски усиливают отражение сильных потоков лучей. Экспериментально доказано, что светлая форма поглощает больше тепла и меньше влаги, а темная (например, у озимой совки) при более низких температурах — меньше, что объясняет явление сезонного диморфизма». http://insects-world.org.ru/page6.php
Серебристые или золотистые волоски усиливают отражение сильных потоков лучей. Экспериментально доказано, что светлая форма поглощает больше тепла и меньше влаги, а темная (например, у озимой совки) при более низких температурах — меньше, что объясняет явление сезонного диморфизма». http://insects-world.org.ru/page6.php Среди насекомых, похоже, единственным видом, который обладает такой способностью, является кузнечик-хамелеон Kosciuscola tristis, обитающий в Австралийских Альпах. Когда температура вокруг превышает 10 ˚C, кузнечик начинает менять цвет с чёрного на бирюзовый — и полностью перекрашивается при 25 ˚C. Объяснение у всего этого, казалось бы, простое: терморегуляция. В холод кузнечику нужно поглощать больше тепла и дольше оставаться активным в вечернее время, а при повышении температуры, наоборот, защищаться от перегрева, отражая часть солнечного света. К таким резким изменениям окраски способны только самцы». http://science.compulenta.ru/618010/
Среди насекомых, похоже, единственным видом, который обладает такой способностью, является кузнечик-хамелеон Kosciuscola tristis, обитающий в Австралийских Альпах. Когда температура вокруг превышает 10 ˚C, кузнечик начинает менять цвет с чёрного на бирюзовый — и полностью перекрашивается при 25 ˚C. Объяснение у всего этого, казалось бы, простое: терморегуляция. В холод кузнечику нужно поглощать больше тепла и дольше оставаться активным в вечернее время, а при повышении температуры, наоборот, защищаться от перегрева, отражая часть солнечного света. К таким резким изменениям окраски способны только самцы». http://science.compulenta.ru/618010/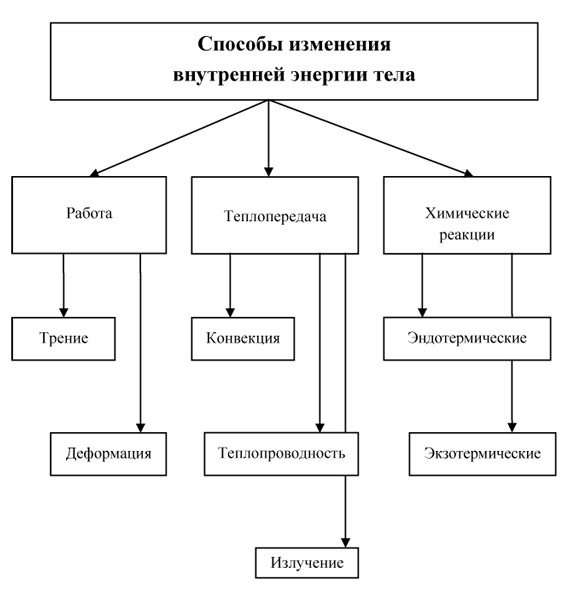

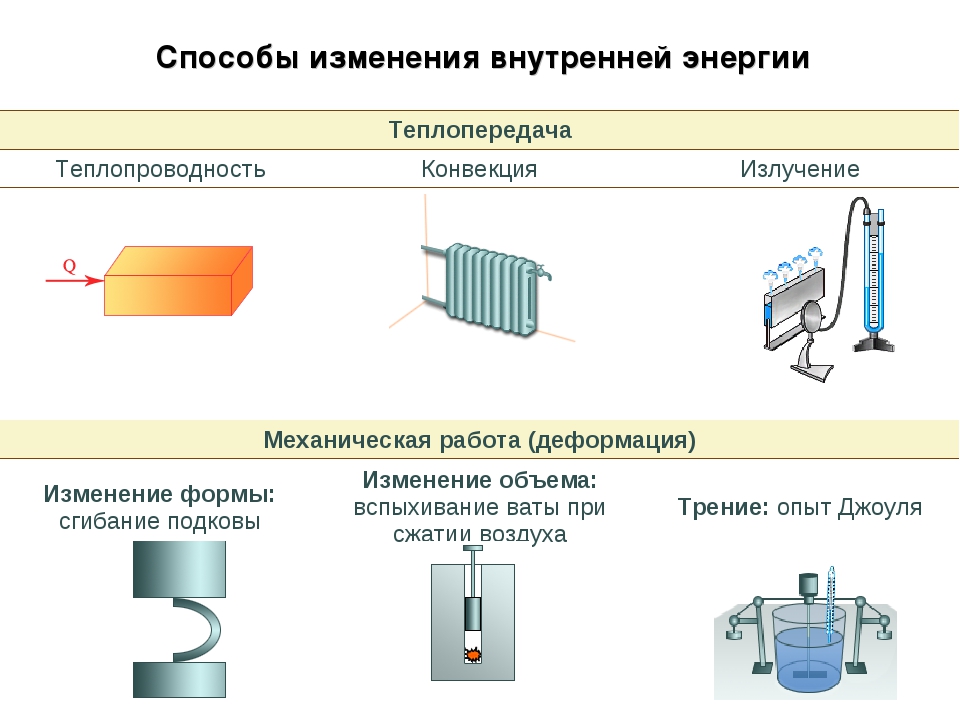
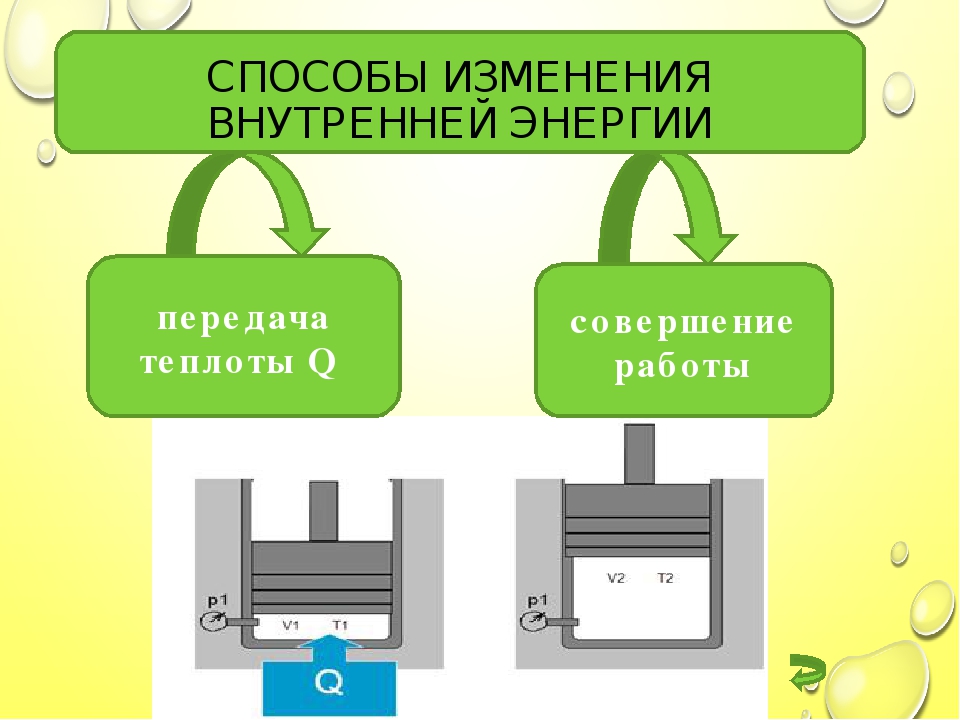
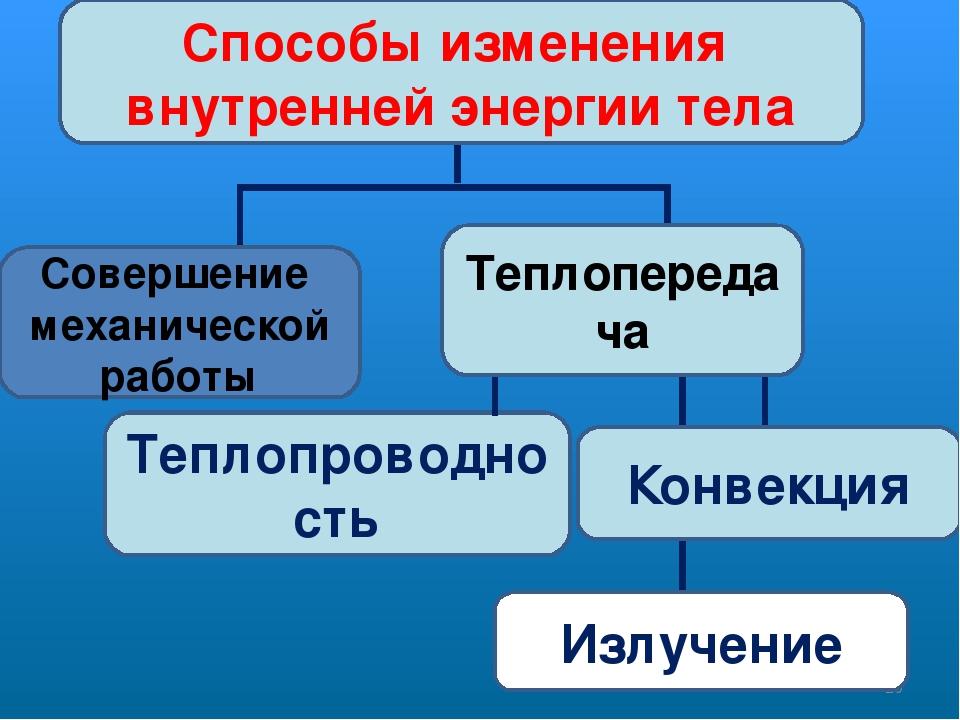


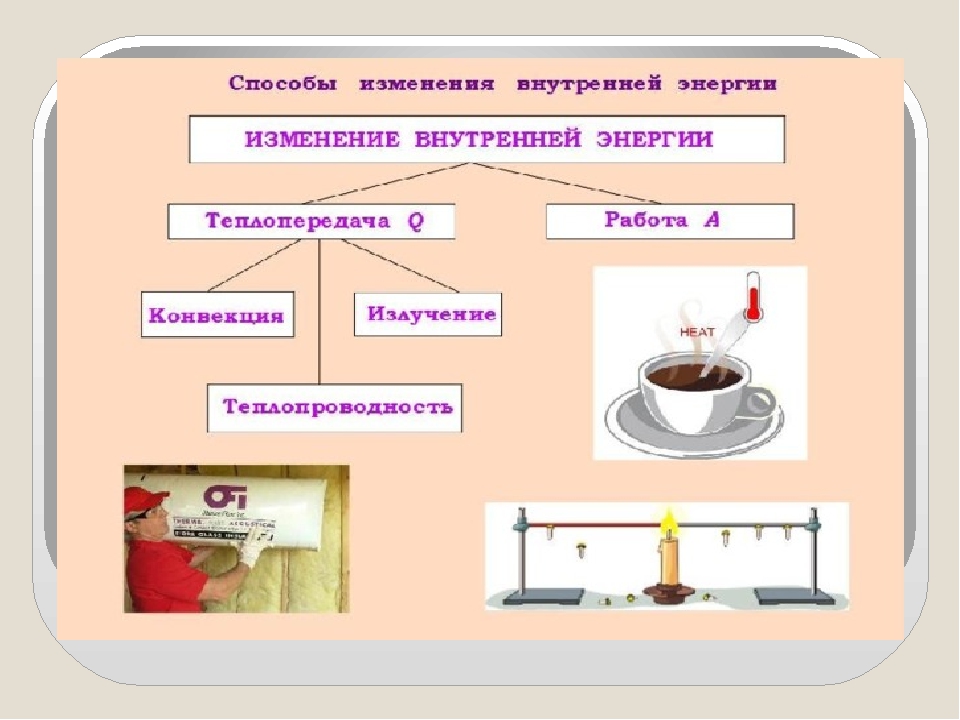

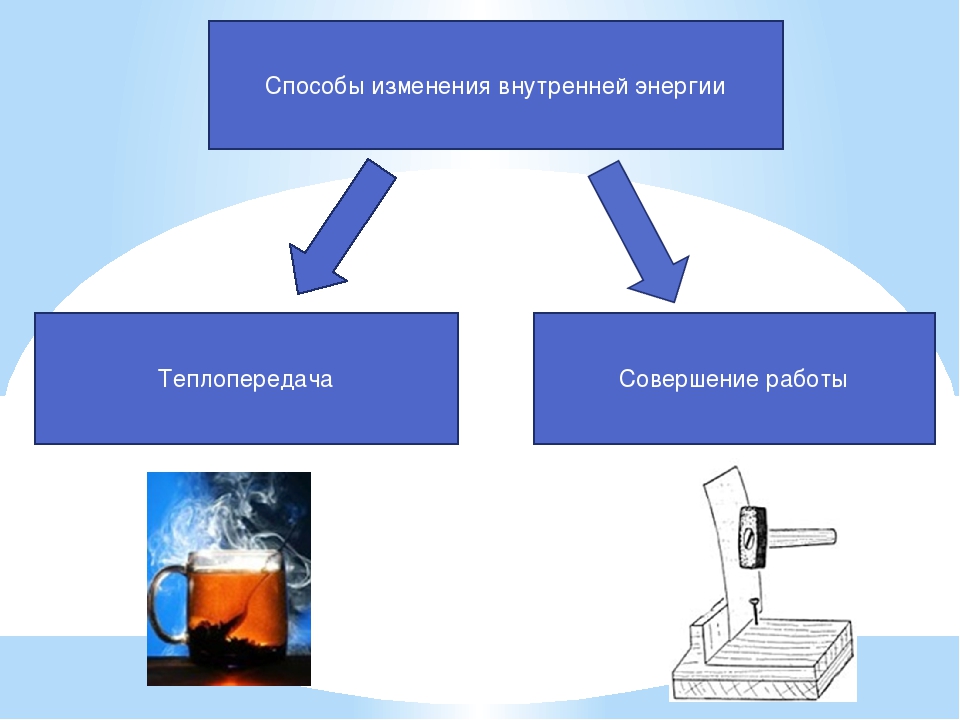
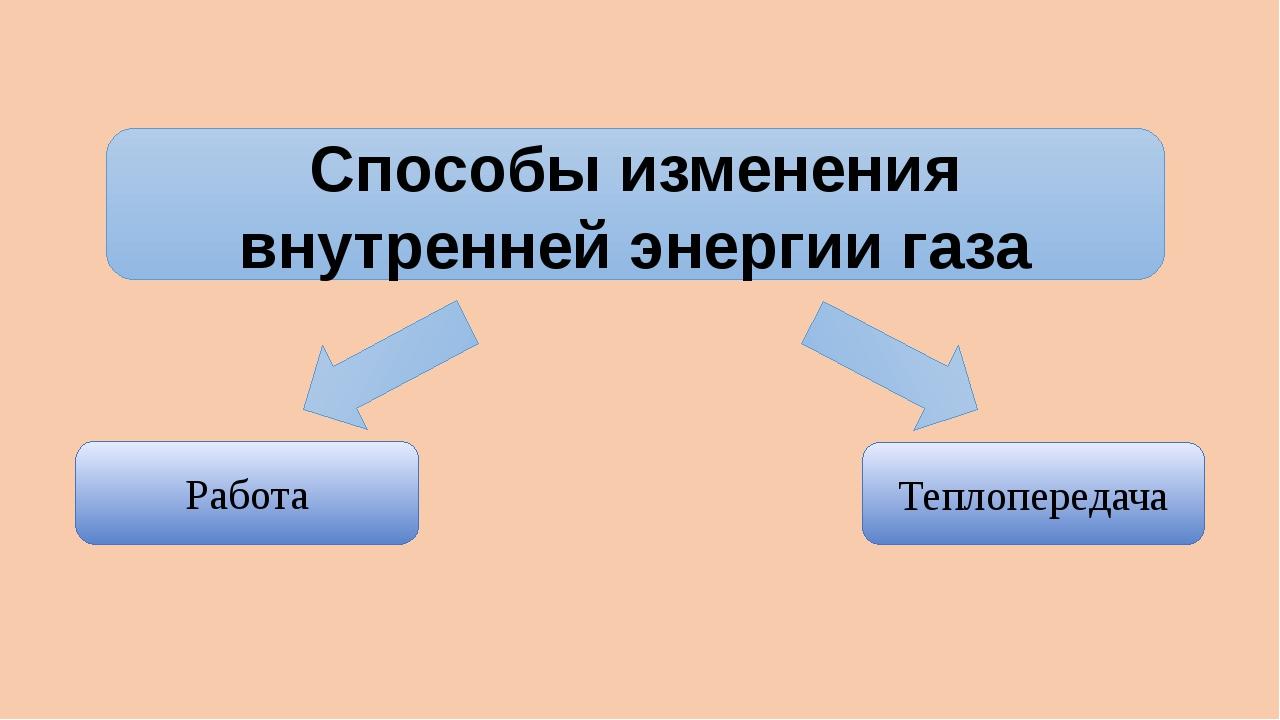
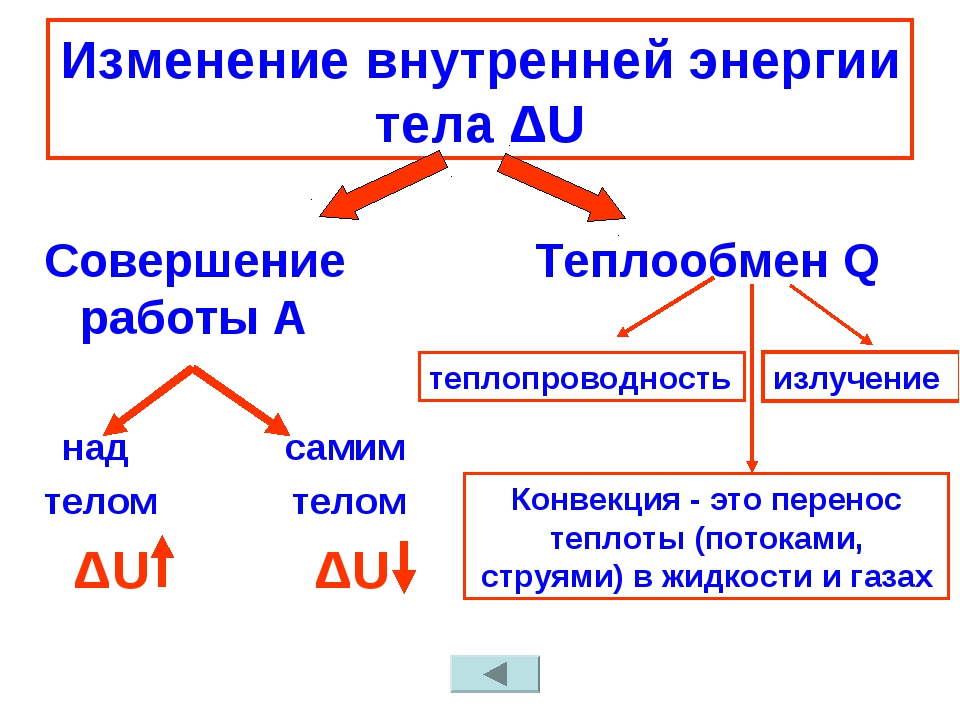
 момент.
момент.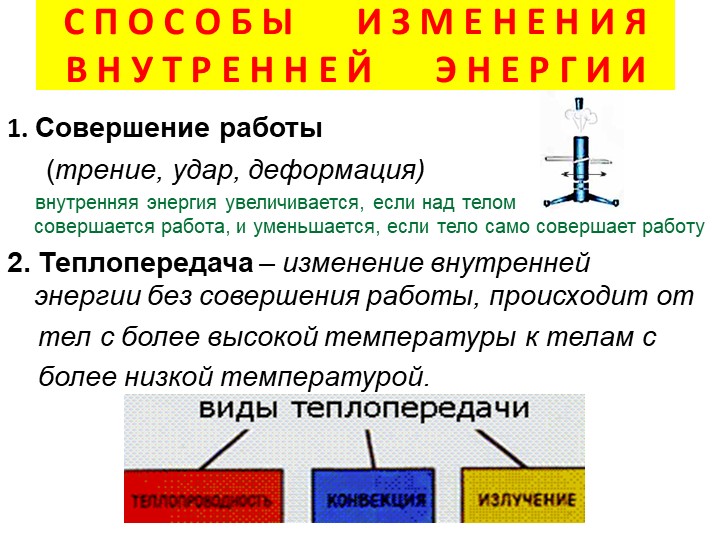 Использование ИКТ.
Использование ИКТ.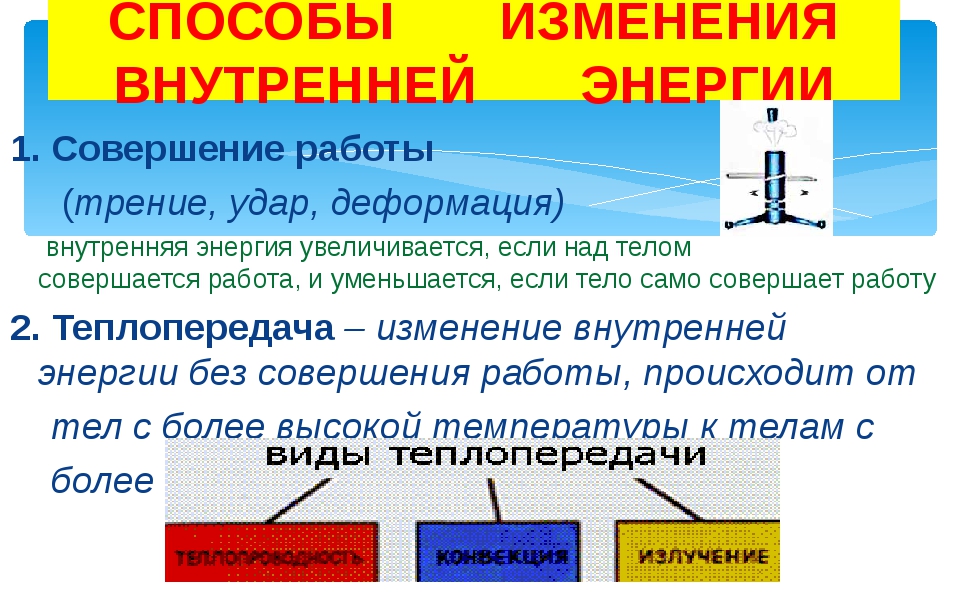 Новые подходы в преподавании и обучении.
Новые подходы в преподавании и обучении.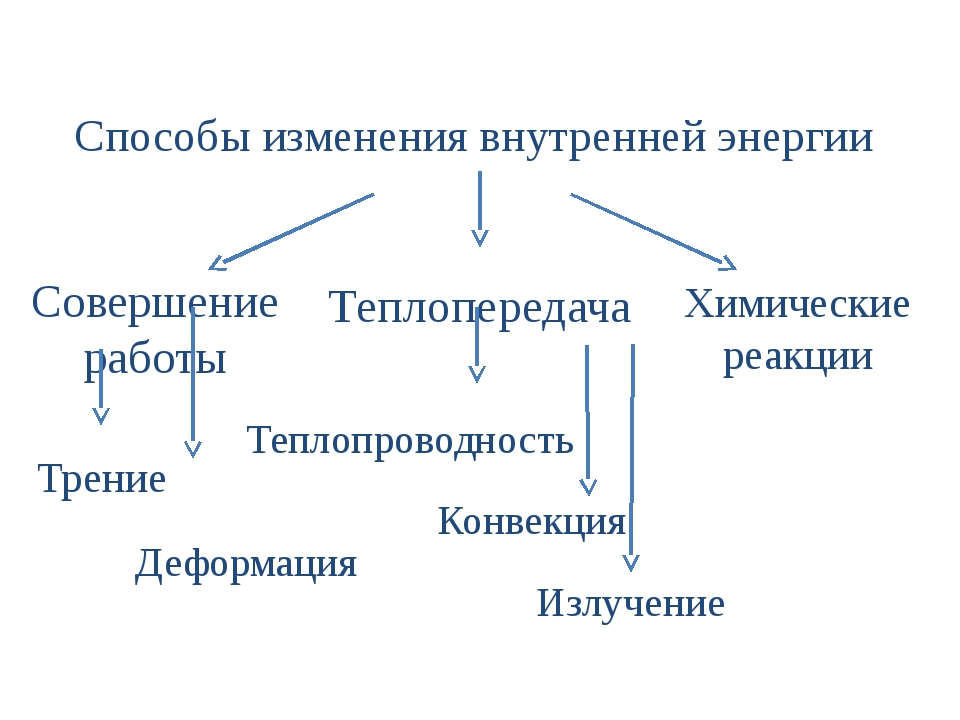
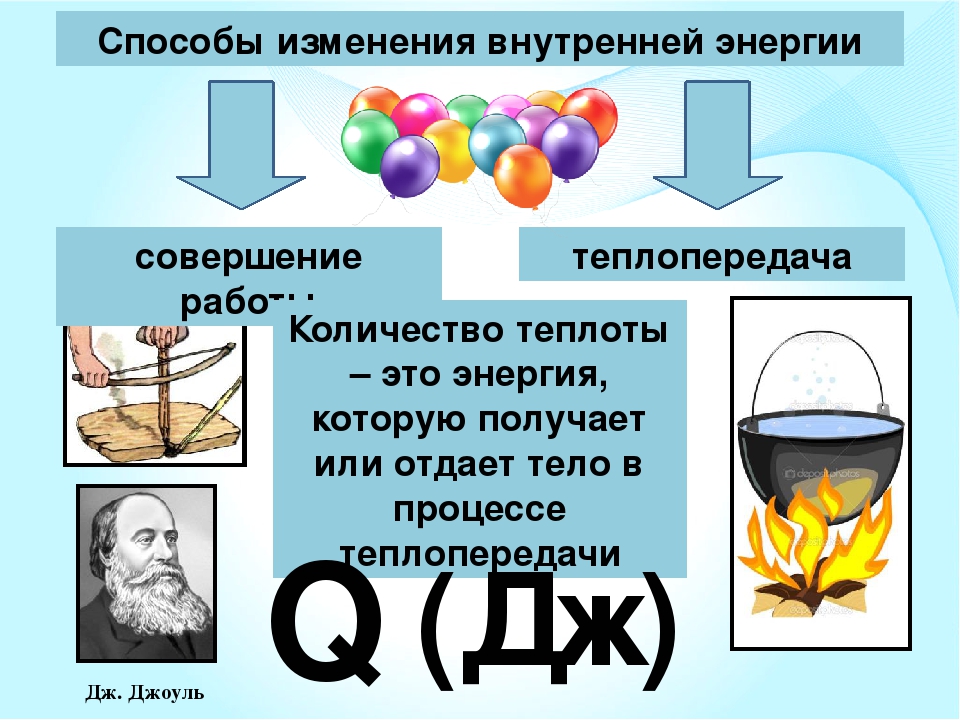 работы
работы


 Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
Если же в условии задаётся математическая зависимость между параметрами газа, то сначала находят зависимость между давлением и объёмом, а затем строят график p(V).
 это
важно точно понять эти идеи или развить термодинамические концепции.
которые разработаны из них, вероятно, не будут ясно поняты.
это
важно точно понять эти идеи или развить термодинамические концепции.
которые разработаны из них, вероятно, не будут ясно поняты. Положительные значения для w или q означают энергию
входит в систему.
Положительные значения для w или q означают энергию
входит в систему.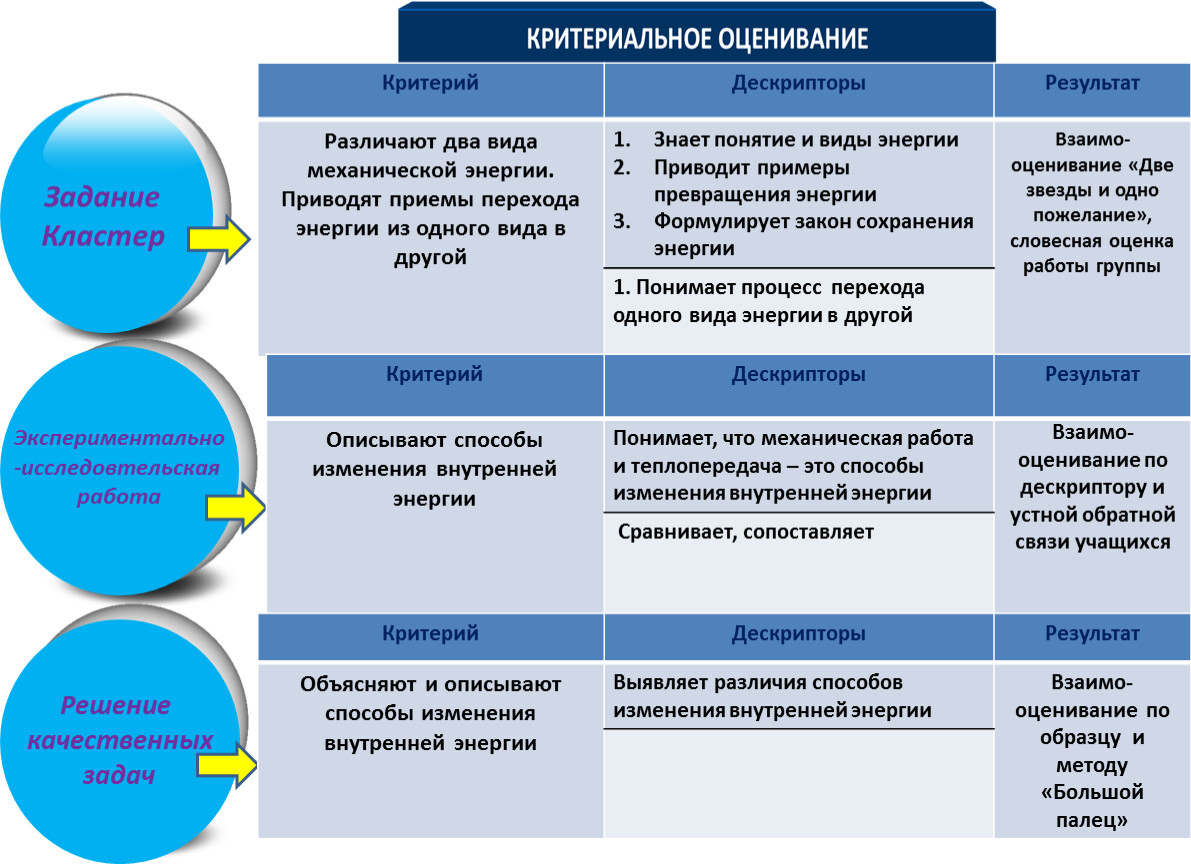 Это своего рода
энергия, которую мы видели в предыдущем разделе этих заметок. Термальный
энергия включает поступательную кинетическую энергию молекул,
энергии колебаний и энергии вращения. Итак, если у нас есть процесс
с положительным q означает найденную энергию
в этих трех режимах формы увеличились.
Если процесс имеет отрицательное значение q, то эти формы энергии имеют
уменьшилось.Он использует то же соглашение о знаках относительно энергии в и
как работает.
Это своего рода
энергия, которую мы видели в предыдущем разделе этих заметок. Термальный
энергия включает поступательную кинетическую энергию молекул,
энергии колебаний и энергии вращения. Итак, если у нас есть процесс
с положительным q означает найденную энергию
в этих трех режимах формы увеличились.
Если процесс имеет отрицательное значение q, то эти формы энергии имеют
уменьшилось.Он использует то же соглашение о знаках относительно энергии в и
как работает. Мы могли бы рассмотреть открытый контейнер
который не был изолирован как хороший пример
Мы могли бы рассмотреть открытый контейнер
который не был изолирован как хороший пример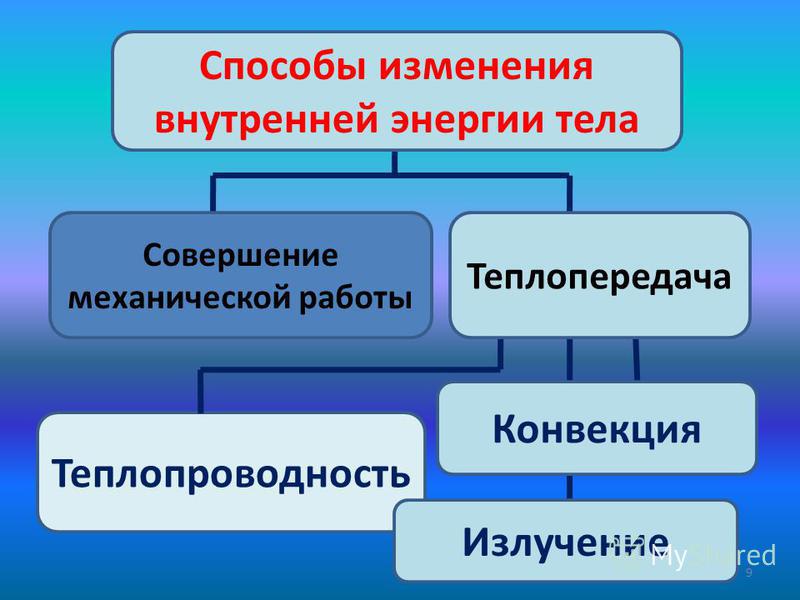 Мы также определили
энергия системы согласно уравнению
2.21 и
2.22. Это
Важно помнить, что в этих уравнениях содержится
предположение, что мы всегда начинаем с нуля энергии внизу
коллектора. Таким образом, как мы это делали в
уравнение 2.33,
нам нужен аддитивный коэффициент U 0 который сдвигает многообразие к истинному нулю энергии. Проблема
заключается в том, что мы не обязательно знаем значение U 0 и, следовательно, мы можем
никогда не узнать истинной внутренней энергии системы.
Мы также определили
энергия системы согласно уравнению
2.21 и
2.22. Это
Важно помнить, что в этих уравнениях содержится
предположение, что мы всегда начинаем с нуля энергии внизу
коллектора. Таким образом, как мы это делали в
уравнение 2.33,
нам нужен аддитивный коэффициент U 0 который сдвигает многообразие к истинному нулю энергии. Проблема
заключается в том, что мы не обязательно знаем значение U 0 и, следовательно, мы можем
никогда не узнать истинной внутренней энергии системы.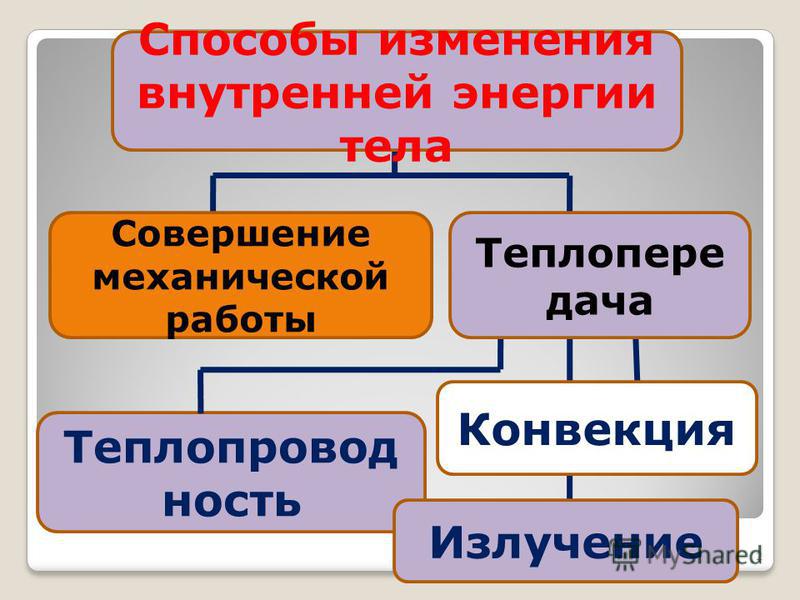 2
2
 Аргон также
полезно, потому что это большой тяжелый атом, который легче содержать
чем маленькие атомы, такие как гелий ( ср. излияний).
Аргон также
полезно, потому что это большой тяжелый атом, который легче содержать
чем маленькие атомы, такие как гелий ( ср. излияний).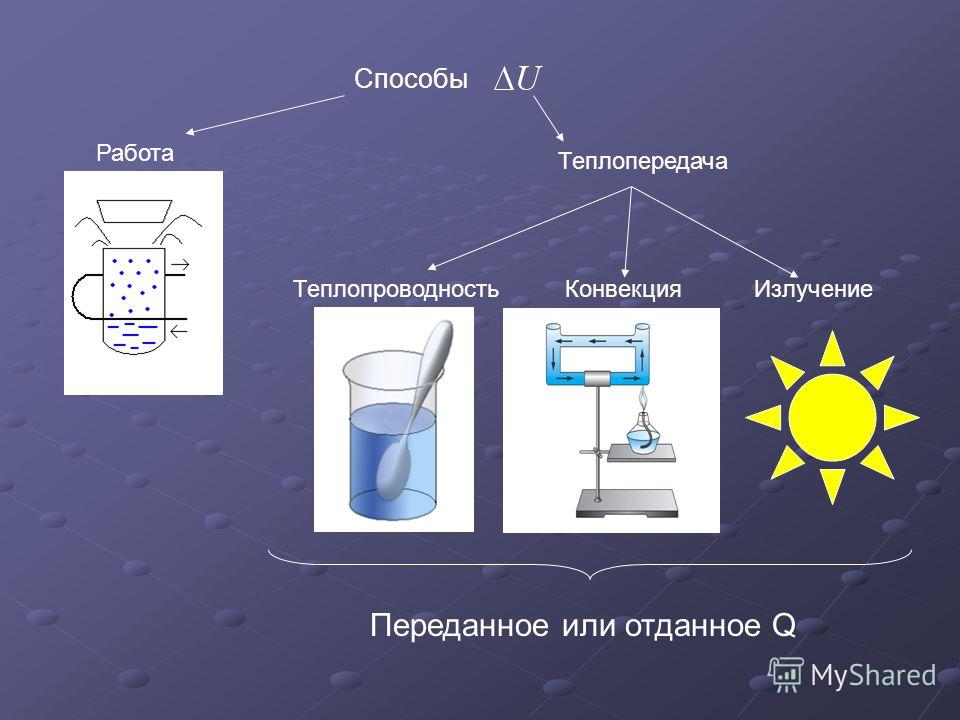 Таким образом, первый закон
позволяет приравнять эти два системных процесса к изменению
внутренняя энергия. Сумма q + w явно состояние
функционируют, даже если отдельные системные процессы не работают.
Таким образом, первый закон
позволяет приравнять эти два системных процесса к изменению
внутренняя энергия. Сумма q + w явно состояние
функционируют, даже если отдельные системные процессы не работают.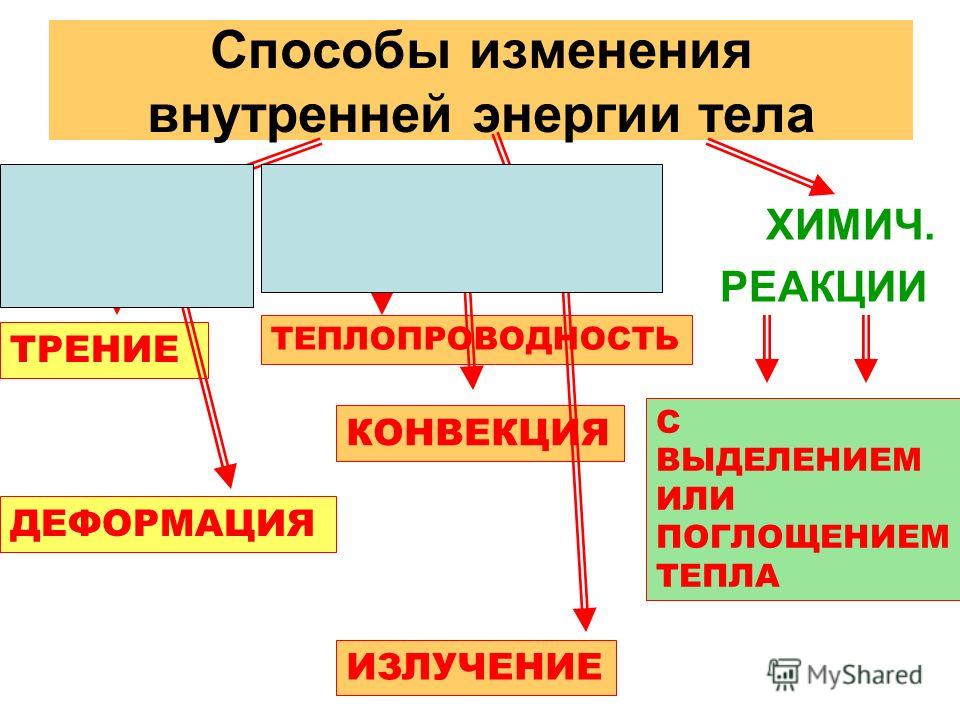 Чем чаще всего интересуются химики
является работа расширения. Когда система увеличивает свой объем на
отталкивает окружение или уменьшает его громкость, когда
окружение давит на него.тогда работа сделана. Это изменение в
объем может произойти наиболее заметно, когда реакции производят газообразные
продукты (расширение) или израсходовать газообразные реагенты (сжатие).
Чем чаще всего интересуются химики
является работа расширения. Когда система увеличивает свой объем на
отталкивает окружение или уменьшает его громкость, когда
окружение давит на него.тогда работа сделана. Это изменение в
объем может произойти наиболее заметно, когда реакции производят газообразные
продукты (расширение) или израсходовать газообразные реагенты (сжатие).

 Этот
является обратимой работой.
Этот
является обратимой работой.
 где V f включает в себя
объем газа и раствора и V i включает в себя
объем раствора и твердого вещества. Объемы раствора
исключается из расчета (значительно не меняется)
и объем твердого тела мал по сравнению с объемом
газовый продукт, поэтому мы проигнорируем его.Таким образом, изменение объема
упрощается до объема выделившегося газа. Так как газ
эволюционировали при постоянном давлении, мы можем приравнять давление газа к
внешнее давление, p ex .
где V f включает в себя
объем газа и раствора и V i включает в себя
объем раствора и твердого вещества. Объемы раствора
исключается из расчета (значительно не меняется)
и объем твердого тела мал по сравнению с объемом
газовый продукт, поэтому мы проигнорируем его.Таким образом, изменение объема
упрощается до объема выделившегося газа. Так как газ
эволюционировали при постоянном давлении, мы можем приравнять давление газа к
внешнее давление, p ex .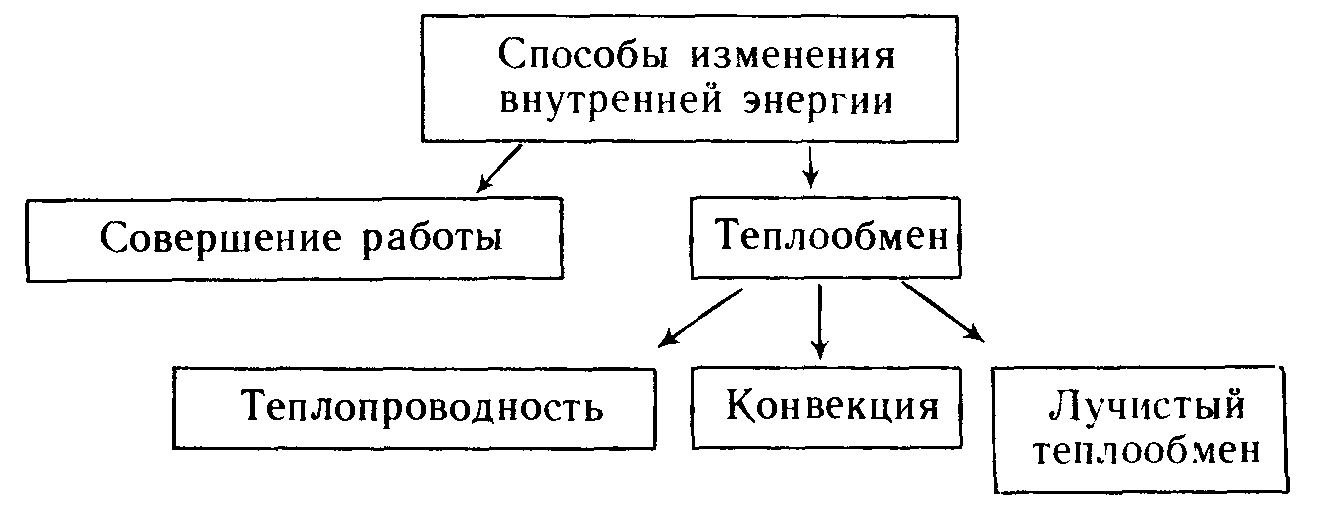 12
12 Примеры включают массу и объем. Обширные свойства
являются фактическими измеряемыми величинами.
Примеры включают массу и объем. Обширные свойства
являются фактическими измеряемыми величинами.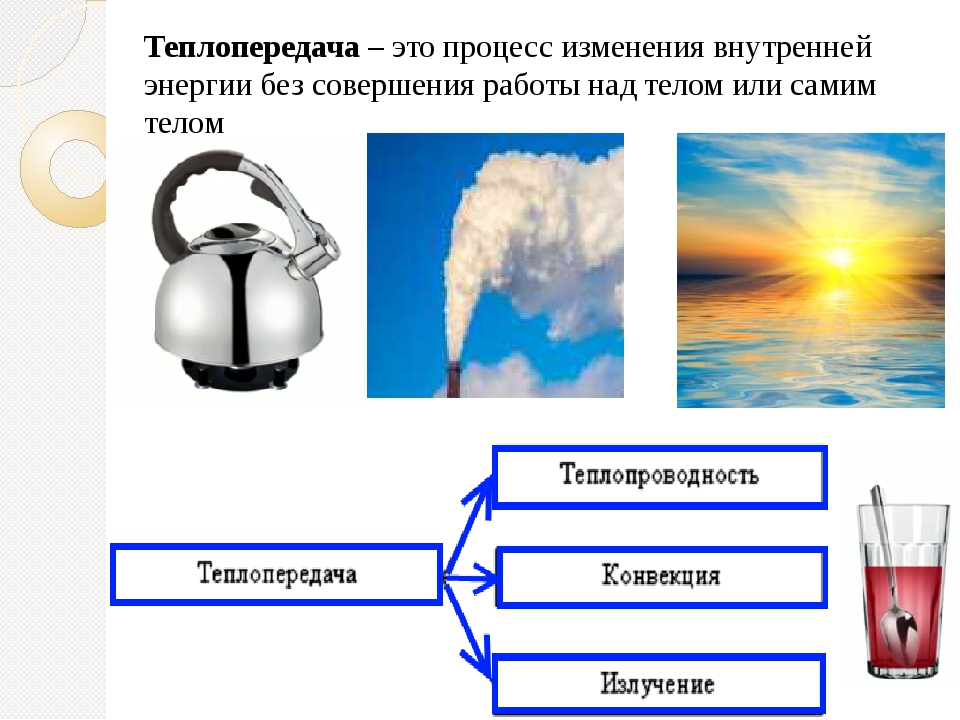 Преобразовать интенсивное свойство (из таблицы)
к экстенсивному значению нам нужно уравнение 3.15,
нам нужно умножить на массу или моли, соответственно, чтобы сократить
единицы должным образом. Некоторые люди на самом деле добавляют два дополнительных
уравнения к списку вещей, которые нужно запомнить; q = mCΔT и q = nCΔT .
Эти последние два уравнения просто делают явным преобразование
интенсивное свойство в экстенсивную (измеримую) величину.
Преобразовать интенсивное свойство (из таблицы)
к экстенсивному значению нам нужно уравнение 3.15,
нам нужно умножить на массу или моли, соответственно, чтобы сократить
единицы должным образом. Некоторые люди на самом деле добавляют два дополнительных
уравнения к списку вещей, которые нужно запомнить; q = mCΔT и q = nCΔT .
Эти последние два уравнения просто делают явным преобразование
интенсивное свойство в экстенсивную (измеримую) величину.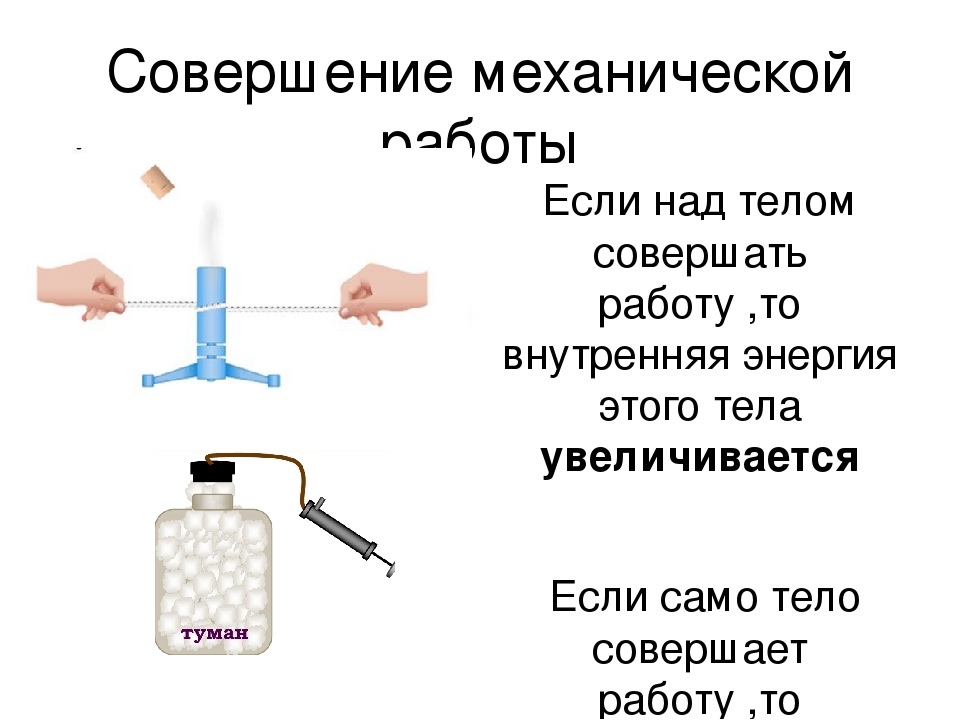 Если
подставляем это в производную, получаем:
Если
подставляем это в производную, получаем:
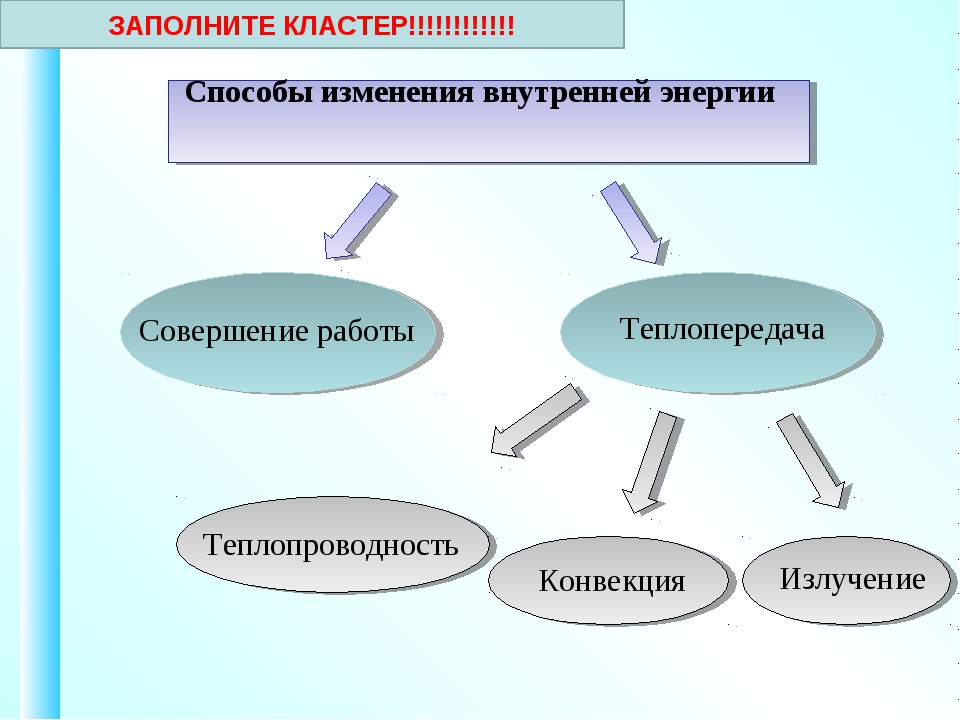 27 дает нашу отправную точку.
27 дает нашу отправную точку. 0936E+14
0936E+14