Cоставление уравнений окислительно – восстановительных реакций
Для составления уравнений окислительных – реакций используется метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которое отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
 Рассмотрим
применение метода электронного баланса
на примере реакции, которая выражается
следующей схемой:
Рассмотрим
применение метода электронного баланса
на примере реакции, которая выражается
следующей схемой:
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
а) Определяем степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1 +6 -2 +2 +6 -2 0 +1 +6 -2 +1 -2
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
б) Находим элементы, которые изменяют степени окисления, это марганец и бром:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 + H2O
в) Составляем уравнения процессов окисления и восстановления:
Mn +7 + 5e = Mn+2 восстановление окислителя
2Br-1 — 2e = Br2 окисление восстановителя
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые количество отданных и принятых электронов будут равны;
Mn +7 + 5e = Mn+2 |2
2Br-1 — 2e = Br2 | 5
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие процессах окисления и восстановления:
2KMnO4 + 10KBr + H2SO4 = 2MnSO4 + 5Br2 + K2SO4 + H2O
е) Уравниваем число атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода:
2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Проверяем правильность уравнивания по равенству числа атомов кислорода в левой (40 атомов) и правой (40 атомов) частях уравнения.
Электролиз
Электролизом называется окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Заряженные ионы электролита под действием электрического тока начинают двигаться к электродам: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются.
Электролиз расплавов и растворов протекает по разному т.к. в растворах дополнительно присутствуют ионы Н+ и ОН— , которые также участвуют в процессе электролиза.
Электролиз расплава. В теоретическом плане простейшим примером электролиза является электролиз расплава. Рассмотрим процесс электролиза расплава NaCI
NaCI = Na+ + CI–
Под действием электрического тока катионы движутся катоду и принимают от него электроны:
Катод (—) Na+ + e = Na0 – процесс восстановления.Анионы CI– движутся к аноду и отдают электроны:
Катод (—)
2 CI– — 2е = CI2 — процесс
окисления.
— процесс
окисления.
Na+ + e = Na0
2 CI– —
2е
= CI2 
Суммарное ионное
уравнение: 2Na+ + 2 CI– = 2Na0 + CI2
электролиз
Суммарное молекулярное уравнение: 2NaCI = 2Na + CI2

На катоде выделяется металлический натрий, на аноде – газообразный хлор. Это реакция окислительно — восстановительная, на катоде всегда идет процесс восстановления, на аноде всегда идет процесс окисления.
Электролиз растворов.
Процесс на катоде.
1.Если катион электролита находится в начале электрохимического ряда (по AI включительно), то на катоде идет процесс восстановления воды (выделяется Н2). Катионы металла не восстанавливаются, остаются в растворе.
2.Если катион электролита находится в ряду между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла и молекулы воды.
3.Если катион электролита находится в ряду напряжения после водорода, то на катоде идет только процесс восстановления ионов металла.
4.Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активных металлов.
Катодные процессы в водных растворах солей
Li, K, Ca, Na, Mg, Al | Mn, Zn, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
Men+ — металл не востанавливается | Men+ + Me0 | Men+ +2e = Me0 | |
2Н2О + 2е = Н2  + 2ОН— + 2ОН— | 2Н2О
+ 2е = Н2 |
Процесс на аноде. Продукты электролиза зависят от материала анода и природы аниона.
Если анод растворимый (железо, медь, серебро), то независимо от природы аниона всегда идет окисление металла анода.
Если анод нерастворимый (уголь, графит, платина, золото), то анионы безкислородных кислот (за исключением фторидов) окисляются на аноде, а анионы оксокислот и фториды не окисляются на аноде, а идет окисление воды с выделением кислорода. При электролизе щелочей идет окисление гидроксид ионов.
Анодные процессы в водных растворах
Анод | Анионы безкислородные | Анионы кислородсодержащие |
Нерастворимы | Окисление аниона (кроме фторидов) Асm — +me = Ас0 | В щелочной среде 4ОН——
4е = О2 В кислой, нейтральной средах 2Н2О
—
4е = О2 |
Растворимый | Окисление металла анода Ме0 —ne = Меn+ Анод раствор | Окисление металла анода Ме0 —ne = Меn+ Анод раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
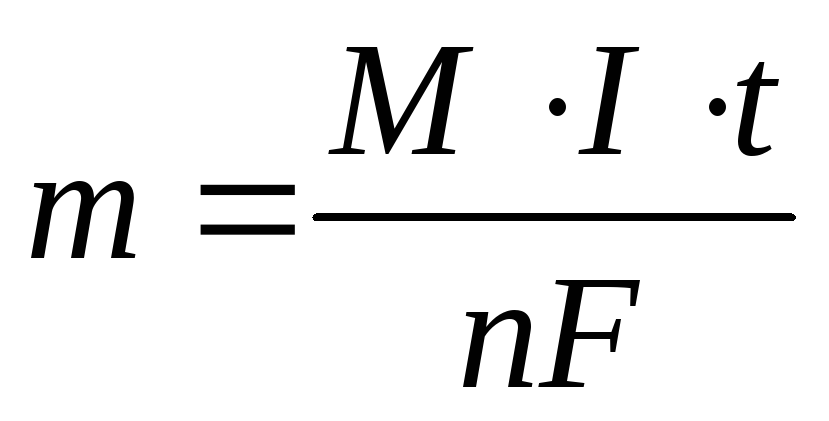 ,
где m
— масса вещества, М – малярная масса, n
— количество отданных или принятых
электронов, F
– число Фарадея (96500 Кл/моль) = А·ч/моль),
I
– сила тока (А), t
— продолжительность процесса.
,
где m
— масса вещества, М – малярная масса, n
— количество отданных или принятых
электронов, F
– число Фарадея (96500 Кл/моль) = А·ч/моль),
I
– сила тока (А), t
— продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Устройства, которые
применяют для непосредственного
преобразования энергии химических
реакций в электрическую энергию, называют
гальваническими элементами или
химическими источниками электрической
энергии. Действие любого гальванического
элемента основано на протекании в нем
окислительно – восстановительной
реакции.  Классический пример гальванического
элемента – элемент Даниэля – Якоби, он
состоит из цинковой пластины (1),
погруженной в раствор сульфата цинка
и медной пластины (2), погруженной в
раствор сульфата меди. Растворы разделены
пористой перегородкой (4) (или
электролитическим мостиком).
Классический пример гальванического
элемента – элемент Даниэля – Якоби, он
состоит из цинковой пластины (1),
погруженной в раствор сульфата цинка
и медной пластины (2), погруженной в
раствор сульфата меди. Растворы разделены
пористой перегородкой (4) (или
электролитическим мостиком).
При замкнутой цепи цинк окисляется, ионы цинка переходят в раствор, электроны движутся по внешней цепи к медному электроду.
На медном электроде происходит восстановление ионов меди из раствора, медь выделяется на пластинке. Цинковый электрод является анодом, медный катодом, цинк растворяется, медь выделяется из раствора, сульфат анионы движутся через пористую перегородку от медного к цинковому электроду.
Процесс на аноде Zn = Zn+2 + 2e
Процесс на катоде Cu+2 + 2e = Cu
Суммарное уравнение: Zn + Cu+2 = Zn+2 + Cu
Молекулярное уравнение: Zn + CuSO4 = Zn SO4 + Cu
Кратко строение элемента Даниэля – Якоби можно записать следующей схемой:
Zn|ZnSO4(р) || CuSO4(р)|Cu
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. В настоящее время используются различные гальванические элементы: железо – никелевые, кадмиево – никелевые, серебряно – цинковые, свинцовые, и др. их называют аккумуляторами. В свинцовом аккумуляторе одни пластины заполнены дооксидом свинца, другие губчатым свинцом. Металлический свинец при работе аккумулятора является анодом и окисляется:
Pb + SO4-2 = PbSO4 +2e
Диоксид свинца является катодом, он восстанавливается:
PbO2 + SO4-2 + 4H+ + 2e = PbSO4 +2H2O
Суммарный процесс: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
При зарядке, через аккумулятор пропускают электрический ток и в результате этого электрохимические процессы на электродах протекают в обратном направлении.
Свинцовый электрод становится катодом, на нем протекает процесс восстановления:
PbSO4 +2e = Pb + SO4-2
На электроде из PbO2 происходит процесс окисления:
PbSO4 + 2H2O = PbO2 + SO4-2 + 4H+ + 2e
 ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ
ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ

Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.
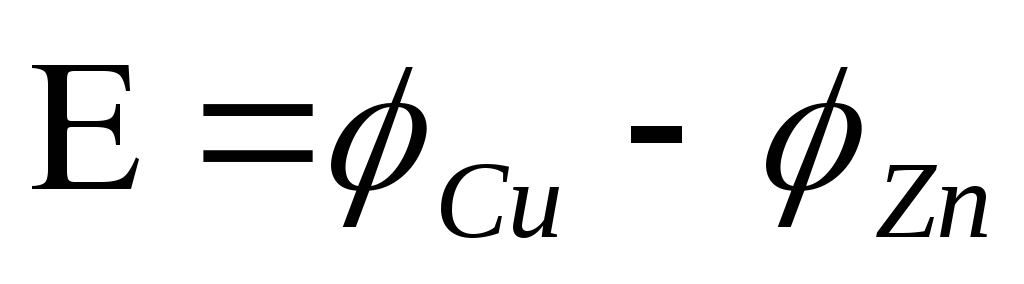


Скачок потенциала,
возникающий на границе раздела металл
– раствор его соли, называется электродным
или окислительно – восстановительным
потенциалом ( ).
).
Зависимость
электродного потенциала от природы
металла, концентрации его ионов в
растворе и температуры количественно
выражается уравнением В. Нернста. 
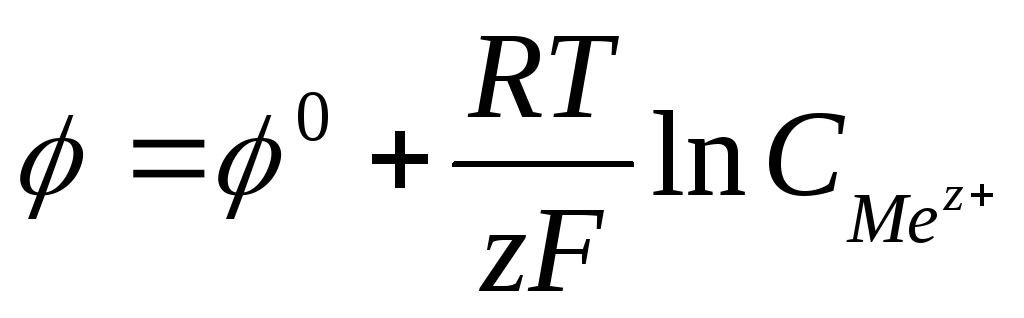 ,
где F — число Фарадея
,
где F — число Фарадея
равно 96500Кл/моль,
z – заряд иона, R – газовая постоянная
8,31Дж/моль·К,
Т температура по Кельвину, 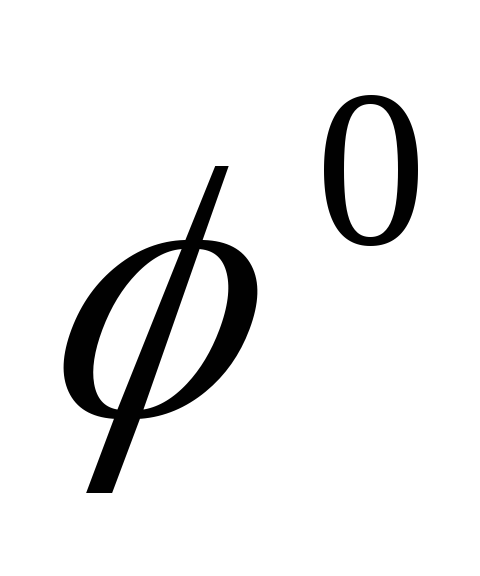 — стандартный электродный потенциал
металла. Подставляя в формулу число
Фарадея, температуру 298К, газовую
постоянную и десятичный логарифм,
получаем:
— стандартный электродный потенциал
металла. Подставляя в формулу число
Фарадея, температуру 298К, газовую
постоянную и десятичный логарифм,
получаем:
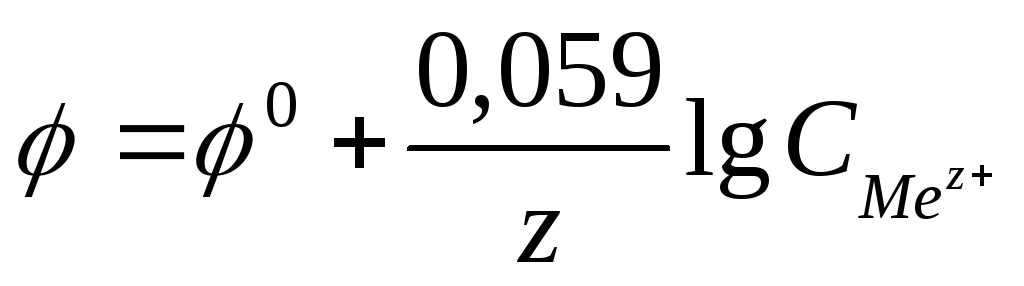
Стандартным
электродным потенциалом металла 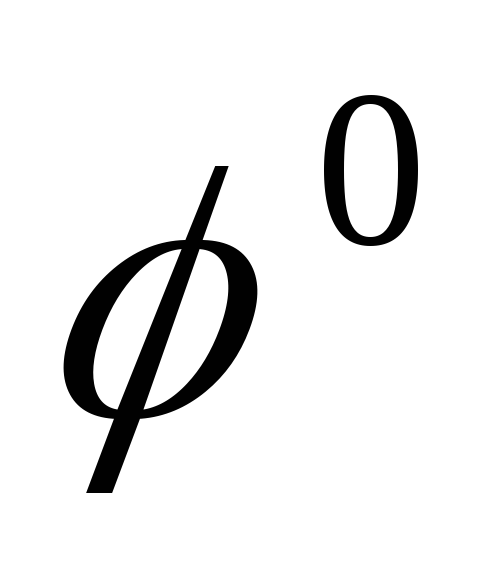 называется скачок потенциала на границе
раздела металл — раствор его соли с
концентрацией 1 моль/л.
называется скачок потенциала на границе
раздела металл — раствор его соли с
концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента) , а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
К электрохимической коррозии относятся все случаи коррозии в водных растворах или во влажной атмосфере. Для предупреждения от электрохимической коррозии применяются различные методы. Например, защитные металлические покрытия. Железные изделия могут покрываться тонкой пленкой хрома, никеля, цинка, кадмия, алюминия, олова, серебра, золота и др. При нарушении целостности металлического покрытия в влажной среде, возникает гальванический элемент, что приводит к растворению более активного металла. Металл, который в ряду напряжения стоит левее, становится анодом и разрушается, при этом менее активный металл не изменяется.
Для защиты металлов от коррозии используют как анодное, так и катодное покрытие металлов. При анодном покрытии берется более активный металл (например, покрытие цинком железного изделия), он и растворяется при коррозии, а основной металл не разрушается. Катодное покрытие (например, серебрение железного изделия), защищает металл до тех пор пока пленка не нарушена. При нарушении защитной пленки основной металл становится анодом, а покрытие катодом, соответственно разрушается защищаемый металл, а покрытие не разрушается.
studfile.net
Тренировочные задания. Окислительно-восстановительные реакции – HIMI4KA

1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


15. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


16. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


17. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


18. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


19. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


20. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


21. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


22. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


23. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


24. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


25. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


26. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


27. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


28. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


29. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


30. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


31. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


32. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


33. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


34. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


35. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


36. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


37. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


38. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


39. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


40. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


41. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


42. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


43. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


44. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


45. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


46. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


47. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


48. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


49. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


50. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


51. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


52. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


53. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


54. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


55. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


56. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


57. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


58. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


59. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


60. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


61. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


62. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


63. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


64. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


65. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


66. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


67. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


68. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


69. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


70. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


71. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


72. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


73. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


74. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


75. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:


Ответы












himi4ka.ru
Уравнения окислительно-восстановительных реакций — Студопедия.Нет
Многие химические реакции уравниваются простым подбором коэффициентов. Но иногда возникают сложности: количество атомов какого-нибудь элемента в левой и правой частях уравнения никак не удается сделать одинаковым без того, чтобы не нарушить «равновесия» между атомами других элементов.Чаще всего такие сложности возникают в уравнениях окислительно-восстановительных реакций. Для их уравнивания используют несколько способов, из которых мы пока рассмотрим один – метод электронного баланса. Напишем уравнение реакции между алюминием и кислородом: Al + O2 = Al2O3
Итак, в чем заключается метод электронного баланса? Баланс – это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
| 0 | 0 | +3 –2 | ||
| Al | + | O2 | = | Al2O3 |
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород – принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
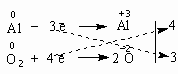
 Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху. Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом. Например, известная всем «марганцовка» – марганцевокислый калий KMnO4 – является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl– отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
| +7 | –1 | 0 | +2 | |||||||||
| KMnO4 | + | KCl | + | H2SO4 | = | Cl2 | + | MnSO4 | + | K2SO4 | + | H2O |
Составим схему электронного баланса: 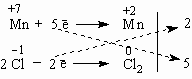
Двойка и пятерка – главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2следует поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 – коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H2SO4 и H2O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды – все это окислительно-восстановительные процессы.
В технике с помощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4)и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Большинство химических реакций– окислительно-восстановительные. Приведем важнейшие определения, связанные с окислительно-восстановительными реакциями.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются.
Поскольку окислитель присоединяет электроны, степень окисления его атомов может только уменьшаться. Наоборот, восстановитель теряет электроны и степень окисления его атомов должна повышаться.
Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем
Если каждый атом окислителя может принять иное количество электронов, чем отдает атом восстановителя, то необходимо так подобрать количество атомов того и другого реагента, чтобы количество отдаваемых и принимаемых электронов стало одинаковым. Это требование положено в основу метода электронного баланса, с помощью которого уравнивают уравнения окислительно-восстановительных реакций.
| Восстановители | Окислители |
| Металлы, водород, уголь Оксид углерода(II) CO Сероводород H2S, оксид серы(IV) SO2, сернистая кислота H2SO3 и ее соли Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова(II) SnCl2, сульфат железа(II) FeSO4, сульфат марганца(II) MnSO4, сульфат хрома(III) Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота(II) NO Фосфористая кислота H3PO3 Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе | Галогены Перманганат калия KMnO4 , манганат калия K2MnO4 , оксид марганца(IV) MnO2 Дихромат калия K2Cr2O7 , хромат калия K2CrO4 Азотная кислота HNO3 Кислород O2, озон О3, пероксид водорода Н2О2 Серная кислота H2SO4(конц.), селеновая кислота H2SeO4 Оксид меди(II) CuO, оксид серебра(I) Ag2O, оксид свинца(IV) PbO2 Ионы благородных металлов (Ag+, Au 3+ и др.) Хлорид железа(III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка, смесь концентрированной азотной и плавиковой кислот Анод при электролизе |
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока,называется электролизом.
В расплавах или растворах происходит диссоциация электролита. Катионы смещаются к катоду, анионы к аноду.
Электролиз расплавов.
На катоде происходит восстановление катионов, на аноде окисление анионов.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов
на катоде — восстановление катионов и ионов водорода
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются следующие:
на аноде — окисление анионов и гидроксид-ионов;
анодное растворение металла — материала анода
на катоде — восстановление катиона соли и ионов водорода;
восстановление катионов металла, полученных при растворении анода
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с нерасходуемым электродом используют следующие правила.
1. На аноде могут образовываться следующие продукты:
а) при окислении анионов 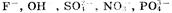 выделяется кислород;
выделяется кислород;
б) при окислении анионов 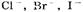 выделяются соответственно хлор, бром, иод;
выделяются соответственно хлор, бром, иод;
в) при окислении анконов органических кислот происходит процесс: 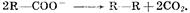
2. Если конкурирующими процессами на катоде является восстановление катионов (металл стоит в электрохимическом ряду напряжений металлов левее водорода) и ионов водорода, то при этом выделяется водород.
В тех случаях, когда в процессе электролиза используется активный (расходуемый) анод, то последний будет окисляться в ходе электролиза и переходить в раствор в виде катионов. Энергия электрического тока при этом расходуется ка перенос металла с анода на катод. Данный процесс широко используется при рафинировании (очистка) металлов. Так, на этом принципе основано, в частности, получение чистой меди из загрязненной. В раствор медного купороса погружают пластины из очищенной и неочищенной меди. Пластины соединяют с источником постоянного тока таким образом, чтобы первая из них (очищенная медь) была отрицательным электродом (катод), а вторая — положительным (анод). В результате пластина из неочищенной меди растворяется и ионы меди из раствора осаждаются на катоде. При этом примесь остается в растворе или оседает на дно ванны. Этот же принцип используется для защиты металлов от коррозии путем нанесения на защищаемое изделие тонких слоев хрома или никеля.
studopedia.net
 + 2ОН—
+ 2ОН— й
й + 2Н2О
+ 2Н2О