Скорость химических реакций. Основной урок. Видеоурок. Химия 9 Класс
Скорость химической реакции характеризует, насколько превращение веществ протекает быстро или медленно. Изучением скоростей химических реакций занимается химическая кинетика. Одна из важнейших ее задач – управление скоростью реакции.
Для гомогенной реакции, протекающей в постоянном объеме, скорость реакции равна изменению концентрации любого из участвующих в реакции веществ в единицу времени:
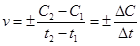
Если концентрация уменьшается (С2 < С1), то перед дробью ставят знак «минус», т. к. скорость не может иметь отрицательное значение.
1. Природа реагирующих веществ
Например, металлы (натрий и калий) с одним и тем же веществом – водой – реагируют с различными скоростями. Калий очень энергично реагирует с водой, выделяющийся водород загорается на воздухе (рис. 2). Натрий реагирует с водой более спокойно (рис. 1).

Рис. 1. Взаимодействие натрия с водой

Рис. 2. Взаимодействие калия с водой
2. Концентрация исходных веществ
Чем больше концентрация веществ, тем больше вероятность столкновения реагирующих веществ, поэтому – тем больше скорость реакции.
3. Температура
Многие химические процессы ускоряются с ростом температуры. Например, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике; в странах с влажным тропическим климатом машины ржавеют быстрее, чем в северных широтах.
Например, если к раствору серной кислоты добавить немного черного порошка оксида меди (II), никаких изменений наблюдаться не будет. При нагревании же смеси раствор станет голубым.
4. Давление
Давление оказывает влияние на скорость реакции тогда, когда реакция протекает с участием газообразных веществ. С повышением давления скорость реакции возрастает. Это связано с тем, что с повышением давления расстояние между молекулами уменьшается, поэтому повышается вероятность столкновений молекул, приводящих к превращению вещества.
5. Площадь поверхности соприкосновения исходных веществ
interneturok.ru
Урок: «Скорость химической реакции»
М
«Средняя общеобразовательная школа» пгт. Войвож
Скорость химической реакции. Факторы, влияющие на скорость.
Учитель химии:
Полушина Татьяна Анатольевна.
пгт. Войвож
2014г.
Урок: «Скорость химической реакции»
Девиз урока:
Знания, не проверенные опытом, бесплодны и полны ошибок.
. Леонардо да Винчи
Тип урока: изучение нового материала.
Цели урока:
образовательные:
-сформировать у учащихся основные представления о скорости реакции и факторов, влияющих на скорость;
-продолжить формирование у учащихся навыков самостоятельной исследовательской работы, умения делать выводы, обобщать результаты эксперимента;
-стимулировать познавательную активность учащихся путём создания проблемной ситуации;
-развивать умение анализировать, делать предположения, выводы.
развивающие:
-развивать умение анализировать, делать предположения, выводы.
-развивать основные компетенции учащихся:
— умение принимать правильное решение;
-брать ответственность на себя;
воспитывающие:
— умение работать в группе;
— считаться с мнением других членов группы;
-радоваться успехам других, сопереживать неудачи.
Задачи:
-сформулировать понятие скорости химической реакции;
-рассмотреть влияние различных факторов на скорость реакции;
-развивать экспериментальные умения и научное мышление учащихся в процессе установления причинно- следственных связей, сравнения и наблюдения объектов и процессов, применения знаний и умений в новых ситуациях.
Методы обучения:— объяснительно- иллюстративный
— проблемно- поисковый
— репродуктивный
-демонстрационные и лабораторные опыты (экспериментальный)
— использование ИКТ
Приёмы обучения:
— постановка проблемных вопросов
-групповая работа
-эксперимент
Оборудование и реактивы: Демонстрация: CuSO4 , Fe , прибор, для изучения состава воздуха. На столах для работы по группам набор реактивов.
Учебно- наглядные пособия: презентация «Скорость химической реакции».
На доске:
Тема урока: Скорость химической реакции. Факторы, влияющие на скорость.
Задачи исследования: 1. Дать определение понятию скорости химической реакции.
2. Экспериментально выявить факторы, влияющие на скорость.
Ход урока.
Перед началом урока учащиеся класса делятся на пять исследовательских групп и садятся таким образом, чтобы было удобно проводить эксперимент и обсуждать вопросы сообща.
Объяснение учителя
Действия учителя и учеников
1-и этап: Вызов:Учитель : захожу в класс с двумя надутыми шариками и отпускаю их. Как вы думаете о чём сегодня пойдёт речь на уроке?
Учитель: Начало урока. Запись темы урока.
Сегодня мы с вами на сорок минут представим себя учёными- исследователями.
Но прежде , чем мы приступим к изучению нового материала, мне хотелось бы продемонстрировать не большой эксперимент. Посмотрите, пожалуйста на доску и сделайте свои предположения по поводу протекания этих реакций:
А)сульфата меди и железа;
Б)раствора сульфата меди и гидроксида калия
Будут ли протекать эти реакции?
Учитель: Я прошу желающего выйти к доске и провести реакции за демонстрационным столом , а затем записать уравнения этих химических реакций.
Учитель: Мы наблюдали сейчас две реакции.
ПРОБЛЕМА: Почему во втором случае мы не видим признаков реакции, неужели наши предположения неверны?
ВЫВОД: Реакции протекают с разной скоростью. Действительно, одни реакции идут медленно- образование ржавчины на железном гвозде, другие быстро, часто со взрывом.
Для полного гниения брошенной в лесу газеты нужен 1 год
Ржавления консервной банки-10 лет
Стекло практически не разрушается в течение столетий.
Но вы можете меня спросить: А какая нам разница, с какой скоростью идут реакции. Неужели это так важно.
Да, ребята , это важно .Важно помнить об этом, когда бросаете пустую бутылку в лесу , важно знать как пойдёт тот или иной процесс директору химического завода. Неслучайно , есть специальная наука-
Химическая кинетика-раздел химической науки, которая изучает скорость реакции и условия, влияющие на неё.
.
ПЕРЕХОД К ТЕМЕ УРОКА.
2-й этап: Осмысление (мозговой штурм):
Что такое скорость реакции и можно ли ей управлять. Попробуем ответить на эти вопросы на нашем сегодняшнем уроке
Итак, перед нами две задачи:
Дать определение понятию « скорость химической реакции».
Экспериментально выяснить, какие факторы влияют на скорость химической реакции.
Для ответа на первый вопрос мы прибегнем к теоретическим рассуждениям , то есть применим теоретический метод исследования. Давайте воспользуемся принципом аналогий. Вы уже сталкивались с понятием скорости в физике.
Вспомните, пожалуйста, определение скорости движения в физике.
СКОРОСТЬ движения показывает отношение перемещения в определённый промежуток времени. V= S/t ( единица измерения.)
Учащиеся выдвигают свои предположения
Учащиеся выдвигают свои предположения
Один из учащихся работает у доски.
Показываю.
Химическая кинетика- записать на доске.
Учитель показывает на экране проектора задачи исследования
На экране проектора- выражение скорости в физике.А сейчас, попробуем провести аналогию с понятием скорости химической реакции ,но вначале посмотрим опыт
демонстрация – горение свечки в закрытом сосуде
1). вам необходимо ответить на вопрос:
— Почему в закрытом сосуде горящая свечка постепенно гаснет?
Предполагаемый ответ: С течением времени количество молекул кислорода уменьшается, а количество молекул углекислого газа- увеличивается.
3). Какая величина характеризует количество частиц?
Чем измеряется?
Попробуем записать формулу скорости


U= n/ t*V Скорость реакции равна отношению изменения количества вещества в единицу объёма за промежуток времени. И единица измерения скорости будет
моль/л.сНо, отношение количества вещества к объёму – это молярная концентрация вещества, значит
Учащиеся в группах обсуждают ответ на поставленный вопрос.(2 мин.)Затем он выносится на общее обсуждение.
Предполагаемый ответ: Количество вещества; В молях (моль)
Мы можем записать формулу, выражающую скорость химической реакции с учётом изменяющихся во времени характеристик т.е молярной концентрации вещества
C1— начальная концентрация вещества
С2— конечная концентрация вещества


V=_+ C / t= c2-c1/t2-t1
,
и измеряется в моль/л
Пример:в реакцию вступило 10 моль кислоты(С1), через определённое время осталось 2 моль (С2). Считаем разностьС= С2-С1= 2-10= -8.Но скорость реакции не может быть отрицательной. Именно поэтому перед формулой стоит знак минус.
Если скорость реакции рассчитывается по количеству продукта реакции, то используется знак + перед формулой.
Но это справедливо для однородных реакций( гомогенных).
А
 если реакция гетерогенная? Реакция будет идти только на поверхности соприкосновения веществ. И в этом случае, скорость реакции можно найти по формуле: V= n/S t
если реакция гетерогенная? Реакция будет идти только на поверхности соприкосновения веществ. И в этом случае, скорость реакции можно найти по формуле: V= n/S t
Учитель записывает на доске нужную формулу
Итак, ребята. Что же такое скорость?
Промежуточное обобщение: Итак, Скорость реакции- величина, показывающая изменение молярной концентрации вещества в единицу времени.
Смотри презентацию.
На экране – промежуточное обобщение- определение и формула.
А сейчас приступим к выполнению второй задачи. Мы должны выяснить, каким образом можно влиять на скорость реакции.
Вам предстоит работа в группах. У каждой группы свое задание, оно написано на карточке, которая перед вами.
Я обращаю ваше внимание на соблюдение правил техники безопасности, будьте осторожны, внимательны при работе с веществами. Ничего не пробовать на вкус, ничего не нюхать. Помните о безопасности ваших партнёров по группе.
Всё ли вам понятно? Начинаем работать.
Далее идёт работа в группах. Каждая исследовательская группа выполняет химический эксперимент по инструкции, записанной на карточке. Время для работы- 10 минут. После работы от каждой группы выступает один человек с результатом испытания.
Учитель: Работа в группах закончена. Сейчас вам предстоит рассказать всем о результатах своих испытаний.
Во время рассказа учеников необходимо показывать странички презентации и давать свои комментарии по поводу экспериментов.
Мои комментарии:
Природа реагирующих веществ. ПРЕЗЕНТАЦИЯ,
Концентрация реагирующих веществ.
Поверхность соприкосновения реагирующих веществ
Температура.
Наличие катализатора.
Итак. Мы выяснили условия от которых зависит скорость химической реакции.
Обобщение. Заключительный слайд на экране проектора.
Презентация- Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Температура
Концентрация реагентов
Площадь соприкосновения реагирующих веществ
Наличие специальных веществ- катализаторов.
Катализаторы- это вещества . ускоряющие химическую реакцию.
3-й этап:Итоги урока и рефлексия:
Сегодня мы с вами представили себя учёными- исследователями.
Перед нами стояли две задачи: дать понятие скорости реакции и определить, можно ли повлиять на скорость. Я думаю, что мы решили стоящие перед нами задачи.
Что непонятно сегодня на уроке? С каким настроением вы уходите сегодня с урок?. В качестве закрепления темы урока я предлагаю вам составить кластер ( кластер- складывать).Но прежде- домашнее задание.
У вас на столах лежат памятки по краткому содержанию сегодняшнего урока. Эти листочки вы вклеите себе в тетрадь и найдёте там домашнее задание. И на этих же листках вам предложен кластер.
Домашнее задание:
Просмотр конспекта урока по предложенной вам памятке.
Задачи для самостоятельного решения:
1.Для реакции были взяты вещества при температуре 400С, а затем их нагрели до 700С. Как изменится скорость химической реакции , если температурный коэффициент её равен 2?
2.Как изменится скорость реакции, протекающей по уравнению 2NO+O2=2NO2, если концентрацию веществ увеличить в три раза?
3.При t= 300С реакция протекает за 25 минут, а при t= 500С за 4 минуты. Рассчитайте температурный коэффициент реакции.
Комментарии по факторам , влияющих на скорость реакции:
Основной теорией, объясняющей скорость химической реакции , является Теория столкновений.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Природа реагирующих веществ. Здесь следует помнить об особенности строения атомом элементов. По электрохимическому ряду напряжений металлов мы видим, что магний активней, чем цинк.
Концентрация реагирующих веществ.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.На основе большого экспериментального материала в 1867г. Норвежские учёные К.Гульдберг и П.Вааге и независимо от них в 1865 г. Русский учёный Н.И.Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс. 2А+3В=А2В3V=(А)2.(В)3
3.Поверхность соприкосновения реагирующих веществ. Этот фактор применим для гетерогенных реакций. Чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
4.Температура.
Чем больше температура, тем больше активных частиц, увеличивается скорость их движения, что приводит к увеличению числа соударений. Скорость реакции возрастает. Правило Вант-Гоффа математически выражается следующей формулой: При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:

где V1 –скорость реакции при температуре t2,
V2 – скорость реакции при температуре t1,
y – температурный коэффициент.
5.Наличие катализатора.
Катализаторы- это вещества, ускоряющие химическую реакцию.
Катализаторы- это вещества которые направляют реакцию по более энергетически выгодному пути. Есть отрицательные катализаторы- ингибиторы. Они замедляют реакцию.
Карточка 1.Факторы, влияющие на скорость химической реакции:
1. Природа реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте соляной кислоты.
В одну опустите несколько стружек магния, а в другую- гранулу цинка.
*Сравните скорость взаимодействия различных металлов с соляной кислотой
*В чём , по вашему мнению, причина различной скорости реакций кислоты с данными металлами.
Запишите уравнения реакций.
( По всей вероятности, разную скорость взаимодействия металлов с кислотой можно объяснить разной химической активностью данных металлов. Магний активней, чем цинк, это значит, что он активнее реагирует с кислотой.).
Hcl +Mg—
Hcl +Zn—-
Карточка 2. Факторы, влияющие на скорость химической реакции:
2.Концентрация реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте растворы сульфата меди (2) различной концентрации, определив большую или меньшую концентрацию по насыщенности цвета раствора. В каждую из пробирок поместите гранулу цинка.
*В какой из пробирок выделение меди на цинке началось быстрее
*Как это можно объяснить с точки зрения атомно — молекулярного учения.
Запишите уравнение реакции.
(По всей вероятности, это можно объяснить тем , что в растворе большей концентрации находится больше молекул, а значит больше количество активных столкновений молекул, что сказывается на скорости химической реакции)
CuSO4 (Р-р)+Zn—
CuSO4 (конц)+Zn—
Карточка 3. Факторы, влияющие на скорость химической реакции:
3.Площадь соприкосновения реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте раствор соляной кислоты. Одновременно в одну пробирку поместите кусочек, а в другую- порошок карбоната кальция.
*В какой из пробирок реакция пройдёт быстрее
* Как это можно объяснить с точки зрения атомно- молекулярного учения.
Запишите уравнение реакции.
(Общая площадь частичек порошка карбоната кальция- мела больше, чем площадь поверхности кусочка, а значит и скорость реакции больше).
Hcl +CaCO3(кусочек)——
Hcl +CaCO3(порошок)——
Карточка 4. Факторы, влияющие на скорость химической реакции:
4.Температура.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В обе пробирки налейте раствор серной кислоты и поместите в них по грануле оксида меди. Одну из пробирок осторожно нагрейте. Пробирку держим держалкой.
*В какой из пробирок реакция протекает более интенсивно.
** Как это можно объяснить с точки зрения атомно- молекулярного учения.
Запишите уравнение реакции.
(При повышении температуры молекулы начинают двигаться быстрее, а значит увеличивается число активных столкновений. Скорость реакции возрастает).
H2SO4 + CuO—-
H2SO4 + CuO(нагреть)—-
Карточка 5. Факторы, влияющие на скорость химической реакции:
5.Наличие специальных веществ- катализаторов, веществ, которые увеличивают скорость химической реакции.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте перекись водорода. В одну из пробирок осторожно присыпьте несколько кристалликов оксида марганца (4).Зажгите лучинку а потом погасите её. Поднесите тлеющую лучинку к отверстию пробирки. Лучинка должна загореться, т.к. выделяется кислород.
*В какой из пробирок наблюдается бурное выделение газа. Какой это газ.
*Какую роль в этой реакции выполняет оксид марганца (4)
Запишите уравнение реакции.
(Катализатор выполняет роль инициатора реакции. Без него реакция не идёт, а он приводит к тому, что реакция начинается. Сам катализатор в результате реакции остаётся без изменений).
H2O2——-
MnO2
H2O2——-
Памятка для обучающихся
Урок: «Скорость химической реакции»
Девиз урока: Знания, не проверенные опытом, бесплодны и полны ошибок.

— Факторы, влияющие на скорость реакции
Природа реагирующих веществ
2HCl+Mg—MgCl2+H2— реакция протекает быстрее т.к. магний активней, чем цинк.
2HCl+Zn—ZnCl2+H2
2 Температура
H2SO4+ CuO—CuSO4+ H2O(нагреваем) При нагревании реакция протекает быстрее, т.к. увеличивается скорость движения молекул, что приводит к увеличению числа активных столкновений. При возрастании температуры на 100С – скорость увеличивается в 2-4 раза.
H2SO4+ CuO—CuSO4+ H2O
3 Концентрация реагентов
CuSO4(конц.)+Zn—ZnSO4+ Cu- чем больше частиц реагентов, тем больше у них шансов столкнуться и прореагировать.Закон действующих масс: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
CuSO4(разбавл..)+Zn—ZnSO4+ Cu
Площадь соприкосновения реагирующих веществ
CaCO3(кусочек)+2HCl—-CaCO3+H2O+ CO2
CaCO3(порошок)+2HCl—-CaCO3+H2O+CO2-чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
Наличие специальных веществ- катализаторов.
2H2O2——2H2O+O2— без катализатора реакция не идёт, но стоит добавить MnO2? Так реакция происходит бурно. Это вешество является катализатором.
Катализаторы- это вещества . ускоряющие химическую реакцию.
Комментарии по факторам , влияющих на скорость реакции:
Основной теорией, объясняющей скорость химической реакции , является Теориястолкновений.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
1.Природа реагирующих веществ. Здесь следует помнить об особенности строения атомом элементов. По электрохимическому ряду напряжений металлов мы видим, что магний активней, чем цинк.
2.Концентрация реагирующих веществ.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.На основе большого экспериментального материала в 1867г. Норвежские учёные К.Гульдберг и П.Вааге и независимо от них в 1865 г. Русский учёный Н.И.Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс. 2А+3В=А2В3V=(А)2.(В)3
3.Поверхность соприкосновения реагирующих веществ. Этот фактор применим для гетерогенных реакций. Чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
4.Температура.
Чем больше температура, тем больше активных частиц, увеличивается скорость их движения, что приводит к увеличению числа соударений. Скорость реакции возрастает. Правило Вант-Гоффа математически выражается следующей формулой: При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:

где V1 –скорость реакции при температуре t2,
V2 – скорость реакции при температуре t1,
y – температурный коэффициент.
5.Наличие катализатора.
Катализаторы- это вещества, ускоряющие химическую реакцию.
Домашнее задание:Просмотр конспекта урока по предложенной вам памятке.
Задачи для самостоятельного решения:
1.Для реакции были взяты вещества при температуре 400С, а затем их нагрели до 700С. Как изменится скорость химической реакции , если температурный коэффициент её равен 2?
2.Как изменится скорость реакции, протекающей по уравнению 2NO+O2=2NO2, если концентрацию веществ увеличить в три раза3.
3.При t= 300С реакция протекает за 25 минут, а при t= 500С за 4 минуты. Рассчитайте температурный коэффициент реакции
Мой кластер
«Скорость химической реакции»








infourok.ru
Цели урока:
-эксперимент
Дать определение понятию « скорость химической реакции».
Экспериментально выяснить, какие факторы влияют на скорость химической реакции.
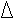
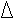
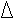
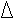
 если реакция гетерогенная? Реакция будет идти только на поверхности соприкосновения веществ. И в этом случае, скорость реакции можно найти по формуле: V= n/S t
если реакция гетерогенная? Реакция будет идти только на поверхности соприкосновения веществ. И в этом случае, скорость реакции можно найти по формуле: V= n/S tПрирода реагирующих веществ. ПРЕЗЕНТАЦИЯ,
Концентрация реагирующих веществ.
Поверхность соприкосновения реагирующих веществ
Температура.
Наличие катализатора.
Природа реагирующих веществ
Температура
Концентрация реагентов
Площадь соприкосновения реагирующих веществ
Наличие специальных веществ- катализаторов.
Домашнее задание:
Просмотр конспекта урока по предложенной вам памятке.
Задачи для самостоятельного решения:
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
Природа реагирующих веществ. Здесь следует помнить об особенности строения атомом элементов. По электрохимическому ряду напряжений металлов мы видим, что магний активней, чем цинк.
Концентрация реагирующих веществ.
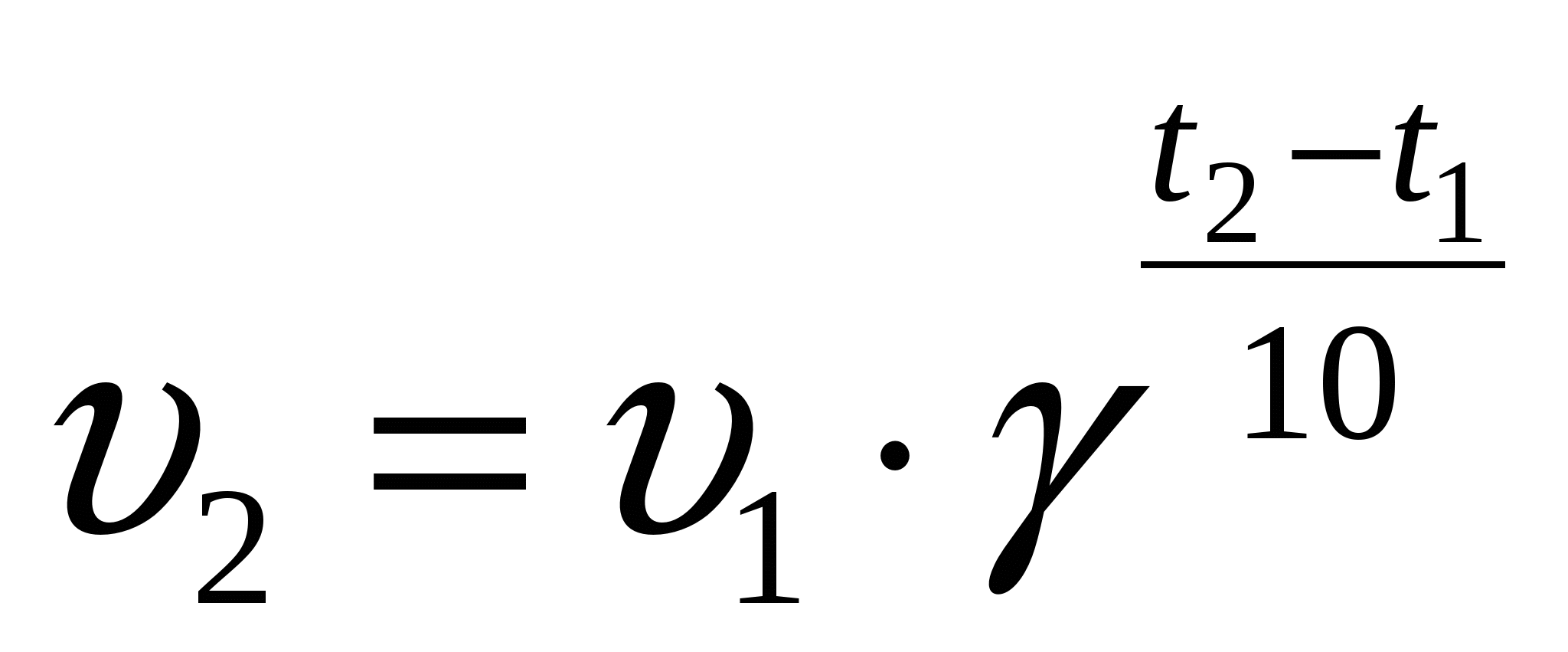
— Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Площадь соприкосновения реагирующих веществ
Наличие специальных веществ- катализаторов.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
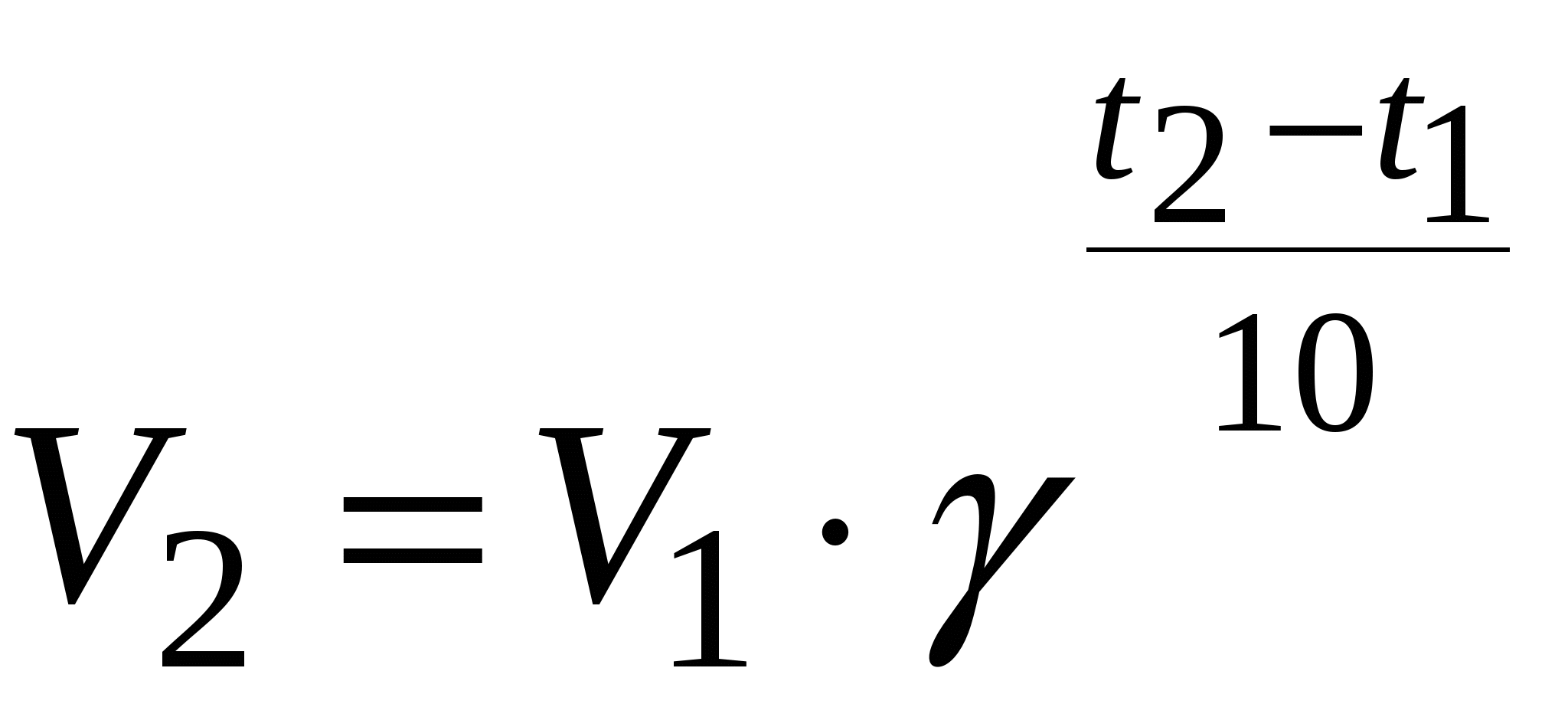
Задачи для самостоятельного решения:



Скорость химической реакции. Видеоурок. Химия 11 Класс
Тема: Классификация реакций, термохимия, скорость
Урок: Скорость химической реакции
Скорость химической реакции измеряется изменением количества вещества одного из реагентов или продуктов реакции в единицу времени в единицу объёма для гомогенных систем или на единицу поверхности для гетерогенных систем.
Для гомогенных систем, для которых реакция происходит во всем объёме системы, скорость химической реакции определяется следующим уравнением: 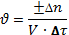
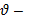 скорость химической реакции
скорость химической реакции
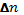 – изменение количества вещества
– изменение количества вещества
V – объём системы
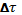 – интервал времени, в котором определяют скорость реакции
– интервал времени, в котором определяют скорость реакции
Отношение ± ∆n / V – это молярная концентрация вещества. И тогда ± ∆с . Для гомогенных систем скорость реакции выражается в 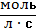
Для гетерогенных систем, в которых реакция протекает на границе раздела фаз, уравнение для определения скорости химической реакции будет такое:
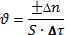
S – Площадь поверхности раздела фаз, на которой идет химическая реакция.
Скорость реакции – величина положительная, поэтому знак ± перед формулой дает возможность выбора. Ставится (+), если скорость реакции определяется по изменению количества продукта реакции.
Ставится (-), если скорость реакции определяется по изменению количества исходного вещества.
Для гетерогенных систем скорость реакции выражается в 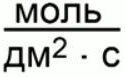
Раздел химии, в котором изучаются скорости химических реакций, называется химической кинетикой.
Химическая реакция происходит в результате столкновения частиц реагирующих веществ. Но не всякое столкновение частиц приводит к образованию продуктов реакции. Если при столкновении частицы не обладают достаточной энергией, то столкновение будет неэффективным. Такое столкновение называют упругим. Оно подобно столкновению бильярдных шаров. Если энергия частиц будет достаточно высока, то столкновение будет эффективным, и произойдёт химическая реакция. В некоторых случаях (реакция распада) не требуется взаимодействия частиц, но для их прохождения также нужна определённая энергия.
· Температура.
Правило Вант-Гоффа. При увеличении температуры на каждые 10 градусов, скорость химической реакции увеличивается в 2-4 раза. Это правило можно записать в виде уравнения таким образом:
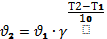 ,
,
где 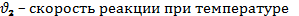 Т2
Т2
interneturok.ru
План-конспект урока по химии (9 класс) на тему: Открытый урок по химии в 9 классе «Скорость химической реакции»
Урок по теме «Скорость химической реакции» (9 класс).
Задачи урока:
1) сформировать у учащихся знания о скорости химической реакции, о факторах, влияющих на скорость химической реакции;
2) показать значения ее в природе и деятельности человека;
3) углубить знания о катализаторах.
Планируемые результаты обучения:
Предметные: учащиеся имеют представление о скорости химической реакции, о единицах ее измерения, знают влияние различных факторов на скорость химической реакции ( природа реагирующих веществ, их концентрация, площадь соприкосновения и температура ).
Метапредметные: формируются навыки групповой работы, развивается самостоятельность мышления, умение обобщать ,анализировать и выделять главное.
Личностные: развивать коммуникативные умения в ходе групповой работы, способность применять полученные знания на практике, учащиеся осознают смысл и ценность познания.
Основные понятия урока: скорость химической реакции, факторы, влияющие на скорость химической реакции.
Основные виды деятельности учащихся: самостоятельная работа с информацией, групповая работа, работа в парах, наблюдение химических превращений, описание химических реакций, участие в совместном обсуждении результатов опытов, обобщать и делать выводы.
Тип урока: урок изучения нового материала
Методы изучения: объяснительно-иллюстративный, частично-поисковый, исследовательский.
Оборудование:
Прибор для определения скорости химической реакции, 10% и 30% раствор HCl, Zn, CuO, h3SO4 р-р, Mg,Cu, CaCO3 мел, CaCO3 порошок, h3O2, MnO2,Nh4,(Nh5)2Сr2O7, колба 500мл, спиртовка.
Эпиграф к уроку
» Знания, не проверенные опытом — матерью всякой достоверности, бесплодны и полны ошибок»
Леонардо да Винчи.
I этап — Актуализация опорных знаний (эвристическая беседа с учащимися)
Мы живём в динамичном мире. Объекты живой и неживой природы движутся с различной скоростью. Изучая физику, вы узнали, что человек изобрёл сверхзвуковые самолёты. На уроках биологии узнали, что амёба тоже передвигается с определённой скоростью 0,2 мм в минуту, а самая быстрая дикая кошка-гепард развивает скорость 60км в час. На уроках химии мы говорим, что одни реакции идут быстро, другие медленно т.е реакции тоже идут с определённой скоростью. Сколько новой информации получаем, но что мы знаем о скорости химической реакции? Практически ничего. Поэтому я вам предлагаю ознакомиться с этим «понятием».
II этапы — Изучения нового материала.
Учитель: на уроках физики вы уже рассматривали скорость механического движения, перемещения тела в пространстве.
Как она обозначается? По какой формуле вычисляют скорость движущегося тела?
υ = S/t км/ч ( м/с). Это пройденный путь за определенный промежуток времени.
Учитель: какая физическая величина здесь изменяется? ( расстояние от точки А до точки В). Координаты тела. Семена брошенные в землю прорастают по разному. Одни растут быстро, другие медленно, но стебель проростка неизменно удлиняется, увеличиваются размеры листочков.
Значит скорость- это изменение какой-то физической величины за единицу времени. В химии есть такое понятие » как скорость химической реакции». А что такое скорость химической реакции, в чем она измеряется? Какая физическая величина может изменятся в химической реакции за определенный промежуток времени?
Возьмем конкретную реакцию:
2 SO2 + O2 = 2 SO3
Что показывают коэффициенты, стоящие перед формулами?
Ученики: Коэффициенты показывают число атомов и молекул т.е. количество вещества.
Учитель: Как вы думаете , количество вещества изменяется в ходе химической реакции?
Взяли 2 моль SO2, + 1 моль O2, а получили 2 моль SO3 — продукта реакции.
3 моль исходного вещества
Число моль исходных веществ и продукта реакции разные.
Как называется количество вещества в единице объема? ( Т.к. в реакции участвуют газообразные вещества, коэффициенты показывают объемные отношения газов).
Количество вещества в единице объема — это концентрация ( молярная концентрация), обозначается буквой «С», единица измерения моль/л ( на доске повесить плакат).
Изменение обозначается греческой буквой Δ (дельта). С1 — концентрация исходных веществ, С2 — концентрация продуктов реакции.
ΔС = С1 — С2
( концентрация исходных веществ больше, чем продуктов реакции).
Изменение молярной концентрации происходит за определенный промежуток времени.
Слайд 3
Учитель: Попробуйте дать определение скорости химической реакции и выведите формулу для скорости химической реакции, напишите аналогично той, что записана на доске υ = S/t
V = ΔС / Δt= С1 — С2 моль/(л.с)
t2 — t1
Пример с учебника с.39
V = (2 — 0,5) : 50 = 1,5 : 50 = 0,03 моль/(л.с)
Закрепление: Сохраняется ли скорость химической реакции неизменной в продолжении всего процесса или изменяется? Для реакции, протекающей в соответствии с уравнением
N2 + 3h3 → 2Nh4
экспериментально определена концентрация одного из веществ в разные промежутки времени
v1 v 2 v 3 v4
t( cек) 0 79 158 316 632
С ( моль/л) 1,85 1,67 1,52 1,30 1,00
Как изменится скорость этой реакции со временем?
( Учащиеся работают в группах)
V1 = (1,85-1,67) / (79 — 0) = 0,0023 моль/л.с. х 103 = 2,3
V2 = (1,67-1,52) / (158-79) = 0,0019 моль/л.с. х 103 = 1,9
V3 = (1,52-1,30) / (316-158) = 0,0014 моль/л.с. х 103 =1,4
V4 = (1,30-1,00) / (632-316) = 0,0009 моль/л.с. х 103 = 0,9
Вывод: Скорость химической реакции уменьшается с течением времени.
Аммиак используется для производства азотных удобрений. Замедление этого процесса невыгодно на практике, производство будет нерентабельным. Можно ли повлиять на скорость химической реакции? Если можно, то каким образом?
Мы должны выяснить, какие факторы влияют на скорость химической реакции?
Работа в группах.
Задание 1. В двух пробирках дан раствор соляной кислоты. В первой пробирке 10% раствор HCI, во второй пробирке 30% раствор HCI. В каждую пробирку добавили гранулу цинка. Что наблюдаем? Напишите уравнения химических реакций. Сделайте выводы.
Вывод: скорость химической реакции зависит от концентрации реагирующих веществ. ( Запись в тетрадь).
На основе огромного экспериментального материала выведен » закон действующих масс», который отражает зависимость скорости химической реакции от концентрации реагирующих веществ.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. А+В=Д
V = k* СА * СВ
V = k* [А]*[В]
k — константа скорости химической реакции, численно равна скорости химической реакции при концентрации реагирующих веществ в 1 моль/л.
Задача. Определите , как изменяется скорость химической реакции синтеза аммиака:
N2 + 3h3 →← 2Nh4
при увеличении концентрации исходных веществ в 2 раза:
V 1 = k [ N2 ][ h3]3 V2 = k [2 N2 ][ 2h3]3
[ N2 ] = х [ h3] = у V2 = k 2х(2у)3 = 2 х 23 = 16
V1 k ху3
Учитель: Концентрация оказывает влияние на скорость химической реакции, если в ней участвуют газы или жидкости. Почему концентрация не влияет на скорость химической реакции при участии твердых веществ?
Учитель: Концентрация твердых веществ не меняется в отличие от газов или жидкостей. Твердые вещества не сжимаются, между частицами твердого вещества нет промежутков.
Концентрация газов меняется в зависимости от давления. При повышении давления концентрация увеличивается, при понижении уменьшается.
Вывод 2. На скорость химической реакции влияет давление, если в этой реакции участвуют газы или жидкости.
Задача . Определить , как изменится скорость химической реакции
2 SO2 + О2 → 2SO3
при увеличении давления в два раза?
V1 = k [SO2]2[ О2] ; V2 = k [2 SO2 ]2[ 2О2]
[ SO2] = х ; [ О2] = у V2 = k (2х)2(2у) = 22 х 2 = 8 раз
V1 k х2у
Группа 2. Что еще может повлиять на скорость химической реакции? ( t температура). Рассмотрим влияние t ( температуры) на скорость химической реакции.
Задание. В пробирку с оксидом меди (II) налить 1-2 мл раствора серной кислоты. Что наблюдаете? Затем пробирку нагрейте. Какие изменения происходят в пробирке?
Вывод: Скорость химической реакции зависит от t. Правило Вант-Гоффа.
С увеличением t на каждые 10 С 0 ( градусов) скорость реакции возрастает в 2-4 раза.
V2= V1 * ɣ( t2- t1)/10
ɣ- температурный коэффициент .
Задача. Во сколько раз увеличится скорость химической реакции при повышении t от 10 до 60 градусов, если ɣ = 2 ( работа у доски)!
Почему скорость химической реакции за висит от температуры? Что мы делаем с веществом, повышая его температуру? Нагреваем, сообщаем энергию, энергия расходуется на разрушение химических связей в исходных веществах. Движение молекул и атомов усиливается , это приводит к увеличению » полезных столкновений», в результате образуется больше продуктов реакции.
Группа 3. Влияние природы реагирующих веществ на скорость химической реакции.
Задание. В трех пробирках находится раствор соляной кислоты. В первую пробирку насыпаем Mg ( магний), во вторую кладем гранулу цинка, в третью гранулу Cu ( меди). Что наблюдаем? Запишем уравнения химических реакций.
Mg + 2HCI = MgCI2 + Н2 ↑
Zn + 2HCI = ZnCl2 + Н2 ↑
Cu+ HCl →
Вывод: Скорость химической реакции зависит от природы реагирующих веществ.
Что мы понимаем под химической природой реагирующих веществ?
Под химической природой понимаем состав веществ, тип и прочность химической связи.
Группа 4. Что ещё может повлиять на скорость химической реакции?
Задание: В две пробирки поместили одинаковое количество мела СаСО3 в виде кусочка и порошка и в эти пробирки налили по 1 мл соляной кислоты. Что наблюдаете? Напишите уравнение химической реакции.
Вывод. На скорость химической реакции влияет площадь соприкосновения реагирующих веществ.
Физкультминутка!!!
Арабская притча о восемнадцати верблюдах. Жил когда-то на востоке человек, который разводил верблюдов. Всю жизнь он работал, а когда состарился, то позвал к себе сыновей и сказал:
«Дети мои! Я стар и немощен и скоро умру. После моей смерти разделите верблюдов так, как я вам скажу. Ты, старший сын, работал больше всех- возьми себе половину верблюдов. Ты, средний сын, только начал мне помогать — возьми себе третью часть. А ты, младший, возьми себе девятую часть.»
Прошло время и старик умер. Тогда сыновья решили разделить наследство так, как завещал им отец. Они выгнали стадо на большое поле, пересчитали, и оказалось, что в стаде всего семнадцать верблюдов. И нельзя было разделить их ни на 2, ни на 3, ни на 9! Что было делать — никто не знал. Стали сыновья спорить и каждый предлагал своё решение. Они уже устали спорить, но так и не пришли к общему решению. В это время мимо ехал путник на своём верблюде. Услышав крик и спор, он спросил: «Что случилось?»
И сыновья рассказали о своей беде. Путник слез с верблюда, пустил его в стадо и сказал: «А теперь разделите верблюдов, как велел отец». И так верблюдов стало восемнадцать, старший сын взял себе половину, то есть 9, средний — треть, то есть 6 верблюдов, а младший девятую часть, то есть 2 верблюдов. И когда они разделили, таким образом, стадо, в поле остался ещё один верблюд, потому что 9+6+2= 17. А путник сел на своего верблюда и поехал дальше.
Какова роль восемнадцатого верблюда? И какая связь этой притчи с темой нашего урока? В подтверждении того, что катализатор влияет на скорость химической реакции послушаем выступление пятой группы.
Группа 5.
Задание: Две пробирки взяли с 3% раствором перекиси водорода Н2О2. . Первую пробирку нагрели в пламени спиртовки. В пробирку без нагревания добавляем диоксид марганца МnО2 . Что наблюдаем? Что в данном примере влияет на скорость химической реакции?
МnО2
2Н2О2 → О2 +2 Н2О
Демонстрационный опыт учителя (звёздный дождь)
В химическую колбу ёмкостью 500мл помещаем раствор аммиака и закрываем пробкой. На спиртовке нагреваем дихромат аммония, затем помещаем в колбу с аммиаком. Наблюдаем реакцию «звёздный дождь».
4Nh4+5O2=4NO+6h3O (Cr2O3)
Итак подводим итог нашего урока (учащиеся вспоминают определение скорости химической реакции, единицу измерения и указывают факторы, влияющие на скорость химической реакции).
III этап — закрепление.
Задача1. Определите, как изменится скорость химической реакции 2SO2+ O2→2SO3 при увеличении давления в 3 раза.
Задача 2. Чему равен температурный коэффициент (ɣ) реакции, если при повышении температыры на 50 градусов скорость увеличивается в 32 раза?.
IV этап- рефлексия
Предлагаю оценить свою работу на уроке
- С каким настроением работал, доволен ли собой?
- На мой взгляд (что понравилось?)…
- Для меня было сложно…
- Самым интересным для меня во время работы на уроке было…
V этап — Домашнее задание.
§14
подготовить небольшое сообщение о факторах, влияющих на скорость химических реакций в быту, в повседневной жизни.
Приложение 1
Исследовательская карточка
№группы | Химический эксперимент | Что наблюдаем? Уравнения хим. реакций | Выводы |
I | Задание 1. В двух пробирках дан раствор соляной кислоты. В первой пробирке 10% раствор HCI, во второй пробирке 30% раствор HCI. В каждую пробирку добавили гранулу цинка. Что наблюдаем? Напишите уравнения химических реакций. Сделайте выводы. | ||
II | Задание. В пробирку с оксидом меди (II) налить 1-2 мл раствора серной кислоты. Что наблюдаете? Затем пробирку нагрейте. Какие изменения происходят в пробирке? | ||
III | Задание. В трех пробирках находится раствор соляной кислоты. В первую пробирку насыпаем Mg ( магний), во вторую кладем гранулу цинка, в третью гранулу Cu ( меди). Что наблюдаем? Запишем уравнения химических реакций. | ||
IV | Задание: В две пробирки поместили одинаковое количество мела СаСО3 в виде кусочка и порошка и в эти пробирки налили по 1 мл соляной кислоты. Что наблюдаете? Напишите уравнение химической реакции. | ||
V | Задание: Две пробирки взяли с 3% раствором перекиси водорода Н2О2. . Первую пробирку нагрели в пламени спиртовки. В пробирку без нагревания добавляем диоксид марганца МnО2 . Что наблюдаем? Что в данном примере влияет на скорость химической реакции? |
Закрепление: Сохраняется ли скорость химической реакции неизменной в продолжении всего процесса или изменяется? Для реакции, протекающей в соответствии с уравнением
N2 + 3h3 → 2Nh4
экспериментально определена концентрация одного из веществ в разные промежутки времени
υ1 υ 2 υ 3 υ4
t( cек) 0 79 158 316 632
С ( моль/л) 1,85 1,67 1,52 1,30 1,00
Как изменится скорость этой реакции со временем?
Закрепление: Сохраняется ли скорость химической реакции неизменной в продолжении всего процесса или изменяется? Для реакции, протекающей в соответствии с уравнением
N2 + 3h3 → 2Nh4
экспериментально определена концентрация одного из веществ в разные промежутки времени
υ1 υ 2 υ 3 υ4
t( cек) 0 79 158 316 632
С ( моль/л) 1,85 1,67 1,52 1,30 1,00
Как изменится скорость этой реакции со временем?
nsportal.ru
План-конспект урока «Скорость химических реакций» (11 класс)
Урок № 11 Химия, 11 класс
Тема урока: «Скорость химической реакции и факторы, влияющие на скорость химической реакции»
Цели:
дать понятие о скорости химической реакции;
показать влияние на скорость химической реакции таких факторов, как природа реагирующих веществ, их концентрация, площадь поверхности соприкосновения веществ, температура и участие катализаторов;
рассмотреть классификацию химических реакций по таким признакам, как «фазовое состояние» и «участие катализатора»;
развивать умение анализировать, сравнивать, делать выводы, применять приобретённые знания и умения в практической деятельности и повседневной жизни.
Тип урока: урок изучения нового материала с элементами исследования.
Основные понятия: молярная концентрация, скорость химической реакции, гомогенные и гетерогенные реакции, катализ, катализаторы, ферменты.
Оборудование и реактивы: растворы HCl, h3SO4, Ch4COOH, h3O2, Zn, Mg, Fe, CuO, MnO2, пробирки, спиртовки, инструкции по выполнению лабораторных работ.
Ход урока.
Организационный момент
Актуализация опорных знаний
Для чего нужны знания о скорости химической реакции?
Приведите примеры химических реакций, идущих с разной скоростью.
Предположите, чем можно измерить скорость химической реакции?
Ответ на 3 вопрос, как правило, вызывает затруднения. Целесообразно обратить внимание учащихся на количественные характеристики веществ (концентрацию), участвующих в химической реакции, и признаки, по которым судят о скорости химической реакции.
3. Тема и цели урока
4. Изучение новой темы
А) Вводное слово учителя
Учитель формулирует определение понятия «молярная концентрация». Молярная концентрация С — это отношение количества вещества к объёму:
C = n ? V
Единицей измерения является моль / л.
Скорость химической реакции υ — это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени:
υ = ± С1 — С2 / t2 — t1 = ± (знак дельта)C / (знак дельта)t,
где С1 и С2 — молярная концентрация реагирующих веществ или продуктов реакции соответственно в момент времени t2 и t1.
Единица изменения скорости химической реакции моль / л • с.
Если С2 больше С1 , то перед дробью ставят знак «минус».
Данное определение и формула справедливы лишь для гомогенных реакций. Учитель предлагает классификацию реакций по фазовому состоянию:
Химические реакции:
гомогенные: протекающие в однородной среде (нет поверхности раздела между реагирующими веществами)
гетерогенные: протекающие в неоднородной среде (есть поверхность раздела между веществами)
Учащимся предлагается классифицировать химические реакции по данному признаку.
N2(Г) +3h3(Г)→2Nh4(Г)
S(Т) +O2(Г)→SO2(Г)
CaCO3(Т) +2HCl(Р-Р)→CaCl2(Р-Р) +CO2(Г) +h3O(Ж)
N2(Г) +O2(Г)→2NO(Г)
Учитель задаёт вопрос: «Что может повлиять на изменение скорости химической реакции?» Учащиеся высказывают предположения. Для подтверждения своих гипотез учащимся предлагается выполнить ряд экспериментальных заданий. Задания выполняются в группах. Каждая группа получает свою инструкцию. Результаты работы оформляются в виде таблицы.
Исходные вещества
Признаки химической реакции
Уравнения химических реакций
Выводы о скорости протекания химической реакции
Перед выполнением работы учитель проводит инструктаж по ТБ
Инструкция группе 1.
Исследование влияния природы реагирующих веществ на скорость химической реакции.
Цель: сравнить скорость протекания химической реакции взаимодействия раствора соляной кислоты с различными металлами.
Оборудование и реактивы: раствор соляной кислоты, Mg, Zn, Fe, пробирки.
Возьмите три пробирки и налейте в них по одному мл соляной кислоты, поместите в них примерно одинаковые кусочки Mg, Zn, Fe. Наблюдения и выводы запишите в таблицу.
Инструкция группе 2.
Влияние концентрации реагирующих веществ на скорость химической реакции.
Цель: изучить зависимость скорости взаимодействия растворов соляной кислоты разной концентрации с Zn.
Оборудование и реактивы: раствор HCl, Zn, h3O.
В три пробирки налейте раствор HCl: в первую — 3мл, во вторую — 2мл, в третью — 1мл. Во вторую и третью пробирки долейте воды до 3 мл. В каждую пробирку поместите одинаковые гранулы Zn. Наблюдения и выводы занесите в таблицу.
Инструкция группе 3.
Влияние температуры на скорость химической реакции.
Цель: сравнить скорость химической реакции взаимодействия CuO и h3SO4 при разной температуре.
Оборудование и реактивы: CuO, h3SO4, спиртовка, стакан с горячей водой, пробирки.
В три пробирки насыпьте немного порошка CuO, добавьте 3-5мл раствора h3SO4 . Первую пробирку поставьте в штатив, вторую — в стакан с горячей водой (пробирку предварительно подогрейте), третью нагрейте в пламени спиртовки. По изменению окраски раствора сделайте вывод о скорости протекания химической реакции.
Инструкция группе 4.
Влияние поверхности соприкосновения реагирующих веществ на скорость химической реакции.
Цель: сравнить скорость взаимодействия раствора соляной кислоты с гранулами, опилками и порошком Zn.
Оборудование и реактивы: раствор HCl, Zn, пробирки.
В три пробирки поместите гранулы, опилки и порошок Zn примерно одинакового объёма, добавьте раствор HCl. Наблюдения и выводы занесите в таблицу.
Инструкция группе 5.
Влияние катализатора на скорость химической реакции.
Цель: рассмотреть влияние катализаторов MnO2 на скорость разложения перекиси водорода.
Оборудование и реактивы: раствор h3O2, MnO2, пробирки, спиртовка, лучинка.
Вспомните, какие вещества называют катализаторами?
В пробирку налейте раствор h3O2. Что наблюдаете? Добавьте в пробирку немного порошка MnO2. Внесите в пробирку тлеющую личинку. Какой газ выделяется? Сравните скорость разложения h3O2 при разных условиях.
После окончания эксперимента происходит обсуждение. Учащиеся демонстрируют результаты опытов, делают выводы о влиянии различных факторов на скорость химических реакций. Уравнения проделанных реакций записывают на доске.
Выводы по результатам эксперимента.
Каждое вещество оказывает влияние на скорость химической реакции.
Чем больше концентрация реагирующих веществ, тем выше скорость химической реакции.
При повышении температуры скорость химической реакции увеличивается. Правило Вант-Гоффа: при изменении (повышении или понижении) температуры на каждые 10 градусов скорость химической реакции изменяется (соответственно повышается или понижается) в 2-4 раза.
υ2 = υ1 • γ (t2-t1) / 10
υ2 υ1 — скорости химической реакции при температуре соответственно t2 и t1, γ — температурный коэффициент, показывающий во сколько раз изменяется скорость химической реакции.
4.Чем больше площадь поверхности соприкосновения реагирующих веществ, тем выше скорость химической реакции.
5.Катализаторы — вещества, изменяющие скорость химической реакции, но остающиеся неизменными к её окончанию.
Ферменты — биологические катализаторы белковой природы.
По участию катализатора химические реакции делят на:
каталитические:
2SO2+O2 →2SO3
4Nh4+5O2 →4NO+6h3O
некаталитические:
CuO+h3SO4 →CuSO4+h3O
2Fe(OH)3 →Fe2O3+3h3O
Вывод: знания о скорости химической реакции и факторах, влияющих на её изменение, позволяют управлять в значительной степени химическими реакциями.
Домашнее задание:
§ 13, 14, выучить термины; тестовые задания;
задача № 3 стр.64
infourok.ru
Методическая разработка урока по химии в 11 классе «Скорость химической реакции»
Урок химии в 11 классе.
Тема: Скорость химической реакции. Факторы, влияющие на скорость.
Тип урока: изучение и первичное закрепление новых знаний.
Цель: обобщить и расширить сведения учащихся о скорости химической реакции, о факторах, влияющих на скорость химической реакции в процессе эксперимента и объяснить кинетические закономерности, которым подчиняется реакция.
Задачи:
Образовательные: 1. Продолжить формировать понятия о скорости, зависимость от
различных факторов
2. Проконтролировать умение проводить расчеты, используя необходимые
законы.
3. Продолжить формирование умений работать с лабораторным
оборудованием.
4. Продолжать формирование умения наблюдать
5. Продолжать формирование навыков работы с учебником, навыков
Самостоятельного добывания знаний.
6. Осуществлять межпредметные связи
Воспитательные: 1. Воспитание ответственности
2. Воспитание умения работать в коллективе
3. Продолжать формирование соблюдения правил техники безопасности
при проведении лабораторных опытов.
4. Воспитание аккуратности, соблюдая порядок на рабочем месте
при проведении лабораторных опытов
5. Воспитание самостоятельности
Развивающие: 1. Развивать наблюдательность
2. Развивать умение сравнивать, формулировать выводы, основываясь на
наблюдаемых явлениях.
3. Развивать речь учащихся в ходе решения образовательных и
воспитательных задач.
4. Развивать память и внимание учащихся.
Оборудование:
Компьютер, проектор, инструкции для учащихся, лабораторное оборудование.
Ход урока:
Этапы урока | Деятельность учителя | Деятельность учащихся |
Организационный (1 мин) — организация начала урока — мотивация учебной деятельности Цели для учащихся: Включиться в деловой ритм урока Определить практическое значение темы Цели для учителя: Создать благоприятную психологическую атмосферу урока, включить учащихся в деловой ритм урока Посредством ответов учащихся сформулировать цели и задачи урока Методы организации работы: Беседа с использованием проблемных вопросов Форма организации работы: Фронтальная, коллективная (эвристическая) беседа Опрос учащихся по ранее изученному материалу (актуализация опорных знаний) Цели для учащихся: -вспомнить основные понятия и термины по теме «Химические реакции» Цели и задачи для учителя: Воспроизвести необходимые для овладения новым материалом знания учащихся о химических реакциях Оценить уровень подготовленности учащихся, скорректировать их знания, проверить готовность к восприятию новой информации. Методы организации работы: фронтальный опрос Форма организации работы: фронтальная Объяснение нового учебного материала Цели для учащихся: Сформулировать понятие скорости химической реакции Доказать зависимость скорости от различных факторов Продолжить формирование навыков в решении задач Цели для учителя: Дать определение скорости Определить разницу между гомогенными и гетерогенными системами Дать понятие энергии активации Помочь учащимся в закреплении практических навыков при проведении лабораторных опытов и в решении задач Методы организации работы: Использование проблемных вопросов Рассказ учителя Практическая работа Самостоятельная работа учащихся Формы организации работы: индивидуальная групповая фронтальная 4.Закрепление материала Цели для учащихся: Закрепить знания по теме Продолжить формирование навыков в решении задач Цели для учителя: Осуществить первичную проверку усвоения и понимания нового материала Проконтролировать навыки учащихся в решении и оформлении задач Установить соответствие между поставленными задачами на урок и его результатами Подвести итоги урока Методы организации работы: Фронтальная беседа Решение задач 5.Задание на дом Цели для учащихся: Получить задание для домашней самостоятельной работы Цели для учителя: Объяснить особеннос- ти выполнения домашнего задания Мотивировать выполнение учащимися домашнего задания хорошими оценками | Организационный момент -1 мин. Активизация знаний, целеполагание – 2 мин. Тема нашего урока: «Скорость химической реакции. Факторы, влияющие на скорость.»(слайд) Мы изучаем закономерности химических реакций, которые нас сопровождают всю жизнь -А зачем нужны знания о скорости химической реакции? — Приведите примеры, с помощью которых можно подтвердить, что химические реакции протекают с различной скоростью? — Вспомните понятие скорости из 9 класса -Сегодня на уроке мы должны: (слайд): Цели: Сформулировать понятие скорости химической реакции. Вывести формулы для вычисления скорости Рассмотреть и объяснить влияние различных факторов на скорость химической реакции Закрепить навыки в решении задач по вычислению скорости химической реакции А начать мне хочется со слов: «Кто мало знает, для того и этого много, кто много знает, тому и этого мало…»(слайд) Терминологический бой (10 мин) «На один химический вопрос может быть несколько правильных ответов, но мы выбираем один»(слайд) Примерные вопросы для устного опроса в приложении №1. «Могущество разума беспредельно» И. Ефремов (слайд) 1.Начнем с определения: Скорость химической реакции – изменение концентрации реагентов в течении времени V= В гомогенных системах: ∆С В гетерогенных системах: V= Решаем задачу: Химическая реакция протекает в растворе, согласно уравнению: А+В=С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 мин концентрация вещества А снизилась до 0,74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени б) концентрацию вещества В через 20 мин -Из курса химии 9 класса вам известны факторы, влияющие на скорость. Назовите их 2. Влияние всех перечисленных факторов можно объяснить, используя простую теорию – теорию столкновений. Основная её идея: реакции происходят при столкновении частиц реагентов, которые обладают определенной энергией. Чем больше частиц, тем больше шансов столкнуться и прореагировать.К химической реакции приводят лишь эффективные соударения. Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации ЕА(СЛАЙД) Если ЕА<40 кдж/моль-скорость реакции очень большая(р-ции ионного обмена) Если ЕА=40-120 кдж/моль- скорость средняя(гидролиз сахарозы, взаимодействие металлов с кислотами) Если ЕА>120 –скорость незначительная(разложение аммиака) (слайд) Многие реальные реакции самопроизвольно не протекают, т.к. реагенты имеют высокую энергию активации. А сечас на основании этой теории рассмотрим влияние различных факторов на скорость химической реакции. Практическая работа в группах по инструкциям.(10 мин) «Практика есть основа познания и критерий истины» (слайд) Инструкции для учащихся в Приложении №2 Отчет групп о проделанной работе (20 мин) Чтобы закрепить теоретические аспекты темы порешаем задачи(15 – 20 мин) Предлагаемые задачи в Приложении №3 -Итак, что вы сегодня усвоили? Что такое скорость химической реакции? Какие факторы влияют на скорость? Чем можно объяснить влияние факторов? Основная теория При наличии времени можно провести короткий тест. Приложение №4 Подведение итогов урока. Выставление оценок. Наш урок подошел к концу. Вы сегодня хорошо потрудились. Спасибо за внимание! | Запись в тетради -Знания помогают химикам определить эффективность химических процессов -Коррозия металлов, гниение, скисание идут медленно Горение спирта, взрыв газа – быстро — Изменение концентрации реагентов в течении времени Устный опрос. Запись в тетради Запись в тетради. Дано: С(А)1=0,80 моль/л С(В)1=1,00 моль/л С(А)2=0,74 моль/л ∆t=20 мин Найти: V ср.=? С(В)2=? Решение: V= По уравнению и по условию количества прореагировавших веществ А и В, равные∆С Следовательно, С(В)2=С(В)1-∆С=1,00-0,06=0,94 моль/л Ответ: V=0,003/моль л мин, С(В)2=0,94 моль/л — Природа реагирующих веществ -Концентрация реагирующих веществ -Температура — Площадь соприкосновения веществ -Катализатор Запись в тетради Практическая работа в группах. Оформление отчетов. Работа с учебником. Подготовка выступления от каждой группы. Каждая группа исследует влияние одного фактора на скорость. Работа у доски Запись в тетрадях Самостоятельная работа Ответы на поставленные вопросы Запись в дневниках: п.13, стр 132-139, упр. 1-5, стр.140 (вып. 3 любые задачи) |
Приложение №1
Вопросы для терминологического боя:
Что такое химическая реакция? ( превращения веществ с разрушением старых химических связей реагентов и образованием новых химических связей продуктов реакции)
Какие типы классификаций химических реакций вы знаете? ( по химиическому составу реагентов и продуктов, по изменению степени окисления, по обратимости, по использованию катализаторов, по тепловому эффекту, по фазе)
Какого типа реакций нет в органической химии? ( обмена)
В органической химии реакции изомеризации, а в неорганической….. (аллотропизации)
Какие признаки химических реакций вы знаете? ( образование осадка, выделение газа, выделение запаха, тепла и света, изменение цвета)
В каких случаях можно судить о том, что реакция прошла до конца? (если образовался осадок, выделился газ, образовалась вода)
Гомогенные и гетерогенные реакции? (Если реагенты и продукты находятся в одинаковой фазе, то гомогенные, в разных –гетерогенные)
Что такое тепловой эффект реакции? (количество тепла, которое выделилось или поглотилось в результате реакции)
Экзотермические и эндотермические реакции? (С выделением тепла –экзотермичекие, с поглощением –эндотермические)
Энтальпия — ? (Полное энергосбережение вещества)
Энтропия? (Мера беспорядка)
Стандартные теплоты сгорания и образования? (Теплота, выделяющаяся или поглощающаяся при образовании или сгорании 1 моль вещества при стандартных условиях)
Закон Гесса? (тепловой эффект химической реакции не зависит от пути процесса, а только от вида и агрегатного состояния исходных веществ и конечных продуктов реакции.)
Следствие из закона Гесса (Тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ)
Что такое энергия Гиббса? (Разница между энтальпийным и энтропийным факторами)
К какому состоянию стремится любая реакционная система? (К состоянию с минимальной энергией, к увеличению беспорядка взаимодействующих частиц)
Когда реакция возможна при любых температурах? ( При отрицательных значениях энтальпии и энергии Гиббса и положительной энтропии)
В каком случае тепловой эффект положителен? (если энергия образования новых химических связей больше, чем энергия разрыва старых связей)
Когда химическая реакция невозможна? ( при положительном значении энергии Гиббса)
Как можно определить тепловой эффект и изменение энтальпии в реакции горения свечи? (экспериментально и по стандартным теплотам сгорания)
Приложение №2
Инструкции для учащихся.
Инструкция №1
Тема: Влияние температуры на скорость химической реакции.
Цель: Установить зависимость скорости химической реакции от температуры
Оборудование: 2 пробирки, зажим для пробирок, спиртовка, спички, раствор серной кислоты.
Задание: 1. Изучить по учебнику (стр. 133) влияние температуры на скорость химической реакции
2. Провести опыт: В две пробирки насыпать порошка оксида меди, прилить одинаковый объем серной кислоты, одну пробирку закрепить в держателе и осторожно нагреть.
3. В какой пробирке скорость реакции больше?
4. Кто из ученых сформулировал зависимость скорости от температуры?
5. Почему при повышении температуры скорость реакции возрастает?
6. Всегда ли применимо для реакции повышение температуры?
7.В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
8. Подготовить выступление
Инструкция № 2
Тема: Скорость химической реакции и площадь соприкосновения реагирующих веществ.
Цель: Установить зависимость между скоростью химической реакции и поверхностью соприкосновения реагирующих веществ
Оборудование: 2 пробирки, железный гвоздь, железные опилки, раствор серной кислоты
Задание: 1. Изучить по учебнику зависимость скорости химической реакции от поверхности соприкосновения веществ (стр. 139)
2. Провести опыт: В одну пробирку поместить железный гвоздь, в другую – железные опилки. В обе пробирки прилить одинаковый объем серной кислоты.
3. В каком случае скорость реакции больше и почему?
4. Как в промышленности увеличивают площадь соприкосновения реагирующих веществ?
5. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Инструкция № 3
Тема: Скорость химической реакции и природа реагирующих веществ
Цель: Изучить зависимость скорости химической реакции от природы реагирующих веществ
Оборудование: 3 пробирки , гранулы цинка, алюминия, меди, раствор соляной кислоты
Задание: 1. Изучить по учебнику (стр.132) влияние природы реагирующих веществ на скорость реакции
2. Проделать опыт: В три пробирки поместить отдельно гранулы цинка, алюминия, меди. Прилить одинаковый объем соляной кислоты.
3. Объясните результаты опыта, используя ряд активности металлов
4. Как величина энергии активации связана с природой реагирующих веществ?
5. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Инструкция №4
Тема: Влияние концентрации реагента на скорость химической реакции.
Цель: Установить зависимость между скоростью химической реакции и концентрацией реагента
Оборудование: 2 пробирки, гранулы цинка, два раствора соляной кислоты с разной концентрацией
Задание: 1. Изучить по учебнику (стр.133-135) влияние концентрации реагентов на скорость химической реакции
2. Провести опыт: В две пробирки положить по две гранулы цинка. В одну прилить раствор соляной кислоты (1:1) ( на одну часть кислоты одна часть воды). В другую прилить раствор соляной кислоты (1:10) ( на одну часть кислоты 10 частей воды)
3. В какой пробирке скорость реакции больше и почему?
4. Назовите и сформулируйте закон, определяющий зависимость скорости химической реакции от концентрации
5. В чем причина прямой пропорциональной зависимости скорости от концентрации реагирующих веществ?
6. Концентрацию веществ в каком агрегатном состоянии учитывает закон действующих масс?
7. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
8. Подготовить выступление
Инструкция № 5 (для 1 группы)
Тема: Скорость химической реакции и катализатор
Цель: установить зависимость между скоростью химической реакции и влиянием катализатора.
Оборудование: 2 пробирки, алюминий, сульфат меди, поваренная соль
Задание: 1. Изучить материал учебника (стр.135-136)
2. Проведите опыт: В две пробирки налейте одинаковый объём сульфата меди. Затем в каждую пробирку поместите гранулы алюминия. Что наблюдаете? Затем в одну пробирку поместите несколько крупинок хлорида натрия. Что наблюдаете?
3. Какую роль играет хлорид натрия в реакции замещения между сульфатом меди и алюминием?
4. Что такое катализаторы?
5. Что такое катализ?
6. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
7. Подготовить выступление
Инструкция №5 (для 2 группы)
Тема: Скорость химической реакции и катализатор
Цель: установить зависимость между скоростью химической реакции и влиянием катализатора.
Оборудование: 4 пробирки, сырой картофель, сырая морковь, сырое мясо, вареное мясо, перекись водорода.
Задание: 1. Изучить по учебнику теоретический материал (стр.138)
2. Провести опыт: В четыре пробирки поместить отдельно сырой картофель, сырую морковь, сырое мясо, вареное мясо. Прилить перекись водорода. Что наблюдаете?
3. Объясните результаты, какой фермент содержат эти вещества?
4. Почему в четвертой пробирке не наблюдалось действие катализатора?
5 . В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Приложение № 3
Решение задач.
Вычислите скорость химической реакции, протекающей по уравнению 2А(г)+В(г)=2АВ, если исходная концентрация вещества А -0,05 моль/л, В-0,03 моль/л, а константа скорости реакции 1 л/моль сек.
Дано: Решение:
С(А)=0,05 моль/л Выразим скорость реакции 2А+В=2АВ
С(В)=0,03 моль/л V=КС(А)2С(В)
К=1 л/моль сек V= 1×0,052×0,03=7,5×10-5 моль/лсек
Найти: V=?
Ответ: V=7,5 ×10-5 моль/л ×сек
Как изменится скорость реакции А(г)+2В(г)=С(г) при повышении концентрации А в 2 раза, давления в 2 раза?
Решение:
Согласно закону действующих масс: V=КС(А)С(В)2
А) если повысить концентрацию А в 2 раза, то скорость будет равна V3=К С(2А)×2С(В)2=8 К С(А) С(В)2
Скорость увеличится в 8 раз.
Скорость некоторой реакции при0 0 равна 1 моль/л ч, температурный коэффициент реакции -3. Какой будет скорость данной реакции при 300С ?
Дано: Решение:
V1=1 моль/л ч По правилу Вант-Гоффа
T1=00 V2=V1Ý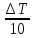
T2=300
Найти V2 =? V2=1×33=27 моль/л ч
Ответ: При 30 градусах скорость данной реакции станет 27 моль/л ч
Реакция протекает по уравнению А(г)+2В(г)=2С Исходная концентрация вещества А- 1 моль/л, через 1 час она стала 0,5 моль/л. Определите концентрации веществ В и С через час, если их исходные соответственно равны 1 моль/л и 0 моль/л Какова скорость данной реакции по веществу А?
Дано: Решение:
С1(А)=1 моль/л V=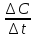 V= (1-0,5)/1= 0,5 моль/л час
V= (1-0,5)/1= 0,5 моль/л час
С2(А)=0,5 моль/л По уравнению А+2В=2С видно, что на 1 моль А затрачивается
t=1 час 2 моль В и образуется 2 моль С, тогда через час израсхо-
С1(В)=1 моль/л дуется 1 моль В, его концентрация станет 0 моль/л,
С1(С)=0 моль/л образуется 1 моль С, его концентрация станет 1 моль/л
Найти: С2(В)=? Ответ: V=0,5 моль/л ч, С2(В)=0 моль/л ,С2(С)=1 моль/л
С2(С)=?
V-?
презентация скорость химических реакций 11 класс
PPTX / 336.43 Кб
xn--j1ahfl.xn--p1ai
Конспект урока «Скорость химической реакции. Факторы, влияющие на скорость»
 Муниципальное бюджетное общеобразовательное учреждение
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа» пгт. Войвож
Скорость химической реакции. Факторы, влияющие на скорость.Учитель химии:
Полушина Татьяна Анатольевна.
Пгт. Войвож
Урок: «Скорость химической реакции»
Тип урока: изучение нового материала.
Цели урока:
образовательные:
-сформировать у учащихся основные представления о скорости реакции и факторов, влияющих на скорость;
-продолжить формирование у учащихся навыков самостоятельной исследовательской работы, умения делать выводы, обобщать результаты эксперимента;
-стимулировать познавательную активность учащихся путём создания проблемной ситуации;
-развивать умение анализировать, делать предположения, выводы.
развивающие:
-развивать умение анализировать, делать предположения, выводы.
-развивать основные компетенции учащихся:
— умение принимать правильное решение;
-брать ответственность на себя;
воспитывающие:
— умение работать в группе;
— считаться с мнением других членов группы;
-радоваться успехам других, сопереживать неудачи.
Задачи:
-сформулировать понятие скорости химической реакции;
-рассмотреть влияние различных факторов на скорость реакции;
-развивать экспериментальные умения и научное мышление учащихся в процессе установления причинно- следственных связей, сравнения и наблюдения объектов и процессов, применения знаний и умений в новых ситуациях.
Методы обучения:
— объяснительно- иллюстративный
— проблемно- поисковый
— репродуктивный
-демонстрационные и лабораторные опыты (экспериментальный)
— использование ИКТ
Приёмы обучения:
— постановка проблемных вопросов
-групповая работа
-эксперимент
Оборудование и реактивы: Демонстрация: CuSO4 , Fe , прибор, для изучения состава воздуха. На столах для работы по группам набор реактивов.
Учебно- наглядные пособия: презентация «Скорость химической реакции».
Примечание: Для подготовки урока использовались материалы сети Интернет.
На доске:
Тема урока: Скорость химической реакции. Факторы, влияющие на скорость.
Задачи исследования: 1. Дать определение понятию скорости химической реакции.
2. Экспериментально выявить факторы, влияющие на скорость.
Ход урока.
Перед началом урока учащиеся класса делятся на пять исследовательских групп и садятся таким образом, чтобы было удобно проводить эксперимент и обсуждать вопросы сообща.
Объяснение учителя | Действия учителя и учеников | |
1-и этап: Вызов:Учитель : захожу в класс с двумя надутыми шариками и отпускаю их. Как вы думаете о чём сегодня пойдёт речь на уроке? Учитель: Начало урока. Запись темы урока. Сегодня мы с вами на сорок минут представим себя учёными- исследователями. Но прежде , чем мы приступим к изучению нового материала, мне хотелось бы продемонстрировать не большой эксперимент. Посмотрите, пожалуйста на доску и сделайте свои предположения по поводу протекания этих реакций: А)сульфата меди и железа; Б)раствора сульфата меди и гидроксида калия Будут ли протекать эти реакции? Учитель: Я прошу желающего выйти к доске и провести реакции за демонстрационным столом , а затем записать уравнения этих химических реакций. Учитель: Мы наблюдали сейчас две реакции. ПРОБЛЕМА: Почему во втором случае мы не видим признаков реакции, неужели наши предположения неверны? ВЫВОД: Реакции протекают с разной скоростью. Действительно, одни реакции идут медленно- образование ржавчины на железном гвозде, другие быстро, часто со взрывом. Для полного гниения брошенной в лесу газеты нужен 1 год Ржавления консервной банки-10 лет Стекло практически не разрушается в течение столетий. Но вы можете меня спросить: А какая нам разница, с какой скоростью идут реакции. Неужели это так важно. Да, ребята , это важно .Важно помнить об этом, когда бросаете пустую бутылку в лесу , важно знать как пойдёт тот или иной процесс директору химического завода. Неслучайно , есть специальная наука- Химическая кинетика-раздел химической науки, которая изучает скорость реакции и условия, влияющие на неё. . ПЕРЕХОД К ТЕМЕ УРОКА. 2-й этап: Осмысление (мозговой штурм): Что такое скорость реакции и можно ли ей управлять. Попробуем ответить на эти вопросы на нашем сегодняшнем уроке Итак, перед нами две задачи: Дать определение понятию « скорость химической реакции». Экспериментально выяснить, какие факторы влияют на скорость химической реакции. Для ответа на первый вопрос мы прибегнем к теоретическим рассуждениям , то есть применим теоретический метод исследования. Давайте воспользуемся принципом аналогий. Вы уже сталкивались с понятием скорости в физике. Вспомните, пожалуйста, определение скорости движения в физике. СКОРОСТЬ движения показывает отношение перемещения в определённый промежуток времени. V= S/t ( единица измерения.) | Учащиеся выдвигают свои предположения Учащиеся выдвигают свои предположения Один из учащихся работает у доски. Показываю. Химическая кинетика- записать на доске. Учитель показывает на экране проектора задачи исследования На экране проектора- выражение скорости в физике. | |
А сейчас, попробуем провести аналогию с понятием скорости химической реакции ,но вначале посмотрим опыт демонстрация – горение свечки в закрытом сосуде 1). вам необходимо ответить на вопрос: — Почему в закрытом сосуде горящая свечка постепенно гаснет? Предполагаемый ответ: С течением времени количество молекул кислорода уменьшается, а количество молекул углекислого газа- увеличивается.
Попробуем записать формулу скорости
U= n/ t*V Скорость реакции равна отношению изменения количества вещества в единицу объёма за промежуток времени. И единица измерения скорости будет моль/л.с Но, отношение количества вещества к объёму – это молярная концентрация вещества, значит | Учащиеся в группах обсуждают ответ на поставленный вопрос.(2 мин.)Затем он выносится на общее обсуждение. Предполагаемый ответ: Количество вещества; В молях (моль) | |
Мы можем записать формулу, выражающую скорость химической реакции с учётом изменяющихся во времени характеристик т.е молярной концентрации вещества C1- начальная концентрация вещества С2- конечная концентрация вещества
V=_+ C / t= c2-c1/t2-t1 , С= С2-С1= 2-10= -8.Но скорость реакции не может быть отрицательной. Именно поэтому перед формулой стоит знак минус. Если скорость реакции рассчитывается по количеству продукта реакции, то используется знак + перед формулой. Но это справедливо для однородных реакций( гомогенных). А | Учитель записывает на доске нужную формулу | |
Итак, ребята. Что же такое скорость? Промежуточное обобщение: Итак, Скорость реакции- величина, показывающая изменение молярной концентрации вещества в единицу времени. Смотри презентацию. | На экране – промежуточное обобщение- определение и формула. | |
А сейчас приступим к выполнению второй задачи. Мы должны выяснить, каким образом можно влиять на скорость реакции. Вам предстоит работа в группах. У каждой группы свое задание, оно написано на карточке, которая перед вами. Я обращаю ваше внимание на соблюдение правил техники безопасности, будьте осторожны, внимательны при работе с веществами. Ничего не пробовать на вкус, ничего не нюхать. Помните о безопасности ваших партнёров по группе. Всё ли вам понятно? Начинаем работать. | Далее идёт работа в группах. Каждая исследовательская группа выполняет химический эксперимент по инструкции, записанной на карточке. Время для работы- 10 минут. После работы от каждой группы выступает один человек с результатом испытания. | |
Учитель: Работа в группах закончена. Сейчас вам предстоит рассказать всем о результатах своих испытаний.
Во время рассказа учеников необходимо показывать странички презентации и давать свои комментарии по поводу экспериментов.
Мои комментарии:
Природа реагирующих веществ. ПРЕЗЕНТАЦИЯ,?
Концентрация реагирующих веществ.
Поверхность соприкосновения реагирующих веществ
Температура.
Наличие катализатора.
Итак. Мы выяснили условия от которых зависит скорость химической реакции.
Обобщение. Заключительный слайд на экране проектора.
Презентация- Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Температура
Концентрация реагентов
Площадь соприкосновения реагирующих веществ
Наличие специальных веществ- катализаторов.
Катализаторы- это вещества . ускоряющие химическую реакцию.
3-й этап:Итоги урока и рефлексия:
Сегодня мы с вами представили себя учёными- исследователями.
Перед нами стояли две задачи: дать понятие скорости реакции и определить, можно ли повлиять на скорость. Я думаю, что мы решили стоящие перед нами задачи.
Что непонятно сегодня на уроке? С каким настроением вы уходите сегодня с урок?. В качестве закрепления темы урока я предлагаю вам составить кластер ( кластер- складывать).Но прежде- домашнее задание.
У вас на столах лежат памятки по краткому содержанию сегодняшнего урока. Эти листочки вы вклеите себе в тетрадь и найдёте там домашнее задание. И на этих же листках вам предложен кластер.
Домашнее задание:
Просмотр конспекта урока по предложенной вам памятке.
Задачи для самостоятельного решения:
1.Для реакции были взяты вещества при температуре 400С, а затем их нагрели до 700С. Как изменится скорость химической реакции , если температурный коэффициент её равен 2?
2.Как изменится скорость реакции, протекающей по уравнению 2NO+O2=2NO2, если концентрацию веществ увеличить в три раза?
3.При t= 300С реакция протекает за 25 минут, а при t= 500С за 4 минуты. Рассчитайте температурный коэффициент реакции.
Комментарии по факторам , влияющих на скорость реакции:
Основной теорией, объясняющей скорость химической реакции , является Теория столкновений.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Природа реагирующих веществ. Здесь следует помнить об особенности строения атомом элементов. По электрохимическому ряду напряжений металлов мы видим, что магний активней, чем цинк.
Концентрация реагирующих веществ.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.На основе большого экспериментального материала в 1867г. Норвежские учёные К.Гульдберг и П.Вааге и независимо от них в 1865 г. Русский учёный Н.И.Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс. 2А+3В=А2В3 V=(А)2.(В)3
3.Поверхность соприкосновения реагирующих веществ. Этот фактор применим для гетерогенных реакций. Чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
4.Температура.
Чем больше температура, тем больше активных частиц, увеличивается скорость их движения, что приводит к увеличению числа соударений. Скорость реакции возрастает. Правило Вант-Гоффа математически выражается следующей формулой: При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
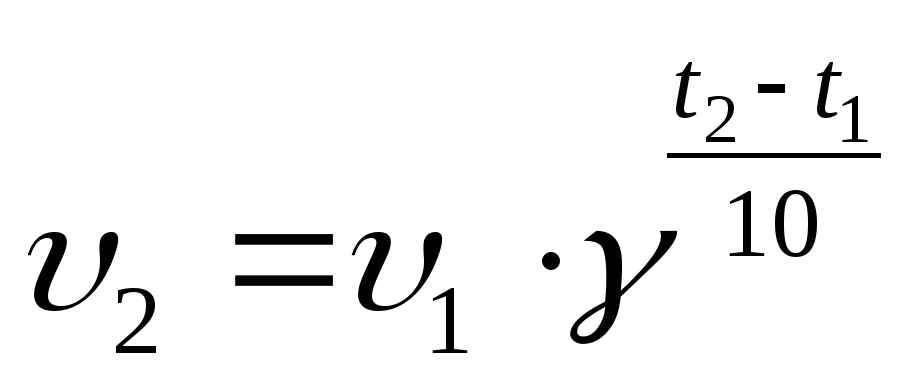 Правило Вант-Гоффа математически выражается следующей формулой:
Правило Вант-Гоффа математически выражается следующей формулой:
где V1 –скорость реакции при температуре t2,
V2 – скорость реакции при температуре t1,
y – температурный коэффициент.
5.Наличие катализатора.
Катализаторы- это вещества, ускоряющие химическую реакцию.
Катализаторы- это вещества которые направляют реакцию по более энергетически выгодному пути. Есть отрицательные катализаторы- ингибиторы. Они замедляют реакцию.
Карточка 1.Факторы, влияющие на скорость химической реакции:
1. Природа реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте соляной кислоты.
В одну опустите несколько стружек магния, а в другую- гранулу цинка.
*Сравните скорость взаимодействия различных металлов с соляной кислотой
*В чём , по вашему мнению, причина различной скорости реакций кислоты с данными металлами.
Запишите уравнения реакций.
( По всей вероятности, разную скорость взаимодействия металлов с кислотой можно объяснить разной химической активностью данных металлов. Магний активней, чем цинк, это значит, что он активнее реагирует с кислотой.).
Hcl +Mg—
Hcl +Zn—-
Карточка 2. Факторы, влияющие на скорость химической реакции:
2.Концентрация реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте растворы сульфата меди (2) различной концентрации, определив большую или меньшую концентрацию по насыщенности цвета раствора. В каждую из пробирок поместите гранулу цинка.
*В какой из пробирок выделение меди на цинке началось быстрее
*Как это можно объяснить с точки зрения атомно — молекулярного учения.
Запишите уравнение реакции.
(По всей вероятности, это можно объяснить тем , что в растворе большей концентрации находится больше молекул, а значит больше количество активных столкновений молекул, что сказывается на скорости химической реакции)
CuSO4 (Р-р)+Zn—
CuSO4 (конц)+Zn—
Карточка 3. Факторы, влияющие на скорость химической реакции:
3.Площадь соприкосновения реагирующих веществ.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте раствор соляной кислоты. Одновременно в одну пробирку поместите кусочек, а в другую- порошок карбоната кальция.
*В какой из пробирок реакция пройдёт быстрее
* Как это можно объяснить с точки зрения атомно- молекулярного учения.
Запишите уравнение реакции.
(Общая площадь частичек порошка карбоната кальция- мела больше, чем площадь поверхности кусочка, а значит и скорость реакции больше).
Hcl +CaCO3(кусочек)——
Hcl +CaCO3(порошок)——
Карточка 4. Факторы, влияющие на скорость химической реакции:
4.Температура.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В обе пробирки налейте раствор серной кислоты и поместите в них по грануле оксида меди. Одну из пробирок осторожно нагрейте. Пробирку держим держалкой.
*В какой из пробирок реакция протекает более интенсивно.
** Как это можно объяснить с точки зрения атомно- молекулярного учения.
Запишите уравнение реакции.
(При повышении температуры молекулы начинают двигаться быстрее, а значит увеличивается число активных столкновений. Скорость реакции возрастает).
h3SO4 + CuO—-
h3SO4 + CuO(нагреть)—-
Карточка 5. Факторы, влияющие на скорость химической реакции:
5.Наличие специальных веществ- катализаторов, веществ, которые увеличивают скорость химической реакции.
Будьте осторожны при работе с веществами. Помните о правилах техники безопасности.
В две пробирки налейте перекись водорода. В одну из пробирок осторожно присыпьте несколько кристалликов оксида марганца (4).Зажгите лучинку а потом погасите её. Поднесите тлеющую лучинку к отверстию пробирки. Лучинка должна загореться, т.к. выделяется кислород.
*В какой из пробирок наблюдается бурное выделение газа. Какой это газ.
*Какую роль в этой реакции выполняет оксид марганца (4)
Запишите уравнение реакции.
(Катализатор выполняет роль инициатора реакции. Без него реакция не идёт, а он приводит к тому, что реакция начинается. Сам катализатор в результате реакции остаётся без изменений).
h3O2——-
MnO2
h3O2——-
Памятка: Урок: «Скорость химической реакции»
Девиз урока: Знания, не проверенные опытом, бесплодны и полны ошибок.

— Факторы, влияющие на скорость реакции
Природа реагирующих веществ
2HCl+Mg—MgCl2+h3- реакция протекает быстрее т.к. магний активней, чем цинк.
2HCl+Zn—ZnCl2+h3
2 Температура
h3SO4+ CuO—CuSO4+ h3O(нагреваем) При нагревании реакция протекает быстрее, т.к. увеличивается скорость движения молекул, что приводит к увеличению числа активных столкновений. При возрастании температуры на 100С – скорость увеличивается в 2-4 раза.
h3SO4+ CuO—CuSO4+ h3O
3 Концентрация реагентов
CuSO4(конц.)+Zn—ZnSO4+ Cu- чем больше частиц реагентов, тем больше у них шансов столкнуться и прореагировать.Закон действующих масс: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
CuSO4(разбавл..)+Zn—ZnSO4+ Cu
Площадь соприкосновения реагирующих веществ
CaCO3(кусочек)+2HCl—-CaCO3+h3O+ CO2
CaCO3(порошок)+2HCl—-CaCO3+h3O+CO2-чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
Наличие специальных веществ- катализаторов.
2h3O2——2h3O+O2- без катализатора реакция не идёт, но стоит добавить MnO2? Так реакция происходит бурно. Это вешество является катализатором.
Катализаторы- это вещества . ускоряющие химическую реакцию.
Комментарии по факторам , влияющих на скорость реакции:
Основной теорией, объясняющей скорость химической реакции , является Теориястолкновений.
Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
1.Природа реагирующих веществ. Здесь следует помнить об особенности строения атомом элементов. По электрохимическому ряду напряжений металлов мы видим, что магний активней, чем цинк.
2.Концентрация реагирующих веществ.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.На основе большого экспериментального материала в 1867г. Норвежские учёные К.Гульдберг и П.Вааге и независимо от них в 1865 г. Русский учёный Н.И.Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: Скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс. 2А+3В=А2В3 V=(А)2.(В)3
3.Поверхность соприкосновения реагирующих веществ. Этот фактор применим для гетерогенных реакций. Чем больше поверхность соприкосновения реагирующих веществ, тем больше скорость.
4.Температура.
Чем больше температура, тем больше активных частиц, увеличивается скорость их движения, что приводит к увеличению числа соударений. Скорость реакции возрастает. Правило Вант-Гоффа математически выражается следующей формулой: При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %, а скорость реакции увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
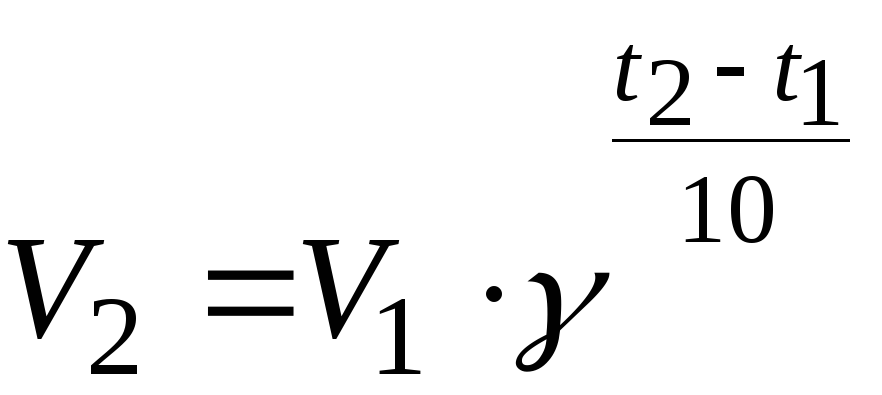
где V1 –скорость реакции при температуре t2,
V2 – скорость реакции при температуре t1,
y – температурный коэффициент.
5.Наличие катализатора.
Катализаторы- это вещества, ускоряющие химическую реакцию.
Домашнее задание:Просмотр конспекта урока по предложенной вам памятке.
Задачи для самостоятельного решения:
1.Для реакции были взяты вещества при температуре 400С, а затем их нагрели до 700С. Как изменится скорость химической реакции , если температурный коэффициент её равен 2?
2.Как изменится скорость реакции, протекающей по уравнению 2NO+O2=2NO2, если концентрацию веществ увеличить в три раза3.
3.При t= 300С реакция протекает за 25 минут, а при t= 500С за 4 минуты. Рассчитайте температурный коэффициент реакции
Мой кластер
«Скорость химической реакции»

xn--j1ahfl.xn--p1ai
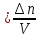 V=
V= 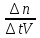 моль/л×сек
моль/л×сек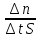 моль / см2×сек (слайд)
моль / см2×сек (слайд) =0,003 моль/л мин
=0,003 моль/л мин