Валентность алюминия (Al), формулы и примеры
Общие сведения о валентности алюминия
Алюминий – серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. Температуры плавления и кипения равны 660oС и -2500oС, соответственно.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающей очень сильным защитным действием.
Валентность алюминия в соединениях
Алюминий — тринадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IIIA группе. В ядре атома алюминия содержится 13 протонов и 14 нейтронов (массовое число равно 27). В атоме алюминия есть три энергетических уровня, на которых находятся 13 электронов (рис. 1).
Рис. 1. Строения атома алюминия.
Электронная формула атома алюминия в основном состоянии имеет следующий вид:
1s22s22p63s23p1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Так как на третьем энергетическом слое помимо 3s-подуровня есть еще и 3p-подуровень, две орбитали которого не заняты электронами, то пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3p-подуровня. Это означает, что для атома алюминия характерно наличие возбужденного состояния:
Наличие трех неспаренных электронов свидетельствует о том, что алюминий проявляет валентность III в своих соединения (AlIII2O3, AlIII(OH)3, AlIIICl3и др.). Валентность алюминия постоянная.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
1. Символ элемента, положение его в периодической системе элементов д.И. Менделеев. Атомная масса
Содержание страницы
Введение……………………………………………………………………………………………3
1. Символ элемента, положение его в периодической системе элементов Д.И. Менделеев. Атомная масса…………………………………………………………………………………….4
2. Строение ядра атома хлора. Возможные изотопы. Примеры………………………….5
3. Электронная формула атома: распределение электронов по уровням, подуровням, ячейкам Хунда. Возбуждённое состояние атома хлора………………………………………………….6
4. Валентность атома алюминия в стационарном и возбуждённом состояниях. Возможные степени окисления атома хлора. Окислительно – восстановительные свойства. Примеры схем перемещения электронов………………………………………………………………………….8
5. Эквиваленты хлора и его соединений. Примеры расчётов……………………………..11
6. Химические свойства хлора и его соединений. Примеры реакций……………………12
7. Виды концентраций……………………………………………………………………….15
8. Электролитическая диссоциация. Схема процесса диссоциации гидроксида. Константа диссоциации………………………………………………………………………………………17
9. Расчёт pH, pOH 0.01м раствора гидроксида или соли элемента………………………21
10. Гидролиз…………………………………………………………………………………..23
11. Качественный анализ хлора………………………………………………………………24
12. Методы количественного определения атома хлора или его соединений……………27
12.1. Гравиметрический метод анализа атома хлора…………………………………………27
13. Заключение……………………………………………………………………………….29
Список литературы………………………………………………………………………………32
Введение
Соединение с водородом — газообразный хлороводород — было впервые получено Джозефом Пристлив 1772 г. Хлор был получен в1774 г.шведским химикомКарлом Вильгельмом Шееле, описавшим его выделение при взаимодействиипиролюзитассоляной кислотойв своём трактате о пиролюзите:
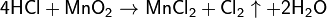
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать сзолотомикиноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химиитого времени теориифлогистона, предположил, что хлор представляет собой дефлогистированную муриевую (соляную) кислоту.БертоллеиЛавуазьев рамках кислородной теории кислот обосновали, что новое вещество должно быть оксидом гипотетическогоэлементамурия. Однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которомуэлектролизомудалось разложитьповаренную сольна натрий хлор, доказав элементарную природу последнего.
Х лор
(от греч. χλωρός — «зелёный») — элемент
17-й группы периодической таблицы
химических элементов (по устаревшей
классификации — элемент главной
подгруппы VII группы), третьего периода,
с атомным номером 17[3]. Обозначается
символом Cl (лат. Chlorum). Химически активный
неметалл. Входит в группу галогенов
(первоначально название «галоген»
использовал немецкий химик Швейгер для
хлора — дословно «галоген» переводится
как солерод — но оно не прижилось и
впоследствии стало общим для 17-й (VIIA)
группы элементов, в которую входит и
хлор[4]).
лор
(от греч. χλωρός — «зелёный») — элемент
17-й группы периодической таблицы
химических элементов (по устаревшей
классификации — элемент главной
подгруппы VII группы), третьего периода,
с атомным номером 17[3]. Обозначается
символом Cl (лат. Chlorum). Химически активный
неметалл. Входит в группу галогенов
(первоначально название «галоген»
использовал немецкий химик Швейгер для
хлора — дословно «галоген» переводится
как солерод — но оно не прижилось и
впоследствии стало общим для 17-й (VIIA)
группы элементов, в которую входит и
хлор[4]).
Простое вещество хлор (CAS-номер: 7782-50-5 ) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Атомная масса
(молярная масса)
[35, 446; 35,457][комм 1][1] а. е. м. (г/моль)
2. Строение ядра атома хлора. Возможные изотопы. Примеры
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22%.
Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
35Cl | 34,968852721 | Стабилен | — | 3/2 |
36Cl | 35,9683069 | 301000 лет | β-распадв36Ar | 0 |
37Cl | 36,96590262 | Стабилен | — | 3/2 |
38Cl | 37,9680106 | 37,2 минуты | β-распад в 38Ar | 2 |
39Cl | 38,968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
40Cl | 39,97042 | 1,38 минуты | β-распад в 40Ar | 2 |
3. Электронная формула атома: распределение электронов по уровням, подуровням, ячейкам Хунда. Возбуждённое состояние атома хлора

Хлор в периодической системе химических элементов находится в 3 периоде, VII группе, главной подгуппе (подгуппа галогенов) .
Заряд ядра атома Z = +[N(p+)] = + 17
Количество протонов N(p+) = 17
Количество электронов N(e-) = 17
В возбужденном сотоянии:
1) 3s2 3p5 3d0 + hn —> 3s2 3p4 3d1
3 неспаренных электрона (2 электрона на 3р-подуровне и 1 электрон на 3d-подуровне) , следовательно валентность равна 3
Пример соединения: HClO2, Cl2O3
2 ) 3s2 3p4 3d1 + hn —> 3s2 3p3 3d2
5 неспаренных электронов (3 электрона на 3р-подуровне и 2 электрона на 3d-подуровне) , следовательно валентность равна 5
Пример соединения: HClO3, Cl2O5
3 ) 3s2 3p3 3d2 + hn —> 3s1 3p3 3d3
7 неспаренных электронов (1 электрон на 3s-подуровне, 3 электрона на 3р-подуровне и 3 электрона на 3d-подуровне), следовательно валентность равна 5
4. Валентность атома алюминия в стационарном и возбуждённом состояниях. Возможные степени окисления атома хлора. Окислительно – восстановительные свойства. Примеры схем перемещения электронов
Валентные электроны: 3s2 3p5
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится один неспаренный электрон, следовательно, невозбужденный атом хлора может проявлять валентность 1. Валентность 1 проявляется в следующих соединениях:
— газообразный хлор Cl2 (или Сl-Cl)
— хлорид натрия NaCl (или Na+ Cl-)
— хлороводород HCl (или H-Cl)
— хлорноватистая кислота HOCl (или H-O-Cl)
Окислительно – восстановительные свойства.
HCl — степень окисления хлора -1
HClO3 — степень окисления хлора +5
HClO4 — степень окисления хлора +7
Промежуточная степень окисления говорит о том, что данный элемент может проявлять как восстановительные так и окислительные свойства, это — HClO3
Окислительные свойства проявляют элементы, у которых максимальная степень окисления (она равна номеру группы, в которой находится элемент). Значит, HClO4 — окислитель.
Восстановительными свойствами обладает элемент с наменьшей степенью окисления, т.е. HCl — восстановитель.
Хлор является сильным окислителем. Различные соединения хлора могут быть использованы в качестве окислителей. Это хлор С12), хлорноватистая кислота НСЮ, соли хлорноватистой кислоты — гипохлорит натрия NaCIO или гипохлорит кальция Са(СЮ)2 и оксид хлора СЮ2.
Хлорирование применяют для удаления из сточных вод фенолов, крезолов, цианидов, сероводорода. Для борьбы с биологическими обрастаниями сооружений его используют в качестве биоцида. Применяют хлор и для обеззараживания воды.
Хлор поступает на производство в жидком виде с содержанием не менее 99,5 %. Хлор является высокотоксичным газом, он обладает способностью накапливаться и концентрироваться в небольших углублениях. С ним достаточно трудно работать. При попадании в воду происходит гидролиз хлора с образованием соляной кислоты. С некоторыми органическими веществами, которые присутствуют в растворе, С12 может вступать в реакции хлорирования. В результате образуются вторичные хлорорганические продукты, которые обладают высокой степенью токсичности. Поэтому применение хлора стремятся ограничить.
Хлорноватистая кислота НСЮ обладает такой же окислительной способностью, как и хлор. Однако ее окислительные свойства проявляются только в кислой среде. Кроме того хлорноватистая кислота является нестабильным продуктом — со временем и на свету она разлагается.
Широкое применение получили соли хлорноватистой кислоты. Гипохлорит кальция Са(СЮ)2 выпускается трех сортов с концентрацией активного хлора от 32 до 35 %. На практике используют также двухосновную соль Са(СЮ)2- 2Са(ОН)г 2Н20.
Наиболее устойчива соль гипохлорита натрия NaOCl * 5Н20, которую получают при химическом взаимодействии газообразного хлора с раствором щелочи или при электролизе поваренной соли в ванне без диафрагмы.
Оксид хлораСO2 — газ зеленовато-желтого цвета, хорошо растворим в воде, сильный окислитель. Его получают взаимодействием хлорита NaC102 с хлором, соляной кислотой или озоном. При взаимодействии оксида хлора с водой не ротекают реакции хлорирования, что исключает образование хлорорганических веществ. В последнее время проводятся широкие разработки по выяснению условий замены хлора на оксид хлора в качестве окислителя. На ряде российских заводов внедрены передовые технологии с использованием СO2.
studfile.net
Валентность и степень окисления, подготовка к ЕГЭ по химии
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим молекулу

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
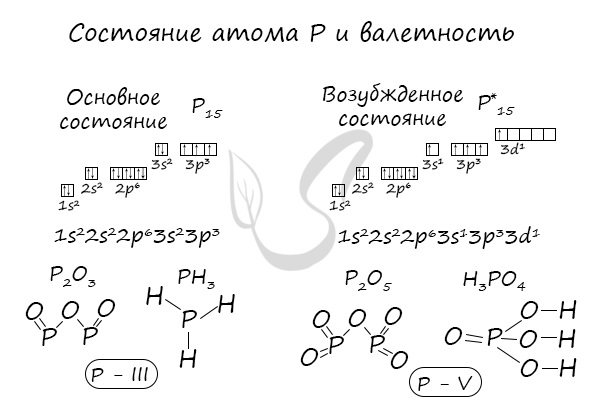
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
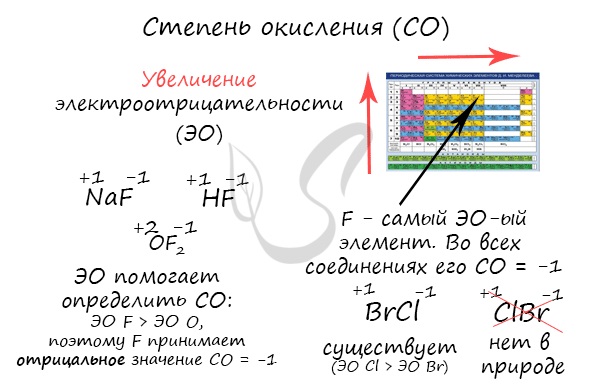
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток - получает знак «+».
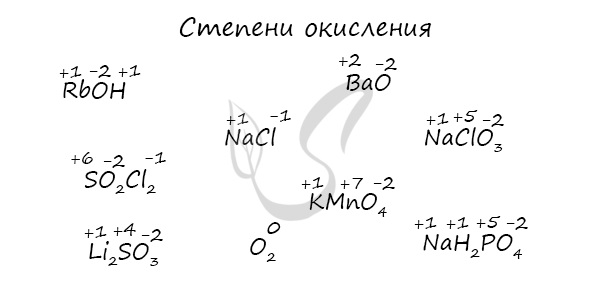
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)
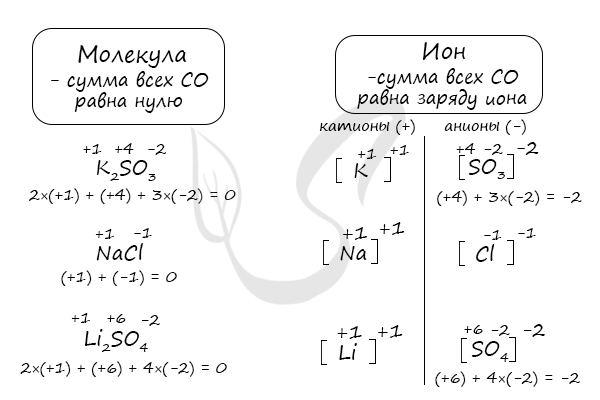
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Валентность химических элементов в химии
Понятие «валентность»
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3Li 1s22s1
11Na 1s22s22p63s1
Валентность элементов главной подгруппы II группы
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be1s22s2
12Mg 1s22s22p63s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Mg*
Валентность кислорода и фтор в химических соединениях
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум (II) для кислорода и единице (I) для фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет более свободных ячеек:
8O 1s22s22p4
9F 1s22s22p5
В то же время сера – аналог кислорода – проявляет переменную валентность II, IV, VI; хлор – аналог фтора – проявляет валентность I, III, V, VII. Это объясняется наличием свободных d-ячеек на третьем энергетическом уровне.
Для большинства d-элементов валентность в невозбужденном состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов и, чтобы определить валентность в этом случае, нужно знать, возможно ли для элемента возбужденное состояние.
Кроме этого значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Примеры решения задач
ru.solverbook.com
Валентность возбужденная — Справочник химика 21
Сера — элемент 3-го периода. Валентный уровень атома серы состоит из 3 подуровней и 9 орбиталей. Атом серы может иметь два валентно-возбужденных состояния [c.84]Таким образом, оценивая валентные возможности элементов, следует учитывать наличие неспаренных электронов в основном и валентно-возбужденных состояниях атома, вакантных орбиталей и неподеленных электронных пар. [c.87]
Решение. АтОМ олова можно представить в основном и валентно-возбужденном состояниях [c.87]
Атом бора имеет одну свободную валентность 2р-электрона, в невозбужденном состоянии, атом алюминия — одну свободную валентность Зр-электрона, а атом азота — три свободные валентности 2р-электронов. Однако в соединениях атомы бора и алюминия, как правило, трехвалентны. Это происходит вследствие одноэлектронного перехода 2s 2р в боре, обусловливающего sp -конфигу-рацию и одноэлектронного перехода 3s Зр в алюминии, также способствующего образованию sp -конфигурации. Одноэлектронный переход 2s 2р в азоте не может способствовать увеличению числа валентностей, так как в образовавшейся 2р -конфигурации в соответствии с принципом Паули только два электрона могут иметь произвольные направления спинов, т. е. к оставшейся 25-валент-ности добавляются две 2р-валентности. Три связи, образуемые тремя валентностями азота и тремя валентностями возбужденных атомов бора осуществляются в базисной плоскости нитрида бора. Связь между базисными плоскостями осуществляется вследствие несимметричности поля, в котором находятся валентные электроны атомов бора и азота. [c.85]
При переходе атома серы в валентно-возбужденное состояние происходит переход одного из электронов Зх и одного из электронов Зр на две вакантные -орбитали и получается следующая электронная конфигурация [c.13]
Но ведь это именно такие состояния многоэлектронных атомов, которые играют преимущественную роль и в валентном возбуждении и в образовании ковалентных и координативных связей между атомами в молекулах за счет взаимодействия периферических электронов. Все эти состоя- [c.61]
В случае соединений инертных газов эта процедура неприменима. Приведем значение энергий валентного возбуждения (табл. 3) [c.93]
Число связей, которые образует атом по обменному механизмукак правило, равно числу его неспаренных электронов в основном или валентно-возбужденном состоянии. В методе валентных связей исходят из того, что валентно-возбужденные состояния атома, отличающиеся от основного большим числом неспаренных электронов, получаются переводом одного или нескольких электронов электронных пар в свободные орбитали другого подуровня того же электронного уровня. [c.83]
Однако эта формула противоречит тому факту, что фосфор-новатистая кислота. Н3РО2 — кислота одноосновная. Последнее означает, что только один атом водорода присоединен к фосфору через кислород, а два других — непосредственно к фосфору. Поэтому графическая формула Н3РО2 строится на основании электронно-графической формулы валентно-возбужденного состояния атома фосфора [c.89]
Короче говоря, ридбергово возбуждение может привести к тем же самым химическим результатам, что и валентное возбуждение, в зависимости от электронных свойств реагентов. С другой стороны, возможны случаи, когда два типа возбуждения будут приводить к различным результатам. В то время как обсужденные выше сходства и различия связаны с формами критических адиабатических поверхностей, они могут быть также обусловлены различными или похожими конформационными свойствами ридберговых и валентных возбужденных состояний. [c.296]
Рассмотрим собственную проводимость. Если в некотором соединении, обладающем лищь собственной проводимостью, перенос электрического заряда происходит в результате обмена валентностями, то сначала должно возникнуть возбужденное состояние, в котором, по крайней мере, один из ионов изменяет свою валентность. Возбужденное состояние может возникнуть, например, в результате реакции Fe + + Fe + Fe +-j-Fe » . При этом образование возбужденной пары (Fe + + Fe +) соответствует образованию одного отрицательного (электрона) и одного положительного (дырки) носителя. Число носителей, как и в случае гомеополярных полупроводников, определяется на основе статистики Ферми — Дирака [c.116]
Согласно сказанному ранее (см. гл. 1), молекулярные отрицательные ионы, относящиеся к электронно-возбужденным фешбаховским резонансам в области ридберговских состояний молекулы можно представить как молекулярные ионы с двумя эквивалентными ридберговскими электронами. Так как ридберговские электроны не оказывают почти ни
www.chem21.info
Валентность золота (Au), формулы и примеры
Общие сведения о валентности золота
Золото представляет собой металл желтого цвета с гранецентрированной кубической решеткой. Золото характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 19,3 г/см3. Температура плавления 1064,4oС, кипения 2880oС.
Валентность золота в соединениях
Золото – семьдесят девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в шестом периоде в IВ группе. В ядре атома золота содержится 79 протонов и 117 нейтронов (массовое число равно 197). В атоме золота есть шесть энергетических уровней, на которых находятся 79 электронов (рис. 1).
Рис. 1. Строение атома золота.
Электронная формула атома золота в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64f145s25p65d106s1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что золото проявляет валентность I в своих соединениях (Au2O, AuNO3, AuCl, Au2S и т.д.).
Известно, что для золота также характерна валентность II (AuO, AuF2).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Валентность хлора (Cl), формулы и примеры
Общие сведения о валентности хлора
В обычных условиях хлор – газ желто-зеленого цвета. Температура плавления – 101,0oС, температура кипения -34,2oС. Органично растворяется в воде. При охлаждении из водных растворов выделяются кристаллогидраты, являющиеся хларатами приблизительного состава Cl2×6H2O и Cl2×8H2O.
Хлор – активный окислитель.
Молекула хлора двухатомна Cl2.
Валентность хлора в соединениях
Хлор — семнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VIIA группе. В ядре атома хлора содержится 17 протонов и 18 нейтронов (массовое число равно 35). В атоме хлора есть три энергетических уровня, на которых находятся 17 электронов (рис. 1).
Рис. 1. Строения атома хлора.
Электронная формула атома хлора в основном состоянии имеет следующий вид:
1s22s22p63s23p5.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что хлор способен проявлять валентность I (низшая валентность) в своих соединениях (NaClI, NaClIO, ClI2O).
Для атома хлора характерно наличие нескольких возбужденных состояний из-за того, что орбитали 3d-подуровня являются вакантными (на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень). Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что хлор проявляет в своих соединениях валентности III (NaClIIIO2), V (KClVO3) и VI (KClVIIO4, ClVII2O7) (высшая валентность).
Формально хлор может проявлять валентности IV (ClO2) и VI (Cl2O6).
Примеры решения задач
ru.solverbook.com