Валентность фтора (F), формулы и примеры
Общие сведения о валентности фтора
Фтор самый электроотрицательный элемент. В обычных условиях фтор представляет собой газ бледно-желтого цвета. Ядовит. В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
Молекула фтора двухатомна F2. Обладает самой низкой поляризуемостью среди галогенов. Температура плавления фтора аномально низкая. Не растворим в воде, т.к. разлагает ее (2F2 + 2H2O = 4HF + O2).
Валентность фтора в соединениях
Фтор — девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIIA группе. В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов (рис. 1).
Рис. 1. Строения атома фтора.
Электронная формула атома фтора в основном состоянии имеет следующий вид:
1s22s22p5.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренных электрона свидетельствует о том, что фтор проявляет валентность I во всех своих соединения (HFI, KFIи т.д.). Валентность постоянная. Фтор – один из элементов, для которого не характерна высшая валентность, определяемая по номеру группы.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Валентные возможности атомов химических элементов. Видеоурок. Химия 11 Класс
Данный урок посвящен повторению понятия «валентность» и изучению принципов определения валентных возможностей атомов химических элементов. В ходе изучения материала вы узнаете, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: 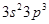 (рис. 1).
(рис. 1).
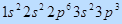
Рис. 1. Электронная формула атома фосфора
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предпоследнего слоев.
Валентность – это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH3 равна трем (Рис. 2).
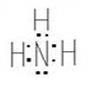
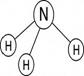
Рис. 2. Электронная и графическая формулы молекулы аммиака
Количество электронных пар, которое может образовать атом с другими атомами, зависит, в первую очередь, от числа его неспаренных электронов. Например, в атоме углерода два неспаренных электрона – на 2р-орбиталях (Рис. 3). По числу неспаренных электронов мы можем сказать, что такой атом углерода может проявлять валентность, равную II.

Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).

Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Может ли азот иметь валентность, равную пяти – по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
7N
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму – донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога урока
На уроке вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§ 9)
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобраз. учрежд.: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010. (§ 5)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 8)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
- с. 30 №№ 2.41, 2.43 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
- Запишите электронные схемы строения атома хлора в основном и возбужденном состояниях.
- Сколько валентных электронов в атоме: а) бериллия; б) кислорода; в) серы?
interneturok.ru
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность
Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами .
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
В ряде случаев, валентность может численно совпадать со степенью окисления, но ни коим образом они не тождественны друг другу. Например, в молекулах N2 и CO реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления азота равна 0, углерода +2, кислорода −2.
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
himege.ru