Как определить валентность по таблице Менделеева и как она изменяется
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?

 Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами.
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.

 Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.Чем поможет периодическая таблица?

 Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.
Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

 То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе h3S двухвалентна, в составе SO2 — четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

 Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод;
- сера;
- хлор;
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

 Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Вконтакте
Одноклассники
Мой мир
znaniya.guru
Как определить валентность в соединении?
Для начала, дадим определение самого понятия «валентность», а также расскажем о том, как определить валентность при помощи Периодической таблицы Д.И. Менделеева.
Валентность — это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. Мерой валентности служит число химических связей, образуемых атомом данного химического элемента с другими атомами, т.е., простыми словами, валентность – это способность образовывать химические связи с другими атомами. Высшая валентность атома равна номеру группы, в которой он расположен, а низшая – разнице между числом восемь и номером группы.
При определении валентности элемента в сложных соединениях, т.е. состоящих из нескольких атомов следует запомнить, что валентности водорода, фтора, кислорода и алюминия постоянны и равны I, I, II и III, соответственно. Также, следует не забывать о том, что валентности элементов IA и IIA групп постоянны и равны номеру группы, т.е., валентность натрия равна I, т.к. он находится в IA группе, валентность кальция равна II, т.к. он находится во IIA группе.
ru.solverbook.com
Как узнать и определить валентность химического элемента по таблице Менделеева
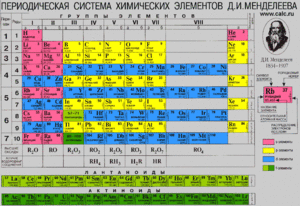
 Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.Он назвал это основностью. Основность углерода равна четырем. То есть углерод может образовать четыре связи с другими элементами.
[block id=»32″]
…
Вконтакте
Google+
Мой мир
[block id=»33″]
Дальнейшее развитие понятие получило в работах Д. И. Менделеева . Дмитрий Иванович развивал учение о периодическом изменении свойств простых веществ. Соединительную силу он определял как способность элемента присоединять определенное количество атомов другого элемента.
Определение по таблице Менделеева
Чтобы определить валентность, нужно знать, какая она бывает. У металлов главных подгрупп она всегда постоянная, а у неметаллов и металлов побочных подгрупп может быть переменной.
Постоянная равна номеру группы. Переменная может быть высшей и низшей. Высшая переменная равна номеру группы, а низкая высчитывается по формуле: восемь минус номер группы . При определении нужно помнить:
- у водорода она равна I;
- у кислорода — II.
Если соединение имеет атом водорода или кислорода, то определить его валентность не составляет труда, особенно если перед нами гидрид или оксид.
[block id=»3″]
Формула и алгоритм
Самая меньшая валентность у тех элементов, которые расположены правее и выше в таблице. И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:

 Записываем формулу соединения.
Записываем формулу соединения.- Проставляем валентность того компонента соединения, которого знаем.
- Умножаем известную величину на количество атомов элемента в соединении.
- Находим наименьшее кратное.
- Проводим проверку: умножаем значение на индекс. Должна получаться одинаковая цифра по каждому компоненту соединения.
Пример: возьмем соединение аммиака — Nh4. Нам известно, что у атома водорода валентность постоянная и равна I. Умножаем I на 3 (количество атомов) — наименьшее кратное — 3. У азота в этой формуле индекс равен единице. Отсюда вывод: 3 делим на 1 и получаем, что у азота она равна IIII.
Величину по водороду и кислороду всегда определять легко. Сложнее, когда ее необходимо определять без них. Например, соединение SiCl4. Как определить валентность элементов в этом случае? Хлор находится в 7 группе. Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
В современных учебниках химии всегда есть таблица валентности химических элементов. Это существенно облегчает задачу учащимся. Тему изучают в восьмом классе — в курсе неорганической химии.
[block id=»4″]
Современные представления

 Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Само ядро состоит из протонов и нейтронов, которые определяют атомный вес. Для того чтобы вещество было стабильным, его энергетические уровни должны быть заполнены и иметь восемь электронов.
При взаимодействии элементы стремятся к стабильности и либо отдают свои неспаренные электроны, либо принимают их. Взаимодействие происходит по принципу «что легче» — отдать или принять электроны. От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
В качестве примера
Щелочной металл натрий находится в первой группе периодической системы Менделеева. Это значит, что у него один неспаренный электрон на внешнем энергетическом уровне. Хлор находится в седьмой группе. Это значит, что у хлора есть семь неспаренных электронов. Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
[block id=»2″]
[block id=»10″]
obrazovanie.guru
Как определить валентность по таблице Менделеева?
Максимальная валентность по кислороду равна числу электронов на внешнем слое. В общем случае номеру группы. У Р с утра ещё была V группа, за это время что-то изменилось? Валентность по водороду равна числу электронов, которые элемент может принять на внешний слой. Равна 8- №группы. У элементов с переменной валентностью всё сложнее. И Fe c утра был в VIII! Железо отдаёт 2 электрона с внешнего слоя, валентность 2, ст. окисления +2, ещё один «лишний» электрон с предвнешнего d слоя — валентность 3. Придётся запоминать! Только не говорите, что таблица Д. Менделеева уже «перекроена», тогда мне придётся всё заново учить!
Валентность — свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента. Есть элементы, которые имеют постоянную валентность: одновалентны (I) — H,Li, Na, K, Rb, Cs, F, I двухвалентны (II) — O, Be, Mg, Ca, Sr, Ba, Zn, Cd трехвалентны (III) — B, Al Есть еще один способ: определять валентность можно по таблице Д. И. Менделеева. Все элементы в таблице разделены на подгруппы а) и б) . Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I. Металлы, которые стоят во второй а) группе имеют валентность II. Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом. Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент; высшую — равную номеру группы, в которой находится этот элемент. Номер группы указан вверху таблицы.
Все элементы в таблице разделены на подгруппы а) и б) . Активные металлы занимают только три первые группы. Металлы, которые стоят в первой а) группе имеют валентность I. Металлы, которые стоят во второй а) группе имеют валентность II. Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III). Это говорит нам о том, что железо — трехвалентно в данном соединении с кислородом. Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую — вычисляют по формуле (8-Ь группы) , в которой находится элемент; высшую — равную номеру группы, в которой находится этот элемент. Номер группы указан вверху таблицы. Алгоритмы составления формул по валентности и определение валентности по формуле я посылаю как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
touch.otvet.mail.ru
