Валентные возможности атомов химических элементов.
2. ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Структура внешних энергетических уровней атомов химических элементов определяет в основном свойства их атомов. Эти уровни называют валентными. Электроны внешних уровней (иногда и предвнешних) принимают участие в образовании химических связей. Такие электроны также называют валентными.
Валентность – это способность атомов химических элементов образовывать определенное число химических связей.
Валентные возможности атомов определяются двумя способами:
Числом неспаренных электронов, которые участвуют в образовании связи по обменному механизму:
в стационарном (основном) состоянии;
в возбужденном состоянии.
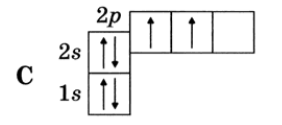
Рассмотрим валентные возможности атома углерода.
Схема строения атома углерода:
6С +6 )2)4
(атом получил дополнительную энергию)
Электронная конфигурация
1s22s22p2
1s22s12p3
Графическая формула

Допишите предложения:
Валентность атома углерода в основном состоянии равна ____.
Валентность атома углерода возбужденном состоянии равна ______.
Числом неподеленных электронных пар, способных участвовать в образовании химической связи по донорно-акцепторному механизму.
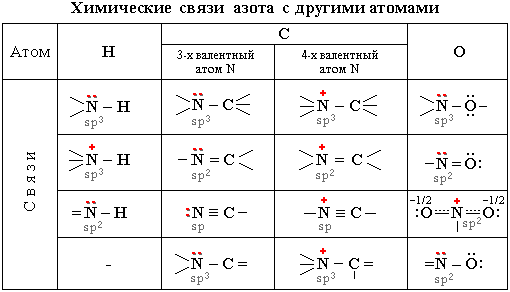
Рассмотрим валентные возможности атома азота.
Схема строения атома азота:
7N +7 )2)5
(атом получил дополнительную энергию)
Электронная конфигурация
1s22s22p3
Не характерно, так как на втором уровне нет больше свободных орбиталей и спаренные электроны не могут распариваться.
Графическая формула

Неспаренные электроны участвуют в образовании химической связи по обменному механизму.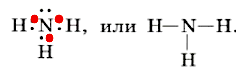
В этом случае валентность азота равна III.
Но у атома азота на втором внешнем уровне есть еще два спаренных s-электрона. Это неподеленная электронная пара.
Неподеленная пара электронов участвует в образовании химической связи по донорно-акцепторному механизму.
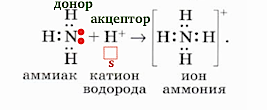
Тогда валентности увеличивается еще на единицу и будет равна IV.
Задания на закрепление:
Задание 1.
Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
infourok.ruВалентные возможности элементов — Талантливый ребенок
Строение наружных (внешних) энергетических уровней атомов химических элементов и определяет в основном химические свойства элементов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев:
Для того, чтобы верно оценить валентные возможности атомов химических элементов, необходимо рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит расспаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
В невозбужденном состоянии атом фосфора имеет три неспаренных электрона на р-подуровне. Так как этот элемент находится в третьем периоде, у него есть вакантные орбитали d-подуровня. Поэтому при переходе атома в возбужденное состояние (например, при нагревании) один из пары электронов s-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Так, атом углерода в стационарном состоянии имеет два неспаренных электрона (например, в соединении СО). Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии, когда электроны s-орбитали расспарились и один из них «перешел» на вакантную орбиталь р-подуровня:
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s22р2 в возбужденное — 2s12р3 требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
На примере атома хлора легко показать, что валентность может быть переменной:
Расспаривание электронов происходит поэтапно: сначала с р-подуровня, затем с s-подуровня.
Валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Донорно-акцепторный механизм образования ковалентных связей объясняет другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь (по донорно-акцепторному механизму).
То есть валентные возможности атомов химических элементов определяются:
1) числом неспаренных электронов (одноэлектронных орбиталей)
2) наличием свободных орбиталей
3) наличием неподеленных пар электронов (как, например, при образовании химических связей в молекуле хлорида аммония).
talantchild.ru
Валентные возможности атомов. Степень окисления
Атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Первой попыткой объяснить химическое взаимодействие была

Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в двадцатом столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет своё значение до сих пор.

Впервые понятие «валентность» как соединительной силы ввёл Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность – это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.

В основном состоянии на внешних энергетических уровнях, а иногда предвнешних уровнях атомов могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.

Рассмотрим эс-, пэ-, дэ-, эф — семейства химических элементов Периодической системы.

У эс и пэ элементов валентные электроны расположены на эс и пэ подуровнях внешнего энергетического уровня.

Например, литий, у которого заряд ядра плюс три, три электрона, электронная формула: один эс два два эс один; это эс элемент, атом имеет один неспаренный эс электрон, значит валентность лития один.

Рассмотрим другой пример, азот. Заряд его атома плюс семь, у него семь электронов. Электронная формула один эс два два эс два два пэ три; это пэ элемент. Соответственно, азот имеет пять валентных электронов – два спаренных эс электрона и три неспаренных пэ электрона.

У дэ элементов валентные электроны находятся на эс подуровне последнего энергетического уровня и дэ подуровне предвнешнего энергического уровня.

Например, у атома титана заряд ядра плюс двадцать два, соответственно столько же электронов двадцать два. Электронная формула атома титана: один эс два два эс два два пэ шесть три эс два три пэ шесть четыре эс два три дэ два, это дэ элемент. Титан имеет четыре валентных электронов, два спаренных эс электронов и два неспаренных дэ электронов.

У эф элементов валентные электроны располагаются на эс подуровне последнего энергетического уровня и дэ подуровне предпоследнего энергетического уровня и эф подуровень, третьего с края энергетического уровня.

Например, у атома эйнштейния заряд ядра плюс девяноста девять, столько же у него и электронов. Электронная формула его внешних и предвнешних слоёв, заполняющихся последними, пять дэ десять шесть пэ шесть семь эс два пять эф одиннадцать; это эф элемент. Эйнштейний имеет тринадцать валентных электронов, двенадцать спаренных и один неспаренный на пять эф подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося учёного двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне.
Количеством этих неспаренных электронов и определяется валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.

Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.

Например, заряд ядра атома фосфора плюс пятнадцать, число электронов пятнадцать, электронная формула атома фосфора один эс два, два эс два, два пэ шесть, три эс два, три пэ три. В основном состоянии атом фосфора, который относится к пэ элементам, на внешнем уровне содержит одну пару спаренных электронов и три неспаренных электрона. Поэтому, он проявляет валентность три, так как у него три неспаренных пэ электрона. И валентность четыре, так как атом фосфора — это атом-донор, который может предоставить пару электронов для образования химической связи.

При имеющихся вакантных орбиталях на три дэ подуровне и паре спаренных электронов на три эс подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется пять неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора – пять.
Поэтому если у элементов на внешнем энергетическом уровне есть неспаренные электроны, они являются активными элементами или реакционноспособными, а если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят главную восьмую группу химических элементов Периодической системе. Их так и называют благородные или инертные (малоактивные) химические элементы, так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Эс, дэ, эф элементы – это металлические элементы кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем три; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем четыре.
Пэ элементы могут быть металлические и неметаллические.
Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все пэ элементы выше диагонали – неметаллические, ниже – металлические. По строению элементы, у которых на внешнем энергетическом уровне три или четыре электрона, считаются переходными элементами; многие дэ элементы – металлические с переходными свойствами.

У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления – это условный заряд атома – положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.

Если в соединении атом не проявляет валентность как донор, то степень окисления численно совпадает с валентностью. Например, в молекуле аммиака валентность азота равна трём и степень окисления равна тоже трём только с минусом.

И наоборот, если в соединении атом проявляет валентность как донор, то степень окисления численно не совпадает с валентностью. У катиона аммония атом азота проявляет валентность четыре, а степень окисления минус три.

Степень окисления может быть минимальной, промежуточной и максимальной.
Минимальная степень окисления для неметаллических элементов определяется числом валентных мест в незавершённом энергетическом уровне. У атома углерода она равна минус четыре, так как до устойчивости внешнего энергетического уровня атома углерода (до восьми электронов) число валентных мест – четыре.

Соответственно, у атома азота минимальная степень окисления минус три, у кислорода – минус два.


Максимальная степень окисления определяется суммой эс и пэ электронов на внешних энергетических уровнях, а для дэ элементов – суммой эс и дэ электронов.
Например, атом титана – это дэ элемент, металлический. На внешнем электронном слое четыре эс два, три дэ два у него находится четыре электрона. Значит, максимальная степень окисления титана плюс четыре.

Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
Определим степень окисления в бинарных соединениях на примере оксидов азота. Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Минимальная степень окисления кислорода равно минус двум, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.

В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за икс. Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине. Также степень окисления в таких соединениях можно находить вот по такой схеме.

В простых веществах с неполярной ковалентной связью степень окисления равна нулю. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.

Таким образом, валентные возможности атомов определяются количеством неспаренных электронов в основном и возбуждённом состоянии, наличием неподелённых пар электронов, числом пустых орбиталей. Степень окисления и валентность это не одно и тоже понятие.
videouroki.net
Урок химии в 10-м классе по теме «Валентность. Валентные возможности атомов»
Цели.
- Развить представления о валентности как основном свойстве атома, выявить закономерности изменения радиусов атомов химических элементов в периодах и группах периодической системы.
- Используя интегрированный подход, развивать у учащихся умения сравнивать, сопоставлять, находить аналогии, предсказывать практический результат на основании теоретических рассуждений.
- Создавая ситуации успеха, преодолевать психологическую инерцию учащихся.
- Развивать образное мышление, способности к рефлексии.
Оборудование: Таблица “ Валентность и электронные конфигурации элементов”, мультимедиа.
Эпиграф. Логика, если она отражается в истине и здравом смысле, всегда ведёт к цели, к правильному результату.
Урок комбинированный, с элементами интеграции. Используемые методы обучения: объяснительно-иллюстрированый, эвристический и проблемный.
Ход урока
Презентация
I этап. Ориентировочно-мотивационный
Урок начинается с “настройки” (звучит музыка – симфония №3 Й. Брамса).
Учитель: Слово “валентность” (от лат. valentia) возникло в середине XIX в., в период завершения второго химико-аналитического этапа развития химии. К тому времени было открыто более 60 элементов.
Истоки понятия “валентность” содержатся в работах разных ученых. Дж. Дальтон установил, что вещества состоят из атомов, соединенных в определенных пропорциях Э. Франкланд, собственно, и ввел понятие валентности как соединительной силы. Ф.А. Кекуле отождествлял валентность с химической связью. А.М.Бутлеров обратил внимание на то, что валентность связана с реакционной способностью атомов. Д.И. Менделеев создал периодическую систему химических элементов, в которой высшая валентность атомов совпадала с номером группы элемента в системе. Он же ввел понятие “переменная валентность”.
Вопрос. Что такое валентность?
Вчитайтесь в определения, взятые из разных источников (учитель показывает слайды через мультимедиа):
“Валентность химического элемента – способность его атомов соединяться с другими атомами в определенных соотношениях”.
“Валентность – способность атомов одного элемента присоединять определенное количество атомов другого элемента”.
“Валентность – свойство атомов, вступая в химические соединения, отдавать или принимать определенное количество электронов (электровалентность) или объединять электроны для образования общих для двух атомов электронных пар (ковалентность)”.
Какое определение валентности, по вашему мнению, более совершенно и в чем вы видите недостатки других? (Обсуждение в группах.)
Валентность и валентные возможности – важные характеристики химического элемента. Они определяются структурой атомов и периодически изменяются с увеличением зарядов ядер.
Учитель. Таким образом, делаем вывод, что:
(учитель показывает следующий слайд)
Что, по-вашему, означает понятие “ валентная возможность”?
Учащиеся высказывают свое мнение. Вспоминают значение слов “возможность”, “возможный”, уточняют смысл этих слов в толковом словаре С.И.Ожегова:
“Возможность – средство, условие, необходимое для осуществления чего-нибудь”;
“Возможный – такой, который может произойти, осуществимый, допустимый, дозволительный, мыслимый”.
(учитель показывает следующий слайд)
Потом учитель подводит итог.
Учитель. Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
II этап. Операционно-исполнительный
Работа с таблицей “ Валентность и электронные конфигурации элементов”.
Учитель. Поскольку валентность атома зависит от числа неспаренных электронов, полезно рассмотреть структуры атомов в возбужденных состояниях, учитывая валентные возможности. Запишем электронографические формулы распределения электронов по орбиталям в атоме углерода. С их помощью определим, какую валентность проявляет углерод С в соединениях. Звездочкой (*) обозначают атом в возбужденном состоянии:
Таким образом, углерод проявляет валентность IV
за счёт расспаривания
2s2 – электронов и перехода одного из
них на вакантную орбиталь. (Вакантный –
незанятый, пустующий (С. И. Ожегов))
Почему валентность С- II и IV , а H-I , He-O , Be – II , B – III , P -V ?
Сопоставьте электронографические формулы элементов (схема №1) и установите причину разной валентности.
Работа в группах:
Схема №1 (Приложение)
Учитель. Итак, от чего зависят валентность и валентные возможности атомов? Давайте рассмотрим эти два понятия во взаимосвязи (схема №2).
Схема №2 (Приложение)
| 1) числа неспаренных электронов | 1) наличие вакантной орбитали |
| 2) распределения электронов на энергетическом уровне | 2) распределения электронов по орбиталям при поглощении атомом энергии |
Расход энергии (Е) на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химической связи.
В чем отличие атома в основном (стационарном) состоянии от атома в возбужденном состоянии (схема №3)?
Схема№3 (Приложение)
Учитель. Могут ли быть следующие валентности у элементов: Li -III , О – IV , Ne – II ?
Поясните свой ответ, используя электронные и электронографические формулы этих элементов (схема №4).
Работа в группах.
Схема №4 (Приложение)
Ответ. Нет, так как в этом случае затраты энергии на перемещение электрона
(1s —> 2p или 2p —> 3s) настолько велики, что не могут быть компенсированы энергией , выделяющейся при образовании химической связи.
Учитель. Есть ещё один вид валентной возможности атомов – это наличие неподеленных электронных пар (образование ковалентной связи по донорно – акцепторному механизму):
(Приложение)
III этап. Оценочно-рефлексивный
Подводятся итоги, характеризуется работа учащихся на уроке (возвращение к эпиграфу урока). Затем подводится резюме – отношение ребят к уроку, учебному предмету, учителю.
Резюме
1. Что не понравилось на уроке?
2. Что понравилось?
3. Какие вопросы остались для тебя неясными?
4. Оценка работы преподавателя и своей работы? (обоснованная).
Домашнее задание (по учебнику О.С. Габриеляна, Химия-10; профильный уровень, параграф №4, упр.4)
urok.1sept.ru
Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Урок Конспект Дополнительные материалыВалентность
Наберите на клавиатуре следующую фразу:
Валентные возможности химических элементов
Найдите в представленном филворде химические элементы, валентность которых может быть равна I.
ПодсказкаОбратите внимание на то, что в предложенном филворде спрятано пять химических элементов.
Валентные возможности атомов, электроотрицательность
Разгадайте кроссворд на тему: «Валентные возможности атомов, электроотрицательность».
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Электроотрицательность химических элементов
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Валентные возможности химических элементов
Выполните задание.
ПодсказкаПовторите конспект по теме: «Валентность и валентные возможности атомов».
Электроотрицательность и типы химических связей
Используя шкалу электроотрицательности, соотнесите соединение и тип его химической связи:
ПодсказкаПовторите конспект по теме: «Валентность и валентные возможности атомов».
Степень окисления атомов в химических соединениях
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Степени окисления химических элементов
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Валентные возможности химических элементов
Из предложенных вариантов выберите валентность, которая не характерна для марганца.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Формула вещества
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Определение валентности элемента в соединении
Определите валентность марганца в соединении MnO(OH)2.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Электроотрицательность соединения
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Химические элементы
Расположите химические элементы с представленными электронными формулами по возрастанию их электроотрицательности.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
1s22s22p63s23p64s23d104p65s14d10
Неизвестное вещество
В данном соединении один из элементов имеет электронную конфигурацию 1s22s22p63s23p3. При определенном соотношении с кислородом это соединение самовоспламеняется. Получить его можно взаимодействием исходного элемента со щелочью и водой. Вещество очень ядовито. Определите тип химической связи в данном соединении.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
resh.edu.ru
Валентность и валентные возможности атомов
Приведенных двух примеров (5-55) и (5-36) достаточно для того, чтобы понять сходство и отличие между идеями метода валентных связей и приближения молекулярных орбиталей. В методе валентных связей для образования нормальных связей необходимо взаимодействие двух наполовину занятых валентных орбиталей. Здесь предполагается, что атом А обладает одним из электронов и обоб-щ,ествляет его с атомом В, который в свою очередь обладает другим электроном и предоставляет возможность атому А воспользоваться также этим электроном. Для сравнения посмотрим, как следует изменить схему 5-35), чтобы она соответствовала методу молекулярных орбиталей [c.159]Исходя из строения ато.ма водорода а) указать возможные валентные состояния и степени окисленности водорода б) описать строение молекулы Hj с позиций методов ВС и МО в) обосновать невозможность образования молекулы Нз. [c.219]
Какое максимальное значение валентности может иметь атом азота Какое максимальное значение степени окисления возможно для этого атома Каковы значения валентности и степени сжисления атома азота в азотной кислоте [c.63]
При затрате энергии атом Ре переходит в валентное состояние й 5р с 6 валентными электронами. Возможно также состояние с 8 валентными электронами. [c.248]
В соответствии с преобладающим типом химической связи в бинарных соединениях реализуются различные кристаллические структуры плотно упакованные ОЦК и другие для металлидов (к.ч. 8, 12 и более), менее плотно упакованные (к.ч. б, 8) для солеобразных ионных кристаллов и «рыхлые» структуры с невысокими координационными числами (к.ч. ковалентных соединений. В последнем случае возможно также образование слоистых, цепочечных и молекулярных кристаллических структур. Изменение типа кристаллической структуры в зависимости от характера химической связи в бинарных соединениях можно проследить в так называемых изоэлектронных рядах. Изоэлектронным рядом называют последовательность соединений с одинаковым средним числом валент ных электронов на атом. Наиболее известны и показательны в этом отношении изоэлектронные ряды соединений, компоненты которых расположены симметрично относительно элементов IVA-группы. Четыре валентных электрона на атом обеспечивают возникновение пространственных тетраэдрических структур с ковалентным типом связи у простых веществ этой группы. [c.258]
Различие в свойствах металлов разных групп периодической таблицы можно описать с помощью зонной теории, Ш,елочные металлы имеют единственный валентный -электрон на атом в совокупности эти электроны заполняют лишь половину состояний в полосе вследствие двух возможных ориентаций спина каждого электрона. Это хорошо соответствует приближению свободных электронов со сферически симметричной поверхностью Ферми. Двухвалентные щелочноземельные металлы обладают двумя валентными [c.45]
Попробуем теперь разобраться, какие химические реакции происходят при выполнении этого опыта. Метаналь (формальдегид) имеет атом кислорода при двойной связи. Этот атом вместе с двумя атомами водорода фенола образует воду. За счет высвобождающихся при этом единиц валентности появляется возможность присоединения молекул фенола к остатку метаналя [c.174]
На рис. 176 дано схематическое изображение тетрадентатного лиганда РАЗ и приведены основные расстояния и валентные углы. Центральный атом Аз(1) имеет почти правильную тетраэдрическую координацию (углы Ки—Аз([)—С с атомами С(1), С(7) и С(13) равны 110°, 114° и 111° соответственно). Валентные утлы при остальных атомах Аз искажены довольно сильно (значения углов Ки—Аз—С лежат в пределах 103—124°, утлы С— Аз—С приведены на рис. 176). Заметно искажены и углы при мостиковых атомах углерода фенильных колец, соединяющих атомы Аз. Благодаря этим искажениям углов в лиганде становится возможной октаэдрическая координация металла. [c.69]
Тетраэдрическое расположение атомов в структуре алмаза и цинковой обманки требует среднего числа валентных электронов на атом, равного четырем. Отсюда, для сложных фаз этой группы, являющихся аналогами элементов четвертой группы, можно сформулировать следующее правило состав их должен быть таким, чтобы среднее число валентных электронов на атом равнялось четырем. Это правило сразу же резко ограничивает число возможных сочетаний элементов различных групп, среди которых следует искать фазы-аналоги четвертой группы. Например, число сочетаний по два элемента из семи различных групп таблицы Менделеева будет равно [c.20]
В насыщенных углеводородах каждый атом углерода использует четыре sp -гибрида для связывания с четырьмя группами, расположенными вокруг него в тетраэдрической конфигурации в ненасыщенных углеводородах имеются по крайней мере два атома углеводорода в состоянии sp — или sp-гибридизации, которые поэтому не используют всех своих валентных возможностей (присоединяют к себе меньше четырех групп). [c.595]
В заключение обзора следует отметить одну общую геометрическую особенность, присущую всем карбонилам и их производным, — нелинейность группировок металл —С—О (по крайней мере в кристаллическом состоянии). Возможны трактовки этого явления как следствия или электронных, или стерическнх эффектов. Кеттл, проанализировав взаимодействие я-орбиталей атома металла с я -орбиталями окиси углерода, пришел к выводу [158], что перекрывание радиальных и тангенциальных компонент я -орбиталей СО-групп с орбиталями атома металла неэквивалентно, следствием чего и является изгиб группировок металл —С—О. Однако, по мнению большинства авторов, существенную роль в наблюдаемом изгибе могут играть и стерические факторы — меж- и внутримолекулярные взаимодействия валентно не связанных ато- [c.211]
Возможность такого процесса становится очевидной из рассмотрения обратного процесса Н + НС -)- I- H, + lg. Действительно, если две валентно-ненасыщенные частицы — атом Н и атом I — подходят к молекуле НС с двух сторон, то они, естественно, будут стремиться перетянуть на себя по одному электрону из связи Н — С , причем их взаимные усилия при выбранном расположении не будут мешать друг другу. Поэтому, если реакция одного атома с молекулой (например, Н+ H l- Ha -f С ) идет с малым активационным барьером, то это тем более будет относиться и к рассматриваемому случаю (Приложение II). Но если это так, то и обратная эндотермическая реакция Н —Н -f I — l—>Н 4- H l -Ь С будет идти с малым активационным барьером (или даже совсем без него). [c.241]
Следовательно, в этих молекулах атому водорода приписывается валентность, равная единице, атому, кислорода — валентность, равная двум. Атомы водорода и кислорода этих рядов, как следует из формул строения, могут образовывать связи О—Н и О—О. На основании постулата, изложенного выше, возможно существование, например, следующих других молекул, содержащих атомы и связи тех же родов [c.52]
При
www.chem21.info