| |||||||||||||
Урок 1. Предмет химии. Вещества и их свойства. Химия как часть естествознания (8 класс)
Урок 1 «Предмет химии. Химия как часть естествознания. Вещества и их свойства. Вводный инструктаж по ТБ».
Тип урока: урок изучения новых знаний (УИНЗ).
Цель урока: создать условия для формирования у учащихся понятий “химия ”, “вещество”, “химический элемент”, “простые вещества ”, “сложные вещества”, “свойства веществ”.
Задачи:
образовательная: сформировать представление о предмете химии. Дать первоначальные понятия о веществе, химическом элементе, о простых и сложных веществах, о трёх формах существования химического элемента.
развивающая: развитие логико — смыслового мышления учащихся, памяти, химического языка, а также умения осуществлять самостоятельную деятельность на уроке.
воспитывающая: воспитывать культуру умственного труда, развивать коммуникативные качества личности.
Форма организации урока: беседа, самостоятельная работа, практическая работа.
Методы и методические приемы: частично-поисковый, исследовательский, проблемный
словесный;
наглядный;
работа с доской;
работа с таблицей;
работа с тетрадью.
Оборудование: компьютер, проектор; гвоздь, колба, линейка.
Реактивы: медь,сера ,алюминий, хром, стакан с водой, магнит, сода, уксусная кислота, гидроксид натрия, фенолфталеин, серная кислота, нитрат бария.
ХОД УРОКА:
1. Организационный этап:
1. Приветствие.
2. Определение отсутствующих.
3. Проверка готовности к уроку.
Учащиеся: Разница очевидна. Чай с кусочком лимона стал светлый.
Учитель: Зажигая спичку, замешивая песок и цемент с водой, обжигая кирпич, мы осуществляем настоящие, а иногда и довольно сложные химические реакции. Что такое химические реакции, какие они бывают, от чего зависит скорость химической реакции, и многое другое вы узнаете на уроках химии. А теперь мысленно вернитесь в седьмой класс на уроки физики и вспомните, что изучает этот предмет.
Учащиеся: Физические тела.
3. Изучение нового материала.
Учитель: Верно. Я вам напомню, что любой предмет, любое живое существо ученые называют телом. Компьютер, книга, дерево, птица, кусок сахара, проволока – это тела. Перечислить все тела невозможно, их существует бесчисленное множество. Все физические тела состоят из веществ. У меня на столе находятся физические тела, можно сказать и проще – предметы. Ответьте мне, пожалуйста, из каких веществ они состоят.
Я вам напомню, что любой предмет, любое живое существо ученые называют телом. Компьютер, книга, дерево, птица, кусок сахара, проволока – это тела. Перечислить все тела невозможно, их существует бесчисленное множество. Все физические тела состоят из веществ. У меня на столе находятся физические тела, можно сказать и проще – предметы. Ответьте мне, пожалуйста, из каких веществ они состоят.
Учащиеся: Гвоздь из железа, колба из стекла, линейка из пластмассы.
Учитель: Так что же такое вещество?
Вещество — это то, из чего состоит физическое тело, вид материи, имеющий массу.
А могут разные тела состоять из одного и того же вещества? Если могут, приведите примеры.
Учащиеся:
Задание 1
Как вы считаете, из каких веществ (горизонтальный столбик) состоят перечисленные в таблице тела (вертикальный столбик)? Напротив верного ответа, в пустую клетку, поставьте звездочку. Сделайте вывод, что такое вещество.
АлюминийВода
Сахар
Золото
Железо
Стекло
Гвоздь
*
Стакан
*
Цепочка
*
Снежинка
*
Карамель
*
Проволока
*
Айсберг
*
При правильном заполнении таблицы вы увидите фигуру, напоминающую ковш.
Учитель: Молодцы.
Учитель сообщает:
Свойства веществ — это признаки , по которым одни вещества отличаются от других.
Из курса физики, учитель вместе с обучающимися вспоминает какими свойствами обладают вещества.
Задание 2
Назовите как можно больше веществ, из которых можно сделать физическое тело- стакан. Назовите как можно больше физических тел, сделанных из стекла, полиэтилена, железа.
ВЫВОД: Из нашей с вами беседы можно сказать, что все вещества отличаются друг от друга по внешним признакам. Эти признаки называются физическими свойствами. Какие свойства называют физическими?
К физическим свойствам относятся:
Агрегатное состояние;
Цвет;
Запах;
Блеск;
Плотность;
Растворимость;
Тепло- и электропроводность;
Твердость;
Пластичность;
Температуры кипения и плавления.
Теперь я продемонстрирую образцы веществ (медь ,серу ,алюминий, хром).
Действие:
а) магнита на железные опилки и на серу,
б) помещаем железные опилки и серу в стакан с водой.
в ) фронтальное обсуждение свойств железных опилок и серы.
Физические свойства веществ изучает физика. У веществ есть еще и химические свойства.
Демонстрация.
сода + уксусная кислота →
гидроксид натрия + фенолфталеин →
серная кислота + нитрат бария →
Вопрос: Что произошло с веществами? Почему вы решили, что вещества прореагировали друг с другом? Какие изменения веществ вы заметили?
Учащиеся: При смешивании веществ мы наблюдали выделение газа, изменение окраски, выпадение осадка. Происходит химическая реакция.
Происходит химическая реакция.
Учитель: Ребята, мы с вами познакомились с некоторыми веществами, посмотрели чудесные превращения этих веществ. А теперь попытайтесь ответить на вопрос: “Что такое химия?” Посмотрите на экран, здесь написано начало определения (химия – это…). Давайте вместе попробуем его закончить.
Учащиеся: Химия – это наука о веществах, их превращениях.
Учитель: Верно. Но более точно определение звучит так: химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Она изучает строение и состав, а также зависимость свойств вещества от состава и строения.
Как вам известно, из курса физики вещества состоят из молекул, а молекулы – из атомов. Атомы чрезвычайно малы и на кончике иглы их может уместиться миллиарды. Тем не менее, наука достигла такого уровня, что различает атомы по размерам, массе и свойствам. В настоящее время различают 110 видов атомом, из которых состоят все вещества. Таким образом: химический элемент – определенный вид атомов.
Каждый химический элемент имеет 3 формы существования: свободные атомы; простые вещества; сложные вещества. Атомы могут существовать изолированно друг от друга в виде свободных атомов, а могут объединяться друг с другом в молекулы. Если объединяются одинаковые атомы, то образуются простые вещества, а если разные – сложные вещества, (упр.6 стр.10)
4. Физкульминутка.
ребятам демонстрируются карточки с изображением атомов разных видов (раздаются несколько одинаковых карточек для возможности создания разных комбинаций простых и сложных веществ):
По команде “Атомы хаос” – атомы двигаются; по команде “простое вещество ” — учащиеся объединяются в группы атомов одного вида; “сложное вещество” – в группы атомов разных видов произвольного количества. Задачу можно усложнить, если конкретизировать количество атомов в простом веществе (два, три) и количество атомов в сложном веществе (два, три и т.д.)
Задачу можно усложнить, если конкретизировать количество атомов в простом веществе (два, три) и количество атомов в сложном веществе (два, три и т.д.)
Учитель: В быту вы тоже не обойдётесь без химических знаний, которые правильно и по назначению помогут вам использовать химические вещества. Иначе можно поплатиться здоровьем (приводятся примеры про ртуть, уксус, стиральные порошки, косметику).
Итак, наш урок подходить к завершению. Настало время подвести итоги.
5. Закрепление изученного материала.
Учитель, предлагает ребятам поиграть:
Называю вещество – дружно хлопаем в ладоши. Называю тело – слушаем в классе тишину.
Например: серьги, медь, гвоздь. соль, стекло, ведро, сода, кастрюля, глюкоза, алюминий)
Вопросы для фронтальной беседы.
Что нового вы узнали сегодня на уроке?
Что называется физическим телом?
Приведите несколько примеров физических тел.
Что такое вещество?
Назовите известные вам вещества.
Что называют химическим элементом?
Какие вещества называют простыми, а какие сложными?
Что изучает химия?
Как мне записать в журнале тему нашего урока?
6. Домашнее задание:
§ 1; упр.3, 8, 9 стр. 10-11.
Выучить определения.
Рефлексия.
В завершение поделитесь своими впечатлениями об уроке. Для этого продолжите предложения, посвященные сегодняшнему дню.
Сегодня я узнал____________________________________________
Я удивился_________________________________________________
Я хотел бы______________________________________________
Разработка урока «Предмет химии.
 Вещества и их свойства» | Презентация к уроку по химии (8 класс) по теме:
Вещества и их свойства» | Презентация к уроку по химии (8 класс) по теме:Слайд 1
ПРЕДМЕТ ХИМИИ. ВЕЩЕСТВА И ИХ СВОЙСТВА 06.02.2017Слайд 2
Что изображено на слайде? Те́ло, или физическое тело — материальный объект, имеющий массу, форму и объём. Задание. Приведите примеры физических тел. зонт будильник лампочка шкатулка очки велосипед мяч глобус 06.02.2017
Слайд 3
Что общего между этими предметами? Все предметы сделаны из одного вещества – фарфора 06.02.2017
Слайд 4
Вещество — это то, из чего состоят физические тела. поваренная соль мрамор стекло древесина графит сахар сера малахит алмаз вода гранит 06.02.2017
Слайд 5
06.02.2017
Слайд 6
Свойства вещества — признаки, по которым вещества отличаются друг от друга или сходны между собой. 06.02.2017
Слайд 7
Химия – наука о веществах, их свойствах и превращениях 06.02.2017
Слайд 8
ИСТОРИЯ РАЗВИТИЯ ХИМИИ У истоков химии Термин » химия » египетского происхождения — в глубокой древности Египет называли Страной Кеми — Черной Землей . Жрецы Древнего Египта были выдающимися мастерами химических ремесел, а химию постепенно стали называть «египетской наукой». За двести лет до нашей эры в Александрии Египетской уже существовала Академия наук, где «священному искусству химии» было отведено особое здание, храм Сераписа — храм жизни, смерти и исцеления. 06.02.2017
Слайд 9
ИСТОРИЯ РАЗВИТИЯ ХИМИИ Химия Средневековья Еще в начале I века нашей эры арабы-химики ввели вместо названия «химия» другое — «алхимия». Европейцы позднее заимствовали это слово у арабов. Полагают, что это слово ближе к понятию «благородная химия», так как алхимию считали «искусством превращения неблагородных металлов (железа, свинца, меди) в благородные» — золото и серебро с помощью особого вещества — «философского камня». Лаборатория алхимика 06.02.2017
Слайд 10
ИСТОРИЯ РАЗВИТИЯ ХИМИИ Химия Средневековья Самый просвещенным из алхимиков своего времени был немецкий епископ Альберт фон Больштедт — Альберт Великий (1193-1280). Он написал Свод правил , где говорилось, что алхимик «должен быть молчаливым и скромным и никому не сообщать результатов своих операций; он должен жить в отдельном от людей доме.» Цель алхимии «Философский камень» « Алкагест » — универсальный растворитель «Эликсир долголетия» 06.02.2017
Он написал Свод правил , где говорилось, что алхимик «должен быть молчаливым и скромным и никому не сообщать результатов своих операций; он должен жить в отдельном от людей доме.» Цель алхимии «Философский камень» « Алкагест » — универсальный растворитель «Эликсир долголетия» 06.02.2017
Слайд 11
ИСТОРИЯ РАЗВИТИЯ ХИМИИ Становление химии как науки Парацельс (1493-1541) «отец медицины» Агрикола (1494-1555) — «отец металлургии» Р. Бойль (1627-1691) «отец современной химии» 06.02.2017
Слайд 12
Михаил Васильевич Ломоносов (1711 – 1756) в 1748 г сформулировал закон сохранения массы веществ ИСТОРИЯ РАЗВИТИЯ ХИМИИ Галерея великих химиков Николай Николаевич Бекетов (1827 – 1911) в 1859 открыл ряд активности металлов Дмитрий Иванович Менделеев (1834 – 1907) в 1869 г. открыл Периодический закон Александр Михайлович Бутлеров ( 1828 — 1886) в 1861 г создал теорию строения органических веществ 06.02.2017
Слайд 13
Химия в народном хозяйстве текстильная промышленность пищевая промышленность товары народного потребления целлюлозно-бумажная промышленность транспортная промышленность фармацевтическая промышленность металлургическая промышленность строительная промышленность сельское хозяйство 06.02.2017
Слайд 14
ЗАДАЧИ ХИМИИ Изучение веществ, их свойств и прогнозирование использования веществ в промышленности, сельском хозяйстве, медицине. Получение различных веществ, необходимых в экономике страны. 06.02.2017
Слайд 15
Задание 1 . Распределите по группам ТЕЛО ВЕЩЕСТВО мяч крахмал уксус сахар ложка свеча стекло чашка резина гвоздь ваза фарфор 06.02.2017
Слайд 16
Задание 2 . Укажите шестое «лишнее» а) снежинка, вода, капля, айсберг, туман, облако; б) алюминий, железо, медь, олово, ртуть, свинец; в) уксус, золото, вода, камень, графит, полиэтилен. проверка а) снежинка, вода , капля, айсберг, туман, облако; б) алюминий, железо, медь, олово, ртуть , свинец; в) уксус, золото, вода, камень , графит, полиэтилен. 06.02.2017
Слайд 17
Задание 3 . О каком веществе – поваренная соль, сода, сахар, лимонная кислота, перец, медный купорос – может идти речь, если оно представляет собой белый кристаллический порошок, который а) хорошо растворяется в воде, имеет сладкий вкус и его применяют в кулинарии; б) хорошо растворяется в воде, имеет соленый вкус и его применяют в кулинарии ; в) не очень хорошо растворяется в воде, имеет кислый вкус и его применяют в кулинарии ; г) хорошо растворяется в воде, по вкусу напоминает мыло и его применяют в кулинарии. проверка САХАР СОЛЬ ЛИМОННАЯ КИСЛОТА 06.02.2017
О каком веществе – поваренная соль, сода, сахар, лимонная кислота, перец, медный купорос – может идти речь, если оно представляет собой белый кристаллический порошок, который а) хорошо растворяется в воде, имеет сладкий вкус и его применяют в кулинарии; б) хорошо растворяется в воде, имеет соленый вкус и его применяют в кулинарии ; в) не очень хорошо растворяется в воде, имеет кислый вкус и его применяют в кулинарии ; г) хорошо растворяется в воде, по вкусу напоминает мыло и его применяют в кулинарии. проверка САХАР СОЛЬ ЛИМОННАЯ КИСЛОТА 06.02.2017
Слайд 18
Задание 4 . Какие свойства ртути используют при ее применении в ртутных термометрах: а) серебристый цвет; б) жидкое состояние при условиях, близких к обычным; в) высокая плотность; г) расширение при повышении температуры ; д) токсичность; е) электропроводность. проверка 06.02.2017
Слайд 19
Задание 5 . По каким признакам – агрегатному состоянию, цвету, запаху, вкусу, действию на соду, воспламеняемости – можно различить воду и а) уксусную кислоту проверка ВОСПЛАМЕНЯЕМОСТЬ ЗАПАХ ДЕЙСТВИЕ НА СОДУ ЗАПАХ ЦВЕТ б) бензин Нельзя пробовать вещества на вкус! 06.02.2017
Слайд 20
Задание 6 . Выберите признаки для следующих веществ: мягкое СТЕКЛО ЗОЛОТО СЕРА твердое пластичное ковкое электропроводное растворимо в воде желтого цвета хрупкое 06.02.2017
Слайд 21
Домашнее задание. § 1, вопросы 1-5 (страница 13). 3-5 вопросы – письменно, в тетради
Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида. Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, образец практически чистой воды бесцветный, без вкуса и запаха, имеет температуру кристаллизации \(0\) °С, температуру кипения \(+100\) °С, плотность при температуре \(+4\) °С равную \(1000\) кг/м³ и не проводит электрический ток.
Чистые вещества: кислород, дистиллированная вода, рафинированный сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Свойства веществ — Справочник химика 21
Горючесть — свойство вещества, определяющее его способность к самостоятельному горению и зависящее от параметров состояния системы вещество — окислительная среда (температуры, давления, объема), а также от агрегатного состояния вещества (степени измельчения) и окислительной среды. По горючести вещества подразделяются на три группы негорючие — вещества, неспособные к горению в воздухе нормального состава (негорючие вещества могут быть пожароопасными) трудно-горючие — вещества, способные загораться под действием источ- [c.9]Твердые растворы замещения образуются в том случае, если кристаллические решетки компонентов однотипны и размеры частиц компонентов близки. Необходимым условием образования твердых растворов является также и известная близость химических свойств веществ (одинаковый тип химической связи). Так, в кристалле КС1 ионы хлора могут быть постепенно замещены ионами брома, т. е. можно осуществить практически непрерывный переход вещества от состава КС1 к составу КВг без заметного изменения устойчивости кристаллической решетки. Свойства образующихся твердых растворов непрерывно меняются от КС1 к КВг. Ниже приведены примеры ионных, атомных, молекулярных и металлических твердых растворов замещения. [c.134]
Физико-химические свойства веществ, как известно, определяют выбор методов исследования и влияют на величину ПДК они важны и при разработке методов очистки газовых выбросов и сточных вод. Поэтому контролируемые показатели сгруппированы отдельно для неорганических и для органических соединений, как это принято в химических справочниках. Всего охвачено примерно [c.7]
Поэтому контролируемые показатели сгруппированы отдельно для неорганических и для органических соединений, как это принято в химических справочниках. Всего охвачено примерно [c.7]
Метиловый спирт отличается от метана только тем, чТо один атом водорода в его молекуле соединен не непосредственно с углеродом, а через кислород, это сочетание О—Н называется гидроксильной группой. Но как от этого лишнего атома кислорода меняются свойства вещества [c.85]
Физические методы разделения основаны на различии физических свойств веществ, например на различии температур кипения, плавления и замерзания, на различной растворимости, на различии адсорбируемости и пр. Из физических методов применяют разделение фракционированной перегонкой, вымораживанием методами абсорбции и адсорбции н пр. [c.246]
Дипольные моменты молекул. Многие физико-химические свойства вещества зависят от так называемых дипольных моментов [c.64]
Основные и кислотные свойства веществ представляют собой лишь две стороны единого процесса основно-кислотного взаимодействия. Кислотные свойства веществ проявляются лишь при взаимодействии с веществами, проявляющими основные свойства, и наоборот. Вещества, проявляющие и основные и кислотные свойства (т. е. способность быть и донорами и акцепторами электронных пар), называются амфотерными. Как видно из приведенных примеров, жидкие НаО, НзЫ и НЫОз как раз и являются амфотерными соединениями. [c.122]
Но есть и непредельные жирные кислоты. К ним принадлежит самая распространенная из жирных кислот — олеиновая. В ее молекуле тоже 18 атомов углс рода, но в самой середине ее цепи находится одна двойная связь. И эта-то единственная двойная связь заметно меняет свойства вещества. Если стеариновая кислота плавится при 69 С и при комнатной температуре представляет собой твердое тело, олеиновая кислота плавится при 13 С и в теплые летние дни представляет собой жидкость. [c.160]
[c.160]
Некоторые продукты, такие, как лаковые красители, в сухом виде способны самовозгораться при температуре около 100 °С вследствие самоокисления. Эти продукты могут самовоспламеняться при контакте с воздухом (при открытой их выгрузке из сушиЛок в нагретом состоянии). Взрыву пыли органических материалов могут способствовать газообразные продукты, выделяющиеся при перегреве или передержке в зоне высоких температур высушиваемых материалов. В то же время повышение температуры сушки в значительной мере позволяет ускорить процесс сушки, сделать его более экономичным. Однако при решении вопросов интенсификации сушильных процессов не следует увеличивать температуру сушки до близкой к температуре плавления, возгонки и тем более теплового разложения высушиваемого материала. Поэтому предельную температуру сушки выбирают в каждом конкретном случае в зависимости от стойкости материала к нагреванию. Однако предельная температура сушки зависит не только от физико-химических свойств веществ. [c.149]
Одной из главных задач химической кинетики является установление связи менаду строением веществ и их реакционной способностью. Это предусматривает возможность расчета констант скоростей реакций на основе знания молекулярных свойств веществ. [c.523]
Когда два атома сталкиваются и вступают в реакцию, они или соединяются вместе, обобществляя свои электроны, или же вновь расходятся после перераспределения электронов. Именно это обобществление или перераспределение электронов и вызывает изменение свойств веществ, наблюдаемое при проведении химических реакций. [c.157]
Длины и энергии связи, валентные углы, а также экспериментально определяемые магнитные, оптические, электрические и другие свойства веществ непосредственно зависят от характера распределения электронной плотности. Окончательное заключение о строении вещества делают после сопоставления информации, полученной разными методами. Квантовомеханическая теория химической связи обобщает совокупность экспериментально полученных данных о строении вещества. [c.43]
Квантовомеханическая теория химической связи обобщает совокупность экспериментально полученных данных о строении вещества. [c.43]
Связь между поляризацией и свойствами веществ, участвующих в реакциях электрохимического восстановления и окисления [c.430]
Учение о химической связи — центральная проблема современной химии. Не зная природу взаимодействия атомов в веществе, нельзя понять причины многообразия химических соединений, представить механизм их образования, их состав, строение и реакционную способность. Создание надежной модели, отражающей строение атомов, молекул и природу сил между ними, позволит рассчитать свойства веществ, не прибегая к эксперименту. [c.41]
Чем глубже и подробнее мы знаем свойства вещества и его строение, тем увереннее может действовать химик в своих синтезах. [c.158]
Отнесение того или иного вещества к соединениям постоянного или переменного состава зависит от чувствительности методов его исследования. Часто отклонения от стехиометрического состава так невелики, что при химическом анализе их установить не удается. Однако исследование свойств веществ, например электрической проводимости, окраски, магнитных и других свойств, вынуждает признать наличие переменного состава. Наиболее широко распространены соединения переменного состава -элементов. [c.262]
Физические свойства вещества зависят от рода, числа и последовательности расположения атомов, из которых состоит молекула, и, следовательно, от массы, объема и формы молекул, типа связей между атомами в молекуле, а также от характера и величины межмолекулярных сил. Иногда, в тех случаях, когда один или два из указанных факторов оказывают решающее влияние на интересующее нас свойство вещества, можно найти приближенные, не очень сложные зависимости между свойствами молекул и свойством вещества и на этой основе предварительно оценить значение требуемой физико-химической величины. [c.63]
[c.63]
Таким образом отбирается базовая система, состоящая из наиболее характерных (с производственно-технической точки зрения) свойств вещества. Эта проблема относится к термодинамике и здесь может привести лишь к рассмотрению новых аспектов известных термодинамических законов. Другими словами, поставленные выше вопросы можно выразить следующим образом какое количество данных необходимо и достаточно для однозначного описания состояния гомогенной фазы В рассматриваемом нами случае условие гомогенности фазы означает инвариантность [c.26]
Наконец, безразмерные величины можно образовать как отношение двух безразмерных комплексов. Такие безразмерные величины выражают только постоянные свойства вещества и независимы от принятой системы единиц измерения. [c.81]
В качестве переменных гидродинамического, теплового и химического подобия можно выбрать безразмерные величины из табл. 8-10, причем выражения, приведенные в первых трех ее столбцах, указывают также на число степеней свободы. Свойства вещества для потоков компонента, теплоты (энтальпии) и импульса (количества движения) р, Ср, к, т], а, р, V, АЯ в модели и промышленном аппарате должны быть одинаковыми. В этом случае равенство независимых безразмерных величин для них в соответствии с определением (7-6) указать легче. В целях дальнейшего упрощения можно пренебречь перепадом давления Ар, так как он часто бывает сравнительно небольшим. При этом число основных переменных в последней строке табл. 8-10 уменьшится на единицу вследствие того, что А и We 0. Упрощается и равенство критериев Ке [c.230]
Так, при турбулентном режиме течения жидкости (газа) перенос вещества в потоке начинает определяться беспорядочными турбулентными пульсациями ( вихрями ) и интенсивность перемешивания характеризуется некоторым коэффициентом турбулентной диффузии Отурб. Его значение не зависит непосредственно от физических свойств вещества потока [6, стр.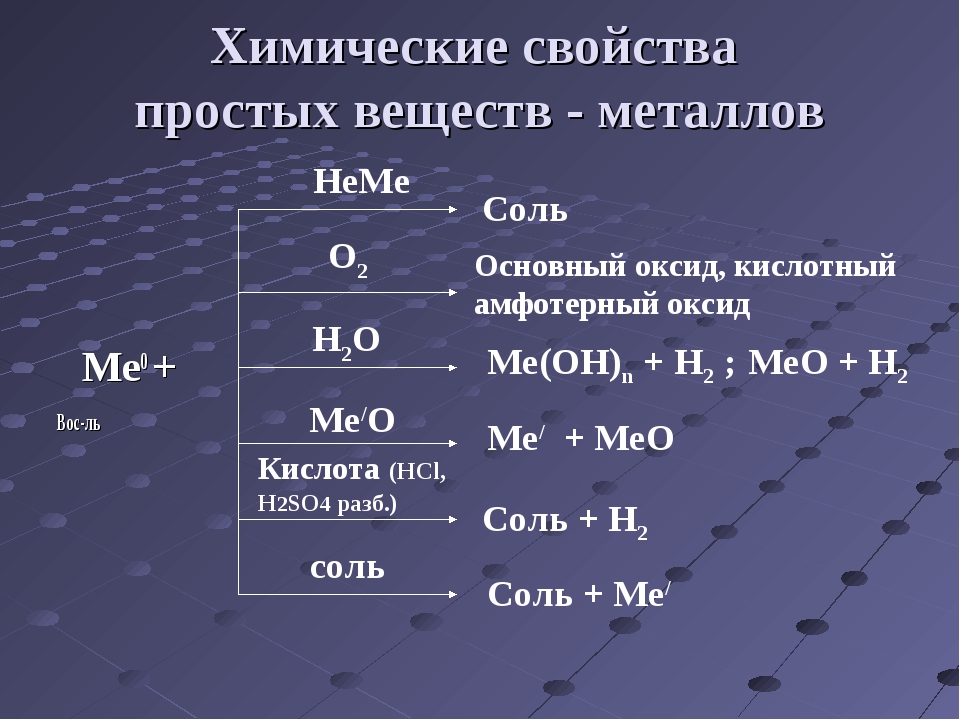 149] и является функцией его средней скорости й и характерного линейного размера L, т. е. [c.87]
149] и является функцией его средней скорости й и характерного линейного размера L, т. е. [c.87]
При подробном изучении аварий по стадиям их развития установлено, что время от начала возникновения аварии до завершающего взрыва колеблется в широких пределах и зависит от скорости образования взрывоопасной смеси, физико-химических и взрывоопасных свойств вещества, а также от наличия источника инициирования и мощности импульса. Большинство аварий (около 75%) сопровождается локальными хлопками в течение 10—20 мин и развивается во времени, достаточном для предупреждения взрывов. Известны случаи, когда вследствие коррозии металла или по другим причинам взрывоопасные газы проникали в помещение в незначительном количестве. Однако отсутствие необходимых средств автоматического контроля степени загазованности и неэффективность противоаварийной вентиляции не позволяли избежать образования взрывоопасной смеси. [c.256]
Определение некоторых физико-химических свойств вещества при известных значениях ог и е. Использовать при проведении технических расчетов точные методы, основанные на принципах статистической механики, очень трудно. Поэтому Гиршфельдер и его сотрудники предложили ввести в уравнения для определения физико-химических постоянных вещества функции от а и е, значения которых они рассчитали и свели в таблицы (см., например, табл. IV 5), исключив тем самым необходимость частого выполнения сложных вычислений. [c.72]
Допустимая максимальная температура поверхности оборудования определяется в зависимости от конкретных условий и свойств веществ, подверженных воздействию тепловой радиации факела. гг [c.234]
Строение и размеры молекул органических соединений. Размеры и строение молекул оказывают большое влияние на некоторые термокинетические свойства веществ (например, на вязкость жидкости). [c.63]
Химикам XVIII в. эта проблема не казалась столь важной, как это представляется нам теперь. Мы привыкли к тщательному анализу явлений, и необъяснимое изменение веса, конечно, взволновало бы нас. Химики же XVIII столетия еще не сознавали важности точных измерений, и изменением в весе они могли и пренебречь. Теория флогистона объясняла причины изменения внешнего вида и свойств веществ, а изменения веса, как в то время считалось, не так уж важны [c.38]
Мы привыкли к тщательному анализу явлений, и необъяснимое изменение веса, конечно, взволновало бы нас. Химики же XVIII столетия еще не сознавали важности точных измерений, и изменением в весе они могли и пренебречь. Теория флогистона объясняла причины изменения внешнего вида и свойств веществ, а изменения веса, как в то время считалось, не так уж важны [c.38]
Предлагаемая читателю книга написана известным американским ученым, писателем-фантастом и популяризатором науки. Рассказывая о соединениях углерода от самых простых до сложных — полимерных, автор вводит читателя в мир органической химии, знакомит со свойствами веществ, зависимостью в0Йст -ет оетава и строения молекул, о роли этих веществ в природе, жизнедеятельности живых организмов, а также о применении веществ в технике и быту. Автор ведет рассказ увлекательно, читается книга очень легко. [c.4]
Форма выделяющегося осадка зависит от индивидуальных свойств веществ. Например, полярные, сравнительно хорошо растворимые вещества (Ва504, АдС1, РЬЗО и т. п.) выпадают в кристаллическом состоянии. [c.99]
Но та или иная форма осадка не только связана с индивидуальными свойствами вещества, но и зависит от условий осаждения. Например, при осаждении из разбавленных водных растворов Ва504 выпадает в виде кристаллического осадка. Если, однако, осаждать его из смеси воды с 50—60% спирта, сильно понижающего растворимость сульфата бария, то образуется коллоидный раствор или аморфный осадок. С другой стороны, осаждая сульфиды в присутствии пиридина СбН5Ы, получают некоторые из них в виде кристаллов. Можно считать экспериментально [c.99]
Все это весьма забавно, если забыть о цене, которую платит человечество за несовершенство технологии творчества, основанной на методе проб и ошибок. Александр Флеминг, первооткрыватель пенициллина, считал, что антибактериальные свойства веществ, содержащихся в плесени, могли быть обнаружены и использованы на 20 лет раньще — это сохранило бы минимум 20 миллионов человеческих жизней. Многие наталкивались на факт антибактериального действия плесени, но сделать открытие мешала психологическая инерция (не было озаре 1Ия…) плесень и лекарство казались несовместимыми понятиями. [c.111]
Многие наталкивались на факт антибактериального действия плесени, но сделать открытие мешала психологическая инерция (не было озаре 1Ия…) плесень и лекарство казались несовместимыми понятиями. [c.111]
При высоких и сверхвысоких давлениях изменяются физические свойства веществ. Так, в ряде случаев вещества, которые при обычных давлениях являются изоляторами (например, сера), при сверхвысоком давлении становятся полупроводниками. Полупроводники же при 2- 10 —5- 10 Па могут переходить в металлическое состояние. Подобные переходь[ изучены у теллура, иода, фосфора, ряда соединений. Расчеты показывают, что дальнейшее повышение давления металлизует все вещества. Интересные превращения претерпевает иттербий (УЬ), При давлении до 2- 10 Па иттербий — металл, при 2-Ю —4-10 Па — полупроводник, выше 4-10 Па— нова металл. [c.124]
Физическими свойствами веществ являются удельные объемы, упругости, температуры, соаержание тех или иных составляющих и т. д. Их называют параметрами состояния тела, так как [c.5]
Поглощение звука определяет воздействие на свойства вещества на субстанциональном уровне [361, 375]. Взаимодействие звука с веществом имеет своим продуктом то же вещество, но с заметно измененными свойствами. Это изменение происходит под действием температурной, концентрационной и гидродинамической нелинейностей [221]. Причина нелинейных эффектов заключается в перераспределении энергии меж у внеишими (поступательными и вращательными) и внутренними (колебательными) степенями свободы молекул (кнезеровский эффект) [361]. [c.49]
См. также Теплофизические свойства веществ , справоч ник под ред. Проф. Н. Б. Варгафтика, Госэнергоиздат, 1956. — Прим. ред. [c.23]
Взрывопожароопасность производств оценивают в соответствии со СНиП П-90—81 [47], исходя из количества применяемого в конкретно рассматриваемых условиях горючего вещества, его свойств, размеров помещений, в которых размещены проив-водства, а также возможности образования взрывоопасных па-ро-, газо- или пылевоздушных смесей в локальном объеме, превышающем 5% объема помещений.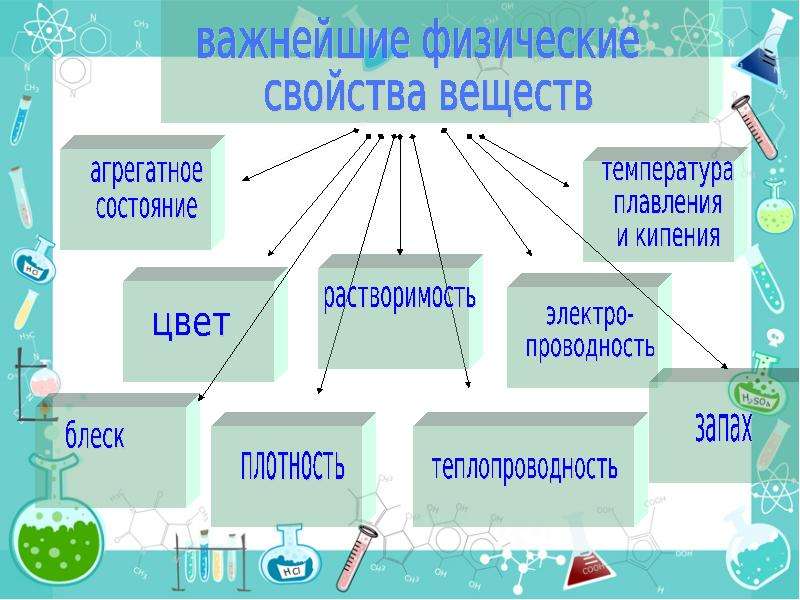 Исходя из свойств веществ и условий их применения или обработки, производства и склады по взрывопожароопасности подразделяют на шесть категорий (СНиП П-90—81). [c.22]
Исходя из свойств веществ и условий их применения или обработки, производства и склады по взрывопожароопасности подразделяют на шесть категорий (СНиП П-90—81). [c.22]
IA. Идеальный газ. Согласно этой модели, молекула представляет собой точечную (безразмерную) частицу, имеющую массу, равную молекулярному весу такая частица не оказывает никакого воздействия на другие молекулы и способна к идеально упругим столкновениям со стенками сосуда, в котором заключен газ. Будет ли эта модель достаточно хоро1по oпи J.I-вать свойства вещества, зависит от выбранного свойства и экспериментальных условий. Так, модель достаточно хорошо передает связь между давлением, объемом и температурой газа в тех условиях, когда среднее расстояние между молекулами велико по сравнению с их диаметрами и температура далека от точки конденсации. Но очевидно, что с помощью такой модели нельзя получить никаких сведений о деталях столкновени между молекулами. [c.126]
Для обоснования ПДКр. з необходимы следующие сведения и экспериментальные данные 1) об условиях производства и применения вещества и о его агрегатном состоянии при поступлении в воздух 2) о химическом строении и физико-химических свойствах вещества (формула, молекулярная масса, плотность, точки плавления и кипения, давление паров при 20°С и насыщающей концентрации, химическая стойкость — гидролиз, окисление и др. растворимость в воде, жирах и других средах, растворимость газов Б воде, показатель преломления, поверхностное натяжение энергия разрыва связей) 3) о токсичности и характере действия химических соединений при однократном воздействии на организм. [c.12]
Формулы для расчета ВДК химических соединений в воздушной среде рабочей зоны выведены методом регрессионного анализа. Узаконенные ПДКр. з сопоставлялись с различными показателями токсичности и физико-химических свойств веществ. [c.29]
Двойной электрический слой о-казывает большое влияние на физические (электрические) и химические свойства поверхности деталей двигателей и механизмов. В частности, под его воздействием изменяется работа выхода электрона через по-верхвость раздела фаз. С другой стороны, двойной слой определяет способность электронов участвовать в реакции, а значит, от него зависят и химические свойства вещества [205]. [c.185]
В частности, под его воздействием изменяется работа выхода электрона через по-верхвость раздела фаз. С другой стороны, двойной слой определяет способность электронов участвовать в реакции, а значит, от него зависят и химические свойства вещества [205]. [c.185]
Открытое образование — Как химия объясняет и изменяет окружающий мир
Курс лекций даёт первоначальное представление о химии и её роли в жизни человека и общества. Он состоит из двух частей. Первая из них рассказывает о том, как химия объясняет окружающий мир: как устроены вещества, почему и как идут химические реакции, какие вещества определяют свойства живых систем. Вторая часть посвящена прикладным аспектам химии: она показывает, как химия влияет на жизнь общества и улучшает повседневную жизнь людей. В ней рассказывается о ценных продуктах химической промышленности, химических способах производства энергии и новых материалах, новых веществах, используемых в быту, современных стёклах, пигментах и красках.
About
Цели изучения курса
- Дать слушателям представление об основных понятиях химии и задачах, которые решает эта наука, научить их пользоваться химическим языком.
- Рассказать о химической картине мира: строении веществ, особенностях химических реакций и свойствах живых систем.
- Показать прикладные возможности химии, объяснить её роль в жизни общества и повседневной жизни людей.
Задачи курса:
- Рассказать о мире веществ и их превращений, основных понятиях химии, химическом языке и великих химических открытиях.
- Дать представление о том, как устроены вещества разной природы и частицы, из которых они состоят. Показать, как строение веществ влияет на их свойства.
- Раскрыть суть химических явлений. Определить факторы, определяющие направление и скорость химических превращений. Объяснить явление катализа и показать его роль в химии.

- Описать химическую природу живых систем. Рассказать о важнейших органических веществах в составе живых организмов и о том, какие функции они выполняют.
- Дать представление о химической промышленности, её масштабах и крупнейших химических производствах. Показать возможность создания безопасных химических производств.
- Объяснить суть химической формы энергии и показать роль химии в решении энергетических проблем человечества.
- Дать представление о современных синтетических материалах на примере полимеров и композитов, описать их свойства и применение.
- Рассказать о важнейших веществах и материалах, используемых в повседневной жизни людей.
Format
Форма обучения заочная (дистанционная)
Еженедельные занятия будут включать просмотр тематических видеолекций и выполнение тестовых заданий с автоматизированной проверкой результатов и творческих заданий с последующим обсуждением на форуме.
Requirements
Курс является общеобразовательным, не требует специальной подготовки и рассчитан на широкую аудиторию слушателей, в первую очередь студентов нехимических вузов и факультетов и людей, уже получивших высшее образование, но желающих больше узнать об окружающем мире и повысить свой общенаучный уровень. Он будет полезен учителям, желающим повысить свою квалификацию, а также различным категориям слушателей, не связанным с наукой и образованием.
Рабочий язык курса: русский.
Course program
Курс состоит из 10 лекций.
Часть I. Как химия объясняет мир
1. Химия как наука. Основные понятия и законы химии. Великие химические открытия
1. Химия как наука.
2. Основные понятия химии: вещество, химический элемент, молекула, валентность, химическая реакция.
3. Язык химии: химические формулы, названия веществ, уравнения реакций.
4. Великие химические открытия: открытие атомов и молекул, Периодический закон, молекулярные формы углерода.
2. От атомов к молекулам. Как устроены молекулы
1. Что такое молекула?
2. Почему молекулы образуются из атомов? Ковалентная связь.
3. Какие бывают связи? Характеристики ковалентной связи.
4. Геометрия молекул.
3. От молекул к веществу. Газы, жидкости, твердые вещества
1. Связи между молекулами.
2. Газы.
3. Жидкости.
4. Твердые вещества.
5. Агрегатные состояния вещества. Фазовые диаграммы.
6. Мифы и заблуждения о воде.
4. Почему и как происходят химические реакции.
Направление, скорость и время реакций. Катализ в химии
1. Физические и химические явления.
2. Почему что-то меняется? Когда изменения будут необратимыми? 2-й закон термодинамики. Энтропия и информация.
3. Почему и в какую сторону идут химические реакции? Химическое равновесие.
4. Время в химии. Скорость химических реакций. От чего и как она зависит?
5. Катализ в химии и в жизни.
5. Химия и жизнь
1. Химический состав живых организмов.
2. Аминокислоты и белки.
3. Нуклеиновые кислоты.
3. Углеводы: моно-, олиго- и полисахариды.
4. Жиры и липиды.
5. Как на Земле появились сложные молекулы?
Часть II. Как химия изменяет мир
а) Химия на службе общества
6. Химическая промышленность – опасная и безопасная.
Зеленая химия
1. Общие сведения о химической промышленности. Природные источники неорганических и органических веществ.
2. Научные принципы организации химического производства. Производство неорганических и органических веществ.
3. Переработка нефти: физические и химические процессы.
4. Безопасная химическая промышленность. Принципы «зеленой химии».
Принципы «зеленой химии».
7. Химическая энергия (химические источники тока, углеводороды)
1. Энергия и ее формы. Закон сохранения энергии.
2. Энергетические проблемы человечества.
3. Энергия химических связей (химическая энергия).
4. Преобразование химической энергии.
5. Водородные топливные элементы. Водород как основа энергетики будущего.
8. Современные материалы. Полимеры и композиты
1. Основные классы полимерных материалов.
2. Пластики.
3. Каучуки и резины.
4. Волокна.
5. Композиты.
6. «Умные» материалы.
б) Химия в повседневной жизни
9. Бытовая химия
1. Моющие средства.
2. Удобрения.
3. Неорганические пигменты и краски.
4. Органические красители.
10. Традиционные материалы – стекло и керамика
1. Кварц и кварцевое стекло.
2. Силикатные стекла.
3. Органические стекла.
4. Керамика.
Education results
По итогам обучения слушатели курсов должны:
знать/понимать
- основные химические понятия: вещество, элемент, молекула, валентность, реакция;
- основные законы химии: закон сохранения массы веществ, периодический закон;
- основы атомно-молекулярной теории;
- язык химии – формулы веществ и уравнения реакций;
- принципы образования химических связей: между атомами в молекулах и между молекулами в веществах;
- движущие силы химических реакций и факторы, влияющие на направление и скорость реакций;
- важнейшие классы биологически активных веществ и их функции;
- научные принципы организации химического производства и способы управления промышленными процессами;
- важнейшие виды сырья для химической промышленности и способы его переработки в полезные вещества;
- химические способы производства энергии;
- вещества и материалы, широко используемые в промышленности: пластмассы, каучуки, синтетические волокна, композитные материалы;
- вещества и материалы, широко используемые в повседневной жизни: стекло, керамика, мыла и моющие средства, красители природные и синтетические;
- глобальные проблемы, стоящие перед человечеством: экологические, энергетические, сырьевые и роль химии в решении этих проблем.

уметь
- составлять формулы химических соединений и уравнения химических реакций;
- определять элементный состав соединения по химической формуле;
- объяснять зависимость свойств веществ от их состава и строения; природу химической связи;
- определять направление протекания химических реакций в различных условиях;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- представления перспективных направлений развития химических технологий;
- критической оценки достоверности химической информации, поступающей из разных источников.
Классификация химических веществ, продукции и материалов. Классы и признаки опасности химических веществ и продукции
Классификация опасности химических веществ и продукции по ГОСТ 12.1.007-76
ГОСТ 12.1.007-76 Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности — национальный стандарт используемый на территории РФ. Класс опасности химической продукции и веществ устанавливается в соответствии с нормами и показателями согласно таблицы (пункт 1.2). Отнесение химической продукции и веществ к определенному классу опасности производится по показателю, значение которого соответствует наиболее высокому классу опасности. По степени воздействия на организм химическая продукция и вещества подразделяют на 4 класса опасности:
1 класс опасности — Чрезвычайно опасная по степени воздействия на организм продукция, в соответствии с ГОСТ 12. 1.007-76;
1.007-76;
2 класс опасности — Высокоопасная по степени воздействия на организм продукция, в соответствии с ГОСТ 12.1.007-76;
3 класс опасности — Умерено опасная по степени воздействия на организм продукция, в соответствии с ГОСТ 12.1.007-76;
4 класс опасности — Малоопасная по степени воздействия на организм продукция, в соответствии с ГОСТ 12.1.007-76;
Безопасная продукция — Не классифицируется как опасная продукция по степени воздействия на организм, в соответствии с ГОСТ 12.1.007-76 (данное определение отсутствует в ГОСТ, но имеет место быть).
Классификация опасности химических веществ и продукции по СГС
Согласованная на глобальном уровне система классификации и маркировки химических веществ (СГС/GHS) — это система классификации и маркировки химических веществ и смесей, созданная ООН с целью приведения к единому стандарту различных национальных и региональных критериев оценки опасности веществ, а также систем маркировки и сообщений об опасности, так же СГС называют «фиолетовая книга». СГС впервые введен в 2003 году и перерабатывается каждые 2 года. В качестве основы для разработки СГС были использованы следующие классификации опасности химических веществ и продукции:
— требования, действующие в Соединенных Штатах Америки в сфере производства, потребления и использования пестицидов;
— требования. действующие в Канаде в сфере производства, потребления и использования пестицидов;
— директивы Европейского союза в отношении квалификации опасности и маркировки веществ и препаратов;
— Рекомендации Организации Объединенных Наций по перевозке опасных грузов.
Обращаем Ваше внимание, что на территории РФ приняты и действуют ГОСТ по классификации опасности химической продукции, разработанные на основании СГС:
— ГОСТ 32419-2013 Классификация опасности химической продукции.
Общие требования;
— ГОСТ 32423-2013 Классификация опасности смесевой химической продукции по воздействию на организм;
— ГОСТ 32424-2013 Классификация опасности химической продукции по воздействию на окружающую среду. Основные положения;
— ГОСТ 32425-2013 Классификация опасности смесевой химической продукции по воздействию на окружающую среду;
— ГОСТ 31340-2013 Предупредительная маркировка химической продукции. Общие требования.
СГС позволяет провести классификацию веществ по факторам опасности, основанную на известных данных об опасных свойствах химических веществ и смесей, которые можно найти в классификаторах. В сложных случаях учитываются надёжные эпидемиологические данные и данные о действии веществ на людей, а в случае смесей, для которых достоверные данные испытаний могут отсутствовать, применяется метод интерполяции свойств компонентов этих смесей. Одной из целей СГС является обеспечение её прозрачности и простоты восприятия, в частности, предполагается возможность самостоятельной классификации химических веществ. Для облегчения этой задачи для некоторых критериев опасности приводятся блок-схемы принятия решений по классификации. Опасности подразделяются на 3 (три) вида: физические опасности, опасности для здоровья человека и опасности для окружающей среды:
| Физические опасности: | Опасности для здоровья человека: | Опасности для окружающей среды: |
|---|---|---|
|
— взрывчатые вещества; — воспламеняющиеся газы; — аэрозоли; — окисляющие газы; — газы под давлением; — воспламеняющиеся жидкости; — воспламеняющиеся твердые вещества; — саморазлагающиеся вещества и смеси; — пирофорные жидкости; — пирофорные твердые вещества; — самонагревающиеся вещества и смеси; — вещества и смеси, выделяющие воспламеняющиеся газы при контакте с водой; — окисляющие жидкости; — окисляющие твердые вещества; — органические пероксиды; — вещества, вызывающие коррозию металлов; — десенсибилизированные взрывчатые вещества.  |
— острая токсичность; — разъедание/раздражение кожи; — серьезное повреждение/раздражение глаз; — респираторная или кожная сенсибилизация; — мутагенность зародышевых клеток; — канцерогенность; — репродуктивная токсичность; — специфическая избирательная токсичность, поражающая отдельные органы-мишени при однократном воздействии; — специфическая избирательная токсичность, поражающая отдельные органы-мишени при многократном воздействии; — опасность при аспирации. |
— опасности для водной среды; — опасности для озонового слоя. |
Методы классификации химических веществ и продукции
Экспериментальный метод — лежит в основе определения токсикологических свойств веществ и признаков опасности продукции. Оценка токсичности производится на основе исследования в отношении животных или тест-культур. Все остальные опасности вещества или продукции, так же оцениваются экспериментальным методом. Данный метод применяется редко, ввиду высокой стоимости и трудоемкости. Как правило экспериментальным методом исследуют только опасности интересующие конкретного производителя или потребителя, при этом не исследованные показатели опасности указываются согласно справочников и баз данных.
Наиболее часто используемый экспериментальный метод в отношении продукции, это токсиколого-гигиенические испытания. В результате данных испытаний определяется класс опасности продукции согласно ГОСТ 12.1.007-76. Данный метод используют в случаях, когда класс опасности полученный расчетным методом не оправдывает ожидания, а здравый ум подсказывает что вероятнее всего класс опасности ниже.
Расчетный метод — основан на базе данных о токсикологических свойствах веществ в сочетании с достаточно полным аналитическим исследованием объекта и признаков опасности.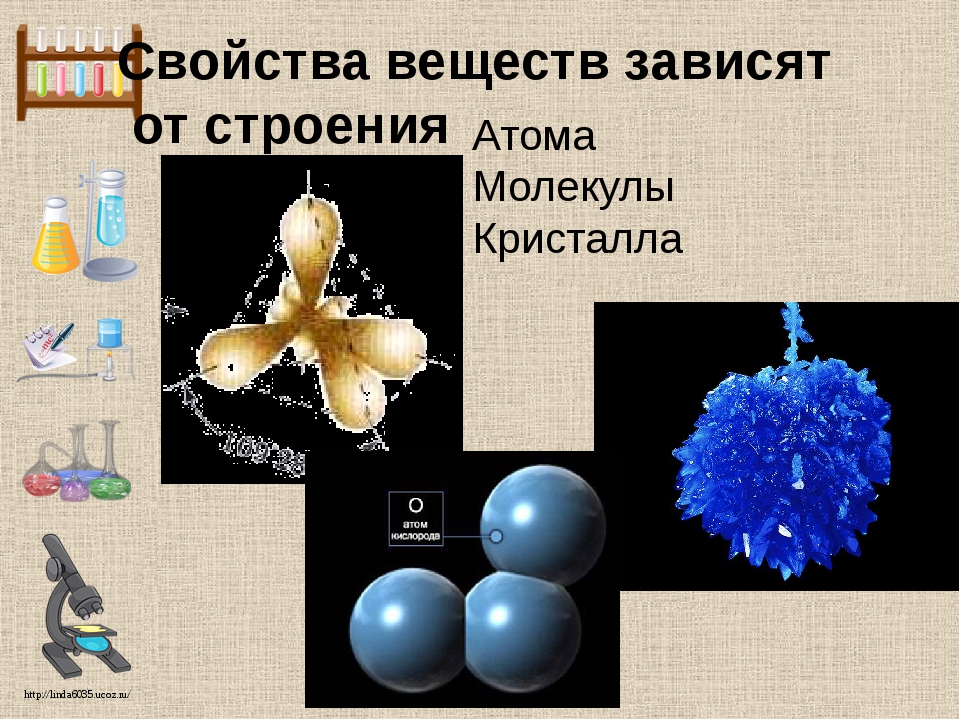 При применении оценке продукции расчетным методом не учитывается целый ряд факторов, которые учитываются при использовании экспериментального метода. Расчетный метод не дает полноценной и всесторонней оценки конкретного вещества или продукции, в отличие от экспериментального метода. Так же стоит учитывать, что данные содержащиеся в базах и каталогах имеют свойство устаревать и не обновляться, но при этом расчет класса опасности и определение признаков опасности можно осуществлять по ним.
При применении оценке продукции расчетным методом не учитывается целый ряд факторов, которые учитываются при использовании экспериментального метода. Расчетный метод не дает полноценной и всесторонней оценки конкретного вещества или продукции, в отличие от экспериментального метода. Так же стоит учитывать, что данные содержащиеся в базах и каталогах имеют свойство устаревать и не обновляться, но при этом расчет класса опасности и определение признаков опасности можно осуществлять по ним.
В связи с дешевизной и низкой трудоемкостью, расчетный метод широко используется для оценки токсичности и опасности химической продукции, а так же при разработке паспортов безопасности химической продукции.
Резюме: экспериментальные данные имеет приоритет над справочными данными.
Классификация и паспорт безопасности химической продукции
Классификация опасности химической продукции и веществ ключевая составляющая при разработке паспорта безопасности химической продукции. Класс опасности и признаки опасности химической продукции указываются на титульном листе и в разделе 2.1 паспорта безопасности. Так же на основании класса опасности и признаков опасности заполняются иные разделы паспорта. К классификации химической продукции необходимо подходить ответственно и всесторонне изучить имеющуюся литературу и справочники по веществам входящим в состав продукции.
При разработке паспорта безопасности химической продукции допускается использовать данные полученные экспериментальным и расчетным методом. Данные полученные экспериментальным методом можно использовать, только если эти данные получены в аккредитованных испытательных лабораториях и оформленных надлежащим образом (Пример: Экспертное заключение ФГБУЗ Центра гигиены и эпидемиологии полученное с целью определения класса опасности).
Физические и химические свойства | Химия для майоров
Результаты обучения
- Определять свойства и изменения вещества как физические или химические
- Определять свойства вещества как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами. Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными противоугонными бирками) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными противоугонными бирками) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Рисунок 1.(а) Воск претерпевает физические изменения при нагревании твердого воска и образует жидкий воск. (б) Конденсация пара внутри кастрюли — это физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит а: модификация работы «95jb14» / Wikimedia Commons; кредит б: модификация работы «mjneuby» / Flickr)
Изменение одного типа вещества в другой (или невозможность изменения) — это химическое свойство . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания.Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 2. (a) Одно из химических свойств железа — ржавчина; (б) одно из химических свойств хрома состоит в том, что это не так. (кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)
Химическое изменение всегда производит один или несколько типов вещества, которые отличаются от вещества, присутствовавшего до изменения.Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рис. 3. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ.(Фото b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи делятся на две категории. Если свойство зависит от количества присутствующего вещества, это обширное свойство . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества.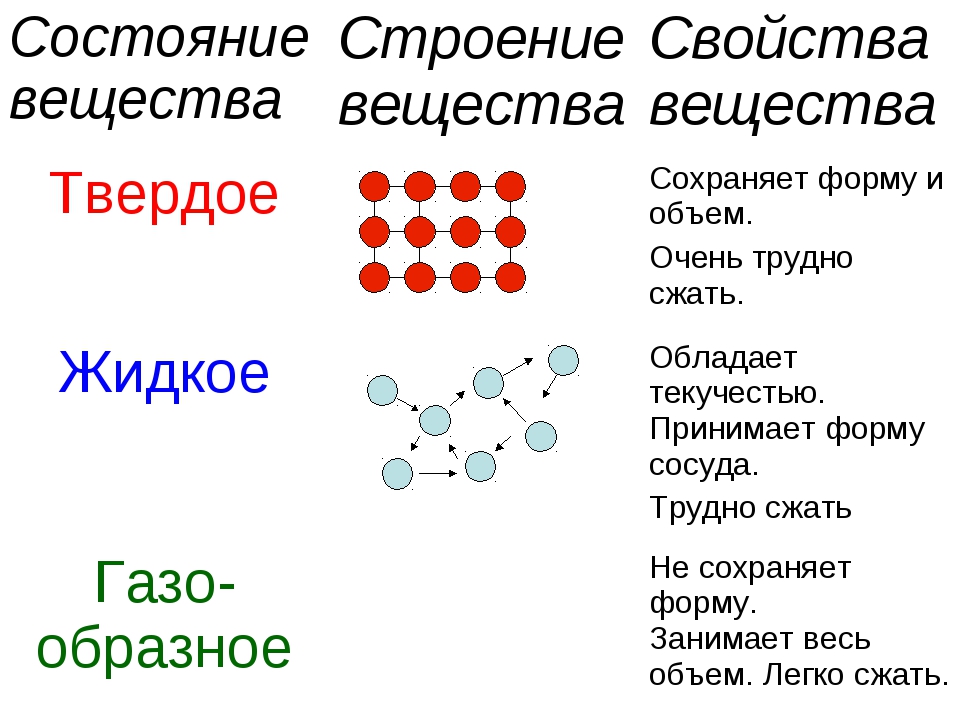 Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивного содержания . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивного содержания . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги.И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Алмаз опасности
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химикатами в лаборатории или на рабочем месте. Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) суммирует основные опасности химического вещества.
Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ. Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки).Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
д. Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 5). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 5. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.
Видеообзор: Физические и химические свойства
Вы можете просмотреть стенограмму «Physical Vs. Химические изменения — объяснение »здесь (открывается в новом окне).
Ключевые концепции и резюме
Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества.Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории. Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Попробуйте
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические: Фтор — это бледно-желтый газ, который вступает в реакцию с большинством веществ. Свободный элемент плавится при −220 ° C и кипит при −188 ° C. Мелкодисперсные металлы горят во фторе ярким пламенем. Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода.
- Классифицируйте каждое из следующих изменений как физические или химические:
- конденсация пара
- сжигание бензина
- сквашивание молока
- растворение сахара в воде
- плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
- уголь сжигание
- таяние льда
- смешивание шоколадного сиропа с молоком
- взрыв петарды
- намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.Это химическое или физическое изменение?
- 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Укажите следующие свойства: экстенсивные или интенсивные.
- объем
- температура
- влажность
- тепло
- точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).[латекс] \ text {density} = \ dfrac {\ text {mass}} {\ text {volume}} [/ latex]; [латекс] \ text {d} = \ dfrac {\ text {m}} {\ text {V}} [/ latex]. Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.

2. (а) физический; (б) химический; (c) химическая; (d) физический; (д) физический
4. физический
6. Стоимость экстенсивного свойства зависит от количества рассматриваемой материи, тогда как ценность интенсивной собственности одинакова независимо от количества рассматриваемой материи.
8. Обладая обширными свойствами, масса и объем прямо пропорциональны количеству исследуемого вещества. Разделение одного экстенсивного свойства на другое фактически «отменит» эту зависимость от количества, давая соотношение, которое не зависит от количества (интенсивное свойство).
Глоссарий
химическое изменение: изменение, производящее другой вид материи по сравнению с исходной материей
химическое свойство: Поведение, связанное с превращением одного вида материи в материю другого типа
обширное свойство: свойство вещества, зависящее от количества вещества
интенсивное свойство: свойство вещества, не зависящее от количества вещества
физическое изменение: изменение состояния или свойств вещества, не связанное с изменением его химического состава
Физические и химические свойства материи
Мы все ежедневно окружены материей.Все, что мы используем, прикасаемся, едим и т. Д., Является примером материи. Материю можно определить или описать как все, что занимает пространство, и состоит из крошечных частиц, называемых атомами. Он должен отображать два свойства: массу и объем.
Введение
Различные типы материи можно различить по двум компонентам: состав и свойства. Состав вещества относится к различным компонентам вещества вместе с их относительными пропорциями. Свойства материи относятся к качествам / атрибутам, которые отличают один образец материи от другого.Эти свойства обычно делятся на две категории: физические и химические.
Физические свойства и изменения
Физические свойства можно наблюдать или измерять без изменения состава вещества. Физические свойства используются для наблюдения и описания материи. Физические свойства материалов и систем часто описываются как интенсивные и экстенсивные свойства. Эта классификация относится к зависимости свойств от размера или степени рассматриваемой системы или объекта.
Интенсивное свойство — это объемное свойство, означающее, что это физическое свойство системы, которое не зависит от размера системы или количества материала в системе. Примеры интенсивных свойств включают температуру, показатель преломления, плотность и твердость объекта. При огранке алмазы части сохраняют свою внутреннюю твердость (пока их размер не достигнет толщины в несколько атомов). Напротив, обширное свойство является аддитивным для независимых, невзаимодействующих подсистем.Свойство пропорционально количеству материала в системе.
Интенсивные свойства : физическое свойство, которое будет одинаковым независимо от количества вещества.
- плотность: \ (\ rho = \ frac {m} {v} \)
- цвет: пигмент или оттенок
- проводимость: электричество проходит через вещество
- пластичность: если вещество можно сплющить
- глянец: как блестит субстанция
Расширенные свойства : физическое свойство, которое изменится при изменении количества вещества.
- Масса
- : сколько вещества в образце Объем
- : сколько места занимает сэмпл Длина
- : длина образца
Физическое изменение
Изменение, при котором внешний вид материи изменяется, но состав остается неизменным.
A Физическое изменение происходит без каких-либо изменений молекулярного состава. Один и тот же элемент или соединение присутствует до и после изменения. Та же самая молекула присутствует во всех изменениях.Физические изменения связаны с физическими свойствами, поскольку некоторые измерения требуют внесения изменений. Три основных состояния вещества: твердое, жидкое и газообразное.
Та же самая молекула присутствует во всех изменениях.Физические изменения связаны с физическими свойствами, поскольку некоторые измерения требуют внесения изменений. Три основных состояния вещества: твердое, жидкое и газообразное.
- Solid отличается фиксированной структурой. Его форма и объем не меняются. В твердом теле атомы плотно упакованы вместе в фиксированном порядке.
- Жидкость отличается своей податливой формой (может принимать форму емкости), но постоянным объемом. В жидкости атомы расположены близко друг к другу, но не в фиксированном порядке.
- Газ состоит из отдельных атомов. Однако, в отличие от твердого тела и жидкости, газ не имеет фиксированной формы и объема.
Пример \ (\ PageIndex {1} \): физическое изменение
Когда жидкая вода (\ (H_2O \)) превращается в твердое состояние (лед), она кажется измененной; Однако это изменение носит только физический характер, поскольку состав составляющих молекул тот же: 11,19% водорода и 88,81% кислорода по массе.
Рисунок \ (\ PageIndex {2} \) : Физическое изменение: таяние льда — это физическое изменение.из Википедии.
Химические свойства и изменения
Химические свойства вещества описывает его «способность» претерпевать некоторые химические изменения или реакции в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы создать потенциал для химических изменений. Довольно сложно определить химическое свойство без слова «изменение». В конце концов, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень сложно сделать, и от вас не ожидается, что вы сможете это сделать.Например, водород может воспламениться и взорваться при правильных условиях. Это химическое свойство. Металлы в целом обладают химическим свойством реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода. Это химическое свойство.
В результате химического изменения одно или несколько веществ полностью отличаются по составу от исходных веществ. Элементы и / или соединения в начале реакции перегруппировываются в новые производные соединения или элементы.ХИМИЧЕСКОЕ ИЗМЕНЕНИЕ изменяет состав исходного вещества. В конце химического изменения присутствуют различные элементы или соединения. Атомы в соединениях перегруппировываются, чтобы образовать новые и разные соединения.
Пример \ (\ PageIndex {1} \): Коррозия металлов
Коррозия — это нежелательное окисление металлов, приводящее к образованию оксидов металлов.
\ [2 Mg + O_2 \ стрелка вправо 2 MgO \]
Рисунок \ (\ PageIndex {3} \): Химическое изменение: горящая лента из магния с очень коротким воздействием для получения подробных сведений об окислении.от капитана Джона Йоссариана (Википедия)Проблемы
Следующие вопросы являются множественным выбором.
1. Молоко скисает. Это ________________
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
2. HCl, будучи сильной кислотой, является __________, Древесина, распиленная пополам, составляет ___________
- Химическое изменение, физическое изменение
- Физическое изменение, Химическое изменение
- Химические свойства, физические изменения
- Физические свойства, химические изменения
- Ничего из вышеперечисленного
3.CuSO 4 растворяется в воде
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
4. Фосфат алюминия имеет плотность 2,566 г / см3
- Химическая замена
- Физическое изменение
- Химическая собственность
- Физическая собственность
- Ничего из вышеперечисленного
5. Что из перечисленного является примерами материи?
Что из перечисленного является примерами материи?
- Собака
- Двуокись углерода
- Кубики льда
- Нитрат меди (II)
- Движущийся автомобиль
6.Признаком какого типа изменения является образование пузырьков газа?
7. Верно ли, что выпечка хлеба — это физическое свойство. 8. Верно ли, что картофель — это физическое изменение. 9. Имеет ли значение солнечный свет? 10. Свинцовая масса является _____________ свойством.
Решения
- химическая замена
- химическое свойство, физическое изменение
- физическое изменение
- физическая собственность
- Все вышеперечисленное
- химическая
- Ложь
- Правда
- №
- физическая собственность
Список литературы
- Петруччи, Биссоннет, Селедка, Мадура.Общая химия: принципы и современные приложения. Десятое изд. Река Аппер Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
- Краколице, Петерс. Основы вводной химии Активный подход к обучению. Второе изд. Бельмонт, Калифорния 94001: Брукс / Коул, 2007.
Авторы и авторство
1.3: Свойства материи — Chemistry LibreTexts
Цели обучения
- Отделить физические свойства от химических и изменения
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемого образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества имеют одинаковые химические и физические свойства. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физические свойства могут быть обширными или интенсивными. Обширные свойства варьируются в зависимости от количества вещества и включают массу, вес и объем. Интенсивные свойства , напротив, не зависят от количества вещества; они включают цвет, точку плавления, точку кипения, электропроводность и физическое состояние при данной температуре. Например, элементарная сера представляет собой желтое кристаллическое твердое вещество, которое не проводит электричество и имеет температуру плавления 115.2 ° C, независимо от того, какое количество проверяется (Рисунок \ (\ PageIndex {1} \)). Ученые обычно измеряют интенсивные свойства, чтобы определить личность вещества, тогда как обширные свойства передают информацию о количестве вещества в образце.
Рисунок \ (\ PageIndex {1} \): Разница между экстенсивными и интенсивными свойствами материи. Поскольку они различаются по размеру, два образца серы имеют разные экстенсивные свойства, такие как масса и объем. Напротив, их интенсивные свойства, включая цвет, температуру плавления и электропроводность, идентичны.Хотя масса и объем являются экстенсивными свойствами, их соотношение является важным интенсивным свойством, называемым плотностью , (\ (\ rho \)). Плотность определяется как масса на единицу объема и обычно выражается в граммах на кубический сантиметр (г / см 3 ). По мере увеличения массы в данном объеме увеличивается и плотность. Например, свинец с его большей массой имеет гораздо большую плотность, чем тот же объем воздуха, точно так же, как кирпич имеет большую плотность, чем такой же объем пенополистирола.При заданных температуре и давлении плотность чистого вещества постоянна:
\ [\ begin {align *} \ text {density} & = {\ text {mass} \ over \ text {volume}} \\ [4pt] \ rho & = {m \ over V} \ label {Eq1} \ end {align *} \]
Чистая вода, например, имеет плотность 0,998 г / см. 3 при 25 ° C. Средние плотности некоторых распространенных веществ указаны в Таблице \ (\ PageIndex {1} \). Обратите внимание, что у кукурузного масла отношение массы к объему ниже, чем у воды. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (Рисунок \ (\ PageIndex {2} \)).
Обратите внимание, что у кукурузного масла отношение массы к объему ниже, чем у воды. Это означает, что при добавлении в воду кукурузное масло будет «плавать» (Рисунок \ (\ PageIndex {2} \)).
| Вещество | Плотность при 25 ° C (г / см 3 ) | Вещество | Плотность при 25 ° C (г / см 3 ) |
|---|---|---|---|
| кровь | 1,035 | Масло кукурузное | 0,922 |
| телесный жир | 0.918 | майонез | 0,910 |
| цельное молоко | 1,030 | мед | 1,420 |
Физическая собственность и изменения
Физические изменения — это изменения, при которых не разрываются и не образуются химические связи.Это означает, что те же типы соединений или элементов, которые были в начале изменения, присутствуют и в конце изменения. Поскольку конечные материалы такие же, как и исходные, их свойства (например, цвет, температура кипения и т. Д.) Также будут такими же. Физические изменения включают перемещение молекул, но не их изменение. Некоторые типы физических изменений включают:
Физические изменения включают перемещение молекул, но не их изменение. Некоторые типы физических изменений включают:
- Изменения состояния (переход от твердого состояния к жидкости или газу и наоборот)
- Разделение смеси
- Физическая деформация (резка, вмятина, растяжение)
- Приготовление растворов (особых видов смесей).
По мере таяния кубика льда его форма изменяется по мере того, как он приобретает способность течь. Однако его состав не меняется. Плавление является примером физического изменения (Рисунок \ (\ PageIndex {3} \)), так как некоторые свойства материала меняются, но идентичность материи — нет. Физические изменения можно далее классифицировать как обратимые или необратимые. Растаявший кубик льда можно повторно заморозить, поэтому таяние — это обратимое физическое изменение. Все физические изменения, связанные с изменением состояния, обратимы.Другие изменения состояния включают в себя испарение , (жидкость в газ), замораживание, (жидкость в твердое тело) и конденсацию , (газ в жидкость). Растворение — это также обратимое физическое изменение. Когда соль растворяется в воде, считается, что соль перешла в водное состояние. Соль можно восстановить, выпарив воду, оставив соль.
Рисунок \ (\ PageIndex {3} \): Таяние льда — это физическое изменение. Когда твердая вода (\ (\ ce {H_2O} \)) в виде льда тает в жидкость (воду), она кажется измененной.Однако это изменение носит только физический характер, поскольку состав составляющих молекул тот же: 11,19% водорода и 88,81% кислорода по массе.
Химические свойства и изменение
Химические изменения происходят, когда связи разрываются и / или образуются между молекулами или атомами. Это означает, что одно вещество с определенным набором свойств (например, температура плавления, цвет, вкус и т. Д.) Превращается в другое вещество с разными свойствами. Химические изменения часто труднее обратить, чем физические.
Химические изменения часто труднее обратить, чем физические.
Хороший пример химического изменения — горящая бумага. В отличие от процесса разрыва бумаги, акт сжигания бумаги фактически приводит к образованию новых химических веществ (если быть точным, углекислого газа и воды). Другой пример химического изменения происходит при образовании воды. Каждая молекула содержит два атома водорода и один атом кислорода, химически связанные.
Другой пример химического изменения — это то, что происходит при сжигании природного газа в вашей печи. На этот раз до реакции у нас есть молекула метана \ (\ ce {CH_4} \) и две молекулы кислорода \ (\ ce {O_2} \), а после реакции у нас есть две молекулы воды, \ (\ ce {H_2O} \) и одна молекула диоксида углерода \ (\ ce {CO_2} \).В этом случае изменился не только внешний вид, но и структура молекул. Новые вещества не обладают такими химическими свойствами, как исходные. Следовательно, это химическое изменение.
Сгорание металлического магния также является химическим изменением (Магний + Кислород → Оксид магния):
\ [\ ce {2 Mg + O_2 \ rightarrow 2 MgO} \ nonumber \]
как ржавчина железа (железо + кислород → оксид железа / ржавчина):
\ [\ ce {4 Fe + 3O_2 \ rightarrow 2 Fe_2O_3} \ nonumber \]
Используя компоненты состава и свойств, мы можем отличить один образец вещества от других.
Список литературы
- Петруччи, Биссоннет, Селедка, Мадура. Общая химия: принципы и современные приложения. Десятое изд. Река Аппер Сэдл, Нью-Джерси 07458: Pearson Education Inc., 2011.
- Краколице, Петерс. Основы вводной химии Активный подход к обучению. Второе изд. Бельмонт, Калифорния 94001: Брукс / Коул, 2007.
Авторы и авторство
Характерные свойства веществ: TEAS || Зарегистрированныйorg
Глоссарий терминов и терминологии свойств веществ
- Изменяющиеся состояния материи: физическое свойство веществ, которое позволяет твердым телам, жидкостям и газам изменять свое состояние при определенных условиях.

- Масса: физическое свойство веществ, которое представляет собой сопротивление объекта движению при приложении силы, выраженное в килограммах (кг).
- Плотность: физическое свойство веществ, измеряющее массу по отношению к объему и во взаимосвязи с ним.
- Объем: физическое свойство веществ, которое является мерой количества или количества вещества в трехмерном пространстве.
- Точка кипения: физическое свойство веществ, то есть точка, при которой жидкость превращается в пар.
- Точка плавления: физическое свойство веществ, то есть температура, при которой твердое вещество превращается в жидкость.
- Электропроводность: физическое свойство веществ, которое является мерой способности или отсутствия способности вещества проводить электричество.
- Теплоемкость: физическое свойство веществ, которое представляет собой количество тепла, которое необходимо добавить или отвести от вещества для достижения определенной температуры.
- Ковкость: физическое свойство веществ, которое представляет собой степень способности твердого тела изменять свою форму и форму под действием напряжения.
- Напряжение при растяжении: напряжение, которое прикладывается к твердому телу в связи с его пластичностью.
Свойства веществ
Уникальные и отличительные свойства веществ отличают их от других веществ с их собственными уникальными и отличительными свойствами.
Некоторые уникальные и отличительные свойства веществ являются физическими, а другие — химическими.
К некоторым физическим свойствам веществ относятся:
- Изменение состояний без изменения или изменения идентичности вещества
- Масса
- Плотность
- Объем
- Температура кипения
- Температура плавления
- Электропроводность
- Тепловая мощность
- Ковкость
Многие физические свойства веществ различаются в зависимости от количества вещества, а другие физические свойства веществ не меняются в зависимости от количества вещества. Например, масса и объем не зависят от количества вещества; но точка кипения, точка плавления, пластичность, проводимость и теплоемкость действительно меняются в зависимости от количества вещества.
Например, масса и объем не зависят от количества вещества; но точка кипения, точка плавления, пластичность, проводимость и теплоемкость действительно меняются в зависимости от количества вещества.
Свойства веществ можно разделить на:
- Обширные свойства веществ
- Интенсивные свойства веществ
Экстенсивные свойства веществ — это такие свойства, как масса и объем, те свойства веществ, которые меняются в зависимости от размера вещества; а интенсивные свойства веществ, такие как температура кипения, точка плавления, пластичность, проводимость и теплоемкость, являются теми свойствами веществ, которые НЕ меняются в зависимости от размера вещества.
Свойства веществ также можно разделить на:
- Физические свойства веществ
- Химические свойства веществ
Физические свойства веществ — это те свойства, которые можно увидеть и наблюдать, а химические свойства веществ — это те свойства, которые возникают в результате химической реакции и изменяют компонент вещества.
Изменение состояний
Материя, включая твердые тела, жидкости и газы, может изменять свое состояние при определенных условиях.Например, вода может превратиться в газообразный водяной пар при испарении и в условиях повышения температуры, а лед превратится из твердого в жидкое, когда температура будет достаточной, чтобы его растопить.
Масса
Проще говоря, масса — это количество вещества, которое содержится в веществе. Дело не в весе вещества. Технически масса — это сопротивление объекта движению при приложении силы. Масса выражается в килограммах (кг).
Масса может быть вычислена математически по следующей формуле:
Масса = приложенная сила в ньютонах силы / ускорения или
M = ж / д
Плотность
Плотность — это измерение массы по отношению к объему и во взаимосвязи с ним.Плотность — это не то же самое, что вес. Математическая формула для расчета плотности:
Математическая формула для расчета плотности:
Плотность = Масса, деленная на Объем
Плотность может варьироваться в зависимости от температуры и давления, которым подвергается материал. Это изменение более выражено для газов, чем для твердых тел и жидкостей.
Применение увеличения температуры уменьшает его плотность, поскольку его объем увеличивается с повышением температуры; и приложение увеличивающегося давления увеличивает плотность, потому что объем уменьшается с увеличением давления.
Объем
Мерный стаканчик можно использовать для измерения объемов жидкостей. Эта чашка измеряет объем в стаканах, жидких унциях и миллилитрах.
Объем — это измерение количества или количества материи в трехмерном пространстве. Твердые тела, жидкости, газы и плазма имеют объемы, которые прямо коррелируют с количеством вещества и размером контейнера. Чем больше количество вещества и чем больше емкость, тем больше объем.
Температура кипения
Точка кипения — это точка, при которой жидкость превращается в пар. Температура кипения выражается в градусах Фаренгейта или Цельсия. Температура кипения будет варьироваться в зависимости от давления, которое окружает его в контейнере.
Температуры по Фаренгейту и Цельсию могут быть преобразованы в температуру Цельсия и Фаренгейта следующим образом:
Температура по Фаренгейту = C + 32 x 9/5
градусов по Фаренгейту = F — 32 x 5/9
Чем выше давление окружающей среды, тем выше температура кипения этой жидкости; и чем ниже окружающее давление, тем ниже температура кипения жидкости.Например, в городе Денвер высотой в милю атмосферное давление низкое и значительно ниже, чем атмосферное давление на приморском острове, таком как Хилтон-Хед. Итак, когда вы кипятите воду в Денвере, она закипает при более низкой температуре и быстрее, чем при кипячении воды на Хилтон-Хед, потому что температура кипения воды в Денвере ниже из-за низкого атмосферного давления и низкого давления. точка кипения воды на Хилтон-Хеде выше, потому что атмосферное давление на уровне моря выше, чем в горах.Ваша паста приготовится в Денвере быстрее, чем в Hilton Head.
точка кипения воды на Хилтон-Хеде выше, потому что атмосферное давление на уровне моря выше, чем в горах.Ваша паста приготовится в Денвере быстрее, чем в Hilton Head.
Различные жидкости различаются по температуре кипения. Например, температура кипения воды на уровне моря составляет 212 градусов по Фаренгейту и 100 градусов по Цельсию, но другие жидкости могут кипеть только при более высокой температуре.
Температура плавления
Проще говоря, точка плавления — это температура, при которой твердое вещество превращается в жидкость. На точку плавления также влияет температура окружающей среды.
Концепция, противоположная точке плавления, — это точка замерзания жидкости, при которой она превращается в твердое тело. При рассмотрении воды лед тает и превращается в воду при определенной температуре, а вода превращается в твердый лед при определенной температуре.
Проводимость
Электропроводность — это мера способности или отсутствия способности вещества проводить электричество. Некоторые вещества имеют высокий уровень проводимости, а другие вещества обладают высоким уровнем сопротивления проводимости электричества.
Тепловая мощность
Проще говоря, теплоемкость — это количество тепла, которое должно быть добавлено или отведено веществу для достижения определенной температуры. Теплоемкость также называется теплоемкостью, и количество добавляемого или отводимого тепла измеряется в джоулях на кельвин.
Ковкость
Опять же, просто говоря, пластичность определяется как степень способности твердого тела изменять свою форму и форму под действием напряжения. Это напряжение, которое прикладывается к твердому телу, называется растягивающим напряжением.
Например, такие металлы, как олово, могут быть подвергнуты ковке, и их форма и форма могут быть легко изменены под воздействием этого ударного фактора растяжения; в то время как другие вещества, такие как сталь, обладают высокой устойчивостью к растягивающим нагрузкам.
СВЯЗАННЫЕ ЧАИ ЖИЗНЬ И ФИЗИЧЕСКИЕ НАУКИ СОДЕРЖАНИЕ:
Alene Burke, RN, MSN
Alene Burke RN, MSN является национально признанным преподавателем сестринского дела. Она начала свою карьеру учителем начальной школы в Нью-Йорке, а затем поступила в общественный колледж Квинсборо, чтобы получить степень младшего специалиста по медсестринскому делу.Она работала дипломированной медсестрой в отделении интенсивной терапии местной общественной больницы, и в то время она решила стать преподавателем медсестер. Она получила степень бакалавра наук по медсестринскому делу в колледже Excelsior, который входит в состав Университета штата Нью-Йорк, и сразу после его окончания поступила в аспирантуру в университете Адельфи на Лонг-Айленде, штат Нью-Йорк. Она закончила Summa Cum Laude в Адельфи со степенью двойного магистра в области сестринского образования и сестринского администрирования и сразу же получила докторскую степень по сестринскому делу в том же университете.Она является автором сотен курсов для медицинских работников, включая медсестер, она работает медсестрой-консультантом в медицинских учреждениях и частных корпорациях, она также является утвержденным поставщиком непрерывного образования для медсестер и других дисциплин, а также была членом Американской ассоциации медсестер. Целевая группа ассоциации по компетентности и обучению членов медсестер.
Последние сообщения Alene Burke, RN, MSN (посмотреть все)1.3 Физические и химические свойства — CHEM 1114 — Introduction to Chemistry
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения вещества как физические или химические
- Определять свойства вещества как экстенсивные или интенсивные
Напомним, что химия — это изучение материи, ее свойств, изменений, которым подвергается материя, и энергии, связанной с этими изменениями.В этой главе мы более подробно рассмотрим материю и энергию и их взаимосвязь.
Когда материя претерпевает изменения, этот процесс часто сопровождается изменением энергии — тепла, света, звука, кинетической энергии движущегося вещества и т. Д. Если во время изменения выделяется (высвобождается) тепло, изменение будет экзотермическим . Если необходимо подвести тепло, заменяют на эндотермический .
Важное различие заключается в том, что тепло — это энергия, которая течет из-за разницы температур, а температура — это мера средней кинетической энергии молекул в веществе.Чем быстрее они двигаются, тем он «горячее».
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами. Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи.Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния (рис. 1) или свойств вещества без каких-либо сопутствующих изменений его химического состава (идентичности веществ, содержащихся в веществе), таких как растворение и разбавление.
Рис. 1. Различные фазовые изменения, которые может претерпеть материя. Мы наблюдаем физические изменения при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 2).Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными противоугонными бирками) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Изменение одного типа вещества в другой тип (или невозможность изменения) — это химическое вещество недвижимость . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 3). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 3. (a) Одно из химических свойств железа — ржавчина; (б) одно из химических свойств хрома состоит в том, что это не так. (кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)Чтобы определить химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов вещества, которые отличаются от вещества, присутствовавшего до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины.Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 4).
Рис. 4. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ. (Фото b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
(b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ. (Фото b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)Пример 1
Классифицируйте каждое из следующих свойств либо как физическое, либо как химическое:
a) Температура кипения воды составляет 100 o ° C
b) Кислород представляет собой газ
c) Сахар сбраживает с образованием спирта
Решение
a) Хотя это свойство описывает изменение, это изменение не связано с изменением содержания.H 2 O остается H 2 O независимо от того, в каком состоянии он находится. Таким образом, это физическое свойство.
б) Это неотъемлемое свойство и, следовательно, физическое свойство.
c) Это свойство включает изменение вещества с сахара на алкоголь. Это химическое свойство.
Проверьте себя
Классифицируйте каждое из следующих свойств либо как физическое, либо как химическое:
a) Эта страница белая b) Древесные ожоги c) Молоко свертывается, если не учитывать его
Ответы
a) физическое свойство b) химическое свойство c) химическое свойство
Свойства материи делятся на две категории.Если свойство зависит от количества присутствующего вещества, это обширное свойство . Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока.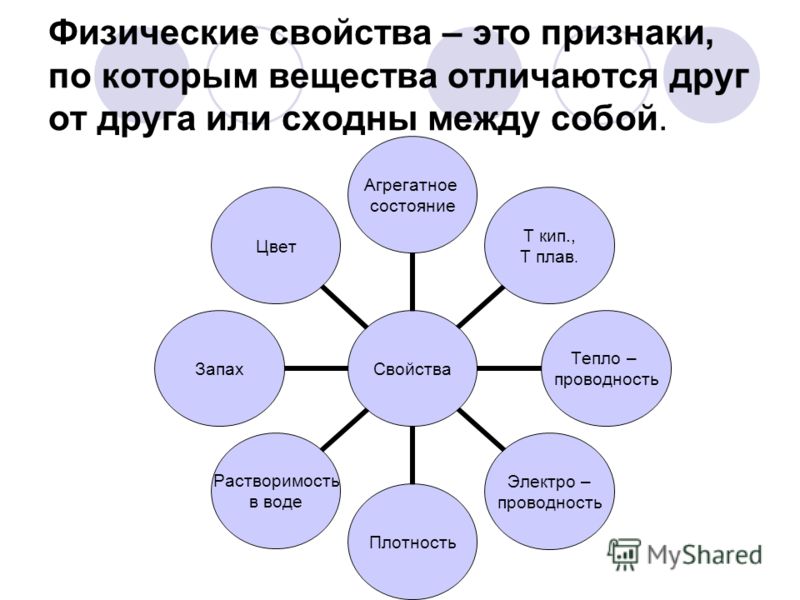 Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества. Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивного содержания . Температура — это пример интенсивного свойства.Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества. Если свойство образца вещества не зависит от количества присутствующего вещества, это свойство интенсивного содержания . Температура — это пример интенсивного свойства.Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C. В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Пример 2
Классифицируйте каждое из следующих изменений либо как физическое, либо как химическое изменение:
a) Конденсация пара на зеркале для душа
b) Ржавчина, образующая железо
c) Таблетка антацида шипит при контакте с желудочной кислотой
d) Соль растворяется в воде
Решение
а) Пар представляет собой водяной пар, и когда он конденсируется, он образует жидкую воду на зеркале.
Это физическое изменение.
б) Железо реагирует с кислородом воздуха, образуя оксид железа, который представляет собой ржавчину.
Это химическое изменение.
c) Шипение в воде — это выделение углекислого газа при контакте с кислотой. Это химическое изменение.
г) Растворение считается физическим изменением. Несмотря на то, что солевые связи разрываются при растворении, они не образуют новых связей или нового вещества. Если выпарить воду, соль останется.
Проверьте себя
Классифицируйте каждое из следующих изменений либо как физическое, либо как химическое изменение:
a) Резинка тянется, когда вы ее тянете
b) Ацетон удаляет лак с ногтей
c) Медь плавится при высоких температурах
d) Тусклость металлического серебра со временем
Ответы
a) физическое изменение b) физическое изменение (растворение)
c) физическое изменение d) химическое изменение
Пример 3
Опишите каждый процесс как физическое или химическое изменение.
а) Вода в воздухе превращается в снег.
б) У человека стрижены волосы.
в) Хлебное тесто превращается в свежий хлеб в духовке.
Решение
a) Поскольку вода переходит из газовой фазы в твердую, это физическое изменение.
б) Ваши длинные волосы укорачиваются. Это физическое изменение.
c) Из-за температуры духовки в хлебном тесте происходят химические изменения, из-за которых получается свежий хлеб.Это химические изменения. (На самом деле, приготовление пищи часто связано с химическими изменениями.)
Проверьте себя
Определите каждый процесс как физическое или химическое изменение.
а) В камине бушует пожар.
б) Вода нагревается, чтобы приготовить чашку кофе.
Ответы
а) химическое изменение б) физическое изменение
Алмаз опасности
Возможно, вы видели символ, показанный на Рисунке 5, на контейнерах с химикатами в лаборатории или на рабочем месте.Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 5. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества. Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ.Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки). Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д.Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д.Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Разложение воды / Производство водорода
Вода состоит из элементов водорода и кислорода, объединенных в соотношении 2: 1. Вода может претерпевать химические изменения, в результате которых молекулы воды расщепляются на газообразный водород и кислород за счет добавления энергии. Один из способов сделать это — использовать аккумулятор или источник питания, как показано на (Рисунок 6).
Рисунок 6. Разложение воды показано на макроскопическом, микроскопическом и символическом уровнях. Батарея обеспечивает электрический ток (микроскопический), разлагающий воду. На макроскопическом уровне жидкость разделяется на газы: водород (слева) и кислород (справа). Символически это изменение представлено тем, как жидкий H 2 O разделяется на газы H 2 и O 2 .Распад воды включает перегруппировку атомов в молекулах воды в разные молекулы, каждая из которых состоит из двух атомов водорода и двух атомов кислорода соответственно.Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление того, что происходит, [латекс] 2 \ text {H} _2 \ text {O} (l) \ rightarrow 2 \ text {H} _2 (g) + \ text {O} _2 (g) [/ latex] , мы рассмотрим более подробно в следующих главах.
Два производимых газа имеют совершенно разные свойства. Кислород не горюч, но необходим для сгорания топлива, а водород легко воспламеняется и является мощным источником энергии. Как это знание можно применить в нашем мире? Одно приложение связано с исследованиями в области более экономичного транспорта. Транспортные средства на топливных элементах (FCV) работают на водороде вместо бензина (Рисунок 7). Они более эффективны, чем автомобили с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, делая нас менее зависимыми от ископаемого топлива. Однако FCV еще не являются экономически жизнеспособными, а текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производить водород другим экологически безопасным способом, FCV могут быть путем будущего.
Транспортные средства на топливных элементах (FCV) работают на водороде вместо бензина (Рисунок 7). Они более эффективны, чем автомобили с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, делая нас менее зависимыми от ископаемого топлива. Однако FCV еще не являются экономически жизнеспособными, а текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производить водород другим экологически безопасным способом, FCV могут быть путем будущего.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 6). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 6. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.Ключевые концепции и краткое изложение
Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Упражнения
1. Классифицируйте каждое из следующих изменений как физические или химические:
а) конденсация пара
б) сжигание бензина
в) сквашивание молока
г) растворение сахара в воде
д) плавка золота
2.Объем пробы газообразного кислорода изменялся с 10 мл до 11 мл при изменении температуры. Это химическое или физическое изменение?
3. Объясните разницу между экстенсивными и интенсивными свойствами.
4. Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
[латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex] [latex] \ text {d} = \ frac {\ text {m}} {\ текст {V}} [/ latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
5. Отражает ли каждое утверждение физическое свойство или химическое свойство?
а) Сера желтая.
б) Металлическая вата горит при воспламенении пламенем.
c) Галлон молока весит более восьми фунтов.
6. Отражает ли каждое утверждение физическое свойство или химическое свойство?
а) Куча листьев на заднем дворе медленно гниет.
б) В присутствии кислорода водород может взаимодействовать с образованием воды.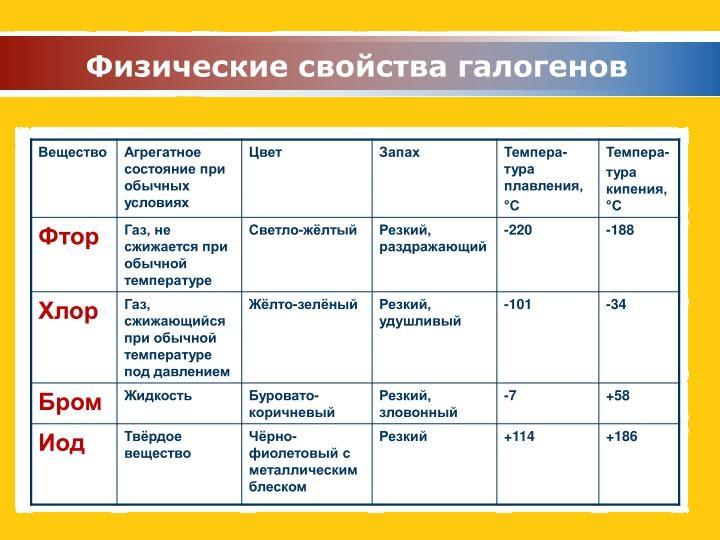
в) Золото можно растянуть в очень тонкую проволоку.
7. Представляет ли каждое утверждение физическое или химическое изменение?
а) Вода закипает и превращается в пар.
б) Пища преобразуется в пригодную для употребления форму пищеварительной системой.
c) Спирт во многих термометрах замерзает при температуре около -40 градусов по Фаренгейту.
8. Представляет ли каждое утверждение физическое или химическое изменение?
а) Графит, одна из форм элементарного углерода, может быть превращен в алмаз, другую форму углерода, при очень высоких температурах и давлениях.
б) Элементы натрия и хлор объединяются, чтобы образовать новое вещество, называемое хлоридом натрия.
Ответы
1. а) физический; б) химический; в) химическая; г) физический; д) физический
2. физический
3. Стоимость экстенсивного свойства зависит от количества рассматриваемой материи, тогда как ценность интенсивной собственности одинакова независимо от количества рассматриваемой материи.
4.Являясь экстенсивными свойствами, как масса, так и объем прямо пропорциональны количеству исследуемого вещества. Разделение одного экстенсивного свойства на другое фактически «отменит» эту зависимость от количества, давая соотношение, которое не зависит от количества (интенсивное свойство).
5. а) физическое свойство б) химическое свойство в) физическое свойство
6. a) химическое свойство b) химическое свойство c) физическое свойство
7. а) физическое изменение б) химическое изменение в) физическое изменение
8.а) физическое изменение б) химическое изменение
Глоссарийхимическое изменение: изменение, производящее другой вид материи по сравнению с исходной материей
химическое свойство: Поведение, связанное с превращением одного вида материи в материю другого типа
эндотермический: если необходимо подвести тепло, чтобы произошло изменение
энергия: способность совершать «работу» — то есть, чтобы сила воздействовала на что-либо и отталкивала некоторое расстояние
экзотермический: , если во время смены выделяется тепло
обширное свойство: свойство вещества, зависящее от количества вещества
интенсивное свойство: свойство вещества, не зависящее от количества вещества
физическое изменение: изменение состояния или свойств вещества, не связанное с изменением его химического состава
физическое свойство: характеристика вещества, не связанная с каким-либо изменением его химического состава
химический элемент | Определение, происхождение, распространение и факты
Химический элемент , также называемый элементом , любое вещество, которое не может быть разложено на более простые вещества обычными химическими процессами. Элементы — это фундаментальные материалы, из которых состоит вся материя.
Элементы — это фундаментальные материалы, из которых состоит вся материя.
Британская викторина
Так много химии, так мало времени Quiz
Какой французский химик первым выделил кодеин? Кому приписывают открытие урана? Проверьте свои знания. Пройдите викторину.
В этой статье рассматривается происхождение элементов и их распространенность во Вселенной.Подробно рассматривается геохимическое распределение этих элементарных веществ в земной коре и недрах, а также их присутствие в гидросфере и атмосфере. В статье также рассматривается периодический закон и табличное расположение элементов на его основе. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Редакция Британской энциклопедииОбщие наблюдения
В настоящее время известно 118 химических элементов.Около 20 процентов из них не существуют в природе (или присутствуют только в следовых количествах) и известны только потому, что были синтетически получены в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть благородных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся примерно при температуре выше комнатной температуры), а остальное — твердые частицы. Элементы могут объединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями.Число возможных соединений практически бесконечно; возможно, известен миллион, и каждый день открывается все больше. Когда два или более элемента объединяются в соединение, они теряют свою индивидуальность, и продукт имеет характеристики, совершенно отличные от характеристик составляющих элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут объединяться с образованием сложной воды, которая имеет совершенно другие свойства, чем кислород или водород. Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Очевидно, что вода не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и фактически может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества никаким известным химическим процессом. Большинство образцов естественного вещества представляют собой физические смеси соединений. Например, морская вода представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других компонентов морской воды.
Историческое развитие концепции элемента
Современная концепция элемента однозначна, поскольку она зависит от использования химических и физических процессов в качестве средства отделения элементов от соединений и смесей. Однако существование фундаментальных веществ, из которых состоит вся материя, было основой многих теоретических предположений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного принципа — элемента.Фалес считал, что этот элемент — вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, выразил иную веру — что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель согласился и подчеркнул, что эти четыре элемента являются носителями фундаментальных свойств: сухость и тепло связаны с огнем, тепло и влага — с воздухом, влажность и холод — с водой, а холод и сухость — с землей. В мышлении этих философов все другие вещества должны были быть комбинациями четырех элементов, и считалось, что свойства веществ отражают их элементный состав.Таким образом, греческая мысль заключала в себе идею, что вся материя может быть понята в терминах элементарных качеств; в этом смысле сами элементы считались нематериальными. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Во второй половине средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие концепции состава материи стали менее удовлетворительными.Были введены дополнительные элементарные качества для приспособления к недавно обнаруженным химическим превращениям. Таким образом, сера стала олицетворять горючесть, ртуть — летучесть или текучесть, а соль — стойкость в огне (или негорючесть). Эти три алхимических элемента или принципа также представляют собой абстракции свойств, отражающих природу материи, а не физических субстанций.
Важное различие между смесью и химическим соединением в конце концов было понято, и в 1661 году английский химик Роберт Бойль осознал фундаментальную природу химического элемента.Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут объединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и соотносил их с соединениями, которые они образуют, современными методами.
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного исследования реакций разложения и рекомбинации.Поскольку он не мог проводить эксперименты по разложению определенных веществ или формированию их из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, глинозем и кремнезем, которые, как теперь известно, являются очень стабильными соединениями. На то, что Лавуазье все еще сохранилось влияние древнегреческой концепции элементов, указывает его включение света и тепла (калорийности) в число элементов.
Семь веществ, признанных сегодня элементами — золото, серебро, медь, железо, свинец, олово и ртуть — были известны древним, поскольку встречаются в природе в относительно чистой форме.Они упоминаются в Библии и в раннем индуистском медицинском трактате Caraka-samhita . Шестнадцать других элементов были открыты во второй половине 18 века, когда методы отделения элементов от их соединений стали более понятными. Еще восемьдесят два последовали после внедрения количественных аналитических методов.
Свойства материалов — Введение — Science Learning Hub
Материя — это все, что имеет массу и занимает пространство. Полезный способ начать думать о материи — это подумать о различных материалах или веществах, из которых она может быть превращена.
Эти материалы составляют предметы вокруг нас, и каждый из этих материалов имеет разные свойства или характеристики, которые можно наблюдать или тестировать. Ученые, технологи и инженеры исследуют эти материалы — они экспериментируют с ними, сравнивают их свойства и связывают результаты с возможными применениями.
Типы материалов
Есть много разных материалов. Некоторые примеры повседневных материалов — это пластик, металлы, ткань и стекло.
Узнайте больше о пластмассовых изделиях в статье «Пластмассы и вторичная переработка».
Узнайте больше о металлах и о том, что происходит при их смешивании, в статье «Металлы, сплавы и соединения металлов».
Керамические материалы используются для изготовления традиционной керамики, вплоть до современной керамики, используемой в технике и медицине. Эти изобретения требуют от ученых понимания свойств минералов. Подробнее читайте в статье Что такое минералы?
Шерсть — еще один традиционный материал, претерпевший инновации. Изучите свойства шерсти и то, как они связаны с ее использованием в студенческой деятельности «Изучение свойств шерстяных волокон».
Некоторые другие интересные, менее известные материалы включают нановолокна, биологические материалы и композиты.
Примеры свойств
Когда мы говорим о свойствах материала, мы говорим об особенностях, которые мы можем ощутить, измерить или протестировать. Например, если у нас есть образец металла перед нами, мы можем определить, что этот материал серый, твердый и блестящий. Тестирование показывает, что этот материал способен проводить тепло и электричество и вступает в реакцию с кислотой.Это некоторые из свойств металла.
Важно решить, исследуете ли вы свойства материала или объекта. Например, вы определяете свойства ложки (предмета) или изучаете свойства материала, из которого она сделана, например, нержавеющей стали? Такие свойства, как форма и масса, могут быть разными для разных объектов, даже если они сделаны из одного и того же материала. Плотность — это полезное свойство для сравнения различных материалов.
Воспользуйтесь этим упражнением, чтобы узнать больше о плотности.
Другие свойства материалов могут включать их вязкость и проводимость.
Обычно о свойстве говорят о состоянии или фазе материи. В настоящее время идентифицировано пять различных состояний вещества: твердые тела, жидкости, газы, плазма и конденсат Бозе-Эйнштейна. Последние два из них гораздо менее известны.
Важно отметить, что состояние вещества относится к расположению и движению частиц, составляющих материал, а не к самому материалу.
Подробнее о состояниях материи можно узнать из статьи «Состояния материи».
Физические и химические
Иногда бывает полезно различать разные типы свойств. Физические свойства относятся к свойствам, которые можно наблюдать или измерять без изменения состава материала. Примеры включают цвет, твердость, запах и температуру замерзания, плавления и кипения.
Химические свойства обнаруживаются путем наблюдения за химическими реакциями.К ним относятся температура горения, реакционная способность с кислотами и токсичность.
Изменение свойств материала
Такие процессы, как смешивание, нагрев и охлаждение, могут изменять материалы и их свойства.




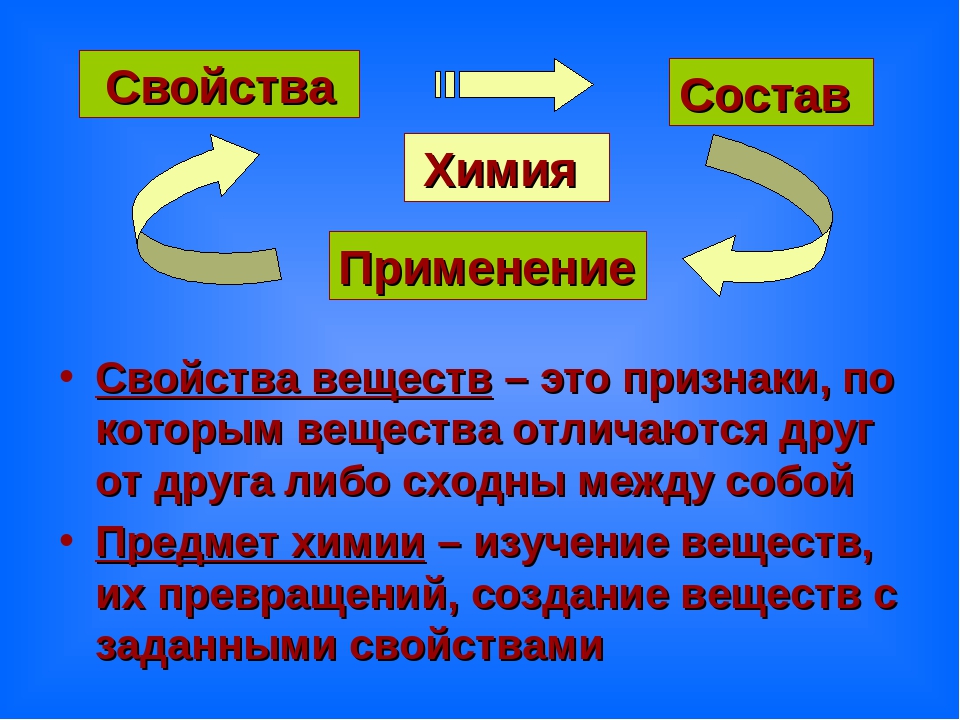 Общие требования;
Общие требования;

