Вещества и их свойства в химии
Агрегатные состояния вещества
Все вещества могут существовать в трех агрегатных состояниях — твердом, жидком и газообразном.
Вещества в твёрдом состоянии обладают четкими формами и объёмами. Среди твёрдых веществ выделяют вещества в кристаллическом и аморфном состояниях. Молекулы и атомы в веществах в твердом агрегатном состоянии в течение длительного времени сохраняют своё среднее положение неизменным, совершая колебания с небольшой амплитудой вокруг них.
В кристаллах средние положения атомов или молекул строго упорядочены (кристаллическая решетка). Естественная форма кристаллов— правильные многогранники.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Частным случаем аморфного состояния является стеклообразное состояние.
Вещества в жидком агрегатном состоянии сохраняют объём, но не сохраняют форму, т.е. жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в газообразном агрегатном состоянии не сохраняет ни форму, ни объём. Газ заполняет всё доступное пространство. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Физические свойства веществ
К физическим свойствам веществ относят:
- агрегатное состояние
- цвет (или его отсутствие)
- блеск (или его отсутствие)
- запах (или его отсутствие)
- растворимость (или нерастворимость) в воде
- температура плавления
- температура кипения
- плотность
- теплопроводность
- электропроводность (или неэлектропроводность)
Смеси веществ
Различают чистые вещества и смеси. Чистое вещество – вещество, состоящее атомов или молекул одного элемента, и обладающее постоянным составом, который может быть выражен единственной химической формулой (вода).
Смесь – это два или более индивидуальных соединения (молоко). Раствор — смесь жидких веществ. Сплав – смесь твердых веществ. Смесь можно разделить на составляющие ее компоненты различными физическими методами, причем изменения состава компонентов смеси при этом не происходит.
В зависимости от фазового состава выделяют гомогенные (однородные) и гетерогенные (неоднородные) смеси. Гомогенные смеси обладают одинаковым химическим составом и физическими свойствами по всех частях смеси; её нельзя разделить физическими методами. Основные способы разделения гомогенных смесей: кристаллизация, дистилляция, обратный осмос, хроматография, экстракция и сорбция.
Среди гомогенных смесей выделяют газовые растворы (воздух), жидкие растворы (раствор сахара в воде) и твердые растворы (аустенит).
Гетерогенные смеси состоят из однородных фаз, которые имеют границу раздела, причем фазы могут отличаться друг от друга по составу и свойствам. Гетерогенные смеси можно разделить физическими методами, такими как отстаивание, декантация, сепарация, фильтрация, центрифугирование и флотация.
Примеры решения задач
ru.solverbook.com
Вещества простые и сложные. Химические элементы » HimEge.ru
Три агрегатных состояния воды
Окружающий мир материален. Материя бывает двух видов: вещество и поле. Объект химии – вещество (в том числе и влияние на вещество различных полей – звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т.е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
Вещество бывает в трех агрегатных состояниях – газообразном, жидком и твердом. Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.
Вещества могут быть чистыми, очень чистыми (нужными, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
Все вещества состоят из мельчайших частиц – атомов. Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Если в веществе (например, в воздухе) присутствуют два или большее число простых веществ, и их атомы не связаны между собой, то его называют не сложным, а смесью простых веществ. Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Вещества способны вступать между собой во взаимодействие, причем возникают новые вещества. Такие превращения называют химическими. Например, простое вещество уголь взаимодействует (химики говорят – реагирует) с другим простым веществом – кислородом, в результате образуется сложное вещество – углекислый газ, в котором атомы углерода и кислорода связаны между собой. Такие превращения одних веществ в другие называют химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химия изучает превращения одних веществ в другие. Задача химии – выяснить, с какими именно веществами может при данных условиях взаимодействовать (реагировать) то или иное вещество, что при этом образуется. Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется совокупностью физических и химических свойств. Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.
Физические свойства веществ подразделяют на счислимые (те, которые можно охарактеризовать с помощью тех или иных физических приборов числом, например, указанием плотности, температур плавления и кипения, растворимости в воде и др.) и несчислимые (те, которые охарактеризовать числом нельзя или очень трудно – такие, как цвет, запах, вкус и др.).
Химические свойства вещества – это совокупность сведений о том, с какими другими веществами и при каких условиях вступает в химические взаимодействия данное вещество. Важнейшая задача химии – выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ – атомы. При химических превращениях из одних веществ образуются другие вещества, и исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А атомы при всех химических превращениях сохраняются. Происходит их перегруппировка, при химических превращениях старые связи между атомами разрушаются и возникают новые связи.
Число различных веществ огромно (и у каждого из них своя совокупность физических и химических свойств). Атомов, отличающихся друг от друга по важнейшим характеристикам, в окружающем нас материальном мире сравнительно невелико – около ста. Каждому виду атомов отвечает свой химический элемент. Химический элемент – это совокупность атомов с одинаковыми или близкими характеристиками. В природе встречается около 90 различных химических элементов. К настоящему времени физики научились создавать новые, отсутствующие на Земле виды атомов. Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Каждый элемент имеет латинское название и одно- или двух-буквенный символ. В русскоязычной химической литературе нет четких правил произношения символов химических элементов. Одни произносят так: называют элемент по-русски (символы натрия, магния и др.), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
Сравнение важнейших характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может отвечать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может – и одно (аргон и др. инертные газы).
| Х и м и ч е с к и й э л е м е н т | П р о с т о е в е щ е с т в о |
| 1. Заряд ядра | 1. Совокупность физических свойств(цвет, запах, растворимость в воде, температуры плавления, кипения, разложения, тип кристаллической решетки и др.) 2. Совокупность химических свойств (с чем реагирует и при каких условиях) |
| 2. Значение электроотрицательности | |
| 3. Совокупность степеней окисления | |
| 4. Для элементов, встречающихся в природе: постоянство изотопного состава,и как следствие, постоянство атомной массы |
himege.ru
Физические и химические свойства веществ
Различные вещества отличаются друг от друга своими свойствами.
Свойства вещества – это признаки, по которым одно вещество отличается от других веществ или сходно с ними.
Пример. Сходства и отличия между водой и ацетоном на примере трёх свойств:
| Свойства | Вещества | |
|---|---|---|
| Вода | Ацетон | |
| Температура кипения | 100 °C | 56 °C |
| Цвет | нет | нет |
| Запах | нет | есть |
Свойства вещества делятся на физические и химические.
Физические свойства вещества – это свойства вещества, которые можно определить наблюдением, измерением или экспериментальным путём, без его превращения в другое вещество.
Пример. Вода не имеет цвета, вкуса, запаха, в зависимости от окружающих условий может находиться в одном из трёх агрегатных состояний – жидком, твёрдом или газообразном. Цвет, запах, вкус, агрегатное состояние при определённых температуре и давлении – физические свойства.
Физические свойства вещества зависят от его агрегатного состояния.
Пример. Плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий – голубой.
Химические свойства вещества – это свойства вещества, которые проявляются в химических реакциях.
Пример. Вода при очень высокой температуре разлагается на водород и кислород. Вода вступает в химическую реакцию с натрием, при этом образуются гидроксид натрия и водород. Железо окисляется при нагревании на воздухе или в токе кислорода, или при высокой влажности воздуха. Способность окисляться, вступать в химическую реакцию с другими веществами и разлагаться – химические свойства.
Для установления свойств вещества необходимо брать его с минимально возможным количеством примесей. Иногда даже очень малое содержание примеси может привести к сильному изменению некоторых свойств вещества.
Пример. Содержание в цинке лишь сотых долей процента железа или меди ускоряет его взаимодействие с соляной кислотой в сотни раз.
Изучить вещество – это значит узнать его свойства, описать из чего и как оно построено.
| О сайте: | конспекты по математике, русскому языку и химии |
| Связь: | [email protected] |
| Новое на сайте | © 2018 – 2019 | |
izamorfix.ru
Классификация и общие свойства основных классов неорганических веществ – HIMI4KA

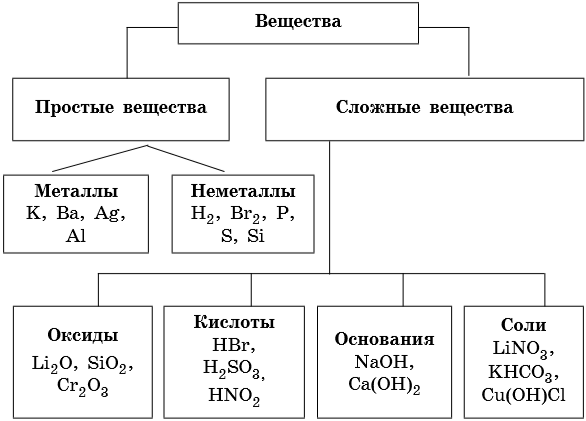
Неорганические вещества классифицируют по различным классифицирующим признакам. По химическому составу их делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента; сложными — вещества, которые образуют атомы двух и более химических элементов.
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В Периодической таблице Д. И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведенной через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и кислорода со степенью окисления –2.
Оксиды классифицируют так.
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни оснОвные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями с образованием солей и воды или кислых солей, а также с водой в том случае, если образующаяся в ходе такой реакции кислота растворима в воде:
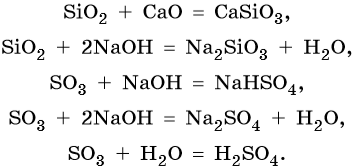
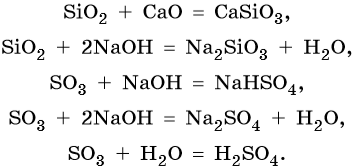
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:


Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, Ag2O.
Их характерные свойства: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:


Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:


Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:


С водой амфотерные оксиды не взаимодействуют.
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щелочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:


Основания могут вступать в реакцию с кислыми солями:


Щелочи при сплавлении с амфотерными оксидами дают соль и воду:


Щелочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:


Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:


Кислотами называют класс химических соединений, которые содержат в своем составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Неорганическими кислотами называют вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А–:


Исключение составляет борная кислота В(ОН)3, которая акцептирует гидроксид-ионы ОН–, в результате чего в водном растворе создается избыток гидроксоний-катионов:


Именно поэтому формулу H3BO3 и соответственно название борная кислота применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т. е. не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
Основностью кислоты называют число способных замещаться на металл атомов водорода в ее молекуле. По основности кислоты делят на одно-, двух- и трехосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3.
Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
Все кислоты вступают в реакцию с основаниями с образованием солей и воды (реакция нейтрализации), с основными и амфотерными оксидами с образованием солей и воды, например:
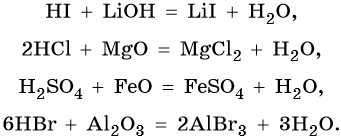
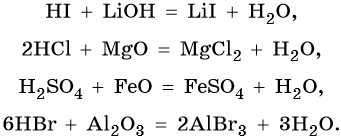
Водные растворы сильных кислот вступают в реакцию с металлами, которые стоят в ряду напряжений металлов левее водорода, с образованием соли и выделением водорода:


Исключением является азотная кислота в любой концентрации и концентрированная серная кислота. В этих случаях водород не выделяется, а происходит восстановление атомов азота и серы соответственно.
Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая соль:


Сильные кислоты: HI, HBr, HCl, HClO4, H2SO4, HNO3, H2CrO4, H2Cr2O7, HMnO4.
Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
Слабые кислоты: CH3COOH, H2CO3, H2S.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2 Некоторые гидроксиды (Cu(OH)2, Fe(OH)3) проявляют амфотерные свойства с преобладанием основных. Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка.
Химические свойства гидроксида:


Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3, CaHPO4.
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)Br2, Cu(OH)I.
Комплексными называют соли, которые содержат в своем составе комплексные катионы и/или анионы, например: K4[Fe(CN)6], [Ag(NH3)2]Cl.
Двойными называют соли, формально представляющие собой продукты взаимодействия двух простых солей, например: KAl(SO4)2.
Смешанными называют соли, являющиеся производными нескольких кислот и/или оснований, например: BaClBr.
Соли могут реагировать с кислотами с образованием кислых солей; более сильные кислоты могут вытеснять более слабые из их солей:


Соли взаимодействуют со щелочами:
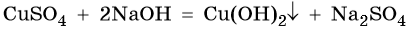
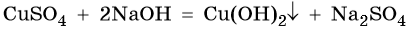
Растворимые в воде соли могут вступать друг с другом в реакции обмена, если один из продуктов уходит из сферы реакции в виде осадка, например:


Растворы или расплавы солей вступают во взаимодействие с металлами, стоящими левее, чем металл, входящий в состав соли, в ряду стандартных электродных потенциалов:
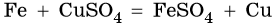
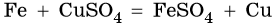
Кислые соли вступают в реакции со щелочами с образованием средних солей и воды:


Некоторые кислые соли, например угольной кислоты, разлагаются под действием более сильных кислот:


ОснОвные соли вступают в реакции с кислотами:
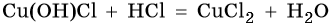
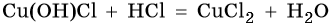
Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами, например:


При нагревании комплексные соли теряют воду:
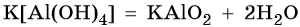
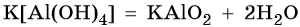
Классификацию неорганических веществ можно представить следующей самой общей схемой:

himi4ka.ru
Предмет химии. Вещества и их свойства.
8 кл
Тема урока: Вводный инструктаж по ТБ. Предмет химии. Дата: 01.09.2014
Вещества и их свойства. Урок № 1
Тип урока: № 1.приобретение новых знаний и умений
Цель урока: Знакомство с предметом, требованиями учителя, основами техники безопасности.
Задачи урока:
О. Дать представление о предмете химии. Раскрыть роль химии в повседневной жизни человека. Познакомить учащихся с возникновением и развитием химии как науки. Дать первоначальные понятия о веществе и его физических свойствах.
Р. создать условия для проявления и формирования умений активной познавательной деятельности: выделять главное, делать выводы, анализировать увиденное и услышанное. Провести вводный инструктаж по технике безопасности в кабинете химии.
В. Воспитание эстетических качеств, патриотизма, культуры учащихся.
Формы урока: панорамный
Методы обучения: наглядно-демонстрационный метод, фронтальный опрос
Технологии: стандартный урок, ИКТ
Наглядности: презентация
Оборудование: компьютер, интерактивная доска
Место практической работы: рабочее место учащихся
Этапы урока.
Ход урока
время
1. Орг. момент.
Приветствие. Проверка готовности класса и кабинета к уроку.
Отсутствующие. Знакомство с классом, с требованиями учителя,
структурой, изучаемого предмета. Ознакомление с правилами
поведения на уроке, нормами выставления отметок.
— Правила поведения на уроке (нормы)
1) один говорит – остальные слушают;
2) не понял – спроси;
3) не выкрикивать с места, а отвечать, когда дано право;
4) высказываться и спрашивать по теме;
5) не отвлекаться и не отвлекать других.
— Почему необходимо соблюдать эти правила на уроке?
— Какие правила вы можете предложить?
3
мин
2. Сообщение
Темы: Вводный инструктаж по ТБ. Предмет химии. Вещества и их свойства.
Цели: ознакомиться с новым предметом, требованиями учителя, вводным инструктажем по ТБ.
Задачи: знать роль и значение химии в жизни человека. Иметь представление о физических свойствах.
Мотивация: дальнейшее изучение химии.
1
мин
3.Актуализация знаний
Вводный инструктаж по технике безопасности в кабинете химии:
Правила поведения в кабинете химии. Поведение при возникновении возгорания. Правила техники безопасности.
Учебник, его структура и правила пользования.
Необходимое обеспечение учебного процесса: рабочая тетрадь, тетради для практических и контрольных работ; требования к ведению рабочих тетрадей.
6
4. Изложение нового материала.
Сегодня всем знакомо слово “химия”. Химические продукты широко применяются в быту, технике, сельском хозяйстве. Это пластмассы, химические волокна, удобрения. Изделиями из металлов люди постоянно пользуются в повседневной жизни. Мы употребляем в пищу сахар или поваренную соль. Что объединяет все это многообразие материального мира, вы узнаете на уроках химии.
Химия, как и природоведение, физика, биология и география, относится к предметам естествознания, которые помогают нам понять окружающий мир.
1. Возникновение химии как науки и ее развитие (кратко).
Химия – очень древняя наука. Химическое производство существовало уже за 3 тыс. лет до нашей эры. В Древнем Египте умели выплавлять из руд металлы, получать их сплавы, производили стекло, керамику, красители (пигменты), духи.
Первыми учеными-химиками были египетские жрецы. Они владели приемами бальзамирования тел, способами получения некоторых красок.
Отдельная эпоха в развитии химии – алхимия. Целью алхимии было найти способ превращения неблагородных металлов в благородные (золото и серебро) с помощью философского камня. Демокрит, Аристотель, Парацельс и многие другие выдающиеся ученые внесли свой вклад в развитие химии в те далекие времена.
На Руси алхимия распространение не получила. В Киевской Руси осуществляли выплавку металлов, производство красок, тканей. При Иване Грозном в Москве была открыта первая аптека. При Петре Первом были построены купоросные заводы , первые химические мануфактуры, а в Москве насчитывалось уже 8 аптек. Дальнейшее развитие химии в России связано с именем М.В.Ломоносова. Выдающиеся ученые-химики, имена которых известны всему просвещенному миру, наши соотечественники: Менделеев Д.И., Бутлеров А.М., Зелинский, Зайцев, Марковников и др.
Точки зрения на происхождение термина «химия»:
— Хеме (Египет.) – «черная» (земля). Это древнее название Египта, где зародилась наука химия.
— Кеме (Египет.) – «черная» (наука). Алхимия как темная, дьявольская наука.
— Хюма (древнегреч) – «литье» металлов (глагол хео – «лью»)
— Ким (древнекитайск.) – «золото».
2. Роль химии в повседневной жизни человека.
На уроках биологии вы говорили о единстве живой и неживой природы. Горные породы, минералы и живые организмы, космическое вещество и атмосфера состоят из одних и тех же химических элементов, в различных соотношениях. Различие между живой и неживой природой в том, какие именно молекулы построены из данных химических элементов. Круговорот химических элементов – основа существования биосферы – живой оболочки Земли. В основе процессов жизнедеятельности любого живого организма – биохимические превращения веществ.
Лекарства, витамины, пищевые продукты, полимерные материалы (пластмассы, искусственная кожа и каучук, искусственные волокна, строительные материалы (бетон, цемент, стекло), лакокрасочная продукция, горюче-смазочные материалы, чистящие и моющие средства, гигиенические и косметические вещества, минеральные удобрения, средства борьбы с насекомыми-вредителями и сорняками – инсектециды и гербициды – все то, без чего невозможна жизнь современного человека – это продукция химической промышленности.
3. Предмет химии.
Химия – наука о веществах, их свойствах и превращениях.
Химия – одна из наук о природе, поэтому она относится к естественным наукам. Химия тесно связана с биологией, физикой и другими естественными науками. Химия имеет множество разделов. В школьном курсе рассматриваются основы химии, знание которых необходимо каждому культурному человеку. Моя цель – помочь вам понять огромное значение химической науки и дать вам знания, которые помогут вам грамотно использовать ее достижения.
4. Первоначальные понятия о веществе и его свойствах.
Что же отличает химию от физики и биологии? Возьмем кусочек сахара. С точки зрения физики, это твердое тело белого цвета с определенной массой. Биология относит сахар к необходимым человеку продуктам питания. Чтобы узнать, как изучается сахар в химии, проведем опыт. Поместим сахар в металлическую ложку и медленно нагреем. Что мы наблюдаем? Вначале сахар плавится, переходит в жидкое состояние, затем постепенно окрашивается в коричневый цвет и, наконец, становится черным порошком. Продолжим нагревание порошка. Он сгорает и превращается в газ. Химия объясняет, что происходит с сахаром при нагревании, почему он превращается из одного вещества в другое.
Среди всех предметов естествознания физика и химия особенно тесно связаны между собой. Физика изучает тела. Химия изучает вещества.
Вещество — это то, из чего состоят тела. Из одного и того же вещества можно получить предметы различных форм. Например, из железа можно делать гвозди, посуду. И, наоборот, одинаковые по форме и объему предметы, например стаканы, можно делать из разных веществ: стекла, пластмассы, металла.
Кусочек сахара химия рассматривает как вещество. В природе очень много веществ. Они составляют основу окружающего нас мира. Каждое вещество обладает определенными, присущими только ему свойствами.
Признаки, позволяющие отличить одни вещества от других и установить сходство между ними, называются свойствами.
Основу химии составляют вещества и их свойства. Химические свойства вещества определяются по его превращениям. Рассмотрим горение металлического магния на воздухе. Он легко воспламеняется при нагревании и горит со свечением, образуя белый порошок. Во время горения выделяется много тепла. Химические свойства магния — горение на воздухе и превращение в белый порошок.
Химия изучает вещества, их состав, свойства и превращения в другие вещества.
Каждое вещество обладает определенными свойствами физическими и химическими.
Физические свойства – это признаки, по которым одни вещества отличаются от других.
К физическим свойствам вещества относятся: агрегатное состояние, цвет, плотность, блеск, запах, растворимость, температура плавления и кипения, электропроводность, плотность.
Одна из задач химии – изучение физических и химических свойств веществ.
Окружающая нас живая и неживая природа, предметы, создан¬ные человеком, состоят из различных веществ. К настоящему времени человечеству известно более 7 млн. веществ. Каждый день исследователи синтезируют сотни новых соединений.
На уроках химии вы научитесь описывать свойства веществ, давать им характеристики.
Опишем свойства сахара и магния.
Сахар — это белое твердое вещество, легко измельчается, имеет сладкий вкус, растворим в воде, при нагревании сначала плавится и меняет цвет из белого в коричневый и, наконец, превращается в черный порошок, уголь.
Магний — твердое вещество, в воде не растворим, на воздухе горит и превращается в белый порошок.
Есть и другие физические и химические свойства этих веществ. Например, плотность магния и сахара, температуры их кипения и плавления, теплопроводность и электропроводность, а также их способность к различным превращениям.
Важнейшим свойством веществ является их влияние на живые организмы. Некоторые вещества оказывают вредное воздействие на человека и окружающий мир. К вредным веществам относятся яды. При работе с химическими веществами следует соблюдать осторожность. Например, нельзя нюхать или пробовать на вкус неизвестные вещества, брать их руками, иначе можно отравиться. Некоторые вещества, попадая на кожу человека, могут вызвать ожоги. При изучении химии вы обязательно познакомитесь с правилами техники безопасности при работе с различными веществами.
Одна из главных задач химии заключается в использовании химических продуктов во всех сферах хозяйства. Прежде чем применить химическое вещество, надо тщательно изучить его свойства. Например, чистый магний легко загорается и дает много света. Эти свойства магния применяются в фотосъемке (магниевая вспышка).
К важной задаче химии относится получение синтетических веществ, которые не встречаются в природе. Новые химические веще¬ства широко используются в разных отраслях народного хозяйства, в быту. К ним относятся хорошо знакомые вам пластмассы, синтети¬ческие волокна, минеральные удобрения, лекарства и краски. Все они получены искусственным путем. Химия вносит свой вклад в развитие технического прогресса и улучшение быта человека. С помощью химии полезные ископаемые перерабатывают в металлы и сплавы, нефть — в топливо, а азот воздуха — в минеральные удобрения. Все эти примеры подтверждают важность химической науки.
Знание предмета химии, проведение лабораторных опытов помогут вам глубже понять многие природные явления, свойства различных веществ. При неправильном использовании химических веществ можно причинить большой вред окружающей среде, жизнедеятельности человека, животным и растениям.
Значение химии в современной жизни, особенно в производственной деятельности человека, неоспоримо. Знание основ химии необходимо всем.
20
5. Закрепление
Работа с учебником – выписать рассмотренные определения
Физическое тело – имеет форму и объём, состоит из вещества.
Вещество – конкретный вид материи, с определёнными свойствами.
Свойства вещества – признаки, по которым вещества отличаются или сходны между собой.
Химия изучает вещества, их состав, свойства и превращения. Вещества — это то, из чего состоят тела. Они отличаются друг от друга физическими и химическими свойствами.
адачи химии — изучение свойств веществ с целью дальней¬шего их применения, получение новых химических веществ, необходимых для нужд человека, рациональное использование природных ресурсов, охрана окружающей среды.
Беседа по вопросам 2,3,6,12,13 (с 7)
10
6. Итог урока
1. Беседа с учащимися :
1. что вы узнали на уроке?
2. чему научились?
3. что вам было интересно?
4. что непонятно?
2. обобщение урока
1. оценка работы всего класса
2. оценка работы учащихся индивидуально
3
7. Д/З
Предисловие – ознакомиться, § 1 – изучить,
ответить на вопросы 16-17
2
Итого:
45
Урок подготовлен: учителем химии Старцевой О.В.
infourok.ru
Урок 1: Химия — наука о веществе
План урока:
Знакомство с химией
Атомно-молекулярное учение. Мельчайшие частицы
Классификация веществ
Знакомство с химией
Когда мы слышим слово «химия», сразу представляем человека, окружённого колбами, пробирками, наполненными веществами всевозможных цветов. Он записывает непонятные символы, которые нам кажутся иероглифами. Перед нами встает вопрос: что это за наука, какие задачи изучает? Ответ достаточно прост, предмет химии – вещества.

(Источник)
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Как и каждая наука, химия имеет свою историю развития. Первые химические знания появились до нашей эры, в Древнем Египте. Египтяне обладали химической наукой, которую называли «Священным искусством». Некоторые рецепты приготовления парфюмерии и лекарственных препаратов используют и до сих пор. Наверняка вы слышали об алхимиках и философском камне, с помощью которого, можно превратить любой металл в золото.
В современном представлении термин «химия» можно услышать в нескольких интерпретациях: химия как наука, а также продукты химического производства (одним словом химия). Мы не представляем наше существование без химических веществ. Просыпаясь утром, идём умываться: мыло, зубная паста ждут нас в ванной комнате. Ароматный чай и хрустящие хлопья на завтрак. Одежда, обувь, школьные принадлежности и многое другое мы получаем благодаря химическим технологиям.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.

(Источник)
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.

(Источник)
Атомно-молекулярное учение. Мельчайшие частицы
Как и каждая наука, химия имеет свои термины и понятия, которые изучаются на протяжении всего курса. Эти термины для вас будут не новыми, вы с ними знакомились на уроках физики и природоведения. А речь пойдёт об атомах, молекулах, химических элементах и веществах. Эти понятия являются основой атомно-молекулярного учения.
Рассмотрим подробно каждое понятие.
Атом
Наверняка вы в учебнике или кабинете химии видели периодическую систему химических элементов (ПСХЭ). Она имеет разный вид и структуру, с которой вы позже подробно познакомитесь. Классический вид периодической системы химических элементов изображён на рисунке.

(Источник)
С уроков природоведения вам известно, что атомы это кирпичики мироздания.
Атом – мельчайшая частица химического элемента, которая отвечает за его свойства и химически неделима.
На данный момент известно 126 видов атомов – химических элементов. Какая связь между химическим элементом и атомом? Химический элемент состоит из атомов определённого вида. В чём состоит отличие этих понятий. Почему алхимики не могли найти философский камень? Почему железо или медь не превращаются в золото? Чтобы ответить на эти вопросы, необходимо рассмотреть строение атома.
Абсолютно каждый атом имеет положительно заряженное ядро и, вращающиеся вокруг него, отрицательные электроны.

(Источник, перевод администрации сайта 100urokov.ru)
Самое тяжёлое в атоме – это ядро, которое состоит с протонов (имеют заряд +) и нейтронов (заряд 0).
Атом не имеет никакого заряда, иными словами нейтрален.
Число протонов = число электронов
Чтобы узнать количество частиц, необходимо определить порядковый номер элемента в ПСХЭ.
Например, если в состав атома входит 10 электронов и 10 протонов, посмотрев в периодическую систему, увидим, что данный набор частиц отвечает химическому элементу – Неон. Химический элемент Золото имеет 79 протонов и 79 электронов. Состав атомов, а точнее, количество протонов, не изменяется в ходе химических реакций. Именно по этой причине, алхимики не смогли найти рецепт философского камня.
Атомы (подобно буквам, которые соединяются в слоги, а потом в слова) соединяются в молекулы.
Молекула
Молекула – наименьшая частица вещества
Как образуются молекулы? Снова проведём аналогию с буквами. Чтобы получилось читаемое и со смыслом слово, необходима определённая комбинация букв и чёткие правила. Также происходит и при образовании молекулы. Атомы соединяются в молекулу с помощью химических связей. Свойства молекул зависят от того, атомы каких элементов входят в их состав, а также каким образом они соединены между собой.
Рассмотрим на примере молекул веществ, которые образованные атомами кислорода, это кислород и озон. Обе эти молекулы образованы атомами химического элемента Кислород, но в состав озона, химическая формула которого О3, входит 3 атома Кислорода, а в молекулу кислорода, формула вещества О2 – два атома химического элемента Кислород.

(Источник)
Данное явление называется аллотропией. Это явление существования простых веществ, образованных одинаковым химическим элементом, но различным по свойствам и строению.
Рекордсменом по образованию аллотропных форм является углерод, который существует в виде алмаза, графита, карбина, фуллеренов, углеродных нанотрубок.
Как видно из определения, атомы и молекулы – это частицы, но в чём их разница? Снова проведём аналогию с буквами и словами. Буквы – это атомы, слова – это молекулы. Буквы не могут состоять из слов, так же как и атомы не могут состоять из молекул.

(Источник)
Молекула сернистого газа SO2 состоит из одного атома Серы и двух атомов Кислорода. Молекула аммиака состоит из одного атома Азота и трёх атомов Водорода и т. д.
Таким образом, мы видим, что все вещества состоят из атомов химических элементов. Живая и неживая природа – это также комбинация химических элементов.
Ионы
Что происходит с атомом, если он присоединяет или отдаёт электроны? Он становится заряженной частицей.

(Источник)
Ионы – частицы, которые положительно или отрицательно заряжены.
Обобщив все вышесказанное, выделим основные постулаты атомно-молекулярного учения, которое является фундаментом в химии, физике и естествознании:
- Вещества состоят из молекул;
- Атомы являются частью молекулы;
- Атомам и молекулам характерно самопроизвольное движение;
- Во время химических реакций происходит изменение состава молекулы и образуются новые вещества.
Вещество. Классификация веществ
От активности химических элементов зависит — будут они существовать в свободном виде или будут частью вещества.
Вещество – это совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии.
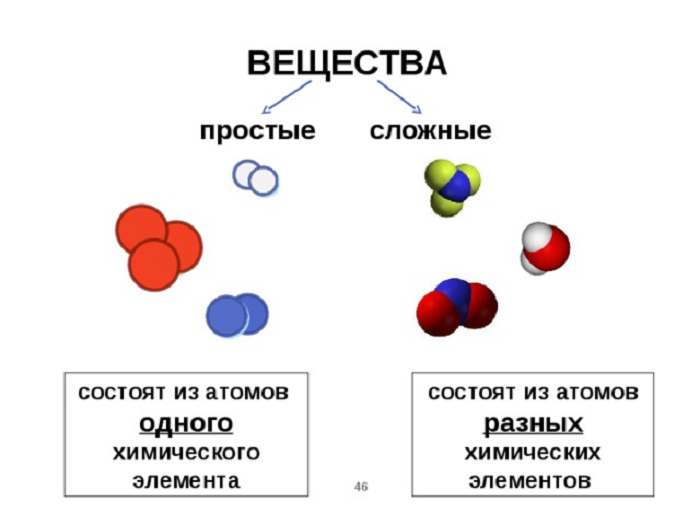
Вещества делятся: простые и сложные.
Определение достаточно несложное и легко запоминается.
(Источник)
Закономерно возникает вопрос: чем сложное вещество отличается от смеси простых и сложных веществ?

(Источник)
На рисунке обозначено:
А) молекулы простого вещества кислород О2;
Б) молекулы простого вещества водород Н2;
В) смесь простых веществ О2 и Н2;
Г) молекула сложного вещества вода Н2О;
Д) смесь молекул простого вещества водород Н2 и сложного вещества Н2О.
Смеси образуются в результате физического воздействия, например, смешивание железных опилок и воды, а сложные вещества – с помощью химического воздействия, например, ржавчина на железе, вызванная взаимодействием железа и воды.
В зависимости от того, какими частицами образованы вещества, их различают молекулярного и немолекулярного строения.

(Источник)
100urokov.ru
Химические, физические свойства веществ
На сегодняшний день существует около 2,5 миллионов разнообразных соединений как природного происхождения, так и синтезированных искусственно человеком. Все они очень разные, часть из них — незаменимые участники биологических процессов, происходящих в живых организмах. Отличают соединения друг от друга свойства веществ. Характеристики и то, что еще позволяет идентифицировать ту или иную химическую молекулу, рассмотрим далее.

Что такое вещество?
Если давать определение этому понятию, то нужно указать на его связь с физическими телами. Ведь веществом принято считать именно то, из чего состоят эти тела. Так, стекло, железо, сера, дерево — это вещества. Примеры можно приводить бесконечно. Проще понять следующее: рассматриваемым термином обозначают все существующее в мире многообразие различных сочетаний молекул, а также простых одноатомных частиц.
Таким образом, вода, спирт, кислоты, щелочи, белки, углеводы, соль, сахар, песок, глина, алмаз, газы и прочее — это все и есть вещества. Примеры позволяют более четко уловить суть этого понятия.
Физическое тело — это продукт, который создается природой или человеком на основе различных соединений. Например, стакан — это тело, которое состоит из стекла, а лист бумаги — это тело, которое представляет собой обработанную целлюлозу или древесину.
Конечно, все молекулы разные. То, что лежит в основе их отличия, называется их свойствами — физическими, органолептическими и химическими. Определяются они при помощи специальных методов, которые у каждой науки свои. Это могут быть и математические, аналитические, экспериментальные, инструментальные способы, и еще множество самых разнообразных. Например, наука химия использует для каждого вещества, вернее, для его идентификации, свой реагент. Он подбирается на основании особенностей строения молекулы и прогнозирования химических свойств. Затем проверяется экспериментально, утверждается и закрепляется в теоретической базе.

Классификация веществ
В основу деления соединений на группы может быть положено множество разных признаков. Например, агрегатное состояние. Все они могут быть по этому фактору четырех видов:
- плазма;
- газ;
- жидкость;
- кристаллическое вещество (твердое).
Если брать за основу более «глубокий» признак, то все вещества можно разделить на:
- органические — в основе цепочки и циклы из атомов углерода и водорода;
- неорганические — все остальные.
По элементному составу, который отражают формулы веществ, все они бывают:
- простые — из одного вида химического атома;
- сложные — два и больше разных типов элементов.
В свою очередь, простые делятся на металлы и неметаллы. Сложные имеют множество классов: соли, основания, кислоты, оксиды, сложные эфиры, углеводороды, спирты, нуклеиновые кислоты и так далее.
Разные виды формул соединений
Что является наглядным, то есть графическим, отображением соединений? Конечно, это формулы веществ. Они бывают разными. В зависимости от вида заключенная в них информация о молекуле тоже отличается. Так, существуют такие варианты:
- Эмпирическая, или молекулярная. Отражает количественный и качественный состав вещества. Она включает в себя символы входящих в состав элементов и индекс в нижнем левом углу у него, показывающий количество данного атома в составе молекулы. Например, Н2О, Na2SO4, AL2(SO4)3.
- Электронно-графическая. Такая формула показывает количество валентных электронов у каждого элемента, входящего в состав соединения. Поэтому по такому варианту уже можно предсказать некоторые химические и физические свойства веществ.
- В органической химии принято использовать полные и сокращенные структурные формулы. Они отражают порядок связи атомов в молекулах, кроме того, четко указывают на принадлежность вещества к тому или иному классу соединений. А это позволяет с точностью определить конкретный тип молекулы и спрогнозировать все характерные для нее взаимодействия.
Поэтому химическая символика и правильно составленные формулы соединений — важнейшая часть работы со всеми известными веществами. Это теоретические основы, которые должен знать каждый школьник, изучающий химию.

Физические свойства
Очень важной характеристикой являются проявляемые физические свойства веществ. Что относится именно к этой группе?
- Агрегатное состояние при различных условиях, в том числе при стандартных.
- Температуры кипения, плавления, замерзания, испарения.
- Органолептические характеристики: цвет, запах, вкус.
- Растворимость в воде и других растворителях (органических, например).
- Плотность и текучесть, вязкость.
- Электро- и теплопроводность, теплоемкость.
- Электрическая проницаемость.
- Радиоактивность.
- Абсорбция и эмиссия.
- Индуктивность.
Также есть ряд показателей, которые очень важны для полного списка, отражающего свойства веществ. Однако они находятся между физическими и химическими. Это:
- электродный потенциал;
- тип кристаллической решетки;
- электроотрицательность;
- твердость и хрупкость;
- ковкость и пластичность;
- испаряемость или летучесть;
- биологическое воздействие на живые организмы (отравляющее, удушающее, нервнопаралитическое, нейтральное, благоприятное и прочее).
Часто эти показатели упоминаются именно тогда, когда рассматриваются уже непосредственно химические свойства веществ. Однако можно указать их и в разделе физических, что ошибкой не будет.

Химические свойства веществ
К данной группе относятся все возможные виды взаимодействий рассматриваемой молекулы с другими простыми и сложными веществами. То есть это непосредственно химические реакции. Для каждого вида соединения они строго специфичны. Однако выделяют общие групповые свойства для целого класса веществ.
Например, все кислоты способны реагировать с металлами согласно их положению в электрохимическом ряду напряжений металлов. Также для всех характерны реакции нейтрализации с щелочами, взаимодействие с нерастворимыми основаниями. Однако концентрированная серная и азотная кислоты особые, так как продукты их взаимодействия с металлами отличаются от полученных в результате реакций с другими представителями класса.
Химических свойств очень много у каждого вещества. Их количество определяется активностью соединения, то есть способностью реагировать с другими компонентами. Есть высокореакционноспособные, есть практически инертные. Это строго индивидуальный показатель.

Простые вещества
К таковым относятся те, что состоят из одного вида атомов, но разного их количества. Например, S8, O2, O3, Au, N2, P4, CL2, Ar и прочие.
Химические свойства простых веществ сводятся к взаимодействию с:
- металлами;
- неметаллами;
- водой;
- кислотами;
- щелочами и амфотерными гидроксидами;
- органическими соединениями;
- солями;
- оксидами;
- пероксидами и ангидридами и прочими молекулами.
Опять же следует указать, что это узко специфичная характеристика для каждого конкретного случая. Поэтому физические и химические свойства простых веществ рассматриваются индивидуально.
Сложные вещества
К данной группе относятся такие соединения, молекулы которых образованы двумя и более разными химическими элементами. Количество каждого из них может быть разным. Для понимания приведем несколько простых примеров:
- H3PO4;
- K3[Fe(CN)6];
- Cu(OH)2;
- LiF;
- AL2O3 и прочие.
Так как все они относятся к разным классам веществ, выделить общие физические и химические характеристики для всех невозможно. Это специфичные свойства, своеобразные и индивидуальные в каждом конкретном случае.

Неорганические вещества
Их на сегодняшний день насчитывается свыше 500 тысяч. Встречаются как простые, так и сложные. Всего можно выделить несколько основных классов неорганических соединений, которые представляют все их многообразие.
- Простые вещества металлы.
- Оксиды.
- Простые вещества неметаллы.
- Благородные или инертные газы.
- Пероксиды.
- Ангидриды.
- Летучие водородные соединения.
- Гидриды.
- Соли.
- Кислоты.
- Основания.
- Амфотерные соединения.
Любой представитель каждого из классов имеет свой набор физико-химических свойств, позволяющих отличить его среди других соединений и идентифицировать.
Свойства органических веществ
Органика — это такой раздел химии, который занимается изучением соединений, отличных от неорганических, и их свойств. В основе их строения лежат атомы углерода, способные соединяться друг с другом в различные структуры:
- линейные и разветвленные цепи;
- циклы;
- ароматические кольца;
- гетероциклы.
Живые организмы состоят как раз из таких соединений, ведь основа жизни — это белки, жиры и углеводы. Все они — представители органических веществ. Поэтому и свойства их особенные. Однако в любом случае, независимо от того, о какой молекуле идет речь, все равно для нее будет характерен определенный набор физико-химических свойств, которые мы уже упоминали раньше.

Что такое живое вещество?
Живым называется вещество, из которого сложена вся биомасса нашей планеты. То есть те организмы, которые составляют жизнь на ней:
- бактерии и вирусы;
- простейшие;
- растения;
- животные;
- грибы;
- люди.
Так как основная часть соединений в составе живого существа — органические, то именно их и можно отнести к группе живого вещества. Однако не все. Только те, без которых невозможно существование представителей живой биосферы. Это белки, нуклеиновые кислоты, гормоны, витамины, жиры, углеводы, аминокислоты и прочие. Термин «живое вещество» был введен Вернадским, основателем учения о биосфере планеты.
Свойства живого вещества:
- обладание энергией с возможностью ее преобразования;
- саморегуляция;
- произвольное движение;
- чередование поколений;
- чрезвычайное разнообразие.
Кристаллы и металлические вещества
Кристаллическими называют все соединения, имеющие определенный тип строения пространственной решетки. Существуют соединения с атомной, молекулярной или металлической кристаллической решеткой. В зависимости от типа отличаются и свойства кристаллических веществ. Типичными твердыми соединениями, имеющими вид мелко- или крупнодисперсных кристалликов, являются различные соли.
Также существуют и простые вещества с подобной структурой, например, алмаз или графит, драгоценные и полудрагоценные камни, минералы, горные породы. Основные свойства их:
- твердость;
- хрупкость;
- средние температуры плавления и кипения.
Однако, как и всегда, каждая характеристика не может подходить для всех.
Металлические свойства вещества проявляют металлы, их сплавы. Для них можно выделить набор общих характеристик:
- ковкость и пластичность;
- высокие температуры кипения, плавления;
- электро- и теплопроводность;
- металлический блеск.
fb.ru