Основные законы химии
Закон сохранения массы и энергии
Один из фундаментальных и общих законов природы — закон сохранения массы — был открыт М.В.Ломоносовым и Л.Лавуазье независимо друг от друга:
Общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, образующихся в результате реакции.
Из закона сохранения массы веществ следует важный следствие закона сохранения массы: количество атомов каждого элемента до и после реакции остается постоянным.
Реакция между Н 2 и О 2 с образованием Н 2 О — подтверждение следствия из закона сохранения массы: количество атомов каждого элемента, которые содержатся в исходных веществах, равно числу атомов этого элемента в продуктах реакции.Сам Ломоносов считал, что закон сохранения массы веществ является частью более общего закона природы и может быть распространен на другие формы движения материи. Он утверждал, что тело, которое своим толчком возбуждает другое тело к движению, теряет от своего движения столько же, сколько отдает другому. Согласно гипотезе Ломоносова изменения в природе происходят так, что если к чему-то несколько прибавилось, то это отнимется у чего-то другого.
Эта гипотеза была развита только после открытия второй части универсального закона природы — закона сохранения энергии (Майер, 1842 г.):
Энергия не возникает и не исчезает бесследно, а лишь превращается из одной формы в другую в эквивалентных количествах.
Законы сохранения массы и энергии отражают принцип сохранения материи и движения , сущность которого заключается в современном виде формулируется так:
В изолированной системе сумма масс и энергий является постоянной, то есть суммарные массы и энергии веществ, вступающих в реакцию, равны суммарным массам и энергиям продуктов реакции.
Закон сохранения энергии как философский принцип не выводится из более общих постулатов. С физической точки зрения он является следствием однородности времени, то есть тот факт, что законы природы в течение времени не изменяются.
Энергия — это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не возникает и не уничтожается, она может только переходить из одной формы в другую. Например, энергия химического взаимодействия может превращаться в тепловую энергию излучения.
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Если химическое соединение имеет молекулярную структуру, то независимо от условий добычи состав ее остается постоянным. Состав химического соединения, не имеющего молекулярной структуры, может изменяться в определенных пределах в зависимости от условий добычи.
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Соотношение объемов газов, вступающих в реакцию и образующихся в результате нее, представляет собой соотношение простых чисел, которые являются кратными стехиометрических коэффициентов, стоящих в уравнении реакции перед формулами соответствующих газов.
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.
Закон Авогадро
Одним из важнейших газовых законов является закон Авогадро:
В равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул:
N=const, если P,V,T=const, где NN — количество молекул; P, V, T — давление, объем, температура соответственно.


Но поскольку число молекул в реальных образцах вещества очень велико, то была введена универсальная количественная характеристика, которая описывает численный состояние веществ:
Количество вещества ν (или n ) — это физическая величина, определяемая числом частиц — структурных элементов вещества: молекул, атомов, ионов, ионных ассоциатов и тому подобное.
Единицей ее измерения является [ моль ] — одна из основных единиц системы СИ.
Моль — это количество вещества, содержащее столько же структурных элементов вещества, сколько атомов содержится в изотопе углерода-12 массой 12 · 10-3 кг.
Установлено, что масса одного атома изотопа углерода-12 составляет 19,92 · 10-27 кг. Тогда число атомов N в 12 · 10-3 кг равна:


Число, равное 6,02 · 10 23 моль-1, называется постоянной Авогадро.
Постоянная Авогадро обозначается NA и указывает на число частиц — структурных элементов веществе, количество которой составляет 1 моль и поэтому имеет размерность моль -1.
Итак, моль любых структурных элементов — это такое количество вещества, которое содержит 6,02 · 1023 частиц. Например, 1 моль Н2О состоит из 6,02 · 1023 молекул Н2О и содержит 2 моль (или 2 · 6,02 · 1023 ) атомов Н и 1 моль (или 6,02 · 1023 ) атомов В ; 1 моль SO42- содержит 6,02 · 10 23 ионов SO42-, в том числе 1 моль (6,02 · 10 23 ) атомов S и 4 моль (4 * 6,02 · 1023 ) атомов О .
Количество вещества связано с числом частиц N и постоянной Авогадро NA зависимостью ν=N/NA.
Масса одного моля вещества называется молярной массой этого вещества, она обозначается через М .
Молярная масса — это физическая величина, определяемая отношением массы вещества к количеству вещества, которое ей отвечает: M=m/ν.
Единицей измерения молярной массы в системе СИ является [кг / моль], но в химии чаще пользуются внесистемной величиной [г / моль], или [г × моль-1 ].
Молярная масса М связана с относительной молекулярной массой Mr и постоянной Авогадро NA зависимостью M=Mr⋅NA⋅1а.в.м.
Например, относительная молекулярная масса оксида углерода равна Mr(CO2)=12+2⋅16=44, а атомная единица массы составляет 1 а.о.м. = 1,66 × 10-24 г, тогда молярная масса будет М (СО2 ) = 44 × 6,02 · 1023 · 1,66 · 10-24 = 44г / моль.
То есть молярная масса численно равна относительной молекулярной массе, но имеет совсем другой физический смысл: М
Закону Авогадро подлежат все газы независимо от размеров их молекул. Не подлежат ему газы в условиях низких температур и высокого давления, а также вещества в жидком или твердом состоянии. Это объясняется так. Как известно, объем, занимает определенное количество вещества, определяется тремя параметрами: числом составляющих частиц, расстояниями между ними и их размерами. В газах в условиях высоких температур и низкого давления расстояния между молекулами в тысячи раз больше их размеры, поэтому размерами молекул можно пренебречь. В результате объем газа будет оговариваться уже только двумя параметрами: числом молекул и расстояниями между ними. Но при одинаковых условиях (давление и температура) расстояния между молекулами в различных газах одинаковы, поэтому в этом случае равные объемы различных газов содержат одно и то же число молекул.
При низких температурах и под высоким давлением расстояния между молекулами в газах уменьшаются и становятся соизмеримыми с размерами самих молекул, поэтому объем газа зависит от размеров молекул, а газы перестают подлежать закону Авогадро.
Очень часто бывает необходимым знать молярную массу воздуха, которая исчисляется как и молярная масса любой смеси газов с учетом объемной доли φφ каждого газа.
Объемные доли кислорода и азота в воздухе примерно составляют φ(O2)≈0,2 (или 20%), φ(N2)≈0,8 (или 80%). Тогда молярная масса воздуха:
М воздуха =φ(O2)× М (О 2 ) + φ(N2) × М (N2 ) = 0,2 × 32 + 0,8 × 28 = 29г / моль.
1-е следствие закона Авогадро
Один моль любого газа при нормальных условиях (н.у.) занимает объем примерно 22,4 л (0,0224 м3 ).
Эта величина называется молярным объемом , обозначается V M и измеряется в [л / моль] или [м 3 / моль].
Нормальными условиями считаются:
Молярный объем — это эмпирически установленная величина на основе соотношений:


где ρρ — плотность газа, [г / л], или [кг / м 3 ].

 Молярный oбьем газов: при н.у. V M = 22,4л / моль
Молярный oбьем газов: при н.у. V M = 22,4л / мольМолярный объем в отличие от молярной массы не является постоянной величиной, а зависит от условий (Р, Т), поэтому VM как понятие употребляют обычно для газов при н.у. Молярный объем связан с другими величинами (объемом V , количеством вещества ν , молярной массой М , плотностью ρ, Числом Авогадро NA и количеством частиц N ) соотношениями:


2-е следствие закона Авогадро
Отношение плотности одного газа в плотности другого газа при одинаковых условиях равна отношению их молярных масс М или относительных молекулярных масс Мr .
Эта величина называется плотностью одного газа по другому и обозначается буквой d или D:
ρ1= ρ2⋅ d2ρ1=ρ2⋅d2 (газа 1), ρ2= ρ1/ d2ρ2=ρ1/d2 (газа 1)
М (газа 1) = d 2 (1) × M (газа 2) M (газа 2) = M (газа 1) / d 2 (газа 1).
Относительная плотность d — это величина безразмерная, она показывает, насколько один газ тяжелее другого.
Основные газовые законы
Состояние газа характеризуется его объемом, давлением и температурой. Между этими величинами экспериментально были установлены следующие законы:
- Закон Бойля-Мариотта (изотермический) сокращенно записывается так:
- при Т = const
- Р 1 · V 1 = Р 2 · V 2 , или Р · V = const;
- Закон Гей-Люссака (Изобарный)
- при Р = const
- V 1 / T 1 = V 2 / T 2 , или V / T = const.
- Закон Шарля (Изохорный)
- при V = const
- Р 1 / T 1 = Р 2 / T 2 , или Р / T = const.
Все три закона можно объединить в один универсальный газовый закон , который описывается уравнением Клапейрона:


Зависимость для одного моля газа была выведена Менделеевым, поэтому называется уравнением Менделеева-Клапейрона. Оно содержит постоянную величину -универсальную газовую постоянную R.



 Расчеты значений универсальной газовой постоянной R
Расчеты значений универсальной газовой постоянной RЗакон эквивалентов
Из закона постоянства состава следует, что элементы сочетаются друг с другом в определенных количественных соотношениях, для характеристики которых было введено понятие эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ).
Эквивалентом называется условная или реальная частица вещества, которая может присоединять, замещать, отдавать или взаимодействовать иным образом с одним ионом водорода Н+ или гидроксила ОН— в кислотно-основных (или ионообменных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, эквивалентом азотной (азотной) кислоты реальная частица — молекула HNO3 , содержащей один ион Н+ ; эквивалентом ортофосфатной (фосфорной) кислоты — условная частица, соответствует 1/3 молекуле Н3РО4 , в состав которой входят три иона Н+.
Но эквиваленты одного элемента могут быть разными — в зависимости от валентности элемента. Так же сложное соединение может иметь разные эквиваленты, что обусловлено характером ее химического взаимодействия. Например, в реакции нейтрализации ортофосфорная кислота калий гидроксидом
H3PO4 + 2KOH →→ K2HPO4 + 2H2O
только два атома Н кислоты замещаются атомами К (то есть кислота показывает основность 2). Тогда согласно определению, эквивалентом H3PO4 будет условная частица, которая составляет 1 / 2H3PO4 , поскольку на один атом Н приходится именно половина молекулы H3PO4.
Итак, эквивалент — это фактически один вид молекулы, которая соответствует одному атому Н или иона Н+.
Число, показывающее, какая часть молекулы или иной частицы вещества соответствует эквиваленту, называется фактором эквивалентности fЕ .
Эквивалент и фактор эквивалентности: а) fЕ (HCl) = 1; б) fЕ (CaCl2 ) = 1/2; в) fЕ (AlCl3 ) = 1/3; г) fЕ (CCl4 ) = 1/4; д) fЕ (PCl5 ) = 1/5; е) fЕ (SCl6 ) = 1/6. (Эквиваленты соединений окрашенные темным оттенком):


Поскольку эквиваленты элемента и эквиваленты сложного соединения могут быть разными, то как следствие, и фактор эквивалентности тоже будет иметь разные значения, для вычисления которого существуют простые формулы:
| частица | фактор эквивалентности | примеры |
|---|---|---|
| элемент | f Е = 1 / В, где В — валентность элемента | f Е (Р в P2O5 ) = 1/5; f Е (С в СН4 ) = 1/4 |
| простое соединение | f Е = 1 / ч · В, где В — валентность элемента, ч — число атомов элемента (индекс в химической формуле) | f Е (H2 ) = 1 / (2 * 1) = 1/2; f Е (O2 ) = 1 / (2 * 2) = 1/4; f Е (Cl2 ) = 1 / (2 * 1) = 1/2; f Е (O3 ) = 1 / (3 · 2) = 1/6 |
| оксид | f Е = 1 / ч · В, где В — валентность элемента, ч — число атомов элемента (индекс в химической формуле) | f Е (Cr2O3 ) = 1 / (2 * 3) = 1/6; f Е (CrO) = 1 / (1 * 2) = 1/2; f Е (H2O) = 1 / (2 * 1) = 1/2; f Е (P2O5 ) = 1 / (2 * 5) = 1/10 |
| кислота | f Е = 1 / ч (H + ), где ч (H + ) — число атомов H, замещенных в ходе реакции (основность кислоты) | f Е (H2SO4 ) = 1/1 = 1 (если основность в реакции равен 1) или f Е (H2SO4 ) = 1/2 (Если основность равен 2) |
| основа | f Е = 1 / ч (ОН — ), где ч (ОН — ) — число гидроксильных групп ОН — , замещенных в ходе реакции (кислотность основы) | f Е (Cu (OH)2 ) = 1/1 = 1 (Если кислотность в реакции равен 1) или f Е (Cu (OH)2 ) = 1/2 (Если кислотность в реакции равен 2) |
| соль | f Е = 1 / ч (Me) · B (Me) = 1 / ч (An) · В (An), где ч (Ме) — число атомов металла, замещенных в ходе реакции, B (Me) — валентность металла, ч (An) — количество замещенных кислотных остатков, · В (An) — валентность кислотного остатка (или его заряд по абсолютной величине) | F Е (Cr2 (SO4 )3 ) = 1 / (2 * 3) = 1/6 (расчет по металлу) или f Е (Cr2 (SO4 )3 ) = 1 / (3 * 2) = 1/6 (расчет по кислотному остатка) |
| Ион | f Е = 1 / | z |, где | z | — заряд иона по абсолютной величине | f E (SO4 2- ) = 1/2; f E (TiO2 2 + ) = 1/2 |
| Частица в окислительно-восстановительной реакции | f Е = 1 / ч (ē), где ч (ē) — число электронов, участвующих в процессе восстановления или окисления частицы | Восстановление: Fe2+ + 2ē →→ Fe0 f E (Fe2+ ) = 1/2; окисление: CrO4 2- + 8H + + 3ē →→ Cr 3+ + 4H2O f E (CrO4 2 — ) = 1/3 |
Как частица эквивалент характеризуется количеством вещества nэкв и молярной массой эквивалента mэкв , которую чаще для сокращения называют просто эквивалентной массой.
Эквивалентная масса элемента — это масса одного моль эквивалентов, равная отношению молярной массы элемента к его валентности в соединении (или произведения фактора эквивалентности на молярную массу элемента): mэкв.элемента = f E · Мэлемента .
Если хоть одно вещество находится в газообразном состоянии, то удобнее использовать понятие молярный объем эквивалента (или просто — эквивалентный объем ), который рассчитывают по формуле
- Vэкв.газа = V М / ч · В,
- где V М — молярный объем газа (V М = 22,4л / моль (н.у.), ч — количество атомов элемента, В — валентность.
К примеру:
V экв (Н 2 ) = 22,4 / 2 · 1 = 11,2л / моль,
V экв (О 2 ) = 22,4 / 2 * 2 = 5,6л / моль,
V экв (NН 3 ) = 22,4 / 1 * 3 = 7,5л / моль,
V экв (СО 2 ) = 22,4 / 1 * 4 = 5,6л / моль.
Количество эквивалентов nэкв — это число эквивалентов, определяется отношением массы вещества к молярной массы эквивалента или отношением объема газа к его эквивалентному объему:
- nэкв = mвещества / m экв
- nэкв = Vгаза / Vэкв.газа
Молярная масса эквивалента mэкв (эквивалентная масса) имеет размерность [г / моль], молярный объем эквивалента Vэкв.газа — [л / моль], а количество эквивалентов — [моль], (иногда [моль-экв]).
Моль эквивалентов соединения — это такое его количество, которое взаимодействует без остатка с 1 моль эквивалентов атомов водорода или в общем случае — с 1 моль эквивалентов любой вещества.
Понятие количества эквивалентов и эквивалентных масс распространяется и на сложные вещества. Для определения эквивалентной массы сложного состава используются простейшие правила.
Например, эквивалентные массы ионов VO3+ и SO4 2- равны:
mэкв (VO3+ ) = 68 / | +3 | = 22,7г / моль, mэкв (SO4 2- ) = 96 / | -2 | = 48г / моль;
- Эквивалентная масса оксида равна отношению его молярной массы М к произведению валентности элемента В на число атомов элемента.
- Эквивалентная масса кислоты равна отношению ее молярной массы М к основности — количества атомов Н, способных замещаться атомами металла.
- Эквивалентная масса основы равна отношению ее молярной массы М к кислотности — количества гидроксильных групп ОН, которые замещаются на кислотный остаток.
- Эквивалентная масса соли равна отношению ее молярной массы М к произведению валентности В металла на количество его атомов.
- Эквивалентная масса иона равна отношению его молярной массы М к абсолютной величине заряда Z.
- Эквивалентная масса бинарного соединения любого элемента с водородом равна отношению молярной массы этого соединения к валентности элемента.
- Эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей.
Например, эквивалентные массы представителей различных классов неорганических соединений:
m экв. оксида = m экв.элемента + m экв. кислорода ,
m экв (Na 2 O) = m экв (Na) + m экв (O) = 23 + 16/2 = 31г / моль.
m экв. основы = m экв (Me) + m экв (ОН — ),
m экв (Ва (ОН) 2 ) = m экв (Ва 2+ ) + m экв (ОН — ) = 137/2 + 17 = 85,5г / моль.
M экв.кислоты = m экв (Н + ) + m экв.кислотного остатка ,
M экв (H 2 SO 4 ) = m экв (H + ) + m экв (SO 4 2 — ) = 1 + 96/2 = 49г / моль.
M экв.соли = m экв (Me) + m экв.кислотного остатка ,
m экв (К 2 СО 3 ) = m экв (К + ) + m экв (СО 3 2 — ) = 39 + 60/2 = 69г / моль.
Закон эквивалентов был экспериментально установлен Рихтером (1797 р.) И окончательно сформулирован Дальтоном (1803р.):
Химические соединения реагируют между собой в эквивалентных соотношениях.
Из этого следует, что для двух любых веществ одной химической реакции (исходных реагентов или продуктов реакции) закон эквивалентов можно выразить так:
Однако при практических расчетах иногда удобнее пользоваться другой формулировкой закона эквивалентов: массы веществ (объемы газов), взаимодействующих между собой, пропорциональны их эквивалентным массам (объемам газов).


И в заключение приведем основные законы химии, сведенные в таблицу:


Основные законы и понятия химии
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na– натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента — кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Сложное вещество, или соединение, — это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления
может иметь положительное, отрицательное
и нулевое значения, которые обычно
ставятся над символом элемента сверху.
Например,  ,
,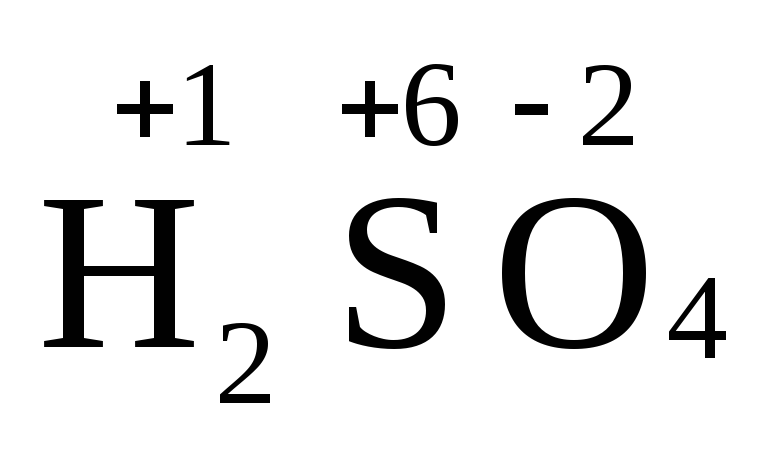
 .
Степень окисления элементов в простых
веществах равна нулю
.
Степень окисления элементов в простых
веществах равна нулю 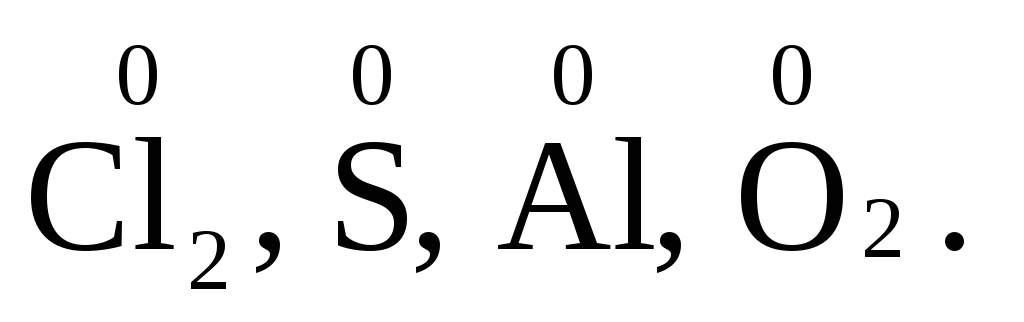 Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро
Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро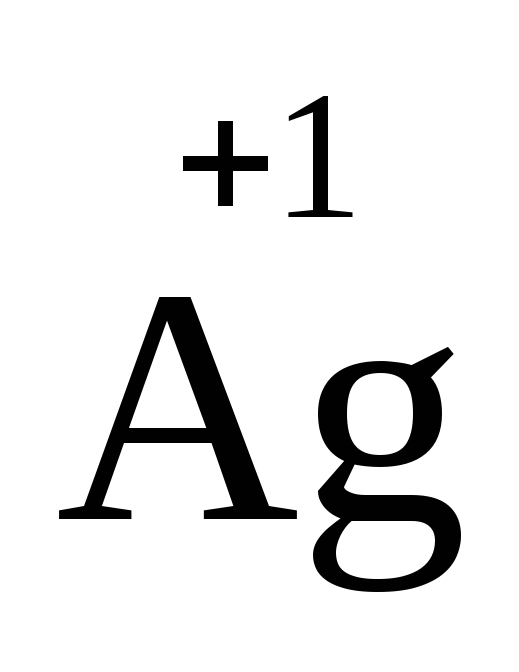 ,
цинк
,
цинк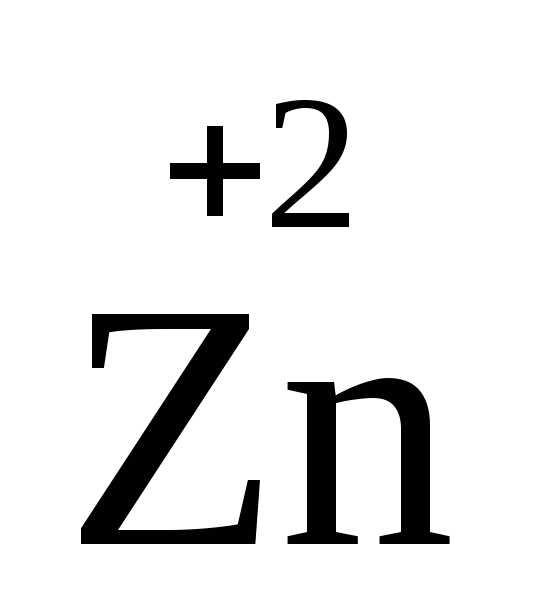 , кадмий
, кадмий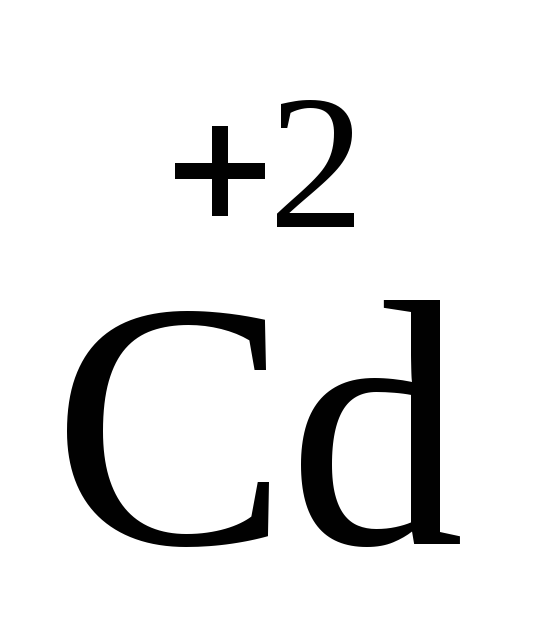 ,
алюминий
,
алюминий .
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1
.
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1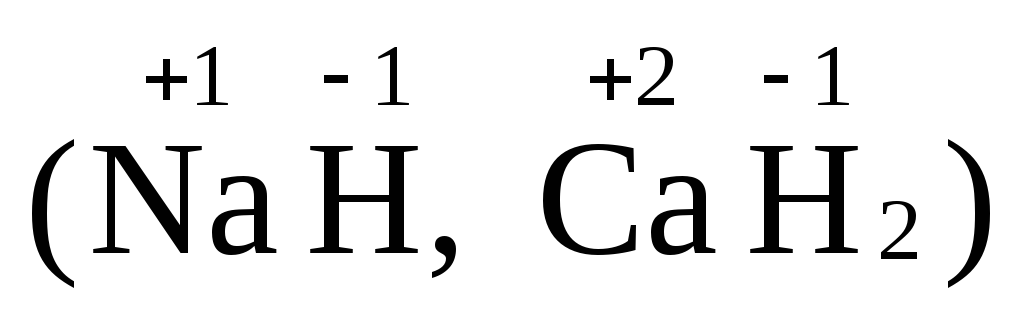 .
Степень окисления кислорода практически
постоянна и составляет –2.
.
Степень окисления кислорода практически
постоянна и составляет –2.
Большинство элементов
имеет переменную степень окисления,
например, 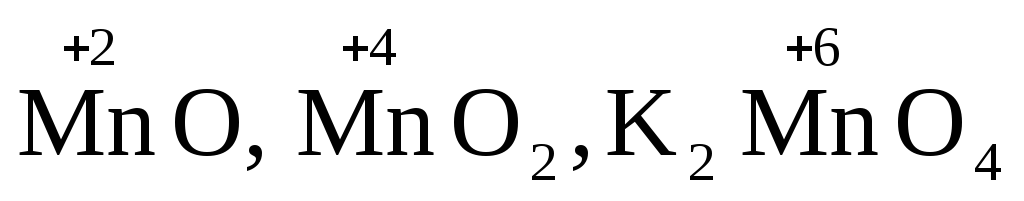 .
.
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023структурных единиц. Число 6,02×1023называется числом Авогадро. ¥
Применяя понятие
«моль», необходимо в каждом конкретном
случае указывать, какие именно структурные
единицы имеются в виду. Например, следует
различать моль атомов Н, моль молекул
Н2, моль ионов Н+. В моле
атомов, молекул, ионов водорода содержится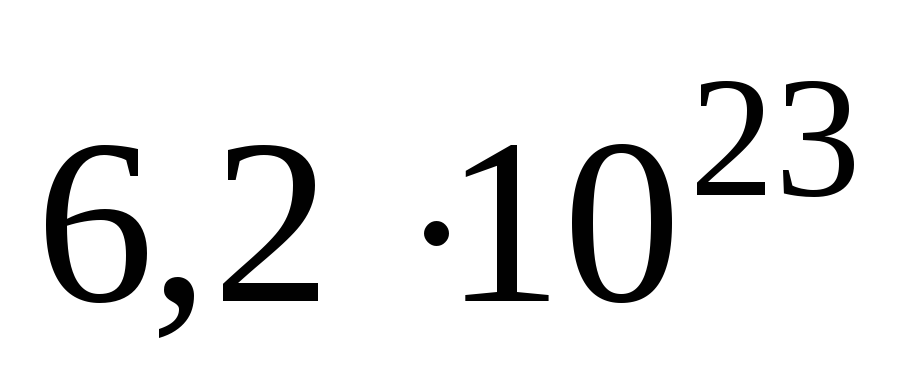 атомов, молекул, ионов водорода
соответственно.
атомов, молекул, ионов водорода
соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой

после подбора коэффициентов будет выглядеть следующим образом:
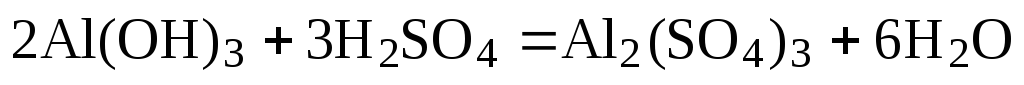 (1)
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:
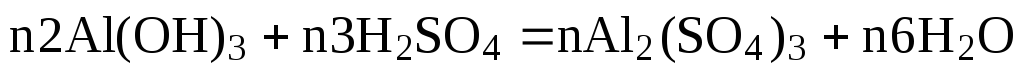
Примем nравным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а) 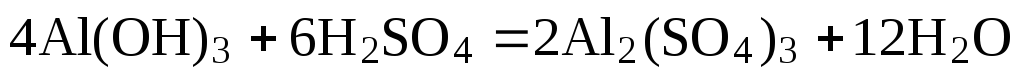 (2)
(2)
б) 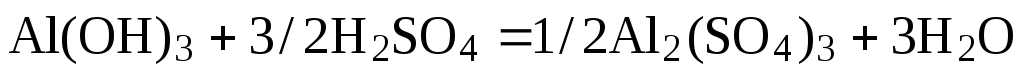 (3)
(3)
Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:
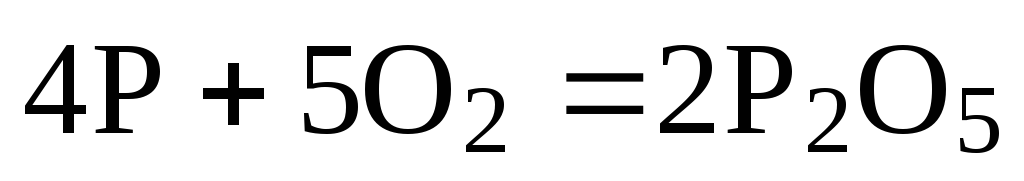 а)
а)
 б)
б)
Чтобы исключить
промежуточное вещество 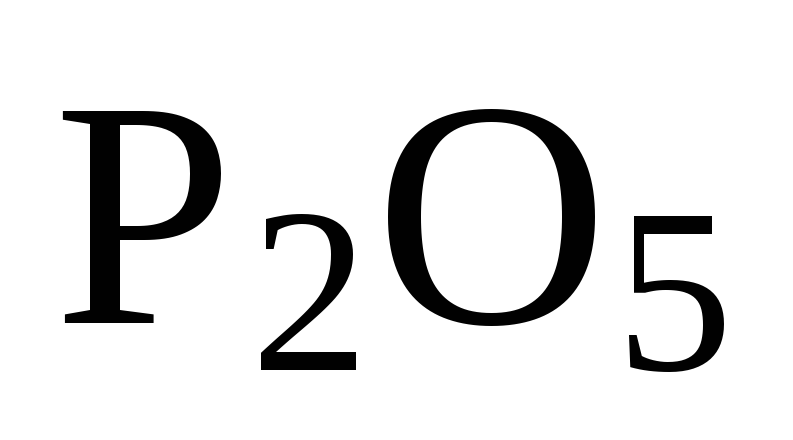 ,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
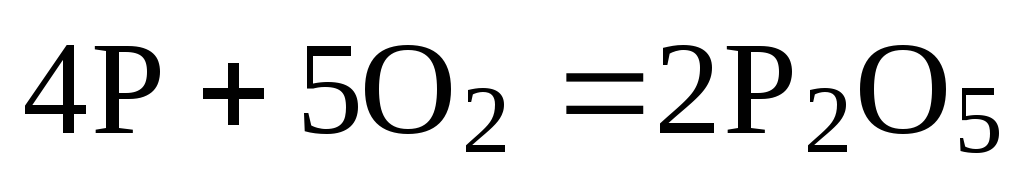
+
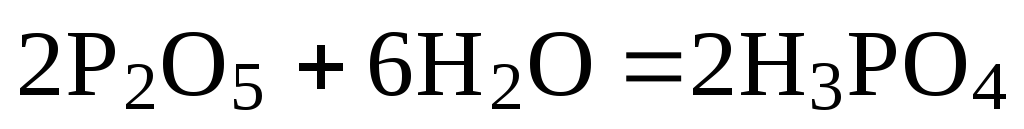
______________________

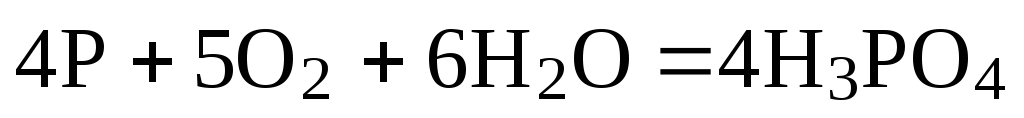
Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры.
Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро.
В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул.
В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро):
При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Поскольку
объем данной массы газа зависит от
давления и температуры, то при расчетах
по химическим реакциям с участием
газообразных веществ необходимо
указывать условия, при которых находится
газ. Наиболее употребительными являются
так называемые «нормальные» условия
(н.у.). К нормальным условиям относятся:
температура 00С (273К) и давление,
равное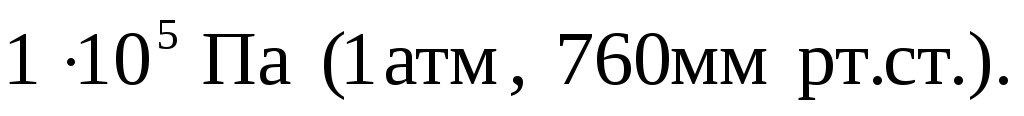
Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л.
Этот объем называется молярным или мольным объемом газа при нормальных условиях.
Вещества, способные распадаться в растворе или в расплаве на заряженные частицы (ионы), называются электролитами.
Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Катионами являются ионы водорода, Н+, ион аммония,NН+4, ионы металлов, например,Na+,Ca2+,Al3+. К анионам относятся гидроксид-ион, ОН—, ионы кислотных остатков, например,Cl—,NO3—,SO42-.
Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Так, натрий и калий разлагают воду с выделением водорода, а ионы Na+иK+такими свойствами не обладают.
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
Электролитическая диссоциация является обратимым процессом, т.е. в растворе или расплаве одновременно протекают две реакции: распад молекул на катионы и анионы (КАК++ А—) и ассоциация (соединение) ионов в молекулы (К++ А—КА). Поэтому уравнение реакции электролитической диссоциации записывается следующим образом: КАК++А—; знакуказывает на обратимость процесса.
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов одновременно присутствуют не только ионы, но и молекулы, не распавшиеся на ионы. Способность молекул данного электролита диссоциировать в растворе или расплаве характеризуется степенью диссоциации .
Степенью диссоциации называется отношение числа молекул (молей) электролита, распавшихся на ионы, к общему числу его молекул (молей). Степень диссоциации выражается либо в долях единицы, либо в процентах.
Все электролиты подразделяются на сильные и слабые. Сильные электролиты диссоциируют практически нацело, степень их диссоциации близка к единице (100%). В растворах сильных электролитов содержатся преимущественно ионы, недиссоциированных молекул практически нет.
Слабые электролиты характеризуются малой степенью диссоциации, поэтому в растворе присутствует значительное количество непродиссоциированных молекул.
К электролитам относятся кислоты, основания и соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком.
Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+и анионNO3—(нитрат-ион)
HNO3 Н++ NO3—.
Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные.
Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл.
Кислоты бывают разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы.
Слабые кислоты диссоциируют ступенчато. Например, угольная кислота диссоциирует в две ступени:
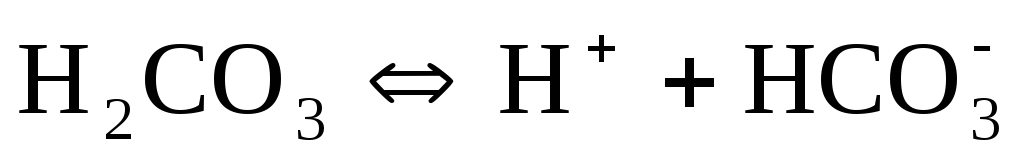
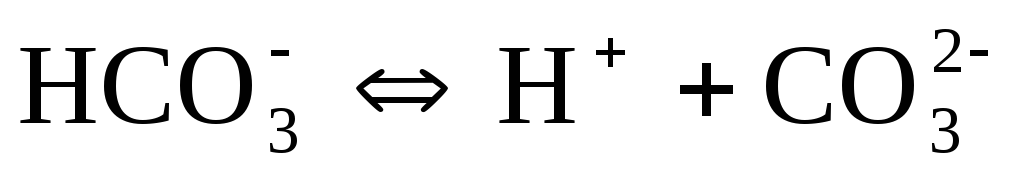
Названия кислотных остатков, полученных при ступенчатой диссоциации кислот, образуются прибавлением приставки гидро- или дигидро- (по числу оставшихся в анионе ионов водорода) к названию кислотного остатка, полученного при полной диссоциации кислоты. Например, ион СО32-называется карбонат-ионом, а ион НСО3—— гидрокарбонат-ионом, ион РО43-называется фосфат-ионом (или ортофосфат-ионом), ионHPO42-– гидрофосфат-ионом, а ион Н2РО4—— дигидрофосфат-ионом).
В таблице приведены формулы и названия некоторых кислот и их кислотных остатков.
Таблица
Формулы и названия кислот и кислотных остатков
Формула кислоты | Название кислоты | Кислотный остаток (анион) | Название аниона |
HCl | Сильные кислоты Соляная (хлористо-водородная) | Cl— | Хлорид |
HBr | Бромисто-водородная | Br— | Бромид |
HJ | Йодисто-водородная | J— | Иодид |
HNO3 | Азотная | NO3— | Нитрат |
H2SO4 | Серная | SO42 HSO4— | Сульфат Гидросульфат |
HF | Слабые кислоты Фтористо-водородная | F— | Фторид |
HNO2 | Азотистая | NO2— | Нитрит |
Формулы и названия кислот и кислотных остатков
H2S | Сероводородная | S2- HS— | Сульфид Гидросульфид |
H2SO3 | Сернистая | SO32- HSO3— | Сульфит Гидросульфит |
H2CO3 | Угольная | CO32- HCO3— | Карбонат Гидрокарбонат |
H2SiO3 | Кремниевая | SiO32- HSiO3— | Силикат Гидросиликат |
H3PO4 | Ортофосфорная(фосфорная) | PO43- HPO42- H2PO4— | Фосфат Гидрофосфат Дигидрофосфат |
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН—).
Основания имеют формулу Me(OH)n, где Ме — ион металла; ОН—— гидроксильная группа; n — количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2.
Запишем уравнение диссоциации основания на примере КОН
КОНК++ОН—
Названия гидроксидов образуются из слова гидроксид и названия металла: NaOH — гидроксид натрия, Ba(OH)2 — гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 — гидроксид железа (П), Fe(OH)3 — гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия — едкое кали, гидроксид натрия — едкий натр, гидроксид кальция — гашеная известь.
Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH — однокислотное основание, Cu(OH)2 — двухкислотное.
Названия катионов, содержащих, кроме металла, гидроксильные ионы. образуются из названия металла с прибавлением приставки гидроксо-, причем, если в состав катиона входят две гидроксогруппы, то название будет включать приставку дигидроксо-. Так, катион, образующийся на первой стадии диссоциации гидроксида алюминия, Al(OH)2+, называется ионом дигидроксоалюминия, а катион, образующийся на второй стадии, Al(OH)2+ — ионом гидроксоалюминия.
Основания подразделяются на растворимые и нерастворимые, а также сильные и слабые. Так, все гидроксиды 1А группы Периодической системы элементов Д.И. Менделеева, например, NaOH, KOH, а также гидроксиды щелочно-земельных металлов, Ca(OH)2, Sr(OH)2, Ba(OH)2 — хорошо растворимые соединения и сильные электролиты. Они называются щелочами. Большинство гидроксидов других металлов плохо растворяются в воде и являются слабыми электролитами. Гидроксид аммония, NH4OH, диссоциирующий по уравнению NH4OH NH4++OH—, является слабым электролитом, но хорошо растворим в воде.
Существуют гидроксиды, способные проявлять как свойства кислот, так и свойства оснований. Такие гидроксиды называются амфотерными. К ним относятся, например, Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 и др.
Солями называются электролиты, полученные при замещении ионов водорода в кислоте на ионы металла или гидроксид-ионов основания на анионы кислотного остатка.
При полном замещении образуются средние соли, например, K2SO4,Al(NO3)3,CuCO3. Средние соли состоят из ионов металла и ионов кислотного остатка, полученного при полном отщеплении всех ионов водорода в процессе диссоциации кислоты.
Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную валентность, то она указывается римской цифрой. Например, K2SO4– сульфат калия,Al(NO3)3– нитрат алюминия,CuCO3– карбонат меди (II).
При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4– гидрофосфат калия,KH2PO4– дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты.
Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, — то дигидроксо-, например CuOHCl– хлорид гидроксомеди (II),Al(OH)2NO3– нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания.
Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются.
Кислоты, основания и соли — это электролиты. К неорганическим соединениям относится еще один класс соединений, которые не являются электролитами, — оксиды.
Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород.
Примеры оксидов: NO, NO2, Mn2O7, ZnO, K2O.
Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO — оксид азота (П), NO2— оксид азота (IV), Mn2O7-оксид марганца (VII). В названиях последних трех оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3— оксид алюминия, ZnO оксид цинка, K2O — оксид калия.
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями. К ним относятся NO, N2O, CO.
Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные.
Основные оксиды — это оксиды, которым соответствуют основания.
Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO — основание Ca(OH)2.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Оксиду углерода (IV) — СО2 — соответствует угольная кислота Н2СО3, оксиду фосфора (V) — Р2О5— фосфорная кислота,H3PO4.
Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5– фосфорный ангидрид, СО2– угольный ангидрид.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления углерода в СО2и Н2СО3равна +4, а степень окисления фосфора в Р2О5и Н3РО4равна +5.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислоты, так и основания.
Так, оксид цинка ZnO — амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) — Cr(OH)3— тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений.
1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ

Исторически при изучении состава, строения веществ и их химических превращений были сформулированы основные законы и понятия химии. Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, её основу составляют стехиометрические законы: сохранения массы и энергии веществ, постоянства состава, эквивалентов, объемных отношений, закон Авогадро и др. Рассмотрим некоторые из них.
Закон сохранения массы и энергии. В 1748 г. М. В. Ломоносов выска-
зал теоретически, а затем в 1756 г. экспериментально обосновал закон сохра-
нения массы веществ: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
С точки зрения атомно-молекулярного учения суть закона сохранения массы веществ заключается в том, что при химических реакциях атомы не исчезают и не возникают из ничего – их количество остаётся неизменным до и после реакции. Поскольку атомы имеют постоянную массу, а их количество в результате реакции не изменяется, то масса веществ до и после реакции остаётся постоянной:
2Zn + O2 = 2ZnO
Современная формулировка закона такова: в изолированной системе сумма масс и энергий постоянна.
Итак, закон сохранения массы веществ и энергии – это две стороны единого закона природы – вечности материи и её движения.
Закон постоянства состава был сформулирован в 1801 г. Ж. Л. Пру-
том: всякое чистое вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Рассмотрим в качестве примера воду, в молекуле которой содержится 11,19 % водорода, 88,81 % кислорода. Воду можно получить различными способами, например:
2Н2 + О2 = 2Н2О
NaOH + HCl = h3O + NaCl
Cu(OH)2 = h3O + CuO
Во всех случаях вода, независимо от способа получения, имеет приведенный выше состав.
Последующее развитие химии показало, что существуют соединения как постоянного, так и переменного состава. По предложению академика Н. С. Курнакова, первые назвали дальтонидами (в память английского фи-
Химия. Учеб. пособие | -7- |

1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
зика и химика Дальтона), вторые – бертоллидами (в память французского химика Бертолле). Состав дальтонидов можно представить в виде простых формул с целочисленным стехиометрическими индексами, например: h3O,
HCl, Ch5, C6H6.
У бертоллидов состав выражается дробными стехиометрическими индексами. Так, оксид титана (II) TiO в действительности имеет состав от TiO0,7
до TiO1,3, а состав оксида титана (IV) TiO2 изменяется от TiO1,9 до TiO2,0 (в зависимости от условий синтеза). Бертоллиды распространены среди ок-
сидов, гидридов, сульфидов, нитридов, карбидов, силицидов и других кристаллических неорганических соединений.
В связи с этим в современную формулировку закона постоянства состава следует внести уточнение: состав соединений дальтонидов является постоянным независимо от способов получения, а состав соединений с кристаллической структурой (бертоллидов) зависит от условий их получения.
Элементы взаимодействуют друг с другом в строго определенных ко-
личественных соотношениях. Это следует из закона постоянства состава. Закон эквивалентов был предложен М. Рихтером в 1792 г.: массы реа-
гирующих и образующихся веществ относятся между собой как молярные массы эквивалентов (объемов) этих веществ.
Для реакции
А + В = АВ
закон эквивалентов можно представить формулой
mА = МЭ.А , mВ MЭ.В
где mA, mB – массы веществ А и В; МЭ.А, МЭ.В – молярные массы эквивалентов веществ А и В.
Одновременно с установлением этого закона Дальтоном было введено понятие эквивалента. Химическим эквивалентом вещества называется его реальная или условная частица, которая эквивалентна одному катиону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Так, в соединениях HCl и NaH один атом водорода соединяется с одним атомом хлора и с одним атомом натрия. Эквиваленты хлора и натрия равны 1.
За единицу количества вещества, в котором частицами являются эквиваленты, принят моль. Молярная масса эквивалента вещества обозначается МЭ и выражается в граммах на моль (г/моль). В приведенном примере молярные массы эквивалентов хлора и натрия численно равны их атомным массам: соответственно, 35,45 и 22,99 г/моль.
Химия. Учеб. пособие | -8- |

1.ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Вотличие от атомной или молекулярной масс химический эквивалент не является постоянной величиной, он зависит от валентности. Постоянные значения эквивалентов могут быть только у элементов с постоянной валентностью:
MЭэлемента = | Arэлемента | , | |
Валентностьэлемента | |||
|
|
где Ar – относительная атомная масса элемента.
Эквивалентом соединения называется такое его количество, которое в данной реакции взаимодействует с одним ионом водорода или одним эквивалентом другого вещества.
Для вычисления молярных масс эквивалентов сложных веществ применяют следующие формулы:
МЭоксида = | Моксида | , | |
Числоатомовэлемента Валентностьэлемента | |||
|
|
или
МЭоксида = МЭэлемента + МЭкислорода,
| Мкислоты | |
МЭкислоты = |
| . |
Основность кислоты | ||
Основность кислоты равна количеству ионов водорода Н+ в молекуле кислоты, способных замещаться на металл:
| Моснования | |
МЭоснования = |
| . |
Кислотностьоснования | ||
Кислотность основания равна количеству гидроксид-ионов OH– в молекуле основания, способных замещаться на кислотные остатки:
МЭсоли = | Мсоли | , |
Числоатомовметалла Валентностьметалла |
где М – мольная масса соединений.
При решении некоторых задач необходимо пользоваться значениями эквивалентного объема. Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества.
Химия. Учеб. пособие | -9- |

1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Если одно из реагирующих веществ находится в твердом состоянии, а другое – в газообразном, то закон эквивалентов можно представить формулой
m = МЭ , V VЭ
где m – масса твердого вещества, г; МЭ – его молярная масса эквивалента, г/моль; V – объем газообразного вещества, л; VЭ – объем эквивалента, л. Эквивалентный объем водорода VЭН = 11,2 л/моль, а кислорода VЭО = 5,6 л/моль.
Закон простых объемных отношений, или закон Гей-Люссака, был сформулирован в 1808 г.: при одинаковых физических условиях (давлении и температуре) объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа (коэффициенты химических уравнений).
Например, при взаимодействии двух объемов водорода и одного объема кислорода образуются два объема водяного пара:
2Н2(г) + O2(г) = 2h3O(пар)
т. е. объемные отношения 2 : 1 : 2.
Или: 1 л водорода соединяется с 1 л фтора, образуя 2 л фтороводорода (объемные отношения 1:1:2):
Н2(г) + F2(г) = 2HF(г)
На законе простых объемных отношений основаны методы часто применяемого газового анализа.
Закон и следствия Авогадро. Для объяснения простых соотношений между объемами реагирующих газов итальянский ученый Авогадро в 1811 г. высказал гипотезу, которая впоследствии была подтверждена опытными данными и стала называться законом Авогадро: в равных объемах любых га-
зов при одинаковых физических условиях (давлении и температуре) содер-
жится одинаковое число молекул. Авогадро предположил, что молекулы простых газов состоят из двух одинаковых атомов.
Например, при соединении водорода с хлором образуются молекулы хлороводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора образуется две молекулы хлороводорода, то и объем последнего должен быть равен сумме объемов исходных газов, т. е.
h3 (г) + Cl2 (г) = 2HCl(г)
Химия. Учеб. пособие | -10- |

1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Таким образом, объемные отношения легко объясняются, если исходить из представления о двухатомности молекул простых газов (h3, Cl2, N2, O2 и др.). В химических уравнениях коэффициенты перед формулами газообразных веществ указывают на объемы реагирующих газов.
Из закона Авогадро вытекают два следствия, сформулированные в 1855 г. Жераром:
1. Один моль любого газа при нормальных физических условиях, т. е. при Т = 273,15 К и Р = 101,3 кПа, занимает один и тот же объем, равный 22,4 л. Этот объем называется молярным объемом газа: V = 22,4 л/моль.
Поскольку в одном моле газообразного вещества содержится 6,02 1023 молекул, то в 22,4 л газа при нормальных условиях содержится 6,02 1023 молекул (число Авогадро NA), т. е.
NА = 6,02 1023 молекул.
При помощи числа Авогадро можно вычислить абсолютную массу атомов и молекул. Для этого нужно атомную или молярную массу разделить на число Авогадро.
2. Молярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду (точнее 2,0158 плотности):
М = 2DН2,
где М – молярная масса газа; DН2 – плотность газа по водороду. Относительная плотность газов D показывает, во сколько раз плотность одного газа больше (меньше) плотности другого и равна отношению плотностей газов:
DН2 =ρρН2 ,
где ρ – плотность газа, ρН2 – плотность водорода.
Часто плотность газа определяется по отношению к плотности воздуха Dвозд. Воздух является смесью газов, его средняя молярная масса равна
29 г/моль. Молярная масса газа по воздуху М = 29 Dвозд.
Определение молярных масс показало, что молекулы простых газов состоят из двух атомов, а каждая молекула инертных газов – из одного атома (He, Ne, Ar, Kr, Хе, Rn). Для инертных газов понятия атома и молекулы равнозначны. Однако молекулы некоторых простых веществ могут иметь три и более атомов, например, озона О3, фосфора Р4, паров серы S8 при невысоких температурах.
Уравнение Менделеева-Клапейрона, или уравнение состояния иде-
ального газа, связывает массу m, г, температуру Т, К, давление Р, Па, и объем V, л, газа с его молярной массой М, г/моль:
Химия. Учеб. пособие | -11- |

1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
PV = Mm RT ,
где R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К).
По уравнению Менделеева-Клапейрона можно вычислить молярную массу газа, определив численно равную ей молярную массу вещества:
M = mRTPV .
Стехиометрические законы основаны на фундаментальных законах и являются количественным выражением атомно-молекулярной теории и периодического закона Д. И. Менделеева.
Контрольныевопросыизадания
1.Назвать известные формы существования материи.
2.Вычислить молекулярные массы хлора, аммиака, этана.
3.Что такое молекулярный объём газа? Какова его размерность?
4.Сформулировать закон сохранения массы и энергии.
5.Дать понятие вещества. Что такое химический элемент? Сколько их известно на сегодняшний день?
6.Сформулировать закон постоянства состава.
7.Как называются соединения переменного и постоянного состава?
8.Дать понятие химического эквивалента, привести примеры.
9.Как определить химический эквивалент оксида, кислоты, основания, соли? Привести примеры.
10.Что такое эквивалентный объём? Вычислить эквивалентный объем
хлора.
11.Сформулировать закон эквивалентов.
12.Сформулировать закон простых объёмных отношений (Гей-
Люссака).
13.Сформулировать закон Авогадро и его следствия.
14.Написать уравнение Менделеева-Клапейрона и объяснить его
смысл.
Химия. Учеб. пособие | -12- |
Основные законы химии
Основные законы химии
Закон сохранения массы веществ. Закон постоянства состава вещества. Химический эквивалент. Закон эквивалентов. Закон объемных отношений. Закон Бойля-Мариотта, Гей-Люссака. Закон Шарля. Объединенный газовый закон. Закон Авогадро. Молекулярные массы газов и паров.
— Закон сохранения массы веществ (М.В.Ломоносов, 1748г): масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Pb + O2 = PbO (в реторте)
— Закон постоянства состава (Пруст, 1808г): всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
— С помощью значения относительной плотности были определены относительные молекулярные массы и уточнены составы молекул многих газообразных веществ. Молекулярная масса может быть вычислена также по уравнению состояния идеального газа или Уравнения Клапейрона-Менделеева.
, или
P — давление газа в замкнутой системе
V — объем системы (м3)
m — масса газа (кг)
М — молярная масса
Т — абсолютная температура t° в Кельвинах
R — универсальная газовая постоянная
P = 101,325 кПа
Используемые величины:
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Дж/(моль•K)
— Бойля — Мариотта при постоянной температуре t°, давление, производимое данной массой газа, обратно пропорционально объему газа:
, при t° = const.
— Гей — Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре:
, при P = const.
— Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
, при V = const.
— Объединенный закон Бойля — Мариотта, Гей — Люссака и Шарля:, при V = const.
Закон кратных отношений (открыт в 1803 Дж.Дальтоном).
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа:
Разделив числа нижней строки на 0,57, видим, что они относятся как 1:2:3:4:5.
2) Хлористый кальций образует с водой 4 кристаллогидрата, состав которых выражается формулами: CaCl2•H22O, CaCl2•2H2O, CaCl2•4H2O, CaCl2•6H2O, т. е. во всех этих соединениях массы воды, приходящиеся на одну молекулу CaCl2, относятся как 1: 2: 4: 6.
Закон эквивалентов: (открыт в конце XVIII в.) — вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
, при t° = const.
Химический эквивалент — это масса элемента (выраженная в углеродных единицах), которая присоединяет или замещает одну атомную массу водорода или половину атомной массы кислорода.
Химический эквивалент кислоты равен её молярной массе, деленной на основность (число ионов водорода) кислоты.
Химический эквивалент основания равен его молярной массе, деленной на кислотность (число гидроксильных групп) основания.
Химический эквивалент соли равен её молярной массе, деленной на сумму зарядов образующих её катионов или анионов.
Закон простых объемных отношений, или «химический» закон (Гей-Люссак, 1808) — объемы вступающих в реакцию газов при одинаковых условиях относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (t˚ и давлении) содержится одинаковое число молекул. Из закона вытекают 2 следствия:
1. 1 моль любого газа при одинаковых условиях занимает один и тот же объем – равный 22,4 л. (при температуре˚-0˚C и давление 1,01325•105 Па). В этом же объеме находится 6,023•1023 молекул газообразного вещества.
2. Массы равных объемов двух газов, взятых при одинаковом давлении и температуре, относятся друг к другу как их молярные массы:
, также плотности газов относятся как их относительные молекулярные массы: ,
Д – относительная плотность.
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
,
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Основы химии (стр. 1 из 32)
Глава 1.
Общие химические и экологические закономерности.
С чего начинается химия?
Cложный ли это вопрос? На него каждый ответит по-своему.
В середней школе учащиеся изучают химию в течение ряда лет. Многие довольно хорошо сдают выпускной экзамен по химии. Однако…
Беседы с абитуриентами и затем и студентами первых курсов говорят о том, что остаточные знания по химии после средней школы незначительные. Одни путаются в различных определениях и химических формулах, а другие вообще не могут воспроизвести даже основные понятия и законы химии, не говоря уже о понятиях и законах экологии.
У них химия так и не начиналась.
Химия, по-видимому, начинается с глубокого освоения ее основ, и прежде всего, основных понятий и законов.
1.1. Основные химические понятия.
В таблице Д.И.Менделеева рядом с символом элемента стоят цифры. Одна цифра обозначает порядковый номер элемента, а вторая атомную массу. Порядковый номер имеет свой физический смысл. О нем мы будем вести разговор позже, здесь остановимся на атомной массе и выделим в каких единицах она измеряется.
Следует сразу оговориться, что атомная масса элемента, приведенная в таблице, величина относительная. За единицу относительной величины атомной массы принята 1/12 часть массы атома углерода, изотопа с массовым числом 12, и назвали ее атомной единицей массы /а.е.м./. Следовательно, 1 а.е.м. равна 1/12 части массы изотопа углерода 12С. И она равна 1,667*10–27 кг. /Абсолютная масса атома углерода равна 1,99*10–26 кг./
Атомная масса, приведенная в таблице, является массой атома, выраженной в атомных единицах массы. Величина безразмерная. Конкретно для каждого элемента атомная масса показывает, во сколько раз масса данного атома больше или меньше 1/12 части массы атома углерода.
Аналогичное можно сказать и о молекулярной массе.
Молекулярная масса – это масса молекулы, выраженная в атомных единицах массы. Величина тоже относительная. Молекулярная масса конкретного вещества равна сумме масс атомов всех элементов, входящих в состав молекулы.
Важным понятием химии является понятие «моль». Моль – такое количество вещества, которое содержит 6,02*1023 структурных единиц /атомов, молекул, ионов, электронов и т.д./. Моль атомов, моль молекул, моль ионов и т.д.
Масса одного моля данного вещества называется его молярной /или мольной/ массой. Она измеряется в г/моль или кг/моль и обозначается буквой «М». Например, молярная масса серной кислоты МН2SO4=98г/моль.
Следующее понятие «Эквивалент». Эквивалентом /Э/ называют такое весовое количество вещества, которое взаимодействует с одним молем атомов водорода или замещают такое его количество в химических реакциях. Следовательно, эквивалент водорода ЭН равен единице. /ЭН=1/. Эквивалент кислорода ЭО равен восьми /ЭО=8/.
Различают химический эквивалент элемента и химический эквивалент сложного вещества.
Эквивалент элемента – величина переменная. Она зависит от атомной массы /А/ и валентности /В/, которую элемент имеет в конкретном соединении. Э=А/В. Например, определим эквивалент серы в оксидах SO2 и SO3. В SO2 ЭS=32/4=8, а в SO3 ЭS=32/6=5,33.
Молярную массу эквивалента, выраженную в граммах, называют эквивалентной массой. Следовательно, эквивалентная масса водорода МЭН=1г/моль, эквивалентная масса кислорода МЭО=8г/моль.
Химический эквивалент сложного вещества /кислоты, гидроксида, соли, оксида/– такое количество соответствующего вещества, которое взаимодействует с одним молем атомов водорода, т.е. с одним эквивалентом водорода или замещает такое количество водорода или любого другого вещества в химических реакциях.
Эквивалент кислоты /ЭК/ равен частному от деления молекулярной массы кислоты на число атомов водорода, участвующих в реакции. Для кислоты H2SO4, когда оба атома водорода вступают в реакцию H2SO4+2NaOH=Na2SO+2H2O эквивалент будет равен ЭН2SO4= МН2SO4/nН=98/2=49
Эквивалент гидроксида /Эгидр. / определяется как частное от деления молекулярной массы гидроксида на число гидроксогрупп, вступающих в реакцию. Например, эквивалент NaOH будет равен: ЭNaOH=МNaOH/nОН=40/1=40.
Эквивалент соли /Эсоли / можно рассчитать, поделив ее молекулярную массу на произведение числа атомов металла, вступающих в реакцию, и их валентность. Так, эквивалент соли Al2(SO4)3 будет равен ЭAl2(SO4)3=МAl2(SO4)3/6=342/2,3=342/6=57.
Эквивалент оксида /Эок / можно определить, как сумму эквивалентов соответствующих элемента и кислорода. Например, эквивалент СО2 будет равен сумме эквивалентов углерода и кислорода: ЭСО2=ЭС+ЭО=3+8=7.
Для газообразных веществ удобно пользоваться эквивалентными объемами /ЭV/. Так как при нормальных условиях моль газа занимает объем 22,4л, то исходя из этой величины, легко определить эквивалентный объем любого газа. Рассмотрим водород. Мольная масса водорода 2г занимает объем 22,4л, тогда его эквивалентная масса 1г занимает объем 11,2л /или 11200мл /. Следовательно ЭVН=11,2л. Эквивалентный объем хлора равен 11,2л /ЭVCl=11,2л/. Эквивалентный объем СО равен 3,56 /ЭVCО=3,56л/.
Химический эквивалент элемента или сложного вещества используется в стехиометрических расчетах обменных реакций, а в соответствующих расчетах окислительно–восстановительных реакций применяют уже окислительный и восстановительный эквиваленты.
Окислительный эквивалент определяют как частное от деления молекулярной массы окислителя на число электронов, которое он принимает в данной окислително–восстановительной реакции.
Восстановительный эквивалент равен молекулярной массе восстановителя поделенной на число электронов, которое он отдает в данной реакции.
Напишем окислително–восстановительную реакцию и определим эквивалент окислителя и восстановителя:
5N2aS+2KMnO4+8H2SO4=S+2MnSO4+K2SO4+5Na2SO4+8H2O
Окислителем в этой реакции является перманганат калия. Эквивалент окислителя будет равен массе KMnO4 деленной на число электронов, принятых окислителем в реакции (nе=5). ЭKMnO4=МKMnO4/nе=158/5=31,5. Молярная масса эквивалента окислителя KMnO4 в кислой среде равна 31,5г/моль.
Эквивалент восстановителя Na2S будет: ЭNa4S=МNa4S /nе=78/2=39. Молярная масса эквивалента Na2S равна 39г/моль.
В электрохимических процессах, в частности при электролизе веществ, пользуются электрохимическим эквивалентом. Электрохимический эквивалент определяют как частное от деления химического эквивалента вещества, выделяемого на электроде, на число Фарадея /F/. Электрохимический эквивалент более подробно будет рассмотрен в соответствующем параграфе курса.
Валентность. При взаимодействии атомов между ними образуется химическая связь. Каждый атом может образовывать только определенное количество связей. Количество связей предопределяет такое уникальное свойство каждого элемента, которое называют валентностью. В наиболее общем виде валентностью называют способность атома образовывать химическую связь. За единицу валентности принимают одну химическую связь, которую способен образовать атом водорода. В связи с этим, водород является одновалентным элементом, а кислород – двухвалентным, т.к. с атомом кислорода могут образовывать связь не более двух водородов.
Умение определять валентность каждого элемента, в том числе и в химическом соединении, является необходимым условием успешного усвоения курса химии.
С валентностью соприкасается и такое понятие химии как степень окисления. Подстепенью окисления понимают тот заряд, который имеет элемент в ионном соединении или имел бы в ковалентном соединении, если бы общая электронная пара бала бы полностью смещена к более электроотрицательному элементу. Степень окисления имеет не только цифровое выражение, но и соответствующий знак заряда (+) или (–). Валентность не имеет этих знаков. Например, в H2SO4 степень окисления: водорода +1, кислорода –2, серы +6, а валентность, соответственно, будет 1, 2, 6.
Валентность и степень окисления в числовых значениях не всегда совпадают по величине. Например, в молекуле этилового спирта СН3–СН2–ОН валентность углерода 6, водорода 1, кислорода 2, а степень окисления, например, углерода первого –3, второго –1: –3СН3––1СН2–ОН.
1.2. Основные экологические понятия.
За последнее время понятие “экология” глубоко входит в наше сознание. Это понятие, введенное еще в 1869г Э.Геккелем /происходит от греческого oikos – дом, место, жилище, logos– учение/ все больше и больше тревожит человечество.
В учебниках биологии экологию определяют как науку о взаимоотношениях живых организмов и среды их обитания. Практически созвучное определение экологии дает Б.Небел в своей книге «Наука об окружающей среде» – Экология – наука о различных аспектах взаимодействия организмов между собой и с окружающей средой. В других источниках можно встретить и более широкое толкование. Например, Экология – 1/. Наука, изучающая отношение организмов и их системных совокупностей и окружающей среды; 2/. Совокупность научных дисциплин, исследующих взаимоотношение системных биологических структур /от макромолекул до биосферы/ между собой и с окружающей средой; 3/. Дисциплина, изучающая общие законы функционирования экосистем различного иерархического уровня; 4/. Комплексная наука, исследующая среду обитания живых организмов; 5/. Исследование положения человека как вида в биосфере планеты, его связей с экологическими системами и воздействие на них; 6/. Наука о выживании в окружающей среде. /Н.А.Агиджанян, В.И.Торшик. Экология человека./. Однако под термином «экология» понимают не только экологию как науку, а само состояние окружающей среды и его влияние на человека, животный и растительный мир.