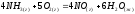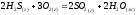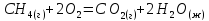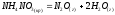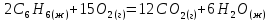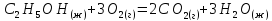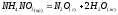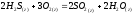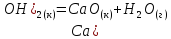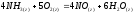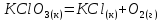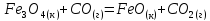Определите энтальпию реакции, зная энтальпии следующих реакций —
Определите энтальпию реакции Fe(т) + Cl2(г) = FeCl2(т), зная энтальпии следующих реакций:
Fe(т) +2 HCl (aq) = FeCl2(aq) + H2(г) ; ∆Η0 = -88,0 кДж/моль
FeCl2(т) = FeCl2(aq) ; ∆Η0 = -81,7 кДж/моль
HCl (г) = HCl (aq) ; ∆Η0 = -73,3 кДж/моль
Н2(г) + Сl2 (г) = 2 HCl (г) ; ∆Η0 = -184,4 кДж/моль
Решение: По следствию из закона Гесса:
∆ Н 0р = ∑ ∆ Н 0прод – ∑∆ Н 0исход
∆ Н 0р = ∆ Н 0(FeCl2(т)) – [∆ Н 0(Fe(т) ) + ∆ Н 0(Cl2(г) )]
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Т.е. термохимические уравнения можно складывать, вычитать и умножать на числовые множители.
(1) Fe(т) +2 HCl (aq) = FeCl2(aq) + H2(г) ; ∆Η0 = -88,0 кДж/моль
(2) FeCl2(т) = FeCl2(aq) ; ∆Η0 = -81,7 кДж/моль
(3) HCl (г) = HCl (aq) ; ∆Η0 = -73,3 кДж/моль
(4) Н2(г) + Сl2 (г) = 2 HCl (г) ; ∆Η0 = -184,4 кДж/моль
Отсюда:
∆ Н 0р = (1)– (2) + 2* (3) + (4) = -88,0 – (-81,7) + 2*(-73,3) + (-184,4) =
= – 264,0 кДж
Ответ: энтальпия реакции Fe(т) + Cl2(г) = FeCl2(т) равна – 264,0 кДж.
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Поскольку число частиц в системе велико (число Авогадро NA = 6,02∙1023), то энтропия пропорциональна натуральному логарифму термодинамической вероятности состояния системы W:
S = R · ln W
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии в необратимых и обратимых процессах передается соотношениями:
ΔS > Q / T и ΔS = Q / T
Например, изменение энтропии плавления равно теплоте (энтальпии) плавления: ΔSпл = ΔHпл/Tпл
Для химической реакции изменение энтропии аналогично изменению энтальпии:
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным TΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
ΔG = ΔH – TΔS
При ΔG < 0 реакция термодинамически разрешена и система стремится к достижению условия ΔG = 0, при котором наступает равновесное состояние обратимого процесса; ΔG > 0 указывает на то, что процесс термодинамически запрещен.
сайт химиков > справочник по химии > Законы термохимии. Расчет энтальпии реакции.
энтальпия реакции — это разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических количеств веществ| ΔH = ∑(nΔH)продукты — ∑(nΔH)реагенты |
Для некоторой реакции
стандартная энтальпия реакции равна:
| ΔH°298 = (nCΔH°298(С) + nDΔH°298(D)) — (nAΔH°298(A) + nBΔH°298(B)) |
Пример. Стандартная энтальпия следующей реакции:
| 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) ΔH°298 = (nNO·ΔH°298(NO) + nH2O·ΔH°298(H2O)) — (nNH3·ΔH° |
Раздел химии, который посвящен количественному определению тепловых эффектов химических реакций, называется термохимией.
Расчет тепловых эффектов реакций, в частности при p = const, основан на двух законах термохимии.
первый закон термохимии: при разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех же простых веществ
Первый закон тeрмохимии открыт в конце XVIII в. французскими учеными Лавуазье и Лапласом, второе название этого закона — закон Лавуазье-Лапласа. Фактически этот закон вытекает из закона сохранения энергии; именно на этом законе основана формула для расчета энтальпии реакции по энтальпии образования участвующих в ней веществ.
Энтальпию образования определить экспериментально можно не для всех веществ из-за сложности проведения или практической неосуществимости многих реакций. Табличные значения ΔH°298 для многих веществ получены расчетным способом, основанном на втором законе термохимии, открытом в 1840 г. русским химиком Г.И. Гессом , закон Гесса:
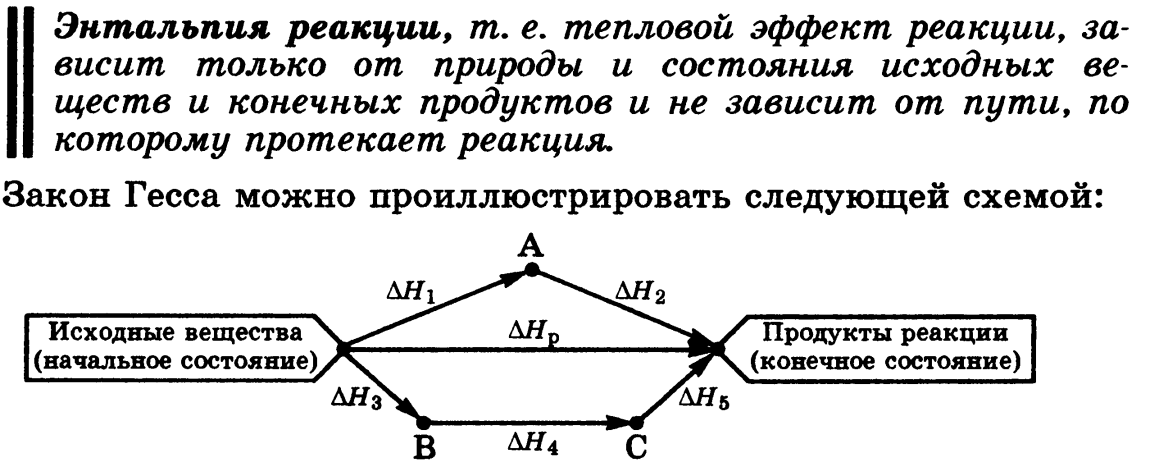
второй закон термохимии: сумма энтальпий двух или более промежуточных реакций (стадий) при переходе от исходного состояния к конечному состоянию равна энтальпии реакции, которая непосредственно ведет от исходного состояния к конечному состоянию
Таким образом, энтальпия реакции зависит только от вида и состояния реагентов, но не зависит от промежуточных состояний и пути перехода от реагентов к продуктам (это вторая формулировка закона Гесса). Закон Гесса позволяет связать энтальпийные эффекты процесса, который может протекать в одну или несколько стадий, и тем самым рассчитать энтальпию (тепловой эффект) той реакции, которую трудно осуществить или довести до конца.
Пример. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
- 2C + O2 = 2CO
2CO + O2 = 2CO2 - C + O2 = CO2
Экспериментально определить энтальпию образования CO по первой реакции невозможно, т.к. идет вторая реакция — превращение CO в CO2. Однако можно экспериментально определить энтальпию реакции превращений CO в CO2 если получить (каким-либо другим способом) чистый CO, а затем перевести его в CO2 сжиганием в кислороде. Кроме того, легко находится и энтальпия полного сгорания графита (путь 2), т.е. энтальпия образования CO2. Отсюда на основе закона Гесса легко рассчитать энтальпию перехода графита в CO, используя схему:
По закону Гесса ΔH°1 + ΔH°2 = ΔH°3; следовательно:
| ΔH°(CO) | = | ΔH°1 | = | ΔH°3 — ΔH°2 | = | (-786) — (-566) | = | -110 кДж/моль |
| ——— | ————— | —————— | ||||||
| n(CO) | n(CO) | 2 |
Полученное значение точно отвечает справочным данным.
5. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса. Формулировка. Математическое выражение. Следствия из закона Гесса.

Стандартная энтальпия сгорания ΔHoсгор – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ –до CO2(г) и H2O(ж). Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность.
Стандартная энтальпия образования вещества (ΔfH0) – увеличение или уменьшение энтальпии, сопровождающее образование 1 моль вещества из простых веществ, при условии, что все участники реакции находятся в стандартном состоянии
Стандартная энтальпия сгорания вещества (ΔсH0) – уменьшение энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления.
Закон Гесса – энергия не создаётся и не уничтожается,
а лишь переходит из одного вида энергии
в другой. 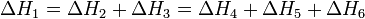
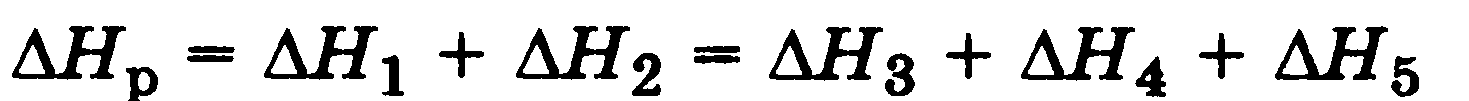
Закон Гесса
Тепловой эффект реакции зависит только от природы и состояния исходных вещ-в и не зависит от пути, по которому реакция протекает
Следствие 1. Тепловой эффект химической реакции равен разности сумм теплот образования(ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрическиекоэффициенты (ν):
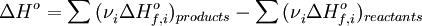
ΔHo
vi – стехиометрические коэффициенты
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания(ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
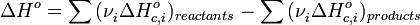
ΔHoс,i— стандартная энтальпия сгорания веществ
vi – стехиометрические коэффициенты
Следствие 3. Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образовании продуктов реакции (–ΣEпрод). Отсюда
ΔH° = ΣEисх – ΣEпрод |
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
Следствие 4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.

Следствие 5. Энтальпия гидратации равна разности энтальпий растворения безводной соли (ΔHoраств.б/с)и кристаллогидрата (ΔHoраств.крист)
6.Второе начало термодинамики. Формулировка. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов.
Второе начало термодинамики: В изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут протекать только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG < 0). В состоянии равновесия G = const, G = 0

Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений. Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.

Энтропия – энтропия – функция состояния, приращение которой ΔS равно теплоте Qмин подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру T, три которой осуществляется процесс: ΔS = Qмин/ T или мера вероятности пребывания системы в данном состоянии – мера неупорядоченности системы.

7. Энергия Гиббса – главный критерий возможности протекания самопроизвольных процессов. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.


Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем).
Если величина ΔG имеет отрицательный знак (ΔG < 0), то реакция самопроизвольно может протекать только в прямом направлении. Причем абсолютное значение разности ΔH – TΔS = ΔG будет определять движущую силу данного процесса.
Если же ΔG > 0, то в условиях, для которых были измерены ΔH и TΔS, в прямом направлении данная реакция протекать не может. Зато осуществимой окажется обратная реакция, для которой ΔG будет иметь отрицательное значение.
Реакции, для которых ΔH < 0, а ΔS > 0, могут самопроизвольно протекать в прямом направлении при любых температурах, т.к. ΔG у них всегда будет меньше нуля. Примером такой реакции может служить гидролиз пептидов или белков.
Если для химической реакции ΔH > 0, а ΔS < 0, то ее самопроизвольное протекание в прямом направлении всегда неосуществимо, т.к. энергия Гиббса в данном случае возрастает. Примером такой реакции может служить процесс фотосинтеза – образование глюкозы и кислорода из углекислого газа и воды, – который невозможен без участия солнечной энергии.
В случае ΔH > 0 и ΔS > 0 самопроизвольному протеканию реакции в прямом направлении способствует энтропийный фактор. При низких температурах отрицательное значение ΔH – TΔS может быть невозможно, но при нагревании – оно возможно и реакция становится осуществимой в прямом направлении. Например, тепловая денатурация белковых молекул.
Если ΔH < 0 и ΔS < 0, то отрицательное значение ΔG такой химической реакции наблюдается только при достаточно низких температурах.
При вычислении ΔG в химической реакции можно использовать следствие из закона Гесса, применяемое для расчета ее теплового эффекта (изменения энтальпии). В данном случае оно будет звучать следующим образом.
В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (TΔrS) фактором. Для реакций, у которых ΔrH< 0 иΔrS> 0, энергия Гиббса всегда будет убывать, т.е.ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах
В изолированных системах энтропия приобретает максимально возможное для данной системы значение Smax; в состоянии равновесияΔS= 0
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. В самопроизвольной реакции:
∆G<0 (G2-G1<0)
∆S>0 (S2-S1>0) реакция пойдет → ∆G>0
∆S<0 реакция пойдет ←
Формула для I и II т/д: ∆Gт=∆H0хр — Т∆S
Энтальпийный и энтропийный факторы Из приведенного выражения следует, что самопроизвольное течение реакции может контролироваться как энтальпийным (∆H), так и энтропийным фактором (T∆S). Очевидно, что для реакций, характеризующихся ∆Hr< 0 и ∆Sr> О, энергия Гиббса должна обязательно убывать, т. е. ∆Gr< 0, и такие реакции могут протекать самопроизвольно при любых температурах, так как оба фактора способствуют протеканию процесса. Пример такой реакции — гидролиз белка. Наоборот, при ∆Hr> 0 и ∆Sr< 0 самопроизвольное течение реакций всегда невозможно, так как энергия Гиббса должна обязательно возрастать. Оба фактора препятствуют протеканию реакции. Пример — фотосинтез, т. е. образование глюкозы и кислорода из углекислого газа и воды.
Несогласованное действие факторов наблюдается в двух случаях:
1) ∆Hr> 0 и ∆Sr> 0 — самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса возможно при соотношении |∆Sr |> |∆Hr|, т. е. при достаточно высоких температурах. Примером процессов этого типа является тепловая денатурация белков;
2) ∆Hr< О и ∆Sr< О — благоприятствующим фактором является энтальпийный, соотношение AGT< 0 наблюдается при |∆Hr| >|∆Sr |, т. е. при достаточно низких температурах. Пример процессов этого типа — гидратация белков.
8 . Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.


Под
стандартной энергией Гиббса биологического
окисления ΔG°, понимают изменение энергии
Гиббса при реакции биологического
окисления 1 моль вещества, находящегося
в стандартном состоянии.Под стандартной
энергией Гиббса образования ΔG°, понимают
изменение энергии Гиббса при реакции
образования 1 моль вещества, находящегося
в стандартном состоянии


Принцип энергетического сопряжения:
Сопряженные реакции – это реакции, в которых протекание одной реакции обусловлено протеканием другой, невозможной в отсутствии первой. Принцип энергетического сопряжения заключается в том, что энергия необходимая для протекания эндергонической реакции поступает за счет осуществление экзэргонической реакции , причем в двух реакциях присутствует общее веществ- интермедиан.
Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.



 11.Химическая
кинетика как основа для изучения
скоростей и механизмов биохимических
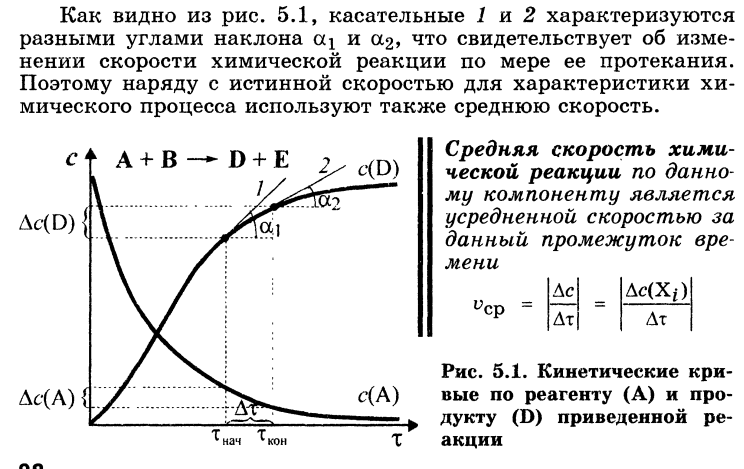
процессов. Скорость реакции, средняя
скорость реакции в интервале, истинная
скорость. Факторы, влияющие на скорость
реакции.
11.Химическая
кинетика как основа для изучения
скоростей и механизмов биохимических
процессов. Скорость реакции, средняя
скорость реакции в интервале, истинная
скорость. Факторы, влияющие на скорость
реакции.
Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций. Последовательность и характер стадий химических реакций называют механизмом реакции.

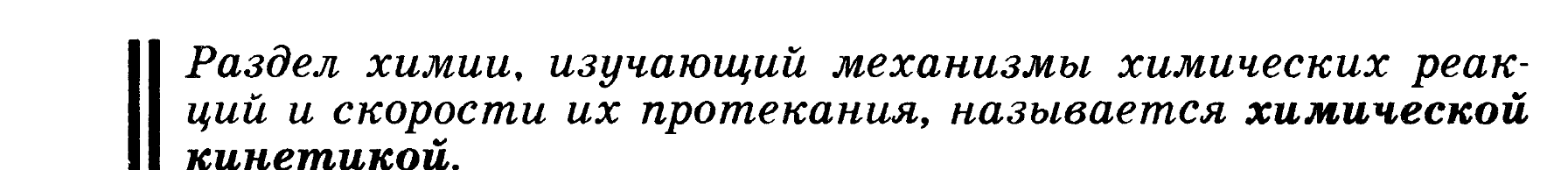

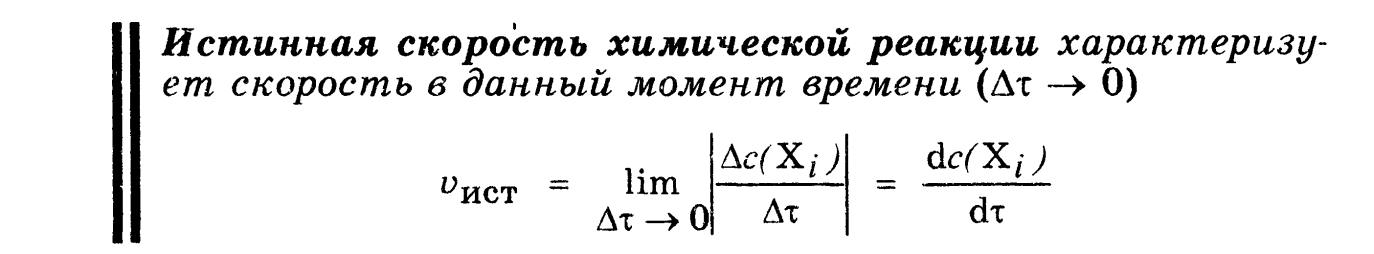

Факторы
влияющие на протекание реакции 
В организме человека протекают тысячи ферментативных реакций, проходящих в живой клетке. Однако в многостадийной цепи процессов достаточно велика разница между скоростями отдельных реакций. Так, синтезу в клетке молекул белка предшествует, по крайней мере, еще две стадии: синтез транспортной РНК и синтез рибосом. Но время, за которое удваивается концентрация молекул т-РНК, составляет 1,7 мин., молекулы белка — 17 мин., а рибосом — 170 мин. Скорость суммарного процесса медленной (лимитирующей) стадии, в нашем примере — скорость синтеза рибосом. Наличие лимитирующей реакции обеспечивает высокую надежность и гибкость управления тысячами реакций, происходящих в клетке. Достаточно держать под наблюдением и регулировать лишь наиболее медленные из них. Такой способ регулирования скорости многостадийного синтеза носит название принципа минимума. Он позволяет существенно упростить и сделать более надежной систему авторегулирования в клетке.
Скорость реакций в зависимости от молекулярности будет выражаться уравнениями: а) V = к • СА — для мономолекулярной реакции; б) V = к • СА • Св или в) V = к • С2А — для бимолекулярной реакции; г) V = к • С • Св • С э д) V = к • С2А • Св или е) V = k • С3А— для тримолекулярной реакции.
12. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения

Микрогетерогенные
реакции –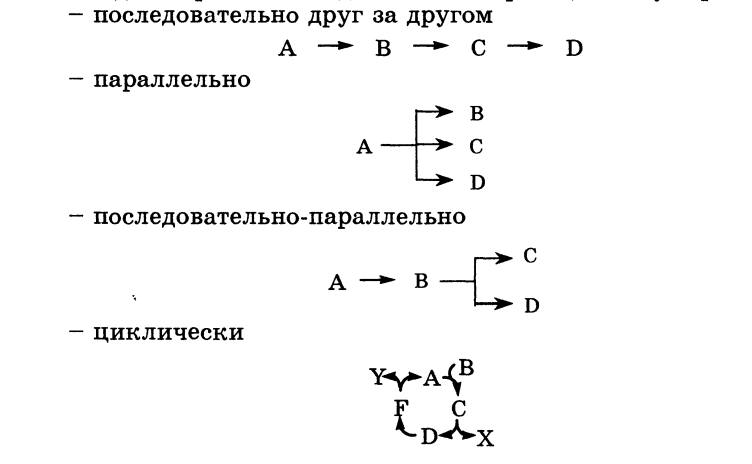

Молекулярность реакции– это количество молекул, которые принимают участие единовременно в одном акте столкновений.
Молекулярность можно определить, лишь установив механизм реакции. В зависимости от числа реагирующих молекул (частиц), участвующих в элементарном акте, различают одномолекулярные (мономолекулярные), двухмолекулярные, тримолекулярные реакции.
К одномолекулярнымреакциям типа А→Р относятся процессы распада молекулы на более простые составные части и реакции изомеризации.
Двухмолекулярными называются элементарные реакции вида: А+В→Р и 2А→Р (Н2+J2=2HJ,HJ+HJ=H2+J2,CH3COOCH3+H2O=CH3COOH+CH3OHи т.д.).
Значительно реже встречаютсятрехмолекулярныереакции А+2В→Р или 3А→Р. Во всех случаях вид и количество образующихся продуктов реакции не имеет значения, так как молекулярность определяется только числом молекул веществ, реагирующих в элементарном акте.
Порядок реакции устанавливается экспериментально.
Молекулярность и порядок реакции могут совпадать, а могут и различаться.
Молекулярность и порядок реакции совпадаюттолько для простых реакций, протекающих только в одну элементарную стадию без участия посторонних молекул.
Молекулярность и порядок реакции не совпадают в трех основных случаях:
1) для сложных реакций;
2) для гетерогенных реакций;
3) для реакций с избытком одного из реагирующих веществ.
Период полупревращения– это время, в течение которого прореагирует половина взятого вещества.
Кинетическое уравнение выражает зависимость скорости хим. реакции от концентраций компонентов реакционной смеси
Молекулярность-число молекул, реагирующих в в одном элементарном химическом акте.
Молекулярность реакции определяется числом молекул, вступающих в химическое взаимодействие в элементарном акте реакции. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные.
Тогда реакции типа А —>В будут являться мономолекулярными, например:
а) С16Н34 (t°C) —>CgH18 + С8Н16 — реакция крекинга углеводородов;
б) CaC03 (t°C) —>СаО + С02 — термическое разложение карбоната кальция. Реакции типа А + В —> С или 2А —> С — являются бимолекулярными, например: а) С + 02 -> С02; б) 2Н202 -> 2Н20 + 02 и т. д.
Тримолекулярные реакции описываются общими уравнениями типа:
а) А + В + С Д; б) 2А + В Д; в) 3А Д.
Например: а) 2Н2 + 02 2Н20; б) 2NO + Н2N20 + Н20.
Скорость реакций в зависимости от молекулярности будет выражаться уравнениями: а) V = к • СА — для мономолекулярной реакции; б) V = к • СА • Св или в) V = к • С2А — для бимолекулярной реакции; г) V = к • С • Св • С э д) V = к • С2А • Св или е) V = k • С3А— для тримолекулярной реакции.



Нередко молекулярность реакции трудно установить, поэтому используют более формальный признак — порядок химической реакции.
Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ (кинетическом уравнении).
Порядок реакции чаще всего не совпадает с молекулярностью ввиду того, что механизм реакции, т. е. «элементарный акт» реакции (см. определение признака молекулярности), трудно установить.
Рассмотрим ряд примеров, иллюстрирующих указанное положение.
Скорость растворения кристаллов описывается уравнениями кинетики нулевого порядка, несмотря на мономолекулярность реакции: AgCl(TB) —>Ag+ + CI», V = k • C(AgCl(TBp= k’C(AgCl(ra}) — p — плотности и является постоянной величиной, т. е. скорость растворения не зависит от количества (концентрации) растворяемого вещества.
Реакция гидролиза сахарозы: СО + Н20 —> С6Н1206(глюкоза) + С6Н1206 (фруктоза) является бимолекулярной реакцией, но ее кинетика описывается кинетическим уравнением первого порядка: V=k*Ccax, так как в условиях опытов, в том числе и в организме, концентрация воды есть величина постоянная С(Н20) — const.
Реакция разложения водородпероксида, протекающая с участием катализаторов, как неорганических ионов Fe3+, Cu2+ металлической платины, так и биологических — ферментов, например каталазы, имеет общий вид:
2Н202 —> 2Н20 + О э т. е. является бимолекулярной.

Примеры типовых экзаменационных задач
Раздел 1. Термохимия
1.1. Примеры задач с решениями
Задача 1. Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразного хлороводорода HCl из простых веществ в стандартных условиях выделяется 92 кДж теплоты.
Решение
Термохимическими уравнениями называют уравнения химических реакций, записанные с указанием значения энтальпии DH (кДж) и агрегатного состояния участвующих в реакции веществ.
Энтальпия реакции DH0 = Qp= ‑92 кДж, появление знака (‑) связано с тем, что энтальпии экзотермических реакций принято считать отрицательными.
Термохимическое уравнение реакции
1/2H2(г) + 1/2Cl2(г) = HCl(г), ∆Н0 = – 92 кДж.
Возможен другой вариант ответа, получаемый удвоением этого уравнения:
H2(г) + Cl2(г) = 2HCl(г), ∆Н0 = – 184 кДж.
4Al (т) + 3O2 (г) = 2Al2O3 (т) , DH0 = – 3340 кДж.
Решение
Энтальпией образования вещества называют энтальпию реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях. Уравнение приведенной реакции соответствует образованию 2 моль оксида алюминияиз простых веществ – алюминия и кислорода. С термохимическими уравнениями можно проводить простейшие математические процедуры: складывать, вычитать, умножать или делить на какое-либо число. Разделим уравнение реакции на два, чтобы оно соответствовало образованию 1 моль вещества (пропорционально уменьшим и значение энтальпии):
2Al (т) + 3/2O2
(г) = Al2O3
(т),  .
.
Ответ: стандартная энтальпия образования
оксида алюминия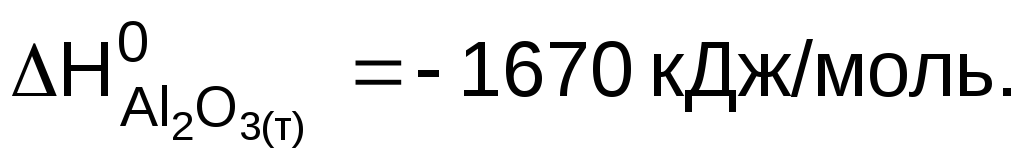
Вещество
DH0обр , кДж/моль
H2O (г)
-242
H2S (г)
-20
H2Se(г)
+85
H2Te (г)
+154
Решение
Значения энтальпий образования позволяют сравнивать устойчивость однотипных соединений: чем меньше значение энтальпии образования, тем устойчивее соединение. Расположение формул веществ в порядке увеличения устойчивости
H2Te (г) H2Se (г) H2S (г) H2O (г).
Задача 4. Запишите, какое соотношение существует между энтальпиями реакций DH1, DH2 и DH3, если известны термохимические уравнения.
1) С (графит) + O2(г)= CO2(г), DH1;
2) С (графит) + 1/2O2(г)= CO(г), DH2;
3) CO(г) + 1/2O2(г)= CO2 (г), DH3.
Решение
Термохимические уравнения можно складывать, вычитать и т. д. Уравнение (1) может быть получено сложением уравнений (2) и (3), т.е.
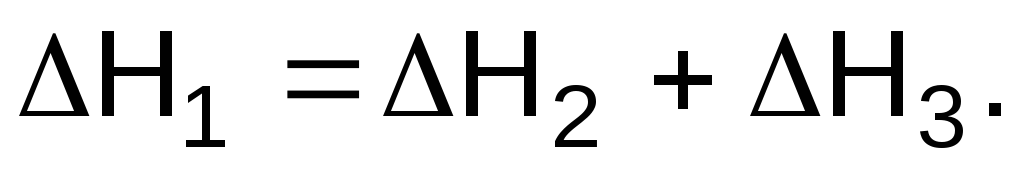
Ответ: 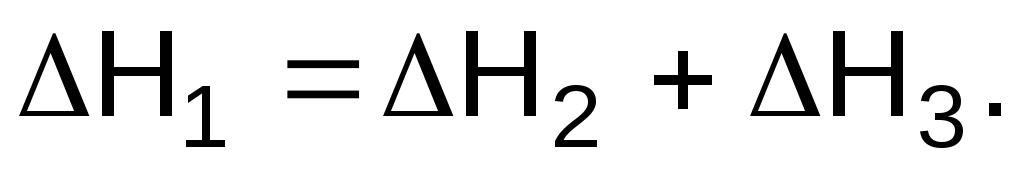
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г).
Вещество | C2H5OH(ж) | O2(г) | CO2(г) | H2O(г) |
DH0обр, кДж/моль | ‑278 | 0 | ‑394 | ‑242 |
Решение
Значение энтальпии реакции находим по первому следствию закона Гесса
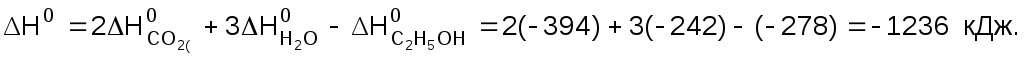 Ответ:
Ответ: 
Задача 6. Рассчитайте количество теплоты, выделяющейся (или поглощающейся) при гашении 1 кг извести в стандартных условиях. Значения стандартных энтальпий образования веществ приведены в таблице.
Вещество | DH0обр , кДж/моль |
CaO(т) Н2О(ж) Са(ОН)2(т) | –635 –286 –987 |
Решение
Уравнение реакции гашения извести:
CaO(т) + Н2О(ж) = Са(ОН)2(т).
Тепловой эффект реакции равен энтальпии реакции, значение которой находим по первому следствию закона Гесса:
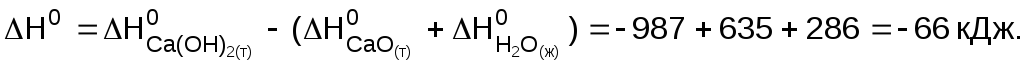
Энтальпия реакции отрицательна, т.е. при гашении извести теплота выделяется. Количество теплоты Q = H0 = ‑66 кДж соответствует гашению 1 моль СаО. Рассчитываем количество вещества, содержащееся в 1 кг оксида кальция:
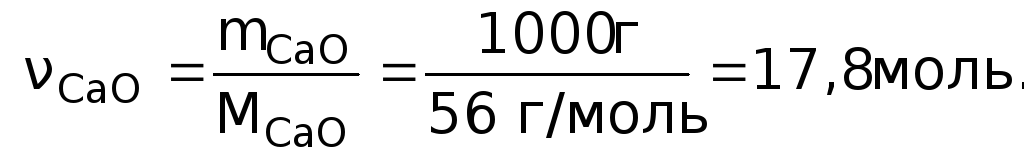
Количество теплоты, выделяющейся при гашении 1 кг извести,
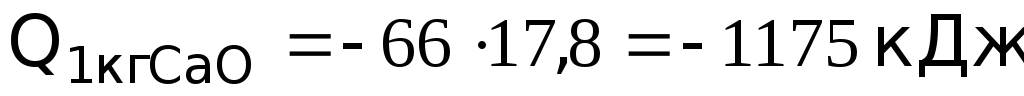
Ответ: при гашении 1 кг извести в стандартных условиях выделяется 1175 кДж теплоты.
Расчет энтальпии и энтропии химической реакции. Задачи 1
Расчет энтальпии и энтропии реакции горения ацетилена
Задача 1.
Реакция горения ацетилена протекает по уравнению: С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж).
Вычислите изменение энтропии системы в стандартных условиях и объясните причины её уменьшения.
Решение.
Согласно следствию из закона Гесса, изменение энтропии определяется как разность сумм энтропий продуктов и реагентов процесса с учетом стехиометрических коэффициентов реакции. Тогда
∆S0х.р. = [2·S0обрСО2(г) + S0обрН2О(ж)] – [S0обрС2Н2(г) + (5/2)·S0обрО2(г)].
По табличным данным найдем значения энтропии для требуемых веществ:
S0обрСО2(г) = 213,65Дж/моль·К;
S0обрН2О(ж) = 69,94Дж/моль·К;
S0обрС2Н2(г) = 219,45Дж/моль·К;
S0обрО2(г) = 205,03Дж/моль·К.
Подставив эти значения в уравнение изменения энтропии процесса, и произведя расчеты, получим:
∆S0х.р. = (2·213,65 + 69,94 — 219,45 – (5/2)·205,03)Дж/моль·К = -234,79 Дж/моль·К.
Уменьшение энтропии процесса объясняется ростом упорядоченности системы, так как количество вещества газов в продуктах реакции в 2,7 раза меньше, чем в реагентах (5,5/2).
Ответ: ∆S0х.р. = -234,79 Дж/моль·К; ∆S0х.р < 0 т.к. ∆n(г) < 0.
Расчет энтальпии и энтропии реакции разложения нитрата магния
Задача 2.
Реакция разложения магния нитрата по уравнению:2Mg(NO3)2(т) = 2MgO(т) + 4NO2(г) + O2(г) сопровождается увеличением энтропии системы на 891 Дж/К и изменением энтальпии на 510 кДж. Рассчитайте стандартную энтальпию образования и энтропию образования магния нитрата. Определите, какой из факторов – энтальпийный или энтропийный – способствует самопроизвольному протеканию этого процесса.
Решение:
Расчеты ∆H0обр[Mg(NO3)2(т)] и S0обр[Mg(NO3)2(т)] произведем на основании 3-го следствия из закона Гесса, согласно которому:
а) ∆H0х.р. = 2·∆H0обр[MgO(т)] + 4·∆H0обр[NO2(г)] — 2·∆H0обр[Mg(NO3)2(т)]
отсюда
∆H0обр[Mg(NO3)2(т)] = ∆H0обр[MgO(т)] + 2·∆H0обр[NO2(г)] -1/2∆H0х.р.
б) ∆S0х.р. = 2·S0обр[MgO(т)] + 4·S0обр[NO2(г)] + S0обр[O2(г)] — 2·S0обр[Mg(NO3)2(т)],
отсюда
S0обр[Mg(NO3)2(т)] = S0обр[MgO(т)] + 2·S0обр[NO2(г)] + 1/2S0обр[O2(г)] — 1/2∆S0х.р.
Используя данные таблицы, найдем значения энтальпий образования и энтропий продуктов реакции:
∆H0обр[MgO(т)] = -601,24 кДж/моль;
∆H0обр[NO2(г)] = 33,50 кДж/моль;
S0обр[MgO(т)] = 26,94 Дж/моль·К;
S0обр[NO2(г)] = 240,45 Дж/моль·К;
S0обр[O2(г)] = 205,04 Дж/моль·К.
Подставив найденные значения в уравнения а) и б), рассчитаем искомые величины:
∆H0обр[Mg(NO3)2(т)] = 1моль·(-601,24кДж/моль) +
+ [2 моль·33,50кДж/моль — ∆(510кДж)] = -789,24 кДж;
S0обр[Mg(NO3)2(т)] = (1моль·26,94Дж/моль·К + 2моль·240,45Дж/моль·К) +
+ [(1/2моль·205,04 Дж/моль·К — (1/2)·891 Дж/К)] = -164,87 Дж/К.
Как известно, самопроизвольному протеканию реакции способствует уменьшение её энтальпийного фактора (∆H0х.р.< 0) и увеличение энтропийного фактора (Т·∆S0х.р. > 0). Согласно данным условия задачи, энтропия во время процесса возрастает, и, следовательно, возрастает и произведение Т·∆S0х.р., что способствует его самопроизвольному протеканию. С другой стороны, возрастает и энтальпия реакции, что не способствует самопроизвольности процесса в прямом направлении.
Ответ: ∆H0обр[Mg(NO3)2(т)] = — 789,24 кДж; S0обр[Mg(NO3)2(т)] = -164,87 Дж/К. Самопроизвольности процесса разложения магния нитрата способствует энтропийный фактор этой реакции.
5.3. Энтальпия образования химических соединений
Для расчетов тепловых эффектов используют величину, называемую энтальпией.
Энтальпией (теплотой) образования химического соединения ∆ HT называется изменение энтальпии в процессе получения 1 моля этого соединения из простых веществ (элементов) при постоянном давлении.
Так, например, энтальпией образования этилового спирта C2H5OHназывается изменение энтальпии при реакции углерода, кислорода и водорода при постоянном давлении
2C + 3H2 + 1/2 O2→ CH3 — CH2 — OH
И наоборот, реакции
CH2 = CH2+H2O→CH3 — CH2 — OH
CH3 — CHO+H2→CH3 — CH2 – OH
не являются реакциями ”образования” спирта, хотя и приводят к синтезу этилового спирта.
Важным термодинамическим представлением является понятие о стандартном состоянии вещества, под которым понимается его реальное состояние при 298 Ки атмосферном давлении (илиp = 101 кПа).
Стандартной
энтальпией (теплотой) образования
химического соединения 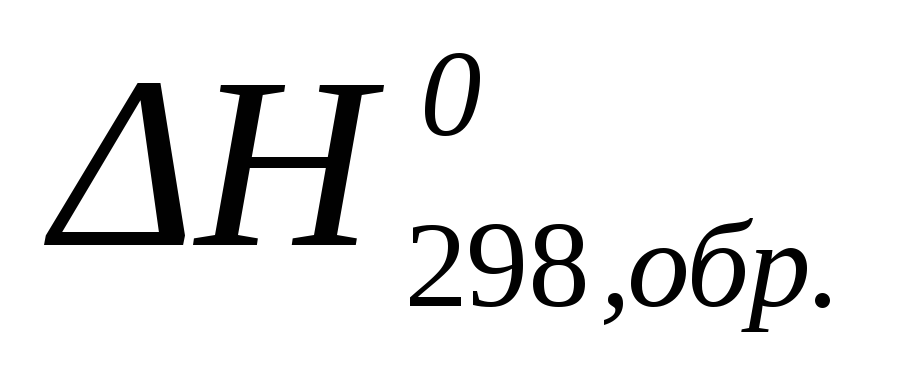 называется изменение энтальпии в
процессе образования 1 моля этого
соединения, находящегося в стандартном
состоянии, из простых веществ, также
находящихся в стандартных состояниях
и термодинамически устойчивых при
данной температуре фазах и модификациях.
называется изменение энтальпии в
процессе образования 1 моля этого
соединения, находящегося в стандартном
состоянии, из простых веществ, также
находящихся в стандартных состояниях
и термодинамически устойчивых при
данной температуре фазах и модификациях.
Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях.
Стандартная энтальпия образования соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения. Если стандартная энтальпия образования отрицательна, то соединение более устойчиво, чем элементы, из которых оно состоит, или наоборот, если она положительна, то соединение менее устойчиво. Из различных молекул более устойчивы те, энтальпии, образования которых меньше.
Например, этан (∆ H298 = —
24,82 ккал/моль)более устойчив, чем
этилен 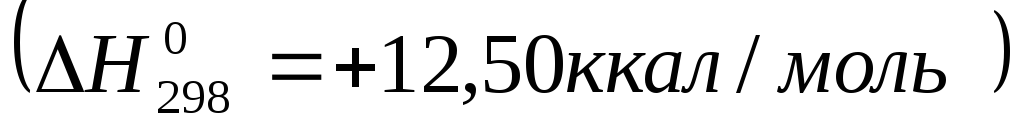
Термохимические расчеты.Значения энтальпий образования позволяет определить изменения энтальпии, сопровождающие реакции, не прибегая к прямым измерениям.
В основе большинства термохимических расчетов лежит следствие из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования исходных веществ.
Так, для уравнения вида
aA + bB +…= dD + eE +…
Тепловой эффект ∆ Hопределяется равенством
 =
=

При этом следует иметь в виду, что при алгебраическом суммировании следует учитывать стехиометрические коэффициенты в уравнении реакции (а, в, d, e).
Приведенное уравнение позволяет определять как тепловой эффект реакции по известным энтальпиям образования веществ, участвующих в реакции, так и одну из энтальпий образования, если известны тепловой эффект реакции и все остальные энтальпии образования.
В настоящее время энтальпии образования известны примерно для четырех тысяч веществ, и это позволяет расчётным путем установить тепловые эффекты самых разнообразных реакций.
Пример 1. Расчет теплового эффекта реакции по стандартным энтальпиям образования веществ.
Al2O3 (к) +3SO3 (г) = Al2(SO4)3 (к)
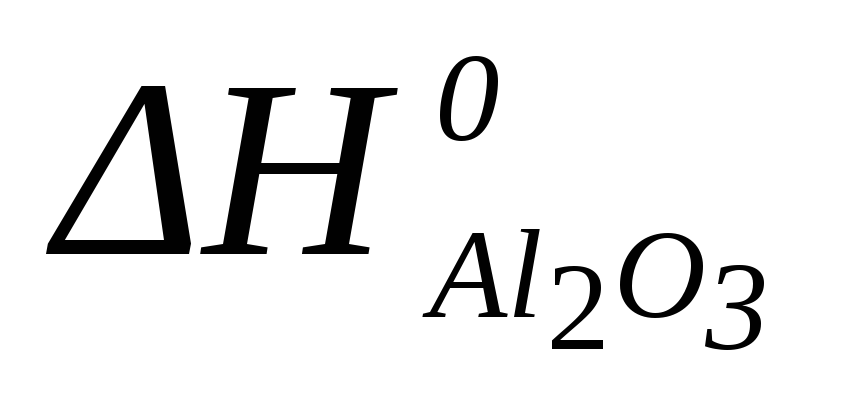 =-1675
кДж/моль;
=-1675
кДж/моль;  =-395,
2 кДж/моль
=-395,
2 кДж/моль
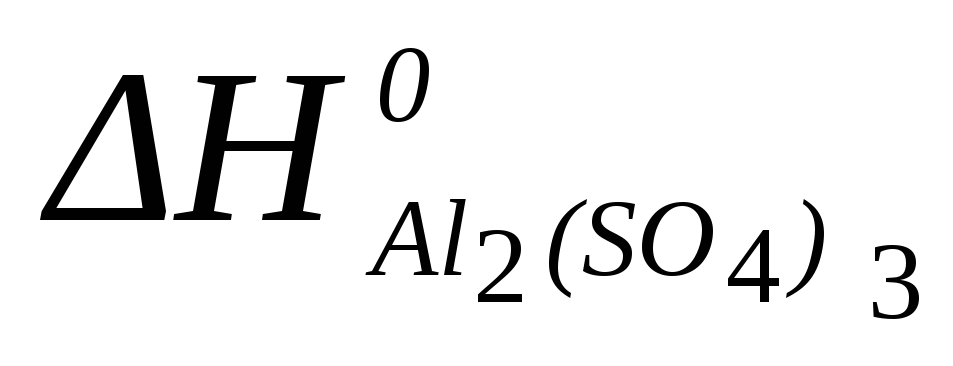 =-3434
кДж/моль
=-3434
кДж/моль
Тепловой эффект
реакции  определяется по уравнению:
определяется по уравнению:

После подстановки значений стандартных энтальпий
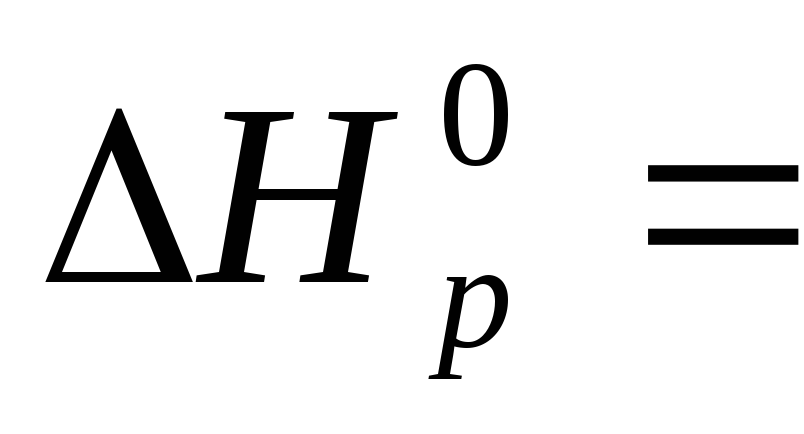 -3434-(-1675-3.395,
2)=-599 кДж/моль
-3434-(-1675-3.395,
2)=-599 кДж/моль
Видно, что 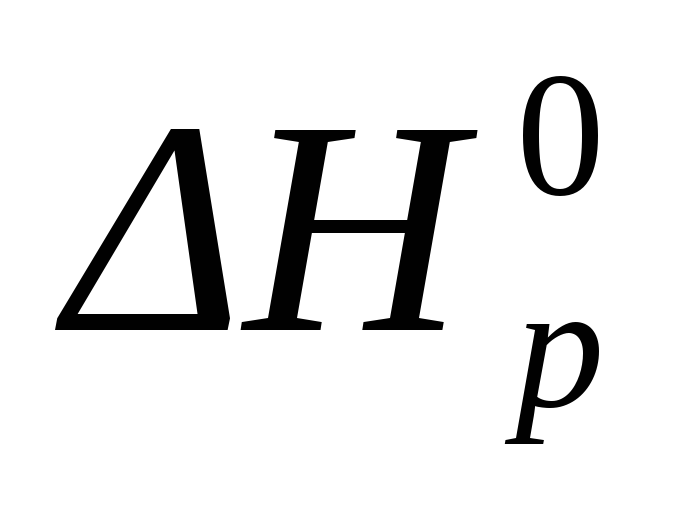 <
0, т.е. это реакция экзотермическая.
<
0, т.е. это реакция экзотермическая.
Пример 2. Расчет энтальпии образования химического соединения по известному тепловому эффекту реакции.
Определить  в реакции:
в реакции:
CH4 (г) + 2 H2O (г) = CO2 (г) + 4 H2 (г)
 =-241,82
кДж/моль;
=-241,82
кДж/моль;  =-393,51
кДж/моль;
=-393,51
кДж/моль; 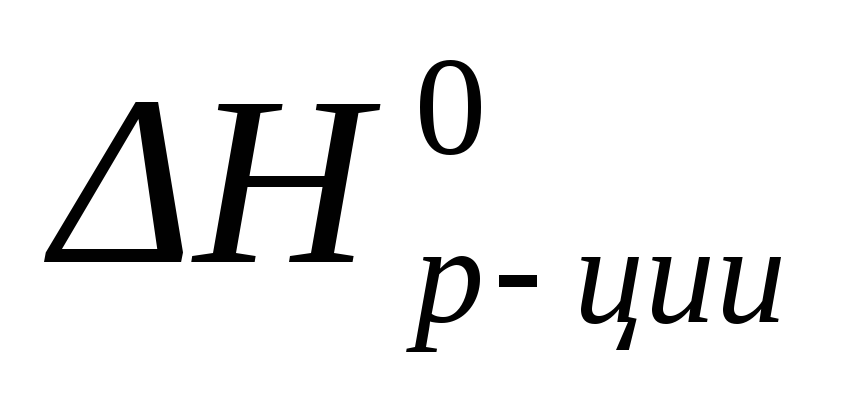 =
+164,98 кДж
=
+164,98 кДж
Стандартный тепловой эффект реакции равен:
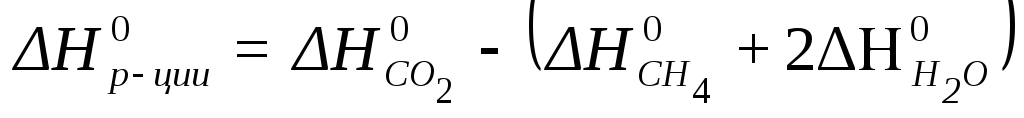 , откуда
, откуда

После подстановки стандартных энтальпий образования веществ:
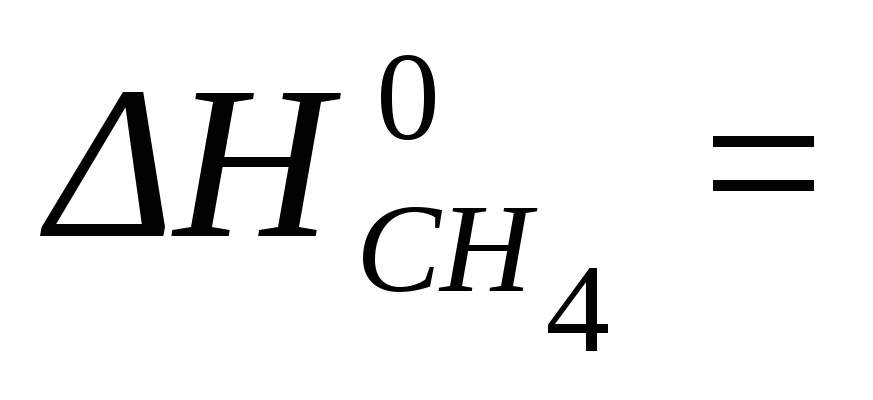 (-1
моль∙ 393,51 кДж/моль + 2 моль ∙ — 241,82
кДж/моль – 164,98 кДж) / 1 моль = — 74,85 кДж/моль
(-1
моль∙ 393,51 кДж/моль + 2 моль ∙ — 241,82
кДж/моль – 164,98 кДж) / 1 моль = — 74,85 кДж/моль
Видно, что реакция образования метана является экзотермической.
Пример 3. Расчет теплового эффекта реакции, который экспериментально определить невозможно.
Реакция 1) C + O2 = CO2,  = -396 кДж/моль
= -396 кДж/моль
может быть также осуществлена в две стадии
2) C + 1/2 O2 = CO, 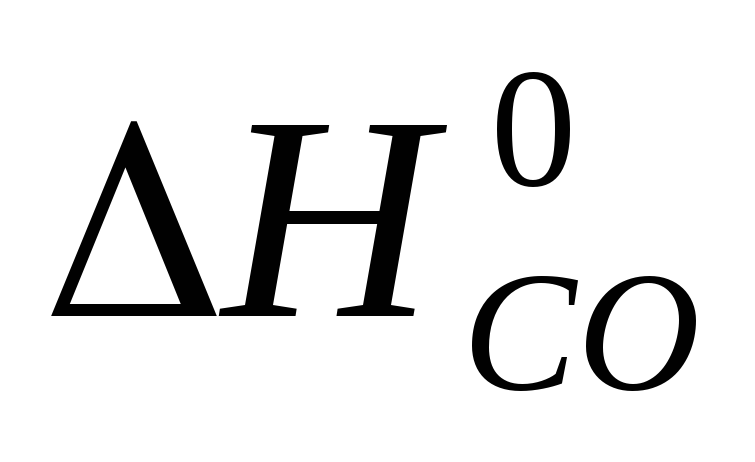 = -110, 5 кДж/моль
= -110, 5 кДж/моль
3) CO + 1/2 O2 = CO2
Тепловой эффект
реакции 2) можно провести экспериментально
и определить 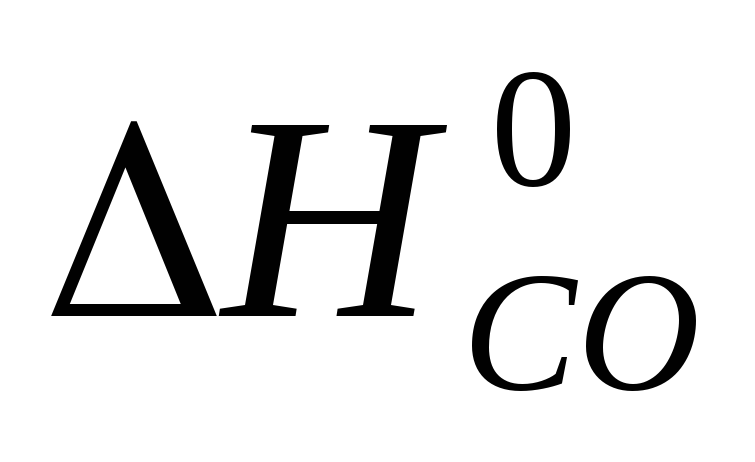 =-110, 5 кДж/моль.
=-110, 5 кДж/моль.
А вот тепловой
эффект реакции 3) экспериментально
осуществить и определить невозможно,
поэтому  реакции
3) получают расчетным путем, используя
закон Гесса
реакции
3) получают расчетным путем, используя
закон Гесса


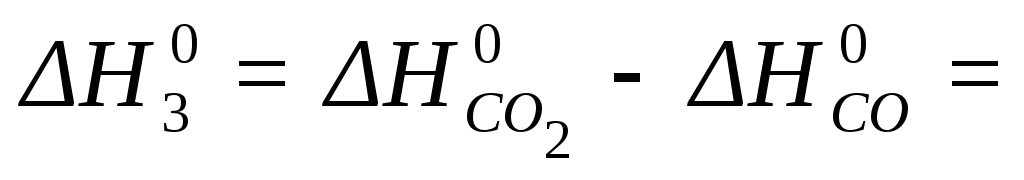 — 396 — (-110, 5) = — 285,5
кДж/моль
— 396 — (-110, 5) = — 285,5
кДж/моль
С помощью термохимических расчетов можно определить энергию химических связей, энергии кристаллических решеток, теплоты растворения и гидратации, тепловые эффекты фазовых превращений и т.д.
Энтальпия есть возрастающая функция температуры, непрерывная во всей области изменения последней, когда существует данная фаза. Для расчета теплового эффекта при температурах, более высоких, чем стандартные, используют уравнение Кирхгофа:

где 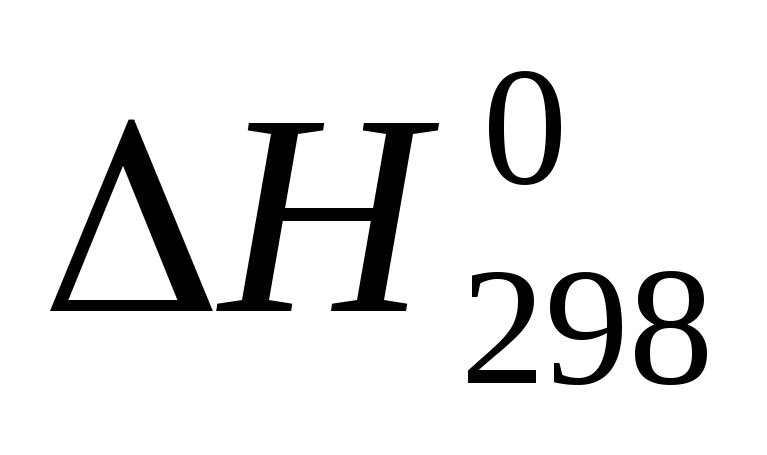 — стандартный тепловой эффект реакции
приT = 298 К;
— стандартный тепловой эффект реакции
приT = 298 К;
 —
стандартный тепловой эффект реакции
при T.
—
стандартный тепловой эффект реакции
при T.
 разность молярных
изобарных теплоемкостей всех продуктов
реакции и молярных изобарных теплоемкостей
всех исходных веществ, т.е.
разность молярных
изобарных теплоемкостей всех продуктов
реакции и молярных изобарных теплоемкостей
всех исходных веществ, т.е.
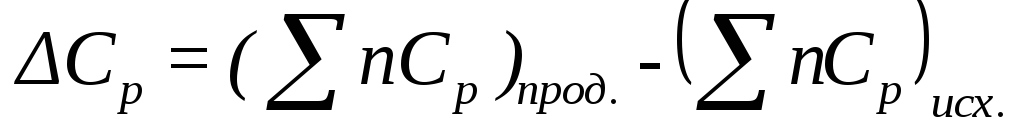
Расчеты по уравнению Кирхгофа показывают, что в том интервале температур, который может иметь практическое значение, изменение величины теплового эффекта реакции невелико.
Так, например,
тепловой эффект процесса 1/2 N2 + 1/2 O2 = NO (г)при
повышении температуры от298до4000Кизменяется всего лишь на2,0
кДж/моль. Еще меньше влияние давления
на тепловой эффект реакции. Так, для
реакции синтеза аммиака из азота и
водорода различие между величинами 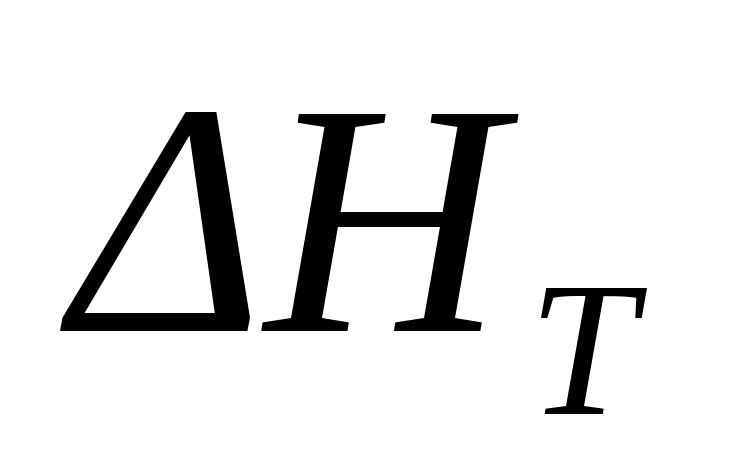 приp = 101 кПаиp = 50 МПане превышает5 %.
приp = 101 кПаиp = 50 МПане превышает5 %.
3. Энергетика химических реакций Химико-термодинамические расчеты
Рекомендуемая литература:
Н.В. Коровин, Общая химия, гл.5, §§5.1-5.4. Лекции по теме.
Н.Л. Глинка, Задачи и упражнения по общей химии, гл. V, §1, примеры 1-9, вопросы для самоконтроля №№ 316-324.
Вопросы для подготовки
Функции состояния: внутренняя энергия, энтальпия, энтропия, энергия Гиббса (изобарно-изотермический потенциал). Тепловой эффект химической реакции. Реакции экзо- и эндотермические. Стандартные условия протекания реакции. Стандартная энтальпия образования сложного вещества. Стандартная энтальпия сгорания. Термохимические уравнения. Закон Гесса. Термодинамические расчеты: определение тепловых эффектов химических реакций, стандартных энтальпий образования сложных веществ. Направление самопроизвольного протекания химической реакции. Изменение энтальпии, энтропии и изобарно-изотермического потенциала в ходе самопроизвольных процессов.
Пример 1.
Рассчитайте стандартную энтальпию образования оксида магния по уравнению химической реакции, протекающей при 298 К:
2Мg (k) + O2 =
2 MgO (k) 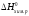 = -1203,6 кДж.
= -1203,6 кДж.
Решение
Стандартная теплота образованиясоединенияэто количество теплоты, которое выделяется или поглощается при образовании одного моль химического соединения из простых веществ в стандартных условиях (давление 101,3 кПа, температура 298 К). Стандартная энтальпия образования равна теплоте образования с обратным знаком.

Ответ: при образовании оксида магния
теплота выделяется, стандартная энтальпия
образования оксида магния – 601,9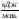 .
.
Пример 2.
Вычислите тепловой эффект химической реакции сгорания этана
2С2H6(г)+ 7O2(г)4CО2(г)+ 6H2O(ж)при 298 К.
Решение
Согласно следствию из закона Гесса, тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Следовательно, энтальпия химической реакции равна:

Выписываем справочные данные:
2С2H6(г)+ 7O2(г)4CО2(г)+ 6H2O(ж)
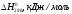 -89,7 0 -393,5 -285,8
-89,7 0 -393,5 -285,8
Рассчитываем энтальпию химической реакции:
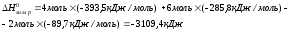
Тепловой эффект реакции Qхим.р.=
–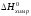 ,
следовательно, реакция экзотермическая,
при сгорании 2 молей этана выделяется
3109,4 кДж теплоты.
,
следовательно, реакция экзотермическая,
при сгорании 2 молей этана выделяется
3109,4 кДж теплоты.
Ответ: 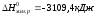
Пример 3.
Вычислите энтальпию и энтропию реакции разложения карбоната кальция
СаСО3(к)СаO(к)+CО2(г)
Рассчитайте изобарно-изотермический
потенциал реакции при 25, 500 и 15000С.
Зависимостью и
и от температуры пренебречь. При какой
температуре система находится в состоянии
равновесия? При каких температурах она
протекает самопроизвольно?
от температуры пренебречь. При какой
температуре система находится в состоянии
равновесия? При каких температурах она
протекает самопроизвольно?
Решение
Выписываем справочные данные:
СаСО3(к)СаO(к)+CО2(г)
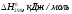 -1207,0 -635,5 -393,5
-1207,0 -635,5 -393,5
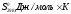 88,7 39,7 213,7
88,7 39,7 213,7
Используя следствие из закона Гесса, рассчитываем энтальпию химической реакции:
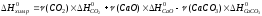 =
=
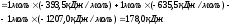
Рассчитываем энтропию химической реакции:
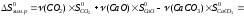
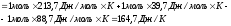
Энергия Гиббса или изобарно-изотермический потенциал рассчитывается по формуле
G =H – TS
При 250С
Т=298 К, 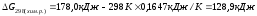
При 5000С
Т=773 К, 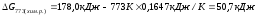
При 10000С
Т=1273 К, 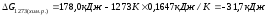
В состоянии термодинамического равновесия G =H – TS = 0.
Данная система находится в состоянии равновесия при температуре

Химическая реакция протекает самопроизвольно, если G<0, следовательно, реакция разложения карбонат кальция возможна при температуре выше 1081 К.
Контрольные задания
Задание 3
Вычислите стандартные энтальпию и энтропию химической реакции … , используя данные таблицы 5.
Рассчитайте изобарно-изотермический
потенциал реакции при температурах t1,t2иt30С.
Зависимостью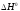 и
и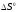 от температуры пренебречь. При какой
температуре система находится в состоянии
равновесия? При каких температурах она
протекает самопроизвольно?
от температуры пренебречь. При какой
температуре система находится в состоянии
равновесия? При каких температурах она
протекает самопроизвольно?
№ | Уравнение химической реакции | t1 | t2 | t3 |
1 |
| 17 | 100 | 1000 |
2 |
| 22 | 120 | 1200 |
3 | | 25 | 150 | 1500 |
4 | | 30 | 175 | 1000 |
5 |
| 27 | 200 | 2000 |
6 | 18 | 125 | 1250 | |
7 |
| 20 | 150 | 1500 |
8 |
| 25 | 170 | 1700 |
9 |
| 33 | 200 | 2000 |
10 |
| 17 | 250 | 2500 |
11 |
| 25 | 100 | 1000 |
12 |
| 30 | 175 | 1750 |
13 |
| 37 | 300 | 3000 |
14 |
| 20 | 250 | 2500 |