1.6. Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Cu + S = CuS.
Взаимодействие с водородом происходит при 150–200 °С:
H2 + S = H2S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O2 = SO2;
2S + 3O2 = 2SO3.
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P2S3;
2S + C = CS2.
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F2 = SF6.
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO3 = 2NO + H2SO4.
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
1.7. Получение серы
Из самородных руд
При нагревании пирита без доступа воздуха
FeS2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2H2S + O2 = 2S + 2H2O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H2S + SO2 = 2H2O + 3S.
1.8. Сероводород
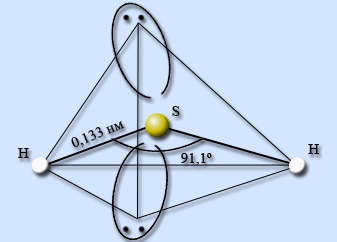
Водородное соединение серы – сероводород H2S. Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp3-гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Тпл
= -86 °С,Ткип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H2S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
H2S = HS— + H+;
HS— = S2- + H+.
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2H2S + O2 = 2H2O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2H2S + 3O2 = 2H2O + 2SО2.
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H2S + Br2 = 2HBr + S.
взаимодействует с хлорной водой:
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO2 + 4H2S = 3PbS + SO2 + 4H2O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO2 + 2H2S = 3S + 2H2O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO2 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O.
studfile.net
Реакции, взаимодействие серы. Уравнения реакции серы с веществами
Реакции, взаимодействие серы. Уравнения реакции серы с веществами.
Сера реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, солями и пр. веществами.
Реакции, взаимодействие серы с неметаллами
Реакции, взаимодействие серы с металлами и полуметаллами
Реакции, взаимодействие серы с оксидами
Реакции, взаимодействие серы с солями
Реакции, взаимодействие серы с кислотами
Реакции, взаимодействие серы с водородсодержащими соединениями
Реакции, связанные с изменением молекулярного состава серы
Реакции, взаимодействие серы с неметаллами. Уравнения реакции:
1. Реакция взаимодействия серы и водорода:
H2 + S → H2S (t = 150-200 °C).
Реакция взаимодействия водорода и серы происходит с образованием сероводорода.
2. Реакция взаимодействия серы и кислорода:
S + O2 → SO2 (t°).
Реакция взаимодействия серы и кислорода происходит с образованием оксида серы (IV). Образуется также примесь оксид серы (VI) SO3. Данная реакция представляет собой сгорание серы на воздухе.
3. Реакция взаимодействия серы и фтора:
S + 3F2 → SF6.
Реакция взаимодействия серы и фтора происходит с образованием фторида серы (VI). Реакция протекает при комнатной температуре.
4. Реакция взаимодействия серы и красного фосфора:
4P + 9S → P4S9 (t = 550 °C, р).
Реакция взаимодействия красного фосфора и серы происходит с образованием нонасульфида тетрафосфора. Реакция протекает при избыточном давлении. Образуется также примесь P4S7.
Реакции, взаимодействие серы с металлами и полуметаллами. Уравнения реакции:
1. Реакция взаимодействия серы и кальция:
Ca + S → CaS (t = 150 °C).
Реакция взаимодействия кальция и серы происходит с образованием сульфида кальция.
2. Реакция взаимодействия серы и кобальта:
Co + S → CoS (t ≈ 650 °C).
Реакция взаимодействия кобальта и серы происходит с образованием сульфида кобальта. В результате реакции также образуются CoS2, Co3
3. Реакция взаимодействия серы и калия:
2K + S → K2S (t = 100-200 °C).
Реакция взаимодействия калия и серы происходит с образованием сульфида калия.
4. Реакция взаимодействия серы и лития:
2Li + S → Li2S (t > 130 °C).
Реакция взаимодействия лития и серы происходит с образованием сульфида лития.
5. Реакция взаимодействия серы и натрия:
2Na + S → Na2S (t > 130 °C).
Реакция взаимодействия натрия и серы происходит с образованием сульфида натрия.
6. Реакция взаимодействия серы и рубидия:
2Rb + S → Rb2S (t = 100-130 °C).
Реакция взаимодействия рубидия и серы происходит с образованием сульфида рубидия.
7. Реакция взаимодействия серы и серебра:
2Ag + S → Ag2S (t > 200°C).
Реакция взаимодействия серебра и серы происходит с образованием сульфида серебра.
8. Реакция взаимодействия серы и меди:
2Cu + S → Cu2S (t = 300-400 °C).
Реакция взаимодействия меди и серы происходит с образованием сульфида меди.
9. Реакция взаимодействия серы и железа:
Fe + S → FeS (t = 600-950°C).
Реакция взаимодействия железа и серы происходит с образованием сульфида железа.
10. Реакция взаимодействия серы и цинка:
Zn + S → ZnS (t = 130 °C).
Реакция взаимодействия цинка и серы происходит с образованием сульфида цинка.
11. Реакция взаимодействия серы и таллия:
2Tl + S → Tl2S (t = 320 °C).
Реакция взаимодействия таллия и серы происходит с образованием сульфида таллия. Реакция протекает в атмосфере водорода.
Реакции, взаимодействие серы с оксидами. Уравнения реакции:
1. Реакция взаимодействия серы и оксида углерода (II):
CO + S → COS (t ≈ 350 °C).
Реакция взаимодействия оксида углерода (II) и серы происходит с образованием оксосульфида углерода. Катализатором может выступать углерод.
Реакции, взаимодействие серы с солями. Уравнения реакции:
1. Реакция взаимодействия серы и сульфита натрия:
Na2SO3 + S → Na2S2O3 (t°)
или
8Na2SO3 + S8 → 8Na2S2O3 (t°).
Реакция взаимодействия сульфита натрия и серы происходит с образованием тиосульфата натрия. Реакция происходит в кипящем водном растворе.
2. Реакция взаимодействия серы и сульфида калия:
K2S + S → K2S2 (t°).
Реакция взаимодействия сульфида калия и серы происходит с образованием дисульфида калия.
3. Реакция взаимодействия серы и трисульфида гадолиния:
Gd2S3 + S → 2GdS2.
Реакция взаимодействия трисульфида гадолиния с серой происходит с образованием сульфида гадолиния.
4. Реакция взаимодействия серы и сульфида таллия (I):
Tl2S + 2S → Tl2S3.
Реакция взаимодействия сульфида таллия (I) и серы происходит с образованием трисульфида таллия (I).
5. Реакция взаимодействия серы и сульфида бора (III):
B2S3 + 2S → B2S5.
Реакция взаимодействия сульфида бора (III) с серой происходит c образованием сульфида бора (V).
6. Реакция взаимодействия серы и трисульфида диванадия:
V2S3 + 2S → V2S5.
Реакция взаимодействия трисульфида диванадия с парами серы происходит с образованием сульфида ванадия.
Реакции, взаимодействие серы с кислотами. Уравнения реакции:
С концентрированными кислотами-окислителями сера реагирует только при длительном нагревании.
Реакции, взаимодействие серы с водородсодержащими соединениями. Уравнения реакции:
1. Реакция взаимодействия серы и гидрида рубидия:
2RbH + S → Rb2S + H2S (t = 300-350 °C).
Реакция взаимодействия гидрида рубидия и серы происходит с образованием сульфида рубидия и сероводорода.
2. Реакция взаимодействия серы и йодоводорода:
2HI + S → I2 + H2S (t ≈ 500 °C).
Реакция взаимодействия йодоводорода и серы происходит с образованием йода и сероводорода.
3. Реакция взаимодействия серы и селеноводорода:
H2Se + S → Se + H2S.
Реакция взаимодействия селеноводорода и серы происходит с образованием селена и сероводорода. В ходе реакции используется насыщенный раствор селеноводорода. Реакция медленно протекает при комнатной температуре.
4. Реакция взаимодействия серы и гидрида натрия:
2NaH + 2S → Na2S + H2S (t = 350-400 °C).
Реакция взаимодействия гидрида натрия и серы происходит с образованием сульфида натрия и сероводорода.
5. Реакция взаимодействия серы и гидрида лития:
2LiH + 2S → Li2S + H2S (t = 300-350 °C).
Реакция взаимодействия гидрида лития и серы происходит с образованием сульфида лития и сероводорода.
6. Реакция взаимодействия серы и гидрида калия:
2KH + 2S → K2S + H2S (t = 350 °C).
Реакция взаимодействия гидрида калия и серы происходит с образованием сульфида калия и сероводорода.
Реакции, связанные с изменением молекулярного состава серы:
1. Реакция изменения молекулярного состава серы:
S8 → S6 → S4 (t°).
S4 → S2 (t = 800-1400 °C).
S2 → S (t = 1700 °C).
Реакция происходит при нагревании.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 738
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Сероводород взаимодействие с водой — Справочник химика 21
Простейшим способом удаления сероводорода является абсорбция его из газа водой при относительно низкой температуре (сероводород при этом растворяется в воде). Однако это — малоэффективный процесс вследствие относительно малой растворимости сероводорода в воде. Поэтому чаще применяют обработку газа различными реагентами. Здесь сочетаются сорбционные (физические) процессы и химическое взаимодействие сероводорода и других примесей с реагентами. [c.248]Природные растворы представляют собой сложные физико-химические системы, которые образуются в различных условиях самопроизвольно при взаимодействии воды как растворителя с горными породами, минералами, продуктами жизнедеятельности животных и растительных организмов. К природным растворам относятся как пресные (с содержанием сухого остатка >1 г1л). Последние отличаются более высоким содержанием растворенных газов, химических элементов и соединений, радиоактивностью, иногда повышенной температурой, достигающей у вод гейзеров 100° С. Соленость воды Мертвого моря в 7,5 раза больше солености морской воды. Минеральные воды, в состав которых.входят йод, бром, углекислота, сероводород, радон и др., оказывают определенное физиологическое воздействие на человеческий организм и применяются как лечебное средство. [c.159]
Как видно из представленных результатов, температурные области эффективного действия катализаторов для выбранных реакций достаточно разнесены. В температурном диапазоне 220-260°С, где достигается выход серы близкий к 100%, реакция окисления пропана протекает с незначительной скоростью. Негативное воздействие паров воды на параметры целевого процесса отмечалось ранее. Селективность процесса существенно падает при введении воды в количестве 60 об.% при одновременном увеличении суммарной конверсии исходного сероводорода. Интересным представляется полученный результат, показывающий, что при высоких значениях объемной скорости (до 100000 ч ) удается достичь высоких показателей реакции прямого окисления сероводорода даже при высоком содержании паров воды 8 газовой фазе (до 95 об.%). Таким образом, при малом времени контакта реакция прямого окисления сероводорода протекает с заметно более высокой скоростью, чем обратный процесс взаимодействия паров воды с серой в газовой фазе с образованием сероводорода и диоксида серы. [c.117]
Это свидетельствует о том, что уже при комнатной температуре происходит взаимодействие части молекул сероводорода с поверхностными сульфатными группами с образованием воды и, по-видимому, элементной серы. Другая часть молекул сероводорода взаимодействует с поверхностным или решеточным кислородом с образованием сульфат-сульфитных комплексов (1168 и 1308 см ). [c.119]
Сернистые соединения с открытой цепью углеродных атомов, по-видимому, все имеют вторичный характер. Незначительная роль их в нефти по сравнению с высокомолекулярной частью, содержащей серу, внедренную в циклические системы, позволяет рассматривать последние как первичную форму сернистых соединений, образованных углеводородами или другими органическими веществами, пришедшими во взаимодействие с серой. Следовательно, должен существовать какой-то источник серы, который бы мог обеспечить позднейшие реакции с углеводородами. Этот источник серы чаще всего видели в процессе восстановления сульфатов, сопровождающих многие нефтяные месторождения, главным образом в виде гипса. Предполагалось, что при взаимодействии с углеводородами возможно восстановление сульфатов с образованием углекислого газа, сероводорода и воды. Эта реакция, известная в технике в виде содового процесса, по Леблану, идет однако только при высоких температурах, нереальных в нефтяных месторождениях. Затем были открыты различные бактерии, которые при обыкновенной температуре и без доступа воздуха могут восстанавливать сульфаты до сульфидов, гидросульфидов и сероводорода. Механизм этой реакции понимается таким образом, что микроорганизмы, нуждающиеся в кислороде для создания живого вещества бактерий, заимствуют необходимый им кислород из сульфатов, переводя их в различные сульфиды, дающие с водой сероводород и кислые сульфиды по уравнениям [c.178]
При действии растворов кислот, в частности таких, как азотная и серная, на металлы в результате реакции в зависимости от активности металла и от концентрации кислоты получаются различные продукты. Так, взаимодействие цинка с разбавленной серной кислотой сопровождается выделением водорода, а с концентрированной серной кислотой — сероводорода н воды [c.111]
Проведение опыта. Закрыть колбу резиновой пробкой, через которую пропущены две согнутые под прямым углом трубки (не доходящие до дна на 4—5 см) и одна короткая трубка (рис. 16). На дно колбы налить немного воды. Через длинные трубки пропустить в колбу сероводород и сернистый газ. Колбу следует время от времени встряхивать, чтобы ее стенки оставались влажными. Через некоторое время на них появляется светло-желтый осадок серы, которая образуется в результате восстановительно-окислительного взаимодействия сернистого газа и сероводорода, катализируемого водой. [c.54]
Оксид углерода, оксиды азота и сероводород являются сильными ядами. Диоксид серы, находясь в воздухе, окисляется до триоксида серы, который при взаимодействии с атмосферной водой образует серную кислоту. Последняя наносит вред расте- [c.297]
Комм. Почему для получения сероводорода используют взаимодействие сульфидов с хлороводородной кислотой Можно ли использовать для той же цели концентрированную или разбавленную а) азотную кислоту 6) серную кислоту в) хлорную кислоту Какова растворимость сероводорода в воде Охарактеризуйте протолитические свойства сероводорода в водном растворе и дайте оценку его окислительно-восстановительным свойствам. [c.147]
На равновесие реакции (П1.7) оказывают влияние пары воды, которые могут находиться в очищаемом газе, особенно в случае очистки конвертированного газа от сероводорода. Влияние парциального давления паров воды на равновесное парциальное давление сероводорода, взаимодействующего при 200—300 °С с оксидом цинка, показано на рис. [c.215]
Отрицательное влияние на протекание процесса алкилирования оказывают различные примеси, присутствующие в сырье. Некоторые из этих примесей вступают во взаимодействие с кислотой или остаются в ней в качестве разбавляющих компонентов. Примесями, содержащимися в сырье для алкилирования, являются сероводород, меркаптаны, вода, бутадиен, этилен. [c.232]
Процессы получения водорода с использованием в качестве основного компонента серы и ее соединений весьма многочисленны. Основной идеей таких процессов является производство водорода путем термического разложения сероводорода, взаимодействием последнего с металлами, а также взаимодействием воды с сульфидами и оксидами металлов. В циклы входят реакции образования сульфидов и распад сульфатов с образованием кислорода. [c.389]
Можно считать, чго реакция протекает в две ступени, как показано этими уравнениями. Сначала часть сероводорода превращается в сернистый ангидрид. Затем сернистый ангидрид, образовавшийся в результате сгорания сероводорода, взаимодействует с остальным количеством сероводорода, образуя элементарную серу и воду. Следует отметить, что в продуктах сгорания, выходящих из печи-реактора, сера в зависимости от температуры и давления (рис. 29) [538] может присутствовать в виде молекул Зг, 5б или Зв или любых сочетаний этих молекул. [c.413]
Сульфид бария гидролизуется во влажном воздухе с выделением сероводорода, разлагается водой и соляной кислотой, окисляется при нагревании на воздухе, взаимодействует с углеродом [c.48]
Выполнение. В аппарате Киппа взаимодействием сульфида железа (II) в кусках с серной кислотой (1 5) получить сероводород. Пройдя через склянку Тищенко, содержащую воду, он поступает в колбу с водой, подкрашенной фиолетовым (нейтральным) лакмусом. Поглощаясь водой, образует сероводородную воду, обладающую свойствами кислоты лакмус окрашив
www.chem21.info