Оксид меди(II) — это… Что такое Оксид меди(II)?
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C получается оксид меди(II):
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается:
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
- (тетрагидроксокупрат(II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Примечания
- ↑ под давлением О2
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
dic.academic.ru
Окись меди — это… Что такое Окись меди?

Оксид меди(II)
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
2Cu + O2 → 2CuO.
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑;
Cu(OH)2·CuCO3 → 2CuO + H2O + CO2↑.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3 → Cu(NO3)2 + H2O.
При сплавлении CuO со щелочами образуются купраты:
CuO + 2KOH → K2CuO2 + H2O.
При нагревании до 1100 °C разлагается:4CuO → 2Cu2O + O2↑.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (гидроксокупрат(II) натрия).
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
H2 + CuO → Cu + H2O.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
- ↑ под давлением О2
Wikimedia Foundation. 2010.
dic.academic.ru
свойства, получение, применение :: SYL.ru
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида. Давайте рассмотрим их детальнее.

Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240оС. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.

Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100оС. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100оС. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.

Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400оС, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Заключение
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
www.syl.ru
Глава 2. Химические свойства меди и ее соединений
§1. Химические свойства простого вещества (ст. ок. = 0).
а) Отношение к кислороду.
В отличие от своих соседей по подгруппе – серебра и золота, — медь непосредственно реагирует с кислородом. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
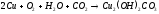
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
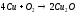
Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например, при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.

Рисунок 2. Строение оксидной пленки меди.
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
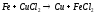 .
.
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
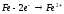
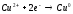
Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода.
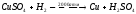
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
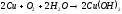
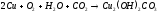
в) Взаимодействие с кислотами.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют.
Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
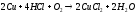
Исключение составляет только иодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I):
2Cu + 3HI → 2H[CuI2] +H2↑
Медь так же реагирует с кислотами – окислителями, например, с азотной:
Cu + 4HNO3(конц.) → Cu(NO3)2+2NO2↑+2H2O
3Cu + 8HNO3(разбав.) → 3Cu(NO3)2+2NO↑+4H2O
А так же с концентрированной холодной серной кислотой:
Cu + H 2SO4(конц.) → CuO + SO2↑ + H2O
C горячей концентрированной серной кислотой:
Cu + 2H2SO4(конц., горячая) → CuSO4 + SO2↑ + 2H2O
C безводной серной кислотой при температуре 2000С образуется сульфат меди (I):
2Cu + 2H2SO4(безводн.) 200 °C→ Cu2SO4↓ + SO2↑ + 2H2O
г) Отношение к галогенам и некоторым другим неметаллам.
Qобразования (CuCl) = 134300 кДж
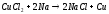
Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например:
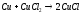
При этом монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Медь так же достаточно легко ступает в реакции с серой и селеном при нагревании (300—400 °C):
2Cu +S→Cu2S
2Cu +Se→Cu2Se
А вот с водородом, углеродом и азотом медь не реагирует даже при высоких температурах.
д) Взаимодействие с оксидами неметаллов
Медь при нагревании может вытеснять из некоторых оксидов неметаллов (например, оксид серы (IV) и оксиды азота (II, IV)) простые вещества, образуя при этом термодинамически более устойчивый оксид меди (II):
4Cu+SO2 600-800°C →2CuO + Cu2S
4Cu+2NO2 500-600°C →4CuO + N2↑
2Cu+2NO 500-600°C →2CuO + N2↑
§2. Химические свойства одновалентной меди (ст.ок. = +1)
В водных растворах ион Cu+ очень неустойчив и диспропорционирует:
Cu+↔Cu0+Cu2+
Однако медь в степени окисления (+1) может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразовния [9].
а) Оксид меди (I) Cu2O
Амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта. Исскуственно может быть получен нагреванием раствора соли меди (II) с щелочью и каким-нибудь сильным восстановителем, например, формалином или глюкозой [11]. Оксид меди(I) не реагирует с водой. Оксид меди(I) переводится в раствор концентрированной соляной кислотой с образованием хлоридного комплекса:
Cu2O+4HCl→2H[CuCl2]+ H2O
Так же растворим в концентрированном растворе аммиака и солей аммония:
Cu2O+2NH4+→2[Cu(H2O)(NH3)]+
В разбавленной серной кислоте диспропорционирует на двухвалентную медь и металлическую медь:
Cu2O+H2SO4(разбав.) →CuSO4+Cu0↓+H2O
Также оксид меди(I) вступает в водных растворах в следующие реакции:
1. Медленно окисляется кислородом до гидроксида меди(II):
2Cu2O+4H2O+O2→4Cu(OH)2↓
2. Реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
Cu2O+2HГ→2CuГ↓ +H2O (Г=Cl, Br, J)
3.Восстанавливается до металлической меди типичными восстановителями, например, гидросульфитом натрия в концентрированном растворе:
2Cu2O+2NaSO3→4Cu↓+Na2SO4+H2SO4
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
1. При нагревании до 1800 °C (разложение):
2Cu2O —1800 °C →2Cu +O2
2. При нагревании в токе водорода, монооксида углерода, с алюминиеми прочими типичными восстановителями:
Cu2O + H2 —>250°C→2Cu +H2O
Cu2O + CO —250-300°C→2Cu +CO2
3Cu2O + 2Al —1000°C→6Cu +Al2O3
Также, при высоких температурах оксид меди(I) реагирует:
1. C аммиаком (образуется нитрид меди(I))
3Cu2O + 2NH3 —250°C→2Cu3N + 3H2O
2. С оксидами щелочных металлов:
Cu2O+M2O-600-800°C →2МCuO (M= Li, Na, K)
При этом образуются купраты меди (I).
Оксид меди (I) заметно реагирует с щелочами [9]:
Cu2O+2NaOH(конц.) +H2O↔2Na[Cu(OH)2]
б) Гидроксид меди (I) CuOH
Гидроксид меди(I) образует жёлтое вещество, не растворяется в воде.
Легко разлагается при нагревании или кипячении:
2CuOH → Cu2O + H2O
в) Галогениды CuF, CuСl, CuBr и CuJ
Все эти соединения – белые кристаллические вещества, плохо растворимые в воде, но хорошо растворимые в избытке NH3, цианидных ионов, тиосульфатных ионов и иных сильных комплексообразователей. Иод образует только соединениеCu+1J. В газообразном состоянии образуются циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих галогенводородных кислотах:
CuГ + HГ ↔ H[CuГ2] (Г=Cl, Br, J)
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4CuГ +2H2O +O2 →4Cu(OH)Г (Г=Cl, Br)
г) Прочие соединения меди (I)
1. Ацетат меди (I) (СН3СООСu) — соединение меди, имеет вид бесцветных кристаллов. В воде медленно гидролизуется до Сu2О, на воздухе окисляется до ацетата двухвалентной меди; Получают СН3СООСu восстановлением (СН3СОО)2Сu водородом или медью, сублимацией (СН3СОО)2Сu в вакууме или взаимодействием (NH3OH)SO4 с (СН3СОО)2Сu в р-ре в присутствии Н3СООNH3. Вещество токсично.
2. Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. Устойчивы во влажном состоянии. При детонации в отсутствие кислорода не образуется газообразных веществ. Под действием кислот разлагается. Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I):
С2H2 +2[Cu(NH3)2](OH) →Cu2C2↓ +2H2O+2NH3
Данная реакция используется для качественного обнаружения ацетилена.
3. Нитрид меди — неорганическое соединение с формулой Cu3N, тёмно-зелёные кристаллы.
Разлагается при нагревании:
2Cu3N —300°C→6Cu +N2↑
Бурно реагирует с кислотами:
2Cu3N +6HCl —300°C→3Cu↓ +3CuCl2 +2NH3↑
§3. Химические свойства двухвалентной меди (ст.ок. = +2)
Наиболее устойчивая степень окисления у меди и самая характерная для нее.
а) Оксид меди (II) CuO
CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета. Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3→Cu(NO3)2 +H2O
При сплавлении CuO со щелочами образуются купраты меди (II):
CuO+2KOH—t°→K2CuO2 +H2O
При нагревании до 1100 °C разлагается [9]:
4CuO-t°→2Cu2O + O2
б) Гидроксид меди (II) Cu(OH)2
Гидроксид меди(II) — голубое аморфное или кристаллическое вещество, практически не растворимое в воде. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О:
Cu(OH)2 → CuO + H2O
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
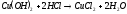
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
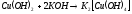
Гидроксид меди(II) со слабыми кислотами образует основные соли [11]. Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2+4NH4OH→[Cu(NH3)4](OH)2+4H2O
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
в) Соли меди (II)
Простые соли меди (II) известны для большинства анионов, кроме цианида и иодида, которые при взаимодействии с катионом Cu2+ образуют ковалентные соединения меди (I), нерастворимые в воде.
Соли меди (+2), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Так, из водного раствора хлорида меди (II) ниже 150С кристаллизуется тетрагидрат, при 15-260С – тригидрат, свыше 260С – дигидрат. В водных растворах соли меди (II) в небольшой степени подвержены гидролизу, и из них часто осаждаются основные соли [9].
1. Пентагидрат сульфата меди (II) (медный купорос)
Наибольшее практическое значение имеет CuSO4*5H2O, называемый медным купоросом. Сухая соль имеет голубую окраску, однако при несильном нагревании (2000С) она теряет кристаллизационную воду. Безводная соль белого цвета. При дальнейшем нагревании до 7000С она превращается в оксид меди, теряя триоксид серы:
CuSO4—t°→CuO+SO3↑
Готовят медный купорос растворением меди в концентрированной серной кислоте. Эта реакция описана в разделе «Химические свойства простого вещества». Медный купорос применяют при электролитическом получении меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, для получения других соединений меди [9].
2. Дигидрат хлорида меди (II).
Это темно-зеленые кристаллы, легкорастворимые в воде. Концентрированные растворы хлорида меди имеют зеленый цвет, а разбавленные – голубой. Это объясняется образованием хлоридного комплекса зеленого цвета:
Cu2++4Cl— →[CuCl4]2-
И его дальнейшим разрушением и образованием голубого аквакомплекса.
3. Тригидрат нитрата меди (II).
Кристаллическое вещество синего цвета. Получается при растворении меди в азотной кислоте. При нагревании кристаллы сначала теряют воду, затем разлагаются с выделением кислорода и диоксида азота, переходя в оксид меди (II):
2Cu(NO3)2—t°→2CuO+4NO2↑+O2↑
4. Карбонат гидроксомеди (II).
Карбонаты меди малоустойчивы и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди Cu2(OH)2CO3, который встречается в природе в виде минерала малахита. При нагревании легко разлагается с выделением воды, оксида углерода (IV) и оксида меди (II):
Cu2(OH)2CO3—t°→2CuO+H2O↑+CO2↑
§4. Химические свойства трехвалентной меди (ст.ок. = +3)
Эта степень окисления является наименее стабильной для меди, и поэтому соединения меди (III) являются скорее исключениями, чем «правилами». Тем не менее, некоторые соединения трехвалентной меди существуют.
а) Оксид меди (III) Cu2O3
Это кристаллическое вещество, темно-гранатового цвета. Не растворяется в воде.
Получается окислением гидроксида меди(II) пероксодисульфатом калия в щелочной среде при отрицательных температурах:
2Cu(OH)2 +K2S2O8+2KOH —-20°C→Cu2O3↓+2K2SO4+3H2O
Это вещество разлагается при температуре 4000С:
Cu2O3—t°→2CuO+O2↑
Окисид меди (III) – сильный окислитель. При взаимодействии с хлороводородом хлор восстанавливается до свободного хлора [10]:
Cu2O3+6HCl—t°→2CuCl2+Cl2↑+3H2O
б) Купраты меди (Ш)
Это черные или синие вещества, в воде не устойчивы, диамагнитны, анион – ленты квадратов (dsp2). Образуются при взаимодействии гидроксида меди(II) и гипохлорита щелочного металла в щелочной среде [10]:
2Cu(OH)2 + МClO + 2NaOH→2МCuO3 +NaCl +3H2O (M=Na—Cs)
в) Калия гексафторкупрат(III)
Зеленое вещество, парамагнитно. Октаэдрическое строение sp3d2. Комплекс фторида меди CuF3, который в свободном состоянии разлагается при -600С. Образуется нагреванием смеси хлоридов калия и меди в атмосфере фтора:
3KCl + CuCl + 3F2 → K3[CuF6] + 2Cl2
Разлагает воду с образованием свободного фтора.
§5. Соединения меди в степени окисления (+4)
Пока науке известно лишь одно вещество, где медь в степени окисления +4, это гексафторкупрат(IV) цезия – Cs2Cu+4F6 — оранжевое кристаллическое вещество, стабильное в стеклянных ампулах при 00С. Бурно реагирует с водой. Получается фторированием при высоком давлении и температуре смеси хлоридов цезия и меди [10]:
CuCl2 +2CsCl +3F2 —t° р→ Cs2CuF6 +2Cl2
studfile.net
Медь — химические свойства » HimEge.ru
Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl3] + H2
himege.ru
Гидроксид меди (II), характеристика, свойства и получение, химические реакции
Гидроксид меди (II), характеристика, свойства и получение, химические реакции.
Гидроксид меди (II) – неорганическое вещество, имеет химическую формулу Cu(OH)2.
Краткая характеристика гидроксида меди (II)
Физические свойства гидроксида меди (II)
Получение гидроксида меди (II)
Химические свойства гидроксида меди (II)
Химические реакции гидроксида меди (II)
Применение и использование гидроксида меди (II)
Краткая характеристика гидроксида меди (II):
Гидроксид меди (II) – неорганическое кристаллическое или аморфное вещество ярко-голубого цвета.
Химическая формула гидроксида меди (II) Cu(OH)2.
Не растворяется в воде. Растворимость в воде 0,000673 г/100 мл.
Не горит. Термически неустойчивый. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается на оксид меди (II) и воду.
Гидроксид меди токсичен.
Физические свойства гидроксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | Cu(OH)2 |
| Синонимы и названия иностранном языке | сopper(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | ярко-голубые кристаллы либо ярко-голубая водная суспензия (аморфное состояние) |
| Цвет | ярко-голубой |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), г/см3 | 3,37 |
| Температура разложения, °C | 70 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 97,561 |
* Примечание:
— нет данных.
Получение гидроксида меди (II):
В лаборатории гидроксид меди (II) получается действием на холоде растворимых гидроксидов металлов на растворимые соли меди в результате следующих химических реакций:
- 1. в результате взаимодействия нитрата меди (II) с гидроксидом натрия:
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 2. в результате взаимодействия сульфата меди (II) и гидроксида калия:
2KOH + CuSO4 → Cu(OH)2 + K2SO4.
При этом гидроксид меди (II) выпадает в осадок.
- 3. в результате взаимодействия нитрата меди (II) с гидроксидом калия:
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KNO3.
При этом гидроксид меди (II) выпадает в осадок.
- 4. в результате взаимодействия сульфата меди (II) с гидроксидом кальция:
Ca(OH)2 + CuSO4 → Cu(OH)2 + CaSO4.
При этом гидроксид меди (II) выпадает в осадок.
- 5. в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
При этом гидроксид меди (II) выпадает в осадок.
Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
Гидроксид меди (II) – слабое основание. Проявляет амфотерные свойства.
Химические свойства гидроксида меди (II) аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида меди (II) с ортофосфорной кислотой:
Cu(OH)2 + H3PO4 → Cu3(PO4)2 + 6H2O.
В результате реакции образуются фосфат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида меди (II) с азотной кислотой:
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O.
В результате реакции образуются нитрат меди (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида меди (II) и с другими кислотами.
3. реакция гидроксида меди (II) и сероводорода:
Cu(OH)2 + H2S → CuS + 2H2O.
В результате реакции образуются сульфид меди (II) и вода. В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
4. реакция гидроксида меди (II) и оксида углерода:
2Cu(OH)2 + CO2 → Cu2(OH)2CO3 + H2O.
В результате реакции образуются карбонат-дигидроксид димеди (II) и вода.
5. реакция гидроксида меди (II) и оксида селена:
SeO2 + Cu(OH)2 → CuSeO3 + 2H2O (to).
В результате реакции образуются селенит меди (II) и вода. Реакция протекает при нагревании.
6. реакция гидроксида меди (II) и гидроксида натрия:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4].
В результате реакции образуется тетрагидроксокупрат натрия.
7. реакция гидроксида меди (II), аммиака и воды:
Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4(H2O)2](OH)2.
В результате реакции образуется гидроксид диакватетрааммин меди (I).
8. реакция гидроксида меди (II) и гидрата аммиака:
Cu(OH)2 + 4(NH3•H2O) → [Cu(NH3)4](OH)2 + 4H2O.
В результате реакции образуются гидроксид тетрааммин меди (II) и вода. Гидрат аммиака используется в ходе реакции в виде концентрированного раствора.
Гидроксид тетрааммин меди (II) имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
9. реакция гидроксида меди (II) с кислородом:
4Cu(OH)2 + O2 ⇄ 4Cu2O3 + 2H2O.
При длительном нахождении на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III). В результате реакции образуется оксид меди (III) и вода.
4Cu(OH)2 + O2 → 4CuО(ОН) + H2O.
При избытке влаги может образоваться гидроксид куприла (III) и вода.
10. реакция термического разложения гидроксида меди (II):
Cu(OH)2 → CuO + H2O (t = 70-90 oC).
В результате реакции образуются оксид меди (II) и вода.
Применение и использование гидроксида меди (II):
Гидроксид меди (II) используется:
– как пигмент при производстве стекол, керамики, красок,
– как катализатор в химической промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
гидроксид меди (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида меди (II) реакции
Коэффициент востребованности 766
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Получение и химические реакции меди
Нахождение в природе.
Медь встречается главным образом в виде сульфидных соединений. Наиболее важные минералы — медный блеск Cu2S, медный колчедан (халькопирит) CuFeS2 и борнит Cu3FeS2 входят в состав так называемых полиметаллических сульфидных руд. Реже встречаются кислородсодержащие соединения: малахит (основной карбонат меди) СuСО3 • Сu(ОН)2, азурит 2СuСО3 • Сu(ОН)2 и куприт СuO2.
Физические свойства.
Медь — металл красного цвета, плавится при температуре 1083°С, кипит при 2877°С. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию. Примеси увеличивают твердость меди. Медь отличается очень высокой электро- и теплопроводностью. Примеси мышьяка и сурьмы значительно уменьшают электропроводность меди. Медь образует различные сплавы (латуни, бронзы и др.).
Химические свойства.
Медь относится к числу малоактивных металлов. На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
2Cu + O2 = 2СuО
Сухой хлор на холоду не взаимодействует с медью, однако в присутствии влаги реакция проходит довольно энергично:
Сu + Сl2 = СuС12.
При нагревании медь довольно энергично взаимодействует с серой:
Си + S = CuS.
Медь может растворятся только в кислотах-окислителях. В концентрированной серной кислоте она растворяется только при нагреваний, a в азотной — и на холоду:
Сu+ 2H2SO4 = CuSO4 + SO2 + 2Н2O,
ЗСu + 8HNO3(Разбавл.) = 3Cu(NO3)2 + 2NO + 4Н2O,
Сu + 4HNO3(Конц .) = Cu(NO3)2+ 2NO + 2Н2O.
Получение.
Процесс получения меди состоит из нескольких стадий. Сначала сульфидную руду обжигают. При этом часть меди превращается в оксид:
4CuFeS2 + 13O2 = 4CuO + 2Fe203 + 8SO2.
Затем проводят плавку на штейн и получают сульфид меди (I). При этом к огарку прибавляют кокс и песок для образования шлака:
2CuO + FeS + С + SiO2 = Cu2S + FeSi03 + СО
или
CuO + FeO + CuS + С + SiO2 = Cu2S + FeSiO3+ CO.
Далее штейн подвергают конвертерной плавке:
9Cu2 S + 3O2 = 2Cu2 O + 2SO2 ,
2CuO2 + Cu2 S = 6Cu + SO2 .
Получаемая медь называется черновой. Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Оксид меди
Обладает основными свойствами. Он может взаимодействовать с кислотами и кислотными оксидами:
CuO + H2SО4 = CuSО4 + Н2О,
CuO + SО3 = CuSО4.
Оксид меди не растворим в воде. При нагревании оксида меди и присутствии восстановителя довольно легко происходит его восстановление:
CuO + Н2 = Сu + Н2O,
СuО + СО = Сu + СO2.
Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди:
2Сu + O2 = 2СuО,
Cu(OH)2 = CuO + Н2O.
Оксид меди встречается в природе в продуктах выветривания некоторых медных руд. Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Гидроксид меди
Гидроксид меди Сu(ОН)2. Выпадает в виде осадка при действии на растворы солей меди (II) растворов щелочей (но не аммиака):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
При действии аммиака на соли меди (II) сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4Н2O
или
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2.
Аммиакат меди окрашен в интенсивный сине-фиолетовый цвет, Поэтому он позволяет обнаружить малые количества ионов меди (П) в растворе. Эта реакция применяется в аналитической химии.
Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди, во втором — гидроксокупраты:
Сu(ОH)2 + 2NaOH = Na2[Cu(OH)4].
Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании С различными не очень сильными восстановителями: альдегидами, сахарами, гидразином, гидроксиламином и др.:
2Cu(OH)2 + R—СНО → Cu2O + R—COOH + 2H2O.
Гемиоксид, или оксид меди (I)
Гемиоксид, или оксид меди (I), Си20. Обладает только основными свойствами. Часть солей меди (I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха. Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения (Cu(NH3)+2 и др.). Гемиоксид меди применяется для изготовления купроксных выпрямителей переменного тока.
При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди (II) и медь:
Cu2O + H2SO4 = CuSO4 + Сu + Н2O,
а при растворении в галогеноводородных кислотах — соли меди (I):
Cu20 + 2НС1 = 2СuС1 + Н2O.
Многие соли меди (II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты. Нерастворимыми солями меди (II) являются сульфид CuS, карбонат (основной карбонат) СuСO3• Сu(ОН)2 • 0,5Н2О, оксалат СuС2O4и фосфат Сu3(РO4)2.
Под действием восстановителей соли меди (II) в кислом растворе могут восстанавливаться до солей меди (I):
2CuSO4 + 4KI = 2K2SO4 + Cu2I2 + I2
Аммиачные растворы солей меди (I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди;
СН≡СН + 2CuCl = Cu2C2 + 2НС1.
www.metmk.com.ua