Реакция соединения. Примеры реакции соединения
Многие процессы, без которых невозможно представить нашу жизнь (такие как дыхание, пищеварение, фотосинтез и подобные им), связаны с различными химическими реакциями органических соединений (и неорганических). Давайте рассмотрим основные их виды и более детально остановимся на процессе под названием соединение (присоединение).
Что называется химической реакцией
Прежде всего стоит дать общее определение этому явлению. Под рассматриваемым словосочетанием подразумеваются различные реакции веществ разной сложности, в результате которых образуются отличные от исходных продукты. Участвующие в этом процессе вещества именуются «реагенты».
На письме химическая реакция органических соединений (и неорганических) записывается при помощи специализированных уравнений. Внешне они немного напоминают математические примеры по сложению. Однако вместо знака равно («=») используются стрелки («→» или «⇆»). Помимо этого в правой части уравнения иногда может быть больше веществ, нежели в левой. Все, что находится до стрелки, — это вещества до начала реакции (левая часть формулы). Все, что после нее (правая часть), — соединения, образовавшиеся в результате произошедшего химического процесса.
В качестве примера химического уравнения можно рассмотреть реакцию разложения воды на водород и кислород под действием электрического тока: 2Н2О → 2Н2↑ + О2↑. Вода — это исходный реагент, а кислород с водородом — продукты.
В качестве еще одного, но уже более сложного примера химической реакции соединений можно рассмотреть явление, знакомое каждой хозяйке, хоть раз выпекавшей сладости. Речь идет о гашении пищевой соды с помощью столового уксуса. Происходящее действие иллюстрируется при помощи такого уравнения: NaHCO3 +2 СН3СООН → 2CH3COONa + СО2↑ + Н2О. Из него ясно, что в процессе взаимодействия гидрокарбоната натрия и уксуса образуется натриевая соль уксусной кислоты, вода и углекислый газ.
По свой природе химические процессы занимает промежуточное место между физическими и ядерными.
В отличие от первых, участвующие в химических реакциях соединения способны менять свой состав. То есть из атомов одного вещества можно образовать несколько других, как в вышеупомянутом уравнении разложения воды.
В отличие от ядерных реакций химические не затрагивает ядра атомов взаимодействующих веществ.
Какие бывают виды химических процессов
Распределение реакций соединений по видам происходит по разным критериям:

- Обратимость/необратимость.
- Наличие/отсутствие катализирующих веществ и процессов.
- По поглощению/выделению тепла (эндотермическая/экзотермическая реакции).
- По количеству фаз: гомогенные/гетерогенные и две гибридные их разновидности.
- По изменению степеней окисления взаимодействующих веществ.
Виды химических процессов в неорганической химии по способу взаимодействия
Этот критерий является особым. С его помощью выделяют четыре разновидности реакций: соединение, замещение, разложение (расщепление) и обмен.
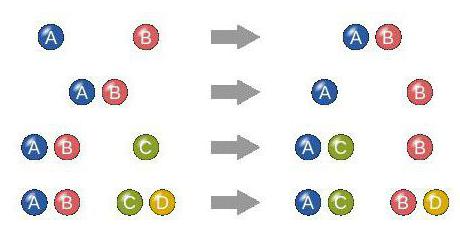
Название каждой из них соответствует процессу, который она описывает. То есть в соединении вещества объединяются, в замещении — меняются на другие группы, в разложении из одного реагента образуется несколько, а в обмене участники реакции меняются между собой атомами.
Виды процессов по способу взаимодействия в органической химии
Несмотря на большую сложность, реакции органических соединений происходят по тому же принципу, что и неорганические. Однако они имеют несколько отличные названия.
Так, реакции соединения и разложения именуются «присоединение», а также «отщепление» (элимирование) и непосредственно органическое разложение (в этом разделе химии присутствуют два типа процессов расщепления).
Другие реакции органических соединений — это замещение (название не меняется), перегруппировка (обмен) и окислительно-восстановительные процессы. Несмотря на схожесть механизмов их протекания, в органике они более многогранны.
Химическая реакция соединения
Рассмотрев различные виды процессов, в которые вступают вещества в органической и неорганической химии, стоит остановиться более подробно именно на соединении.
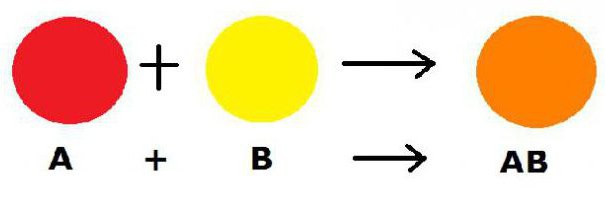
Данная реакция отличается от всех остальных тем, что, независимо от количества реагентов в ее начале, в финале они все соединяются в одно.
В качестве примера можно вспомнить процесс гашения извести: СаО + Н2О → Са(ОН)2. В данном случае происходит реакция соединения оксида кальция (негашеной извести) с оксидом гидрогена (водой). В результате образуется гидроксид кальция (гашеная известь) и выделяется теплый пар. Кстати, это означает, что данный процесс действительно экзотермический.
Уравнение реакции соединения
Схематически рассматриваемый процесс можно изобразить следующим образом: А+БВ → АБВ. В данной формуле АБВ – это новообразованное сложное вещество, А – простой реагент, а БВ – вариант сложного соединения.
Стоит отметить, что эта формула характерна и для процесса присоединения и соединения.
Примеры реакции рассматриваемой — это взаимодействие оксида натрия и углекислого газа (NaO2 + СО2↑ (t 450-550 °С) → Na2CO3), а также оксида серы с кислородом (2SO2 + O2↑ → 2SO3).
Также между собой способны реагировать несколько сложных соединений: АБ + ВГ → АБВГ. Например, все тот же оксид натрия и оксид гидрогена: NaO2+Н2О → 2NaOH.
Условия протекания реакции в неорганических соединениях
Как было показано в предыдущем уравнении, в рассматриваемое взаимодействие способны вступать вещества разной степени сложности.

При этом для простых реагентов неорганического происхождения возможны окислительно-восстановительные реакции соединения (А + В → АБ).
В качестве примера можно рассмотреть процесс получения трехвалентного хлорида железа. Для этого проводится реакция соединения между хлором и ферумом (железом): 3Cl2↑ + 2Fe → 2FeCl3.
В случае если речь идет о взаимодействии сложных неорганических веществ (АБ + ВГ → АБВГ), процессы в них способны происходить, как влияя, так и не влияя на их валентность.
Как иллюстрацию к этому стоит рассмотреть пример образования гидрокарбоната кальция из углекислого газа, оксида гидрогена (воды) и белого пищевого красителя Е170 (карбоната кальция): СО2↑ + Н2О +СаСО3→ Са(СО3)2.В данном случае имеет место классическая реакция соединения. При ее осуществлении валентность реагентов не меняется.
Чуть более совершенное (нежели первое) химическое уравнение 2FeCl2 + Cl2↑ → 2FeCl3 является примером окислительно-восстановительного процесса при взаимодействии простого и сложного неорганических реагентов: газа (хлора) и соли (хлорида железа).
Виды реакций присоединения в органической химии
Как уже было указано в четвертом пункте, в веществах органического происхождения рассматриваемая реакция именуется «присоединением». Как правило, в ней принимают участие сложные вещества с двойной (или тройной) связью.
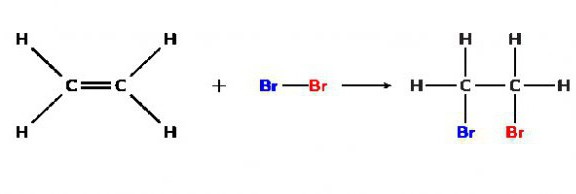
Например, реакция между дибромом и этиленом, ведущая к образованию 1,2-дибромэтана: (С2Н4) СН2= СН2 + Br2 → (C₂H₄Br₂) BrCH2 — CH2Br.Кстати, знаки похожие на равно и минус («=» и «-«), в данном уравнении показывают связи между атомами сложного вещества. Это особенность записи формул органических веществ.
В зависимости от того, какие из соединений выступают в роли реагентов, выделяются несколько разновидностей рассматриваемого процесса присоединения:
- Гидрирование (добавляются молекулы гидрогена Н по кратной связи).
- Гидрогалогенирование (присоединяется галогеноводород).
- Галогенирование (добавление галогенов Br2,Cl2↑ и подобных).
- Полимеризация (образование из нескольких низкомолекулярных соединений веществ с высокой молекулярной массой).
Примеры реакции присоединения (соединения)
После перечисления разновидностей рассматриваемого процесса стоит узнать на практике некоторые примеры реакции соединения.
В качестве иллюстрации гидрирования можно обратить внимание на уравнение взаимодействия пропена с водородом, в результате которого возникнет пропан: (С3Н6↑) СН3—СН=СН2↑+Н2↑→ (С3Н8↑) СН3—СН2—СН3↑.
В органической химии реакция соединения (присоединения) может происходить между соляной кислотой (неорганическое вещество) и этиленом с формированием хлорэтана: (С2Н4↑) СН2= СН2↑ + HCl → CH3— CH2—Cl (C2H5Cl).Представленное уравнение является примером гидрогалогенирования.
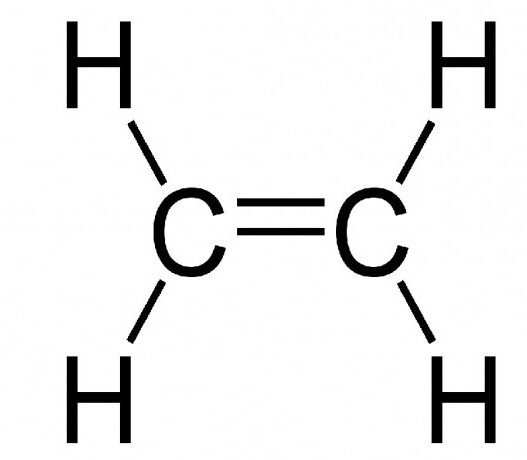
Что касается галогенирования, то его можно иллюстрировать реакцией между дихлором и этиленом, ведущей к образованию 1,2-дихлорэтана: (С2Н4↑) СН2= СН2 + Cl2↑ → (C₂H₄Cl₂) ClCH2-CH2Cl.
Множество полезных веществ образовывается благодаря органической химии. Реакция соединения (присоединения) молекул этилена с радикальным инициатором полимеризации под воздействием ультрафиолета – тому подтверждение: n СН2= СН2 (R и УФ-свет) → (-СН2-СН2-)n. Образованное таким способом вещество хорошо известно каждому человеку под именем полиэтилена.

Из этого материала изготавливаются различные виды упаковок, пакеты, посуда, трубы, утепляющие вещества и многое другое. Особенностью данного вещества является и возможность его вторичной переработки. Своей популярностью полиэтилен обязан тому, что не разлагается, из-за чего экологи негативно относятся к нему. Однако в последние годы был найден способ безопасной утилизации изделий из полиэтилена. Для этого материал обрабатывается азотной кислотой (HNO3). После чего отдельные виды бактерий способны разлагать это вещество на безопасные составляющие.
Реакция соединения (присоединения) играет важную роль в природе и жизни человека. Помимо этого, она часто используется учеными в лабораториях, чтобы синтезировать новые вещества для различных важных исследований.
fb.ru
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т.е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са(НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
to | ||
CuSO4 5H2O | = | CuSO4 + 5H2O |
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
to | ||
4HNO3 | = | 2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2, (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особенно характерны окислительно-восстановительные реакции разложения для солей азотной кислоты.
Реакции разложения в органической химии носят название крекинга:
С18H38 = С9H18 + С9H20,
или дегидрирования
C4H10 = C4H6 + 2H2.
3. Реакции замещения
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3,
Zn + 2НСl = ZnСl2 + Н2,
2КВr + Сl2 = 2КСl + Вr2,
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2,
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5,
Иногда эти реакции рассматривают как реакции обмена:
СН4 + Сl2
= СН3Сl + НСl.4. Реакции обмена
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами — оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О,
AgNО3 + КВr = АgВr + КNО3,
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена — реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑,
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О,
СН3СООNа + Н3РО4 = СН3СООН + NаН2РО4.
studfile.net
Реакции соединения
В реакциях соединения, в отличие от реакций разложения, происходит образование одного сложного вещества из одного или нескольких исходных.
Рассмотрим эти реакции с помощью цепочек переходов. Запишем схему перехода: S → SO2 → H2SO3. Сера превращается в оксид серы (IV), который затем превращается в сернистую кислоту. Число стрелок в цепочке превращений показывает число химических реакций.

Первый
процесс – это превращение серы в оксид серы (IV).
Для этого запишем реакцию соединения серы с кислородом: S
+ O2
→ SO2.
Если в ложечке сжечь серу, то она горит синим пламенем с образованием
сернистого газа, об этом можно судить по появлению запаха жженой серы. Если в
колбу с образовавшимся сернистым газом добавить воды, то дым исчезает. К этому
раствору можно добавить лакмуса, и он окрасится в красный цвет, что является
доказательством образования сернистой кислоты: SO2
+ H2O
→ H2SO
Все рассмотренные реакции протекали без участия катализатора, поэтому их называют некаталитическими. Кроме того, все эти реакции протекают в одном направлении, т.е. они являются необратимыми.
В первой реакции из двух простых веществ образовалось одно сложное, во второй реакции – из двух сложных веществ – одно сложное. Одно сложное вещество может образоваться и при взаимодействии одного сложного и одного простого, как в реакции образования оксида серы (VI) и оксида серы (IV): 2SO2 + O2 ↔ 2SO3. Эта реакция является обратимой, т.е. протекает как в прямом направлении с образованием продукта реакции и в обратном направлении, когда из конечного продукта образуются исходные вещества. Условно обратимые реакции обозначают с помощью знака обратимости.
Поэтому реакции, протекающие одновременно в двух противоположных направлениях, называют обратимыми.
В реакции образования оксида серы (VI) участвует катализатор V2O5, который указывают над знаком обратимости, поэтому эта реакция является каталитической.

Поэтому, если реакции протекают с участием катализатора, то они называются каталитическими, если реакции протекают без участия катализатора, то такие реакции называются некаталитическими, если реакции протекают с участием биологических катализаторов – ферментов, то такие реакции называются ферментативными.
В реакциях соединения сложное вещество может образоваться не только из двух веществ, но и из трех, как
NO2 + O2 + H2O → HNO3.
Расставим коэффициенты в этом уравнении. Атомов азота одинаковое число в левой и правой части уравнения, поэтому азот не нужно уравнивать. Атомов водорода до реакции 2, а после реакции один атом, поэтому перед формулой азотной кислоты ставим коэффициент 2. Теперь необходимо и перед формулой оксида азота (IV) поставить коэффициент 2. Считаем число атомов кислорода: до реакции 5 атомов, после реакции – 6 атомов. Следовательно, нужно удвоить все коэффициенты. Перед оксидом азота (IV) ставим коэффициент 4, перед формулой воды – 2, перед формулой азотной кислоты – 4. Теперь осталось поставить коэффициент перед формулой кислорода. Для этого подсчитаем число атомов кислорода в правой части уравнения, их 12. В левой тоже, следовательно, вместо стрелки можно поставить знак равенства.
4NO2 + O2 + 2H2O → 4HNO3.

videouroki.net
Химические реакции, типы реакций, виды реакций, окислительно-восстановительные реакции
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO4→ FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О. Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения A + B = AB Пример: Из нескольких простых или сложных веществ образуется одно сложное |
химические реакции разложения AB = A + B Пример: Из сложного вещества образуется несколько простых или сложных веществ |
химические реакции замещения A + BC =AC + B Пример: Атом простого вещества замещает один из атомов сложного |
химические реакции ионного обмена AB+CD = AD+CB Пример: Сложные вещества обмениваются своими составными частями |
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Признаки химических реакций. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
— Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа — химическая реакция взаимодействия железа с кислородом).
— Выпадение осадка (например, если через известковый раствор (раствор гидроксида кальция) пропустить углекислый газ, выпадет белый нерастворимый осадок карбоната кальция).
— Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).
— Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
— Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — составляют особый класс химических реакций. Их характерной особенностью является изменение степени окисления, по крайней мере, пары атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Сложные вещества, понижающие свою степень окисления — окислители, а повышающие степень окисления — восстановители. Например:
2Na + Cl2→ 2NaCl,
— здесь окислитель — хлор (он присоединяет к себе электроны), а восстановитель — натрий (он отдаёт электроны).
Реакция замещения NaBr-1+ Cl20→ 2NaCl-1 + Br20 (характерна для галогенов) тоже относится к окислительно -восстановительным реакциям. Здесь хлор — окислитель (принимает 1 электрон), а бромид натрия (NaBr) — восстановитель (атом брома отдаёт электрон).
Реакция разложения дихромата аммония ((NH4)2Cr2O7) тоже относится к окислительно-восстановительным реакциям:
(N-3H4)2Cr2+6O7→ N20 + Cr2+3O3 + 4H2O
Ещё одна из распространённых классификаций химических реакций — это их разделение по тепловому эффекту. Разделяют эндотермические реакции и экзотермические реакции. Эндотермические реакции — химические реакции, сопровождающиеся поглощением окружающего тепла (вспомните охлаждающие смеси). Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Опасные химические реакции :»БОМБА В РАКОВИНЕ»- забавно или не очень?!
Существуют некоторые химические реакции, которые протекают спонтанно при смешивании реагентов. При этом образуются достаточно опасные смеси, которые могут взрываться, воспламеняться или отравлять. Вот одна и них!
В некоторых американских и английских клиниках наблюдались странные явления. Время от времени из раковин раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто не пострадал. Расследование показало, что виновником всего этого был очень слабый (0,01%) раствор азида натрия NaN3, который использовали в качестве консерванта физиологических растворов.
 Азид свинца
Азид свинцаИзлишки раствора азида в течение многих месяцев, а то и лет сливали в раковины — иногда до 2 л в день.
Сам по себе азид натрия — соль азидоводородной кислоты HN3 — не взрывается. Однако азиды тяжёлых металлов (меди, серебра, ртути, свинца и др.) — весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N3)2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов Pb(N3)2. Это соединение более взрывчато, чем нитроглицерин, а скорость детонации (распространения взрывной волны) при взрыве достигает 45 км/с — в 10 раз больше, чем у тротила.
Но откуда в клиниках могли взяться азиды тяжёлых металлов? Оказалось, во всех случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки легко гнутся, особенно после нагревания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. В химической литературе также не удалось найти описания этого процесса. Но можно предположить, исходя из сильных окислительных свойств HN3, что имела место такая реакция: анион N-3, окисляя медь, образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Это соответствует уравнению реакции: 3NaN3+Cu+3Н2О→ Cu(N3)2+3NaOH+N2+NH3.
С опасностью образования бомбы в раковине приходится считаться всем, кто имеет дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органическом синтезе, в качестве порообразователя (вспенивающего агента для производства газонаполненных материалов: пенопластов, пористой резины и т. п.). Во всех подобных случаях надо проследить, чтобы сливные трубки были пластмассовыми.
Сравнительно недавно азиды нашли новое применение в автомобилестроении. В 1989 г. в некоторых моделях американских автомобилей появились надувные подушки безопасности. Такая подушка, содержащая азид натрия, в сложенном виде почти незаметна. При лобовом столкновении электрический запал приводит к очень быстрому разложению азида: 2NaN3=2Na+3N2. 100 г порошка выделяют около 60 л азота, который примерно за 0,04 с надувает подушку перед грудью водителя, спасая тем самым ему жизнь.
www.kristallikov.net
Самые невероятные химические реакции (гифки) :: Инфониак
 Невероятные факты
Невероятные факты Молекулярный материал в нашей повседневной жизни настолько предсказуем, что мы часто забываем, какие удивительные вещи могут твориться с основными элементами.
Даже внутри нашего тела происходит множество удивительных химических реакций.
Вот несколько увлекательных и впечатляющих химических и физических реакций в форме гифок, которые напомнят вам курс химии.
Химические реакции
1. «Фараонова змея» — распад тиоцианата ртути

Горение тиоцианата ртути приводит к его разложению на три других химических вещества. Эти три химических вещества в свою очередь разлагаются на еще три вещества, что приводит к развертыванию огромной «змеи».
2. Горящая спичка
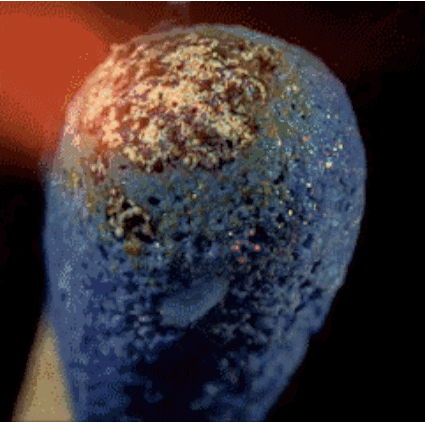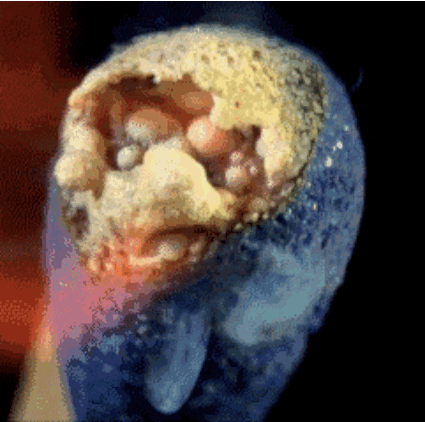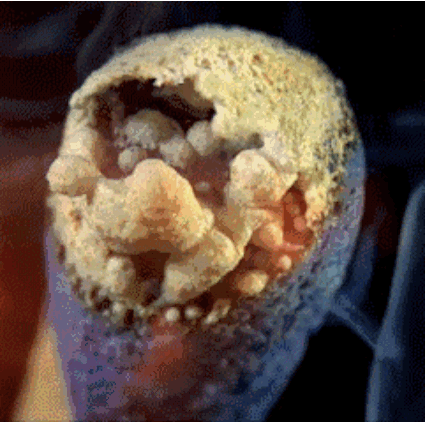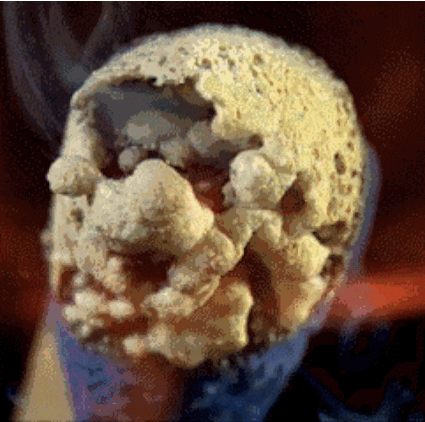
Спичечная головка содержит красный фосфор, серу и бертолетову соль. Тепло, генерируемое фосфором, разлагает бертолетову соль и в процессе высвобождает кислород. Кислород в сочетании с серой производит кратковременное пламя, которое мы используем, чтобы зажечь, например, свечу.
3. Огонь + водород

Газообразный водород легче воздуха и его можно разжечь пламенем или искрой, что приведет к впечатляющему взрыву. Вот почему сейчас чаще используется гелий, а не водород для наполнения аэростатов.
4. Ртуть + алюминий

Ртуть проникает сквозь защитный слой окиси (ржавчину) алюминия, заставляя его ржаветь намного быстрее.
Примеры химических реакций
5. Змеиный яд + кровь

Одна капля яда гадюки, попавшая в чашку Петри с кровью, заставляет ее свернуться в толстый комок твердого вещества. Именно это происходит в нашем теле, когда нас кусает ядовитая змея.
6. Железо + раствор медного купороса
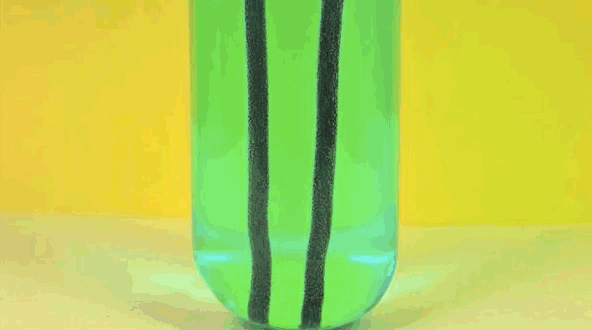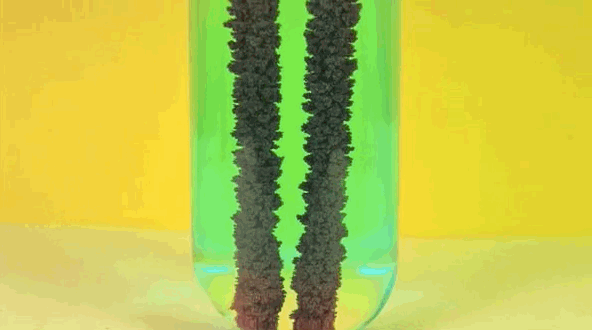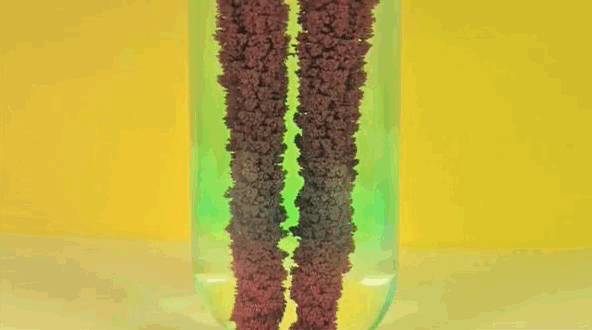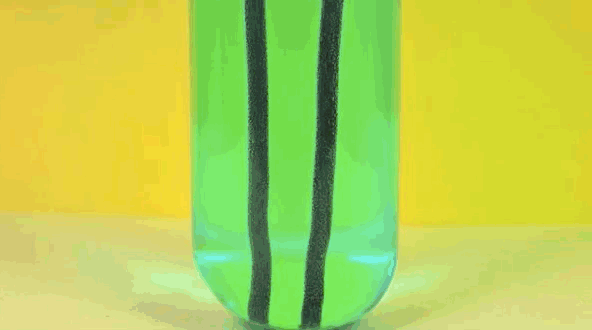
Железо заменяет медь в растворе, превращая медный купорос в железный купорос. Чистая медь собирается на железе.
7. Воспламенение емкости с газом

8. Хлорная таблетка + медицинский спирт в закрытой бутылке

Реакция приводит к увеличению давления и заканчивается разрывом контейнера.
9. Полимеризация п-нитроанилина

На гифке к половине чайной ложки п-нитроанилина или 4-нитроанилина добавляют несколько капель концентрированной серной кислоты.
10. Кровь в перекиси водорода

Фермент в крови, называемый каталаза, превращает перекись водорода в воду и газообразный кислород, создавая пену кислородных пузырей.
Химические опыты
11. Галлий в горячей воде

Галлий, который в основном используется в электронике, имеет температуру плавления составляющую 29,4 градуса по Цельсию, а значит будет плавиться в руках.
12. Медленный переход бета-олова в альфа-модификацию

При холодной температуре бета-аллотроп олова (серебристый, металлический) самопроизвольно переходит в альфа-аллотроп (серый, порошкообразный).
13. Полиакрилат натрия + вода

Полиакрилат натрия – тот же материла, который используется в детских подгузниках, действует как губка, впитывая влагу. При смешивании с водой, соединение превращается в твердый гель, а вода уже не является жидкостью и не может выливаться.
14. Газ Радон 220 впрыснут в туманную камеру

Следы в форме буквы V появляются благодаря двум альфа частицам (ядер гелия-4), которые выделяются, когда радон распадается на полоний, а затем свинец.
Домашние химические опыты
15. Шарики из гидрогеля и разноцветная вода

В данном случае действует диффузия. Гидрогель представляет собой гранулы полимера, которые очень хорошо впитывают воду.
16. Ацетон + пенопласт

Пенопласт состоит из пенополистирола, который, будучи растворенным в ацетоне, выпускает воздух в пену, что создает вид, будто вы растворяете большое количество материала в малом количестве жидкости.
17. Сухой лед + средство для мытья посуды

Сухой лед, помещенный в воду, создает облако, а средство для мытья посуды в воде удерживает углекислый газ и водяной пар в форме пузыря.
18. Капля моющего средства, добавленная к молоку с пищевым красителем

Молоко — это в основном вода, но оно также содержит витамины, минералы, белки и крошечные капли жира, находящиеся во взвешенном состоянии в растворе.
Средство для мытья посуды ослабляет химические связи, которые удерживают белки и жиры в растворе. Молекулы жира сбиваются с толку по мере того, как молекулы мыла начинают метаться, чтобы соединиться с молекулами жира, пока раствор равномерно не перемешается.
19. «Слоновья зубная паста»

Дрожжи и теплую воду наливают в контейнер с моющим средством, перекисью водорода и пищевым красителем. Дрожжи служат катализатором выделения кислорода из перекиси водорода, создавая множество пузырей. В результате образуется экзотермическая реакция, с образованием пены и выделением тепла.
Химические опыты (видео)
20. Перегорание лампочки

Вольфрамовая нить ломается, вызывая короткое замыкание электрической цепи, которое заставляет нить светиться.
21. Ферромагнитная жидкость в стеклянной банке

Ферромагнитная жидкость – это жидкость, которая сильно намагничивается в присутствии магнитного поля. Она используется в жестких дисках и в машиностроении.

Еще ферромагнитной жидкости.
22. Йод + алюминий

Окисление тонкодисперсного алюминия происходит в воде, формируя темно-фиолетовые пары.
23. Рубидий + вода

Рубидий очень быстро реагирует с водой, формируя гидроокись рубидия и газообразный водород. Реакция настолько быстрая, что если бы ее проводить в стеклянном сосуде, он может разбиться.
www.infoniac.ru