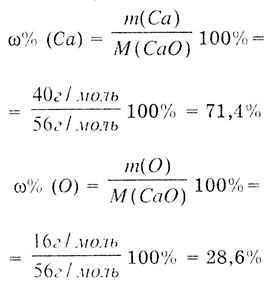Закон сохранения массы.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Например, реакция горения метана записывается следующим образом:

Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
В начале 20 века формулировка закона сохранения массы подверглась пересмотру в связи с появлением теории относительности (А.Эйнштейн, 1905 г.), согласно которой масса тела зависит от его скорости и, следовательно, характеризует не только количество материи, но и ее движение. Полученная телом энергия E связана с увеличением его массы mсоотношением E = m • c2 , где с — скорость света. Это соотношение не используется в химических реакциях, т.к. 1 кДж энергии соответствует изменению массы на ~10 -11 г и mпрактически не может быть измерено. В ядерных реакциях, где Е в ~106 раз больше, чем в химических реакциях, m следует учитывать.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Материал из Википедии — свободной энциклопедии
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Закон
постоянства состава не выполняется
для бертоллидов (соединений
переменного состава). Однако условно
для простоты состав многих бертоллидов
записывают как постоянный. Например,
состав
ЗАКОН ПОСТОЯНСТВА СОСТАВА |
Согласно закону постоянства состава, всякое чистое вещество имеет постоянный состав независимо от способа его получения. Так, оксид кальция можно получить следующими способами: Независимо от того, каким способом получено вещество СаО, оно имеет постоянный состав: один атом кальция и один атом кислорода образуют молекулу оксида кальция СаО. Определяем молярную массу СаО:
Определяем массовую долю Са по формуле:
Вывод: В химически чистом оксиде массовая доля кальция всегда составляет 71,4% и кислорода 28,6%. |
Закон кратных отношений
Закон кратных отношений — один из стехиометрических законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Примеры
studfile.net
Закон сохранения массы и энергии
Фундаментальный закон естествознания — закон неуничтожимости материи и движения: невозможно исчезновение каких-либо форм материи без возникновения других ее форм, так же как исчезновение одних форм движения без возникновения других. Одним из его следствий является
Закон сохранения массы веществ впервые был сформулирован в 1748 г М.В.Ломоносовым.: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. Независимо от Ломоносова этот закон позднее был сформулирован А.Лавуазье. Он установил также, что в химических реакциях остается неизменной не только масса веществ, но и масса элементов, т.е. превращения элементов друг в друга не происходит.
Поскольку в химических реакциях не происходит превращений элементов, общее число атомов остается постоянным. А так как атомы имеют постоянную массу, то не меняется и масса веществ до и после реакции.
Однако точно этот закон выполняется только в изолированной системе (такой, которая не обменивается с окружающей средой ни веществом, ни энергией). Если в результате обмена с окружающей средой система теряет или поглощает энергию, масса продуктов реакции не равна массе исходных веществ. Например, масса атома изотопа углерода 12С равна точно 12 а.е.м. (изотопы — разновидности атомов одного элемента, отличающиеся атомной массой). Образование этого изотопа можно представить процессом соединения 6 протонов, 6 нейтронов и 6 электронов: и вычислить его массу по известным значениям масс этих элементарных частиц:
m (12C) = 6 m (p) + 6 m (n) + 6 m (e)
m (12C) = 6 . 1,0078 + 6. 1,0087 + 6. 0,00055 = 12,099 а.е.м.
12,099 — 12 = 0,099 а.е.м.
Разница в 0,099 а.е.м., так называемый «дефект массы», возникает из-за того, что в реакции выделяется ~ 1010 кДж/моль энергии. В реальных химических расчетах «дефект массы» не учитывают и используют закон сохранения массы для составления уравнений химических реакций (число атомов каждого вида должно быть одинаковым в левой и правой частях уравнения) и расчета материальных балансов.
Закон сохранения энергии был сформулирован Ломоносовым и век спустя экспериментально подтвержден Майером. Его современная формулировка: энергия изолированной системы постоянна, возможны лишь переходы из одного вида энергии в другой. Закон дает основу для составления тепловых балансов химических систем.
Атомно-молекулярное учение
Представления о составе и строении веществ формировались на протяжении многих столетий, начиная с древнегреческих философских учений Левкиппа, Демокрита, Эпикура. Однако создание учения об атомно-молекулярном строении вещества стало возможным к середине ХIХ в. на основании экспериментально установленных стехиометрических законов. Основные его положения, принятые на первом Международном съезде химиков в 1860 г. в Германии, сводились к следующим:
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Атомы и молекулы находятся в непрерывном движении.
4. Атомы — мельчайшие, неделимые составные части молекул.
В последующий век представления о строении вещества значительно изменились. В ХХ в. прямым экспериментом было доказано существование не только атомов и молекул, но также ионов и элементарных частиц.
Современные представления о строении вещества могут быть кратко сформулированы следующим образом:
1. Вещества состоят из атомов, молекул или ионов.
Атом — наименьшая частица химического элемента, сохраняющая его химические свойства. Атом электронейтрален, состоит из положительно заряженного ядра и электронов
Химический элемент — определенный вид атомов с одинаковым зарядом ядра.
Химические элементы обозначаются начальными буквами их латинских названий (эти символы введены в начале ХIХ в. Я.Берцелиусом), например: водород (Hydrogenium) — H, сера (Sulfur) — S, медь (Cuprum) — Cu. Они приведены в таблице химических элементов Д.И.Менделеева. В названиях соединений элементов используются их латинские корни, например: LiH — гидрид лития, Na2SO4 — сульфат натрия, FeS —сульфид железа.
Молекула — электронейтральная наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов, соединенных химическими связями в определенную структуру. Число атомов в молекуле может быть от двух (например, в молекуле водорода Н2) до миллионов ( в молекулах полимеров).
Физические свойства вещества (температуры кипения и плавления, плотность, тепло- и электропроводность и др.) для отдельной молекулы не имеют смысла.
Ион— заряженная частица, образующаяся при отдаче или приобретении электронов атомами или молекулами.
2. Все молекулы, атомы и ионы, входящие в состав вещества, находятся в непрерывном движении, обусловленном запасом тепловой энергии вещества. Элементарные частицы в атоме также находятся в движении. При химических превращениях молекулы разрушаются, но атомы сохраняются и перегруппировываются.
3. Вещества подразделяют на смеси и чистые вещества (условно чистые, так как абсолютно чистых веществ в природе не существует).
Смеси бывают гомогенные, или однородные (например, вода и сахар, вода и спирт) и гетерогенные, или неоднородные (например, сахар и соль).
Чистые вещества подразделяют на простые вещества (состоят из атомов одного элемента, например, углерод С, азот N2 , цинк Zn) и сложные вещества, или химические соединения
Химическая формула вещества записывается символами элементов и показывает его качественный состав и количественное соотношение элементов в нем. (Формула воды — Н2О — показывает, что в веществе «вода» на каждый атом кислорода приходится два атома водорода.).
Химических элементов в настоящее время известно 111, а простых веществ намного больше — около 400. Это связано с тем, что некоторые элементы образуют несколько простых веществ. Их называют аллотропными видоизменениями (аллотропными модификациями), а само явление — аллотропией. Аллотропные видоизменения — это либо молекулы с разным числом атомов (например, кислород О2 и озон О3), либо кристаллы разного строения (например, алмаз и графит — разные простые вещества, образованные одним элементом углеродом).
В зависимости от физических условий (температуры и давления) вещества могут существовать в разных агрегатных состояниях: газообразном, жидком, твердом (кристаллическом или аморфном), плазменном.
Все вещества подразделяют на вещества молекулярного и немолекулярного строения.
Молекулярные вещества состоят из молекул, например, в обычных условиях газы: кислород О2, водород Н2, азот N2 ; жидкости: этиловый спирт С2Н5ОН, бензол С6Н6 ; твердые вещества: йод I2, белый фосфор P4.
Немолекулярные вещества состоят из атомов (например, газы: гелий Не, неон Nе, аргон Аr; твердый сульфид железа FeS — из атомов Fe S) или ионов (например, кристалл поваренной соли — из ионов Na+ и Cl— ). Для этих веществ записывают формулу условной молекулы (формульной единицы), которая показывает соотношение атомов в веществе (NaCl).
Химическое превращение, или химическая реакция — процесс, при котором из одних веществ образуются другие вещества (из реагентов образуются продукты реакции). При этом не происходит превращений атомов одних химических элементов в другие (это происходит в ядерных реакциях). Химические реакции изображают в виде химических уравнений. При этом согласно закону сохранения массы число атомов каждого элемента, вступающих в реакцию, должно быть равно их числу, образующемуся в результате реакции. В уравнениях реакций это уравнивание числа атомов выполняется расстановкой стехиометрических коэффициентов.
studfile.net
Закон сохранения массы — это… Что такое Закон сохранения массы?
Закон сохранения массы — закон физики, согласно которому масса физической системы сохраняется при всех природных и искусственных процессах.
В исторической, метафизической форме, согласно которой вещество несотворимо и неуничтожимо, закон известен с древнейших времён. Позднее появилась количественная формулировка, согласно которой мерой количества вещества является вес (позднее — масса).
С точки зрения классической механики и химии, сохраняются общая масса закрытой физической системы, равная сумме масс компонентов этой системы (то есть масса считается аддитивной. Этот закон с большой точностью верен в области применимости ньютоновской механики и химии, так как релятивистские поправки в этих случаях пренебрежимо малы.
В современной физике концепция и свойства массы существенно пересмотрены. Масса более не является мерой количества вещества, а закон сохранения массы тесно связан с законом сохранения внутренней энергии системы. В отличие от классической модели, сохраняется масса только изолированной физической системы, то есть при отсутствии энергообмена с внешней средой. Не сохраняется сумма масс компонентов системы (масса неаддитивна). Например, при радиоактивном распаде в изолированной системе состоявшей из вещества и радиации, совокупная масса вещества уменьшается, но масса системы сохраняется, несмотря на то что масса радиации может быть нулевая.
Исторический очерк
Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи. Одним из первых его сформулировал древнегреческий философ Эмпедокл (V век до н. э.)[1]:
Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться.
Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего.[2]
Позже аналогичный тезис высказывали Демокрит, Аристотель и Эпикур (в пересказе Лукреция Кара). Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. В 1630 году Жан Рэ (Jean Rey, 1583—1645), доктор из Перигора, писал Мерсенну [3]:
Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
С появлением понятия массы как меры количества вещества, пропорциональной весу, формулировка закона сохранения материи была уточнена: масса есть инвариант (сохраняется), то есть при всех процессах общая масса не уменьшается и не увеличивается (вес, как предполагал уже Ньютон, инвариантом не является, поскольку форма Земли далека от идеальной сферы).
В середине XVIII века опыты Роберта Бойля поставили закон сохранения массы под сомнение — у него при химической реакции вес вещества увеличился. Однако М. В. Ломоносов и другие физики вскоре указали Р. Бойлю на его ошибку: увеличение веса происходило за счёт воздуха, а в запаянном сосуде вес сохранялся неизменным. Ломоносов писал Л. Эйлеру:
Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, то это отнимается у чего-то другого. Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.
В дальнейшем, вплоть до создания физики микромира, закон сохранения массы считался истинным и очевидным. Иммануил Кант объявил этот закон постулатом естествознания[4] (1786). Лавуазье в «Начальном учебнике химии» (1789), приводит точную количественную формулировку закона сохранения массы вещества, однако не объявляет его каким-то новым и важным законом, а просто упоминает мимоходом как о хорошо известном и давно установленном факте. Для химических реакций Лавуазье сформулировал закон так[5]:
Ничто не творится ни в искусственных процессах, ни в природных, и можно выставить положение, что во всякой операции [химической реакции] имеется одинаковое количество материи до и после, что качество и количество начал остались теми же самыми, произошли лишь перемещения, перегруппировки. На этом положении основано всё искусство делать опыты в химии.
Другими словами, сохраняется масса закрытой физической системы, в которой происходит химическая реакция, а сумма масс всех веществ, вступивших в эту реакцию, равна сумме масс всех продуктов реакции (то есть тоже сохраняется). Масса считается аддитивной.
Современное состояние
В XX веке обнаружились два новых свойства массы.
(M1) Масса физического объекта зависит от его внутренней энергии (см. Эквивалентность массы и энергии). При поглощении внешней энергии масса растёт, при потере — уменьшается. Отсюда следует, что масса сохраняется только в изолированной системе, то есть при отсутствии обмена энергией с внешней средой. Особенно ощутимо изменение массы при ядерных реакциях. Но даже при химических реакциях, которые сопровождаются выделением (или поглощением) тепла, масса не сохраняется, хотя в этом случае дефект массы ничтожен. Академик Л. Б. Окунь пишет:[6]
Чтобы подчеркнуть, что масса тела меняется всегда, когда меняется его внутренняя энергия, рассмотрим два обыденных примера:
1) при нагревании железного утюга на 200° его масса возрастает на величину ;
2) при полном превращении некоторого количества льда в воду .
(M2) Масса не является аддитивной величиной: масса системы не равна сумме масс её составляющих. Примеры неаддитивности:
- Электрон и позитрон, каждый из которых обладает массой, могут аннигилировать в фотоны, не имеющие массы поодиночке, а обладающие ею только как система.
- Масса дейтрона, состоящего из одного протона и одного нейтрона, не равна сумме масс своих составляющих, поскольку следует учесть энергию взаимодействия частиц.
- При термоядерных реакциях, происходящих внутри Солнца, масса водорода не равна массе получившегося из него гелия.
- Особенно яркий пример: масса протона (≈938 МэВ) в несколько десятков раз больше массы составляющих его кварков (около 11 МэВ).
Таким образом, при физических процессах, которые сопровождаются распадом или синтезом физических структур, не сохраняется сумма масс составляющих (компонентов) системы, но сохраняется общая масса этой (изолированной) системы:
- Масса системы получившихся при аннигиляции фотонов равна массе системы, состоящей из аннигилирующих электрона и позитрона.
- Масса системы, состоящей из дейтрона (с учётом энергии связи), равна массе системы, состоящей из одного протона и одного нейтрона отдельно.
- Масса системы, состоящей из получившегося при термоядерных реакциях гелия, с учётом выделенной энергии, равна массе водорода.
Сказанное означает, что в современной физике закон сохранения массы тесно связан с законом сохранения энергии и выполняется с таким же ограничением — надо учитывать обмен системы энергией с внешней средой.
Более детально
Чтобы более детально пояснить, почему масса в современной физике оказывается неаддитивной[7] (масса системы не равна — вообще говоря — сумме масс компонент), следует вначале заметить, что под термином масса в современной физике понимается лоренц-инвариантная величина:
где — энергия, — импульс, — скорость света. И сразу заметим, что это выражение одинаково легко применимо к точечной бесструктурной («элементарной») частице, так и к любой физической системе, причём в последнем случае энергия и импульс системы вычисляются просто суммированием энергий и импульсов компонент системы (энергия и импульс — аддитивны).
- Можно попутно заметить также, что вектор импульса-энергии системы — это 4-вектор, то есть его компоненты преобразуются при переходе к другой системе отсчета в соответствии с преобразованиями Лоренца, поскольку так преобразуются его слагаемые — 4-векторы энергии-импульса составляющих систему частиц. А поскольку масса, определённая выше, есть длина этого вектора в Лоренцевой метрике, то она оказывается инвариантной (лоренц-инвариантной), то есть не зависит от системы отччета, в которой ее измеряют или рассчитывают.
Кроме того, заметим, что — универсальная константа, то есть просто число, которое не меняется никогда, поэтому в принципе можно выбрать такую систему единиц измерения, чтобы выполнялось , и тогда упомянутая формула будет менее загромождена:
как и остальные связанные с нею формулы (и мы ниже будем для краткости использовать именно такую систему единиц).
Рассмотрев уже самый парадоксальный на вид случай нарушения аддитивности массы — случай, когда система нескольких (для простоты ограничимся двумя) безмассовых частиц (например фотонов) может иметь ненулевую массу, легко увидеть механизм, порождающий неаддитивность массы.
Пусть есть два фотона 1 b 2 с противоположными импульсами: . Масса каждого фотона, как известно, равна нулю, следовательно можно записать:
то есть энергия каждого фотона равна модулю его импульса. Заметим попутно, что масса равна нулю за счет вычитания под знаком корня ненулевых величин друг из друга.
Рассмотрим теперь систему этих двух фотонов как целое, посчитав ее импульс и энергию. Как видим, импульс этой системы равен нулю (импульсы фотонов, сложившись, уничтожились, так как эти фотоны летят в противоположных направлениях)[8]:
- .
Энергия же нашей физической системы будет просто суммой энергий первого и второго фотона:
Ну и отсюда масса системы:
(импульсы уничтожились, а энергии сложились — они не могут быть разного знака).
В общем случае всё происходит аналогично этому, наиболее отчётливому и простому примеру. Вообще говоря, частицы, образующие систему, не обязательно должны иметь нулевые массы, достаточно, чтобы массы были малы или хотя бы сравнимы с энергиями или импульсами[9], и эффект будет большим или заметным. Также видно, что точной аддитивности массы нет практически никогда, за исключением лишь достаточно специальных случаев.
Масса и инертность
Отсутствие аддитивности массы, казалось бы, вносит затруднения. Однако они искупаются не только тем, что определённая так (а не иначе, например, не как энергия деленная на квадрат скорости света) масса оказывается лоренц-инвариантной, удобной и формально красивой величиной, но и имеет физический смысл, точно соответствующий обычному классическому пониманию массы как меры инертности.
А именно для системы отстчета покоя физической системы (то есть той системы отсчета, в которой импульс физической системы ноль) или систем отсчета, в которых система покоя медленно (по сравнению со скоростью света) движется, упомянутое выше определение массы
— полностью соответствует классической ньютоновской массе (входит во второй закон Ньютона).
Это можно конкретно проиллюстрировать, рассмотрев систему, снаружи (для внешних взаимодействий) являющейся обычным твердым телом, а внутри содержащую быстро движущиеся частицы. Например, рассмотрев зеркальный ящик с идеально отражающими стенками, внутри которого — фотоны (электромагнитные волны).
Пусть для простоты и большей четкости эффекта сам ящик (почти) невесом. Тогда, если, как в рассмотренном в параграфе выше примере, суммарный импульс фотонов внутри ящика ноль, то ящик будет в целом неподвижен. При этом он должен под действием внешних сил (например если мы станем его толкать), вести себя как тело с массой, равной суммарной энергии фотонов внутри, деленной на .
Рассмотрим это качественно. Пусть мы толкаем ящик, и он приобрел из-за этого некоторую скорость вправо. Будем для простоты сейчас говорить только об электромагнитных волнах, бегущих строго вправо и влево. Электромагнитная волна, отражающаяся от левой стенки, повысит свою частоту (вследствие эффекта Допплера) и энергию. Волна, отражающаяся от правой стенки, напротив, уменьшит при отражении свои частоту и энергию, однако суммарная энергия увеличится, так как полной компенсации не будет. В итоге тело приобретет кинетическую энергию, равную (если ), что означает, что ящик ведет себя как классическое тело массы . Тот же результат можно (и даже легче) получить для отражения (отскока) от стенок быстрых релятивистских дискретных частиц (для нерелятивистских тоже, но в этом случае масса просто окажется[10] суммой масс частиц, находящихся в ящике).
Примечания
- ↑ Пер. Э. Радлова (см., напр. п. 346 здесь).
- ↑ Энциклопедия Кругосвет
- ↑ Письмо Жана Рэ
- ↑ И. Кант. Метафизические начала естествознания. Соч., том VI, стр. 148.
- ↑ Лавуазье.
- ↑ Окунь Л. Б. Понятие массы, указ. соч., стр. 519.
- ↑ Приближенно аддитивной она, конечно же, может быть — в приближении нерелятивистской механики, однако как только в системе имеются движения со скоростями, сравнимыми со скоростью света, аддитивность массы как правило нарушается вполне заметно или даже сильно.
- ↑ Выбрав (по условию) именно противоположные (и равные по величине) импульсы, мы получили сразу же и удобное для нас обстоятельство: первоначально выбранная система отсчёта тогда сразу оказывается системой, в котором сисиема покоится (это и значит формально, что ее импульс равен нулю; да это и интуитивно так). Поэтому энергия нашей физической системы, которую мы посчитаем, как раз и будет сразу ее энергией покоя.
- ↑ В нашей системе единиц , для того, чтобы выразить это условие в других (любых) системах единиц надо не забыть умноджать или делить на нужные степени .
- ↑ В принципе — конечно, лишь приближенно.
Литература
dic.academic.ru
Закон сохранения массы
Закон сохранения массы — исторический закон физики, согласно которому масса как мера количества вещества сохраняется при всех природных процессах, то есть несотворима и неуничтожима.
Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи. Одним из первых его сформулировал древнегреческий философ Эмпедокл (V век до н. э.).
Закон сохранения массы вещества открыли М. В. Ломоносов и А. Л. Лавуазье почти независимо друг от друга. Они далеко продвинули развитие химии тем, что при химических реакциях применили физические методы, в частности взвешивание. Закон сохранения массы в химических процессах можно сформулировать так: сумма масс исходных веществ (соединений) равна сумме масс продуктов химической реакции.1
Понимая значение законов сохранения, неуничтожимости материи для науки, М.В. Ломоносов, подтверждая свои мысли, повторил опыты английского ученого XVII в. Р. Бойля и получил тот же результат: вес металла увеличился; видоизменив опыт: после нагревания реторты на огне и охлаждения ее взвешивает сосуд, не отламывая горлышка, он доказал, что «без допущения внешнего воздуха вес сожженного металла останется в одной мере, никакой материи огня в реторту не проникает».2
Закон сохранения массы звучит так: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.3
В общефизическом смысле закон сохранения массы можно подвергнуть сомнению. Например, электрон и позитрон, обладающие массой, могут аннигилировать в фотоны, не имеющие массы покоя. А масса дейтрона, состоящего из одного протона и одного нейтрона, не равна сумме масс своих составляющих, поскольку следует учитывать энергию взаимодействия этих частиц. Подтверждается это и тем, что при радиоактивном распаде совокупная масса вещества уменьшается. Закон сохранения массы в физике работает с известными оговорками, а на самом деле является ограниченным и частным случаем закона сохранения энергии, с учётом известного соотношения для энергии массы покоя частиц: E = mc².
Таким образом, с точки зрения современной физики, этот закон неверен.
Заключение
Подведя итоги проделанной работы, можно сделать следующие выводы. В современной физике прочтение законов, установленных несколько веков назад и подтвержденные опытами, принимают новое значение, получают уточнения в связи с развитием науки.
Так, например, классический закон сохранения массы в современной интерпретации подвергается сомнениям и работает только с учетом оговорок. Фундаментальный закон сохранения энергии о том, что энергия не исчезает и не появляется, а переходит из одной формы в другую, то есть сохраняется неизменной в изолированной системе, можно распространить и на незамкнутые системы, если принять во внимание принцип приращений, о чем было сказано выше.
Таким образом, некогда универсальные законы сохранения сегодня дополняются условиями, что позволяет их применять и в других областях, хотя бывают и исключения, когда классический закон можно принять в современных условиях, только с оговорками.
studfile.net
Урок 11. Формулировка закона сохранения массы и энергии – HIMI4KA
В уроке 11 «Формулировка закона сохранения массы и энергии» из курса «Химия для чайников» дадим определение закону сохранения массы и закону сохранения энергии, познакомимся с открытием Ломоносова, а также повторим некоторые основы химии из прошлой главы. Этим уроком мы открываем следующий раздел курса, под названием «Закон сохранения массы и энергии». Поэтому, чтобы у вас не возникало вопросов по урокам, обязательно изучите все уроки из первого раздела «Атомы, молекулы и ионы».


Мысль о том, что все в мире состоит из атомов, зародилась еще до нашей эры. Древнегреческий философ Демокрит полагал, что вся материя состоит из неделимых микрочастиц — атомов, что каждый атом обладает индивидуальными свойствами, что свойства веществ определяются их взаимным расположением относительно друг друга. Таким образом его идеи являются примитивным вариантом того, что изложено в разделе 1 «Атомы, молекулы и ионы». Напрашивается вопрос: почему же тогда древние греки не воспользовались гипотезой Демокрита и не научились получать атомную энергию? Почему прошло еще 2000 лет, прежде чем наука достигла своего современного уровня? Одна из причин заключалась в том, что древние греки понятия не имели о законах сохранения вещества, ну и конечно же о законе сохранения энергии.
Закон сохранения массы и энергии
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.


В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.


Закон сохранения массы: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:

Повторюсь, что не плотность или объем, а именно масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса молекулы вычисляется через сумму всех атомных масс входящих в ее состав атомов. А из урока 5 «Моль и молярная масса» нам известно, что моль любого вещества — это такое его количество, в котором число частиц этого вещества равно 6,022·1023. Масса одного моля вещества в граммах называется молярной массой. Моль и молярная масса являются важнейшими понятиями, без которых невозможно проводить химический расчет.
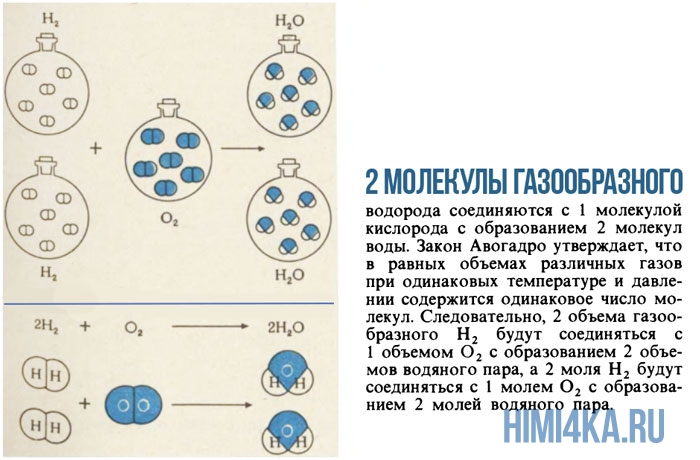

Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·1023. Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Урок 11 «Формулировка закона сохранения массы и энергии» является повторением уже пройденного материала перед погружением в более серьезный раздел химии. Надеюсь вы открыли в этом уроке для себя что-то новое и интересное. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, но их общая масса также не изменяется.
С точки зрения атомно-молекулярного учения закон кажется очевидным.
Однако в процессе химической реакции неизменными остаются только ядра атомов. А атом – не только ядро, но и окружающие его электроны. В процессе взаимодействия веществ реагентов происходит перестройка внешних электронных уровней, атом изменяется и совсем не очевидно, что его масса остается постоянной.
Может возникнуть возражение, число электронов так, как и ядер, сохраняется. Это правильно, но опять обратимся к уравнению Эйнштейна Е = mc2, выражающего связь между массой тела и энергией процесса.
Если происходит выделение энергии, масса продуктов уменьшается и наоборот. Изменение массы можно вычислить, зная тепловой эффект реакции.
Например
С
+ О2 = СО2; ∆Н = –393,5 кДж
= –393,5 кДж
∆m = 4,4 10–12 кг = 4,4 10–9 г
С выделившейся энергией рассеивается часть вещества. Масса моль СО2 меньше суммы масс С и О2 на 0,0000000044 г. Такое изменение массы находится вне пределов современных методов её определения. Точность определения молярных масс в таблице Менделеева ограничена четырьмя знаками после запятой. Поэтому следует считать, что в эттом месте теория с практикой расходятся. С практической точки зрения закон сохранения массы в химических процессах выполняется. Он выполняется строго, если не дать возможности выделяющейся энергии рассеиваться в окружающем пространстве или поступить из неё.
Значение закона сохранения массы для химии лишь историческое. Он утверждает материальность химических элементов и веществ. Широко используется в технологических расчетах при составлении баланса масс реагентов и продуктов промышленных производств.
Для характеристики природы веществ особенно важен заряд: нейтрон 0, электрон –, протон +. Электрон и протон обладают одинаковыми, но противоположными по знаку зарядами 1,6 10-19 Кл. заряд протона и электрона дальше неделим, поэтому называется элементарным. При образовании атомных ядер и при формировании вокруг них электронных оболочек заряды элементарных частиц алгебраически суммируются. Ядро атома гелия состоит из двух протонов и двух нейтронов, имеет суммарный заряд +2, а электронная оболочка состоит из двух электронов, (–2) в целом атом электронейтрален. Закон сохранения заряда: алгебраическая сумма зарядов любой изолированной системы постоянна. Взаимодействие между атомами и ядрами и электронными оболочками осуществляется благодаря наличию у них зарядов и служит основой при возникновении химической связи и образовании химических соединений.
Составление химических уравнений
Включает три этапа:
1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками «+» и «=» :
HgO = Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO = 2Hg + O2
3. Проверка числа атомов каждого элемента в левой и правой частях уравнения.
studfile.net
Закон сохранения массы веществ. Химические уравнения
В 1748 г. М. В. Ломоносов (Россия) и в 1789 г. А. Лавуазье (Франция) независимо друг от друга открыли закон сохранения массы веществ в химических реакциях. Этот закон формулируется так:
Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции.
Запишем схему реакции горения метана СН4 в кислороде О2. В результате этой реакции образуются углекислый газ СО2 и вода Н2О:
СН4 + О2 = СО2 + Н2О
По закону сохранения массы:
m(СН4) + m(О2) = m(СО2) + m(Н2О),
где m(СН4) и m(О2) — массы метана и кислорода, которые вступили в реакцию; m(СО2) и m(Н2О) — массы углекислого газа и воды, образовавшиеся в результате реакции.
Сохранение массы веществ в химических реакциях объясняется тем, что число атомов каждого элемента до и после реакции не изменяется. В ходе химической реакции происходит только перегруппировка атомов. В реакции, например, в молекулах исходных веществ — СН4 и О2 — атом углерода соединяется с атомами водорода, а атомы кислорода— друг с другом; в молекулах продуктов реакции — СО2 и Н2О — и атом углерода, и атомы водорода соединяются с атомами кислорода. Легко посчитать, что для сохранения числа атомов каждого элемента в данную реакцию должны вступать 1 молекула СН4 и 2 молекулы О2, а в результате реакции должны образоваться 1 молекула СО2 и 2 молекулы Н2О:
СН4 + 2О2 = СО2 + 2Н2О
Данное выражение является уравнением химической реакции, или химическим уравнением.
Числа перед формулами веществ в уравнении реакции называются коэффициентами. В уравнении коэффициенты перед формулами О2 и Н2О равны 2; коэффициенты перед формулами СН4 и СО2 равны 1 (их обычно не записывают).
Химическое уравнение — это выражение химической реакции, в котором записаны формулы исходных веществ (реагентов) и продуктов реакции, а также коэффициенты, показывающие число молекул каждого вещества.
Если известна схема реакции, то для составления химического уравнения нужно найти коэффициенты.
Составим, например, уравнение реакции, которая выражается следующей схемой:
Al + НСl = AlCl3 + H2
В левой части схемы атомы водорода и хлора входят в состав молекулы HCl в соотношении 1 : 1; в правой части схемы содержатся 3 атома хлора в составе молекулы AlC13 и 2 атома водорода в составе молекулы Н2. Наименьшее общее кратное чисел 3 и 2 равно 6.
Напишем коэффициент «6» перед формулой HCl, коэффициент «2» — перед формулой AlC13 и коэффициент «3» — перед формулой Н;
Аl+ 6HCl = 2AlCl3 + 3Н2
Так как теперь в правой части содержится 2 атома алюминия, напишем коэффициент «2» перед формулой Al в левой части схемы:
2Al + 6НС1 = 2AlC13 + 3H2
В результате мы получили уравнение данной реакции. Коэффициенты в химическом уравнении показывают не только число молекул, но и число молей исходных веществ и продуктов реакции. Например, это уравнение показывает, что в реакцию вступают 2 моля алюминия Аl и 6 молей хлороводорода HCl, а в результате реакции образуются 2 моля хлорида алюминия AlC13 и 3 моля водорода Н2).
Похожее
al-himik.ru