11 класс Урок №2 — 3. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Решение расчётных задач
11 класс Урок №2 — 3. Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Решение расчётных задач
Цели урока Знать формулировки законов, применять законы для решения задач. Знать формулировки законов, применять законы для решения задач.Проверка домашнего задания 1. Что такое период? Сколько периодов в периодической системе? Какими элементами начинаются и заканчиваются периоды? Какие бывают периоды? 2. Что в периодической системе называют группой? Сколько групп имеется в периодической системе? На какие подгруппы делятся группы в периодической системе? 3. Как устроен атом? Как, пользуясь ПСХЭ, определить количество частиц в атоме? 4. Как определить количество энергетических уровней (электронных слоев) в электронной оболочке атома? Как распределяются электроны по электронным слоям? 5. Как определить количество электронов на внешнем электронном слое? 6. Что такое изотопы? Что называется химическим элементом?
Изучение нового материала. Беседа, работа в тетради. Стехиометрические химические законы
(Закон сохранения массы, закон постоянства состава, закон Авогадро)
Основные понятия
1. Закон сохранения массы вещества: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. (М.В.Ломоносов, 1748 г)
2H2 + O2 = 2H2O
m(H2) + m(O2) = m(H2O)
(2∙2г/моль) + (1∙32г/моль) = (2∙18г/моль)
2. Закон постоянства состава вещества: всякое чистое вещество, независимо от способа его получения имеет постоянный качественный и количественный состав. (Ж.Пруст, 1801 г)
Следует помнить!
Закон строго применим только к соединениям с молекулярной структурой (Дальтонидам). Соединения с немолекулярной структурой (Бертоллиды) часто имеют переменный состав.
Обратное утверждение, что определённому составу отвечает определённое соединение, неверно. Так, диметиловый эфир и этиловый спирт имеют одинаковый количественный и качественный состав, но это разные вещества.
Повторите вещества молекулярного и немолекулярного состава по материалам урока №6, 8 класс
3. Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г)
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при н.у. занимает объём равный 22,4 л.
2 следствие:
Отношение объёмов реагирующих веществ, измеренных при одинаковых условиях, равно отношению стехиометрических коэффициентов, т.е. равно отношению количеств этих веществ.
V1:V2:V3 = ν1:ν2:ν3
H2 + Cl2 = 2HCl
V(H2):V(Cl2):V(HCl) = ν(H2):ν(Cl2):ν(HCl) = 1 : 1 : 2
3 следствие:
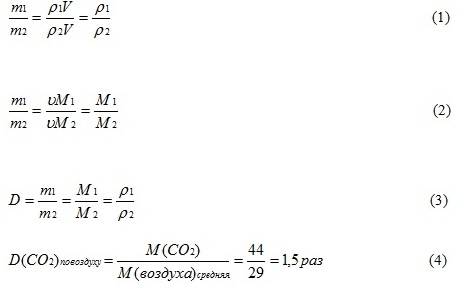
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их плотностей (1).
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей) (2).
Это отношение называется относительной плотностью одного газа по другому (3)
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например, (4)
4. Закон объёмных отношений: При неизменных температуре и давлении объёмы, вступающих в реакцию газов, относятся друг к другу, а также к объёмам образующихся газообразных продуктов, как небольшие целые числа. (Ж.Гей-Люссак, 1805 г)
Задачи для самостоятельного решения:
№1. Какое число молекул содержится в 1 м3 хлора при н.у.?
№2. Определите абсолютную массу атома гелия.
№3. В каких объёмах азота и воды при н.у. содержится 3,01 ∙ 1024 молекул?
кол-во в-ва=3,01*10^24/6,02*10^23=5 моль
V(Н2)=5*22,4=112л
m(Н2О)=5*18=90г
№4. Какова молярная масса газа, если 1 л его при н.у. имеет массу 3,17 г?
n=1/22,4=0,05(моль)
M=3,17/0,05=63,4(г/моль)
№5. 33,6 л смеси СО и СО2 имеют массу 48 г. Рассчитать массовые доли компонентов смеси.
РЕШЕНИЕ : Обозначим через х моль количество угарного газа и через у моль количество углекислого газа.
Тогда, масса СО в смеси составит: m(CO) = n(CO) *M(CO) = 28x
А масса СО2 в смеси составит: m(CO2)= n(CO2)*M(CO2) = 44y
Объём, занимаемый газами, можно подсчитать:
V = Vm*m/ M
Отсюда объёмы газов в смеси равны: V(CO)=22,4x , V(CO2) = 22,4 y
В условии задачи даны суммарные масса и объём смеси, следовательно,
28х + 44у = 48
22,4х + 22,4у = 33,6
Получилась система уравнений с двумя неизвестными. Решая её, найдём: х=1,125; у = 0,375 . Далее находим массы компонентов в смеси:
m (СО) = 28х = 31,5 г
m(СО2) = 44у = 16,5 г
Теперь нетрудно рассчитать массовые доли СО и СО2 , учитывая, что 48 г составляют 100 %, тогда
w (СО) = 31,5 : 48 = 0,656 или 65,6%
w (СО2)=16,5 : 48 = 0,344 или 34,4%
Теперь рассчитаем объёмные доли газов в смеси :
фсумм. = 1,125 + 0,375 = 1,5
ф(СО) = 1,125 : 1,5 = 0,656 или 65,6%
ф(СО2)=0,375 : 1,5 = 0,344 или 34,4%
№6. Плотность газовой смеси, состоящей из СО и СО2, по воздуху составляет 1,214. Определить состав в мольных (объёмных) долях.
№7. Какой объём кислорода (н.у.) потребуется для полного сгорания 10 м3 пропана
C3H8 + 5O2 => 3CO2 + 4h3O
По уравнению реакции на один объем пропана требуется 5 объемов кислорода. Значит на 10 м3 потребуется 50 м3 кислорода.
Содержание кислорода в воздухе составляет примерно 21%
Значит, потребуется 50/0,21 = 23,7 м3 воздуха
infourok.ru
Конспект урока по химии на тему «Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения» 11 класс
Урок № 2
Тема: «Закон сохранения массы веществ. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения».
Цель: повторить основные законы стехиометрии – закон сохранения массы веществ и закон постоянства состава веществ.
Задачи:
Образовательные:
Углубить знания учащихся о законе сохранения массы веществ, дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области, рассмотреть значимость этого закона в химии.
Повторить закон постоянства состава веществ и научить применять для решения задач.
Развивающие:
Развивать познавательный интерес к предмету.
Создать условия для овладения приемами изучения состава веществ.
Формировать умение проводить поиск, обработку и систематизацию информации.
Воспитательные:
Воспитывать толерантные отношения в группе, классе.
Тип урока: изучение нового материала.
Методы: словесный, наглядный, практический.
Ход урока:
Орг.момент.
Взаимное приветствие, проверка готовности к уроку, отметка отсутствующих.
Проверка домашнего задания.
Стр.6
22 протона содержит ядро атома Титана, так как порядковый номер его 22.
Речь идет о Железе. Порядковый номер 26, электронов 26, нейтронов 30. 26 56Fe.
Атом урана: протонов – 92, нейтронов 143; атом калия: протонов – 19, нейтронов- 22, атом стронция: протонов 38, нейтронов – 52.
Актуализация опорных знаний. Вводный контроль знаний.
Дайте ответы на следующие вопросы:
Что называется химическими реакциями? Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Что называется реагентами и продуктами реакции? Продукты реакции — это те вещества, которые получаются в результате реакции.
Что называют химическим уравнением? Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Что показывают коэффициенты в уравнении химической реакции? Коэффициенты в уравнении химической реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции.
4.Изучение нового материала.
Давайте рассмотрим реакции между метаном и кислородом. В этой реакции метан и кислород – реагенты, а диоксид углерода и вода – продукты.
СН4 + 2О2 = СО2 + 2Н2О
Изготовим пластилиновые модельки реагентов, похожие на те, что изображены на рисунке: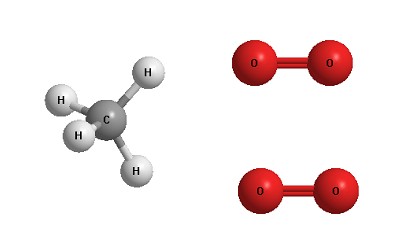
Получатся модельки одной молекулы метана и двух молекул кислорода. Мы можем разобрать эти модельки на отдельные «атомы» и тут же собрать из них модельки продуктов. Для этого нам не потребуется никаких других деталей – только те атомы, которые мы взяли из одной “молекулы” метана и двух “молекул” кислорода.
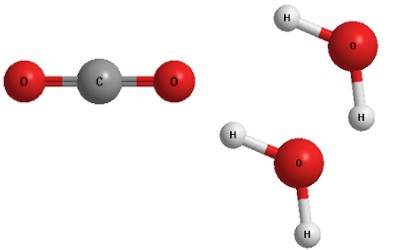
Разумеется, масса всех пластилиновых «атомов» при этом не изменилась, хотя перед нами теперь лежат уже совсем другие «молекулы» – диоксида углерода и воды.
Этот простой опыт иллюстрирует один из важнейших законов природы –
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
Когда мы разбирали пластилиновые модельки реагентов СН4 и О2, чтобы собрать модельки продуктов СО2 и Н2О, нам не потребовалось что-либо изменять в атомах. Разве что самую малость: к атому углерода в молекуле СО2 атомы кислорода прикрепляются не так, как до этого прикреплялись атомы водорода.
Значит, изменения коснулись только «внешней поверхности» атома. Там, как мы знаем, в настоящем атоме находится валентная электронная оболочка. Точно так же в химических реакциях изменения касаются только внешних электронов, а вся внутренняя «начинка» атома, находящаяся под его валентной оболочкой, остается неизменной.
Задача: Аэронавты погрузили на воздушный шар 2 кг продуктов и отправились в полет. Как изменилась масса воздушного шара с аэронавтами после того, как все продукты были съедены?
Работа в группах. А сейчас я предлагаю Вам небольшие задачи. Обсудите их в группах и через минуту докажите справедливость закона сохранения массы.
1 группа
Масса золы, полученной при сжигании дров гораздо меньше массы исходных веществ. Объясните, не противоречит ли этот факт закону сохранения массы веществ?
Дополнительная информация!
При сжигании дров органические вещества, входящие в состав дерева превращаются в водяной пар и углекислый газ.
2 группа
Горящая свеча тает, оставляя лишь маленькую лужицу парафина. Объясните, не противоречит ли это закону сохранения массы веществ.
Дополнительная информация!
При горении парафина образуются летучие водяные пары и углекислый газ.
3 группа
Объясните, не противоречит ли закону сохранения массы веществ, что масса проржавевшего ведра может оказаться больше, чем масса такого же нового ведра?
Дополнительная информация!
Ржавчина образуется при взаимодействии железа с кислородом воздуха и влагой.
4 группа
Можно ли при сжигании 100 кг угля (С) получить углекислого газа (СО2) больше, чем 100 кг? За счет чего масса углекислого газа больше массы использованного угля?
Дополнительная информация!
При горении вещества присоединяют кислород.
Закон постоянства состава веществ был открыт французским ученым Прустом в 1808 г. Вот как этот закон звучал в его изложении: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
Современная формулировка закона: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
А сейчас послушайте выступление о знаменитом споре между французскими учеными Ж.Л.Прустом и К.Л.Бертолле, который длился около 10 лет на страницах французских журналов в начале XIX в.
В 1799 г. профессор Королевской лаборатории в Мадриде, француз по происхождению, Жозеф Луи Пруст опубликовал статью «Исследования меди». В статье подробно освещены анализы соединений меди и сделан вполне обоснованный вывод, что химически индивидуальное соединение всегда, независимо от способа его образования, обладает постоянным составом. К такому же выводу Пруст пришел и позже, в 1800–1806 гг., исследуя химические соединения свинца, кобальта и других металлов.
В 1800–1803 гг. английский химик Джон Дальтон обосновал этот закон теоретически, установив атомное строение молекул и наличие определенных атомных масс элементов. Чисто теоретически Дальтон пришел к открытию еще одного основного закона химии – закона кратных отношений, находящегося в единстве с законом постоянства состава.
В то же самое время профессор Нормальной школы в Париже Клод Луи Бертолле, уже знаменитый химик, опубликовал ряд статей, в которых отстаивал вывод о том, что состав химических соединений зависит от способа их получения и часто бывает не постоянным, а переменным. Бертолле выступил против законов Пруста и Дальтона, аргументируя это все новыми и новыми опытами по получению сплавов, твердых оксидов металлов. Он воспользовался и данными самого Пруста, указав на то, что в природных сульфидах и оксидах металлов содержится избыток серы и кислорода по сравнению с полученными в лаборатории.
Развитие химии показало, что обе стороны были правы. Точка зрения Пруста и Дальтона для химии 1800-х гг. была понятна, конкретна и почти очевидна. Пруст и Дальтон заложили основы атомно-
молекулярного учения о составе и строении химических соединений. Это была магистральная линия развития химии. Точка зрения Бертолле была практически неприемлема для тогдашней химии, т. к. она отражала химизм процессов, изучение которых началось в основном лишь
с 1880-х гг. И только будущее показало, что и Бертолле был прав!
По предложению академика Н.С.Курнакова вещества постоянного состава были названы дальтонидами (в честь английского химика и физика Дальтона), а вещества переменного состава – бертоллидами (в память о французском химике Бертолле).
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
5. Выводы по уроку:
В чем сущность закона сохранения массы веществ?
Закон сохранения массы веществ заключается в том, что масса вступивших веществ в реакцию равна массе веществ образованных.Какое значение имеет закон сохранения массы веществ?
Слово учителя:
Уравнение реакции отражает материальный баланс вступивших в реакцию веществ (реагентов) и образовавшихся продуктов.
6. Закрепление.
Почему масса железной окалины больше массы железа? Какие вещества могут входить в состав окалины? (В состав окалины входят железо и кислород.)
Почему масса золы меньше массы сгоревшей древесины? (Углекислый газ, вода испаряются.)
Анализ уравнения реакции:
2Н2О → 2Н2 + О2
2*(1*2+16) = 2*2 + 2*16
7. Домашнее задание.
Параграф 2, упр 3-4.
infourok.ru
Урок химии по теме «Закон сохранения массы веществ. Химические уравнения»
Цель урока:ознакомить с количественной стороной химических процессов, узнать о научном подвиге М.В. Ломоносова, получить представление о химических уравнениях, научиться писать их.
Задачи:
1. Образовательные: Экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химических реакций и научить расставлять коэффициенты в уравнениях реакций.
2. Развивающие: содействовать развитию у учащихся исследовательских умений в процессе выполнения и наблюдения эксперимента, углубление знаний.
3. Воспитательные: поддерживать интерес к изучению химии, воспитывать сотрудничество, способствовать развитию грамотной химической речи, учить анализировать.
Основные понятия. Закон сохранения массы веществ, химическое уравнение, коэффициент.
Тип урока. Изучение нового материала.
Методы обучения. Частично-поисковый, исследовательский, репродуктивный.
Формы деятельности. Общеклассная, групповая, индивидуальная.
Ожидаемый результат:
- Знать формулировку закона сохранения массы веществ, его значение, понимать смысл уравнений химических реакций, значение коэффициентов в химических уравнениях;
- Уметь применять закон сохранения массы веществ при написании уравнений, расставлять коэффициенты в уравнениях, проводить опыты.
Демонстрации. Опыты, подтверждающие закон сохранения массы веществ: взаимодействие сульфата натрия и хлорида бария в закрытом сосуде, мрамора и соляной кислоты.
Оборудование и реактивы. Мультимедиапроектор, компьютер, экран, диск Школа Кирилла и Мефодия «Уроки химии 8-9 кл.», карточки с заданиями, пробирки, пластмассовые штативы, стаканы, весы, растворы хлорида бария, сульфата натрия, соляной кислоты, мрамор.
Ход урока.
I. Орг. Момент.
Ознакомление с целями, задачами и планом урока.
План урока.
- Самостоятельная работа.
- Открытие закона (1756г.), (видеозапись), Современная формулировка закона.
- Объяснение опыта с горением свечи.
- Лабораторный опыт.
- Значение закона.
- Химическое уравнение. Знаки, используемые в химическом уравнении. (видеозапись)
- Алгоритм расстановки коэффициентов. Коэффициент.
- Закрепление.
- Вывод.
- Домашнее задание: § 14, 15, упражнение 1-4 (стр.42).
II. Проверка знаний полученных на предыдущих уроках.
1. Самостоятельная работа.
Учитель: Проверим свои знания и умения составлять химические формулы, определять валентности элементов. Выполним самостоятельную работу по вариантам на карточках с заданиями. На экране задания для самостоятельной работы (приложение № 1)
Учитель: Правильность выполнения заданий проверим по ответам на экране (приложение № 2).
III. Изучение нового материала.
2. Постановка проблемы: Будет ли масса веществ, полученных после реакции, равна массе веществ, вступивших в реакцию?
Учитель: Вспомним, что представляют собой химические реакции с точки зрения атомно-молекулярного учения? Что происходит с веществами во время химических реакций? Из чего состоят вещества?
Вывод: Во время химических реакций атомы сохраняются, значит и масса веществ, вступающих в реакцию должна быть равна массе веществ, полученных после реакции. В течение тысячелетий люди верили в то, что вещество может бесследно исчезать и появляться из ничего. Это житейское наблюдение подтвердил и такой известный ученый как Р. Бойль. На экране видеоматериал (диск «Уроки химии Кирилла и Мефодия. 8-9 классы» урок 5 «Закон сохранения массы веществ» 2004г.).
В 1756г. М.В. Ломоносов доказал закон сохранения массы веществ: «Все перемены в Натуре случающиеся такого суть состояния, что, сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов кто положит на бдение, столько же сну отнимет…».
В настоящее время этот закон формулируется так: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
3. Объяснение, совместное с учащимися обсуждение.
Учитель: Объясните известный опыт: сжигание свечи, уравновешенной на весах. Чаша весов со свечой поднимается вверх. Можно ли утверждать, что закон сохранения массы веществ по мере сгорания парафиновой свечи нарушен?
Как усовершенствовать этот опыт, чтобы доказать правильность закона? Чем объяснить поднятие чашки со сгораемой свечой на весах? Можно ли сказать, что парафиновая свеча исчезает бесследно, уничтожается?
Ученик: Свеча сгорела, продукты реакции улетучились, смешались с воздухом. Установить поглотители продуктов реакции.
Вывод: Таким образом, если учесть массу парафиновой свечи, кислорода воздуха (это исходные вещества) и массу продуктов реакции (углекислый газ и пары воды), то окажется, что масса веществ, взятых для реакции, точно равна массе веществ, получившихся после реакции. А значит, реакция горения подчиняется закону сохранения массы веществ.
4. Организация лабораторной работы и объяснение ее результатов.
Проведем лабораторный опыт. Задания на карточках и на экране (приложение № 3).
Вывод: в первом опыте все продукты остались в стаканчике, а во втором – образовался газ, который улетучился.
Уменьшение массы веществ после реакции возможно только в том случае, если один из продуктов её не замечен и не измерен, чаще всего такими веществами являются пары и газы.
5. Значение закона.
Закон М.В. Ломоносова имеет большое значение: помогает правильно понимать окружающий мир: ничто в природе не может возникнуть из ничего и не может исчезнуть бесследно. Этот закон является основой для составления уравнений химических реакций.
6. Работа над термином «химические уравнения».
Химическое уравнение – это условная запись химических реакций с помощью химических знаков и формул.
На экране знаки, используемые в химическом уравнении. (диск «Уроки химии Кирилла и Мефодия. 8-9 классы» урок 5 «Закон сохранения массы веществ» 2004г.)
7. Работа над термином «коэффициент» и алгоритмом расстановки коэффициентов.
Алгоритм расстановки коэффициентов в уравнениях химических реакций на примере реакции горения красного фосфора. (приложение №4)
Коэффициент – это цифра, которая ставится перед химической формулой.
Учитель: Расставим коэффициенты в химической реакции между натрием и хлороводородом. В начале записываем схему реакции:
Na + HCl → NaCl + H2 ↑
Чтобы схема стала уравнением мы должны уравнять число атомов каждого элемента в левой и правой частях уравнения. Для этого используем коэффициенты – цифры, которые ставятся впереди химических формул.
Сравним число атомов каждого элемента в левых и правых частях схемы. Число атомов Na одинаковое (1), коэффициенты здесь не нужны. Число атомов водорода в правой части в 2 раза больше чем в левой, перед формулой HCl ставим коэффициент – 2. В 2-х молекулах HCl содержится 2 атома Cl, а в правой части только 1 атом Cl, ставим коэффициент – 2 перед формулой NaCl, теперь нарушилось равенство в числе атомов Na, чтобы восстановить его нужно поставить коэффициент – 2 перед химическим знаком Na. Теперь закон сохранения массы веществ выполняется.
2Na + 2HCl → 2NaCl + H2 ↑
8. Закрепление.
Для закрепления полученных знаний выполним самостоятельную работу. Расставим коэффициенты в приведенных схемах:
Ba + O2 → BaO
H2 + O2 → H2O
Al + Br2 → AlBr3
H2O → H2 + O2
9. Подведение итогов.
Решение проблемы, поставленной в начале урока.
10. Домашнее задание § 14, 15 упражнения 1-4 по учебнику «Химия – 8» (авторы Г.Е. Рудзитис, Ф.Г. Фельдман).
urok.1sept.ru
Методическая разработка урока «Закон сохранения массы веществ. Химические уравнения.»
Тема урока: Закон сохранения массы веществ. Химические уравнения
Образовательные задачи:
Повторить понятия о физических и химических явлениях, химических реакциях и их сути;
На основании демонстрационного эксперимента подвести учащихся к открытию закона сохранения массы веществ;
Используя видеофрагмент электронного приложения к учебнику, познакомить учащихся с исторической справкой открытия закона сохранения массы веществ;
Показать значение открытия закона в химии и для производства;
Развивающие задачи:
Способствовать развитию навыков самостоятельной и групповой работы;
Способствовать развитию познавательной активности учащихся на уроке через применение видеофрагментов электронного приложения;
Развивать логическое мышление учащихся для умения объяснять результаты демонстрационного эксперимента;
Развивать умение применять закон сохранения массы веществ для решения задач и составления уравнений реакций.
Воспитательные задачи:
Продолжать воспитание аккуратности у учащихся в оформлении записи при решении задач и написания уравнений реакций;
Способствовать формированию у учащихся умения выслушивать мнение других, владению различными формами устных выступлений, оценке разных точек зрения.
Воспитывать культуру умственного труда, диалектико-материалистическое восприятие мира.
Тип урока: Урок усвоения новых знаний.
Формы и методы: рассказ, беседа, самостоятельная работа, работа с учебником, наглядный, работа в группах.
Оборудование: ноутбук, мультимедийный проектор, интерактивная доска, электронное приложение, ПСХЭ, весы, прибор для демонстрации закона сохранения массы веществ.
Реактивы: Растворы сульфата натрия и хлорида бария.
Демонстрации: 1) взаимодействие хлорида бария и сульфата натрия на весах; 2) видеофрагменты электронного приложения к учебнику.
Ожидаемый результат:
Ученик:
даёт определение закону сохранения массы веществ, знает его суть;
расставляет коэффициенты в уравнениях химических реакций;
рассчитывает массу вещества (продукта или реагента), используя закон сохранения массы веществ.
ХОД УРОКА
I. Организация учащихся к уроку.
II. Актуализация опорных знаний. Мотивация учебной деятельности. Постановка проблемного вопроса.
1. Фронтальный опрос
«ИГРА – упражнение». Учитель перечисляет физические и химические явления. Учащиеся внимательно слушают. Если названо химическое явление, то они поднимают руку вверх. Ученик, ответивший не верно, даёт определение физического или химического явления и приводит дополнительно свой пример:
а) скисание молока;
б) брожение винограда;
в) таяние льда;
г) ржавление гвоздя;
д) плавление парафина;
е) испарение спирта;
ж) кипячение дистиллированной воды;
з) горение природного газа;
и) образование инея;
к) гниение мусора.
2. Беседа
 Учитель: Вспомните опыт по горению серы при изучении темы «Физические и химические явления». Как мы записывали схему данной химической реакции? (ученик на доске записывает схему химической реакции при помощи химических формул S + O2 SO2, в это время с классом фронтально проверяем механизм записи схемы химической реакции, который был отработан на том уроке).
Учитель: Вспомните опыт по горению серы при изучении темы «Физические и химические явления». Как мы записывали схему данной химической реакции? (ученик на доске записывает схему химической реакции при помощи химических формул S + O2 SO2, в это время с классом фронтально проверяем механизм записи схемы химической реакции, который был отработан на том уроке).
Как называются исходные и конечные вещества в схеме реакции?
Что происходит с атомами серы и кислорода по окончании химической реакции, судя по её схеме?
3. Определение темы и цели урока, её значимости в химической науке.
Учитель: Сегодня на уроке перед нами стоит чрезвычайно ответственная миссия – открыть для себя один из важнейших законов природы, науки. Вы попробуете себя в роли теоретиков и частично практиков, решая несложные упражнения и задачи.
Через несколько минут вы самостоятельно сформулируете тему сегодняшнего урока.
Девизом нашего урока будут слова английского философа Ф. Бекона: «Истина – дочь времени, а не авторитета». Будьте внимательными, так как в конце урока я попрошу вас объяснить, что понимал автор под этим высказыванием. А ещё вы должны дать ответ на ключевой вопрос: «Как химики познают мир веществ?».
Беседа
Учитель: Вернёмся снова к известной нам схеме химической реакции горения простого вещества серы. Как вы думаете: В чём суть химической реакции? (атомы Серы и Кислорода не исчезают, и новые атомы не появляются, а происходит их перегруппировка, в результате чего образуется новое вещество эс-О-два). Итак, суть химической реакции – перегруппировка атомов элементов вследствие чего происходит образование новых веществ.
Учитель: Изменяется ли количество атомов до и после реакции? (число атомов элементов не изменяется).
Учитель: Изменяется ли масса атомов Серы и Кислорода до и после реакции? (масса атомов элементов Серы и Кислорода не изменяется).
Учитель: Так, изменяется ли общая масса веществ до и после реакции?
(масса веществ до и после реакции не изменяется).
Рассказ учителя
Такое наше теоретическое предположение, которое в науке называют Гипотезой. Гипотеза – это мысль, предположение, которое требует доказательства. Когда гипотеза подтверждается практически, экспериментально, тогда она стаёт Законом.
Определите тему нашего урока (учащиеся формулируют тему урока)
III. Изучение нового материала.
1. История открытия закона.
Рассказ с сопровождением видеофрагментов
Учитель: В 1676 году английский физик и химик Роберт Бойль провёл такой опыт: он взвесил запаянную реторту с порошком металла, длительное время нагревал её, потом охладил до комнатной температуры, вскрыл реторту и снова взвесил. Вес реторты с содержимым увеличился. На основании чего Р. Бойль делает вывод, что масса прокалённого металла увеличивается за счёт соединения металла с «огненной силой», которая проникает через стенки реторты (видеофрагмент 1). Такие частицы «огненной силы» в то время называли флогистонами. Существовала даже целая теория флогистона.
Однако, согласно наших теоретических рассуждений масса веществ до реакции и после реакции должна быть неизменной!
ТАК КТО ОШИБАЕТСЯ? Мы или Р. Бойль? Что нам остаётся сделать? Правильно! Провести собственный эксперимент!
Демонстрация. Перед проведением эксперимента уравновесим сосуд Ландоля (двухколенная пробирка) на технических весах. В одно колено наливаем бесцветный раствор хлорида бария, а другое – бесцветный раствор сульфата натрия. Наклонив пробирку, переливаем содержимое одного колена к содержимому другого, т.е. смешиваем прозрачные вещества. Наблюдаем образование белого осадка.
Учитель: О чём свидетельствует данный признак реакции?
(об образовании нового вещества).
Наблюдение: Равновесие весов не нарушается!
Вывод: Мы правы! Это уже ЗАКОН.
Учитель: Какую же ошибку допустил Р. Бойль? (ответы учащихся).
Учитель: Я вас всех поздравляю, мы открыли для себя один из важнейших законов природы о сохранении массы вещества во время протекания химических реакций.
Однако, до нас его открыл учёный с многогранным талантом, у которого тоже имелись сомнения относительно справедливости опытов
Р. Бойля (видеофрагмент 2).
Учитель: Как М.В. Ломоносов изменил опыт? Он провёл ряд опытов аналогичных тем, которые проводил Р. Бойль с прокаливанием металлов в ретортах. Он подметил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не раскрывая её, то масса остаётся неизменной. Опыты М.В. Ломоносова опровергают опыты и выводы Р. Бойля.
Ломоносов называет свой закон – Закон сохранения массы веществ. Тот факт, что атомы имеют постоянную массу, и обусловливает сохранение массы вещества. Ломоносов писал: «Все перемены в Натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте…».
Это открытие было огромным прорывом в науке, толчком к её развитию, поскольку предположение Р. Бойля почти столетие господствовало в химии и тем самым сдерживало её развитие. Это мы к сути закона подошли просто…, а в науке открытия происходят достаточно не просто. Отсутствие точных приборов, знания о газах, неумение их взвешивать не давали возможности открыть этот закон природы.
2. Открытие А.Л. Лавуазье.
Лавуазье писал: «Масса никогда не образуется и не исчезает, а только переходит от одного вещества к другому». «Элементы не появляются и не исчезают, а происходит только их перегруппировка».
Учитель: А известны ли вам факты, которые являются исключением из этого закона? Например: после сгорания дров, их масса явно уменьшается по сравнению с изначальной. Так ли это? Ответ поясните (ответы учащихся). Нет!
Следствие из закона: «Ничто не возникает из ничего и не исчезает бесследно. Наука не знает ни одного случая, когда бы во время каких-нибудь процессов этот закон нарушался».
3. Применение закона сохранения массы веществ, его значение.
в химическом производстве;
при составлении химических уравнений реакций;
в расчётах при решении задач;
открытие закона сохранения массы веществ способствовало даль-нейшему развитию химической науки, пониманию законов природы.
Учитель: Предлагаю проверить закон в действии на примере известной нам реакции горения серы и горения водорода.
S + O2 = SO2
32 32 64 Закон действует!
H2 + O2 = H2O
2 32 18
 2 + 32 = 18 Закон не действует!
2 + 32 = 18 Закон не действует!
Учитель: Поскольку атомы не исчезают и новые не образуются, то их количество согласно закону сохранения массы должно быть равным. Как этого можно добиться? Этого можно добиться, подбирая коэффициенты.
2H2 + O2 = 2H2O
4 + 32 = 36 Закон действует!
Учитель: Закон сохранения массы веществ применяется и для решения задач. Например: Какую массу серы необходимо сжечь в 4 г кислорода, чтобы получить 8 г оксида серы(IV)?
Дано: Решение:
m(O2) = 4 г m(S) + m(O2) = m(SO2)
m(S) – ? m(S) = m(SO2) – m(O2) = 8 г – 4 г = 4 г
Ответ: m(S) = 4 г
IV. Закрепление полученных знаний.
Работа в парах
1. Расставьте коэффициенты в уравнениях химических реакций:
а) Na + С12 → NaС1 ; б) Аg + S → Аg2S ;
г) НgО → Нg + О2 ; д) Na + О2 → Nа2О .
2. Решите задачи:
а) При горении 24 кг угля образовалось 88 кг углекислого газа. Какая масса кислорода для этого потребуется?
б) Какую массу ртути можно получить разложением 8,68 г оксида ртути(II), если при этом выделилось 0,64 г кислорода?
Самостоятельная работа
1. Закончите предложения:
а) Закон сохранения массы веществ экспериментально подтвердили: _____________________________ и ______________________________ .
б) Современная формулировка закона сохранения массы веществ такая: __________________________________________________________________.
в) Закон сохранения массы веществ используют для составления _____________________________ и _______________________________.
г) Число атомов до реакции всегда должно равняться ______________________________________________________________.
д) Коэффициент всегда ставится ________________________________.
2. Сумма всех коэффициентов в уравнении химической реакции
Р + О2 = Р2О5 , равна:
а) 8 ; б) 9 ; в) 11 ; г) 6 .
V. Обобщение и систематизация полученных знаний.
Фронтальный опрос
— Какую тему мы изучили сегодня на уроке?
— Кем был открыл закон сохранения массы веществ?
— Какое значение имеет закон сохранения массы веществ и где применяется?
— Какое следствие вытекает из закона сохранения массы веществ?
— В чём суть химической реакции?
— Что называют коэффициентом и для чего его применяют в уравнениях химических реакций?
VI. Рефлексия.
— Так какой смысл, по-вашему, мнению, вложил Ф. Бекон в выражение: «Истина – дочь времени, а не авторитета»?
— Как химики познают мир веществ?
Сегодня на уроке…


 узнал… понял… понравилось…
узнал… понял… понравилось…
я

мне


научился… поможет… интересно…
VII. Инструктаж Д/з.
§ 20 , с.67 – 68, упр. 3, 4 , 5 , тестовые задания 1 , 2 .
Используя электронное приложение к учебнику, подготовьтесь к уроку.
VIII. Подведение итогов урока.
7
multiurok.ru
Конспект урока «Закон сохранения массы веществ»
УМК Г.Е. Рудзитис, Ф.Г. Фельдман
План-конспект урока химии 8 класс
Тема урока. Закон сохранения массы веществ
Цель урока: формировать знания о законе сохранения массы веществ как одном из основных законов, его значении для развития химии как науки, дать понятие химических уравнений, применения закона сохранения массы для решения задач.
Планируемые результаты обучения
Предметные. Знать суть закона сохранения массы веществ, уметь его объяснять с точки зрения атомно-молекулярного учения.
Метапредметные. Развивать критическое мышление, умение устанавливать причинно-следственные связи, прогнозировать, делать выводы, планировать и регулировать свою учебную деятельность.
Личностные. Формировать ответственное отношение к учебной деятельности, познавательную и информационную культуру, умение сотрудничать с учителем, одноклассниками.
Оборудование: периодическая система химических элементов, весы с разновесами, двухколенные пробирки, реактивы.
ХОД УРОКА
1. Организационный этап. Создание позитивной рабочей атмосферы.
2. Проверка домашнего задания.
3. Сообщение темы, цели урока, ожидаемых результатов. Мотивация учебной деятельности.
3. Актуализация опорных знаний
1. Чем характеризуются физические и химические явления? Что происходит с молекулами и атомами при химических реакциях?
2. Сформулируйте основные положения атомно-молекулярного учения.
3. Что такое валентность? Составить формулы соединений:
1 вариант – формулы оксидов натрия, кальция, алюминия;
2 вариант — водородные соединения углерода, азота, серы.
Взаимопроверка.
4. Усвоение новых знаний
Проблемный вопрос. В печи сожгли уголь массой 10кг, а масса образовавшейся золы составила всего 3кг. Почему?
Учитель. Изучая химические явления, вы узнали, что при их осуществлении одни вещества превращаются в другие. Вы высказали предположение, что в
химических реакциях атомы переходят из одних веществ в другие. Следовательно, продукты реакции состоят из тех атомов, которые входили в состав реагентов. Что вы можете сказать о массе реагентов и продуктов?
Учащиеся высказывают свои предположения.
Учитель рассказывает об опытах, проводимых М.В. Ломоносовым и
А. Лавуазье, формулирует закон сохранения массы веществ.
Учащиеся рассматривают анимации (электронное приложение к учебнику).
Учитель. Мы с вами тоже можем экспериментально проверить этот закон.
Демонстрация опытов, иллюстрирующих закон.
Взаимодействие мела с кислотой.
Взаимодействие хлорида бария и сульфата натрия.
Обсуждение результатов опытов. Учащиеся делают вывод.
Учитель. Таким образом, закон сохранения массы веществ дает возможность не только записывать ход реакции, составлять уравнения, но и делать по ним расчеты.
5. Закрепление. Использование полученных знаний
Работа по учебнику. Вопросы №1 – 4, стр.65 (устно).
Решение задач на закон сохранения массы веществ
Магний соединяется с серой в соотношении 3:4. Сколько потребуется исходных веществ для получения 70г сульфида магния?
Согласно закону сохранения массы веществ, при взаимодействии 3г магния и 4г серы образуется 7г сульфида магния. Так как необходимо получить 70г сульфида магния, то массы реагентов нужно увеличить в 10 раз, то есть взять 30г магния и 40г серы.
Какая масса водорода прореагировала с кислородом массой 16г, если образовалось 18г воды?
В соответствии с законом сохранения массы веществ суммарная масса водорода и кислорода равна массе воды.
Поэтому m(H2) = m(H2O) – m(O2)
m(H2) = 18 – 16 = 2
6. Контроль и коррекция полученных знаний
Решение задач
1 уровень
10г кальция вступило в реакцию с 4г кислорода. Определите массу полученного оксида кальция.
2 уровень
При сгорании 8г метана образовалось 22г углекислого газа и 18г воды. Какая масса кислорода участвовала в химической реакции?
7. Домашнее задание
Изучить параграф 19, выполнить тестовые задания №1,2,
дополнительно: подготовить вопросы одноклассникам по закону сохранения массы веществ.
Комментарии к домашнему заданию.
8. Итог урока. Рефлексия
Достигли ли вы ожидаемых результатов?
Над какими навыками, умениями необходимо дополнительно поработать дома?
Что понравилось на уроке? Что не понравилось? Что для вас было наиболее сложным?
О чем хотели бы услышать на следующем уроке?
Выставление оценок с комментариями.
videouroki.net
Закон сохранения массы веществ | Дистанционные уроки
05-Авг-2012 | комментариев 10 | Лолита Окольнова
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
М. В. Ломоносов, 1748 г. ; А. Лавуазье, 1789 г.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Еще нам понадобится
закон объемных отношений
Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа.
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
В общем, все задачи по химии решаются на основе этих двух законов. Давайте на примерах рассмотрим решение самых типичных задач, которые встречаются как в заданиях ГИА, так и ЕГЭ.
B10 ЕГЭ по химии:
 1) записываем уравнение реакции:
1) записываем уравнение реакции:
FeS + O2 -> FeO + SO2
2) обязательно нужно уравнять (согласно закону сохранения массы веществ, количество атомов, которое вступило в реакцию, обязательно должно быть равно количеству атомов, получившихся в результате реакции, т.е. «ничего не исчезает и не пропадает»):
2FeS + 3O2 -> 2FeO + 2SO2
3) теперь определяемся с численными данными:
Дано: V(SO2) = 28 л; н.у.
4) Решение: решение любой задачи(кроме задач на массовую долю) сводится к нахождению количества вещества — молей. Т.к. нам дан объем вещества при нормальных условиях, то по следствию из закона объемных отношений мы можем найти его количество:

значит, n = V \ 22.4
n(SO2) = 28 л \ 22.4 л\моль = 1,25 моль (как видите, литры в числителе и знаменателе сокращаются)
5) Теперь нам надо найти количество моль сульфида железа — по уравнению реакции его столько же, сколько и оксида серы:
2FeS + 3O2 -> 2FeO + 2SO2
1,25 моль <— 1,25 моль
n(FeS)= n(SO2) = 1,25 моль
6) Определяем массу сульфида железа (II):

m(FeS)=n*Mr=1,25 моль * (56+32) г\моль =110 г (моли в числителе и знаменателе сокращаются
Ответ: m(FeS)=73 г (просили с точностью до целых…)
_________________________________________________________________________________________________________________
При полном взаимодействии 11,2 л сероводорода (при н.у.) с избытком сернистого газа получена сера массой г.
(Запишите число с точностью до целых).
1) записываем уравнение реакции:
H2S+ SO2 -> S + H2O
2) уравниваем:
2H2S+ SO2 -> 3S + 2H2O
3) теперь определяемся с численными данными:
Дано: V(H2S) = 11.2 л; н.у.
4) Решение:
n((H2S)=V\22.4 л\моль = 11.2 \22.4 =0.5 моль
n(S) = 3\2 n (H2S) = 0.5*1.5 моль
m(S)= n · Ar(S) = 0.75 моль · 32 г\моль = 24 г
Ответ: 24 г
_________________________________________________________________________________________________________________
Кстати, ради тренировки можно посчитать все массы веществ, вступивших в реакцию и все массы продуктов реакции — закон сохранения массы веществ в действии — они будут равны:
∑ m (реагентов) = ∑ m (продуктов)
_________________________________________________________________________________________________________________
- В ЕГЭ это задачи А28 и задания части С — С4 и С5
- В ГИА (ОГЭ) это задачи части С
_________________________________________________________________________________________________________________
Еще на эту тему:
Обсуждение: «Закон сохранения массы веществ»
(Правила комментирования)distant-lessons.ru
Химические уравнения. Закон сохранения массы веществ
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
1. Образовательные: систематизировать знания учащихся о классификации веществ, научить учащихся составлять уравнения химических реакций согласно Закону сохранения массы веществ.
2. Развивающие: совершенствовать умения учащихся при составлении химических уравнений, развивать у них умения сравнивать и обобщать, устойчивое внимание; развивать аналитическое мышление; осуществлять межпредметную связь.
3. Воспитательные: формировать информационную и коммуникативную культуру.
Оборудование и реактивы: весы, пробирки, колбы, HCL, CuSO4, CaCO3, H2 SO4, Cu(OH)2.
Тип урока: комбинированный.
План урока:
- Организационный момент.
- Актуализация знаний. (Решение кроссворда, диктант).
- Изучение нового материала:
а) историческая справка;
б) демонстрация опытов;
в) формулировка закона;
г) химические уравнения. - Закрепление (Выполнение упражнений).
- Итоги урока.
- Домашнее задание.
- Песенка.
Ход урока
1. Орг.момент.
Приветствие.
Девиз урока: “ О, сколько нам открытий чудных
Готовит просвещения дух…”
Сегодня на уроке мы будем говорить об открытиях, узнаем много нового, мы повторим пройденный материал, вспомним, как пишутся формулы веществ, познакомимся с законом сохранения массы веществ, научимся писать уравнения. А для достижения наших целей мы будем работать по следующему плану: (на экране появляется план).
2. Актуализация знаний
– Вспомните, какие явления существуют в природе.
– Чем физические явления отличаются от химических?
– Чем сопровождаются химические реакции?
– Как обозначают вещества в химии?
– Кто предложил такое обозначение?
А теперь, обратите внимание на экран. Вы видите кроссворд, разгадав который вы не только повторите то, что всем известно, но и узнаете тему нашего сегодняшнего урока.
Обратите внимание, заголовок написан, а ключевое слово выделено красным цветом и зашифровано. После решения верные ответы появляются на экране.
Молодцы! Таким образом, тема нашего урока: “Химические уравнения.
Закон сохранения массы веществ”
Открываем тетради, пишем число, тему урока.
Сейчас мы с вами напишем диктант.
Я буду называть вещества, а вы будете записывать формулы.
Диктант.
Ba(N O3), BaCL2,HCL, Cu SO4, CaC O3,H2O, NaOH, H2 SO4, HN O3,AL2O3,
Zn (N O3)2, Mg CL2.
На экране появляются верные формулы. Учащиеся сверяют свои записи.
3. Изучение нового материала.
Теперь, когда мы вспомнили знаки, формулы, приступим к изучению нового материала.
Историческая справка
З.С.М.В. был открыт великим русским ученым Ломоносовым в 1748 году, позднее подтвердил этот закон в 1789 году французский химик Лавуазье. Какова же история открытия?
Пытливый ум Ломоносова занимала мысль о том, что происходит с веществами, вступающими в химическую реакцию.
Изменяется ли их состав и масса?
Он проводил опыты.
Сначала он брал для опытов сосуды с открытыми отверстиями. Масса изменялась.
Затем он провел опыты в запаянных стеклянных ретортах– масса оставалась неизменной.
Тогда он объяснил закон тем, что при химических реакциях атомы не исчезают и не возникают, а происходит только их перегруппировка.
Сейчас мы с вами проведем опыты, подтверждающие открытия Ломоносова.
Демонстрация опытов:
Какой вывод мы можем сделать, как изменилась масса веществ ?
Какой закон физики имеет подобное смысловое значение? (закон сохранения энергии).
Как он формулируется?
Во всех явлениях, происходящих в природе, энергия не возникает и не исчезает. Она только превращается из одного вида в другой, при этом её значение сохраняется.
– Теперь, когда вы вспомнили закон сохранения энергии и узнали суть закона сохранения массы веществ. попробуйте сформулировать сам Закон сохранения массы веществ.(на экране появляется закон)
– Запишите в тетради.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
– Вещества вступают в реакцию, образуются новые вещества.
Мы обо всем этом говорим. А как это можно записать?
А записывают эти процессы с помощью уравнений.
Как в русском языке вы из букв составляете слова, а из слов предложения, так и в химии из знаков – формулы, из формул – уравнения.
Для записи уравнений в химии используются следующие знаки:
Записывая уравнения, нужно придерживаться следующего алгоритма действий (на экране).
N2+H2. —> NH3
N2+3 H2 —> 2NH3
– Ребята, кто сможет предположить что такое химическое уравнение?
(Формулировка появляется на экране)
– Химическое уравнение – это условная запись химической реакции посредством химических формул.
Вещества, принимающие участие в реакции называются реагентами.
Вещества, образующиеся в результате реакции – продуктами реакции.
Учащиеся записывают в тетради.
– А теперь составим уравнение реакции, которые мы провели.
2HCL+ CuSO4—>CuCL2+ H2.SO4
2HCL+ CaCO3—>Ca CL2 + H2 CO3
Cu(OH)2+ H2 SO4 —> Cu SO4 + H2О
4. Упражнения для закрепления
– Ребята, у кого есть вопросы?
– А сейчас мы выполним несколько упражнений для закрепления:
1. Какой коэффициент стоит в уравнении реакции перед формулой соляной кислоты
| Na+ HCL—> NaCL+H2 | (2 Na+2 HCL—> 2NaCL+H2) |
2. Продолжите уравнения реакции, расставьте коэффициенты :
AL + O2 —>…(AL2 O3)
3. Запишите уравнения реакции и расставьте коэффициенты : сульфат натрия соединяется с нитратом бария с образованием сульфата бария и нитрата натрия
(Na2SO4 +Ba (N O3)2—> Ba S O4v+ 2NaN O3)
3. Найдите ошибки:
| Mg+HBr —> MgBr2 +H2 | (Mg+2HBr —> MgBr2 +H2) |
| BaO+ H2 SO4 —> Ba2 SO4 + H2O | (BaO+ H2 SO4—> BaSO4 + H2O) |
| ZnO + HNO3 —> ZnNO3 + H2O | (ZnO + HNO3—> ZnNO3 + H2O) |
5.Закончите уравнения:
6. Выполните ряд превращений, запишите уравнения реакции:
Ca —> CaO —> (CaOH)2
– Закончили, хорошо. Обратите внимание на экран. Возьмите друг у друга тетради и проверьте себя. Поменяйтесь обратно. У кого все верно? Хорошо.
5. Итоги урока
.– Какие выводы мы можем сделать?
– Что мы проходим на уроке?
– Как уравниваются уравнения?
– Кто открыл Закон сохранения массы веществ?
– Что называется уравнением?
– Как называются вещества, вступившие в реакцию?
– Как называются получившиеся вещества?
Сегодня славно потрудились
Могу я подвести итог.
Вы все старались, не ленились
И каждый сделал сколько мог!
Выставление оценок.
– А теперь, запишите в дневниках:
Дом.задание.
П. 31, упр.2,3.стр.110, для любознательных упр. 2,3,4.
– Хорошо!
– А урок мы закончим песенкой про Закон на мотив песни “Улыбка”.
Ломоносов сей закон открыл
Подтвердил французский химик Лавуазье
Массы всех веществ в реакцию вступивших
Равна массе получившихся веществ
Каждый атом не дурак
Поступает ровно так:
Не возникнет, не исчезнет
Не изменитсяНу, а масса как всегда
Этих атомов одна
И в исходных веществах она не сменится. – 2 разаЛомоносова закон тогда
В химии стал главной панацеей
Все реакции теперь всегда
Составляются системой уравнений.Каждый атом не дурак
Поступает ровно так:
Не возникнет, не исчезнет
Не изменитсяНу, а масса как всегда
Этих атомов одна
И в исходных веществах она не сменится. — 2 раза
№1 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. HCL + ? —> ZnCL2 + H2 2. O2 + ? —> CuO |
№2 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. CL + ? —> ALCL3 2.. HCL + ? —> MgCL2 + H2 |
№3 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. H2 + ? —> N H3 2. O2 + ? —> CaO |
Диктант. Ba(N O3), BaCL2,HCL, Cu SO4, CaC O3,H2O, NaOH, H2 SO4, HN O3,AL2O3, Zn (N O3)2, Mg CL2. |
| Выполните ряд превращений, запишите
уравнения реакции: Ca —> CaO —> (CaOH)2 |
urok.1sept.ru