Конспект урока «Соли как производные кислот и оснований» 8 класс
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 13 ПОСЁЛКА ИСКРА БУДЕННОВСКОГО РАЙОНА»
Конспект урока химии
«Соли как производные кислот и оснований»
в 8 классе
- Волохова Жанна Александровна
учитель химии МОУ СОШ № 13 п. Искра Будённовского района
2017 год
Тема: «Соли как производные кислот и оснований»
Химия 8 класс
Учебник: О.С.Габриелян, Химия 8 класс, учебник для общеобразовательных учреждений, Дрофа М.2012 г.
Цель: Выяснить, почему соли являются производными кислот и оснований?
Задачи:
Изучить понятие «соль»
Научиться составлять формулы и определять названия солей
Продолжить обучение, по определению степени окисления элементов
Познакомиться с физическими свойствами некоторых солей
Развивать память, логическое мышление, внимание, работу в парах
Воспитание толерантности, самосознания, работать в парах
Методы: частично- поисковый, объяснительно- иллюстративный.
Оборудование: Таблица Д.И.Менделеева, ПК, экран, штатив с пробирками, проектор.
Реактивы: Образцы солей: медный купорос, железный купорос, мел, хлорид натрия, сульфат магния.
Организационный момент: Приветствие учеников. Постановка цели и задач.
Актуализация знаний:
Да прошлых уроках, учащиеся изучали степени окисления и знакомились с некоторыми классами неорганических веществ, на основании этого предлагаются следующие задания:
1 задание:
Дайте определение:
-
Оксиды (бинарные соединения, состоящие из двух химических элементов, один из которых кислород со степенью окисления -2) (слайд №2)
Основания (сложные вещества, состоящие из катионов металла и гидроксид анионов (OH¯)) (слайд №3)
Кислоты (сложные вещества, состоящие из катионов водорода (H+) и анионов кислотного остатка) (слайд №4)
Катион (положительно заряженный ион) (слайд №5)
Анион (отрицательно заряженный ион)
Ион (частица имеющая заряд)
2 задание: (слайд №6)
Данывещества: H2O, KOH, H3PO4, HBr, CO, Mg(OH)2, Na2O,H2SiO3, Al(OH)3, SO3, Sr(OH)2, H2SO4.
Распределите данные вещества в соответствующие колонки:
ОКСИДЫОСНОВАНИЯ
КИСЛОТЫ
Изучение нового материала:
Учитель предлагает выполнить следующее задание:
Из предложенных формул выберете те, которые вам еще не знакомы, чем они похожи и чем отличаются:
BaCl2, H2CO3, Mg(OH)2, CO2, AgNO3, Ca(OH)2,HCl, Na2SO4 . (ученики отвечают, что все они содержат в составе металл и кислотный остаток) (слайд №8)
(ВИДЕОФРАГМЕНТ) (СЛАЙД 9)
На основании видеофрагмента учитель предлагает ученикам определить тему занятия (тема СОЛИ)
Что же такое соль?
(СЛАЙД 10)
На видео главный герой употребляет в пищу соль, а какую именно? (поваренную, пищевую) Или как говорят химики хлорид натрия, формула этой соли NaCl.
Рассказ ученика о поваренной соли
Поваренная соль
Хлорид натрия – это единственное минеральное сырьё, которое человек употребляет в пищу в чистом виде. Без соли не возможны физиологические процессы в организме. Она в виде ионов содержится в крови, обеспечивает работу эритроцитов, в мышцах обуславливает способность в возбудимости. В тех странах, где соли было мало, люди прибегали к различным способам удовлетворить свои потребности в ней. Меланезийцы каждое утро натощак пили морскую воду. В Новой Зеландии пищу запевали морской водой. На островах Самоа, Таите и Тонга население употребляло в пищу сырую рыбу, обмакивая её в морскую воду, налитую в скорлупу кокосовых орехов. В Северной Америке индейские племена высушивали и прессовали специальной вид морской водоросли и этим своеобразным пирогом закусывали каждый кусок пищи. У травоядных животных потребность в поваренной соли высока. Лошади, коровы, козы, овцы с удовольствием едят солёный корм. Дикие животные пьют воду солёных источников и едят солончаковые травы. Все пищевые продукты содержат поваренную соль в некотором количестве: мука – 0,01%, картофель – 0,04%, фрукты – 0,05 %, молоко – 0,15%. Прибавляя к пище ежедневно около 20 г соли, человек съедает в год 7 – кг, а за 70 лет – 500 кг.Учитель: Еще, соли считают производными кислот и оснований, а как вы думаете, почему?
( ученики отвечают: они образуются из кислот (кислотный остаток) и оснований (металл))
(СЛАЙД 11)
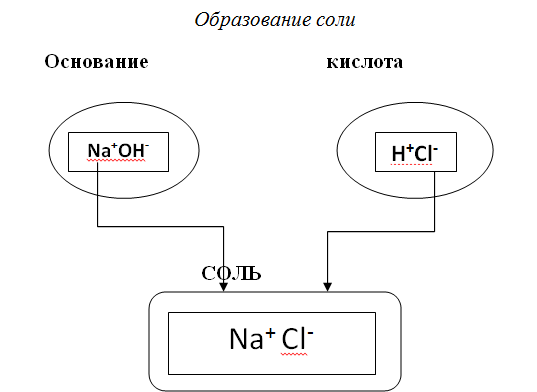
Учитель. Сегодня мы с вами посещаем Страну веществ, классовое название которых означает «рождённые солнцем». Почему же «рождённые солнцем»? Да потому что многие вещества этого класса любят «прятаться» в воде. Но как только горячие солнечные лучи выпарят воду, эти вещества предстают перед нами во всей своей красе. Посмотрите, какими разными они бывают!
Учащиеся, работая в парах, знакомятся с образцами солей и проводят лабораторную работу, заполняя таблицу. (Таблица у каждого ученика, положить перед уроком)
Агрегатноесостояние
Цвет
Запах
Формула
Растворимость
в воде
Карбонат кальция
CaCO3
Cульфат меди (II)
CuSO4
Хлорид натрия
NaCI
Cульфат железа (II)
FeSO4
Сульфат магния
MgSO4
Учащиеся после выполненной работы делают выводы. Соли представляют из себя твёрдые вещества, кристаллические, растворимые или не растворимые в воде, с разнообразным цветом.
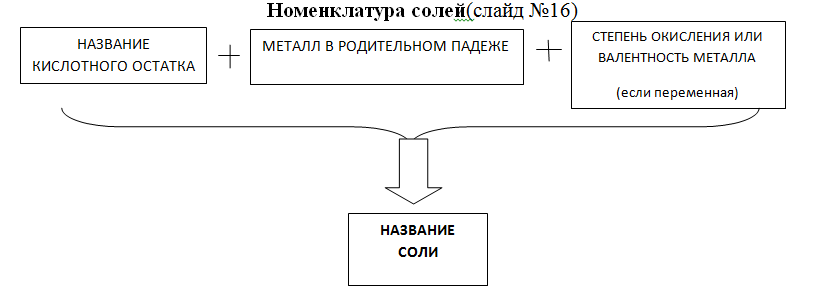
Учитель: Как и все изученные вами вещества (оксиды, основания и кислоты) соли имеют названия, как же составлять названия солей?
Кислотные остатки и их названия: (слайд №17)
НАЗВАНИЕФОРМУЛА
Хлорид
Cl—
Бромид
Br—
Йодид
I—
Фторид
F—
Сульфид
S2-
Сульфит
SO3 2-
Сульфат
SO4 2-
Нитрит
NO2 —
Нитрат
NO3 —
Карбонат
CO3 2-
Метасиликат
SiO3 2-
Ортофосфат
PO4 3-
ПРИМЕР 1: По таблице растворимости назвать соль (слайд №18)
NaNO3
МЕТАЛЛКИСЛОТНЫЙ ОСТАТОК
(натрий) (нитрат)
соль: нитрат натрия (т.к. у натрия единственная степень окисления +1, она в скобках не указывается)
задание: самостоятельно назвать соль k2so4 (сульфат калия)
ПРИМЕР 2: По таблице растворимости составить формулу сульфата алюминия Al2(SO4)3
При составлении формулы соли необходимо(слайд №19)
расставить заряды ионов металлов и заряды ионов кислотных остатков;
по правилу креста расставить коэффициенты.
Чётные коэффициенты сократить
Закрепление изученного материала:(слайд №20)
Задание 1: Составьте формулы:
Сульфат натрия, хлорид железа (III), карбоната кальция.
Задание 2: Дайте названия веществам:
Na2CO3, K3PO4, MgSO4.
Задание 3:
Определите степени окисления элементов в соединениях:
Ca(NO3)2, K2SO3, Li2CO3.
Домашнее задание: параграф 21, №2,3 наизусть названия солей(слайд №21)
Раздаточная памятка:
KCl – хлорид калия
KBr – бромид калия
KI – йодид калия
KF – фторид калия
K2S – сульфид калия
K2SO3 – сульфит калия
K2SO4 – сульфат калия
K2CO 3 – карбонат калия
KNO3 – нитрат калия
KNO2 – нитрит калия
K2SiO3 – метасиликат калия
K3PO4 – ортофосфат каля
Итоги урока, оценки , рефлексия
Конспект урока в 8 классе Состав кислот. Соли.
Состав кислот. СолиОбразовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
Состав кислот.
Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего необходимо знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет уравнения химических реакций. Класс помогает ему в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
Название кислоты | Формула кислоты | Кислотный остаток и его валентность | Название соли |
Соляная кислота | НСl | С1 — | Хлориды |
Серная кислота | H2SO4 | SO4 = | Сульфаты |
Сернистая кислота | Н2SО3 | SO3= | Сульфиты |
Азотная кислота | НNО3 | NO3 — | Нитраты |
Ортофосфорная кислота | Н3РO4 | РO4= | Ортофосфаты |
Сероводородная кислота | H2S | S = | Сульфиды |
Угольная кислота | Н2СО3 | СOз= | Карбонаты |
Кремниевая кислота | Н2SiO3 | SiO3 = | Силикаты |
Бромоводородная кислота | НВr | Br — | Бромиды |
Фтороводородная кислота | HF | F — | Фториды |
Иодоводородная кислота | HI | I — | Иодиды |
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
Из чего состоят кислоты?
Дайте определение — что такое кислоты?
Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
Как узнать валентность кислотного остатка?
Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
Кислоты | |
Бескислородные | Кислородсодержащие |
HCl, HBr, HY (одноосновные) H2S (двухосновная) | HNO3 (одноосновная), H2SO4 (двухосновная), H3PO4 (трехосновные) |
III. Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
азотная кислота – НNО3
серная кислота – H2SО4
ортофосфорная кислота – НзРО4
метафосфорная кислота – НРО3
Задание 2 группы
сероводородная кислота – H2S
хлорная кислота – НClO4
соляная кислота – НС1
мышьяковая кислота – Н3АsO4
Задание 3 группы
сернистая кислота – Н2SО3
бромоводородная кислота – НВr
кремниевая кислота – Нг8Юз
пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
Формула металла | Формула кислоты | |||
HCl | H2SO4 | HNO3 | H3PO4 | |
K (I) |
|
|
|
|
Al (III) |
|
|
|
|
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
Формула металла | Формула кислоты | |||
HCl | H2SO4 | HNO3 | H3PO4 | |
Ag (I) |
|
|
|
|
Cu (II) |
|
|
|
|
Б) по названию составьте формулы солей: иодид кальция, сльфит калия, силикат лития, сульфат хрома (III).
Задание 2 для третьей группы
А)
Формула металла | Формула кислоты | |||
HCl | H2SO4 | HNO3 | H3PO4 | |
Fe (II) |
|
|
|
|
Fe (III) |
|
|
|
|
Б) по названию составьте формулы солей: карбонат натрия, бромид магния, сульфид калия, сульфат марганца (II).
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание:
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Рудзитис Г.Е. Фельдман Ф.Г. Химия. 8 класс средней школы. М.: Просвещение., 1993г.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
«Оксиды. Кислоты. Соли. Основания» 8 класс
Обобщающий урок по теме:
«Оксиды. Кислоты. Соли. Основания»
8 класс
Урок обобщения и систематизации знаний и умений
Повышение теоретического уровня курса химии предполагает принципиально иной подход к построению и методике проведения большинства уроков. В особенности это относится к обобщающим урокам повторения, которыми заканчивается изучение темы, раздела, курса (неорганической и органической химии) и всего предмета в целом. На этих уроках систематизируются знания, устанавливаются взаимосвязи понятий, сравниваются изучаемые факты и явления на межпредметной основе. Это дает учащимся возможность видеть место фактов в общей системе знаний, объяснять их с позиций фундаментальных теорий и законов химии.
Повторение и обобщение в обучении химии решает следующие задачи: обеспечивает прочное и глубокое усвоение знаний, умений и навыков, приводит в систему факты и явления, углубляет содержание изученных понятий, помогает установить более высокий уровень связи между фактами, понятиями и явлениями, формирует умения и навыки самостоятельной работы, способствует умственному развитию учащихся.
Особенность уроков повторения, на которых осуществляется систематизация и обобщение, заключается в тщательной предварительной подготовке. Главные моменты, на которые следует обратить внимание, следующие:
1) определение цели и задач урока в целом;
2) выбор структуры урока и определение последовательности его этапов, соответствующих конкретному материалу;
3) отбор содержания, методов и приемов повторения;
4) определение форм работы с учениками – общеклассная, групповая или индивидуальная;
5) использование химического эксперимента и технических средств обучения;
6) определение содержания и объема домашних заданий;
7) выбор форм контроля и учета знаний.
Методика проведения уроков должна быть направлена не только на выяснение состояния знаний, умений и навыков учащихся и их общего развития, но и на достижение более высокого уровня систематизации и обобщения всего изученного материала.
Возможны следующие методические подходы. В начале урока преподаватель кратко знакомит с его задачами. Затем по порядку обсуждаются вопросы, которые были заданы на дом для повторения, вызывают учащихся, желающих отвечать на них. В исправлении ошибок и дополнении ответов участвуют все школьники. После рассмотрения каждого вопроса преподаватель делает краткие замечания, уточняет и обобщает сказанное. Высокой активности в работе на уроке можно добиться, если отдельные вопросы заранее, за 1–2 недели, распределить для подготовки между отдельными учениками или группами, дать им план сообщений и указать соответствующую литературу. Можно объявить конкурс на лучшее сообщение и оформить стенд докладов.
В тех случаях, когда желающих отвечать не находится, вызывают хорошо подготовленных учеников. Привлечение же слабо подготовленных ребят к ответам на обобщающие вопросы приводит лишь к неоправданной трате времени и не дает возможности обсуждать намеченные вопросы с достаточной глубиной.
В конце урока преподаватель делает общие выводы по теме или разделу, разбирает ответы и выставляет за лучшие ответы отметки в журнал.
Иной методический подход к проведению обобщающих уроков заключается в том, что они начинаются с устных сообщений в сочетании с демонстрацией опытов, графических и объемных наглядных пособий. Далее проводится коллективное обсуждение материала с целью получения выводов обобщающего характера. Затем выполняются задания, требующие применения имеющихся знаний.
Обобщающие уроки должны помочь в активном усвоении и закреплении изученного материала, выработать практические навыки, вооружить умением правильно выражать свои мысли и применять теоретические знания на практике.
Хочу остановиться на одном уроке обобщения по теме «Важнейшие классы неорганических соединений: оксиды, кислоты, основания, соли», проведенном мною в 8-м классе.
Чтобы химия восьмого класса вызывала большой интерес у учащихся, тщательно готовлюсь к каждому уроку, перед изучением нового раздела задаю учащимся опережающие задания. Назначаю индивидуальные, групповые консультации, даю инструктаж, советую выбрать дополнительную литературу.
Наша школа в республике является экспериментальной площадкой «Школа полного дня»: ученики присутствуют в школе с 8.00 до 17.00 ч. Находясь столько времени в школе, любой здоровый человек почувствует усталость, поэтому администрацией школы перед педагогами была поставлена задача разнообразить формы обучения. Экспериментально доказано, что применение разнообразных форм работы поддерживает активность, внимание и снижает утомляемость.
Предлагаемый вашему вниманию урок был показан на семинарах директоров и заведующих школ города во вторую смену и был оценен на «отлично». Он прошел живо, интересно и, как выразился один из директоров при анализе урока, после такого урока «у меня даже перестала болеть голова». Из 30 учеников 8-го класса 18 человек справились на «5», 7 – на «4», 5 – на «3». Урок понравился и ученикам. Вот мнения некоторых учащихся. Козлов В.: «…Урок мне очень понравился. Мне вообще нравятся уроки химии. Нравятся опыты, которые нам часто показывают здесь. Особенно интересны такие уроки, где мы проводим опыты сами, как, например, сегодня». Иванова О.: «…Мне нравится, когда мы сами сочиняем стихи, пишем сказки, составляем кроссворды, путешествуем по лабиринтам, ну, конечно же опыты. Галина Павловна просто и хорошо объясняет темы».
Пробудить интерес к предмету – одна из важнейших задач каждого учителя.
Знания учащихся часто оказываются разрозненными, обедненными, если не сделать необходимых обобщений в конце изучения темы, не подвести итог развитию понятий, не переосмыслить ранее пройденное.
Я думаю, в условиях нашей школы надо больше использовать подобные уроки с элементами занимательности, не утомляющие ученика, развивающие его творческие способности.
Девиз урока. «Повторение – мать учения». (Русская народная пословица.)
Цели урока. Обучающая. Повторение, углубление и обобщение сведений об основных классах неорганических соединений: построение названий соединений, классификация, способы получения, химические свойства, генетическая связь между основными классами неорганических соединений.
Развивающая. Развитие «химического» мышления, умения использовать терминологию, ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать информацию.
Воспитывающая. Формирование интереса к учению, стремления добиваться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия их способностей на уроке.
Форма урока. Беседа с элементами исследовательской и самостоятельной работы учеников, работа у доски, индивидуальная, групповая работа, выполнение лабораторных опытов.
При подготовке данного урока был заранее роздан дополнительный материал, подготовленный учителем: «Суд над кислотой» (см. приложение), сценка «Кто я?».
Оборудование и реактивы. Н а с т о л а х у ч е н и к о в: опорные схемы (оксиды, кислоты, основания), дидактическая игра «Лабиринт “Соли”», дидактические карточки с заданиями, вращающиеся круги, пробирки с реактивами: оксид кальция, вода, фенолфталеин, метилоранж, пронумерованные пробирки (1, 2, 3 – вода, кислота, основание).
Н а д е м о н с т р а ц и о н н о м с т о л е: гидроксид натрия, сульфат меди(II), кислота, индикаторы, карбонат и оксид кальция, оксид меди, натрий металлический, вода.
ХОД УРОКА
1. Организационный момент, вступительное слово учителя о целях урока
Учитель.
Химия – такая есть наука,
Учить ее по книжкам – скука:
Формулы, законы, элементы,
Уравнения… И прочие моменты.
Из нее, однако, можем мы узнать,
Что и как, и надо ли взрывать,
Что нельзя нам с вами есть и пить,
Чтоб потом себя не хоронить,
Из чего все вещи, что вокруг…
Они возникают просто вдруг!
Чтобы это знать и более,
Учат химию в нашей школе.
Итак, ребята, на предыдущих уроках химии мы подробно разбирали состав и свойства неорганических соединений различных классов.
На доске записана тема:
«Важнейшие классы неорганических соединений»

Учитель. Целью сегодняшнего урока является повторение и обобщение знаний по этой теме в занимательной форме.
Ребята, если вы обратили внимание на доску, то, наверное, заметили, что от названия темы вниз идут четыре стрелки. Пустые места под стрелками мы будем заполнять по мере отгадывания загадок.
• «Их получают путем горения
Или сложных веществ разложения.
В них два элемента, один – кислород.
Я отнесу к ним и известь, и лед».
Какие это вещества?
(О т в е т. Оксиды.)
• «Они имеют кислый вкус.
В них изменяет цвет лакмус.
А если активный металл попадет,
Получим мы соль и еще водород».
(О т в е т. Кислоты.)
• «В каких веществах у фенолфталеина
Бывает не жизнь, а сплошная малина?»
(О т в е т. Щелочи.)
• «Хлориды и нитраты,
Сульфаты, карбонаты
Я без труда и боли
Объединю в класс…»
(О т в е т. Соли.)
2. Повторение свойств оксидов
Учитель. Ребята, к нам в гости напрашивается одно вещество. Вы должны отгадать, кто это?
Сценка «Кто я?»
Я у древних химиков самым главным веществом считалась. «Начало всех начал», – говорил греческий ученый Фалес, живший в VI в. до н.э. и утверждавший, что окружающий мир возник из меня – «первичной материи». Я в древности считалась матерью жизни и смерти. Мне поклонялись, а по преданиям древней Руси во мне жили русалки и водяные.
Я у древних народов Азии в прошлом служила причиной войн и борьбы.
Я являюсь вечным двигателем, который не ломается, не ржавеет, не горит, не гниет и никем не уничтожается.
Кто я?
(О т в е т. Вода.)
Учитель. К какому классу веществ относится вода?
Какие вещества называются оксидами?
Приведите классификацию оксидов.
Несколько учеников приглашаются к доске.
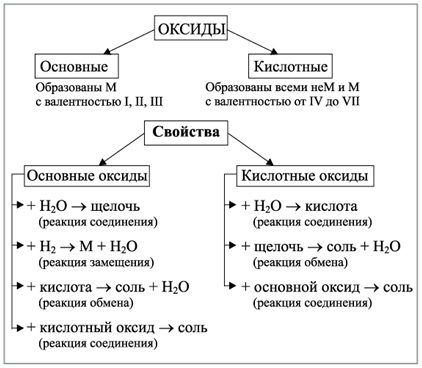
Учитель. Ваши знания об оксидах мы проверим экспериментально. Заглядывая в опорную схему (схема 1), вам надо доказать, что СuО и СаО – основные оксиды, а СО2 – кислотный оксид. Но перед тем как выполнять эту работу, мы проведем экзамен по технике безопасности. На чью голову я буду надевать переходящую корону ТБ, тот будет задавать вопросы.
Схема 1
Оксиды
1) Как надо обращаться с химическими веществами при выполнении работ?
2) Что надо делать при попадании кислот и щелочей на кожу?
3) Как правильно нужно разбавлять кислоты?
4) Как правильно держать пробирку при нагревании жидкости?
Пока ученики у доски размышляют над своими экспериментами, мы с вами проведем игру «Как получить оксид?»
Самостоятельная работа
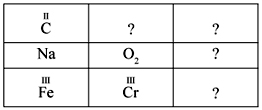
Формулы каких оксидов вы должны вписать в клеточки с вопросительными знаками? (По принципу «крест-накрест», например формулу оксида углерода(IV) пишут в нижней правой клетке, а марганца – в верхней второй клетке.)
После завершения работы – устная проверка ответов.
К а р т о ч к а № 1
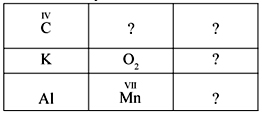
К а р т о ч к а № 2
Учитель. Ну а теперь, будущие химики, расскажите о своих экспериментах.
Учащиеся у доски демонстрируют и комментируют опыты.
3. Повторение свойств оснований
Учитель. А теперь, ребята, понаблюдаем за моими действиями.
(Проводит опыт взаимодействия натрия с водой и одновременно читает стих.)
«Я очень маленького роста
И получаюсь очень просто:
Берут стакан, а в нем вода;
Теперь кладут металл сюда.
Хлопок! И взрыв! И сноп огня!
И вы получите меня.
Хоть польза от меня огромная,
Натура я довольно скромная.
Вот индикатор влей сюда,
И я краснею от стыда…»
О чем идет речь?
(О т в е т. NaOH.)
А теперь, ребята, проведем лабораторную работу. Перед вами вода, оксид кальция, фенолфталеин. Вы должны доказать, что СаО – основной оксид. Что при этом получается? О чем говорит изменение цвета фенолфталеина?
Ребята, вы посмотрели два опыта. Какой же вывод напрашивается по ним?
Ученик. Основания получаются при взаимодействии активного металла с водой и оксидов активных металлов с водой.
Учитель. Когда-то вы сочиняли стишки о разных веществах. Вспомните, пожалуйста, стишок, посвященный основанию.
Ученик.
Если в формуле заметишь –
Впереди металл стоит
И своей ОН-подвеской
Как большим хвостом вертит,
Ты не думая ответишь:
«Знаю, это – гидроксид».
Но гидроксид – начало названия,
А класс веществ – основания.
Учитель. Какие вещества называются основаниями?
Вспомните классификацию оснований (схема 2).
Схема 2

Основания и их свойства
Ребята, растворимые основания или щелочи у нас есть в лаборатории, нам их присылают. А вот нерастворимых оснований готовых нет. Мы их получаем сами, проводим опыты. Ваша задача – получить Cu(ОН)2.
Я, конечно, могу вам немного подсказать теоретически… У меня здесь спрятана запись уравнения реакции получения Cu(ОН)2.
Кто-то стер часть записи, что же делать?
… + … = Сu(ОН)2 + …
Восстановите запись в тетрадях. И получите практически из веществ, данных в пробирках, Сu(ОН)2.
Один ученик восстанавливает запись на доске, другой проводит опыт взаимодействия CuSO4 с NaOH на демонстрационном столе.
В это же время с классом проводится с а м о с т о я т е л ь н а я р а б о т а.
Самостоятельная работа
Из предложенного списка веществ выбрать основания и отдельно расположить щелочи и нерастворимые основания.
К а р т о ч к а № 3
NaOH, HCl, LiOH, Cu(OH)2, h3SO4, Fe(OH)3, CaO, CO2, Ca(OH)2, Al(OH)3.
К а р т о ч к а № 4
KОН, h3SO4, Ba(OH)2, Fe(OH)2, CuO, SO2, Zn(OH)2, Pb(OH)2, Al2O3, HNO3.
Ученики вместе с учителем проверяют правильность выполнения работы.
4. Повторение свойств кислот
Учитель. Ребята, немного прервемся и послушаем в вашем исполнении стихотворную пьесу «Суд над кислотой» (см. приложение).
Ученики декламируют заранее подготовленную мини-пьесу.
Учитель. Дайте определение кислотам. Как классифицируются кислоты? (Схема 3; таблица)
Схема 3
Свойства кислот
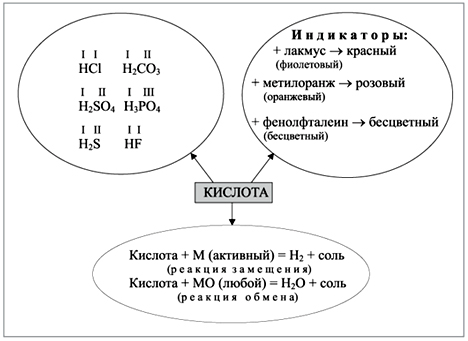
Проведем небольшую исследовательскую работу. Перед вами три пронумерованные пробирки. Вам надо определить, в какой пробирке находится кислота. (Набор реактивов NaOH, h3SO4, Н2О, метилоранж.)
А теперь проведем конкурс «Вращающиеся круги». Вы должны совместить эти диски (рис. 1) таким образом, чтобы формулы кислот в окошках соответствовали названиям их солей.
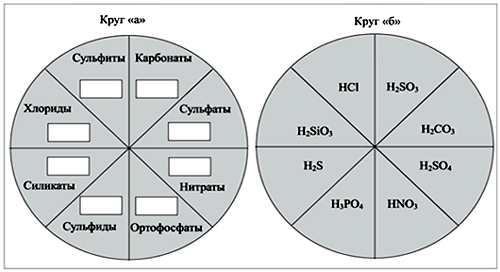
Рис. 1. «Вращающиеся круги». Круг «а» соединен с кругом «б» так, чтобы, вращая их, можно было увидеть в окошках формулы кислот
Учитель. Если в кислоте атом водорода я заменю на атом металла, то что я получу? Напишите формулы веществ, которые получаются при взаимодействии натрия и кальция со всеми кислотами из таблицы (см. таблицу).
Таблица
Состав кислот. Соли
(Учащиеся пишут формулы солей, затем все вместе их проверяют.)
Мы получили с вами соли.
5. Повторение свойств солей
Учитель. Дайте определение солям. Как классифицируются соли?
А теперь пять человек отправляются в путешествие в царство Солей (схема 4 «Лабиринт»). Если формула вещества соответствует приведенному под ней названию, то вы переходите к следующему пункту по стрелке «да», если не соответствует – по стрелке «нет». Можно войти в любой «вход». Но правильный «выход» только один – «пункт Г». Остальные работают со мной. Назовите мне соль, с которой мы ежедневно сталкиваемся дома. (Ученики отвечают, что это поваренная соль.)
Схема 4
Лабиринт
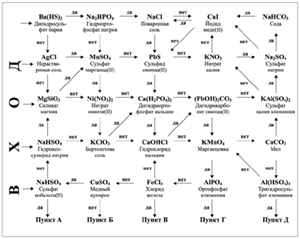
Ученые подсчитали, что человек в день употребляет 12–15 г поваренной соли. Сосчитайте, сколько соли вы потребляете за месяц, за год. Сколько соли вы съели за свою жизнь (14 лет).
Ученики проводят подсчеты, проверяют вместе с учителем.
За месяц: 15 г•30 = 450 г, за год: 450 г•12 = 5,4 кг,
за 14 лет: 5,4 кг•14 = 75,6 кг.
6. Подведение итогов
Учитель. Теперь мы с вами подведем итоги. Перед вами опорная схема «Генетическая связь между основными классами неорганических соединений» (схема 5).
Схема 5
Генетическая связь между основными классами неорганических соединений
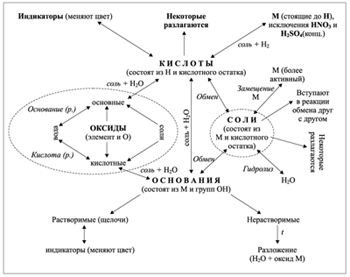
Повторяя свойства и способы получения этих веществ, мы пришли к выводу, что они между собой взаимосвязаны.
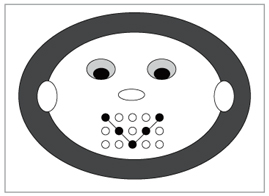
Рис. 2. Забавная рожица для ответов на вопросы теста. Верхний ряд кружков соответствует ответу «а», средний – «б», нижний – «в». Если ответы верные, то получается улыбка, как показано на рисунке
И для закрепления того, что мы с вами прошли, выполним тест. В задании по вариантам выберите правильный ответ и обведите красной ручкой или фломастером соответствующие точки на рисунке (рис. 2). А теперь эти точки соедините линией. Затем поднимите свои работы, и я увижу ваши улыбки.
Т е с т
В а р и а н т 1.
1) Из предложенного перечня выберите основной оксид:
а) Na2O; б) SO3; в) Р2О5.
2) В результате взаимодействия оксида серы(VI) с водой образуется:
а) основание; б) кислота; в) соль.
3) В растворах щелочей фенолфталеин имеет цвет:
а) бесцветный; б) синий; в) малиновый.
4) Какой металл не реагирует с соляной кислотой?
а) Натрий; б) серебро; в) цинк.
5) Вещества какой пары могут реагировать между собой?
а) NaOH + HCl; б) NaCl + Zn; в) Аu + h3SO4.
В а р и а н т 2.
1) Из предложенного перечня выберите кислотный оксид:
а) СО2; б) СаО; в) K2О.
2) В результате взаимодействия оксида натрия с водой образуется:
а) кислота; б) щелочь; в) соль.
3) В растворах щелочей лакмус имеет цвет:
а) бесцветный; б) фиолетовый; в) красный.
4) Что из перечисленного не подходит для характеристики соляной кислоты?
а) Сильная;
б) двухосновная;
в) бескислородная.
5) Вещества какой пары могут реагировать между собой?
а) Zn + НСl;
б) Fe(OH)3 + SiО2;
в) Ag + h3SO4 (разб.).
7. Домашнее задание
Учитель. Пришла телеграмма: «Пропали вещества А и В, вместо них появилось неизвестное вещество С».
Вам надо разыскать эти вещества. Итак, вы отправляетесь на поиски:
SО3 + h3O —> А;
СаО + h3O —> В;
А + В —> С.
О ходе вашего путешествия и поисков напишите или нарисуйте (в виде какой-нибудь творческой работы), а на следующем уроке мы подведем итоги ваших работ.
8. Заключение и критерии выставления итоговой оценки
Учитель. С какой трудностью вы столкнулись и как вы решили эту проблему? Что понравилось и не понравилось на уроке? Почему?
(Выслушивается мнение одного-двух учеников. Подводятся итоги.)
1) Если все задания выполнены и бо’льшая часть оценок «5» – поставьте «5»;
2) если все задания выполнены, но преобладает оценка «4» – поставьте «4»;
3) если задания сделаны на оценку «3» или «4», или есть прочерки – поставьте «3»;
4) если вы не справились с двумя и более заданиями – поставьте прочерк.
Урок заканчивается гимном:
«Мы рождены пролить все то, что льется.
Просыпать то, чего нельзя пролить.
Наш класс химическим не зря зовется,
Мы будем вечно химию любить.
Все выше, и выше, и выше!
К вершинам науки идем,
Когда мы все школу закончим,
Смелее по жизни пойдем!»
ПРИЛОЖЕНИЕ
Суд над кислотой
СУДЬЯ.
Суд мы начнем. Дело здесь непростое.
Суд мы вершим над самой Кислотою.
Скажет пусть речь Прокурор наш сначала:
Как Кислота подсудимой стала?
В чем преступленье ее заключается?
Иль в наказании она не нуждается?
ПРОКУРОР.
С жалобой многие в суд обращались,
Что при общении с ней обжигались.
Скажут еще – при ее попадании
Гибнет металл, разрушаются здания.
Мрамор, гранит украшают строения,
Их разрушает она, к сожалению.
Язву желудка она вызывает,
Если в избытке в нем пребывает.
Зубы крошатся, ожоги на коже…
На преступление это похоже.
Если вдруг дождик кислотный прольется,
Многим тогда от нее достается:
Травы пожухнут, лес высыхает,
Рыба в озерах порой исчезает.
Губит природу она без сомненья,
Очень тяжелое то преступление.
Надо сказать, что особенно скверная
Та кислота, что зовем мы все cерная.
Если уж где-то она и прольется,
То чернота лишь вокруг остается.
И, обращая слово к суду,
Требую я наказать Кислоту!
СУДЬЯ.
Итак, господа, суд продолжается,
Слово Защитнику предоставляется.
АДВОКАТ.
Я заявляю, что это шантаж!
Кого подвергала она опасности,
Тот никогда не учил инструктаж
По технике безопасности!
Чтоб с кислотой без опаски общаться,
Надо лишь знать, как с ней обращаться…
Так, например, чтобы жертвой не стать,
Надо вам знать, что к чему приливать.
Только незнайки не помнят, наверное,
Как разбавляют кислоту серную.
Если решили ее разбавлять,
В воду должны вы ее приливать.
Она тяжелее, на дно оседает,
Между молекул воды проникает,
Не будет ожогов и тяжких последствий,
Не будет причин для судов и следствий.
Если незнайка, наоборот,
На кислоту вдруг воду польет,
То, чуть коснувшись, вода закипает –
Брызги летят и в глаза попадают.
Если пролил кислоту на одежду,
Сам виноват, потому что невежда,
Свойства кислот не учил ты прежде,
И результат вот – дыра на одежде.
СУДЬЯ.
Свидетели дело сейчас прояснят,
Вызывается фармацевт-гомеопат.
ФАРМАЦЕВТ-ГОМЕОПАТ.
Я расскажу вам о пользе кислот,
Может, не знает о них наш народ.
Если ты проглотил аскорбинку,
Твой организм получил витаминку.
Знай, закрывает болезням врата
Аскорбиновая кислота!
Если простыли, болит голова,
Вас аспирин выручает сперва.
Яблоко ешь – кислый вкус красота,
В яблоке – яблочная кислота.
Яблочный уксус по ложечке пейте,
И обязательно вы похудеете.
Уксус столовый на кухне хранится –
Для консервации он пригодится.
Но и компресс из него помогает,
Быстро он жар при простуде снижает.
Фрукты и овощи, щавель, крапива
Кислоты содержат – и это не диво.
Есть в муравьях и крапиве невинная
С виду совсем кислота муравьиная.
Жжет она кожу, но есть в ней и прок –
Ваш ревматизм она вылечит в срок.
Лучше не жуйте косточки вишни
И абрикосов – это все лишнее.
Будет вам плохо – диагноз такой:
Синильной отравлены вы кислотой.
Думаю, что совсем не приукрашу,
Если хвалить буду я простоквашу,
Есть в ней молочная кислота –
Молодость ваша и красота.
Аминокислот в организме полки,
В цепях они образуют белки.
А без белков нет ни мышц и ни кожи,
Скажите, на что же мы будем похожи?!
СУДЬЯ. Директор завода – свидетель второй,
С серной давно он знаком с кислотой.
ДИРЕКТОР.
Вам известно уже, наверное,
Очень важна кислота серная.
И без нее нам, как ни крутись,
Верьте не верьте, не обойтись
При производстве красок и лаков;
Нефть очищает прекрасно от шлаков.
Аккумуляторы автомобилей
Без кислоты бы нам не послужили.
Надо нам ее не судить,
А по достоинству оценить.
СУДЬЯ. Ну а теперь подсудимой слово.
КИСЛОТА.
Я объяснить все вам готова,
Если права я, суд пусть решает,
Может, меня он все ж оправдает?
В чем виновата я? Не понимаю…
Что я умею, то выполняю.
Беды все там от меня случаются,
Где люди со мною не так обращаются.
Построили заводы разные,
Летят из труб вещества газообразные,
С водой образуют кислот целый ряд,
Ну а потом нас во всем винят.
Кто виноват в этом? Человек!
Сам сокращает прекрасный свой век!
СУДЬЯ.
Слово защитнику предоставляем,
Как поступить с кислотой – решаем!
АДВОКАТ.
Много свидетели здесь говорили,
Думаю я, что всех убедили,
Что осуждать кислоту не стоит:
Что-то разрушит, а больше построит.
Надо учесть все это суду.
Требую я оправдать кислоту!
СУДЬЯ.
Так, господа, суд прекращаем,
И кислоту мы сегодня прощаем.
Стоит совет всем хороший дать:
Свойства кислот продолжать изучать!
Л и т е р а т у р а
Лычкова Г.Е. Обобщение сведений об основных классах неорганических соединений. 8 класс. Химия (ИД «Первое сентября»), 2003, № 23; Зайковский И.И. Занимательная химия. М.: Учпедгиз, 1961; Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс. М.: Просвещение, 1998; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1988; Устяк В.В., Федотова Л.Г. Химия в схемах и тестах. Для абитуриентов и учащихся 11-х классов. Чебоксары, 2001; Хомченко Г.П. Химия: для подготовительных отделений вузов. М.: Высшая школа, 1981.
Технологическа карта урока в 8 классе по теме «Соли, как производные кислот и оснований»
ИТОГОВАЯ РАБОТА СЛУШАТЕЛЯ курсов повышения квалификации
Сценарий учебного занятия по предмету
Фамилия, имя, отчество (полностью)
Кириллова Людмила Михайловна
Район
Ковернинский
Место работы
МОУ «Гавриловская средняя школа»
Должность
Учитель химии и биологии
Общая информацияОбразовательная область, учебный предмет
Естествознание, химия
Класс
8
Авторская программа к учебникам (линии учебников или УМК) (если есть)
О.С.Габриелян «Программа курса химии для 8-11 классов общеобразовательных учреждений
Учебник: Габриелян О. С. Химия. 8 класс. — М.: Дрофа, 2013г.
Габриелян О. С., Воскобойникова Н. П., Яшукова А. В. Настольная книга учителя. Химия. 8 к л.: Методическое пособие.
Габриелян О.С., Яшукова А.В. Химия. 8 класс: рабочая тетрадь.
Химия. 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия 8»/ О. С. Габриелян, П. Н. Березкин, А. А. Ушакова
Габриелян О. С., Смирнова Т. В. Изучаем химию в 8 кл.: Дидактические материалы.
Тема учебного занятия
Тема урока или другой формы организации УВП: экскурсия, консультация, проект, лабораторное занятие, практикум, игра и т.п.
«Соли как производные кислот и оснований»
Место урока или другой формы организации учебной деятельности в структуре учебного занятия
Раздел: «Соединения химических элементов»
Степень окисления
Оксиды. Летучие водородные соединения.
Основания
Кислоты
Соли как производные кислот и оснований.
Аморфные и кристаллические вещества. Кристаллические решетки.
Чистые вещества и смеси. Массовая и объемная доли компонентов смеси.
Расчеты, связанные с понятием «доля»
Контрольная работа №2.
Учебная задача
Овладеть теоретическими знаниями о составе молекул солей, о правилах составления химических формул солей и их названий, о физических свойствах данного класса соединений.
Обобщенные цели учебного занятия — планируемые результаты Ц ель
ель
Уровень
Базовый («обучающийся научится»)
Повышенный («обучающийся получит возможность научиться»)
Цель – предмет (предметный результат)
Обучающиеся научатся определять по химической формуле класс солей, среду растворов солей, давать названия данному классу веществ, отличать соли от изученных ранее классов веществ.
Обучающиеся получат возможность научиться определять соли по химическим формулам, среду растворов солей, давать названия солям.
Цель – способ (метапредметный результат)
Обучающиеся овладеют умениями:
— работать с текстовой информацией,осуществлять логические операции при разрешении проблемной ситуации, концентрировать внимание,осуществлять самоконтроль и оценку своей деятельности, предвидеть возможные результаты.
Обучающиеся получат возможность работать с текстовой информацией при обращении к учебному пособию и рабочей тетради, анализировать информацию, обобщать материал и делать выводы.
Цель – ценность (личностный результат)
Обучающиеся сформируют представление о значимости солей в жизни человека.
Обучающиеся получат возможность для формирования понимания важности класса солей в народном хозяйстве и жизни каждого человека.
Исходное состояние обучающихся
-имеют опыт работы с различными источниками информации
-знают формы существования химического элемента, правила написания химических формул; — могут определять химические формулы водородных соединений, оксидов, оснований, кислот
— обладают теоретическим и наглядно-образным мышлением
— владеют основными видами логических операций (анализ, синтез, обобщение. Классификация, аналогия)
— могут осуществлять самоконтроль
Формы оценки планируемых результатов
Предметный результат
Метапредметный результат
Личностный результат
Умение определять понятие «Соли», составлять молекулярные формулы солей, по формулам давать названия веществам, определять среду водных растворов солей, делать выводы из демонстрационных опытов.
Выполнение поставленных задач, участие в разрешении проблемной ситуации, осуществлять наблюдения, делать выводы.
Участие в обсуждении демонстрационных опытов, заданий, высказывание своей точки зрения, умение грамоно обращаться с веществами в быту.
Комментарии учителя к учебному занятию или уроку
Учебно – информационное и техническое обеспечение учебного занятияУчебно – информационное
обеспечение
Основная литература
Дополнительная литература
Интернет — ресурсы
ЭОРы
1.О.С.Габриелян «Программа курса химии для 8-11 классов общеобразовательных учреждений
2.Учебник: Габриелян О. С. Химия. 8 класс. — М.: Дрофа, 2013г.
3.Габриелян О. С., Воскобойникова Н. П., Яшукова А. В. Настольная книга учителя. Химия. 8 к л.: Методическое пособие.
4.Габриелян О.С., Яшукова А.В. Химия. 8 класс: рабочая тетрадь.
5.Химия. 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия 8»/ О. С. Габриелян, П. Н. Березкин, А. А. Ушакова
6.Габриелян О. С., Смирнова Т. В. Изучаем химию в 8 кл.: Дидактические материалы.
1.Кузнецова Н.Е. Титова И.М. Гара Н.Н. Жегин А.Ю. «Химия 8 класс» Москва. : Издательский центр» Вентана-Граф», 2002 год.
2.Гузей Л.С. Суровцева Р.П. Химия: вопросы, задачи, упражнения Москва: «Дрофа», 2002 год.
1. Химия для всех. Электронный справочник полного курса химии (http://www.informika.ru/text/database/chemy/START.html).
2. Химия и жизнь. Научно-популярный журнал. Электронная версия известного издания, архив содержания номеров (http://www.hij.ru).
3. Мир химии. Справочная информация, опыты, новости науки (http://www.chem.km.ru).
Тренажер по составлению формул солей: http://files.school-collection.edu.ru/dlrstore/0ab71cb7-4185-11db-b0de-0800200c9a66/index_mht.htm
Тренажер по составлению названия солей: http://files.school-collection.edu.ru/dlrstore/0ab71cb7-4185-11db-b0de-0800200c9a66/index_mht.htm
Тренажер-классификация солей по растворимости в воде: http://files.school-collection.edu.ru/dlrstore/0ab71cb8-4185-11db-b0de-0800200c9a66/ch08_21_03.swf
Техническое обеспечение
Мультимедийный проектор, персональный компьютер.
Дидактическая структура учебного занятия (урока) и его психолого – педагогическое обоснованиеЭтап урока
Подэтап урока
Организация педагогически целесообразного взаимодействия (описываются конкретные методы и приемы, которые использует учитель на каждом подэтапе урока)
Психолого – педагогическое обоснование (представляется смысловая характеристика организуемого образовательного процесса с точки зрения его соответствия требованиям развития обучающихся на конкретной ступени общего образования и педагогической концепции, на которой основывается деятельность учителя)
1. Мотивационно ориентировочный
1.1. Вхождение в контакт
Подготовка учащихся к учебной деятельности
По источнику передачи и восприятию учебной информации: словесные, наглядные, практические.
Методы стимулирования интереса к учению: предъявление требований учителем.
Создание комфортной психологической атмосферы урока
1.2. Актуализация субъектного опыта обучающихся
По источнику передачи и восприятию учебной информации: словесные, наглядные, практические.
Постепени самостоятельности и активности мышления учащихся: репродуктивный (работа с презентацией, книгой, выполнений заданий.
По характеру управления учебной работой: индивидуальная, групповая, общеклассная.
Опора на уже имеющиеся знания обучающихся из курсов химии, биологии, географии.
1.3. Создание проблемной ситуации (конструктивного конфликта «знания – не знания», «умения – неумения», «понимания – не понимания»
По источнику передачи и восприятию учебной информации: словесные, наглядные, практические.
По степени самостоятельности и активности мышления учащихся: проблемное изложение материала.
Методы стимулирования интереса к учению: создание ситуации занимательности.
Создание проблемной ситуации – это новый поворот в уже знакомом материале, озадачивание. Разрыв непрерывности предметного действия, переживание невозможности дальнейшего движения требует обсуждения сложившейся ситуации. Здесь возникает учебно-познавательный мотив, направляющий мыслительную деятельность обучающихся
2. Операционно – исполнительский
2.1. Целеполагание и планирование
Формулирование цели урока как прогностической модели ожидаемого результата
Построение ориентировочной основы учебной деятельности (план урока):
Организационный этап – 2 мин.
Целеполагание – 2 мин.
Актуализация знаний – 7 мин.
Введение новых знаний – 20 мин.
Первичное обобщение , введение новых знаний в систему знаний учащихся – 10 мин.
Определение домашнего задания и инструктаж по его выполнению – 4 мин.
Реализация субъект-субъективных отношений, совместное участие учителя и обучающихся в постановке основной дидактической цели урока.
2.2. Поиск способа решения проблемной ситуации
По источнику передачи и восприятию учебной информации: словесные (беседа, диалог), наглядные (ДЭ, демонстрация ЭОР).
По степени самостоятельности и активности мышления учащихся: проблемное изложение материала (проблемная ситуация, диалог), репродуктивный (работа с книгой)
По характеру управления учебной работой: под руководством учителя.
Методы стимулирования интереса к учению: создание ситуации успеха, создание ситуации занимательности.
Методы контроля и самоконтроля: устный самоконтроль .
Осуществление данного этапа учебной деятельности связано с содержательным анализом предметного материала, который направлен на поиск и выделение в целостном предмете основного и генетически исходного отношения
2.3. Выбор верного варианта решения, фиксация найденного способа
По источнику передачи и восприятию учебной информации: словесные (беседа, диалог), наглядные (ДЭ, демонстрация ЭОР).
По степени самостоятельности и активности мышления учащихся: проблемное изложение материала (проблемная ситуация, диалог), репродуктивный (работа с книгой)
По характеру управления учебной работой: под руководством учителя, самостоятельно.
Методы стимулирования интереса к учению: создание ситуации успеха.
Для данного подросткового возраста ведущую роль играют следующие виды деятельности:
1.Деятельность по овладению системой научных понятий (для дальнейшего успешного изучения данного предмета)
2.Практическая деятельность
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий
По источнику передачи и восприятию учебной информации: практические (выполнений заданий)
По степени самостоятельности и активности мышления учащихся: репродуктивные, продуктивные.
По характеру управления учебной работой: самостоятельная работа.
Методы контроля и самоконтроля: письменный контроль и самоконтроль.
Методы стимулирования интереса к учению: компетентностно-ориентированные задания.
На этом этапе урока обучающиеся самостоятельно осуществляют выбор действий для решения предлагаемых заданий.
3. Рефлексивно – оценочный
3.1. Ситуация контроля за выполнением учебных действий
По источнику передачи и восприятию учебной информации: словесный.
Методы контроля и самоконтроля: письменный и устный самоконтроль.
Учащиеся анализируют правильность действий в ходе решения учебной задачи
3.2. Ситуация оценки образовательных результатов
По источнику передачи и восприятию учебной информации: словесный.
По характеру управления учебной работой: формирование убеждений в личной значимости учения.
Методы стимулирования интереса к учению: комментирование учителем результатов обучающихся.
Осмысление процесса решения учебной задачи, своих способностей к осуществлению данного рода учебных действий, усвоения их принципов построения.
Сценарий проведения учебного занятияЭтап урока или другой формы УВП
Подэтап урока или другой формы УВП
Действия учителя (педагога)
Действия обучающихся
(примерные версии ответов)
1. Мотивационно ориентировочный
1.1. Вхождение в контакт
Приветствует обучающихся, фиксирует отсутствующих. определяет готовность к уроку.
Приветствуют учителя, проверяют свои рабочие места, готовятся к учебной деятельности.
1.2. Актуализация субъектного опыта обучающихся
Организует деятельность по проверке домашнего задания:
-предлагает учащимся в течение 7 минут выполнить химический диктант на тему «Названия и формулы кислот»
(Работа с карточками в двух вариантах).
Приложение 1
Выполняют задание в карточках: записывают формулы кислот.
1.3. Создание проблемной ситуации
Учитель предлагает соотнести химические формулы и название классов веществ. ( Учащиеся поочередно выходят к доске и записывают формулы веществ, данных в карточках, в соответствующий класс). Читают формулы и дают определение классу веществ.
Как Вы думаете, как можно назвать этот неизвестный нам класс? (можно предложить исторические названия NaCl-поваренная соль, MgSO4-входит в состав горькой соли)
Отвечают по вызову учителя или по желанию.
Слушают ответы одноклассников.
Обсуждают ответы одноклассников
Предлагают различные варианты ответов
2. Операционно – исполнительский
2.1. Целеполагание и планирование
Сегодня на уроке вы продолжите знакомство с классами неорганических веществ. Вы познакомитесь с классом солей. Их признаками и некоторыми физическими свойствами.
Готовятся к активной учебно-познавательной деятельности.
2.2. Поиск способа решения проблемной ситуации
По мере того как учитель рассказывает о некоторых солях он записывает формулы их на доске: NaCl, MgSO4, CaCO3, Ca3(PO4)2
Показывает заранее приготовленные образцы солей называя их, и предлагает определить физические свойства: агрегатное состояние, цвет.
Предлагает найти общее в составе веществ, формулы которых записаны на доске.
Растворимость этих веществ вы определите сами . Предлагает вспомнить правила безопасной работы в химической лаборатории;
— предлагает в парах выполнить лабораторные опыты.
-А если воды под рукой нет?
Тогда необходимо воспользоваться таблицей растворимости: найти необходимый металл и кислотный остаток и посмотреть, растворима соль или нет.
Организует деятельность по выполнению задания на умение называть соли используя алгоритм, приведенный в учебнике ( и на карточке), организует деятельность учащихся и контроль.
Организует деятельность по выполнению задания на составление формул , используя алгоритм, приведенный в учебнике. Организует контроль проделанной работы,
корректирует деятельность учащихся
Организует деятельность по работе с учебником и предлагает познакомиться с образцами солей, встречающимися в природе в виде полезных ископаемых: NaCL-поваренная соль,хлорид натрия
CaCO3-известняк, мел, мрамор-карбонат кальция
Ca3(PO4 )2 – фосфат кальция
— Предлагает ответить на вопрос: где данные соли можно использовать в жизнедеятельности
человека?
Осмысливают сущность нового понятия. Записывают в тетрадях определение понятия «соли»
Предлагают различные варианты ответов
У нас дома есть соль – поваренная или пищевая).
– А еще мел. Это тоже соль.
Белый
Твердое
Вспоминают и озвучивают правила безопасной работы в химической лаборатории.
В парах проводят лабораторные опыты
исследуют предложенные вещества на растворимость в воде; делают вывод по лабораторной работе
Соль растворилась, а мел – нет.Значит, cоли бывают растворимые и нерастворимые.
Ссылка:
http://files.school-collection.edu.ru/dlrstore/0ab71cb8-4185-11db-b0de-0800200c9a66/ch08_21_03.swf выполняют работу с тренажером-классификация солей по растворимости в воде.
Записывают в тетрадях алгоритм составления названий солей ,используя таблицу 5 стр.109 учеб. Ссылка:
http://files.school-collection.edu.ru/dlrstore/0ab71cb7-4185-11db-b0de-0800200c9a66/index_mht.htm.Выполняют работу с тренажером по составлению названия солей, оценивают результаты своей работы,
Записывают в тетрадях алгоритм составления формул солей ,
изучают материал параграфа, знакомятся с составлением формул солей.Используют умение пользоваться таблицей растворимости при составлении формул солей. Ссылка:
http://files.school-collection.edu.ru/dlrstore/0ab71cb6-4185-11db-b0de-0800200c9a66/ch08_21_01.swf.выполняют работу с тренажером по составлению формул солей, оценивают результаты своей работы.
Находят в тексте информацию о важнейших представителях солей
Обсуждают где их можно использовать в жизнедеятельности человека
2.3. Выбор верного варианта решения, фиксация найденного способа
Организует обсуждение результатов выполнения заданий на составление молекулярных формул солей, умение давать названия солям, лабораторных опытов.
Обсуждают результаты выполнения заданий, результаты эксперимента. Слушают ответы одноклассников, дополняют.
2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий
Учащимся предлагается выполнить самостоятельную работу , включающую два задания на название формул солей и составление их молекулярных формул.
Самостоятельно выполняют задание
3. Рефлексивно – оценочный
3.1. Ситуация контроля за выполнением учебных действий
Организует работу по анализу выполнения задания:
— предлагает осуществить самооценку;
— предлагает озвучить правильный ответ;
— предлагает сравнить свой ответ с озвученным правильным ответом;
— предлагает учащимся, допустившим ошибки, установить их причины
Отвечают по вызову учителя или по желанию.
Слушают ответы одноклассников.
Обсуждают ответы одноклассников
Исправляю допущенные ошибки.
3.2. Ситуация оценки образовательных результатов
Проводит диагностику уровня усвоения учащимися новых знаний, выставляет отметки;
Подводят итог урока
Г БОУ ДПО «НИЖЕГОРОДСКИЙ ИНСТИТУТ РАЗВИТИЯ ОБРАЗОВАНИЯ»
БОУ ДПО «НИЖЕГОРОДСКИЙ ИНСТИТУТ РАЗВИТИЯ ОБРАЗОВАНИЯ»