Алифатические соединения — это… Что такое Алифатические соединения?
Алифатические соединения в органической химии — соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи (ациклические соединения) или замкнутые (алициклические или циклоалифатические соединения).[1] Иногда к алифатическим соединениям относят только ациклические, а алициклические выделяют в отдельный класс.[2]
Общая информация
В органической химии соединения разделяются на два класса: ароматические — содержащие бензольное кольцо и другие подобные замкнутые структуры, и алифатические соединения, которые их не содержат. В алифатических соединениях атомы углерода могут соединяться между собой в прямые цепочки, разветвлённые цепочки или кольца (в этом случае они называются алициклические соединения). Атомы углерода могут соединяться одинарными связями (алканы), двойными связями (алкены), и тройными связями (алкины). Кроме водорода к углеродной цепочке могут присоединяться и другие элементы, наиболее распространённые — кислород, азот, сера, галогены.
Простейшим алифатическим соединением является метан (СН4). Алифатические соединения включают алканы и их производные, такие как жирные кислоты, алкены (напр. этилен) и алкины (напр. ацетилен).
Многие алифатические соединения горючи, что позволяет использовать их, в частности углеводороды (метан), спирты (этанол) в лабораторных горелках Бунзена и спиртовках; ацетилен используется в сварке.
Ациклические соединения
Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы и все атомы углерода соединены между собой в прямые или разветвленные (открытые) цепи. Различают две основные группы ациклических соединений — насыщенные (предельные) углеводороды, у которых все атомы углерода связаны между собой только простыми связями (напр., гомологический ряд метана), и ненасыщенные (непредельные) углеводороды, у которых между атомами углерода имеются, кроме простых (одинарных) связей, также двойные, тройные связи (напр., ряды этилена, ацетилена).
Алициклические соединения
Алициклические соединения — соединения, молекулы которых содержат один или несколько циклов, за исключением ароматических соединений. Типичными представителями алициклических соединений являются циклоалканы.
См. также
Примечания
Алифатические соединения — Википедия
Материал из Википедии — свободной энциклопедии
Алифатические соединения в органической химии — соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи (ациклические соединения) или замкнутые (алициклические или циклоалифатические соединения).[1] Иногда к алифатическим соединениям относят только ациклические, а алициклические выделяют в отдельный класс.[2]
Общая информация
В органической химии соединения разделяются на два класса: ароматические — содержащие бензольное кольцо и другие подобные замкнутые структуры, и
Простейшим алифатическим соединением является метан (СН4). Алифатические соединения включают алканы и их производные, такие как жирные кислоты, алкены (напр. этилен) и алкины (напр. ацетилен).
Многие алифатические соединения горючи, что позволяет использовать их, в частности углеводороды (метан), спирты (этанол) в лабораторных горелках Бунзена и спиртовках; ацетилен используется в сварке.
Ациклические соединения
Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы, и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи. Различают две основные группы ациклических соединений — насыщенные (предельные) углеводороды, у которых все атомы углерода связаны между собой только простыми связями (напр., гомологический ряд метана), и ненасыщенные (непредельные) углеводороды, у которых между атомами углерода имеются, кроме простых (одинарных) связей, также двойные, тройные связи (напр., ряды этилена, ацетилена).
Алициклические соединения
Алициклические соединения — соединения, молекулы которых содержат один или несколько циклов, за исключением ароматических соединений. Типичными представителями алициклических соединений являются циклоалканы.
Примечания
Алифатические углеводороды — это что такое?
Алифатические углеводороды — это органические соединения, молекулы которых содержат только одинарную связь. К ним относятся алканы и циклопарафины, их особенности будут рассмотрены в нашем материале.
Общая формула алканов
Представители данного класса характеризуются общей формулой СпН2п+2. К парафинам относят все соединения, имеющие открытую цепь, где атомы соединяются между собой простыми связями. В связи с тем, что при нормальных условиях алифатические углеводороды это малоактивные соединения, они получили свое название «парафины». Выясним некоторые особенности строения представителей данного класса, характер связи в молекулах, отрасли применения.

Краткая характеристика метана
В качестве простейшего представителя данного класса можно упомянуть метан. Именно он начинает алифатический ряд углеводородов. Выявим его отличительные особенности.
Метан является при нормальных условиях газообразным веществом, не имеющим запаха и цвета. Образуется это соединение в природе при разложении без присутствия кислорода воздуха животных и растительных организмов. К примеру, он обнаружен в природном газе, поэтому в настоящее время в больших количествах используется в качестве топлива на производстве и в быту.
Какую химическую связь имеют эти углеводороды? Алифатические, предельные органические соединения являются ковалентными полярными молекулами.
Молекула метана имеет тетраэдрическую форму молекулы, тип гибридизации углеродных атомов в нем sp3, что соответствует валентному углу 109 градусов 28 минут. Именно по этой причине алифатические углеводороды — это химически малоактивные соединения.

Особенности гомологов метана
Помимо метана в природном газе и нефти содержатся другие углеводороды, которые имеют с ним сходное строение. Четыре первых представителя гомологического ряда парафинов находятся в газообразном агрегатном состоянии, имеют незначительную растворимость в воде.
По мере повышения величины относительной молекулярной массы наблюдается увеличение температур кипения и плавления СхНу. Между отдельными представителями ряда есть определенная разница СН2, которая называется гомологической разностью. Она является прямым подтверждением принадлежности соединения к этому органическому ряду.
Все алифатические углеводороды — это вещества, хорошо растворимые в органических растворителях.

Изомерия ряда
Для представителей ряда парафинов характерна изомерия углеродного скелета. Она объясняется возможностью пространственного вращения углеродного атома вокруг химических связей. Например, для соединения состава С4Н10 можно взять углеводород с прямым углеродным скелетом – бутаном. В качестве структурного изомера будет выступать 2-метилпропан, имеющий разветвленное строение.
Среди типичных химических свойств, характерных для парафинов, необходимо отметить реакции замещения. Насыщенность связей объясняет сложность протекания реакции, ее радикальный механизм. Для того чтобы получить галогенопроизводные алифатических углеводородов, необходимо провести реакцию галогенирования, протекающую при наличии УФ-излучения. Цепной характер этого взаимодействия наблюдается у всех представителей данного ряда. Образующиеся продукты называют галогенпроизводными. Они широко используются в химической промышленности в качестве органических растворителей.
Кроме того, все алифатические и ароматические углеводороды горят при наличии кислорода, образуя воду и углекислый газ. В зависимости от процентного содержания в молекуле углерода выделяется разное количество теплоты. Независимо от принадлежности к классу органических соединений, все процессы горения являются экзотермическими реакциями, используются в быту и промышленности.
Практическое применение имеет и дегидрирование метана (отщепление водорода). В результате этого процесса образуется ацетилен, являющийся ценным химическим сырьем.

Дихлорметан, хлороформ, тетрахлометан – жидкости, являющиеся отличными органическими растворителями. Хлороформ и йодоформ применяют в современной медицине. Разложение метана является одним из промышленных способов получения сажи, необходимой для изготовления типографской краски. Метан считается основным источником получения в химической промышленности газообразного водорода, идущего на производство аммиака, а также на синтез многочисленных органических веществ.
Ненасыщенные углеводороды
Непредельные алифатические углеводороды – это представители ряда этилена и ацетилена. Проанализируем их основные свойства и применение. Для алкенов характерно наличие двойной связи, поэтому общая формула ряда имеет вид СпН2п.
Учитывая непредельный характер этих веществ, можно отметить, что они вступают в реакции соединения: гидрирования, галогенирования, гидратации, гидрогалогенирования. Кроме того, представители ряда этилена способны к полимеризации. Именно эта их особенность делает представителей данного класса востребованными в современном химическом производстве. Полиэтилен и полипропилен – вещества, составляющие основу полимерной промышленности.
Ацетилен – первый представитель ряда, имеющего общую формулу СпН2п-2. Среди отличительных особенностей этих соединений можно выделить наличие тройной связи. Ее присутствие поясняет протекание реакций соединения с галогенами, водой, галогеноводородом, водородом. Если тройная связь в таких соединениях располагается в первом положении, то для алкинов характерна качественная реакция замещения с комплексной солью серебра. Именно эта способность является качественной реакцией на алкин, используется для обнаружения его в смеси с алкеном и алканом.
Ароматические углеводороды являются циклическими непредельными соединениями, поэтому не считаются алифатическими соединениями.
Заключение
Несмотря на различия по количественному составу, существующие у представителей предельных и непредельных алифатических соединений, они сходны по качественному показателю, содержат в молекулах углерод и водород. Отличия в количественном составе (различные общие формулы) у представителей насыщенных и ненасыщенных СхНу объясняют разницу в механизмах реакций получения различных продуктов.
Именно поэтому представители всех классов таких соединений вступают в реакции горения, образуя углекислый газ, воду, выделяя определенное количество тепловой энергии, что делает их востребованными в качестве топлива в быту и промышленности.
АЦИКЛИЧЕСКИЕ (АЛИФАТИЧЕСКИЕ) СОЕДИНЕНИЯ — это… Что такое АЦИКЛИЧЕСКИЕ (АЛИФАТИЧЕСКИЕ) СОЕДИНЕНИЯ?
АЦИКЛИЧЕСКИЕ (АЛИФАТИЧЕСКИЕ) СОЕДИНЕНИЯ
УГЛЕВОДОРОДЫ, НЕФТЬ И НЕФТЕПРОДУКТЫ. Нефть и нефтепродукты (бензин, керосин, мазут, дизельное топливо, смазочные масла и др.), в состав которых входят разнообразные углеводороды, циклические соединения, нафтеновые кислоты, деэмульгаторы и др., относятся к числу широко распространенных загрязнителей воды. Нефть и нефтепродукты попадают в водоемы со стоками с нефтепромыслов и нефтеперерабатывающих предприятий, с нефтеналивных судов, смываются талыми и дождевыми водами с территорий различных промышленных, сельскохозяйственных и транспортных предприятий, нефтебаз.
Нефть состоит из трех основных фракций, химический состав и соотношение которых во многом зависят от районов добычи. При попадании в водоемы маслянистые фракции покрывают воду устойчивой поверхностной пленкой, растворимые и эмульгирующиеся соединения распределяются в толще воды, а твердые частицы оседают на дно водоема и водную растительность. Кроме того, нефть способна захватывать и концентрировать другие загрязнения, например пестициды и тяжелые металлы.
Токсичность. Нефть и нефтепродукты действуют на водную фауну в нескольких направлениях:
маслянистые вещества, покрывая поверхность жабр тонкой пленкой, нарушают газообмен и приводят к асфиксии рыб;
водорастворимые соединения легко проникают в организм рыб;
при концентрации нефти 0,1 мг/л мясо рыб приобретает неустранимый “нефтяной” запах и привкус;
донные отложения нефти подрывают кормовую базу водоемов и поглощают кислород из воды.
Токсичность нефти и нефтепродуктов для рыб колеблется в широких пределах. Острое отравление большинства видов рыб наступает при концентрации эмульгированных нефтепродуктов 16 — 97 мг/л. Неочищенная бакинская нефть вызывает гибель осетровых при 100 — 200 мг/л, а при 50 мг/л отмечается снижение их роста и развития. Из костистых рыб к бакинской нефти более чувствительны молодь жереха и судака, для которых токсические концентрации ее превышают 60 мг/л. Более устойчивы сом, сазан и вобла. Они гибнут при концентрациях, превышающих 200 мг/л. Среднесмертельные концентрации нефтяных фракций, в которых преобладают толуол, бензол и ксилол, составили для карасей 19,8 мг/л (экспозиция 48 ч), а молодь форели погибала в этой концентрации в течение нескольких часов. Бензин и дизельное топливо токсичны для молоди форели в концентрациях 40 — 100 мг/л.
Токсичность водорастворимых нефтепродуктов также зависит от химического состава. Многокомпонентные фракции вызывают острое отравление смариды и морского языка в концентрациях 25 — 29 мг/л и подострое отравление 15 — 19 мг/л. При содержании в них нафтеновых кислот до 65% гибель рыб наступала в концентрациях 0,03 — 0,1 мг/л (Н. Д. Мазманиди и др.).
Деэмульгаторы нефти (Азербайджан I и II) вызывают гибель большинства рыб и беспозвоночных в концентрациях свыше 0,5 — 1 мг/л, “диссольван 4411 — 4422” и нейтрализованный черный контакт (НЧК) — более 100 мг/л. Хроническое отравление карпов (экспозиция 90 дней) наступает при действии НЧК в концентрациях выше 2,5 мг/л, “темного полимера> — более 6 мг/л и “диссольвана 4411 — 4422” выше 0,8 г/л.
Для дафний губительны концентрации выше 0,1 и хирономид — выше 1,4 мг/л.
При длительном воздействии углеводороды нефти могут накапливаться до токсического уровня в жировой ткани, внутренних органах и мышцах рыб, а также способны передаваться по трофической цепи. Потребление в пищу таких продуктов, особенно содержащих канцерогенные бензпирены, опасны для здоровья человека.
Симптомы и патоморфологические изменения. При остром отравлении рыб нефтью преобладают признаки расстройства функций нервной системы и нарушения дыхания, вызванного локальным действием нефти на жабры. В ранних стадиях интоксикации рыбы очень подвижны, стремятся.выпрыгнуть из воды, затем перевертываются на бок, теряют равновесие, совершают круговые движения, дыхание учащенно в 1,5 — 2 раза. Затем наступает фаза угнетения, рыбы переходят в наркотическое состояние и гибнут с явлениями паралича центра дыхания.
Трупы погибших рыб тусклые, ослизнены, с признаками очагового дерматита, проявляющегося пятнистой гиперемией кожи, распадом и слущиванием эпидермиса и иногда образованием язв. Вследствие повреждения роговицы глаза может наступить слепота. В жабрах отмечают отек лепестков, гиперемию капилляров, набухание, дистрофию, некробиоз и очаговое слущивание респираторного эпителия и слизистых клеток. Поражение внутренних органов ограничивается застойной гиперемией и зернисто-вакуольной дистрофией клеток паренхимы.
При подостром и хроническом отравлении в жабрах преобладает набухание и гиперплазия эпителия. В паренхиматозных органах (печени, почках, поджелудочной железе) ярко выраженные некробиотические изменения паренхиматозных клеток сочетаются с пролиферативной реакцией, выражающейся увеличением количества макрофагов и меланоцитов селезенки и почек. Во всех случаях погибшие рыбы имеют сильный “нефтяной” запах и привкус. В крови отмечают снижение уровня гемоглобина и количества эритроцитов, лейкоцитов, лимфо- и моноцитопению. Сходные патоморфологические изменения вызывают деэмульгаторы.
Диагноз ставят на основании клинико-анатомических признаков отравления, определения нефтепродуктов в органах рыб, а также органолептических показателей. Нефтепродукты в воде и органах рыб определяют люминесцентными, колориметрическими, спектрофотометрическими и хроматографическими методами. Пробой варки запах нефтепродуктов выявляется на уровне 0,1 мг/кг и выше. Степень загрязнения водоема нефтью можно оценить также визуально (см. ).
|
Внешний вид нефтяной пленки на поверхности водоема и приблизительное количество нефтепродуктов |
||
|
Балл |
Внешний вид |
Количество нефтепродуктов, л/га |
|
1 |
Отсутствие пленок и пятен |
— |
|
2 |
Отдельные пятна и серые пленки на поверхности воды |
0,37 — 0,7 |
|
3 |
Пятна, ирридирующие (радужные) пленки нефти на поверхности воды; отдельные промазки по берегам и на прибрежной растительности |
1,45 — 2,94 |
|
4 |
Ирридирующая пленка с коричневыми пятнами на поверхности воды; берега с растительностью вымазаны нефтью |
9.8 |
|
5 |
Коричневая пленка нефти (видна и при сильном волнении), берег и прибрежные сооружения вымазаны нефтью |
Больше 19,5 |
|
Загрязнение на уровне 3 баллов и выше недопустимо. |
||
Профилактика заключается в периодическом контроле чистоты водоисточников, установлении защитных приспособлений, препятствующих распространению нефти по поверхности воды; удалении загрязненной жесткой растительности, очистке ложа прудов от ила и нефтяных осадков; увеличении проточности воды или пересадке рыб в чистый водоем.
Рыбохозяйственные ПДК нефти и масел в пресноводных водоемах 0,001 мг/л, диспергатора ДН-75 — 0,015 мг/л, НФ диспергатора — 0,25 мг/л, диспергента 124-И и диспергента 124-Д — отсутствие, диссольвана 4411 0,9 мг/л, НЧК 0,01 мг/л; в морской воде нефтепродуктов 0,05 мг/л, диспергаторов ДН-75 и ОМ-6 0,005 мг/л.
СПИРТЫ, ЭФИРЫ, ГАЛОГЕНИДЫ попадают в водоемы из предприятий химической и пищевой промышленности.
Токсичность. Спирты, эфиры и галогениды малотоксичны для рыб. Они обладают четко выраженным наркотическим действием. Рыбы впадают в состояние наркоза при следующих концентрациях: метилового спирта — 31,7 г/л, этилового спирта — 13 г/л, пропилового спирта — 2,8 — 5,6 г/л, бутилового спирта — 1 — 1,6 г/л, амилового спирта — 1,65 г/л, этилового эфира — 1,5 — 2,4 г/л, дихлорэтилового эфира — 302,0 — 646,0 мг/л, хлороформа — более 60 мг/л, дихлорэтана — 140 — 220 мг/л, гексахлорэтана — 0,98 мг/л, тетрахлорэтилена — 13 мг/л, трихлорэтилена — 45 мг/л.
Симптомы и патоморфологические изменения. Наркотическое действие проявляется возбуждением рыб, которое вскоре сменяется резким угнетением, сопровождающимся замедлением подвижности рыб, потерей равновесия, замедлением дыхательных движений и гибелью от паралича центра дыхания.
Диагноз ставят по характерной клинической картине, а также определением их содержания в воде и рыбе методами, применяемыми в медицине.
Профилактика основывается на общих принципах. Рыбохозяйственная ПДК бутилового спирта — 0,03 мг/л, изобутилена — 0,025, метиленхлорида — 9,4, метилового спирта — 0,1 мг/л.
АЛЬДЕГИДЫ И КЕТОНЫ
Болезни рыб: Справочник. — М.. Г. В. Васильков, Л. И. Грищенко, В. Г. Енгашев и др.; Под ред. В. С. Осетрова.. 1989.
Алифатические соединения — Википедия
Материал из Википедии — свободной энциклопедии
Алифатические соединения в органической химии — соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи (ациклические соединения) или замкнутые (алициклические или циклоалифатические соединения).[1] Иногда к алифатическим соединениям относят только ациклические, а алициклические выделяют в отдельный класс.[2]
Общая информация
В органической химии соединения разделяются на два класса: ароматические — содержащие бензольное кольцо и другие подобные замкнутые структуры, и алифатические соединения, которые их не содержат. В алифатических соединениях атомы углерода могут соединяться между собой в прямые цепочки, разветвлённые цепочки или кольца (в этом случае они называются алициклические соединения). Атомы углерода могут соединяться одинарными связями (алканы), двойными связями (алкены), и тройными связями (алкины). Кроме водорода к углеродной цепочке могут присоединяться и другие элементы, наиболее распространённые — кислород, азот, сера, галогены.
Простейшим алифатическим соединением является метан (СН4). Алифатические соединения включают алканы и их производные, такие как жирные кислоты, алкены (напр. этилен) и алкины (напр. ацетилен).
Многие алифатические соединения горючи, что позволяет использовать их, в частности углеводороды (метан), спирты (этанол) в лабораторных горелках Бунзена и спиртовках; ацетилен используется в сварке.
Ациклические соединения
Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы, и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи. Различают две основные группы ациклических соединений — насыщенные (предельные) углеводороды, у которых все атомы углерода связаны между собой только простыми связями (напр., гомологический ряд метана), и ненасыщенные (непредельные) углеводороды, у которых между атомами углерода имеются, кроме простых (одинарных) связей, также двойные, тройные связи (напр., ряды этилена, ацетилена).
Алициклические соединения
Алициклические соединения — соединения, молекулы которых содержат один или несколько циклов, за исключением ароматических соединений. Типичными представителями алициклических соединений являются циклоалканы.
Примечания
Классы соединений Алифатические соединения
1. Ациклические алканы, их галоген- и кислородсодержащие соединения
1.1. Ациклические радикалы
Название одновалентных радикалов производится от названий алканов, алкенов и алкинов путем замены суффиксов »-ан» на »-ен», »-ин» на »-ил», »-енил» на »-инил».
Правила ИЮПАК разрешают использование префиксов »изо-»,
»втор-», »нео-», »трет-».
При обозначении положения заместителей в цепи радикала атом, которым он присоединяется к основной части молекулы, получает наименьший из возможных номеров (т.е. этот атом получает номер 1) и соблюдают обычный порядок: наибольшая насыщенность, замещенность или длина.
Названия некоторых радикалов:
СН3— – метил
-СН2— – метилен (или метилиден)
-СН= – метин (или метилидин)
Н3С-СН-СН3— – изопропил
НС С-
– этинил.
С-
– этинил.
1.2. Галогенпроизводные
Применяется заместительная номенклатура с использованием в качестве префиксов названий »фтор-», »хлор-», »бром-» и »иодо-». Однако для простых соединений (СН3I, С2Н5Cl) используют радикально-функциональные названия – метилиодид и этилхлорид. Эти названия показывают главную, по существу единственную, химическую особенность соединения.
П остроение
формулы по названию:
остроение
формулы по названию:
1,1,1-трифтор-2-хлор-2-бромэтан
В основе лежит углеводород – этан
У первого углеродного атома три атома водорода замещены на три атома фтора, у второго углеродного атома один атом водорода замещен на атом хлора, а другой – атомом бром:

фторотан
1.3. Спирты
Если ОН является главной группой, то спирты обозначают характерным суффиксом »-ол», в противном случае – префиксом »гидрокси», например: СН3-СН2-ОН – этанол,

l-2-изопропил-5-метилциклогексанол-1(ментол)

2-метил-3-гидрокси-4,5-ди (гидроксиметил)-пиридина гидрохлорид
(пиридоксина гидрохлорид)
Алифатические соединения с двумя и большим числом гидроксильных групп обозначают, прибавляя к названию алкана суффикс (окончание) – диол, – триол и т.д., указывая их с помощью цифр. Например:
 пропандиол-1,3
пропандиол-1,3
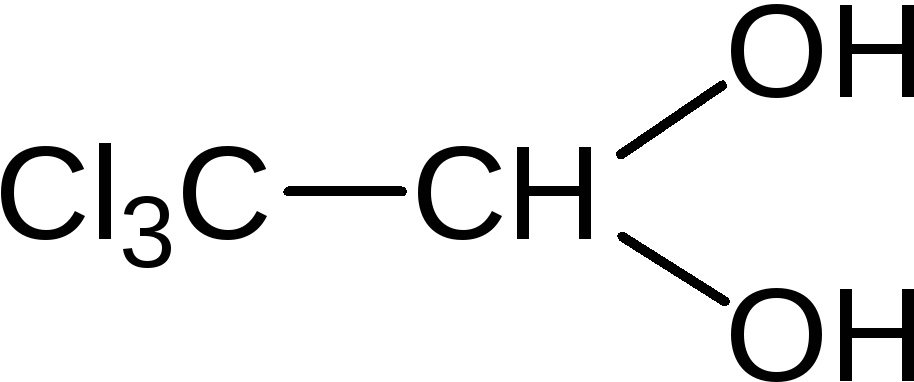
2,2,2-трихлорэтандиол-1,1 (хлоралгидрат)
1.4. Простые эфиры
В несложных случаях применимы радикально-функциональные названия, например:
Н5С2 – О – С2Н5 – диэтиловый эфир
Название префикса для этилового заместителя RО- образуется добавлением к названию радикала R суффикса »-окси», например: -ОСН3 – метокси.
Построение формулы по названию:
 -диметиламиноэтилового
эфира бензгидрола гидрохлорид (димедрол).
-диметиламиноэтилового
эфира бензгидрола гидрохлорид (димедрол).
В образовании простой эфирной связи участвуют два спирта:
 -диметиламиноэтанол
-диметиламиноэтанол

 и
бензгидрол (дифенилметанол)
и
бензгидрол (дифенилметанол)
Тогда формула препарата будет записана так:

Алифатические углеводороды Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan. |
 |
| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].