Окислительные свойства азотной кислоты | Дистанционные уроки
02-Янв-2015 | Нет комментариев | Лолита Окольнова
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.

автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV.
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5

Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO3 + Ме → нитрат + H2O + продукт восстановленного азота
Два нюанса:
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:

Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH4NO3 или N2O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn. Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N 2O, а при взаимодействии с разб. азотной кислотой NH4NO3.
4Ba + 10HNO3(конц.) → 4Ba(NO3)2 + 5H2O + N2O↑
4Ba + 10HNO3(разб.) → 4Ba(NO3)2 + 3H2O + NH4NO3
8Li + 10HNO3(конц.) → 8LiNO3 + 5H2O + N2O↑
8Li + 10HNO3(разб.) → 8LiNO3 + 3H2O + NH4NO3
8Al + 30HNO3(конц.) (t)→ 8Al(NO3)3 + 15H2O + 3N2O↑
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO. Ну а с конц. азотной NO2:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
Fe + 6HNO3(конц.) (t)→ Fe(NO3)3 + 3H2O + 3NO2↑
Fe + 4HNO3(разб.) → Fe(NO3)3 + 2H2O + NO↑
(обратите внимание, что железо окисляется до высшей степени окисления)
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO↑
Если тяжело сразу понять всю логичность выбора, вот таблица:

Азотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ (NO
неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO3(конц.) → соединение неметалла в высшей степени окисления + NO2
C + 4HNO3(конц.) → CO2↑ + 2H2O + 4NO2↑
3C + 4HNO3(разб.) → 3CO2↑ + 2H2O + 4NO↑
(угольная кислота не образуется, так как она не стабильна)
P + 5HNO3(конц.) → H3PO4 + H2O + 5NO2↑
3P + 5HNO3(разб.) + 2H2O → 3H3PO4 + 5NO↑
B + 3HNO3(конц.) → H3BO3 + 3NO2↑
B + HNO3(разб.) + H2O → H3BO3 + NO↑
S + 6HNO3(конц.) → H2SO4 + 2H2O + 6NO2↑
S + 2HNO3(разб.) → H2SO4 + 2NO↑
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
2HNO3(конц.) + H2S → S↓ + 2NO2 + 2H2O
H2S + 8HNO3(конц.) → H2SO4 + 8NO2↑ + 4H2O
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
CuS + 8HNO3(конц.) → CuSO4 + 4H2O + 8NO2↑
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO3:
10HNO3(конц.) + I2 (t)→ 2HIO3 + 10NO2↑ + 4H2O
10HNO3(разб.) + 3I2 (t)→ 6HIO3 + 10NO↑ + 2H2O
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
NaCl(тв.) + HNO3(конц.) → HCl↑ + NaNO3
NaF(тв.) + HNO3(конц.) → HF↑ + NaNO3
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO2:
8HNO3(конц.) + 6KBr(тв.) → 3Br2 + 4H2O + 6KNO3 + 2NO2↑
4HNO3(конц.) + 2NaI(тв.) → 2NaNO3 + 2NO2↑ + 2H2O + I2↓
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
7HNO3(конц.) + NaI → NaNO
То же самое происходит при взаимодействии с иодо- и бромоводородами:
2HNO3(конц.) + 2HBr → Br2 + 2NO2↑ + 2H2O
6HNO3(конц.) + HI → HIO3 + 6NO2↑ + 3H2O
Еще на эту тему:
Обсуждение: «Окислительные свойства азотной кислоты»
(Правила комментирования)distant-lessons.ru
Азотная кислота химические свойства | Дистанционные уроки
19-Окт-2012 | комментария 4 | Лолита Окольнова
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:

4HNO3 = 4NO2 + 2h3O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
Почему? Да потому что азот N проявляет в этом соединении степень окисления +5, что соответствует номеру его группы. Т.е. сам азот N может только понизит свою степень окисления — восстановиться. Значит, по химическим свойствам азотная кислота — сильный окислитель.
S + HNO3 = NO2 + SO2 + h3O
окислитель N(+5) +1e(-) = N(+4) — восстановление
восстановитель S(0) -4e(-) =S(+4) — окисление
S +4 HNO3 = 4NO2 + SO2 + 2h3O
Это просто один из примеров таких реакций. Продукт реакции — оксид азота (IV) — NO2, не единственно возможный, есть еще варианты, и их образование подчиняется определенным правилам.
Химические свойства азотной кислоты
Правила взаимодействия азотной кислоты и металлов
1 правило — правило концентрации
Концентрированная азотная кислота восстанавливается до оксида азота (IV) — NO2
Zn + 4HNO3 (конц) = Zn(NO3)2 + 2NO2 + 2h3O
Разбавленная азотная кислота восстанавливается до оксида азота (II) — NO
3Zn + 8HNO3 (разб) = 3Zn(NO3)2 + 2NO + 4h3O
2 правило — правило металла
Смотрим ряд активности металлов!
- С золотом (Au) и платиной (Pt)азотная кислота не реагирует ни при каких условиях.
- Азотная кислота и металлы, стоящие в ряду напряжений после водорода — применимо правило 1 — правило концентрации:
Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2h3O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4h3O - Азотная кислота и металлы, стоящие в ряду напряжений до водорода: вариантов продуктов немало, есть закономерность:

Все реакции азотной кислоты — окислителя ( с металлами и неметаллами) изучаем ЗДЕСЬ!
Соли азотной кислоты
(нитраты)
Здесь мы рассмотрим вопрос реакций разложения нитратов
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
2KNO3 = 2KNO2 + O2
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
2Сu(NO3)2 = 2CuO + 4NO2 + O2
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
- Разложение нитратов металлов правее ртути — до металла:
2AgNO3 =2 Ag + 2NO2 + O2
- Разложение нитратов металлов правее ртути — до металла:
- Нитрат аммония разлагается до образования оксида азота(I) — N2O:
Nh5NO3 = N2O + 2h3O
На нитрат-ионы NO3(-) нет качественных реакций — все соли азотной кислоты очень хорошо растворимы в воде.
Еще на эту тему:
Обсуждение: «Азотная кислота химические свойства»
(Правила комментирования)distant-lessons.ru
Азотная кислота. Cвойства азотной кислоты
 Концентрированная азотная кислота
Концентрированная азотная кислотаАзотная кислота
Азотная кислота (HNO3) — одна из сильных одноосновных кислот с резким удушливым запахом, чувствительна к свету и при ярком освещении разлагается на один из оксидов азота (ещё называемый бурым газом — NO2 ) и воду. Поэтому её желательно хранить в тёмных ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо, поэтому можно хранить в соответствующих металлических ёмкостях.
Азотная кислота — является сильными электролитом как многие кислоты) и очень сильный окислитель. Её часто используют при реакциях с органическими веществами.
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Азотная кислота как и озон может образовываться в атмосфере при вспышках молнии. Азот, который составляет 78% состава атмосферного воздуха, реагирует с атмосферным кислородом, образуя оксид азота NO. При дальнейшем окислении на воздухе этот оксид переходит в диоксид азота (бурый газ NO2), который реагирует с атмосферной влагой (облаками и туманом), образуя азотную кислоту . Но такое малое количество совершенно безвредно для экологии земли и живых организмов.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):
HNO3 = 2NO2 +O2 + 2H2O — выделяется бурый газ (NO2), кислород и вода.
 Азотная кислота
Азотная кислота(при нагревании выделяется бурый газ)
Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
С металлами железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием (Ir), натрием (Na) — не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
Со всеми остальными металлами при химической реакции выделяется бурый газ
(NO2). Например, при химической реакции с медью (Cu):
4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O
С неметаллами, например с фосфором:
5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
— разложения солей азотной кислоты
В зависимости от растворённого металла разложение соли при температуре происходит следующими образом:
Любой металл (обозначен как Me) до магния (Mg):
MeNO3 = MeNO2 + O2
Любой металл от магния (Mg) до меди (Cu):
MeNO3 = MeO + NO2 + O2
Любой металл после меди (Cu):
MeNO3 = Me + NO2 + O2
— азотная кислота разбавленная:
При взаимодействии с щелочно-земельными металлами, а также цинком (Zn), железом (Fe), она окисляется до аммиака
(NH3) или же до аммиачной селитры (NH4NO3). Например при реакции с магнием (Mg):
10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Но может также и образовываться закись азота (N2O), например , при реакции с магнием (Mg):
10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
С остальными металлами реагирует с образованием оксида азота (NO), например, растворяет серебро (Ag):
2HNO3 разбавл. + Ag = AgNO3 + NO + H2O
Аналогично реагирует с неметаллами, например с серой:
2HNO3 разбавл. + S = H2SO4 + 2NO — окисление серы до образования серной кислоты
и выделения газа оксида азота.
— химическая реакция с оксидами металлов, например, оксид кальция:
2HNO3 + CaO = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода
— химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
2HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода — реакция нейтрализации
— химическая реакция с солями, например с мелом:
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 — образуется соль (нитрат кальция) и другая кислота (в данном случае образуется угольная кислота, которая распадается на воду и углекислый газ).
www.kristallikov.net
5.Взаимодействие металлов с азотной кислотой (разб. И конц.).
Окислителем в азотной кислоте любой концентрации является нитрат-ион (N5+). На сильные окислительные свойства нитрат-иона указывают высокие положительные значения ОВПОТ систем, например:
NO3— + 2H+ +e NO2+ H2O Eo = +0,76B
NO3— + 4H+ + 3e NO + 2H2O Eo = +0,96B
Катион водорода не может конкурировать с таким сильным окислителем, как нитрат-ион, поэтому водород не выделяется при взаимодействии металлов с азотной кислотой. Азотная кислота окисляет все металлы, кроме металлов платиновой группы, золота и титана.
N5+(NO3—) + ne → N4+( NO2),N2+( NO),N+( N2O),No(N2),N3-(NH3).
Аммиак в растворе азотной кислоты образует нитрат аммония: NH3 + НNO3 = NH4NO3. Любой из этих продуктов может образоваться при действии на металлы азотной кислоты.
Схематично реакцию можно представить следующим образом:
Ме + НNO3(р.,к.) → Ме(NO3)х + H2O + (NO2 NO, N2O, N2, NH4 NO3)
Исключение составляют металлы, оксиды которых обладают кислотными свойствами (Sn, Ge). С этими металлами реакция идет до образования не солей, а кислот:
Sn + 4НNO3 (конц.) = Н2SnO3↓ + 4NO2 + H2O
3Sn + 4НNO3(разб.)+H2O = 3Н2SnO3↓ + 4NO
Металлы Продукты вос-я Продукты вос-я
НNO3(конц.) НNO3(разб.)
Акт.металлы N2O N2O, N2, NH4 NO3
(до Zn вкл.)
Неакт.мет. NO2 NO
(ниже Zn)
Следует иметь в виду, что предлагаемая схема является упрощенной и при необходимости получения более строгой информации о поведении конкретного металла в растворе азотной кислоты, рекомендуется обращаться к специальной литературе (Н.Реми, Химия металлов в 2-х томах).
Разбавленная азотная кислота является более сильным окислителем, чем концентрированная, т.к. реакция протекает в более благоприятной среде ионов Н+, образующихся за счет сильной диссоциации кислоты в разбавленном растворе.
Необходимо помнить, что, как очень сильный окислитель, азотная кислота окисляет многие металлы до высоких степеней окисления (аналогично концентрированной серной кислоте, т.е. FeFe3+, CrCr3+, SnSn4+ и т.д.).
Примеры реакции:
Холодная концентрированная азотная кислота пассивирует некоторые металлы аналогично серной кислоте (железо, хром, никель, алюминий, кобальт, бериллий), что позволяет транспортировать эти кислоты в железных цистернах предварительно пассивированных этими кислотами. Реакцию пассивации азотной кислотой можно записать следующим образом:
Fe + 4НNO3(конц.) = Fe2O3 + 2Н2О + NО2 (на холоду).
Азотная кислота окисляет все металлы, за исключением золота, металлов платиновой группы и титана.
Взаимодействие металлов с «царской водкой»- (3V НСl + 1V HNO3)
Платина, золото и другие благородные металлы могут быть окислены «царской водкой». Химическая сущность процесса следующая:
Реакция между азотной и соляной кислотами приводит к образованию неустойчивого хлорида нитрозила, который распадается с образованием атомарного химически активного хлора:
3HCl + HNO3 = Cl2 + 2H2O + NOCl (NO +Cl)
NO3— + 4H+ + 3e NO + 2H2O x1
Cl— — e Clox3
NO3— + 4H+ + 3Cl— = NO + 2H2O +3Clo
Атомарный хлор окисляет металл с образованием хлорида металла в высшей степени окисления:
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
NO3— + 4H+ + 3e NO + 2H2O x1
Auo — 3e Au3+x1
NO3— + 4H+ + Auo = NO + 2H2O + Au3+
studfile.net
Особенности взаимодействия серной и азотной кислот с металлами
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления (S+6). Концентрированная H2SO4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO42- (0,36 В). В связи с этим, сконцентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H2SO4 (конц.) соль + вода + продукт восстановления H2SO4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H2S, S и SO2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:
Алюминий (Al) и железо (Fe) не реагируют с холодной концентрированной H2SO4, покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag, Au, Ru, Os, Rh, Ir, Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe0 → Fe3+,
Cr0 → Cr3+,
Mn0 → Mn4+,
Sn0 → Sn4+
Свинец (Pb) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb(HSO4)2.
Примеры:
Активный металл
8 A1 + 15 H2SO4(конц.)→4A12(SO4)3 + 12H2O + 3H2S
4│2Al0 – 6e— → 2Al3+ — окисление
3│ S6+ + 8e → S2-– восстановление
Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
1│ 2Cr0 – 6e →2Cr3+— окисление
1│ S6+ + 6e → S0 — восстановление
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3SO2
1│ 2Bi0 – 6e → 2Bi3+ – окисление
3│ S6+ + 2e →S4+ — восстановление
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3— имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород H2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации). Процесс протекает по схеме:
Me + HNO3 соль + вода + продукт восстановления HNO3Продукты восстановления HNO3:
Обычно при взаимодействии азотной кислоты с металлом образуется смесь продуктов восстановления, но как правило, один из них является преобладающим. Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Концентрированная азотная кислота
Концентрированным считают раствор кислоты плотностью ρ > 1,25 кг/м3, что соответствует
концентрации > 40%. Независимо от активности металла реакция взаимодействия с HNO3 (конц.) протекает по схеме:
Me + HNO3(конц.) → соль + вода + NO2
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr,Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
Примеры
Активный металл
Al + 6HNO3(конц.) → Al(NO3)3 + 3H2O + 3NO2↑
1│ Al0 – 3e → Al3+ — окисление
3│ N5+ + e → N4+ — восстановление
Металл средней активности
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3H2O + 3NO↑
1│ Fe0 – 3e → Fe3+ — окисление
3│ N5+ + e → N4+ — восстановление
Металл малоактивный
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
1│ Ag0 – e →Ag+ — окисление
1│ N5+ + e → N4+ — восстановление
Разбавленная азотная кислота
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
Примеры:
Активный металл
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
8│ Al0 – 3e → Al3+ — окисление
3│ N5+ + 8e → N3- — восстановление
Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония NH4NO3:
NH3 + HNO3 → NH4NO3.
Металл средней активности
10Cr + 36HNO3(разб.) → 10Cr(NO3)3 + 18H2O + 3N2
10│ Cr0 – 3e → Cr3+ — окисление
3│ 2N5+ + 10e → N20 — восстановление
Кроме молекулярного азота (N2) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I) – N2O. В уравнении реакции нужно писать одно из этих веществ.
Металл малоактивный
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO
3│ Ag0 – e →Ag+ — окисление
1│ N5+ + 3e → N2+ — восстановление
«Царская водка»
«Царская водка» (ранее кислоты называли водками) представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» — золото. Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила – NOCl:
HNO3 + 3 HCl → Cl2 + 2 H2O + NOCl
Хлорид нитрозила далее разлагается по схеме:
2 NOCl → 2 NO + Cl2
Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
Реакции окисления золота и платины протекают согласно следующим уравнениям:
Au + HNO3 + 4 HCl → H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O
На Ru, Os, Rh и Ir «царская водка» не действует.
chem56.blogspot.com
|
|
Азотная кислота, HNO3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов химической промышленности. Структурная формула: Физические и химические свойства. Плотность безводной азотной кислоты 1522 кг/м3, tпл — 41,15°С, tкип 84° С. С водой смешивается во всех отношениях, причём образует азеотропную смесь, содержащую 69,2% азотной кислоты с tкип 121,8°C. Известны кристаллогидраты HNO3×H2O с tпл —37,85° С и HNO3×3H2O c tпл—18,5°С. В отсутствии воды азотная кислота неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO3 = 4NO2 + 2H2O + O2), причём выделяющейся двуокисью азота окрашивается в жёлтый, а при высоких концентрациях NO2 — в красный цвет. Азотная кислота — сильный окислитель, окисляет серу до серной кислоты, фосфор — до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с азотной кислотой. С большинством металлов азотная кислота взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O. Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной азотной кислоте, устойчивы к воздействию концентрированной азотной кислоты, что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную азотную кислоту в стальных ёмкостях. Смесь концентрированной азотной кислоты и соляной кислоты (1:3), называется царской водкой, растворяет даже золото и платину. Органические соединения под действием азотной кислоты окисляются или нитруются, причём в последнем случае остаток азотной кислоты — нитрогруппа — NO2+ замещает в органических соединениях водород (см. Нитрование). Соли азотной кислоты называютя нитратами, а соли с Na,K, Са, NH4+ также селитрами. Получение и применение. В 13 в. было описано получение азотной кислоты нагреванием калиевой селитры с квасцами, железным купоросом и глиной. В середине 17 в. И. Р. Глаубер предложил получать азотную кислоту при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO3 + H2SO4 = HNO3 + KHSO4 До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3. Современный способ производства азотной кислоты основан на каталитическом окислении аммиака кислородом воздуха. Основные стадии процесса: контактное окисление аммиака до окиси азота: 4NH3 + 5O2 = 4NO + 6H2O; окисление окиси азота до двуокиси и поглощение смеси так называемых «нитрозных газов» водой: 2NO + O2 = 2NO2; 3NO2 + H2O = 2HNO3+NO. Смесь аммиака (10 — 12% ) с воздухом пропускают через нагретую до 750 — 900° С сетку катализатора, которым служат сплавы платины — тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 — 95% Pt, 10 — 5% Rh). Используют также двухступенчатый катализатор (1-я ступень — платиноидная сетка, 2-я — неплатиновый катализатор), что позволяет на 25 — 30% сократить расход платины. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1 мсек, иначе образовавшаяся окись азота разлагается. Вторая стадия процесса — окисление NO до N02и растворение NO2 в воде — может быть проведена при атмосферном давлении, под давлением до 1 Мн/м2 (10 кгс/см2) или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой. Получают азотную кислоту с концентрациями 45 — 49% или (при использовании давления) 55 — 58% . Дистилляцией таких растворов может быть получена азотная кислота азеотропного состава. Более концентрированную кислоту (до 100% ) получают перегонкой растворов азотной кислоты с концентрированной H2SO4или прямым синтезом — взаимодействием N2O4 с водой (или разбавленной азотной кислоты) и кислородом: 2N2O4 + 2H2O + O2 = =4HNO3. В СССР производят 97 — 98%-ную азотную кислоту. Важнейшие области применения азотной кислоты — производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей. В органическом синтезе широко применяют смесь концентрированной азотной кислоты и серной кислоты — «нитрующую смесь». Азотную кислоту используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива. В металлургии азотную кислоту применяют для травления и растворения металлов, а также для разделения золота и серебра. Вдыхание паров азотной кислоты приводит к отравлению, попадание азотной кислоты (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание азотной кислоты в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5. Концентрированная азотная кислота при соприкосновении с органическими веществами Вызывает пожары и взрывы.
Лит.: Атрощенко В. И., Каргин С. И., Технология азотной кислоты, М. — Л., 1949; Миниович М. А., О современном состоянии и о перспективах развития производства разбавленной азотной кислоты, «Журнал прикладной химии», 1958, т. 31, в. 8; Миниович М. А., Азотная кислота, КХЭ, т. 1, М., 1961, с. 74-79. Э. Б. Шиллер. |
www.xumuk.ru
7.3. Взаимодействие металлов с кислотами
Почти все металлы реагируют с кислотами, образуя соли. Характер взаимодействия металла с кислотой зависит от активности металла, его свойств и концентрации кислоты.
При действии
кислоты на металл роль окислителя играет
или ион водорода ( ,
разбавленная
,
разбавленная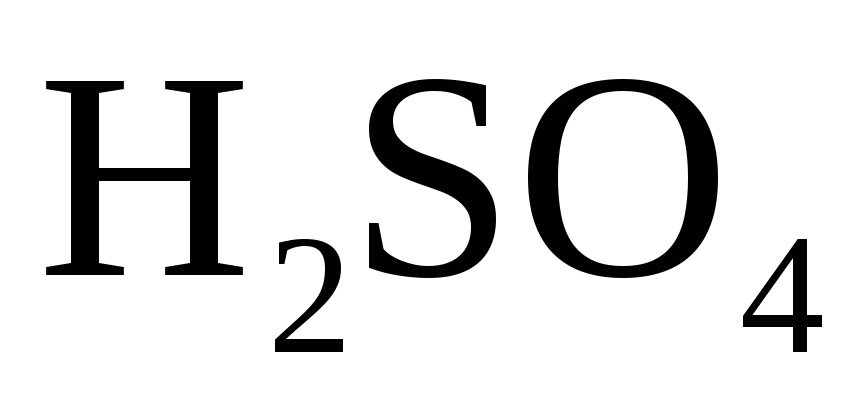 ),
или кислотный остаток кислородсодержащей
кислоты (
),
или кислотный остаток кислородсодержащей
кислоты ( ,
,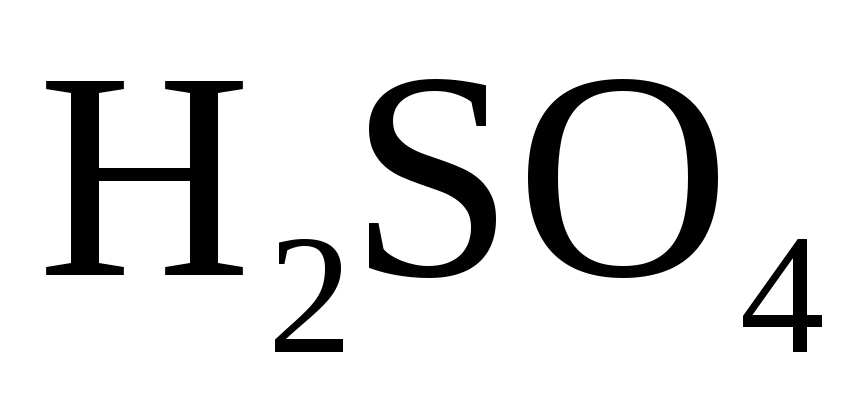 – концентрированная).
– концентрированная).
Взаимодействие металлов с соляной кислотой.
С соляной кислотой взаимодействуют металлы, стоящие в ряду напряжений до водорода.
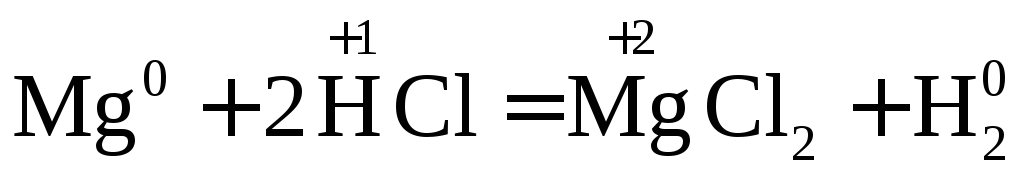 .
.

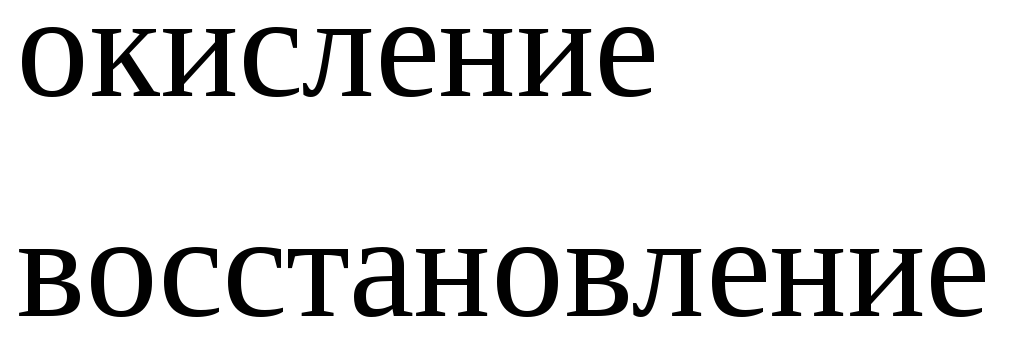
Вывод: окислителем являются катионы водорода, которые принимают электроны от атома металла.
Взаимодействие металлов с азотной кислотой
Концентрированная
и разбавленная азотная кислота
окисляет
металлы без выделения водорода, так как
в ней окислителем является нитрат-ион
( ).
).
Восстановление азотной кислоты различной концентрации при взаимодействии с металлами разной активности можно представить в виде схемы.








Согласно схеме степень окисления азота при взаимодействии кислоты с металлами меняется от +5 до -3.
Рассмотрим несколько примеров.
 .
.
Коэффициенты в уравнении реакции подбираем ионно-электронным методом.

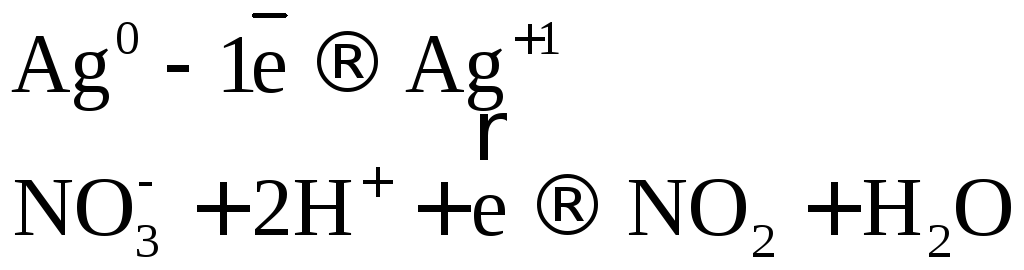


или 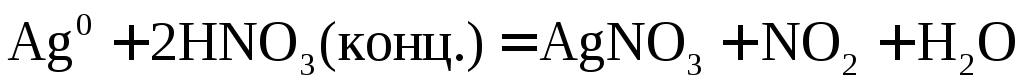 .
.
 .
.
Разбавленная
азотная кислота при взаимодействии с
неактивными металлами восстанавливается
до 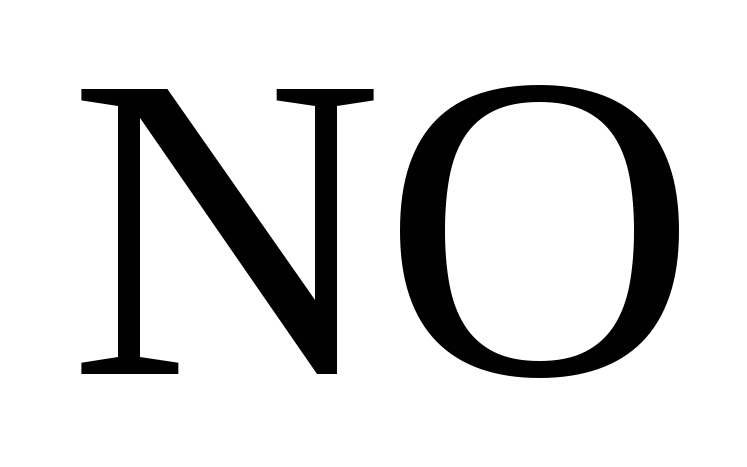 ,
образуется соль
,
образуется соль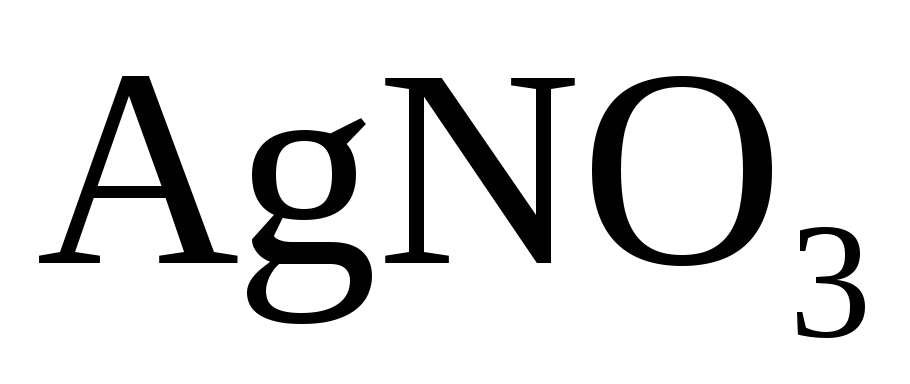 и вода.
и вода.

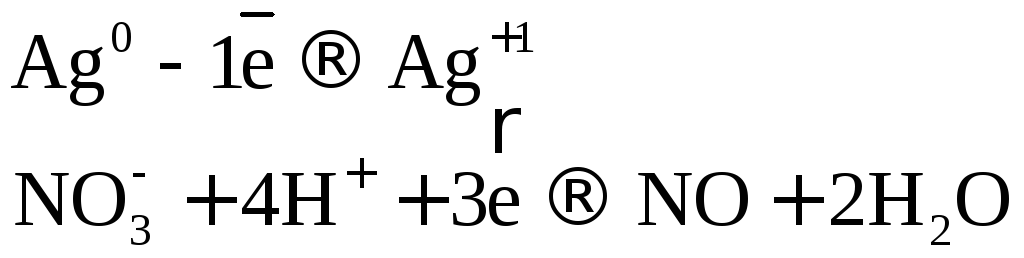


или 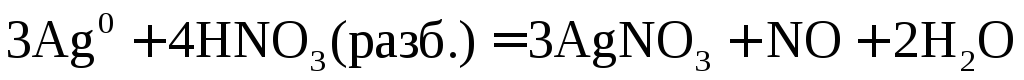 .
.
 .
.
При взаимодействии
активных металлов с разбавленной азотной
кислотой образуется соль, вода и 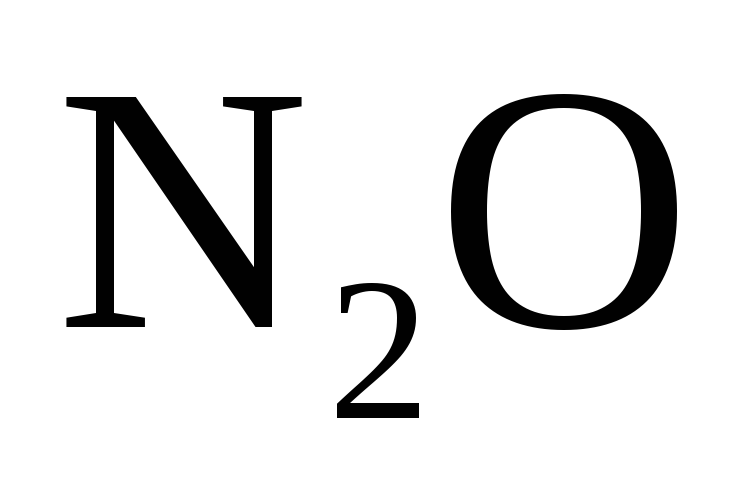 или
или .
.



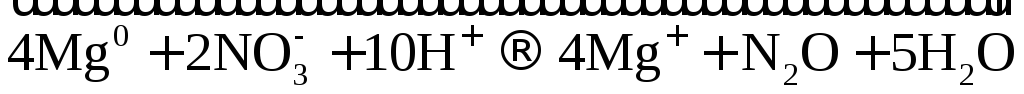
или  .
.
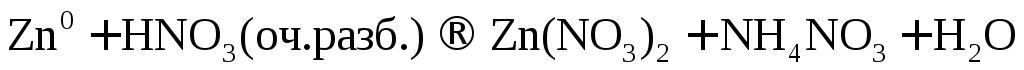 .
.
При взаимодействии активных металлов с очень разбавленной азотной кислотой образуется соль, вода и аммиак или нитрат аммония.
или 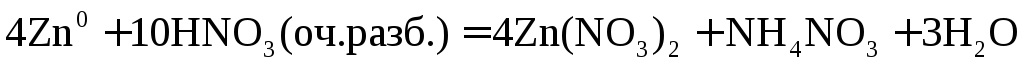
Вывод:
окислителем в азотной кислоте является
нитрат-анион. Концентрированная азотная
кислота пассивирует 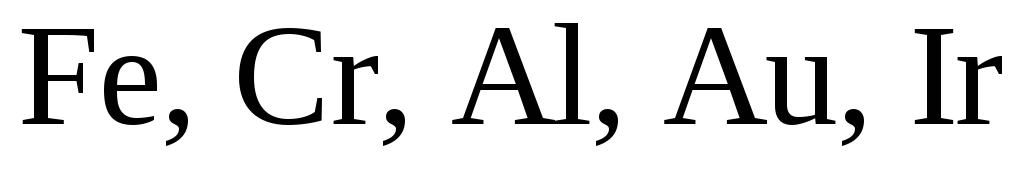
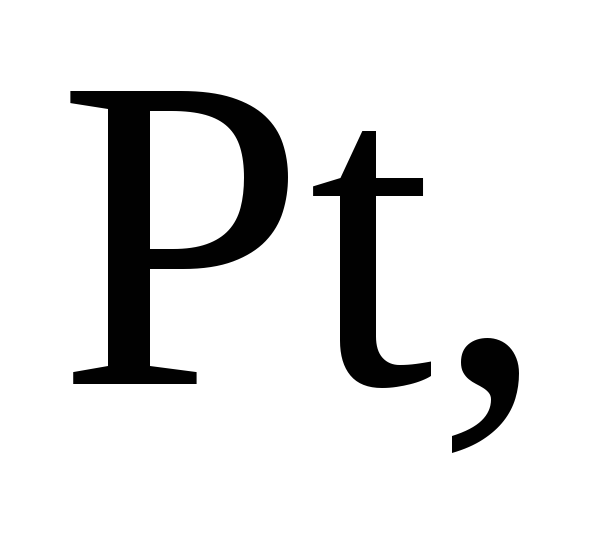 …
…
Следует иметь в виду, что во многих случаях при действии азотной кислоты на металлы образуется смесь различных азотсодержащих соединений, в которых преобладает какое-либо из них.
Взаимодействие металлов с серной кислотой
С разбавленной серной кислотой.
В разбавленной
серной кислоте окислителем являются
ионы водорода 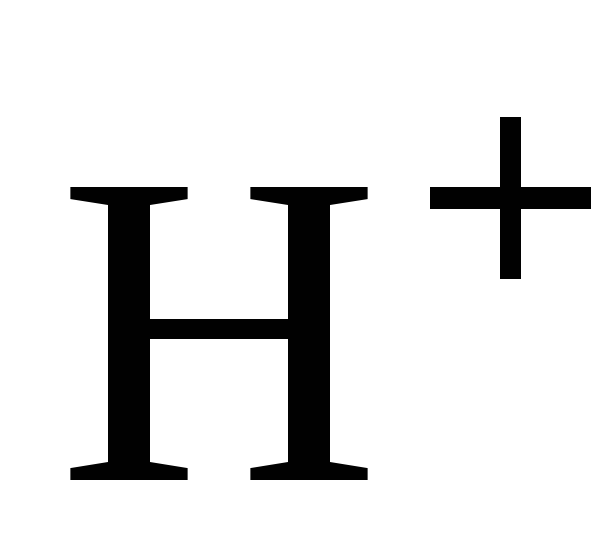 ,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.
,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.
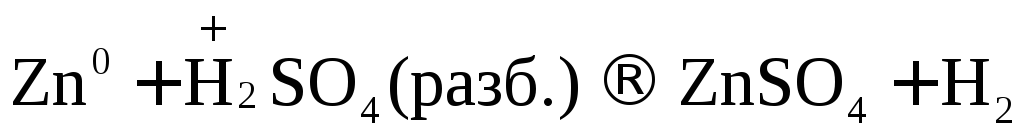

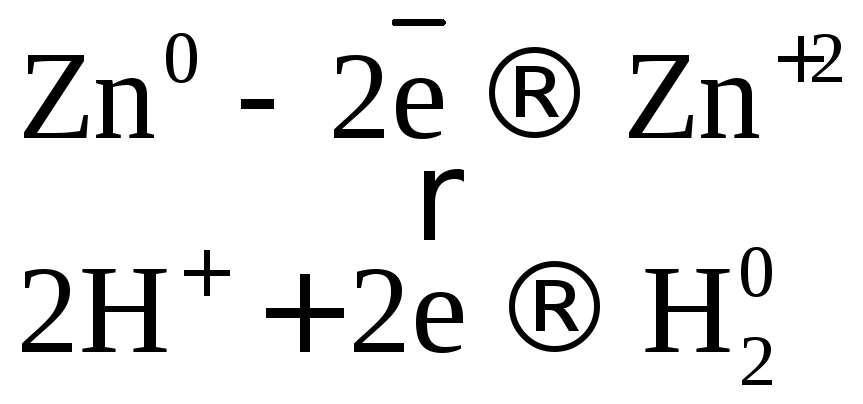


С концентрированной серной кислотой.
В концентрированной
серной кислоте окислителем является
ион 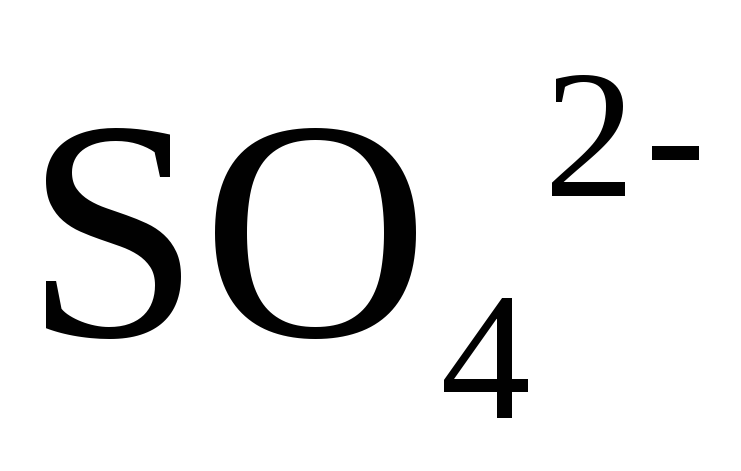 но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
— 2. Чем
активнее металл, тем больше степень
восстановления серы.
Взаимодействие металлов с серной кислотой можно представить в виде схемы.
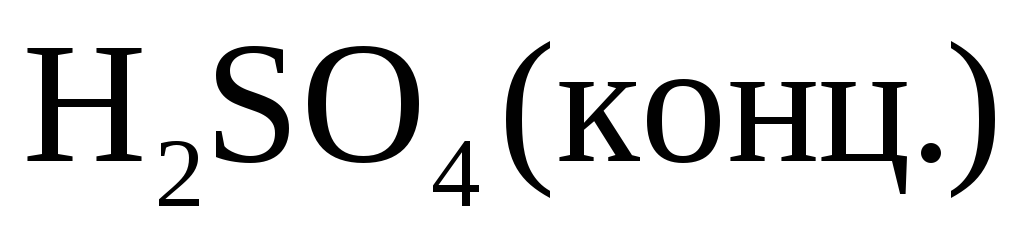




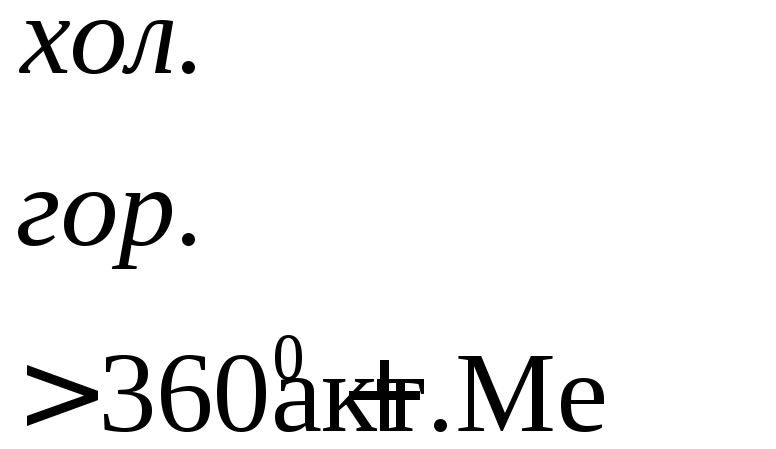

Характер взаимодействия зависит от активности металла, условий проведения реакции.
Например: при нагревании серной концентрированной кислоты с цинком сначала выделяется сернистый газ, а затем элементарная сера и сероводород.


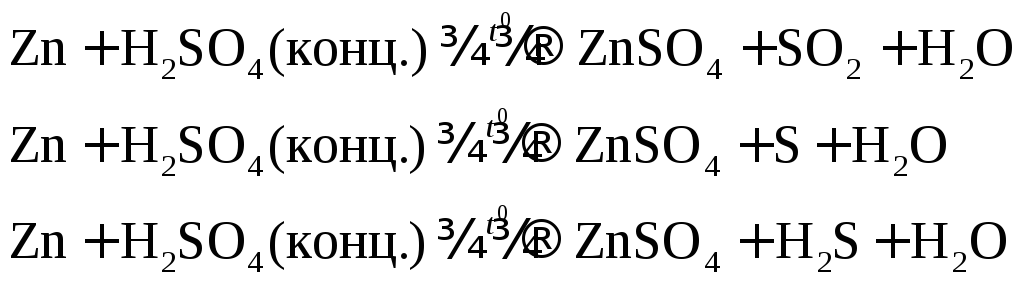
В одном из уравнений расставим коэффициенты ионно-электронным методом.
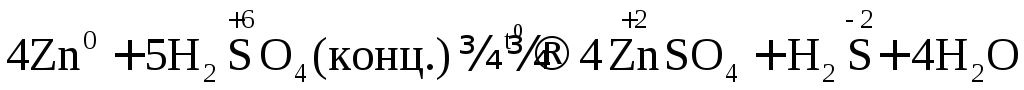

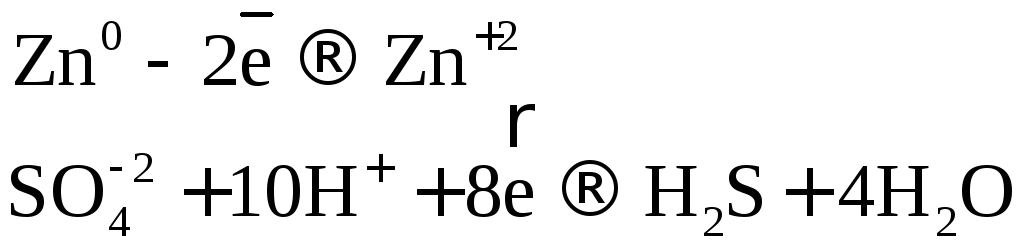


Вывод: Окислителем в концентрированной серной
кислоте является ион 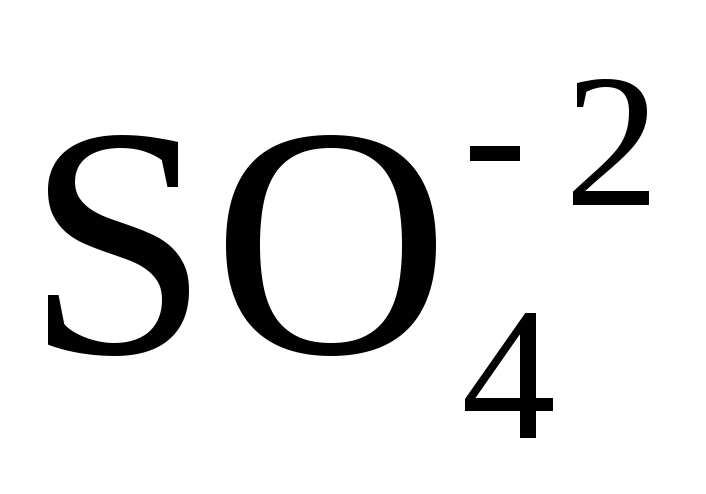 .
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.
.
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.

Концентрированная
серная кислота не действует на 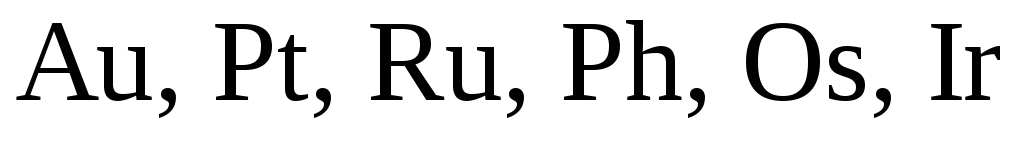 и пассивирует
и пассивирует  .
.
studfile.net

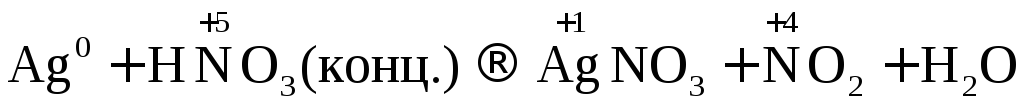 .
. .
.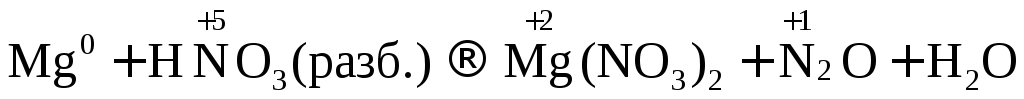 .
.