Азотная кислота цена 300 руб.
CAS: 7697-37-2
Синонимы: Селяная кислота, Острая водка, Аква фортис, Нитрат водорода, Травильная кислота, Nitric acid, Aqua fortis, Hydrogen nitrate, Azotic acid
Химическая формула азотной кислоты: HNO3
Азотная кислота это оксокислота азота с формулой HNO3, в которой атом азота связан с гидроксигруппой и эквивалентными связями с двумя оставшимися атомами кислорода, представляет собой дымящуюся на воздухе жидкость от бесцветного до бледно-желтого и красновато-коричневого цвета, выделяющую красно-коричневые пары и имеющую едкий, удушающий запах. Она играет роль протонного растворителя и реагента.
Сильная одноосновная кислота, очень токсичная при вдыхании, может разъедать металлы или ткани.
Хорошо растворяется и смешивается с водой. Под воздействием атмосферной влажности или тепла происходит разложение с образованием перекиси азота. Не горюча, но усиливает горение других веществ и способна привести к взрыву. При пожаре выделяет раздражающие или токсичные пары.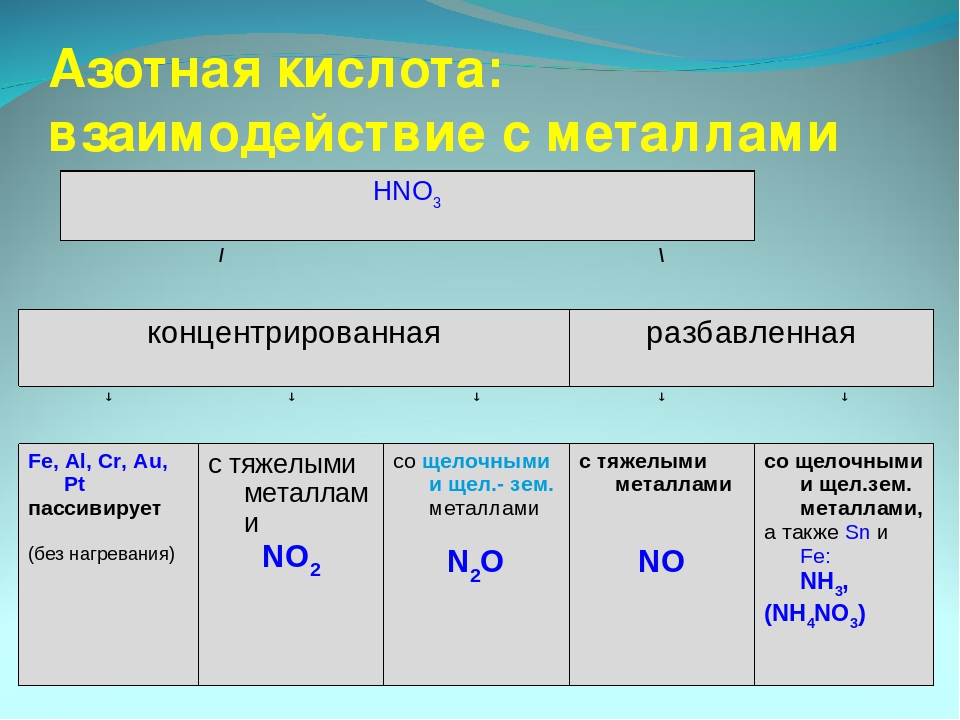
Азотная кислота нестабильна, разлагается при контакте с теплом и под воздействием света, воды, диоксида азота и кислорода.
HNO3 разъедает некоторые виды пластмасс, резины и покрытий. Бурно реагирует с горючими или легко окисляемыми материалами, такими как спирты, скипидар, древесный уголь, органические отходы. Вступает в реакцию с большинством металлов выделяя газ водород.
Продолжительное воздействие низких и высоких концентраций приводит к неблагоприятным последствиям для здоровья, воздействие паров может вызвать хронический бронхит и химический пневмонит. При попадании на кожу разъедает её, вызывая серьёзные химические ожоги, является сильным раздражителем глаз и слизистых оболочек. При попадании этого химического вещества на кожу, в глаза немедленно промойте место большим количеством воды. Запрещается носить контактные линзы при работе с этим химическим веществом.
Используется во многих отраслях промышленности
Азотная кислота (HNO3) бесцветная жидкость, которая используется при производстве неорганических и органических нитратов и нитросоединений для удобрений, промежуточных красителей, взрывчатых веществ и многих различных органических химикатов. Она используется для растворения, травления и очистки металлов, а также для получения нитратов и нитросоединений, включая органические производные, содержащиеся в коммерческих или военных взрывчатых веществах, а также в ювелирном деле.
Она используется для растворения, травления и очистки металлов, а также для получения нитратов и нитросоединений, включая органические производные, содержащиеся в коммерческих или военных взрывчатых веществах, а также в ювелирном деле.
Азотная кислота безводная — Справочник химика 21
Азотная кислота, безводная. Безводную азотную кислоту получают при действии концентрированной серной кис юты ( 1 =1,84) на сухой химически чистый нитрат калия, Образующуюся азотную кислоту, во избежание термического разложения, отгоняют прн пониженном давлении. [c.209]Изучая упругость паров азотной кислоты в смесях ее с сер ной кислотой и водой, Сапожников нашел, что по мере прибавле ния к разбавленной азотной кислоте безводной серной кислоты упругость пара растет и достигает максимума в момент образования в смеси состава, отвечающего формуле [c.73]
Азотная кислота — безводная или в смеси с серной кислотой— образует с циклическими органическими соединениями (бензолом, нафталином и т.
 п.) нитросоединения. Нитрование парафинов идет медленно. Органические вещества, содержащие гидроксил (глицерин, целлюлозу), образуют с азотной кислотой азотнокислые эфиры.
п.) нитросоединения. Нитрование парафинов идет медленно. Органические вещества, содержащие гидроксил (глицерин, целлюлозу), образуют с азотной кислотой азотнокислые эфиры. Азотная кислота безводная [c.740]
Нитрование фенола в присутствии BFg проводилось азотной кислотой безводной, 20, 10 и 5%-ной в растворителе и без растворителя [c.167]
Азотная кислота — безводная или в смеси с серной кислотой — образует с ароматическими органическими соединениями (бензолом, [c.342]
Процесс нейтрализации протекает с выделением тепла. В уравнении (VII. 1) указан тепловой эффект нейтрализации 100%-ной азотной кислоты безводным газообразным аммиаком при Получении твердого нитрата аммония. [c.118]
Тетрафтороборат нитрония может быть получен действием на дымящую азотную кислоту безводного фтороводорода и трифторида бора в нитрометане [c.124]
Азотная кислота безводная или в смеси с крепкой серной кислотой образует с циклическими органическими соединениями (бензол, нафталин и т.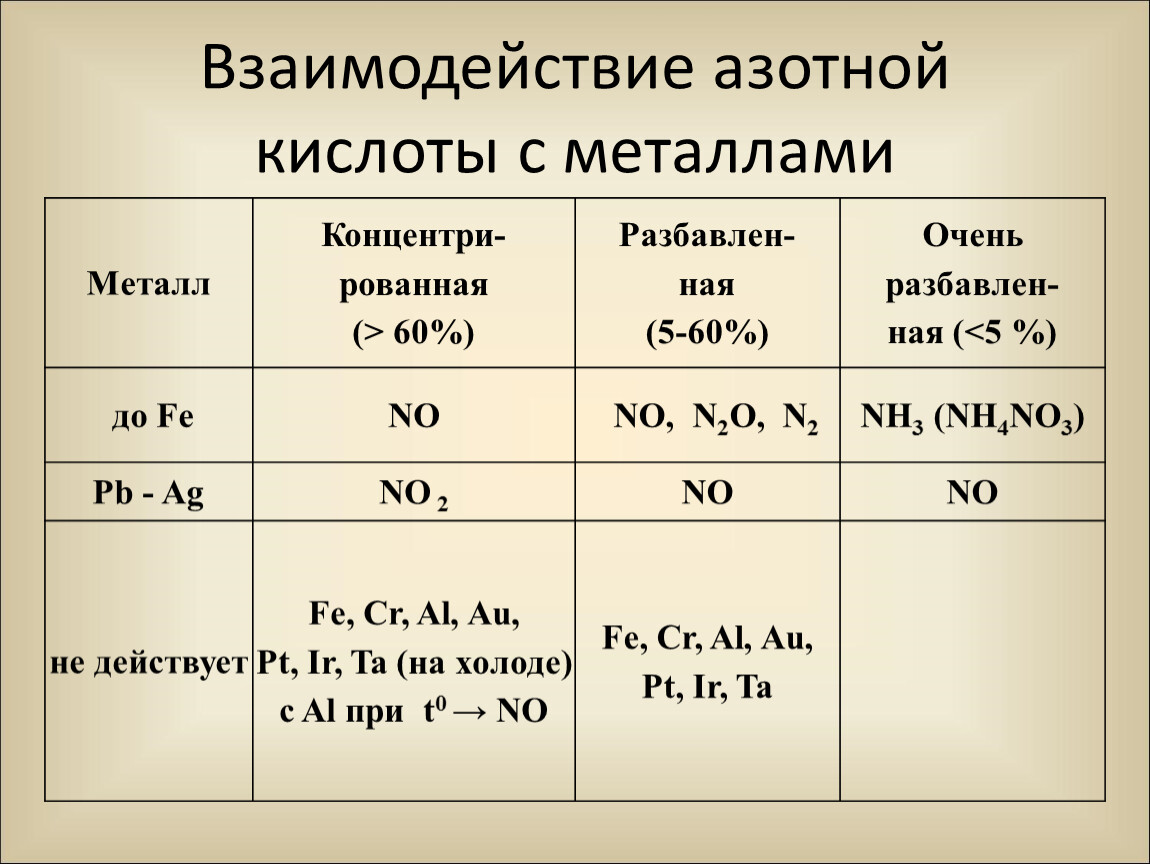
Уранилхлорид UO2 I2 получается взаимодействием UO3 с соляной кислотой, окислением двуокиси урана хлором или тетрахлорида урана азотной кислотой. Безводный уранилхлорид— кристаллическое вещество ярко-желтого цвета гидратированные его формы имеют зеленоватый оттенок. Уранилхлорид гигроскопичен. [c.517]
Действие на целлюлозу 75%-НОЙ азотной кислоты 87%-ной азотной кислоты безводной азотной кислоты [c.122]
Процесс нейтрализации протекает с выделением тепла [уравнение (УНЫ)]. Выше указан тепловой эффект нейтрализации 100%-ной азотной кислоты безводным газообразным аммиаком при получении твердого нитрата аммония. В производственных условиях применяется азотная- кислота концентрацией 45—60% ИМОз.
Низкая кислотность среды достигается использованием солей азотной кислоты. Безводный нитрат пиридина [91] применяется в присутствии избытка пиридина для нитрования нафталина (выход 1-нитронафталина 40%) и антрацена (выход 9-нитроантрацена 70%). Для нитрования азулена используется нитрат мочевины [92]. [c.28]
NaN03 + 4K 1 + 6h3O Азотная кислота безводная представляет собой бесцветную летучую жидкость, дымящую , красного цвета — раствор выделяющегося бурого газа NO2 в концентрированной азотной кислоте одна из сильных кислот, сильный окислитель, окисляет почти все металлы и неметаллы. [c.258]
Формула Азотной кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: HNO3
Химический состав Азотной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| O | Кислород | 15. 999 999 |
3 | 76,2% |
| H | Водород | 1.008 | 1 | 1,6% |
| N | Азот | 14.007 | 1 | 22,2% |
Молекулярная масса: 63,012
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, T
Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, T
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения. ри нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила.
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется. Нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия).
Азотная кислота по степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3.
РАЗНИЦА МЕЖДУ ДЫМЯЩЕЙСЯ АЗОТНОЙ КИСЛОТОЙ И КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТОЙ | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между дымящей азотной кислотой и концентрированной азотной кислотой заключается в том, что дымящаяся азотная кислота образует бесцветный, желтоватый или коричневатый дым, тогда как
В ключевое отличие

Азотная кислота — это очень едкая и опасная кислота, имеющая химическую формулу HNO3. Более того, он может иметь разбавленную или концентрированную химическую природу. В любом случае, в нем растворены молекулы азотной кислоты в воде. При реакции диоксида азота с водой образуется азотная кислота. Но при приготовлении дымящейся азотной кислоты мы можем приготовить ее, добавив к азотной кислоте избыток диоксида азота.
1. Обзор и основные отличия
2. Что такое дымящая азотная кислота?
3. Что такое концентрированная азотная кислота?
5. Резюме
Что такое дымящаяся азотная кислота?
Дымящаяся азотная кислота — это промышленный сорт азотной кислоты с очень высокой концентрацией и высокой плотностью. Он содержит 90-99% HNO3. Мы можем приготовить эту жидкость, добавив к азотной кислоте избыток диоксида азота. Он образует бесцветную, желтоватую или коричневатую дымящуюся жидкость, обладающую высокой коррозионной активностью.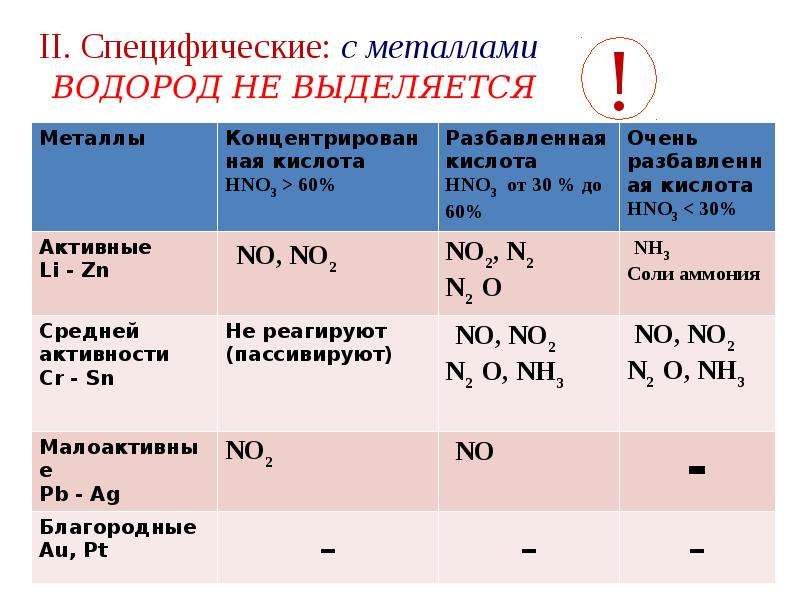 Следовательно, этот кислотный раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Пары этой кислоты поднимаются с поверхности кислоты; это привело к его названию «дымящийся». Химическая формула этого соединения — HNO.3-хНет2.
Следовательно, этот кислотный раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Пары этой кислоты поднимаются с поверхности кислоты; это привело к его названию «дымящийся». Химическая формула этого соединения — HNO.3-хНет2.
Кроме того, существует две основные формы этой кислоты: белая и красная дымящая азотная кислота. Поэтому мы рассматриваем белую дымящуюся кислоту как самую чистую форму азотной кислоты, содержащую менее 2%; иногда совсем нет воды. Таким образом, он очень близок к безводной азотной кислоте и доступен в виде 99% раствора. Он содержит максимум 0,5% диоксида азота. Это полезно в качестве хранимого окислителя и ракетного топлива.
Красная дымящая азотная кислота на 90% состоит из HNO3. Он имеет высокое содержание диоксида азота, благодаря чему раствор имеет красновато-коричневый цвет. Имеет плотность менее 1,49 г / см.3. Таким образом, он также полезен в качестве хранимого окислителя и ракетного топлива. Чтобы получить эту кислоту, мы можем использовать 84% азотную кислоту и 13% тетроксид диазота с 2% воды.
Чтобы получить эту кислоту, мы можем использовать 84% азотную кислоту и 13% тетроксид диазота с 2% воды.
Использует:
- Красная дымящая азотная кислота является компонентом одноразового горючего.
- Используется как единственное топливо в ракетах.
- В качестве хранимых окислителей.
- Белая дымящаяся азотная кислота используется при производстве взрывчатых веществ. Пример: нитроглицерин.
Что такое концентрированная азотная кислота?
Концентрированная азотная кислота — это просто раствор, содержащий больше азотной кислоты в меньшем количестве воды. Это означает, что концентрированная форма этой кислоты содержит меньше воды по сравнению с количеством растворенных в ней веществ. В промышленных масштабах 68% и выше считается концентрированной азотной кислотой.
Причем плотность этого раствора составляет 1,35 г / см.3. Эта большая концентрация не вызывает образования паров, но очень высокая концентрация этой кислоты может давать испарения не совсем белого цвета. Мы можем производить эту жидкость, реагируя диоксид азота с водой.
Мы можем производить эту жидкость, реагируя диоксид азота с водой.
В чем разница между дымящейся азотной кислотой и концентрированной азотной кислотой?
Дымящаяся азотная кислота — это промышленный сорт азотной кислоты с очень высокой концентрацией и высокой плотностью. Кроме того, он образует бесцветный, желтоватый или коричневатый дым. Самая низкая концентрация этой кислоты — 90%. Концентрированная азотная кислота — это просто раствор, содержащий больше азотной кислоты в меньшем количестве воды. Самая низкая концентрация этой кислоты — 68%. Кроме того, эта кислота обычно не образует дыма; но очень высокая концентрация этой кислоты может давать испарения не совсем белого цвета. Следующая инфографика представляет более подробную информацию о разнице между дымящей азотной кислотой и концентрированной азотной кислотой.
Резюме — дымящаяся азотная кислота против концентрированной азотной кислоты
Есть две формы азотной кислоты с высокой концентрацией HNO3; они дымят азотной кислотой и концентрированной азотной кислотой. Основное различие между дымящей азотной кислотой и концентрированной азотной кислотой заключается в том, что дымящая азотная кислота образует бесцветный, желтоватый или коричневатый дым, тогда как концентрированная азотная кислота обычно не образует дыма; но очень высокая концентрация этой кислоты может давать испарения не совсем белого цвета.
Основное различие между дымящей азотной кислотой и концентрированной азотной кислотой заключается в том, что дымящая азотная кислота образует бесцветный, желтоватый или коричневатый дым, тогда как концентрированная азотная кислота обычно не образует дыма; но очень высокая концентрация этой кислоты может давать испарения не совсем белого цвета.
Взаимодействие цинка и концентрированной азотной кислоты
| Гостевая книга Наш сайт является участником кольца патриотических ресурсов Сайт создан | Азотная кислота HNO3 — бесцветная жидкость, «дымит» на воздухе, на свету подвергается разложению, а выделяющийся оксид азота (IV) — см. фото 2, окрашивает кислоту в коричневый цвет. HNO3 = H+ + NO3— Азотная кислота — окислитель, окисляет металлы, неметаллы и сложные вещества. Продукты реакции зависят от концентрации кислоты, активности металла, условий реакции. С цинком концентрированная азотная кислота реагирует с выделением оксида азота (IV) — NO2, ядовитым газом красно-бурого цвета. Окислитительно-восстановительное уравнение, расстановка коэффициентов методом электронного баланса на примере уравнения реакции взаимодействия цинка с конц. азотной кислотой. Zn + HNO3 = Zn(NO3)2 + NO2 + H2O Электронный баланс: Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O Ещё в фотоальбоме Живая химия: Список всех фотографий фотоальбомаВзаимодействие цинка и азотной кислоты Водородный пистолет Горение фосфора Металлы Отдельные вещества Получение кислорода Химическая посуда и приборы Окислительно-восстановительные реакции Практическая работа «Получение кислорода и изучение его свойств» | Живая химия Фотоальбом школы День лицеиста |
Азотная кислота и нитраты
Азотная кислота
Молекулярная формула: HNO3, B(N) = IV, С. О. (N) = +5
О. (N) = +5
Атом азота образует 3 связи с атомами кислорода по обменному механизму и 1 связь — по донорно-акцепторному механизму.
Физические свойства
Безводная HNO3 при обычной температуре — бесцветная летучая жидкость со специфическим запахом (т. кип. 82,6’С).
Концентрированная «дымящая» HNO3 имеет красный или желтый цвет, так как разлагается с выделением NO2. Азотная кислота смешивается с водой в любых соотношениях.
Способы получения
I. Промышленный — 3-стадийный синтез по схеме: NH3 → NO → NO2 → HNO3
1 стадия: 4NH3 + 5O2 = 4NO + 6H2O
2 стадия: 2NO + O2 = 2NO2
3 стадия: 4NO2 + O2 + 2H2O = 4HNO3
II. Лабораторный — длительное нагревание селитры с конц. H2SO4:
2NaNO3(тв.) +H2SO4(конц.) = 2HNO3 + Na2SO4
Ba(NO3)2(тв) +H2SO4(конц. ) = 2HNO3 + BaSO4
) = 2HNO3 + BaSO4
Химические свойства
HNO3 → H+ + NO3—
HNO3 — очень реакционноспособное вещество. В химических реакциях проявляет себя как сильная кислота и как сильный окислитель.
HNO3 взаимодействует:
а) с оксидами металлов 2HNO3 + CuO = Cu(NO3)2 + H2O
б) с основаниями и амфотерными гидроксидами 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
в) с солями слабых кислот 2HNO3 + СaСO3 = Ca(NO3)2 + СO2↑ + H2O
г) с аммиаком HNO3 + NH3 = NH4NO3
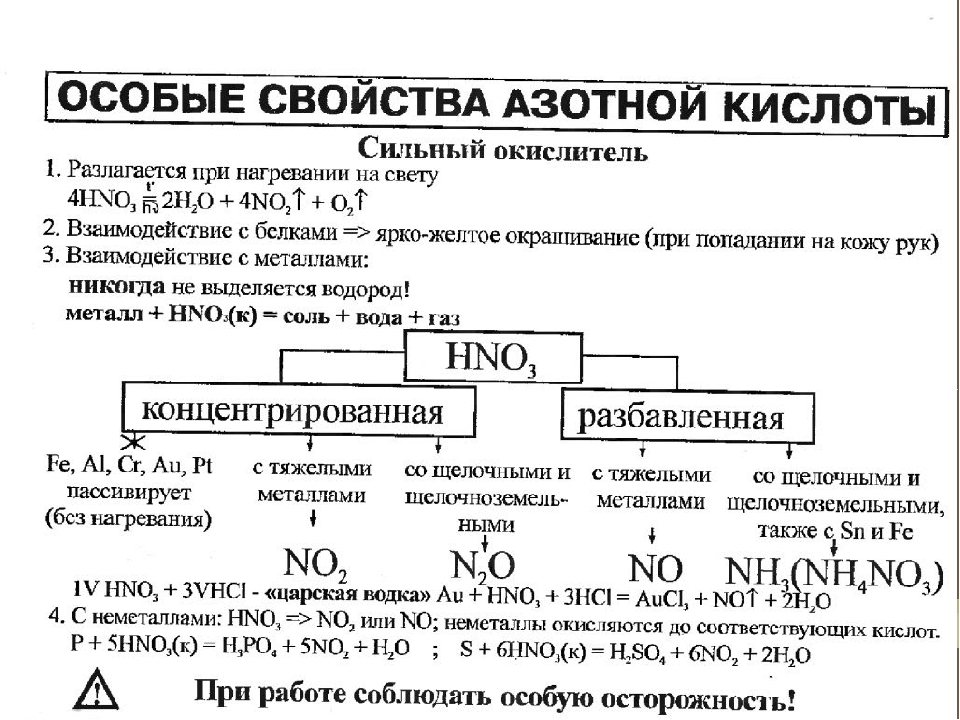
1. При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H+ кислоты не участвуют в окислении металлов.
2. Вместо ионов H+ окисляющее действие оказывают анионы NO3—.
3. HNO3 способна растворять не только металлы, расположенные в ряду активности левее водорода, но и малоактивные металлы — Си, Аg, Нg. В смеси с HCl растворяет также Au, Pt.
I. Окисление металлов:
Взаимодействие HNO3: а) с Me низкой и средней активности: 4HNO3(конц.) + Сu = 2NO2↑ + Cu(NO3)2 + 2H2O
8HNO3(разб.) + ЗСu = 2NO↑ + 3Cu(NO3)2 + 4H2O
б) с активными Me: 10HNO3(разб.) + 4Zn = N2O + 4Zn(NO3)2 + 5H2O
в) с щелочными и щелочноземельными Me: 10HNO3(оч. разб.) + 4Са = NH4NO3 + 4Ca(NO3)2 + 3H2O
Очень концентрированная HNO3 при обычной температуре не растворяет некоторые металлы, в том числе Fe, Al, Cr.
II. Окисление неметаллов:
HNO3 окисляет Р, S, С до их высших С. О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
5HNO3 + Р = 5NO2↑ + H3PO4 + H2O
2HNO3 + S = 2NO↑ + H2SO4
III. Окисление сложных веществ:
Особенно важными являются реакции окисления сульфидов некоторых Me, которые не растворяются в других кислотах. Примеры:
8HNO3 + PbS = 8NO2↑ + PbSO4 + 4H2O
22HNO3 + ЗСu2S = 10NO↑ + 6Cu(NO3)2 + 3H2SO4 + 8H2O
R-Н + НО-NO2 → R-NO2 + H2O
Примеры:
С2Н6 + HNO3 → C2H5NO2 + H2O нитроэтан
С6Н5СН3 + 3HNO3 → С6Н2(NO2)3СН3 + ЗH2O тринитротолуол
С6Н5ОН + 3HNO3 → С6Н5(NO2)3OH + ЗH2O тринитрофенол
R-ОН + НO-NO2 → R-O-NO2 + H2O
Примеры:
С3Н5(ОН)3 + 3HNO3 → С3Н5(ONO2)3 + ЗH2O тринитрат глицерина
При хранении на свету, и особенно при нагревании, молекулы HNO3 разлагаются за счет внутримолекулярного окисления-восстановления:
4HNO3 = 4NO2↑ + O2↑ + 2H2O
Выделяется красно-бурый ядовитый газ NO2, который усиливает агрессивно-окислительные свойства HNO3
Соли азотной кислоты — нитраты Me(NO
3)nНитраты — бесцветные кристаллические вещества, хорошо растворяются в воде.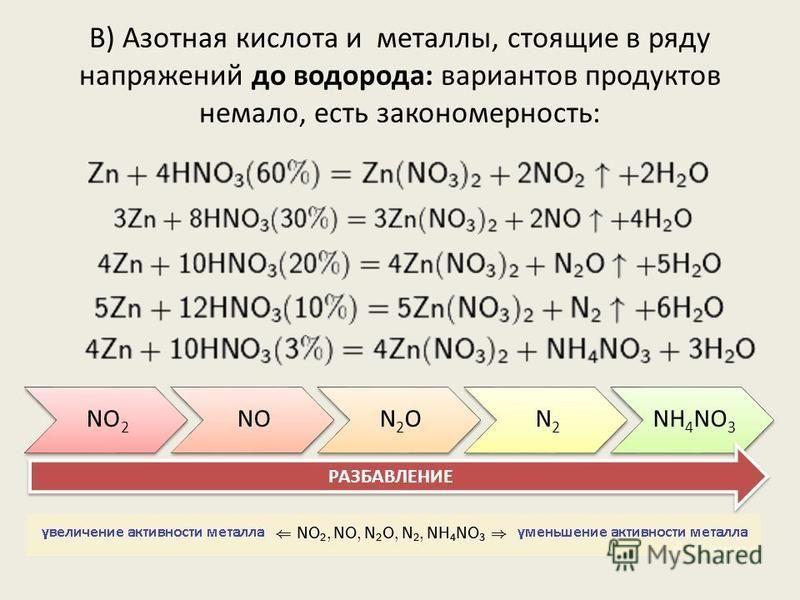 Имеют химические свойства, характерные для типичных солей.
Имеют химические свойства, характерные для типичных солей.
Отличительные особенности:
1) окислительно-восстановительное разложение при нагревании;
2) сильные окислительные свойства расплавленных нитратов щелочных металлов.
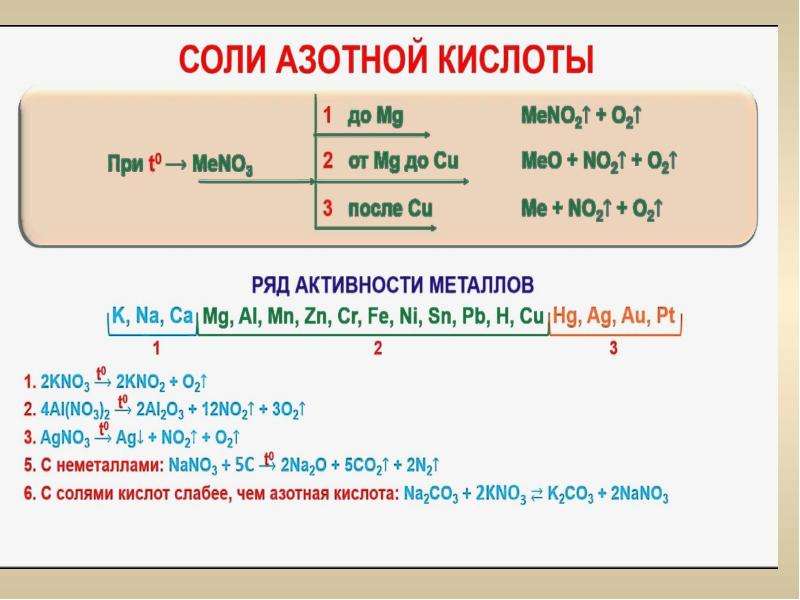
1. Разложение нитратов щелочных и щелочноземельных металлов:
Me(NO3)n → Me(NO2)n + O2↑
2. Разложение нитратов металлов, стоящих в ряду активности металлов от Mg до Cu:
Me(NO3)n → МеxОy + NO2↑ + O2
3. Разложение нитратов металлов, стоящих в ряду активности металлов превее Cu :
Me(NO3)n → Ме + NO2↑ + O2
Примеры типичных реакций:
1) 2NaNO3 = 2NaNO2 + O2↑
2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3) 2AgNO3 = 2Ag + 2NO2↑ + O2↑
В водных растворах нитраты, в противоположность HNO3, почти не проявляют окислительной активности.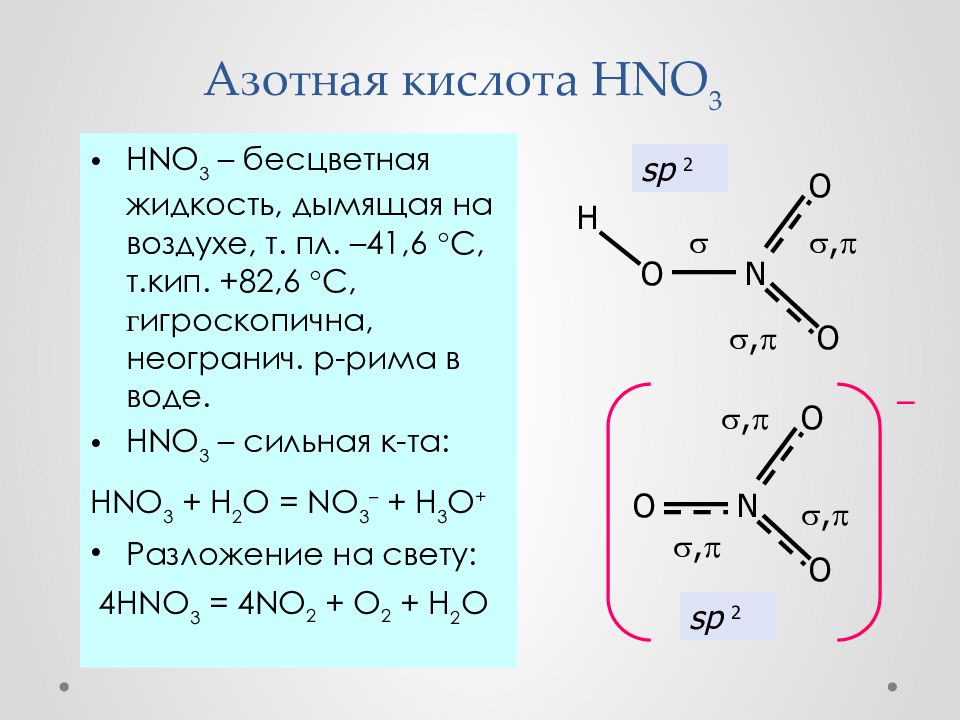 Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.
Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.
Формула азотной кислоты — Использование, свойства, структура и формула азотной кислоты
Формула и структура: Химическая формула азотной кислоты: HNO 3 . Его молекулярная формула записывается как NHO 3 , а его молярная масса составляет 63,01 г/моль. Химическая структура азотной кислоты показана ниже с ее резонансными формами:
Молекула HNO 3 плоская, азот присоединен к трем атомам кислорода, один из которых удерживает протон.Две связи NO эквивалентны и демонстрируют резонанс с характером двойной связи.
Получение: Азотную кислоту получают реакцией диоксида азота (NO 2 ) с водой.
3 НО 2 + H 2 O → 2 HNO 3 + НО
Побочный продукт оксида азота (NO) обычно снова окисляется кислородом воздуха для получения дополнительного исходного материала диоксида азота.
Коммерческое производство азотной кислоты осуществляется путем окисления безводного аммиака до оксида азота в присутствии платинового катализатора при высокой температуре (процесс Оствальда).
Физические свойства: Азотная кислота представляет собой жидкость с едким, резким и удушливым запахом. Доступны различные концентрации азотной кислоты, и они соответственно бесцветные, желтые или красные. Промышленный сорт составляет около 68% в воде, товарный сорт составляет от 52% до 68%, дымящая азотная кислота составляет 86% или выше, а концентрации выше 95% называются белой дымящейся или красной дымящейся азотной кислотой.
Химические свойства: Азотная кислота — сильная моноосновная кислота. Он легко образует твердые гидраты, такие как моногидрат (HNO 3 · H 2 O) и тригидрат (HNO 3 · 3H 2 O).Азотная кислота может быть разложена под действием тепла или света, как показано ниже:
4 HNO 3 → 2 H 2 O + 4 NO 2 + O 2 .
Это сильный окислитель, который бурно реагирует со многими неметаллическими соединениями. Он также реагирует с металлами, растворяя их, образуя оксиды металлов и т. д.
Использование: Азотная кислота широко используется для производства удобрений, таких как нитрат аммония, и полимеров (например, нейлон). Это отличный нитрующий агент (вводит нитрогруппу) в сочетании с серной кислотой.Он также используется в качестве окислителя в жидкостных ракетах.
Опасность для здоровья/воздействие на здоровье: Азотная кислота является коррозионно-активной кислотой, которая может вызвать серьезные ожоги кожи. Являясь сильной кислотой и окислителем, он может полностью разлагать ткани. Даже разбавленные формы могут вызывать ожоги и окрашивать кожу в желтый цвет, реагируя с белками кожи. Едкие пары также очень раздражают и повреждают глаза, горло и слизистые оболочки.
Что такое азотная кислота? — Структура, использование и формула — Видео и стенограмма урока
Использование азотной кислоты: удобрения
Азотная кислота является очень важным веществом, которое используется в качестве сырья для производства других веществ. Это делает его важным в химической и фармацевтической промышленности. Чаще всего азотная кислота используется для производства удобрений. Одним из исходных материалов, необходимых для изготовления эффективного удобрения, является азотная кислота, которая вступает в реакцию с аммиаком с образованием нитрата аммония.
Это делает его важным в химической и фармацевтической промышленности. Чаще всего азотная кислота используется для производства удобрений. Одним из исходных материалов, необходимых для изготовления эффективного удобрения, является азотная кислота, которая вступает в реакцию с аммиаком с образованием нитрата аммония.
Использование азотной кислоты: аэрокосмическая техника
Вы когда-нибудь задумывались, что входит в состав ракетного топлива? Ракеты используют различные виды топлива.В жидкостных ракетах жидкий окислитель сочетается с горючим. Азотная кислота, будучи сильным окислителем, использовалась в качестве окислителя в ракетах на жидком топливе.
Формами азота, используемыми в качестве ракетного топлива, обычно являются: белая дымящаяся азотная кислота (WFNA) , окислитель длительного хранения, который состоит из высококонцентрированной азотной кислоты — примерно более 95% — и красная дымящая азотная кислота (RFNA) , также хранимый окислитель с концентрацией азотной кислоты около 84%.
Другие виды использования азотной кислоты
Азотная кислота также используется в качестве прекурсора для получения органических азотсодержащих соединений, таких как нейлон.
Азотная кислота также используется для производства нитратных солей, таких как нитрат аммония, нитрат серебра и нитрат кальция.
Азотная кислота также используется для очистки металлов, таких как золото, серебро и платина, путем удаления других присутствующих металлических примесей.Из-за этой способности такие металлы, как медь, бронза и латунь, можно травить азотной кислотой, создавая на металле стойкий рисунок.
В пищевой и молочной промышленности азотная кислота также используется для очистки оборудования, так как она эффективно удаляет соединения кальция и магния. Низкие концентрации азотной кислоты (около десяти процентов) также могут использоваться для искусственного старения древесины сосны и клена.
Низкие концентрации азотной кислоты (около десяти процентов) также могут использоваться для искусственного старения древесины сосны и клена.
Краткий обзор урока
Азотная кислота — сильнокислотное вещество и сильный окислитель.Его физическое состояние представляет собой бесцветную или слегка желтоватую жидкость. Химическая формула азотной кислоты HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода. Его химическая структура указывает на то, что это плоская молекула, имеющая две резонансные формы .
Азотная кислота чаще всего используется в производстве удобрений. Другие области применения включают в себя использование в качестве окислителя в жидком топливе в ракетах, прекурсора в синтезе органических азотсодержащих соединений и нитратных солей, травлении и очистке различных металлов, в качестве чистящего средства в пищевой и молочной промышленности, а также в искусственном старении. из дерева.
Условия использования азотной кислоты
 .
.| Условия | Определения |
|---|---|
| Азотная кислота | сильно коррозионное кислотное вещество |
| Сильный окислитель | вещество, которое легко принимает электроны от другого вещества |
| Резонансная форма | возникает, когда существует несколько способов изображения структуры Льюиса соединения |
| Структура Льюиса | диаграмма, показывающая, как атомы связаны друг с другом, и иллюстрирующая наличие несвязанных пар электронов в соединении |
| Белая дымящаяся азотная кислота (WFNA) | хранимый окислитель, состоящий из высококонцентрированной азотной кислоты — примерно более 95% |
| Красная дымящаяся азотная кислота (RFNA) | хранимый окислитель с концентрацией азотной кислоты около 84% |
Результаты обучения
После этого урока вы должны уметь:
- Описывать химическую формулу и свойства азотной кислоты
- Изучить структуру азотной кислоты
- Вспомните различные виды использования азотной кислоты
Объяснение урока: Свойства азотной кислоты
В этом объяснении мы научимся описывать физические и химические свойства и применение азотной кислоты.
Азотная кислота (HNO3) — бесцветный минерал
кислота обычно встречается в разбавленной форме в школьных лабораториях. Это очень
едкий в концентрированной форме, который содержит около 68%
азотная кислота. Концентрированная форма представляет собой жидкость при комнатной температуре и кипит при
около 120∘С.
Это очень
едкий в концентрированной форме, который содержит около 68%
азотная кислота. Концентрированная форма представляет собой жидкость при комнатной температуре и кипит при
около 120∘С.
Молекулярную структуру азотной кислоты можно показать с помощью различных резонансные структуры. Фактическая молекулярная структура будет где-то между две основные резонансные структуры, показанные на диаграмме ниже.
Азотную кислоту можно приготовить в лаборатории, но следует соблюдать осторожность следует принимать из-за коррозионной природы вовлеченных концентрированных кислот. Экспериментальная установка показана на диаграмме ниже.
В этом препарате к серной кислоте добавляют нитрат калия (или натрия). После смешивания нитрата калия и концентрированной серной кислоты
они нагреваются осторожно, следя за тем, чтобы температура не превышала
100∘C, что может
разлагают образующуюся азотную кислоту.Азотная кислота, дистиллят в
эту реакцию затем собирают в круглодонную колбу и охлаждают на льду.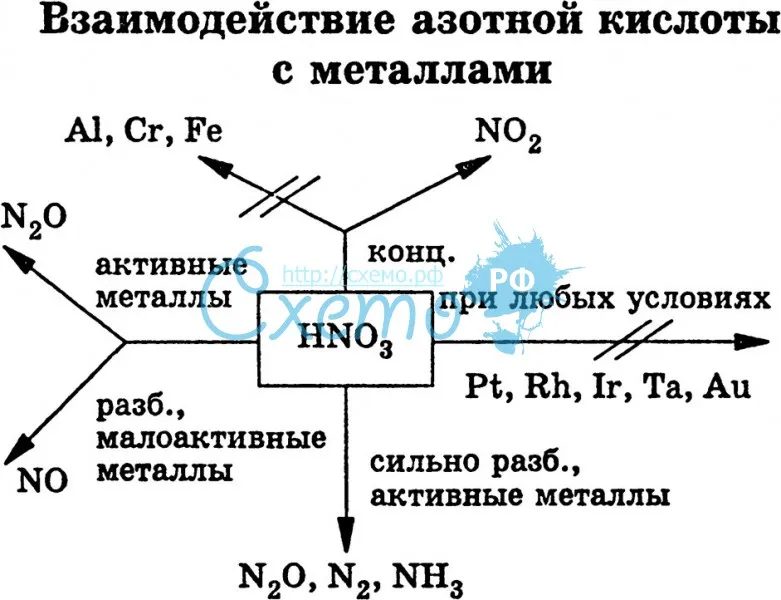 ванна.
ванна.
Химическое уравнение для этого препарата азотной кислоты: KNO()+HSO()HNO()+KHSO()32434saqlaq
Пример 1. Определение правильной химической формулы реагентов и продуктов в синтезе азотной кислоты
Азотная кислота может быть получена путем смешивания нитрата натрия с серной кислотой и подогрев смеси до 83∘С.Какое из следующих химических уравнений является правильным для этой реакции?
- Nano + HConaso + HNO224323
- Nano + Hsonahso + HNO32443
- Na (No) + 2HSO2NASO + HNO + H33244232
- Nano + HSonaso + HNO3443
- Na (No) + Hsonaso + 2Hno322443
Этот вопрос проверяет наши знания правильных химических формул для реагенты и продукты, участвующие в синтезе азотной кислоты.
Нитрат натрия имеет химическую формулу NaNO3, поэтому ответы C и E неверны.Соединение натрия в уравнении A на самом деле нитрит натрия, а не нитрат.
 Это оставляет нам варианты
B и D.
Это оставляет нам варианты
B и D.D имеет неверную формулу серной кислоты, которая правильно написана как HSO24 в ответе B, правильный ответ.
В приведенном выше подготовительном эксперименте мы избегали высоких температур при работе с с азотной кислотой. Всегда следует соблюдать осторожность, чтобы избежать нагрева концентрированных азотная кислота, поскольку она может разлагаться с образованием токсичных коричневых паров азота. диоксид: 4HNO()4NO()+O()+2HO()3222lggl
Это разложение будет происходить в гораздо меньшей степени даже при комнатной температуре, концентрированная азотная кислота также подвержена легкому разложению.По этим двум причинам кислоту следует хранить в коричневых склянках с реактивами в классная кладовка. Коричневый цвет диоксида азота, образующегося в этом разложение — это то, что придает более старым образцам концентрированной азотной кислоты характерный желтый цвет.
 Другой газ, образующийся при разложении,
кислород вместе с жидкой водой.
Другой газ, образующийся при разложении,
кислород вместе с жидкой водой.Пример 2: Расчет изменения степени окисления азота при окислении графита
Азотная кислота является сильным окислителем и вступает в реакцию даже с элементарный углерод в виде аллотропного графита, как показано: 3C+4HNO3CO+4NO+2HOграфит322
На какую величину изменяется степень окисления азота при этом реакция?
Ответ
Водород всегда будет иметь степень окисления +1 если только он не является частью гидрида, такого как NaH.Кислород более электроотрицателен, чем азот, поэтому в нитрат-ионе он будет имеют степень окисления -2.
Таким образом, степень окисления азота в азотной кислоте равна +5, учитывая, что степень окисления кислорода должна быть −2, а у водорода должно быть +1.
В продуктах мы видим азот в виде оксида азота. Опять же, учитывая что кислород должен иметь степень окисления −2, азот должен иметь степень окисления +2.
 Это означает, что разница между
+5 и +2 равно -3,
что является правильным ответом.
Это означает, что разница между
+5 и +2 равно -3,
что является правильным ответом.Азотная кислота реагирует с металлами. Однако продукты реакции зависят очень сильно зависит от рассматриваемого металла и концентрации азотной кислоты.
При рассмотрении металлов, более активных, чем водород, таких как магний и цинк, очень разбавленная азотная кислота будет реагировать аналогично другим минеральные кислоты, образующие соль и газообразный водород: Mg()+2HNO()Mg(NO)()+H()saqaqg3322
Однако при более высоких концентрациях азотная кислота может начать действовать как окислитель.Мы можем наблюдать окислительную природу азотной кислоты в после реакции между металлическим железом и более концентрированной азотной кислотой производят ионы Fe3+: Fe()+4HNO()Fe(NO)()+2HO()+NO()saqaqlg3332
Для металлов менее активных, чем водород, азотная кислота действует как окислитель, сначала окисляют металл до оксида, который затем реагирует с азотной кислотой с образованием соли нитрата металла, оксида азота и воды: 3Cu()+8HNO()3Cu(NO)()+4HO()+2NO()saqaqlg3322
Реакции металлов с концентрированной азотной кислотой могут привести к более сильному окислению эффекты, такие как реакция концентрированной азотной кислоты с металлической медью: Cu()+4HNO()Cu(NO)()+2HO()+2NO()slaqlg33222
Пример 3.
 Упорядочивание реакций металлического магния с различными концентрациями
Азотная кислота
Упорядочивание реакций металлического магния с различными концентрациями
Азотная кислотаМагний может реагировать с различными концентрациями азотной кислоты с образованием производить разные продукты.Расположите следующие реакции в порядке от наименее или наиболее концентрированная азотная кислота, используемая в реакции: Mg+4HNOMg(NO)+2NO+2HO(1)Mg+2HNOMg(NO)+H(2)3Mg+8HNO3Mg(NO)+2NO+4HO(3)3322233223322
Ответ
Хотя азотная кислота ведет себя аналогично мода на другие минеральные кислоты при низкой концентрации, при более высоких концентрациях может действовать как окислитель.
Разбавленные минеральные кислоты обычно реагируют с металлами с образованием соли и водорода газа, как видно из уравнения 2, и поэтому самая низкая концентрация азотной кислоты кислота используется в уравнении 2.
По мере увеличения концентрации азотной кислоты окислительная природа может быть легче увидеть, и первоначально это приводит к образованию азотной оксид (NO).

По мере дальнейшего увеличения концентрации оксид азота окисляется до двуокиси азота (NO2). Эти две разновидности азота соответствуют уравнениям 3 и 1 соответственно, давая нам окончательный порядок 2, 3, 1.
Однако, когда железо, кобальт, хром, никель и алюминий реагируют с концентрированной азотной кислоты, они образуют слой оксида металла на поверхности металл.Этот процесс называется пассивацией и защищает металл под ним. от дальнейшей реакции с концентрированной азотной кислотой.
Определение: Пассивация
Активное вещество становится пассивным за счет образования пассивирующая пленка.
Практическое руководство. Выполнение теста коричневого кольца на нитраты
Можно провести тест на наличие нитрат-иона (NO3–), выполнив тест «коричневое кольцо».
Свежеприготовленный концентрированный раствор сульфата железа(II) смешивают с неустановленный раствор, который может содержать нитрат-ионы.
 После смешивания в пробирке
несколько капель концентрированной серной кислоты осторожно стекают по
внутри стен. Когда концентрированная серная кислота встречается со смесью на поверхности
жидкости появляется коричневое кольцо, которое затем исчезает при встряхивании или нагревании. В этом тесте протекают две стадии реакций. Первоначально оксид азота
(NO) производится на месте:
2NaNO()+6FeSO()+4HSO()3Fe(SO)()+NaSO()+4HO()+2NO()3424243242aqaqaqaqaqlg
После смешивания в пробирке
несколько капель концентрированной серной кислоты осторожно стекают по
внутри стен. Когда концентрированная серная кислота встречается со смесью на поверхности
жидкости появляется коричневое кольцо, которое затем исчезает при встряхивании или нагревании. В этом тесте протекают две стадии реакций. Первоначально оксид азота
(NO) производится на месте:
2NaNO()+6FeSO()+4HSO()3Fe(SO)()+NaSO()+4HO()+2NO()3424243242aqaqaqaqaqlgПолученный оксид азота затем может реагировать со свежеприготовленным сульфат железа (II) с образованием коричневого твердого вещества, содержащего комплексное железо [Fe(HO)(NO)]SO254.Упрощенная интерпретация этой реакции выглядит следующим образом: FeSO()+NO()FeSONO()44aqgs⋅
Описанный выше тест коричневых колец не работает в присутствии нитритов. ионов (NO2–), поэтому полезно уметь различать нитрит- и нитрат-ионы.
Пример 4. Тестирование на наличие нитрат-ионов с помощью теста коричневого кольца
Студент хотел определить, присутствуют ли в растворе нитрат-ионы.
 Сначала они добавили в раствор сульфат железа (II), а затем медленно добавили
концентрированная серная кислота.Они заметили образование двух слоев с
цветное кольцо на интерфейсе. Если бы нитрат-ионы присутствовали, какой цвет
кольцо должно было быть?
Сначала они добавили в раствор сульфат железа (II), а затем медленно добавили
концентрированная серная кислота.Они заметили образование двух слоев с
цветное кольцо на интерфейсе. Если бы нитрат-ионы присутствовали, какой цвет
кольцо должно было быть?Ответ
Для определения нитрат-анионов свежеприготовленный раствор железа(II) необходимо использовать сульфат. Затем раствор сульфата железа смешивают с раствором которые могут содержать нитрат-ионы.
Концентрированная серная кислота осторожно добавляется внутрь пробирки и позволили спуститься по внутренним стенам.Когда кислота достигает поверхности жидкость, она вступает в контакт с оксидом азота, образующимся в реакция между сульфатом железа(II) и нитрат-ионами. Кислота реагирует с оксидом азота, и образуется коричневое твердое вещество, содержащее комплекс ион Fe3+ и оксид азота.
Следовательно, правильный ответ — коричневый.

Ионы нитратов и нитритов можно отличить по их реакциям (или отсутствию) с подкисленным перманганатом калия.В случае нитрита подкисленный перманганат калия теряет свой характерный темно-фиолетовый цвет. восстанавливается до ионов марганца (II): 5KNO()+2KMnO()+3HSO()5KNO()+KSO()+2MnSO()+3HO()242432442aqaqaqaqaqaql
Нитрат-ионы не восстанавливают ионы перманганата, следовательно, не будет изменение цвета.
Однако следует отметить, что результаты этих испытаний не уникальны к нитрат- и нитрит-ионам и что другие анионы могут давать такие же результаты.Таким образом, положительные результаты этих тестов определенно не подтверждают наличие нитрат- или нитрит-ионов.
Как мы видели, азотная кислота является хорошим окислителем и используется на промышленных масштабах в производстве нейлона, а также в качестве окислителя для жидкостные ракеты. Он также может быть использован в качестве чистящего средства, в промышленности удобрений и даже в деревообрабатывающем сообществе для искусственного возраст сосны и клена!
Ключевые моменты
- Азотная кислота может быть получена в лаборатории по реакции калия
или нитрат натрия и серная кислота.

- Азотная кислота — бесцветная, сильная и коррозионно-активная минеральная кислота.
- Азотная кислота разлагается при нагревании с образованием NO и является эффективным окислителем.
- Азотная кислота реагирует различными способами с различными металлами в зависимости от на активность металла и концентрацию азотной кислоты.
- Азотная кислота образует слои оксидов металлов на поверхности некоторых металлов в процесс, известный как пассивация.
- Наличие нитрат-ионов может быть частично определено с помощью коричневой кольцевой тест.
- Наличие нитрит-ионов можно частично определить с помощью обесцвечивание перманганата калия.
- Азотная кислота используется в качестве прекурсора для многих реакций органической химии, в качестве окислителя и в других областях.
Азотная кислота — Химическая компания
Азотная кислотаTCC (HNO 3 ) представляет собой сильно коррозионную и токсичную сильную минеральную кислоту, которая обычно бесцветна, но имеет тенденцию приобретать желтый оттенок из-за накопления оксидов азота при длительном хранении.
 Обыкновенная азотная кислота имеет концентрацию 68%. Когда раствор содержит более 86% HNO3, его называют дымящей азотной кислотой. В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота с концентрацией выше 95%. Азотная кислота также широко используется в качестве сильного окислителя.
Обыкновенная азотная кислота имеет концентрацию 68%. Когда раствор содержит более 86% HNO3, его называют дымящей азотной кислотой. В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота с концентрацией выше 95%. Азотная кислота также широко используется в качестве сильного окислителя.Кислота азотная безводная чистая (100%) представляет собой бесцветную подвижную жидкость плотностью 1,512 г/см2, затвердевающую при -42°С с образованием белых кристаллов.Она кипит при 83°С. Следовательно, безводную азотную кислоту следует хранить при температуре ниже 0°С во избежание разложения.
Азотную кислоту получают реакцией двуокиси азота (NO 2 ) с водой. Обычно оксид азота, образующийся в результате реакции, повторно окисляется кислородом воздуха с образованием дополнительного количества диоксида азота. Добавляя серную кислоту к азотнокислой соли и нагревая смесь на масляной бане, можно получить почти чистую азотную кислоту.
 Конденсатор используется для конденсации паров азотной кислоты, выделяющихся из раствора.
Конденсатор используется для конденсации паров азотной кислоты, выделяющихся из раствора.В промышленности крепкая азотная кислота производится путем растворения дополнительного количества диоксида азота в 68% азотной кислоте в абсорбционной колонне. Растворенные оксиды азота либо удаляются в случае белой дымящей азотной кислоты, либо остаются в растворе, образуя красную дымящую азотную кислоту. Совсем недавно были разработаны электрохимические средства для производства безводной кислоты из исходного концентрированного азотнокислого сырья.
Растворы азотной кислоты товарного сорта обычно содержат от 52% до 68% азотной кислоты.Производство азотной кислоты осуществляется по процессу Оствальда, названному в честь немецкого химика Вильгельма Оствальда. В этом процессе безводный аммиак окисляется до оксида азота в присутствии платинового или родиевого калибровочного катализатора при высокой температуре около 500 К и давлении 9 бар.
Приложения
Азотная кислота используется в производстве аммиачной селитры для удобрений, изготовления пластмасс и в производстве красителей.
 Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил.При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.
Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил.При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.Азотная кислота обычно используется в научных лабораториях в школах для проведения экспериментов при специальном тестировании на хлорид. Это достигается путем добавления образца с раствором нитрата серебра и азотной кислотой для проверки наличия белого осадка хлорида серебра.В области медицины азотная кислота используется в чистом виде как едкое средство для удаления шанкров и бородавок. Разведенные растворы применяют при лечении диспепсии.
Азотная кислота использовалась в различных формах в качестве окислителя в жидкостных ракетах. Эти формы включают красную дымящую азотную кислоту, белую дымящую азотную кислоту, смеси с серной кислотой и формы с ингибитором HF.

Он также обычно используется в процессе разложения образцов мутной воды, образцов твердого ила, а также других типов уникальных образцов, требующих элементного анализа с помощью ICP-MS, ICP-OES, ICP-AES, GFAA и пламенной атомно-абсорбционной спектроскопии. .
В органическом синтезе азотная кислота может использоваться для введения нитрогруппы. При использовании с серной кислотой образуется ион нитрония, который электрофильно реагирует с ароматическими соединениями, такими как бензол.
В электрохимии азотная кислота используется в качестве химического легирующего агента для органических полупроводников и в процессах очистки необработанных углеродных нанотрубок.
В низкой концентрации азотная кислота часто используется в деревообработке для искусственного старения сосны и клена.Цвет получается серо-золотистый, очень похожий на очень старое дерево, обработанное воском или маслом.
Азотную кислоту можно использовать в качестве точечного теста на алкалоиды, такие как ЛСД, который дает различные цвета в зависимости от алкалоида.

Азотная кислота – обзор
3.3.12.1 Азотная кислота
Азотная кислота (HNO 3 , также известная как aqua fortis и спирт селитры) является очень агрессивной минеральной кислотой. Чистое соединение бесцветно, но более старые образцы имеют тенденцию приобретать желтый оттенок из-за разложения на оксиды азота (NO x ) и воду.Наиболее коммерчески доступная азотная кислота имеет концентрацию 68% (об./об.) в воде. Если раствор содержит более 86% (об./об.) азотной кислоты, он обозначается как дымящаяся азотная кислота , которая, в зависимости от количества присутствующего диоксида азота (NO 2 ), далее характеризуется как (i ) белая дымящаяся азотная кислота или (2) красная дымящаяся азотная кислота при концентрации выше 95%. Азотная кислота является основным реагентом, используемым для нитрования — добавления нитрогруппы (NO 2 ), обычно к органической молекуле.В то время как некоторые из полученных нитросоединений являются взрывчатыми веществами, чувствительными к ударам и температуре (например, нитроглицерин и тринитротолуол (ТНТ)), некоторые из них достаточно стабильны, чтобы их можно было использовать в боеприпасах и разрушениях, в то время как другие еще более стабильны и используются в качестве пигментов в чернилах.
 и красители. Азотная кислота также широко используется в качестве сильного окислителя.
и красители. Азотная кислота также широко используется в качестве сильного окислителя.Азотная кислота используется в качестве промежуточного продукта при производстве нитрата аммония (NH 4 NO 3 ), который в основном используется для производства удобрений.Азотная кислота также используется в процессе окисления для производства адипиновой кислоты (HO 2 CCH 2 CH 2 CH 2 CH 2 CO 2 H), которая представляет собой дикарбоновую кислоту, используемую в производство нейлона.
Азотная кислота также используется в органическом окислении для производства терефталевой кислоты (C 6 H 4 (CO 2 H) 2 ) и других органических соединений.
Азотная кислота также используется в производстве взрывчатых веществ, таких как производные нитробензола, производные динитротолуола и производные тротила, а также для производства других химических промежуточных продуктов.

Азотная кислота производится двумя способами: (1) первый метод использует окисление, конденсацию и абсорбцию для получения слабой азотной кислоты с концентрацией от 30% до 70% (об./об.) азотной кислоты, и ( 2) второй способ сочетает обезвоживание, отбелку, конденсацию и абсорбцию с получением концентрированной азотной кислоты из слабой азотной кислоты; высококонцентрированная азотная кислота обычно содержит более 90% (об./об.) азотной кислоты.
Процесс обычно состоит из трех стадий: (1) окисление аммиака, (2) окисление оксида азота и (3) абсорбция.Каждый шаг соответствует отдельной химической реакции. Для стадии окисления аммиака смесь аммиака и воздуха 1:9 окисляется при температуре 750–800°C (1380–1470°F) при прохождении через каталитический нейтрализатор:
4Nh4+5O2→4NO+6h3O
Наиболее часто используемый катализатор состоит из платиновой (90 % по массе) и родиевой (10 % по массе) сетки и в этих условиях. окисление аммиака до оксида азота протекает в экзотермической реакции с диапазоном выхода порядка 93–98% (об.
 /об.).Более высокие температуры катализатора повышают селективность реакции в отношении образования оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными в отношении образования азота (N 2 ) и оксида азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.
/об.).Более высокие температуры катализатора повышают селективность реакции в отношении образования оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными в отношении образования азота (N 2 ) и оксида азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.Оксид азота, образующийся при окислении аммиака, окисляется на другом отдельном этапе.На этом этапе технологический поток проходит через охладитель/конденсатор и охлаждается до 38°C (100°F) или ниже при давлении до 116 фунтов на квадратный дюйм, а оксид азота некаталитически реагирует с остаточным кислородом с образованием диоксида азота и жидкого димер, четырехокись азота; эта медленная гомогенная реакция зависит от температуры и давления:
4NO+2O2→2NO2+N2O4
При низких температурах и высоком давлении максимальное образование диоксида азота происходит за минимальное время реакции.

Абсорбция является последней стадией процесса, и смесь диоксида азота/димера вводят в процесс абсорбции после охлаждения. Смесь перекачивается в нижнюю часть абсорбционной колонны, а жидкий четырехокись азота добавляется в более высокую точку. Деионизированная вода поступает в верхнюю часть колонны, и обе жидкости текут в противоточном направлении, что позволяет протекать экзотермической реакции окисления в свободном пространстве между тарелками, в то время как абсорбция происходит на тарелках.Абсорбционные тарелки обычно представляют собой ситчатые или колпачковые тарелки:
3NO2+h3O→2HNO3+NO
В колонну вводят поток вторичного воздуха для повторного окисления оксида азота, который образуется в этой реакции. Этот поток вторичного воздуха также удаляет любой диоксид азота из полученной кислоты. Водный раствор (обычно) 55–65% (об./об.) азотной кислоты выводят из нижней части колонны; концентрация кислоты может варьироваться от 30% до 70% (об./об.) азотной кислоты. Однако концентрация кислоты зависит от температуры, давления и количества ступеней абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.

Хотя конфигурации могут несколько различаться между заводами, обычно используются три основных этапа. На первом этапе аммиак окисляется до оксида азота (NO) в каталитическом нейтрализаторе на платиновом катализаторе (90 % платины и 10 % родия). Реакция является экзотермической (с выделением тепла) и дает оксид азота с выходом порядка 93–98%. Реакция протекает при высоких температурах в диапазоне от 750°C до 900°C (1380–1650°F). Полученная в результате этой реакции смесь затем направляется в котел-утилизатор, где производится пар.На втором этапе оксид азота окисляется путем прохождения через охладитель/конденсатор, где он охлаждается до температуры порядка 38°C (100°F) или ниже при давлении до 116 фунтов на квадратный дюйм. На этом этапе оксид азота реагирует с остаточным кислородом с образованием диоксида азота и четырехокиси азота. На последнем этапе эта смесь оксидов азота вводится в процесс абсорбции, где смесь течет в противотоке с деионизированной водой и дополнительным жидким четырехокисью азота.
 Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.
Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.Азотная кислота высокой концентрации (98–99 % по объему) может быть получена путем концентрирования слабой азотной кислоты (концентрация 30–70 %) методом экстрактивной перегонки.Слабая азотная кислота не может быть сконцентрирована простой фракционной перегонкой. Перегонку необходимо проводить в присутствии дегидратирующего агента. Концентрированная серная кислота (обычно 60% по объему серной кислоты) чаще всего используется для этой цели. Процесс концентрирования азотной кислоты состоит из подачи концентрированной серной кислоты и азотной кислоты концентрацией 55–65% (об.
 /об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, и концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Концентрированные пары кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны.
/об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, и концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Концентрированные пары кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны.Выбросы при производстве азотной кислоты включают главным образом оксиды азота (NO и NO 2 ), а также следовые количества аммиака и тумана азотной кислоты.
 Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер подается недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.
Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер подается недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.Борьба с выбросами заводов по производству азотной кислоты обычно осуществляется посредством расширенной абсорбции или каталитического восстановления.Расширенная абсорбция работает за счет повышения эффективности процесса абсорбции. Каталитическое восстановление окисляет оксиды азота в хвостовых газах и восстанавливает их до азота. Хотя каталитическое восстановление является более энергоемким, оно обеспечивает большее сокращение выбросов, чем метод расширенной абсорбции. Менее используемые варианты контроля включают мокрые скрубберы или молекулярные сита, оба из которых имеют более высокие капитальные и эксплуатационные затраты, чем другие варианты.

Твердые отходы производства азотной кислоты включают отработанные катализаторы, которые либо возвращаются производителю, либо утилизируются.Пыль от катализатора может оседать в оборудовании, но если в ней есть драгоценные металлы, ее извлекают и отправляют на переработку сторонним поставщикам. Драгоценные металлы (например, платина), выпадающие из катализатора окисления аммиака, улавливаются улавливающей сеткой (геттером), которую необходимо периодически заменять и которая перерабатывается производителем сетки. Фильтры, используемые для фильтрации аммиака/воздуха, также должны быть заменены.
Разница между дымящейся азотной кислотой и концентрированной азотной кислотой
Опубликовано Madhu
Ключевое различие между дымящей азотной кислотой и концентрированной азотной кислотой заключается в том, что дымящая азотная кислота образует бесцветный, желтоватый или коричневатый дым, тогда как концентрированная азотная кислота обычно не образует дым; но очень высокая концентрация этой кислоты может давать грязно-белый дым.

Азотная кислота — очень агрессивная и опасная кислота, имеющая химическую формулу HNO3. При этом он может иметь как разбавленную, так и концентрированную химическую природу. В любом случае, в воде растворены молекулы азотной кислоты. Реакция между диоксидом азота и водой приводит к образованию азотной кислоты. Но при получении дымящей азотной кислоты мы можем приготовить ее, добавив к азотной кислоте избыток диоксида азота.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое дымящаяся азотная кислота
3.Что такое концентрированная азотная кислота
4. Сравнение бок о бок – дымящаяся азотная кислота и концентрированная азотная кислота в табличной формеЧто такое дымящаяся азотная кислота?
Дымящаяся азотная кислота представляет собой азотную кислоту товарного сорта с очень высокой концентрацией и высокой плотностью. Содержит 90-99% HNO3. Мы можем приготовить эту жидкость, добавив избыток диоксида азота в азотную кислоту.
 Он образует бесцветную, желтоватую или коричневатую дымящуюся жидкость, обладающую высокой коррозионной активностью.Следовательно, этот кислый раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Дым этой кислоты поднимается над поверхностью кислоты; это привело к его названию «дымящий». Химическая формула этого соединения: HNO 3-x NO 2 .
Он образует бесцветную, желтоватую или коричневатую дымящуюся жидкость, обладающую высокой коррозионной активностью.Следовательно, этот кислый раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Дым этой кислоты поднимается над поверхностью кислоты; это привело к его названию «дымящий». Химическая формула этого соединения: HNO 3-x NO 2 .Кроме того, существуют две основные формы этой кислоты: белая и красная дымящаяся азотная кислота. Поэтому мы считаем белую дымящую кислоту самой чистой формой азотной кислоты, имеющей менее 2%; иногда вообще без воды.Таким образом, он очень близок к безводной азотной кислоте и доступен в виде 99% раствора. Он содержит максимум 0,5% диоксида азота. Он полезен в качестве хранимого окислителя и ракетного топлива.
Рисунок 01: Белая дымящаяся азотная кислота
Красная дымящаяся азотная кислота состоит на 90% из HNO3. Он имеет высокое содержание диоксида азота, из-за чего раствор имеет красновато-коричневый цвет.
 Имеет плотность менее 1,49 г/см 3 . Таким образом, он также полезен в качестве хранимого окислителя и ракетного топлива.Чтобы приготовить эту кислоту, мы можем использовать 84% азотную кислоту и 13% четырехокись азота с 2% воды.
Имеет плотность менее 1,49 г/см 3 . Таким образом, он также полезен в качестве хранимого окислителя и ракетного топлива.Чтобы приготовить эту кислоту, мы можем использовать 84% азотную кислоту и 13% четырехокись азота с 2% воды.Использование:
- Красная дымящаяся азотная кислота является компонентом монотоплива.
- Используется в качестве единственного топлива в ракетах.
- В качестве окислителей длительного хранения.
- Белая дымящаяся азотная кислота применяется в производстве взрывчатых веществ. Пример: нитроглицерин.
Что такое концентрированная азотная кислота?
Концентрированная азотная кислота — это просто раствор, содержащий большее количество азотной кислоты в меньшем количестве воды.Это означает, что концентрированная форма этой кислоты содержит меньше воды по сравнению с количеством растворенных в ней веществ. В коммерческом масштабе 68% или выше считается концентрированной азотной кислотой.

Рисунок 02: 70 % азотная кислота
При этом плотность этого раствора составляет 1,35 г/см 3 . Эта большая концентрация не дает дыма, но очень высокая концентрация этой кислоты может давать грязно-белый дым. Мы можем получить эту жидкость путем взаимодействия диоксида азота с водой.
В чем разница между дымящейся азотной кислотой и концентрированной азотной кислотой?
Дымящаяся азотная кислота представляет собой азотную кислоту товарного сорта с очень высокой концентрацией и высокой плотностью. Кроме того, он образует бесцветный, желтоватый или коричневатый дым. Самая низкая концентрация этой кислоты составляет 90%. Концентрированная азотная кислота — это просто раствор, содержащий больше азотной кислоты в меньшем количестве воды. Самая низкая концентрация этой кислоты составляет 68%. Кроме того, эта кислота обычно не образует дыма; но очень высокая концентрация этой кислоты может давать грязно-белый дым.Следующая инфографика представляет более подробную информацию о разнице между дымящей азотной кислотой и концентрированной азотной кислотой.
Резюме
— Дымящаяся азотная кислота против концентрированной азотной кислоты
Существуют две формы азотной кислоты с высокой концентрацией HNO3; это дымная азотная кислота и концентрированная азотная кислота. Основное различие между дымящей азотной кислотой и концентрированной азотной кислотой заключается в том, что дымящаяся азотная кислота образует бесцветный, желтоватый или коричневатый дым, тогда как концентрированная азотная кислота обычно не образует дыма; но очень высокая концентрация этой кислоты может давать грязно-белый дым.
Артикул:
1. «Азотная кислота». Википедия, Фонд Викимедиа, 31 июля 2018 г. Доступно здесь
2. «Азотная кислота». Национальный центр биотехнологической информации. База данных соединений PubChem, Национальная медицинская библиотека США. Доступно здесьИзображение предоставлено:
1. «Дымление азотной кислоты» В. Оэлен (CC BY-SA 3.0) через Commons Wikimedia
2. «Азотная кислота 70» Александр Соболевский через Wikimedia Commons (CC BY-SA 4. 0) через Commons Wikimedia
0) через Commons WikimediaМедный пенни с концентрированной азотной кислотой
В результате реакции образуется красно-коричневый газообразный диоксид азота и горячий концентрированный раствор нитрата меди(II) синего цвета.По мере испарения воды и охлаждения раствора начинают формироваться кристаллы Cu(NO 3 ) 2 ( s ).
CU ( S ) + 4Hno 3 ( AQ ) → CU (NO 3 ) 2 ( AQ ) + 2NO 2 ( г ) + 2H 2 o ( л )
Нижеследующее взято из статьи Ричарда Раметта (1), в которой содержится цитата Айры Ремсен о воздействии азотной кислоты на медь.
Читая учебник по химии, я наткнулся на утверждение: «Азотная кислота действует на медь.Мне надоело читать такие абсурдные вещи, и я решил посмотреть, что это значит. Медь была мне более или менее знакома, потому что тогда в ходу были медные центы. Я видел бутылку с пометкой азотная кислота на столе в кабинете врача.
 где я тогда «отбывал срок». Я не знал его особенностей, но дух авантюризма был на мне. Имея азотную кислоту и медь, мне оставалось только узнать, что означают слова «действует на». кислота действует на медь» было бы чем-то большим, чем просто слова.Все было тихо. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда располагал. Я поставил одну из них на стол, открыл бутыль с надписью «Азотная кислота», вылил немного жидкости на котел и приготовился сделать наблюдение. Но что это была за чудесная вещь, которую я увидел? Цента уже поменяли, и это тоже была немалая сдача. Зелено-голубая жидкость пенилась и дымила над центом и над столом. Воздух в районе спектакля окрасился в темно-красный цвет.Поднялось большое цветное облако. Это облако было неприятным и удушающим. Как мне остановить это? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно. Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту.
где я тогда «отбывал срок». Я не знал его особенностей, но дух авантюризма был на мне. Имея азотную кислоту и медь, мне оставалось только узнать, что означают слова «действует на». кислота действует на медь» было бы чем-то большим, чем просто слова.Все было тихо. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда располагал. Я поставил одну из них на стол, открыл бутыль с надписью «Азотная кислота», вылил немного жидкости на котел и приготовился сделать наблюдение. Но что это была за чудесная вещь, которую я увидел? Цента уже поменяли, и это тоже была немалая сдача. Зелено-голубая жидкость пенилась и дымила над центом и над столом. Воздух в районе спектакля окрасился в темно-красный цвет.Поднялось большое цветное облако. Это облако было неприятным и удушающим. Как мне остановить это? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно. Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту. Я провел пальцами по штанам, и обнаружился еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, вероятно, самый дорогостоящий эксперимент, который я когда-либо проводил.Это было для меня откровением. Это привело к желанию с моей стороны узнать больше об этом замечательном виде деятельности. Ясно, что единственным способом узнать об этом было увидеть его результаты, поэкспериментировать, поработать в лаборатории.
Я провел пальцами по штанам, и обнаружился еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, вероятно, самый дорогостоящий эксперимент, который я когда-либо проводил.Это было для меня откровением. Это привело к желанию с моей стороны узнать больше об этом замечательном виде деятельности. Ясно, что единственным способом узнать об этом было увидеть его результаты, поэкспериментировать, поработать в лаборатории.- Ramette, Richard M. Exocharmic Reactions J. Chem. Образовательный 1980 57 68-69.
.
- Азотная кислота может быть получена в лаборатории по реакции калия
или нитрат натрия и серная кислота.
 Смешивается с водой в любых соотношениях. Азотная кислота сильная: в водном растворе она полностью диссоциирует с образованием катиона водорода и аниона
кислотного остатка.
Смешивается с водой в любых соотношениях. Азотная кислота сильная: в водном растворе она полностью диссоциирует с образованием катиона водорода и аниона
кислотного остатка. Это оставляет нам варианты
B и D.
Это оставляет нам варианты
B и D.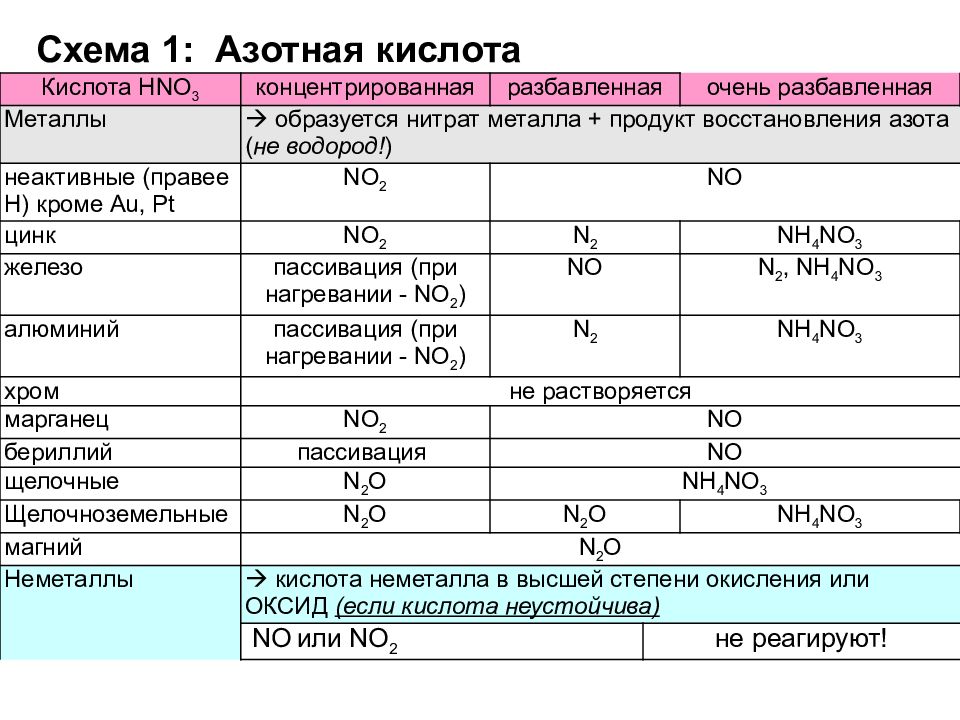 Другой газ, образующийся при разложении,
кислород вместе с жидкой водой.
Другой газ, образующийся при разложении,
кислород вместе с жидкой водой. Это означает, что разница между
+5 и +2 равно -3,
что является правильным ответом.
Это означает, что разница между
+5 и +2 равно -3,
что является правильным ответом. Упорядочивание реакций металлического магния с различными концентрациями
Азотная кислота
Упорядочивание реакций металлического магния с различными концентрациями
Азотная кислота
 После смешивания в пробирке
несколько капель концентрированной серной кислоты осторожно стекают по
внутри стен. Когда концентрированная серная кислота встречается со смесью на поверхности
жидкости появляется коричневое кольцо, которое затем исчезает при встряхивании или нагревании. В этом тесте протекают две стадии реакций. Первоначально оксид азота
(NO) производится на месте:
2NaNO()+6FeSO()+4HSO()3Fe(SO)()+NaSO()+4HO()+2NO()3424243242aqaqaqaqaqlg
После смешивания в пробирке
несколько капель концентрированной серной кислоты осторожно стекают по
внутри стен. Когда концентрированная серная кислота встречается со смесью на поверхности
жидкости появляется коричневое кольцо, которое затем исчезает при встряхивании или нагревании. В этом тесте протекают две стадии реакций. Первоначально оксид азота
(NO) производится на месте:
2NaNO()+6FeSO()+4HSO()3Fe(SO)()+NaSO()+4HO()+2NO()3424243242aqaqaqaqaqlg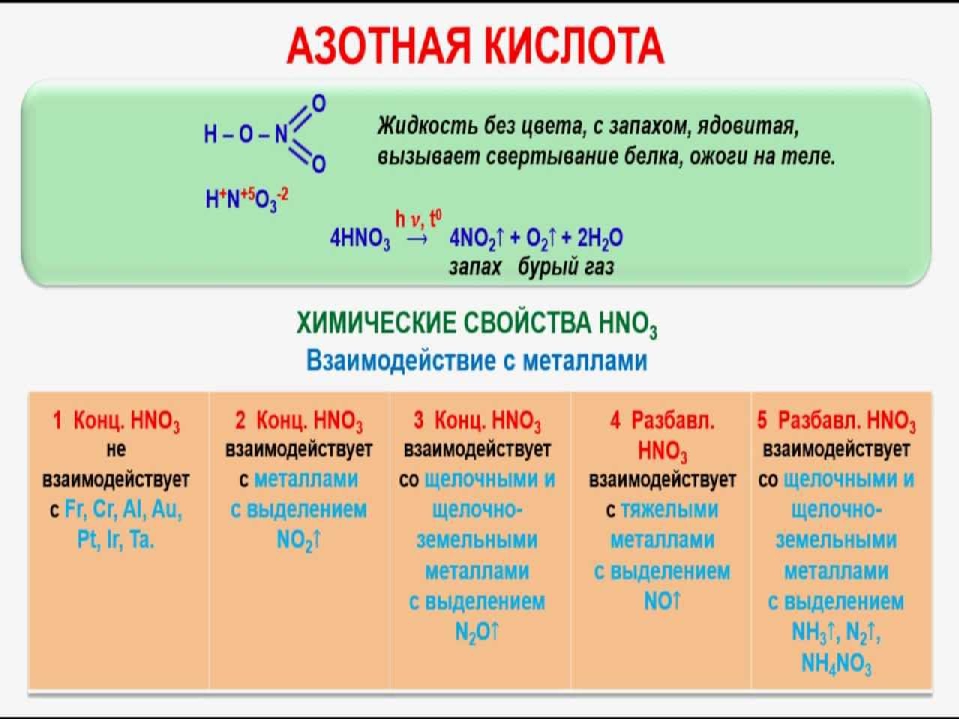 Сначала они добавили в раствор сульфат железа (II), а затем медленно добавили
концентрированная серная кислота.Они заметили образование двух слоев с
цветное кольцо на интерфейсе. Если бы нитрат-ионы присутствовали, какой цвет
кольцо должно было быть?
Сначала они добавили в раствор сульфат железа (II), а затем медленно добавили
концентрированная серная кислота.Они заметили образование двух слоев с
цветное кольцо на интерфейсе. Если бы нитрат-ионы присутствовали, какой цвет
кольцо должно было быть?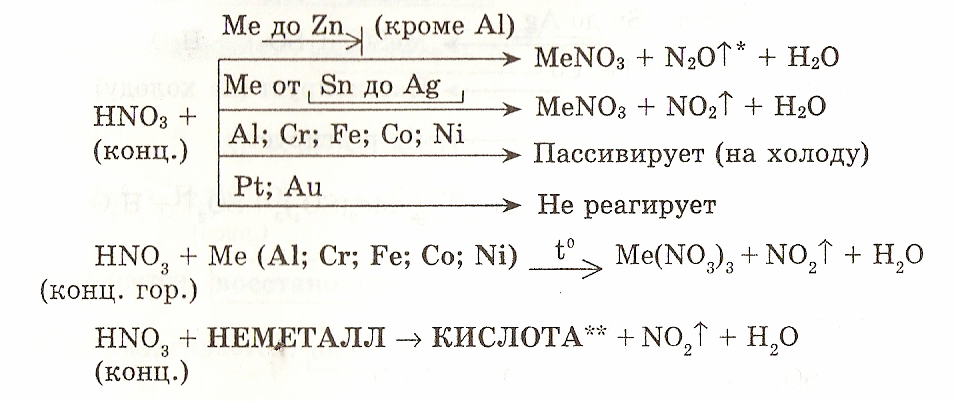

 Обыкновенная азотная кислота имеет концентрацию 68%. Когда раствор содержит более 86% HNO3, его называют дымящей азотной кислотой. В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота с концентрацией выше 95%. Азотная кислота также широко используется в качестве сильного окислителя.
Обыкновенная азотная кислота имеет концентрацию 68%. Когда раствор содержит более 86% HNO3, его называют дымящей азотной кислотой. В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота с концентрацией выше 95%. Азотная кислота также широко используется в качестве сильного окислителя. Конденсатор используется для конденсации паров азотной кислоты, выделяющихся из раствора.
Конденсатор используется для конденсации паров азотной кислоты, выделяющихся из раствора. Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил.При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.
Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил.При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.
 и красители. Азотная кислота также широко используется в качестве сильного окислителя.
и красители. Азотная кислота также широко используется в качестве сильного окислителя.
 /об.).Более высокие температуры катализатора повышают селективность реакции в отношении образования оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными в отношении образования азота (N 2 ) и оксида азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.
/об.).Более высокие температуры катализатора повышают селективность реакции в отношении образования оксида азота (NO), в то время как более низкие температуры катализатора имеют тенденцию быть более селективными в отношении образования азота (N 2 ) и оксида азота (N 2 O). Оксид азота считается критериальным загрязнителем, а оксид азота известен как парниковый газ. Затем смесь двуокиси азота/димера проходит через котел-утилизатор и платиновый фильтр.

 Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.
Колонна заполнена тарелками ситового или колпачкового типа для дистилляции.Окисление происходит между лотками в колонне; впитывание происходит на лотках. В башне происходит экзотермическая реакция между NO 2 и водой с образованием азотной кислоты и NO. В колонну вводят воздух для повторного окисления образующегося NO и удаления NO 2 из азотной кислоты. Раствор слабой кислоты (55–65 %) отбирают из нижней части абсорбционной колонны.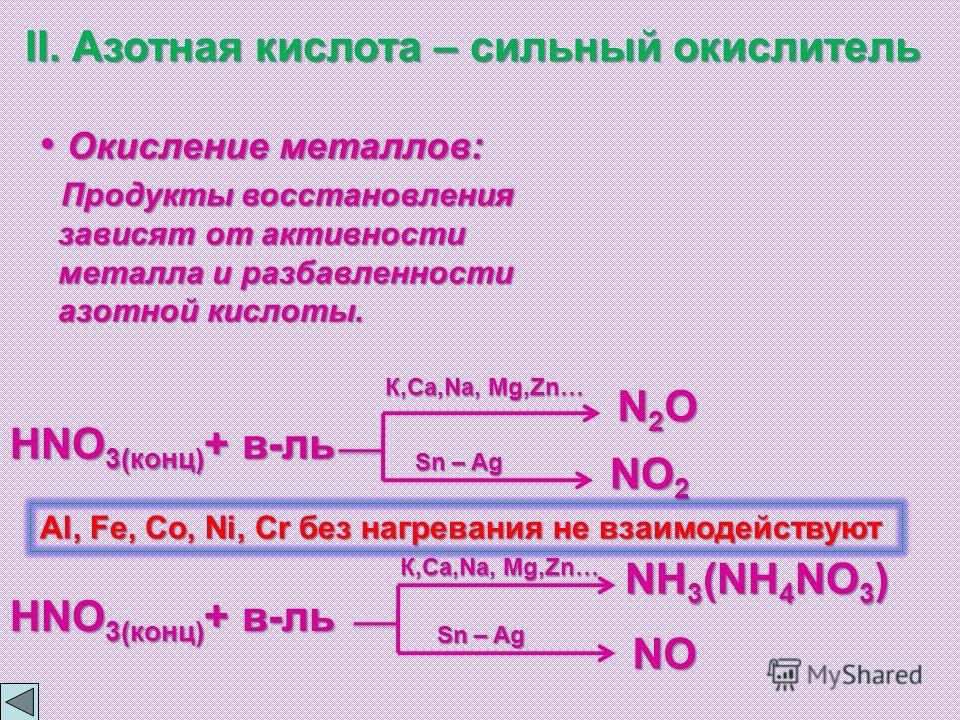 /об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, и концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Концентрированные пары кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны.
/об.) в верхнюю часть насадочной колонны дегидратации при примерно атмосферном давлении. Кислотная смесь течет вниз, и концентрированная азотная кислота выходит из верхней части колонны в виде 99% (об./об.) паров, которые содержат небольшое количество диоксида азота и кислорода, образующихся в результате диссоциации азотной кислоты.Концентрированные пары кислоты покидают колонну и направляются в отбеливатель и систему противоточного конденсатора для конденсации крепкой азотной кислоты и разделения побочных продуктов кислорода и оксидов азота. Эти побочные продукты затем поступают в абсорбционную колонну, где окись азота смешивается со вспомогательным воздухом с образованием двуокиси азота, которая извлекается в виде слабой азотной кислоты. Инертные и непрореагировавшие газы выбрасываются в атмосферу из верхней части абсорбционной колонны. Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер подается недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.
Хвостовые газы колонны абсорбции кислоты являются крупнейшим источником выбросов оксидов азота. Эти выбросы могут увеличиваться, когда в окислитель и абсорбер подается недостаточно воздуха, в условиях низкого давления в абсорбере и в условиях высокой температуры в охладителе/конденсаторе и абсорбере. Этому могут способствовать и другие факторы, такие как высокая пропускная способность, очень прочные изделия или неисправные компрессоры или насосы.

 Он образует бесцветную, желтоватую или коричневатую дымящуюся жидкость, обладающую высокой коррозионной активностью.Следовательно, этот кислый раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Дым этой кислоты поднимается над поверхностью кислоты; это привело к его названию «дымящий». Химическая формула этого соединения: HNO 3-x NO 2 .
Он образует бесцветную, желтоватую или коричневатую дымящуюся жидкость, обладающую высокой коррозионной активностью.Следовательно, этот кислый раствор имеет газообразные молекулы в сочетании с водой; в нем нет воды. Дым этой кислоты поднимается над поверхностью кислоты; это привело к его названию «дымящий». Химическая формула этого соединения: HNO 3-x NO 2 . Имеет плотность менее 1,49 г/см 3 . Таким образом, он также полезен в качестве хранимого окислителя и ракетного топлива.Чтобы приготовить эту кислоту, мы можем использовать 84% азотную кислоту и 13% четырехокись азота с 2% воды.
Имеет плотность менее 1,49 г/см 3 . Таким образом, он также полезен в качестве хранимого окислителя и ракетного топлива.Чтобы приготовить эту кислоту, мы можем использовать 84% азотную кислоту и 13% четырехокись азота с 2% воды.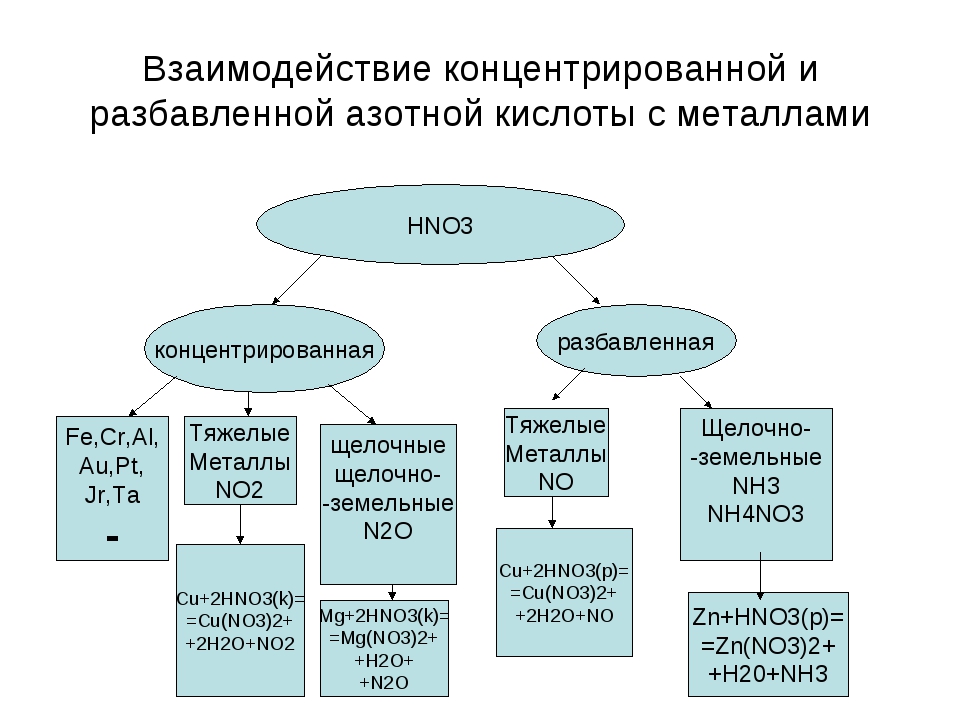

 0) через Commons Wikimedia
0) через Commons Wikimedia где я тогда «отбывал срок». Я не знал его особенностей, но дух авантюризма был на мне. Имея азотную кислоту и медь, мне оставалось только узнать, что означают слова «действует на». кислота действует на медь» было бы чем-то большим, чем просто слова.Все было тихо. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда располагал. Я поставил одну из них на стол, открыл бутыль с надписью «Азотная кислота», вылил немного жидкости на котел и приготовился сделать наблюдение. Но что это была за чудесная вещь, которую я увидел? Цента уже поменяли, и это тоже была немалая сдача. Зелено-голубая жидкость пенилась и дымила над центом и над столом. Воздух в районе спектакля окрасился в темно-красный цвет.Поднялось большое цветное облако. Это облако было неприятным и удушающим. Как мне остановить это? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно. Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту.
где я тогда «отбывал срок». Я не знал его особенностей, но дух авантюризма был на мне. Имея азотную кислоту и медь, мне оставалось только узнать, что означают слова «действует на». кислота действует на медь» было бы чем-то большим, чем просто слова.Все было тихо. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда располагал. Я поставил одну из них на стол, открыл бутыль с надписью «Азотная кислота», вылил немного жидкости на котел и приготовился сделать наблюдение. Но что это была за чудесная вещь, которую я увидел? Цента уже поменяли, и это тоже была немалая сдача. Зелено-голубая жидкость пенилась и дымила над центом и над столом. Воздух в районе спектакля окрасился в темно-красный цвет.Поднялось большое цветное облако. Это облако было неприятным и удушающим. Как мне остановить это? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно. Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту. Я провел пальцами по штанам, и обнаружился еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, вероятно, самый дорогостоящий эксперимент, который я когда-либо проводил.Это было для меня откровением. Это привело к желанию с моей стороны узнать больше об этом замечательном виде деятельности. Ясно, что единственным способом узнать об этом было увидеть его результаты, поэкспериментировать, поработать в лаборатории.
Я провел пальцами по штанам, и обнаружился еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, вероятно, самый дорогостоящий эксперимент, который я когда-либо проводил.Это было для меня откровением. Это привело к желанию с моей стороны узнать больше об этом замечательном виде деятельности. Ясно, что единственным способом узнать об этом было увидеть его результаты, поэкспериментировать, поработать в лаборатории.