Азотная кислота, подготовка к ЕГЭ по химии
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO 2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

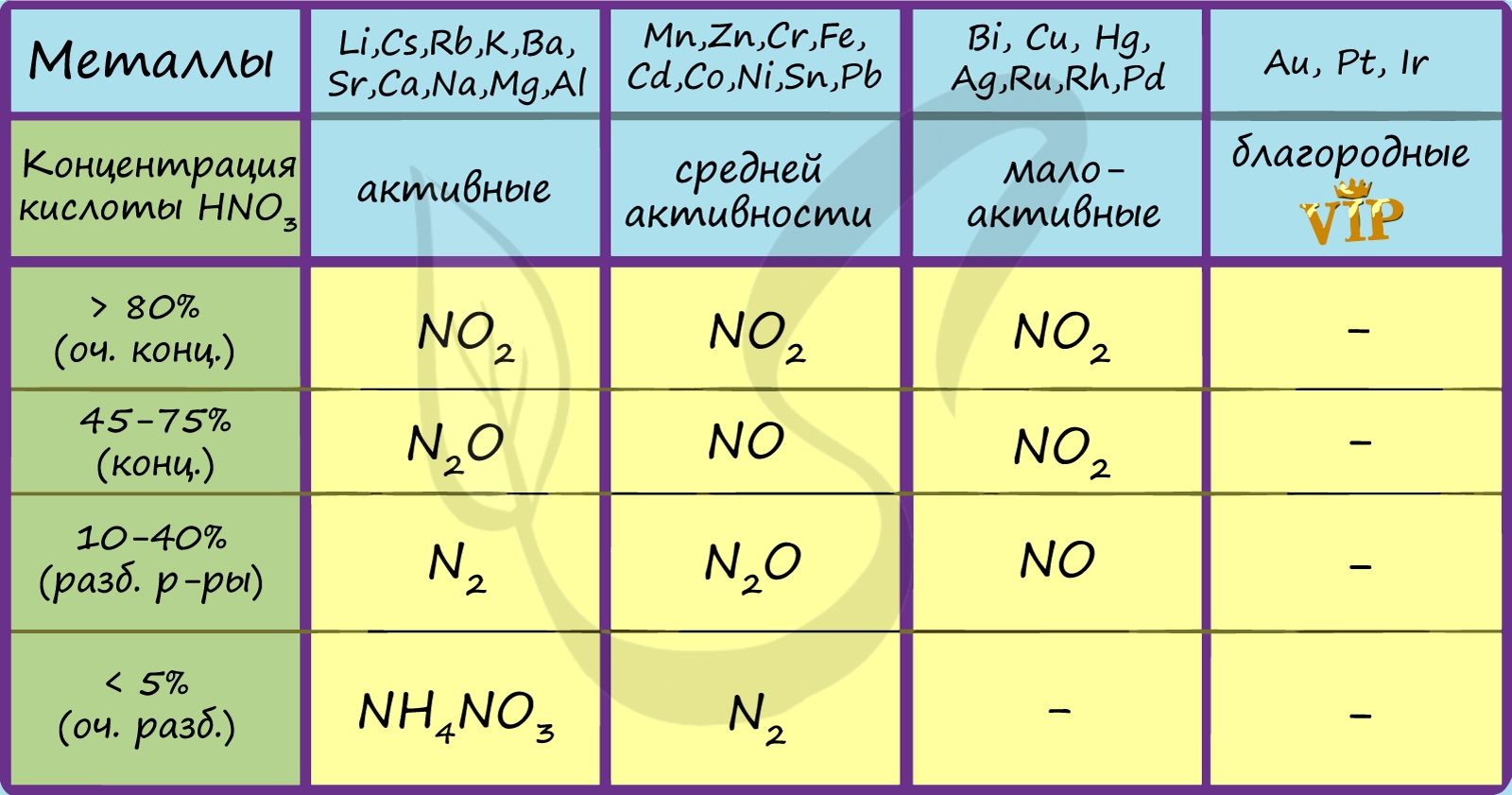
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
Cu + HNO 3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O

Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Zn + HNO3(3% — оч. разб.) → Zn(NO3)2 + NH4NO3 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al2O3 + NO2 + H2O
Соли азотной кислоты — нитраты NO3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3
)2 + NH4NO3 + H2OFe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
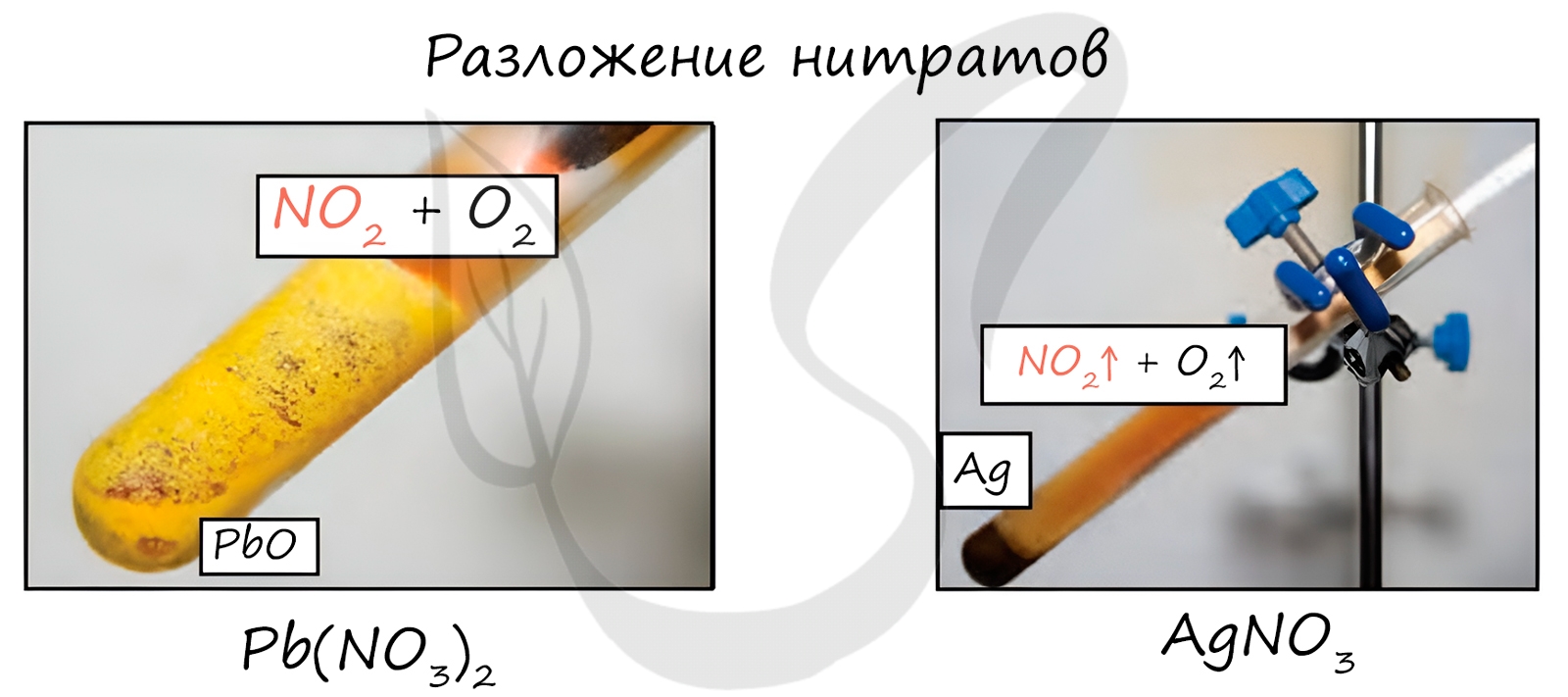
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) KNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Азотная кислота
Азотная кислота (HNO3) — одноосновная неорганическая кислота, представляющая собой прозрачную жидкость с неприятным удушливым запахом.
Кристаллизуется при температуре -420С, закипает при 830С. Образует с водой азеотропную смесь с процентным содержанием компонентов: H2O — 32% и HNO3 — 68%.
HNO3 является сильным электролитом.
Безводная азотная кислота неустойчива, при солнечном свете происходит её разложение:
4HNO3 = 4NO2↑ + O2↑+ 2H2O
Чем выше температура и концентрация раствора, тем быстрее происходит реакция разложения.
Интересным и немаловажным фактом является то, что степень окисления (СО) азота в кислоте и его валентность не совпадают. Азот в данном соединении проявляет СО, равную пяти H+1N+5O-23.
Однако максимальная допустимая валентность азота равна четырём, так как у него есть всего 4 электронных облака, на которых и расположены валентные электроны.
История открытия
Азотная кислота прошла долгий исторический путь, прежде чем стала узнаваема. Первым получил и описал её арабский алхимик Гебер (Джабир) на рубеже VIII-IX веков. Интересно то, что азотная кислота высоких концентраций была впервые получена только в XVII веке немецким алхимиком И.Глаубером. При этом молекулярный состав вещества был неизвестен.
В 20-х годах XIX века Ж. Гей-Люссак вывел формулу, которая закрепилась и используется при обозначении азотной кислоты по сей день.
Химические свойства
Азотная кислота обладает сильными окислительными свойствами. Реагирует со многими неметаллами, при этом образуя соответствующие кислоты. Например, если к концентрированной азотной кислоте добавить серу и прокипятить эту смесь, то произойдёт образование серной кислоты.
Азотная кислота оказывает действие на многие металлы, в ходе реакции образуется соль, вода и газ. На то, какой именно газ выделится, влияет концентрация кислоты и активность металла. С повышением концентрации азотной кислоты восстановление будет происходить хуже. Эта зависимость выражается следующим образом:
NO2 → NO → N2O → N2 → NH4NO3
← →
Повышение концентрации кислоты Повышение активности металла
Так, при взаимодействии HNO3(конц.) с металлом, который стоит правее водорода в ряду напряжений, образуется NO2↑:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Разбавленная кислота реагирует с таким металлом с выделением NO↑:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
С активными металлами, стоящими в ряду напряжений до водорода реакция выглядит следующим образом:
8Li + 10HNO3(разб.) = 8LiNO3+ NH4NO3↑ + 3H2O
С такими металлами, как золото, платина, палладий, тантал азотная кислота не взаимодействует, какой бы высокой ни была её концентрация. HNO3(конц.) на холоде пассивирует такие элементы, как: Fe, Al, Cr, Be, Co, Ni. Они покрываются оксидной плёнкой, из-за чего становятся неактивными.
Но существует смесь азотной и соляной кислот в пропорции 1:3, которая носит интересное название “царская водка”. Это сильнейшее вещество способно растворить те металлы, которые в принципе не вступают в реакцию с азотной кислотой, одним из примеров является золото. Кстати, от этого и происходит название, ведь золото называют “царём металлов”. Действие этого необычного вещества обуславливается выделением таких газов, как хлор и хлорид нитрозила (NOCl) в результате взаимодействия:
HNO3 + 3HCl = Cl2 + NOCl + 2H2O
Азотная кислота способна вытеснить слабые кислоты из их солей:
CaCO3 + HNO3 = Ca(NO3) + CO2↑ + H2O
Вступает в реакцию с оксидами (амфотерными и основными), в результате образуется соль и вода:
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
Также соль и вода образуются в результате реакции с щелочами и гидроксидами амфотерных металлов:
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие с органическими веществами. Азотную кислоту используют в процессе получения нитросоединений. В области органического синтеза нашла применение смесь концентрированной азотной и серной кислот. Она получила название нитрующей.
Такие органические вещества, как амины, скипидар, контактируя с азотной кислотой способны самовоспламеняться.
Реакция взаимодействия какого-либо белка с азотной кислотой сопровождается появлением ярко-жёлтой окраски – ксантопротеиновая реакция. Это происходит из-за нитрования ароматических систем.
Получение
Схема, по которой получают азотную кислоту в промышленных условиях, выглядит следующим образом: NH3 → NO → NO2 → HNO3.
1. Аммиак окисляют до оксида азота (II) в присутствии платинового катализатора:
4NH3 + 5O2 = 4NO + 6H2O
2. Полученный оксид азота (II) окисляют до оксида азота (IV):
2NO + O2 = 2NO2
3. Оксид азота (IV) абсорбируют водой в избытке О2:
4NO2↑ + O2↑+ 2H2O = 4HNO3
Концентрация азотной кислоты, полученной этим способом, не превышает 60%. При необходимости её концентрируют. В промышленных условиях выпускают разбавленную HNO3 с концентрацией 45, 47 и 55% и концентрированную 96-98%.
Транспортировку концентрированной HNO3 выполняют в алюминиевых цистернах, а разбавленной – в цистернах, изготовленных из кислотоупорной стали.
Если азотную кислоту необходимо получить в лабораторных условиях, то проводится следующая реакция:
NaNO3 + H2SO4 = NaHSO4 + HNO3
Применение
Азотная кислота является одним из основных азотных соединений. Её используют при производстве минеральных удобрений (различные селитры), взрывчатых веществ (тринитротолуол), также она входит в состав некоторых органических красителей. Является важным компонентом ракетного топлива, который играет роль окислителя. С её помощью повышается количество выделенного тепла и эффективность сгорания.
Ювелиры с помощью азотной кислоты определяют содержание золота в сплаве. В металлургии азотной кислотой растворяют и травят металлы.
hishnik-school.ru
Азотная кислота — урок. Химия, 8–9 класс.
Физические свойства
Азотная кислота HNO3 — бесцветная дымящая на воздухе жидкость с неприятным запахом. При хранении на свету она разлагается и может окрашиваться в жёлтый цвет за счёт образования бурого оксида азота(\(IV\)):
4HNO3=2h3O+4NO2↑+O2↑.
Азотная кислота смешивается с водой в любых соотношениях и в водном растворе полностью распадается на ионы:
HNO3→H++NO3−.
Общие свойства кислот
Азотная кислота реагирует с основными и амфотерными оксидами и гидроксидами с образованием нитратов:
CuO+2HNO3=Cu(NO3)2+h3O,
Al(OH)3+3HNO3=Al(NO3)3+3h3O.
Азотная кислота вступает в реакции обмена с солями других кислот, если образуется газ или осадок:
CaCO3+2HNO3=Ca(NO3)2+h3O+CO2↑.
Особые свойства
В отличие от других кислот азотная кислота реагирует с большинством металлов, кроме благородных.
Обрати внимание!
В реакциях азотной кислоты с металлами никогда не образуется водород.
Окислителем в этих реакциях выступает атом азота кислотного остатка, поэтому продуктами реакции являются соединения азота в разной степени окисления. Состав соединений зависит от активности металла и концентрации азотной кислоты. Так, при взаимодействии концентрированной азотной кислоты с медью образуется бурый оксид азота(\(IV\)):
4HN+5O3+Cu0=Cu+2(NO3)2+2N+4O2+2h3O.
Медь с концентрированной азотной кислотой
При взаимодействии разбавленной азотной кислоты с медью продукт реакции — бесцветный оксид азота(\(II\)):
8HN+5O3+3Cu0=3Cu+2(NO3)2+2N+2O+4h3O.
Обрати внимание!
Концентрированная азотная кислота пассивирует железо и алюминий.
На их поверхности под действием концентрированной кислоты образуется прочная плёнка, которая защищает металл от дальнейшей реакции. Поэтому концентрированную азотную кислоту можно транспортировать в стальных или алюминиевых цистернах.
Азотная кислота способна окислять и другие неорганические и органические вещества. Органические вещества могут воспламеняться при соприкосновении с азотной кислотой, и работа с ней требует аккуратности и осторожности.
Азотная кислота используется в промышленности для получения:
- минеральных удобрений,
- лекарств,
- взрывчатых веществ,
- пластмасс,
- красителей,
- лаков.
www.yaklass.ru
Азотная кислота
Азотная кислота – сильная кислота. Представляет собой бесцветную жидкость с резким запахом. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света она частично разлагается:
4HNO3 = 4NO2 + 2H2O + O2
Азотную кислоту в промышленности получают в три стадии. На первой стадии происходит контактное окисление аммиака до оксида азота (П):
4NH3 + 5O2 = 4NO + 6H2O
На второй стадии происходит окисление оксида азота (П) до оксида азота (IV) кислородом воздуха:
2NO + O2 = 2NO2
На третьей стадии оксид азота (IV) поглощается водой в присутствии O2:
4NO2 + 2H2O + O2 = 4HNO3
В результате получается 60-62% -ная азотная кислота. В лаборатории её получают действием концентрированной азотной кислоты на нитраты при слабом нагревании:
NaNO3 + h3SO4 = NaHSO4 + HNO3
Молекула азотной кислоты имеет плоское строение. В ней имеется четыре связи с атомом азота:
Однако два атома кислорода равноценны, так как между ними четвёртая связь атома азота делится поровну, а перешедший от него электрон принадлежит им в равной степени. Таким образом, формулу азотной кислоты можно представить в виде:
Азотная кислота является одноосновной кислотой, образует только средние соли – нитраты. Азотная кислота проявляет все свойства кислот: реагирует с оксидами металлов, гидроксидами, солями:
2HNO3 + CuO = Cu(NO3)2 + H2O
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O
Концентрированная азотная кислота реагирует со всеми металлами (кроме золота, платины, палладия) с образованием нитратов, оксида азота (+4). воды:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
Формально концентрированная азотная кислота не реагирует с железом, алюминием, свинцом, оловом, но на их поверхности она образует оксидную плёнку, предохраняющую растворение общей массы металла:
2Al + 6HNO3 = Al2O3 + 6NO2 + 3H2O
В зависимости от степени разбавленности, азотная кислота образует следующие продукты реакции:
3Mg + 8HNO3 (30%) = 3Zn(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3 (20%) = 4Zn(NO3)2 + N2O + 5H2O
Сильно разбавленная азотная кислота с активными металлами образует соединения азота (-3), по сути: аммиак, но вследствие избытка азотной кислоты он образует нитрат аммония:
4Ca + 10HNO3 = 4Ca(NO3)2 + Nh5NO3 + 3H2O
Активные металлы с сильно разбавленной кислотой на холоде могут образовывать азот:
5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O
Металлы: золото, платина, палладий реагируют с концентрированной азотной кислотой в присутствии концентрированной соляной кислоты:
Au + 3HCl + HNO3 = AuCl3 + NO + 2H2O
Азотная кислота, как сильный окислитель, окисляет простые вещества – неметаллы:
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
2HNO3 + S = H2SO4 + 2NO
5HNO3 + P = H3PO4 + 5NO2 + H2O
Кремний окисляется азотной кислотой до оксида:
4HNO3 + 3Si = 3SiO2 + 4NO + 2H2O
В присутствии фтористоводородной кислоты азотная кислота растворяет кремний:
4HNO3 + 12HF + 3Si = 3SiF4 + 4NO + 8H2O
Азотная кислота способна окислять сильные кислоты:
HNO3 + 3HCl = Cl2 + NOCl + 2H2O
Азотная кислота способна окислять как слабые кислоты, так и сложные вещества:
6HNO3 + HJ = HJO3 + NO2 + 3H2O
FeS + 10HNO3 = Fe(NO3)2 + SO2 + 7NO2 + 5H2O
Соли азотной кислоты – нитраты хорошо растворимы в воде. Соли щелочных металлов и аммония называются селитрами. Нитраты обладают менее сильной окислительной активностью, однако в присутствии кислот могут растворять даже неактивные металлы:
3Cu + 2KNO3 + 4H2SO4 = 3CuSO4 + K2SO4 + 2NO + 4H2O
Нитраты в кислой среде окисляют соли металлов с меньшей валентностью до их солей с высшей валентностью:
3FeCl2 + KNO3 + 4HCl = 3FeCl3 + KCl + NO + 2H2O
Характерной особенностью нитратов является образование кислорода при их разложении. При этом продукты реакции могут быть различны и зависеть от положения металла в ряду активности. Нитраты первой группы (от лития до алюминия) разлагаются с образованием нитритов и кислорода:
2KNO3 = 2KNO2 + O2
Нитраты второй группы (от алюминия до меди) разлагаются с образованием оксида металла, кислорода и оксида азота (IV):
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Нитраты третьей группы (после меди) разлагаются на металл, кислород и оксид азота (IV):
Hg(NO3)2 = Hg + 2NO2 + O2
Нитрат аммония при разложении не образует кислород:
NH4NO3 = N2O+ 2H2O
Сама же азотная кислота разлагается по механизму нитратов второй группы:
4HNO3 = 4NO2 + 2H2O + O2
Если у Вас есть вопросы, приглашаю Вас на свои уроки химии. Записывайтесь в расписании на сайте.
Спасибо за внимание!
Ваш Владимир Смирнов.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Азотная кислота
3) Взаимодействие Металлов с разбавленной, концентрированной азотной кислотой (примеры)
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3— имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород H2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации). HNO3(разб,конц) – разрушает все Me за исключением Au и некоторых Ме платиновой группы. Процесс протекает по схеме:
Me + HNO3  Me(NO3)n+ H2O + продукт восстановления HNO3 (N+4O2,N+2O,N2+1O,N20,N-3H3)
Me(NO3)n+ H2O + продукт восстановления HNO3 (N+4O2,N+2O,N2+1O,N20,N-3H3)
Продукты восстановления HNO3:

Реакции протекают по схеме:
Активные Me до Zn включительно: Акт. Ме(до Zn включ.)+HNO3р→NH3(NH4NO3) Акт. Ме(до Zn включ.)+HNO3к→N2O(N2, NO)
Малоактивные Me(после Zn): Малоактивные Me(после Zn)+HNO3р→NO Малоактивные Me(после Zn)+HNO3к→NO2
НNO3р более сильный окислитель, чемНNO3к
Концентрированная азотная кислота
Реакция взаимодействия с HNO3 (конц.) протекает по схеме, представленной выше. С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры. HNO3 к,хол пассивирует некоторые Ме аналогично H2SO4 к,хол
Например, 2Fe+6HNO3 к, хол→Fe2O3↓+3H2O+6NO2↑
Примеры:
Активный металл
8K + 10HNO3(конц.) → 8KNO3 +N2O+5H2O
8│ K0 – e→ K+— окисление
1│ 2NO3— +8e+10H+→ N2O+5H2O — восстановление
Металл малоактивный
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
1│Cu0 – 2e →Cu2+ — окисление
2│ N5+O3+e+2H+→ N4+O2+H2O- восстановление
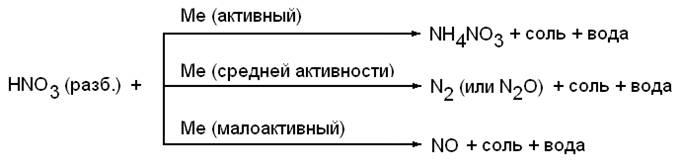
Разбавленная азотная кислота
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
Примеры:
Активный металл
4Mg + 10HNO3(разб.) → 4Mg(NO3)2 + 3H2O + NH4NO3
4│ Mg0 – 2e → Mg2+ — окисление
1│ N5+ + 8e → N3- — восстановление
Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония NH4NO3:
NH3 + HNO3 → NH4NO3.
Металл средней активности
8Al + 30HNO3(разб.) → 8 Al(NO3)3 + 3N2O+15H2O
8│ Al0 – 3e → Al3+ — окисление
3│ 2NO—3+8e+10H+ → N2O↑+5H2O- восстановление
Кроме молекулярного азота (N2) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I) – N2O. В уравнении реакции нужно писать одно из этих веществ.
Металл малоактивный
3Cu+ 8HNO3(разб.) → 3Cu(NO3)2 + 4H2O + 2NO↑
3│ Cu0 – 2e →Cu2+ — окисление
2│ N5+ + 3e → N2+ — восстановление
studfile.net
ЕГЭ. Химические свойства азотной кислоты
Химические свойства азотной кислоты
Чем более разбавленной является кислота, тем более сильным окислителем она является.
- Изменение степени окисления азота в реакциях с сильным восстановителем:
| Восстановление N+5 | Продукты восстановления | Условие |
|---|---|---|
| N+5 + 8e → N–3 | NH3 или NH4NO3 | очень разбавленная HNO3 |
| N+5 + 5e → N0 | N2 | разбавленная HNO3 |
| N+5 + 4e → N+1 | N2O | разбавленная HNO3, концентрированная |
- Изменение степени окисления азота в реакциях со слабым восстановителем:
| Восстановление N+5 | Продукты восстановления | Условие |
|---|---|---|
| N+5 + 3e → N+2 | NO | разбавленная HNO3 |
| N+5 + 1e → N+4 | NO2 | концентрированная HNO3 |
Восстановители:
Сильные:
- Металлы от Li до Al
Слабые:
- Металлы, начиная с Fe
- Неметаллы
- Соли (если можем окислить)
- Оксиды (если можем окислить)
- HI и йодиды, H2S и сульфиды
Взаимодействие азотной кислоты с простыми веществами:
1) с металлами — сильными восстановителями:
10HNO3(оч. разб.) + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 + N2O + 5H2O (возможно образование N2)
2) с металлами — слабыми восстановителями:
8HNO3(разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
4HNO3(конц.) + 3Cu → 3Cu(NO3)2 + 2NO2 + 2H2O
HNO3(конц.) + Fe → Fe(NO3)3 + NO2 + H2O
3) С неметаллами (слабыми восстановителями) образуются соответствующие кислоты, а также NO (если кислота разб.) или NO2 (если кислота конц.):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
4HNO3(конц.) + C → CO2 + 4NO2 + 2H2O
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
6HNO3(конц.) + S → H2SO4 + 6NO2 + 2H2O
Взаимодействие азотной кислоты со сложными веществами:
Окисляем анион:
8HNO3(к) + H2S → H2SO4 + 8NO2 + 4H2O
8HNO3(к) + Na2S → Na2SO4 + 8NO2 + 4H2O
4HNO3(конц.) + CuS → Cu(NO3)2 + S + 2NO2 + 2H2O
8HNO3(конц.) + CuS → CuSO4 + 8NO2 + 4H2O
8HNO3 + Cu2S → 2Cu(NO3)2 + S + 4NO2 + 4H2O
12HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + 10NO2 + 6H2O
16HNO3(к) + Mg3P2 → Mg3(PO4)2 + 16NO2 + 8H2O
16HNO3(к) + Ca(HS)2 → H2SO4 + CaSO4 + 16NO2 + 8H2O
8HNO3(к) + AlP  → AlPO4 + 8NO2 + 4H2O
В избытке кислоты фосфаты растворяются:
11HNO3(к, изб.) + AlP → H3PO4 + Al(NO3)3 + 8NO2 + 4H2O
Окисляем металл соли или оксида:
10HNO3(к) + Fe3O4 → 3Fe(NO3)3 + NO2 + 5H2O
4HNO3(к) + FeO → Fe(NO3)3 + NO2 + 2H2O
HNO3(к) + FeSO4 → Fe(NO3)3 + NO2 + H2SO4 + H2O
4HNO3(к) + CrCl2 → Cr(NO3)3 + NO2 + 2HCl + H2O (ионы Cl– азотная кислота окислить не может)
Одновременное окисление катиона и аниона:
14HNO3(к) + Cu2S → H2SO4 + 2Cu(NO3)2 + 10NO2 + 6H2O.
chemrise.ru
Азотная кислота — строение и химические свойства » HimEge.ru
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + 2H2O + O2.
Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями. Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Mr = 63, 01; d = 1, 503(25); tпл = -41, 6 oC; tкип +82,6 oC (разл.).
1. Типичные свойства кислот:
1) Взаимодействует с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
2) С основаниями, амфотерными гидроксидами:
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
3) Вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
2HNO3 + Na2SiO3 = H2SiO3 ↓+ 2NaNO3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже. Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.
4 HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 H2O
N+5 + 1e → N+4 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 1 восстановитель, пр-с окисления
8 HN+5O3(разб.) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
N+5 + 3e → N+2 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 3 восстановитель, пр-с окисления
2) Проявляет окислительные свойства при взаимодействии с неметаллами:
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O;
B + 3HNO3 = H3BO3 + 3NO2;
3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
3) Азотная кислота окисляет сложные вещества:
6HI + 2HNO3 = 3I2 + 2NO + 4H2O;
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O.
4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
5) Окислительные свойства «царской водки»:
Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O;
4HNO3 + 18HCl + Pt = 3H2[PtCl6] + 4NO + 8H2O
4HNO3 = 4NO2 + 2H2O + O2 (комн., на свету).
HNO3 + H2O = NO3– + H3O+.
HNO3 (разб.) + NaOH = NaNO3 + H2O ,
HNO3 (разб.) + NH3 · H2O = NH4NO3 + H2O.
2HNO3 (2-3%-я) + 8H0(Zn, разб. H2SO4) = NH4NO3 + 3H2O,
2HNO3 (5%-я) + 8H0(Mg, разб. H2SO4) = N2O ↑ + 5H2O,
HNO3 (30%-я) + 3H0(Zn, разб. H2SO4) = NO2↑ H2O,
HNO3 (60%-я) + 2H0(Zn, разб. H2SO4) = HNO2 + H2O. (кат Pd)
2HNO3 (конц.) +Ag = AgNO3 + NO2 ↑ + H2O.
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
10HNO3 (разб.) + 4Mg = 4Mg(NO3)2 +N2O↑ + 5H2O (примесь H2)
12HNO3 (разб.) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
30HNO3 (оч. разб.) + 8Al = 8Al(NO3)3 + 3 NH4NO3 + 9H2O (примесь H2)
12HNO3 (оч. разб.) + 5Fe = 5Fe(NO3)2 + N2 ↑ + 6H2O (0-10 oC),
4HNO3 (разб.) + Fe = Fe(NO3)3 + NO↑ + 2H2O.
4HNO3 (конц., гор.) + Hg = Hg(NO3)2 + 2NO2 ↑ + 2H2O,
8HNO3(разб., хол) + 6Hg = 3Hg2(NO3)2 + 2NO ↑ + 4H2O.
6HNO3 (конц.) + S = H2SO4 + 6NO2 ↑ + 2H2O (кип.),
2HNO3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl2↑ + 4H2O (100-150 oC).
HNO3 (конц.) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
4HNO3 (конц.) + 18HCl(конц.) + 3Pt = 3H2[PtCl6] + 4NO↑ + 8H2O
4HNO3 (конц.) + 18HF(конц.) + 3Si = 3H2[SiF6] + 4NO↑ + 8H2O.
4HNO3 (дымящ.) + P4O10 = 2N2O5 + 4HPO3 (в атмосфере O2+O3)
himege.ru