Конспект «Количество теплоты. Удельная теплоёмкость»
«Количество теплоты. Удельная теплоёмкость»
Количество теплоты
Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количествоv теплоты.
Количество теплоты – это изменение внутренней энергии тела в процессе теплопередачи без совершения работы. Количество теплоты обозначают буквой Q.
Работа, внутренняя энергия и количество теплоты измеряются в одних и тех же единицах — джоулях (Дж), как и всякий вид энергии.

В тепловых измерениях в качестве единицы количества теплоты раньше использовалась особая единица энергии — калория (кал), равная количеству теплоты, необходимому для нагревания 1 грамма воды на 1 градус Цельсия

При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. Таким образом, чем больше масса тела, тем большее количество тепла требуется ему для нагревания. То же самое и с охлаждением.

Количество теплоты, необходимое для нагревания тела зависит еще и от рода вещества, из которого это тело сделано. Эта зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
Удельная теплоёмкость
Удельная теплоёмкость – это физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К). Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой с. Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг °К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Поскольку кол-во теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на 1 °С. В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.
Количество теплоты Q, необходимое для нагревания тела массой m от температуры t1°С до температуры t2°С, равно произведению удельной теплоёмкости вещества, массы тела и разности конечной и начальной температур, т.е.
Q = c ∙ m (t2 — t1)
По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.

Это конспект по теме «Количество теплоты. Удельная теплоёмкость». Выберите дальнейшие действия:
uchitel.pro
Количество теплоты
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин. Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая
Количество теплоты, передаваемое от одного тела к другому, может идти на нагревание тела, плавление, парообразование, либо выделяться при противоположных процессах – остывании тела, кристаллизации, конденсации. Теплота выделяется при сгорании топлива. Между массой вещества и количеством теплоты, необходимым для его нагревания, существует прямая пропорциональная зависимость.
- Количество теплоты, необходимое для нагревания тела или выделяющееся при его охлаждении, прямо пропорционально массе тела и изменению его температуры:
Q = cmΔT, где с — удельная теплоемкость [Дж/кг·К], m — масса тела [кг], ΔT — изменение температуры [К]
- Количество теплоты, необходимое для превращения жидкости в пар или выделяющееся при его конденсации, прямо пропорционально массе жидкости: Q = Lm, где L — удельная теплота парообразования [Дж/кг], m — масса тела [кг]
- Количество теплоты, необходимое для плавления тела или выделяющееся при его кристаллизации, прямо пропорционально массе этого тела: Q = λm, где λ (лямбда) — удельная теплота плавления [Дж/кг], m — масса тела [кг]
- Количество теплоты, выделяющееся при сгорании топлива, прямо пропорционально его массе: Q = qm, где q — удельная теплота сгорания [Дж/кг], m — масса тела [кг]
Удельная теплоемкость вещества показывает, чему равно количество теплоты, необходимое для нагревания или выделяющееся при охлаждении 1 кг вещества на 1 К.
Удельные теплоты парообразования, плавления, сгорания
Другие заметки по физике
edu.glavsprav.ru
Количество теплоты. Тепловой баланс. Видеоурок. Физика 8 Класс
Все тела состоят из атомов и молекул, которые непрерывно движутся и взаимодействуют между собой. Нас интересует суммарная энергия их движения (кинетическая) и взаимодействия (потенциальная) – внутренняя энергия тела.
Внутреннюю энергию можно изменить двумя способами: выполняя работу и с помощью теплообмена.
Про механическую работу мы уже говорили, в ответвлении подробнее рассмотрим, как это связано с изменением внутренней энергии.
Механическая работа и превращение энергии
В механике мы использовали закон сохранения механической энергии:
Полная механическая энергия системы, в которой действуют только консервативные силы, остается постоянной.
Под полной механической энергией мы понимаем сумму кинетической и потенциальной энергии. Значит, энергия превращается из кинетической в потенциальную, и наоборот, чтобы их сумма оставалась постоянной (см. рис. 1).
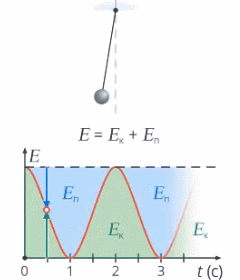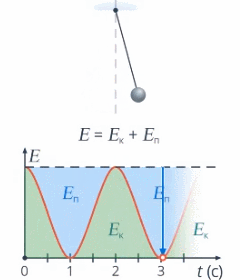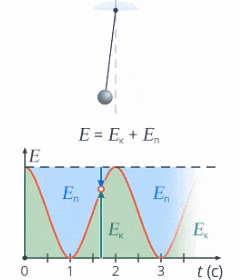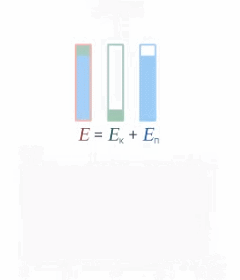
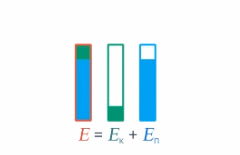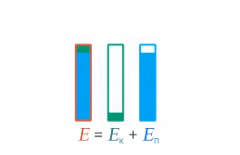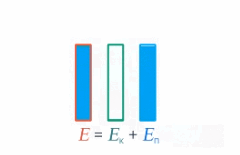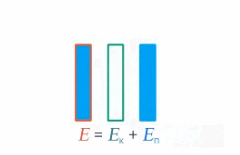
Рис. 1. Превращение кинетической и потенциальной энергий
Изменение кинетической энергии равно изменению потенциальной энергии со знаком минус – это значит, на сколько увеличилась кинетическая энергия, на столько же уменьшилась потенциальная. А работа консервативных сил равна этому изменению:
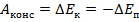
Что же происходит с энергией тела, если на него действуют неконсервативные силы, например сила трения? Механическая энергия не сохраняется, она превращается в другие виды энергии, в частности в тепловую (или внутреннюю энергию тела) (см. рис. 2).
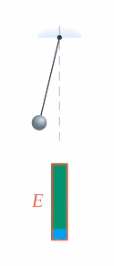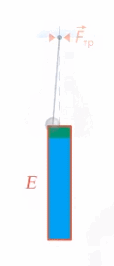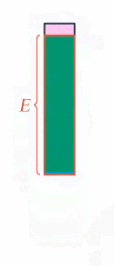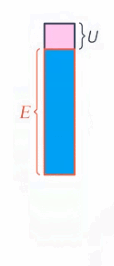
Рис. 2. Превращение механической энергии в тепловую
Работа неконсервативной силы равна изменению механической энергии (а оно равно изменению внутренней энергии со знаком минус, для превращения кинетической энергии в потенциальную мы записывали так же).
При изучении тепловых явлений нас как раз интересует изменение внутренней энергии.
Рассмотрим второй способ изменения внутренней энергии тела – это передача энергии от более теплого объекта к менее теплому. Назвали это теплопередачей и выделили виды теплопередачи: через излучение и через соударения молекул, назвав это теплопроводностью (см. рис. 3).
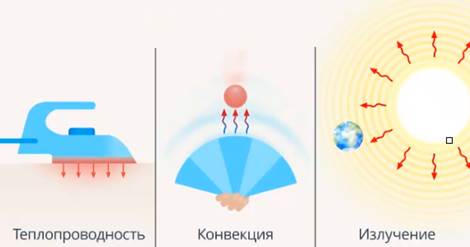
Рис. 3. Виды теплопередачи
Теплопередача может сопровождаться перемещением вещества, этот процесс мы назвали конвекцией.
Но для того чтобы количественно описывать тепловые процессы, нам недостаточно знать сам факт, что теплота передается.
Предположим, что в системе тел неконсервативные силы не совершают механическую работу. Рассмотрим энергию, которую передает или получает тело в результате теплообмена. Вследствие этого изменяется его внутренняя энергия. Эту полученную энергию, равную изменению внутренней энергии, назовем теплотой, а для ее количественного выражения часто будем употреблять название количество теплоты.
О терминах «теплота» и «количество теплоты»
Мы определили теплоту как энергию, которую передает или получает тело в процессе теплообмена. Это физическая величина, единицы измерения у нее те же, что и для энергии. То есть можно сказать «теплота равна 10 Дж» и т. д. Но в русском языке сложилась такая ситуация: если о многих других величинах можно сказать «какая масса?», «какая скорость?», то к теплоте более естественно применить вопрос «сколько?». То есть не «чему равна теплота?», а «сколько теплоты?», или, другими словами: «какое количество теплоты?». Это понятие, «количество теплоты», мы применяем наряду с понятием «теплота», но стоит помнить, что подразумевается одна и та же физическая величина. Просто иногда удобнее сказать «теплота передалась», а иногда «количество теплоты равно 10 Дж».
Обратите внимание: теплота равна изменению внутренней энергии тела. То есть мы не будем говорить об абсолютном количестве теплоты, а только о его изменении. То есть отвечать на вопрос: «Сколько теплоты получило или передало тело?». А привычные нам понятия «тепло/холодно» лучше всего описывает такая физическая величина, как температура.
Ощущаем ли мы температуру?
Касаясь чашки с горячим чаем, вы чувствуете ее тепло (см. рис. 4).

Рис. 4. Чашка с горячим чаем
Кажется, что мы определяем ее температуру и можем судить о внутренней энергии. А попробуйте провести следующий опыт: опустите одну руку в теплую воду, другую – в холодную, чтобы руки «привыкли» к температуре (см. рис. 5).

Рис. 5. Проведение эксперимента
А затем поместите их обе в воду комнатной температуры. Одной рукой вы почувствуете холод, другой – тепло. Получается, что наши ощущения связаны не с абсолютным значением температуры тела, а с разностью температур тела и нашей руки и с направлением теплообмена между ними.
Одна рука чувствует тепло, поскольку теплота передается от воды к руке. А вторая рука чувствует холод, поскольку тепло передается от руки к воде. При этом в случае холодной воды это не вода передает руке холод, а рука отдает воде тепло.
Конечно, мы иногда говорим «закрой дверь – холод напустишь» (как будто подразумеваем передачу именно холода), но это обывательский оборот, который закрепился в языке.
Например, при игре в пятнашки мы всегда двигаем сами «костяшки», но часто говорим о перемещении пустой клетки.
Мы говорим: «становится темно». Хотя темнота – это отсутствие света. Августин Блаженный говорил: «Нет зла, есть недостаток добра».
Так и с холодом – это отсутствие тепла. Нет передачи холода, есть теплопередача в том или ином направлении. Поэтому и лед, и чай, укутанные в шубу, будут некоторое время сохранять температуру, здесь у шубы одна и та же функция – теплоизоляция.
Обычно количество теплоты обозначается буквой Q. Количество теплоты – это изменение внутренней энергии при теплообмене, значит, эта величина измеряется, как и энергия, в джоулях: [Q] = Дж.
Обозначим внутреннюю энергию U. Тогда определение количества теплоты можно записать следующим образом:
Q = ΔU при равной нулю механической работе внешних сил (о чем мы договорились в начале урока).
Если тело получило 10 Дж теплоты и если тело потеряло 10 Дж теплоты – это не одно и то же (см. рис. 6).
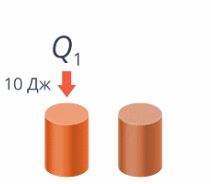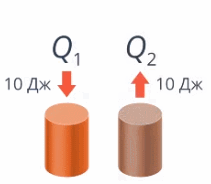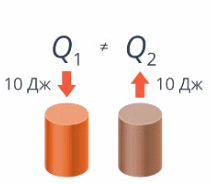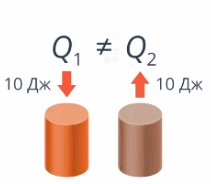
Рис. 6. Получение и потеря теплоты
Как это обозначить? Для этого можем использовать удобный математический инструмент – отрицательные числа. Мы его уже использовали для обозначения направления движения. Если рассматривать прямолинейное движение вдоль одной прямой, удобно выбрать ось координат и одно направление считать положительным (см. рис. 7).
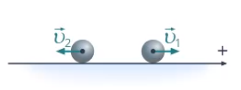
Рис. 7. Выбор положительного направления
В проекции на эту ось скорости тел 5 м/с и –5 м/с означают, что тела движутся со скоростью 5 м/с в противоположных направлениях.
Так и здесь: договоримся, что если тело получает теплоту (наши руки получили от теплой воды 10 Дж тепла), то Q положительно (запишем Q = 10 Дж), а если отдает – отрицательно, запишем Q = –10 Дж.
Остановимся пока на изучении тех случаев, когда агрегатное состояние вещества не меняется. Тогда если передать тепло телу, то оно нагреется, увеличится его температура (см. рис. 8)
. 
Рис. 8. Агрегатное состояние вещества не изменяется при получении теплоты
Разберемся, как количественно описать этот процесс.
Чайник закипит быстрее, если в него залить теплую воду, а не холодную (см. рис. 9).

Рис. 9. Закипание чайника с теплой и холодной водой
То есть чем большей разности конечной и начальной температур нужно достичь, тем больше нужно передать энергии. Полный чайник будет закипать дольше, чем почти пустой (см. рис. 10).
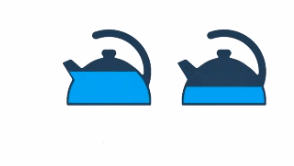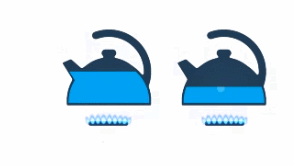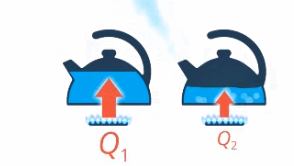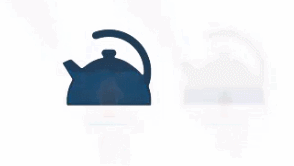
Рис. 10. Закипание полного чайника и полупустого
То есть чем больше масса воды, тем больше нужно передать энергии, чтобы ее нагреть. И наверняка есть разница, нагреть на одни и те же 10 градусов килограмм воды или килограмм железа – это тоже нужно учесть (см. рис. 11).
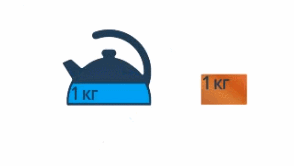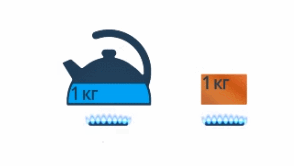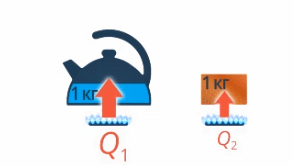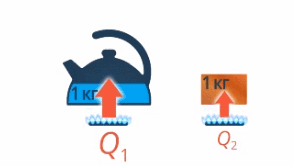
Рис. 11. Нагревание разных веществ
Можно провести эксперименты и установить более точные закономерности.
Оказывается, количество теплоты, которое необходимо передать телу, прямо пропорционально изменению температуры: 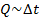 , где
, где 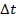 обозначает изменение температуры: конечная температура минус начальная
обозначает изменение температуры: конечная температура минус начальная 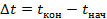 .
.
Если тело отдает тепло, то оно охлаждается. Конечная температура будет меньше начальной: 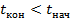 . Тогда
. Тогда 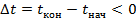 . Количество теплоты также будет
. Количество теплоты также будет 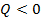 . Это согласуется с введенным понятием количества теплоты: если тело отдает тепло, то
. Это согласуется с введенным понятием количества теплоты: если тело отдает тепло, то 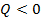 .
.
Экспериментально также было установлено, что: 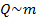 (количество теплоты, которое необходимо передать телу, прямо пропорционально массе тела).
(количество теплоты, которое необходимо передать телу, прямо пропорционально массе тела).
Почему изменение внутренней энергии пропорционально массе?
Количество теплоты, которое получает тело, идет на увеличение его внутренней энергии. Внутренняя энергия – это суммарная энергия частиц вещества: атомов или молекул. Значит, изменение внутренней энергии должно быть пропорционально количеству частиц: 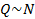 .
.
Однако таким параметром, как количество молекул, мы пользуемся редко. Более удобной характеристикой, эквивалентной количеству частиц данного вещества, является масса.
Масса вещества равна массе одной частицы (атома или молекулы), умноженной на количество частиц: 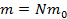 , тогда количество молекул равно
, тогда количество молекул равно 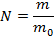 .
.
Получаем, что 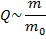 или
или  , т. к. масса одной молекулы – величина постоянная для данного вещества и она будет заложена в коэффициенте пропорциональности, который определяется отдельно для каждого вещества и учитывает его параметры: массу молекул, связь между ними, связь кинетической энергии молекул и температуры и т. д.
, т. к. масса одной молекулы – величина постоянная для данного вещества и она будет заложена в коэффициенте пропорциональности, который определяется отдельно для каждого вещества и учитывает его параметры: массу молекул, связь между ними, связь кинетической энергии молекул и температуры и т. д.
Количество теплоты пропорционально массе тела и изменению его температуры:
Кроме того, количество теплоты, необходимое для нагревания данной массы на данную температуру, зависит от вещества: для спирта нужно меньше теплоты, чем для воды (см. рис. 12), а для золота – меньше, чем для железа (см. рис. 13).
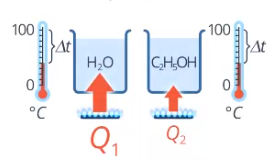
Рис. 12. Количество теплоты для нагревания воды и спирта
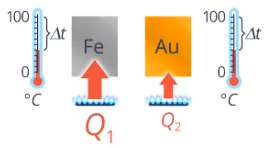
Рис. 13. Количество теплоты для нагревания железа и золота
Для данного вещества количество теплоты, которое нужно передать для нагревания данной m на данную 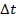 , оказалось постоянной величиной.
, оказалось постоянной величиной.
Отношение 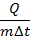 назвали удельной теплоемкостью, которую принято обозначать буквой c. Это количество теплоты, которое нужно передать 1 кг вещества, чтобы нагреть его на 1 °С (или 1 К, потому что мы говорим об изменении температуры, а цена деления этих двух шкал одинакова (см. рис. 14)).
назвали удельной теплоемкостью, которую принято обозначать буквой c. Это количество теплоты, которое нужно передать 1 кг вещества, чтобы нагреть его на 1 °С (или 1 К, потому что мы говорим об изменении температуры, а цена деления этих двух шкал одинакова (см. рис. 14)).

Рис. 14. Шкалы температур Цельсия и Кельвина
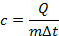
Для разных веществ это отношение отличается.
Единицы измерения удельной теплоемкости:
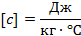
Различные вещества имеют различные удельные теплоемкости. Почему это так – поговорим в ответвлении.
c = const
Удельная теплоемкость с зависит от температуры t. Чтобы нагреть один и тот же железный шарик с 10 градусов до 11 и с 200 до 201 – нужно разное количество теплоты (см. рис. 15).
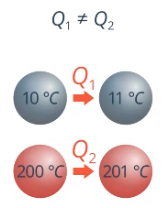
Рис. 15. Нагрев одного и того же шарика на 1 градус
Изменение удельной теплоемкости с изменением температуры достаточно мало, поэтому для решения задач мы можем считать, что с = const и зависимость 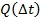 линейная (на участках, где не изменяется агрегатное состояние вещества (см. рис. 16)).
линейная (на участках, где не изменяется агрегатное состояние вещества (см. рис. 16)).
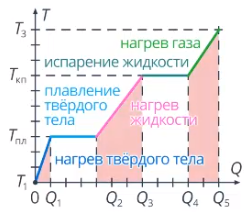
Рис. 16. Линейная зависимость 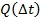 на участках, где не изменяется агрегатное состояние вещества
на участках, где не изменяется агрегатное состояние вещества
На самом деле, с, кроме температуры, зависит и от давления, но обычно мы будем решать задачи, в которых описаны процессы при нормальном атмосферном давлении, поэтому и здесь можно считать с = const.
Почему у веществ различные удельные теплоемкости
Почему для нагревания одной и той же массы на одну и ту же температуру для разных веществ нужно разное количество энергии?
Мы определили внутреннюю энергию тела как сумму кинетической и потенциальной энергии всех частиц тела. Когда теплота передается телу, часть ее идет на увеличение кинетической энергии (а значит, увеличение температуры), а часть – на увеличение потенциальной энергии частиц (см. рис. 17).
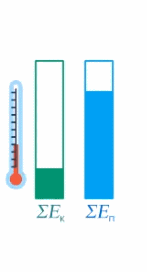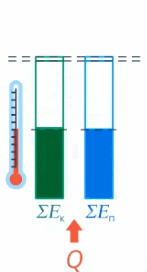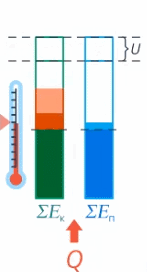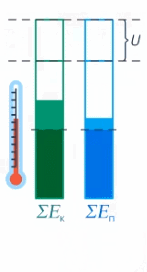
Рис. 17. Внутренняя энергия тела
У разных веществ соотношение этих частей разное.
Например, двум разным телам передали 100 Дж теплоты (см. рис. 18).

Рис. 18. Нагревание разных тел
У одного тела 40 Дж ушло в кинетическую энергию, а 60 – в потенциальную. У другого в кинетическую энергию перешло 20 Дж, 80 – в потенциальную. Итого тела получили одинаковое количество теплоты, но первое тело нагрелось больше, чем второе, т. к. кинетическая энергия его частиц увеличилась сильнее (40 Дж > 20 Дж). Это значит, что удельная теплоемкость второго вещества больше – ведь его труднее нагреть, чем первое.
Для разных веществ полученная энергия может распределяться по-разному – для нас это не ново.
Возьмем три мяча (см. рис. 19): хорошо накачанный, спущенный и деревянный.

Рис. 19. Опыт с тремя мячами
Если ударить по ним, сообщив одинаковую энергию, полетят они с разной скоростью. Часть переданной энергии пойдет на неупругую деформацию мяча и обуви бьющего, а часть – на увеличение кинетической энергии мяча. Для перечисленных мячей соотношение этих частей будет разное.
Значения удельных теплоемкостей различных веществ уже измерены, их можно найти в соответствующих таблицах.
Итак, на основе всего вышесказанного можно записать формулу для расчета количества теплоты, необходимого для нагревания тела:
Процессы нагревания и охлаждения отличаются лишь знаком  , так что формулу можно использовать и для расчета количества теплоты, которое выделяет тело при охлаждении.
, так что формулу можно использовать и для расчета количества теплоты, которое выделяет тело при охлаждении.
Для задач, которые мы будем решать в ближайшее время, нам достаточно такого очевидного утверждения: тепло передается от тела с большей температурой к телу с меньшей температурой до тех пор, пока температуры этих тел не уравняются (см. рис. 20).

Рис. 20. Теплообмен между телами с разной температурой
Более точно эта закономерность сформулирована в виде законов термодинамики, но их мы будем подробно изучать позже.
Мы сейчас рассматриваем изменение внутренней энергии тел через передачу теплоты. Если выделить систему тел, которые будем рассматривать вместе в рамках решения конкретной задачи, то возможны два варианта.
Первый – энергия может быть получена извне этой системы (см. рис. 21)
Рис. 21. Теплообмен с другими телами вне системы
(например, теплообмен с другими телами вне системы, превращение механической энергии в тепловую и т. д.). Второй вариант – считаем, что энергия передается посредством теплообмена только внутри системы, тогда суммарная энергия системы не меняется (см. рис. 22).

Рис. 22. Теплообмен только внутри системы
Рассмотрим первый случай, когда тепло передается системе тел извне.
В алюминиевой кастрюле массой 1,5 кг находится 5 кг воды при температуре 20 °С (см. рис. 23).
Рис. 23. Задача 1
Най
interneturok.ru
Количество теплоты. Удельная теплоемкость. Видеоурок. Физика 10 Класс
На этом уроке мы продолжим изучение внутренней энергии тела, а конкретнее – способов её изменения. И предметом нашего внимания на этот раз станет теплообмен. Мы вспомним, на какие виды он разделяется, в чём измеряется, и по каким соотношениям можно вычислить количество теплоты, переданное в результате теплообмена, также мы дадим определение удельной теплоёмкости тела.
Тема: Основы термодинамики
Урок: Количество теплоты. Удельная теплоемкость
Как мы уже знаем из младших классов, и как мы вспомнили на прошлом уроке, существует два способа изменить внутреннюю энергию тела: выполнить над ним работу или передать ему некое количество теплоты. О первом способе нам уже известно из, опять-таки, прошлого урока, но и о втором мы достаточно много говорили в курсе восьмого класса.
Процесс передачи теплоты (количества теплоты или энергии) без совершения работы называется теплообменом или теплопередачей. Разделяется он по механизмам передачи, как мы знаем, на три вида:
- Теплопроводность
- Конвекция
- Излучение
В результате одного из этих процессов телу передаётся некое количество теплоты, на значение которого, собственно, и меняется внутренняя энергия. Охарактеризуем эту величину.
Определение. Количество теплоты. Обозначение – Q. Единицы измерения – Дж. При изменении температуры тела (что эквивалентно изменению внутренней энергии) количество теплоты, затраченное на это изменение, можно вычислить по формуле:
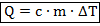
Здесь: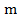 — масса тела;
— масса тела; 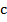 — удельная теплоёмкость тела;
— удельная теплоёмкость тела; 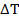 – изменение температуры тела.
– изменение температуры тела.
Причём, если 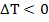 , то есть при охлаждении, говорят, что тело отдало некоторое количество теплоты, или же телу передали отрицательное количество теплоты. Если же
, то есть при охлаждении, говорят, что тело отдало некоторое количество теплоты, или же телу передали отрицательное количество теплоты. Если же 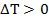 , то есть наблюдается нагрев тела, количество переданной теплоты, конечно же, будет положительным.
, то есть наблюдается нагрев тела, количество переданной теплоты, конечно же, будет положительным.
Особое внимание следует обратить на величину удельной теплоёмкости тела.
Определение. Удельная теплоёмкость – величина, численно равная количеству теплоты, которую необходимо передать, чтобы нагреть один килограмм вещества на один градус. Удельная теплоёмкость – индивидуальная величина для каждого отдельного вещества. Поэтому это табличная величина, заведомо известная при условии, что нам известно, порции какого вещества передаётся тепло.
Единицу измерения удельной теплоёмкости в системе СИ можно получить из вышеприведённого уравнения:
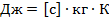
Таким образом:
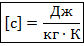
Рассмотрим теперь случаи, когда передача некого количества теплоты приводит к изменению агрегатного состояния вещества. Напомним, что такие переходы называются плавлением, кристаллизацией, испарением и конденсацией.
При переходе от жидкости к твёрдому телу и наоборот количество теплоты высчитывается по формуле:
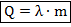
Здесь: 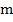 — масса тела;
— масса тела; 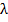 — удельная теплота плавления тела (количество теплоты, необходимое для полного плавления одного килограмма вещества).
— удельная теплота плавления тела (количество теплоты, необходимое для полного плавления одного килограмма вещества).
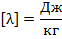
Для того чтобы расплавить тело, ему необходимо передать некое количество теплоты, а при конденсации тело само отдаёт в окружающую среду некое количество теплоты.
При переходе от жидкости к газообразному телу и наоборот количество теплоты высчитывается по формуле:
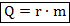
Здесь: 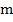 — масса тела;
— масса тела; 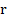 — удельная теплота парообразования тела (количество теплоты, необходимое для полного испарения одного килограмма вещества).
— удельная теплота парообразования тела (количество теплоты, необходимое для полного испарения одного килограмма вещества).
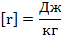
Для того чтобы испарить жидкость, ей необходимо передать некое количество теплоты, а при конденсации пар сам отдаёт в окружающую среду некое количество теплоты.
Следует подчеркнуть также, что и плавление с кристаллизацией, и испарение с конденсацией проходят при постоянной температуре (температура плавления и кипения соответственно) (рис. 1).
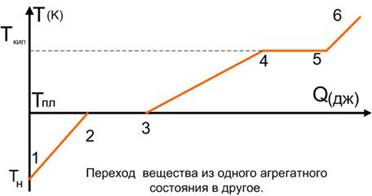
Рис. 1. График зависимости температуры (в градусах Цельсия) от полученного количества вещества (Источник)
Отдельно стоит отметить вычисление количества теплоты, выделяющееся при сгорании некоторой массы топлива:
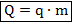
Здесь: 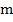 — масса топлива;
— масса топлива; 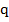 — удельная теплота сгорания топлива (количество теплоты, выделяющееся при сгорании одного килограмма топлива).
— удельная теплота сгорания топлива (количество теплоты, выделяющееся при сгорании одного килограмма топлива).
Особое внимание нужно обратить на тот факт, что помимо того, что для разных веществ удельные теплоёмкости принимают разные значения, этот параметр может быть различным и для одного и того же вещества при различных условиях. Например, выделяют разные значения удельных теплоёмкостей для процессов нагревания, протекающих при постоянном объёме (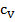 ) и для процессов, протекающих при постоянном давлении (
) и для процессов, протекающих при постоянном давлении (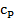 ).
).
Различают также молярную теплоёмкость и просто теплоёмкость.
Определение. Молярная теплоёмкость (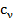 ) – количество теплоты, необходимое для того, чтобы нагреть один моль вещества на один градус.
) – количество теплоты, необходимое для того, чтобы нагреть один моль вещества на один градус.
Теплоёмкость (C) – количество теплоты, необходимое, чтобы нагреть на один градус порцию вещества определённой массы. Связь теплоёмкости с удельной теплоёмкостью:
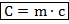
На следующем уроке мы рассмотрим такой важный закон, как первый закон термодинамики, который связывает изменение внутренней энергии с работой газа и количеством переданной теплоты.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. – М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. – М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. – М.: Дрофа, 2010.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Словари и энциклопедии на Академике (Источник).
- Tt.pstu.ru (Источник).
- Elementy.ru (Источник).
Домашнее задание
- Стр. 83: № 643–646. Физика. Задачник. 10-11 классы. Рымкевич А.П. – М.: Дрофа, 2013. (Источник)
- Как связаны между собой молярная и удельная теплоёмкости?
- Почему иногда поверхности окон запотевают? С какой стороны окон это происходит?
- В какую погоду быстрее высыхают лужи: в спокойную или в ветреную?
- *На что затрачивается теплота, полученная телом при плавлении?
interneturok.ru
Количество теплоты — это… Что такое Количество теплоты?
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Единица измерения в Международной системе единиц (СИ): Джоуль.
Определение
Рассмотрим систему, состоящую из двух тел и . Предположим, что тело заключено почти полностью в жёсткую адиабатическую оболочку, так что оно не способно совершать макроскопическую работу, а обмениваться теплом (то есть энергией) посредством микроскопических процессов может лишь с телом . Предположим, что тело также заключено в адиабатическую оболочку почти полностью, так что для него возможен теплообмен лишь с , но не будем предполагать, что оболочка жёсткая. Количеством теплоты, сообщённой телу в некотором процессе, будем называть величину , где — изменение внутренней энергии тела . Согласно закону сохранения энергии,
где — макроскопическая работа внешних сил над телом . Если учесть, что
где — работа, совершённая телом , то по закону сохранения энергии можно придать форму первого начала термодинамики:
Из первого начала термодинамики следует корректность введённого определения количества теплоты, то есть независимость соответствующей величины от выбора пробного тела и способа теплообмена между телами. Заметим, что для определения количества теплоты необходимо пробное тело, в противном случае первое начало теряет смысл содержательного закона и превращается в определение количества теплоты (весьма бесполезное в таком виде). При определении количества теплоты независимо от и первое начало становится содержательным законом, допускающим экспериментальную проверку.
Отметим, что, как и совершённая работа, количество переданной теплоты зависит от конкретного процесса, совершённого над телом.
Неравенство Клаузиуса. Энтропия
Предположим, что рассматриваемое тело может обмениваться теплотой лишь с бесконечными тепловыми резервуарами, внутренняя энергия которых столь велика, что при рассматриваемом процессе температура каждого остаётся строго постоянной. Предположим, что над телом был совершён произвольный круговой процесс, то есть по окончании процесса оно находится абсолютно в том же состоянии, что и в начале. Пусть при этом за весь процесс оно заимствовало из i-го резервуара, находящегося при температуре , количество теплоты . Тогда верно следующее неравенство Клаузиуса:
Здесь обозначает круговой процесс. В общем случае теплообмена со средой переменной температуры неравенство принимает вид
Здесь — количество теплоты, переданное участком среды с (постоянной) температурой . Это неравенство применимо для любого процесса, совершаемого над телом. В частном случае квазистатического процесса оно переходит в равенство. Математически это означает, что для квазистатических процессов можно ввести функцию состояния, называемую энтропией, для которой
здесь — это абсолютная температура внешнего теплового резервуара. В этом смысле является интегрирующим множителем для количества теплоты.
Для неквазистатических процессов такое определение энтропии не работает. Например, при адиабатическом расширении газа в пустоту
однако энтропия при этом возрастает, в чём легко убедиться, переведя систему в начальное состояние квазистатически и воспользовавшись неравенством Клаузиуса. Кроме того, энтропия (в указанном смысле) не определена для неравновесных состояний системы, хотя во многих случаях систему можно считать локально равновесной и обладающей некоторым распределением энтропии.
Литература
- Сивухин Д. В. Общий курс физики. — Т. II. Термодинамика и молекулярная физика.
dic.academic.ru
Формула количества теплоты в физике
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем, что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии, которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
ОпределениеТеплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой). Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики. Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как . Обратим внимание, что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом. Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
где – удельная теплоемкость тела, m – масса тела, — молярная теплоемкость, – молярная масса вещества, – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты (), которое получает тело при увеличении его темп
www.webmath.ru
Формула количества теплоты
Здесь – количество теплоты, – удельная теплоёмкость вещества, из которого состоит тело, – масса тела, – разность температур.
Единица измерения количества теплоты — Дж (Джоуль) или кал (калория).
По сути тепловая энергия – это внутренняя энергия тела, значит потеря тепла – это уменьшение внутренней энергии тела, а нагревание – увеличение. Удельная теплоёмкость – это характеристика вещества, обозначающая его способность накапливать в себе внутреннюю (тепловую) энергию. Чем она меньше, тем легче вещество нагреть или охладить. Она не пропорциональна плотности, то есть более плотное вещество не обязательно будет нагреваться легче, чем менее плотное. Одно из веществ с большой теплоёмкостью – вода ( Дж/(кг * К)).
Примеры решения задач по теме «Количество теплоты»
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com