Урок «Азотная кислота, состав, строение молекулы, физические и химические свойства, получение»
Тип урока: Урок передачи и приобретения новых знаний и умений.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и специфические химические свойства азотной кислоты – взаимодействие ее с металлами; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
В результате урока необходимо знать:
- Состав и строение молекулы азотной кислоты; число ковалентных связей, образуемых атомом азота и степень окисления азота в молекуле азотной кислоты.
- Общие химические свойства азотной кислоты: взаимодействие с индикаторами (лакмусом и метилоранжем), с основными и амфотерными оксидами, основаниями, с солями более слабых и более летучих кислот.
- Специфические химические свойства азотной кислоты: взаимодействие ее с металлами.
- Лабораторный и промышленный способы получения азотной кислоты.
Необходимо уметь:
- Составлять уравнения химических реакций с позиции теории электролитической диссоциации.
- Составлять уравнения реакций взаимодействия концентрированной и разбавленной кислоты с металлами с использованием метода электронного баланса.
Методы и методические приемы:
- Беседа.
- Самостоятельная работа учащихся по составлению уравнений химических реакций азотной кислоты с металлами.
- Лабораторная работа по изучению общих химических свойств азотной кислоты;
- Составление опорного конспекта.
- Творческая работа: сообщение учащегося о получении азотной кислоты.
- Демонстрация опытов: взаимодействие разбавленной и концентрированной азотной кислоты с медью.
- Демонстрация слайдов с помощью мультимедиа проектора.
- Взаимопроверка и взаимооценка результатов самостоятельной работы.
Оборудование и реактивы:
На столах учащихся: растворы азотной кислоты HNO3 (20 – 25 %), индикаторы лакмус и метилоранж, раствор гидроксида натрия NaOH, раствор сульфата меди (II) CuSO4, раствор сульфата железа (II) FeSO4, оксид меди (II) CuO, оксид алюминия Al2O3, раствор карбоната натрия Na2CO3, пробирки, пробиркодержатели.
На столе учителя: концентрированная азотная кислота HNO3 (60 – 65 %), разбавленная азотная кислота HNO3 (30 %), штатив с пробирками, медная проволока (кусочки), газоотводная трубка, кристаллизатор с водой, пробиркодержатель, мультимедийная установка (компьютер, проектор, экран).
План урока:
План урока написан на доске и отпечатан для составления опорного конспекта на столах учащихся (Приложение 1)
Ход урока:
I Повторение.
Учитель: На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Ученик: Это аммиак, соли аммония, оксиды азота.
Учитель: Какие оксиды азота являются кислотными?
Ученик: Оксид азота (III) N2O3 – азотистый ангидрид и оксид азота (V) N2O5 – азотный ангидрид, ему соответствует азотная кислота HNO3.
Учитель: Каков качественный и количественный состав азотной кислоты?
Учитель пишет на доске формулу азотной кислоты и просит ученика расставить степени окисления
Ученик: Молекула состоит из трех химических элементов: H, N, O – из одного атома водорода, одного атома азота и трех атомов кислорода.
II Состав и строение HNO3
Учитель: Как же образуется молекула азотной кислоты?
Учитель показывает презентацию об азотной кислоте (Приложение 2 – презентация, Приложение 3 – текст пояснения к презентации)
III Физические свойства:
Учитель: Теперь переходим к изучению физических свойств азотной кислоты.
Учащиеся составляют краткое описание физических свойств азотной кислоты.
Учитель на демонстрационном столе показывает, что представляет собой концентрированная азотная кислота HNO (60 – 65 %) — бесцветная жидкость, «дымящаяся на воздухе», с едким запахом. Концентрированная 100 % — ая HNO3 иногда окрашена в желтоватый цвет, т.к. она летучая и нестойкая, и при комнатной температуре разлагается с выделением оксида азота (
Учитель на доске пишет уравнение химической реакции разложения азотной кислоты:
Учитель: Азотная кислота гигроскопична, смешивается с водой в любых отношениях. В водных растворах – сильный электролит, при температуре – 41,6 0С затвердевает. На практике применяется 65 % азотная кислота, она не дымит, в отличие от 100 % — ой.
IV Химические свойства
Учитель: Переходим к следующему этапу урока. Азотная кислота – сильный электролит. Следовательно, ей будут присущи все общие свойства кислот. С какими веществами реагируют кислоты?
Ученик: С индикаторами, с основными и амфотерными оксидами, с основаниями, с солями более слабых и летучих кислот, с металлами.
Учитель: Перед вами общие свойства кислот.
Включается мультимедийная установка. Учитель показывает презентацию об общих химических свойствах кислот (Приложение 4).
Учитель: Проведем экспериментальный этап урока. Ваша задача – провести химические реакции, подтверждающие химические свойства кислот, на примере азотной кислоты. Работать будете группами по 4 человека. На партах лежат инструкции к лабораторным опытам (Приложение 5). В тетрадях надо составить уравнения химических реакций в молекулярном и ионном виде.
Далее учитель проверяет технику безопасности выполнения лабораторных опытов. Вызывает учеников к доске записывать уравнения реакций.
Учитель: Переходим к специфическим химическим свойствам азотной кислоты. Следует отметить, что азотная кислота, и разбавленная, и концентрированная, при взаимодействии с металлами не выделяет водород, а может выделять различные соединения азота – от аммиака до оксида азота (IV).
Включается мультимедийная установка. Учитель показывает презентацию о возможных продуктах восстановления азотной кислоты (Приложение 6).
Учитель: Посмотрим на схему. У каждого на столах лежат схемы восстановления азотной кислоты (разбавленной и концентрированной) металлами (Приложение 7).
Далее учитель демонстрирует опыты:
- Взаимодействие разбавленной азотной кислоты с медью. Собирание оксида азота (II) над водой.
- Взаимодействие концентрированной азотной кислоты с медью. Получение оксида азота (IV).
На доске записывает уравнения реакций:
Учитель: На основе опытов можно сделать выводы:
- Раствор азотной кислоты реагирует не только с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода, но и с металлами, стоящими после водорода.
- В реакции с разбавленной HNO 3 окислителем металлов является не ион водорода H+, а ион NO3-, у которого окислительные свойства сильнее.
- Концентрированная азотная кислота также реагирует с металлами, стоящими в электрохимическом ряду напряжений металлов правее водорода. Окислителем металлов в данном случае являются молекулы HNO3 за счет предельно окисленного атома азота .
- В окислительно-восстановительных реакциях с металлами азотная кислота выступает как сильный окислитель за счет атомов . Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
Учитель: Пользуясь схемами восстановления концентрированной и разбавленной азотной кислоты металлами, а также учебником на стр. 127, перейдем к самостоятельной работе по вариантам (Приложение 8). Каждый выполняет свой вариант. Вам предложены карточки – задания. Время работы 5-7 минут.
Включается мультимедийная установка. Учитель показывает правильные варианты ответов (Приложение 9). Учащиеся проверяют правильность выполнения задания.
V Получение азотной кислоты HNO3
Ученик: (сообщение) В лаборатории азотную кислоту получают взаимодействием калийной или натриевой селитры с концентрированной серной кислотой при нагревании или без нагревания:
В промышленности азотную кислоту получают каталитическим окислением аммиака, синтезированного из азота воздуха:
Ученик показывает схему получения азотной кислоты (Приложение 10), а учащиеся записывают уравнения реакций в тетрадь.
VI Заключение
Учитель: На сегодняшнем уроке мы познакомились с составом и строением азотной кислоты. Повторили и закрепили общие свойства кислот на примере азотной кислоты, закрепили свои знания по теории ТЭД, теории строения атома и химической связи. Изучили специфические свойства азотной кислоты, а именно взаимодействие ее с металлами. Познакомились со способами получения азотной кислоты.
Далее подводятся итоги, выставляются оценки. Учитель задает домашнее задание по учебнику, задачнику и конспекту.
Д/з: § 33, упр. 4 на стр. 128 учебника;
задачи: 4 – 35, 4 – 41 задачник;
выучить конспект.
Список литературы
- Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: учебник для 9 класса общеобразовательных учреждений. – М.: Вентана – Граф, 2004.
- Энциклопедия для детей. Химия. – М.: Аванта, 2000.
- Максименко О.О. Химия. Пособие для поступающих в вузы. – М.: Эксмо, 2003.
- Полосин В.С., Прокопенко В.Г. Практикум по методике преподавания химии. Учебное пособие. – М.: Просвещение, 1989.
- Мартыненко Б.В. Химия: Кислоты и основания. – М.: Просвещение, 2000.
Урок 15. азотная кислота. строение молекулы. свойства разбавленной и концентрированной азотной кислоты. соли азотной кислоты. азотные удобрения. — Химия — 9 класс
Конспект
Азотная кислота имеет формулу HNO3. Азотная кислота – бесцветная дымящая жидкость с резким запахом.
В водных растворах диссоциирует. Разбавленная азотная кислота обладает всеми типичными свойствами кислот.
Концентрированная и разбавленная азотная кислота являются сильными окислителями, поэтому по-особому реагируют с металлами. При взаимодействии разбавленной азотной кислоты с активными металлами (стоящими в ряду напряжений до цинка) преимущественно образуются аммиак (или соль аммония), нитрат металла и вода. Степень окисления азота при этом понижается с +5 до -3. При взаимодействии разбавленной азотной кислоты с другими металлами преимущественно образуются оксид азота два, нитрат металла и вода. Степень окисления азота при этом понижается с +5 до +2. Также, в некоторых случаях может образовываться азот. Например, при взаимодействии магния с разбавленной азотной кислотой образуются: нитрат магния, аммиак и вода, а при взаимодействии меди с разбавленной азотной кислотой образуются: нитрат меди (II), моноксид азота и вода.
Получают азотную кислоту в три стадии:
1. Каталитическое окисление аммиака
2. Окисление моноксида азота в диоксид
3. Растворение диоксида азота в воде с одновременным окислением кислородом
Соли азотной кислоты – нитраты – твердые, кристаллические вещества.
Помимо общих свойств солей обладают специфическим свойством – способностью разлагаться при нагревании. Продукты разложения зависят от металла, входящего в состав соли.
Некоторые соли азотной кислоты называют селитрами, например, нитрат натрия – натриевая селитра. Многие селитры используются в качестве азотсодержащих удобрений для повышения урожайности сельхозхозяйственных культур.
Строение молекулы HNO3 — Знаешь как
Атомы элементов второго периода не имеют свободных d-подуровней. Поэтому фтор проявляет только одну валентность, равную единице, кислород — двухвалентен, а азот — трехвалентен. Как же в таком случае объяснить строение молекул азотной кислоты HNO3? Приводимая обычно в учебниках структурная формула  согласно которой атом азота образует пять ковалентных связей, не совсем правильна. Строение молекулы HNO3 следует выражать формулой:
согласно которой атом азота образует пять ковалентных связей, не совсем правильна. Строение молекулы HNO3 следует выражать формулой:

Один электрон атома азота переходит в электронную оболочку атома кислорода. Возникший при этом ион N+

образует четыре ковалентные связи. Таким образом, в молекуле азотной кислоты азот действительно пятивалентен, однако одна его связь ионная, а другие четыре — ковалентные.
Структурные формулы совершенно равнозначны, но, поскольку из опыта известно, что два не соединенных с водородом атома кислорода в молекуле HNO3 неразличимы, каждая из этих формул в отдельности неверна. Лишь вместе они правильно отражают строение азотной кислоты. Чтобы показать это, пользуются знаком «резонанса»⇔,который обозначает,что истинное строение выражается некоторой промежуточной формулой:

Не нужно путать знак резонанса со знаком обратимости (⇄). Электроны не прыгают с одного атома кислорода на другой, чтобы «давать» то одну, то другую форму. Реальная молекула соответствует наложению крайних структур.
Поскольку электрон имеет корпускулярно-волновую природу, его можно считать как бы «размазанным» между, двумя атомами кислорода. Тогда вместо двух резонансных структур можно написать следующую формулу, отражающую строение молекулы азотной кислоты.

Статья на тему Строение молекулы HNO3
Конспект урока по химии на тему «Оксиды азота (II и IV). Азотная кислота. Строение молекулы. Свойства азотной кислоты.»
9 класс Урок № Дата:
Тема. Оксиды азота (II и IV). Азотная кислота. Строение молекулы. Свойства азотной кислоты.
Цели урока: изучить строение и свойства оксидов азота (II и IV) и азотной кислоты, отметить ее особенности взаимодействия с металлами.
Задачи:
Обучающие: продолжить формирование умений записывать уравнения реакций, характеризующих свойства азотной кислоты.
Развивающие: применять полученные знания на практике и оценивать результаты выполненных действий.
Воспитательные: воспитание положительного отношения к знаниям, инициативности, способности преодолевать трудности для достижения цели.
Тип урока: комбинированный.
Ход урока.
I. Организационный момент.
II. Актуализация знаний, умений, навыков.
Блиц – опрос « Ты – мне, я – тебе» (список вопросов передается по рядам, учащиеся сами выбирают тех, кто будет отвечать; можно отдельные карточки раздать учащимся).
1.Элемент, который находится под порядковым номером 7 –
2.Общее число электронов у атома азота –
3. Число неспаренных электронов атомов элементов подгруппы азота –
4.Степень окисления азота в азотной кислоте —
5. Степень окисления азота в аммиаке –
6.В молекуле азота связь –
7. В молекуле аммиака связь –
8. 3 – 10% — раствор аммиака называется …
9. «Азот – непременная составная часть живых организмов». Речь идет о простом веществе или химическом элементе?
10. В составе воздуха азот — %
11. Аммиак при нормальных условиях – это …
III. Формирование новых знаний, умений, навыков.
Оксиды азота
Заполните таблицу, используя дополнительный текст.
«Сравнительная характеристика оксидов азота»
Модельный ответ. Азотная кислота. Конспект (основные данные записываются на доске и в тетради)HNO3
Mr (HNO3) = 63
M (HNO3) = 63г/моль
Физические свойства.
Азотная кислота – одноосновная сильная кислота, бесцветная жидкость с резким раздражающим запахом. Азотную кислоту с концентрацией 97 -99% называют дымящей, с концентрацией 58 – 60% — концентрированной. Плотность азотной кислоты 1,4 г/см3. Азотная кислота – сильный окислитель. Дымящая азотная кислота способна поджечь скипидар, другие органические вещества.
Исторические сведения. Рассказ.
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Во времена М. В. Ломоносова, азотную кислоту называли крепкой водкой.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платинородиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Химические свойства. Реакции записывают учащиеся на доске (по одной реакции) и в тетрадях.
а) Общие свойства
1. Действие на индикаторы
2. Диссоциация
HNO3 = H+ + NO3—
3. Взаимодействие с основными и амфотерными оксидами
2HNO3 + BaO = Ba(NO3)3 + H2O
6HNO3 + AI2O3 = 2AI(NO3)3 + 3H2O
4. Взаимодействие с основаниями
HNO3 + NaOH = NaNO3 + H2O
5. Взаимодействие с солями
2HNO3 + K2CO3 = 2KNO3 + H2O + CO2
б) Специфические свойства
1. Взаимодействие с металлами
Концентрированная и разбавленная азотная кислота взаимодействуют со всеми металлами, расположенными до и после водорода, кроме золота и платины.
При взаимодействии азотной кислоты с металлами водород не выделяется:
 Zn + 2HNO3 = Zn(NO3)2 + H2
Zn + 2HNO3 = Zn(NO3)2 + H2
а в зависимости от концентрации выделяются следующие вещества:
1). 4HNO3(k) + Zn = Zn(NO3)2 + 2NO2 + 2H2O
2). 8HNO3(p) + 3Zn = 3Zn(NO3)2 + 2NO + 4H2O
3). 10HNO3(p) + 4Zn = 4Zn(NO3)2 + N2O + 5H2O
4). 12HNO3(p) + 5Zn = 5Zn(NO3)2 + N2 + 6H2O
5). 10HNO3(p) + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты 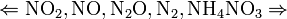 увеличение активности металла
увеличение активности металла
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются.
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
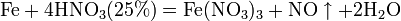
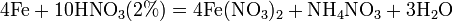
Таблицу распечатать и раздать учащимся.
Активные металлыLi Na …….Zn
Металлы средней активности
Cr………..Sn
Металлы малоактивные и неактивные
Pb…………..Ag
Благородные металлы
Au Pt Os Ir
Конц
HNO3
Разб
HNO3
очень Разб
HNO3
Конц
HNO3
Разб
HNO3
очень Разб
HNO3
Конц
HNO3
Раз
HNO3
Раств. только в царской водке-смеси 3об.HCl
B 1об. HNO3
NO
NO2
N2O или N2 NO2
NH3
NH4NO3
Не реаги-руют
NO2
NO
N2O
NH3
NO2
NO
N2O
NH3
NO2
NO
2. Разложение на свету или при нагревании
4HNO3 = 4NO2 + O2 + 2H2O
3. Взаимодействие с неметаллами
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
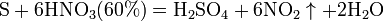
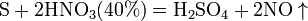
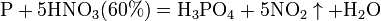
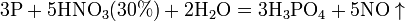
и сложные вещества, например:
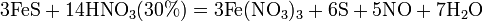
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
7. Применение
— для получения красителей
— для получения лекарственных препаратов
— для получения полимеров
— при производстве фотопленки
— для получения взрывчатых веществ
— для производства минеральных удобрений.
IV. Рефлексивно-оценочный этап
Тест
В а р и а н т 1
1. Какой ряд чисел соответствует распределению электронов по энергетическим уровням в атоме азота?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Закончите уравнение реакции:
1) HNO3 (разб.) + Cu 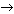 … ;
… ;
3. Укажите, какое уравнение иллюстрирует одну из стадий процесса промышленного производства азотной кислоты.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N2 + O2 = 2NO.
4. Отрицательная степень окисления проявляется азотом в соединении:
1) N2O; 2) NO; 3) NO2; 4) Na3N.
5. Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию:
1) NO2; 2) NO; 3) N2; 4) NH3.
В а р и а н т 2
1. Значение высшей валентности азота равно:
1) 1; 2) 2; 3) 5; 4) 4.
2. Запишите возможное взаимодействие концентрированной азотной кислоты со следующими металлами: алюминий, цинк, железо, хром.
3. Выберите вещества, являющиеся сырьем для производства азотной кислоты:
1) азот и водород;
2) аммиак, воздух и вода;
3) нитраты.
4. Концентрированная азотная кислота не реагирует с:
1) углекислым газом;
2) соляной кислотой;
3) углеродом;
4) гидроксидом бария.
5. При взаимодействии очень разбавленной кислоты с магнием образуется:
1) NO2; 2) NO; 3) N2O; 4) NH4NO3.
Ответы на тестыВ а р и а н т 1.
1 – 4;
2.
1) 8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O;
3 – 1; 4 – 4; 5 – 1.
В а р и а н т 2.
1 – 4;
2.
Zn + 4HNO3 (конц.) = Zn(NO3)2 + 2NO2 + 2H2O;
3 – 2; 4 – 1; 5 – 4.
Домашнее задание. Прочитать по учебнику «Химия-9» (Рудзитис Г.Е., Фельдман Ф.Г. М.: Просвещение, 2013) § 21, повторить конспект урока и схему взаимодействия кислоты с металлами.
Приложение.
Текст для заполнения таблицы (распечатать один экземпляр на парту).
Оксид азота (II)
Формула — NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Свойства. При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижать, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха. Несолеобразующий.
Получение. Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольких опытах: Реакция меди и 30%-ного раствора азотной кислоты. Взаимодействие хлорида железа, нитрита натрия и соляной кислоты. Реакция азотистой и иодоводородной кислот. Применение. Получение оксида азота (IV) для производства азотной кислоты.
Оксид азота (IV)
Формула — NO2. Также его могут называть диоксидом азота или бурым газом.
Свойства. Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность, обладает кислотными свойствами.
Получение. Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение. С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества
Конспект урока «Оксид азота (II) и оксид азота (IV).Азотная кислота, строение молекулы и получение. Общие с другими кислотами свойства азотной кислоты.»
Урок: Оксид азота (II) и оксид азота (IV).Азотная кислота, строение молекулы и получение. Общие с другими кислотами свойства азотной кислоты.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и общие с другими кислотами химические свойства азотной кислоты; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
Задачи:
Обучающие : продолжить формирование умений записывать уравнения реакций, характеризующих свойства оксидов азота, общие свойства азотной кислоты.
Развивающие : применять полученные знания на практике и оценивать результаты выполненных действий.
Воспитательные : воспитание положительного отношения к знаниям, инициативности, способности преодолевать трудности для достижения цели.
Оборудование: экран, проектор, штатив с пробирками, спиртовка, железная ложечка.
Реактивы: оксид меди (II),15 % азотная кислота.
Тип урока: комбинированный
Технология урока: информационно-коммуникативная
Ход урока:
Организационный этап.
Актуализация опорных знаний
На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Сегодня мы изучим соединения азота с кислородом Оксид азота (II) и оксид азота (IV), а также Азотную кислоту, строение молекулы и получение. Общие с другими кислотами свойства азотной кислоты.(Слайд №1)
Давайте вспомним какие вещества называются оксидами?
Какие оксиды называют солеобразующими?
Какие оксиды называют несолеобразующими?
Какие оксиды называют кислотными?
Какие вещества называют кислотами?
III. Изучение нового материала
Оксид NO реагирует с кислородом с образованием оксида азота(IV). Реакция обратимая. Причем с повышением температуры скорость этой реакции уменьшается:
2NO + O2 = 2NO2.
Оксид NO с водой не реагирует. Оксид не солеобразующий.
Оксид NO2, сильный окислитель, сильный яд!
С кислородом вообще не реагирует.(Слайд 2)
Реакции с водой. Оксид NO2 с водой образует азотную кислоту (степень окисления азота +5) и оксид азота(II) (степень окисления азота +2). В присутствии кислорода оксид NO2 целиком переходит в азотную кислоту:
3NO2 + Н2O = 2НNО3 + NO
4NO2 + O2 + 2Н2О = 4НNО3.
Реакции со щелочами. Оксид NO2 образует с щелочью соли двух кислот – азотной и азотистой:
2NO2 + 2NaOH = NaNO3 + NaNO2 + h3O.
(Слайд 3)
Азотная кислота, строение молекулы и получение.
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые , это означает то что двойная связь равномерно распределена между двумя кислорода . Степень окисления азота +5, а валентность равна IV.(Слайд 4)
Физические свойства(слайд 5(видеоролик «Физические свойства Азотной кислоты»,Слайд 6)
Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. (Слайд 7)
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота окисляет многие органические вещества. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы .То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. (слайд 8)
Получение(Слайд №9)
1. Лабораторный способ
KNO3 + h3SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платинородиевом катализаторе до NO
4Nh4 + 5O2 → 4NO + 6h3O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2h3O ↔ 4HNO3 и
3NO2 + h3O ↔ 2HNO3+NO (без избытка кислорода)
Общие с другими кислотами свойства азотной кислоты(Слайд №10,11)
1.Диссоциация
HNO3 = H+ + NO3
Метилоранж в присутствии азотной кислоты меняет оранжевый цвет на розовый.
2.Взаимодействие с оксидами
Демонстрация. В пробирку кладем 2-3 гр. Оксида меди (II) и наливаем несколько миллилитров 15% азотной кислоты, пробирку нагреваем и наблюдаем образование голубого раствора нитрата меди (II)
2HNO3 + CuO = Cu(NO3)2 + H2O
3.Взаимодействие со щелочами
HNO3 + NaOH = NaNO3 + H2O
4.Взаимодействие с солями, вытесняет менее активные кислоты из раствора их солей.
2HNO3 + K2CO3 = 2KNO3 +CO2 + H2O
IV.Закрепление изученного материала
Самостоятельная работа по карточкам. (Приложение№1)
V.Рефлексия
(Слайд 12)
VI. Домашнее задание
Параграф 27, стр 92-93, зад 4(б),7. Интерактивный тест размещен на школьном сайте.(Слайд13)
Приложение №1
I — Вариант
№1. Степень окисления атома азота в молекуле NO?
№2. С какими из перечисленных веществ будет реагировать азотная кислота?
h3SO4, ВаО, KOH, CaCO3
II- Вариант
№1. Степень окисления атома азота в молекуле NO2?
№2. С какими из перечисленных веществ будет реагировать азотная кислота?
HCI, CaO, Ba(OH)2 , K2CO3
III- Вариант
№1. Степень окисления атома азота в молекуле HNO3?
№2. С какими из перечисленных веществ будет реагировать азотная кислота?
HNO2 , MgO, Ca(OH)2 , MgCO3
Самоанализ урока химии в 9-м классе
Оксид азота (II) и оксид азота (IV).Азотная кислота, строение молекулы и получение. Общие с другими кислотами свойства азотной кислоты.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и общие с другими кислотами химические свойства азотной кислоты; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
Задачи:
Обучающие : продолжить формирование умений записывать уравнения реакций, характеризующих свойства оксидов азота, общие свойства азотной кислоты.
Развивающие : применять полученные знания на практике и оценивать результаты выполненных действий.
Воспитательные : воспитание положительного отношения к знаниям, инициативности, способности преодолевать трудности для достижения цели.
Анализируемый урок входит в систему уроков по теме «Неметаллы».
Урок начинается с организационного момента, задача которого — подготовить учащихся к работе на уроке. (Приветствие друг друга, запись в журнал фамилии тех, кто отсутствует, проверка готовности ребят к занятию.) Этот этап урока, хотя и был непродолжительным, позволил быстро включить учащихся в ход урока.
Следующий этап — обзор изученного материала — повторение ранее изученных тем и проверка домашнего задания.
Задача — выявить пробелы в знаниях и устранить их, совершенствовать знания и умения, подготовиться к восприятию новой темы.
Чтобы определить уровень знаний большинства учеников за короткий промежуток времени, я провела .С сидящими за своими партами ребятами мы обсудили вопросы применения и негативного воздействия на окружающую среду оксидов азота. В ходе фронтальной беседы я стремилась проверить качество усвоения материала, степень сформированности общеучебных навыков и умений. Обязательны на этапе повторения комментирование ответов учащихся, оценка их знаний, умений и навыков, стимулирование деятельности школьников похвалой, одобрением.
Затем была проведена актуализация опорных знаний. Запись схемы электронного строения атома, распределение электронов атома азота по орбиталям позволило подвести итог беседы, и послужила вспомогательным материалом для изучения новой темы.
Этап изучения нового материала я начала с сообщения темы, целей и задач урока, поставила перед школьниками учебную проблему. Поскольку ребята уже знают важнейшие теоретические вопросы курса химии, то большую часть учебного материала этого урока я предпочла преподавать дедуктивно. Для этого учащимся предлагаются вопросы, при ответе на которые школьники привлекают ранее приобретенные знания и в то же время изучают новый материал. К тому же это позволяет использовать такие важнейшие принципы дидактики, как научность и доступность. Новые понятия и схемы реакций предлагались учащимся по слайдам презентации. Соблюдая принцип систематичности, я шла по пути от известного к неизвестному, от простого к сложному. Никак нельзя было обойтись на уроке без демонстрационного эксперимента, поскольку он способствует выработке умений и навыков проведения химического эксперимента. Реализации принципа систематичности способствует осуществление межпредметных связей. Установление таких связей помогает формированию в сознании учащихся целостной картины мира. Связь с экологией особо тесная. На этом уроке она реализуется через систему понятий об атмосфере, рассмотрены значения ПДК оксидов азота. Связь с биологией видна при рассмотрении биологического воздействия на организм оксидов азота, причем основную информацию этого вопроса ребята изложили сами.
Для закрепления полученных знаний я использовала самостоятельную работу по карточкам. При проведении самостоятельной работы были получены следующие результаты:
«5»-5-33,3%
«4»-6-40%
«3»-3-20%.
«2»-1-6,7%
Средний бал-3,6
Успеваемость-93,3%
Качество-73,3
СОУ-67,2
Целью этапа закрепления я ставила повторение, воспроизведение усвоенного, но не дословное, а преобразованное, что способствует выработке у учащихся умения применять полученные знания.
Домашнее задание. Учащимся было предложено пройти онлайн-тестирование по данной теме, что активизирует познавательный интерес обучающихся.
Завершающим этапом была оценка учителем результатов урока, подведение итогов, комментирование деятельности учащихся, выставление отметок.
Проведенный урок — комбинированный. В ходе урока были использованы объяснительно-иллюстративные методы (беседа, объяснение учителя, сообщение ученика), применялись средства наглядности (слайды презентации, демонстрационный эксперимент), эвристические методы (беседа о соответствии строения и свойств молекул), исследовательский метод (исследование физических и химических свойств оксида азота(IV),общих с другими кислотами свойств азотной кислоты). На уроке многократно использовались технические средства обучения.
Проведенная проверочная работа и фронтальный опрос показали, что ученики, в целом, тему освоили, способны не только воспроизводить полученные знания, но и применять в нестандартных ситуациях.
Но следует отметить, что проведенный урок не лишен недостатков. Мне кажется, что на этапе проверки домашнего задания ребята были несколько пассивны. В беседах школьники не всегда формулировали полные ответы. В целом урок прошел успешно, настроение учащихся и учителя было хорошым, все остались довольны своей работой.
Методическая разработка по химии (9 класс) по теме: «Строение и свойства азотной кислоты»
Новиченко Ирина Васильевна,
учитель химии
Конспект урока по предмету «Химия» в 9 классе
Тема урока: «Строение и свойства азотной кислоты»
Класс: 9 класс
Тип урока: открытия нового знания.
Цель и задачи урока:
1. Изучение строения и свойств азотной кислоты на основе ранее полученных знаний о кислотах, окислительно-восстановительных процессах, теории электролитической диссоциации.
2. Формирование умений характеризовать свойства веществ, составлять уравнения изучаемых реакций, проводить учебный эксперимент.
Планируемые результаты:
В результате урока учащиеся должны знать:
— состав и строение молекулы азотной кислоты;
— физические свойства азотной кислоты;
— химические свойства азотной кислоты, общие со всеми кислотами, и особенности её взаимодействия с металлами.
В ходе урока у учащихся формируются умения:
— составлять уравнения реакций, характеризующих свойства азотной кислоты в растворах, в молекулярном и ионном виде;
— составлять уравнения реакций взаимодействия азотной кислоты с металлами при помощи метода электронного баланса;
— проводить учебный эксперимент по изучению свойств веществ и объяснять результаты наблюдений.
Методы обучения:
— беседа;
— самостоятельная работа
— учебный эксперимент;
— составление опорного конспекта.
Формы организации деятельности учащихся:
— индивидуальная;
— работа в парах;
— фронтальная.
Оборудование урока:
— наборы реактивов на столах учащихся;
— прибор и реактивы для демонстрации взаимодействия азотной кислоты с медью;
— мультимедийный проектор, компьютер, интерактивная приставка «Mimio»;
— программа для интерактивной доски «Наглядная химия»;
— документ-камера.
Методическое обеспечение:
1. Учебник «Химия-9» Г.Е.Рудзитис, Ф.Г.Фельдман. – М., Просвещение, 2010 г.
2. Интерактивное учебное пособие «Наглядная химия» — ООО «Экзамен-Медиа», 2011г.
Приложения ?
План урока:
1. Актуализация ранее полученных знаний, необходимых для изучения нового учебного материала.
2. Совместное изучение учебного материала темы с использованием учебного эксперимента.
3. Первичная проверка усвоения новых знаний.
4. Итог урока.
5. Домашнее задание.
Ход урока:
1. Этап актуализации опорных знаний (фронтальная беседа)
Учитель: Мы продолжаем изучать соединения азота. Вспомните, о каких соединениях азота шла речь на прошлом уроке. Какой из оксидов азота является его высшим оксидом? Каков его характер? Какое вещество является высшим гидроксидом азота?
Тема нашего урока «Строение и свойства азотной кислоты». Сформулируйте цель урока.
Какого плана нужно придерживаться при изучении вещества?
(Учащиеся вспоминают план изучения веществ: строение молекулы, физические свойства, нахождение в природе, химические свойства, получение и применение).
2. Этап изучения новых знаний
Учитель: рассмотрим состав и строение молекулы азотной кислоты.
Работа с интерактивной программой «Наглядная химия» — строение азотной кислоты и её физические свойства (Приложение 1).
Учитель: познакомимся с физическими свойствами азотной кислоты (демонстрирует концентрированную азотную кислоту, растворяет её в воде)
Чистая азотная кислота – бесцветная, «дымящая» на воздухе жидкость с резким запахом, что говорит о её летучести. При длительном хранении окрашивается в жёлтый цвет – его придаёт оксид азота(IV), образующийся при частичном разложении азотной кислоты.
Вспомните, как ещё называют оксид азота(IV) за его окраску? (бурый газ).О каком свойстве азотной кислоты говорит возможность её разложения при обычных условиях? (нестойкость).
Азотная кислота очень хорошо растворяется в воде.
(Учащиеся делают краткую запись о физических свойствах азотной кислоты в опорный конспект).
Учитель: для изучения химических свойств азотной кислоты дадим её характеристику с позиции теории электролитической диссоциации.
(Учащиеся характеризуют азотную кислоту как сильную одноосновную кислоту, диссоциирующую в водном растворе с образованием катионов водорода и нитрат-ионов и вступающую во взаимодействие с металлами, оксидами металлов, основаниями и солями более слабых и летучих кислот).
Учитель: у вас на столах наборы реактивов для изучения свойств азотной кислоты. Пользуясь краткой инструкцией (Приложение 2), проведите лабораторные опыты и составьте уравнения реакций в молекулярном и ионном виде.
(Учащиеся проводят опыты, записывают наблюдения и уравнения реакций)
Учитель: какие из выданных вам веществ взаимодействуют с раствором азотной кислоты? Что вы наблюдали при этом?
(наблюдали растворение в азотной кислоте оксида меди (II) при нагревании, обесцвечивание окрашенного фенолфталеином раствора гидроксида натрия при добавлении к нему раствора азотной кислоты , выделение газа при взаимодействии с азотной кислотой карбоната кальция)
Учащиеся делают вывод о том, что азотная кислота обладает общими свойствами кислот.
Проверка выполнения письменного задания проводится на экране при помощи документ-камеры (Приложение 3).
Учитель: с каким свойством кислот мы не встретились в ходе эксперимента?
(взаимодействие кислот с металлами).
Азотная кислота по-особому взаимодействует с металлами. Давайте откроем эту особенность.
Какие металлы способны взаимодействовать с растворами других кислот?
(Металлы, расположенные в ряду активности металлов левее водорода).
Может ли «растворяться в кислотах медь? (нет, она расположена правее водорода). Проверим в ходе эксперимента, может ли взаимодействовать медь с азотной кислотой. (Учитель проводит демонстрационный эксперимент взаимодействия медного порошка с концентрированной азотной кислотой).
Что вы наблюдали в процессе эксперимента? («растворение» меди, образование раствора голубого цвета, выделение бурого газа).
Учитель записывает на доске схему реакции:
Cu + HNO3 = Cu(NO3)2 + h3O + NO2
Учитель: в чём отличие данной реакции от ранее изученных реакций взаимодействия металлов с кислотами? (образуются три продукта, не выделяется водород). В азотной кислоте окислителем является не ион водорода, как в растворах других кислот, а атом азота в высшей степени окисления (+5), поэтому азотная кислота взаимодействует и с неактивными металлами тоже, а вот водород при этом не выделяется. Расставьте коэффициенты в этом уравнении методом электронного баланса (один из учащихся работает у доски).
Учитель: как определить продукты реакции взаимодействия азотной кислоты с металлами? В результате всегда образуются соль, вода и продукт восстановления кислоты, который зависит от активности металла и степени концентрации кислоты. Рассмотрим схему.
(Работа с интерактивной доской- приложение 4: в ходе беседы выясняют зависимость продуктов реакции от активности металла и концентрации кислоты, учащиеся записывают схему в опорный конспект).
3. Этап проверки первичного усвоения новых знаний.
Учитель предлагает составить уравнения реакций взаимодействия азотной кислоты с металлами методом электронного баланса:
1 вариант: Mg + HNO3 (конц) = Mg + HNO3(разб) =
2 вариант: Ag + HNO3(конц) = Ag + HNO3(разб) =
Проверка работы осуществляется на экране с помощью документ-камеры.
(Приложение 5). (Ученики осуществляют взаимопроверку выполненного задания в парах и оценивают друг друга по определённым учителем критериям).
В ходе беседы выясняются затруднения в выполнении задания, количество учащихся, справившихся с заданием. На основании беседы подводятся итоги урока.
4. Подведение итогов урока (фронтальная беседа)
Учитель: что нового мы узнали сегодня о свойствах кислот? В чем отличие химических свойств азотной кислоты от других кислот? В чём сходство?
Как вы оцениваете результат своей работы на уроке?
Какие пункты плана изучения вещества мы не затронули на уроке?
(получение и применение азотной кислоты).
Ответы на эти вопросы вы подготовите самостоятельно к следующему уроку.
5. Домашнее задание:
Учебник п.19 стр.53 , упр.1,4 стр.59
Подготовить сообщения:
1 вариант «Получение азотной кислоты в лаборатории и промышленности»
2 вариант «Применение азотной кислоты».
Литература и источники:
1. Настольная книга учителя химии. Химия 9 класс. О.С.Габриелян, И.Г.Остроумов – М.:Дрофа,2002г.
2. Интерактивное учебное пособие «Наглядная химия» — ООО «Экзамен-Медиа», 2011г.
Приложения
Конспект урока химии по теме: «Азотная кислота»
Тип урока: Урок передачи и приобретения новых знаний и умений.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и специфические химические свойства азотной кислоты – взаимодействие ее с металлами; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
В результате урока необходимо знать:
Состав и строение молекулы азотной кислоты; число ковалентных связей, образуемых атомом азота и степень окисления азота в молекуле азотной кислоты.
Общие химические свойства азотной кислоты: взаимодействие с индикаторами (лакмусом и метилоранжем), с основными и амфотерными оксидами, основаниями, с солями более слабых и более летучих кислот.
Специфические химические свойства азотной кислоты: взаимодействие ее с металлами.
Лабораторный и промышленный способы получения азотной кислоты.
Необходимо уметь:
Составлять уравнения химических реакций с позиции теории электролитической диссоциации.
Составлять уравнения реакций взаимодействия концентрированной и разбавленной кислоты с металлами с использованием метода электронного баланса.
Методы и методические приемы:
Беседа.
Самостоятельная работа учащихся по составлению уравнений химических реакций азотной кислоты с металлами.
Лабораторная работа по изучению общих химических свойств азотной кислоты;
Составление опорного конспекта.
Творческая работа: сообщение учащегося о получении азотной кислоты.
Демонстрация опытов: взаимодействие разбавленной и концентрированной азотной кислоты с медью.
Демонстрация слайдов с помощью мультимедиа проектора.
Взаимопроверка и взаимооценка результатов самостоятельной работы.
Оборудование и реактивы:
На столах учащихся: растворы азотной кислоты HNO3 (20 – 25 %), индикаторы лакмус и метилоранж, раствор гидроксида натрия NaOH, раствор сульфата меди (II) CuSO4, раствор сульфата железа (II) FeSO4, оксид меди (II) CuO, оксид алюминия Al2O3, раствор карбоната натрия Na2CO3, пробирки, пробиркодержатели.
На столе учителя: концентрированная азотная кислота HNO3 (60 – 65 %), разбавленная азотная кислота HNO3 (30 %), штатив с пробирками, медная проволока (кусочки), газоотводная трубка, кристаллизатор с водой, пробиркодержатель, мультимедийная установка (компьютер, проектор, экран).
План урока:
План урока написан на доске и отпечатан для составления опорного конспекта на столах учащихся (Приложение 1)
Ход урока:
I Повторение.
Учитель: На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Ученик: Это аммиак, соли аммония, оксиды азота.
Учитель: Какие оксиды азота являются кислотными?
Ученик: Оксид азота (III) N2O3 – азотистый ангидрид и оксид азота (V) N2O5 – азотный ангидрид, ему соответствует азотная кислота HNO3.
Учитель: Каков качественный и количественный состав азотной кислоты?
Учитель пишет на доске формулу азотной кислоты и просит ученика расставить степени окисления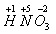
Ученик: Молекула состоит из трех химических элементов: H, N, O – из одного атома водорода, одного атома азота и трех атомов кислорода.
II Состав и строение HNO3
Учитель: Как же образуется молекула азотной кислоты?
Учитель показывает презентацию об азотной кислоте (Приложение 2 – презентация, Приложение 3 – текст пояснения к презентации)
III Физические свойства:
Учитель: Теперь переходим к изучению физических свойств азотной кислоты.
Учащиеся составляют краткое описание физических свойств азотной кислоты.
Учитель на демонстрационном столе показывает, что представляет собой концентрированная азотная кислота HNO (60 – 65 %) — бесцветная жидкость, «дымящаяся на воздухе», с едким запахом. Концентрированная 100 % — ая HNO3 иногда окрашена в желтоватый цвет, т.к. она летучая и нестойкая, и при комнатной температуре разлагается с выделением оксида азота (IV) или «бурого» газа, именно поэтому ее хранят в бутылках из темного стекла.
Учитель на доске пишет уравнение химической реакции разложения азотной кислоты:
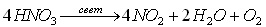
Учитель: Азотная кислота гигроскопична, смешивается с водой в любых отношениях. В водных растворах – сильный электролит, при температуре – 41,6 0С затвердевает. На практике применяется 65 % азотная кислота, она не дымит, в отличие от 100 % — ой.
IV Химические свойства
Учитель: Переходим к следующему этапу урока. Азотная кислота – сильный электролит. Следовательно, ей будут присущи все общие свойства кислот. С какими веществами реагируют кислоты?
Ученик: С индикаторами, с основными и амфотерными оксидами, с основаниями, с солями более слабых и летучих кислот, с металлами.
Учитель: Перед вами общие свойства кислот.
Включается мультимедийная установка. Учитель показывает презентацию об общих химических свойствах кислот (Приложение 4).
Учитель: Проведем экспериментальный этап урока. Ваша задача – провести химические реакции, подтверждающие химические свойства кислот, на примере азотной кислоты. Работать будете группами по 4 человека. На партах лежат инструкции к лабораторным опытам (Приложение 5). В тетрадях надо составить уравнения химических реакций в молекулярном и ионном виде.
Далее учитель проверяет технику безопасности выполнения лабораторных опытов. Вызывает учеников к доске записывать уравнения реакций.
Учитель: Переходим к специфическим химическим свойствам азотной кислоты. Следует отметить, что азотная кислота, и разбавленная, и концентрированная, при взаимодействии с металлами не выделяет водород, а может выделять различные соединения азота – от аммиака до оксида азота (IV).
Включается мультимедийная установка. Учитель показывает презентацию о возможных продуктах восстановления азотной кислоты (Приложение 6).
Учитель: Посмотрим на схему. У каждого на столах лежат схемы восстановления азотной кислоты (разбавленной и концентрированной) металлами (Приложение 7).
Далее учитель демонстрирует опыты:
Взаимодействие разбавленной азотной кислоты с медью. Собирание оксида азота (II) над водой.
Взаимодействие концентрированной азотной кислоты с медью. Получение оксида азота (IV).
На доске записывает уравнения реакций:
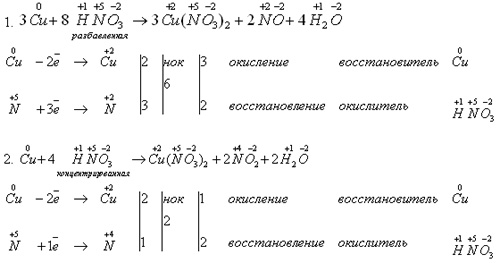
Учитель: На основе опытов можно сделать выводы:
Раствор азотной кислоты реагирует не только с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода, но и с металлами, стоящими после водорода.
В реакции с разбавленной HNO3 окислителем металлов является не ион водорода H+, а ион NO3-, у которого окислительные свойства сильнее.
Концентрированная азотная кислота также реагирует с металлами, стоящими в электрохимическом ряду напряжений металлов правее водорода. Окислителем металлов в данном случае являются молекулы HNO3 за счет предельно окисленного атома азота
 .
.В окислительно-восстановительных реакциях с металлами азотная кислота выступает как сильный окислитель за счет атомов
 . Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
. Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
Учитель: Пользуясь схемами восстановления концентрированной и разбавленной азотной кислоты металлами, а также учебником на стр. 127, перейдем к самостоятельной работе по вариантам (Приложение 8). Каждый выполняет свой вариант. Вам предложены карточки – задания. Время работы 5-7 минут.
Включается мультимедийная установка. Учитель показывает правильные варианты ответов (Приложение 9). Учащиеся проверяют правильность выполнения задания.
V Получение азотной кислоты HNO3
Ученик: (сообщение) В лаборатории азотную кислоту получают взаимодействием калийной или натриевой селитры с концентрированной серной кислотой при нагревании или без нагревания:
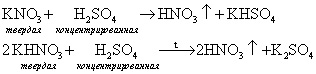
В промышленности азотную кислоту получают каталитическим окислением аммиака, синтезированного из азота воздуха:
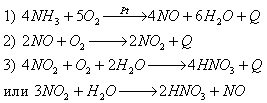
Ученик показывает схему получения азотной кислоты (Приложение 10), а учащиеся записывают уравнения реакций в тетрадь.
VI Заключение
Учитель: На сегодняшнем уроке мы познакомились с составом и строением азотной кислоты. Повторили и закрепили общие свойства кислот на примере азотной кислоты, закрепили свои знания по теории ТЭД, теории строения атома и химической связи. Изучили специфические свойства азотной кислоты, а именно взаимодействие ее с металлами. Познакомились со способами получения азотной кислоты.
Далее подводятся итоги, выставляются оценки. Учитель задает домашнее задание по учебнику, задачнику и конспекту.
Д/з: § 33, упр. 4 на стр. 128 учебника;
задачи: 4 – 35, 4 – 41 задачник;
выучить конспект.
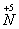 .
.