Чем органическая химия отличается от неорганической
На данном этапе эволюции ни один человек не может представить свою жизнь без химии. Ведь каждый день во всем мире происходят различные химические реакции, без которых просто невозможно существование всего живого. В целом в химии существует два раздела: неорганическая и органическая химия. Чтобы разобраться в основных их отличиях, в первую очередь необходимо понять, что эти разделы собой представляют.
Неорганическая химия
Известно, что эта область химии изучает все физические и химические свойства неорганических веществ, а так же их соединений, при этом берется во внимание их состав, структура, а так же способность к различным реакциям с применением реактивов и при их отсутствии.

Они бывают как простыми, так и сложными. С помощью неорганических веществ создаются новые технически важные материалы, которые пользуются спросом у населения. Если быть точными, то этот раздел химии занимается изучением тех элементов и соединений, которые не создаются живой природой и не являются биологическим материалом, а получаются
В ходе некоторых экспериментов, оказалось, что живые существа способны производить много неорганических веществ, а так же существует и возможность синтеза органических веществ в лаборатории. Но, несмотря на это, все же разделять между собой эти две области просто необходимо, так как по механизмам прохождения реакций, структуре и свойствам веществ этих областей существуют некие различия, не позволяющих все объединить в один раздел.
Выделяют простые и сложные неорганические вещества. К простым веществам относятся две группы соединений – это металлы и неметаллы. Металлы – это такие элементы, которым присущи все металлические свойства, а так же существует металлическая связь между ними. К этой группе относят такие виды элементов: щелочные металлы, щелочноземельные, переходные, легкие, полуметаллы, лантаноиды, актиноиды, а так же магний и бериллий. Из всех, официально признанных, элементов периодической системы к металлам относят девяносто шесть элементов из ста восьмидесяти одного возможного, то есть больше половины.
Самыми известными элементами из неметаллических групп являются кислород, кремний, и водород, а те, которые менее распространенные — это мышьяк, селен и йод. К простым неметаллам так же относят гелий и водород.
Сложные неорганические вещества подразделяют на четыре группы:
- Оксиды.
- Гидроксиды.
- Соли.
- Кислоты.
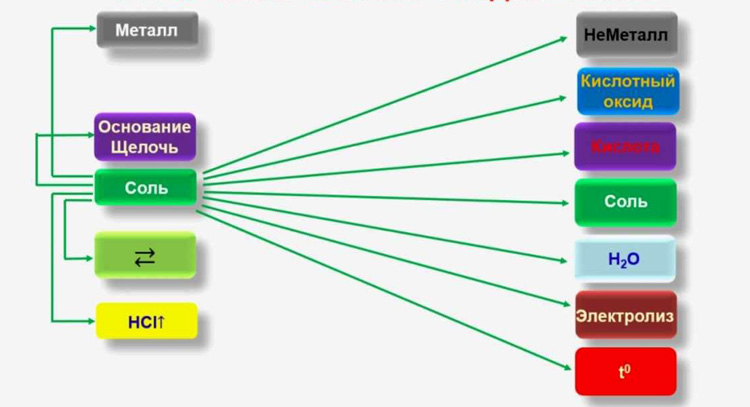
Схема взаимодействия солей с неорганическими соединениями
Органическая химия
Данная область химии исследует вещества, которые состоят из углерода и других элементов, тех, что вступают с ним в связь, то есть создают так называемые органические соединения. Это могут быть вещества и неорганической природы, так как углеводород может присоединять к себе много разных химических элементов.

Чаще всего, органическая химия занимается синтезом и обработкой веществ и их соединений из сырья растительного, животного или микробиологического происхождения, хотя, особенно в последнее время, эта наука выросла далеко за пределы обозначенных рамок.
К основным классам органических соединений относятся: углеводороды, спирты, фенолы, галогенсодержащие соединения, простые и сложные эфиры, альдегиды, кетоны, хиноны, азотсодержащие и серосодержащие соединения, карбоновые кислоты, гетероциклические, металлоорганические соединения и полимеры.
Вещества, изучаемые органической химией, отличаются огромным разнообразием, так как из-за наличия в их составе углеводорода они могут связываться с множеством других различных элементов. Безусловно, органические вещества так же входят в состав живых организмов в виде жиров, белков и углеводов, которые выполняют различные жизненно важные функции. Самыми главными с которых есть энергетическая, регуляторная, структурная, защитная и другие. Они входят в состав каждой клеточки, каждой ткани и органа любого живого существа. Без них невозможно нормальное функционирование организма в целом, нервной системы, репродуктивной и других. Значит, все органические вещества играют огромную роль в существовании всего живого на земле.
Основные отличия между ними
В принципе, эти два раздела связанны между собой, но так же и имеют некоторые отличия. Прежде всего, в состав органических веществ обязательно входит углерод, в отличие от неорганических, в состав которых он может и не входить. Так же существуют различия в структуре, в способности реагировать на различные реагенты и созданные условия, в строении, в основных физических и химических свойствах, в происхождении, в молекулярной массе и так далее.
В органических веществ молекулярная структура намного сложнее, чем у неорганических. Последние могут плавиться только при достаточно высоких температурах и крайне затрудненно поддаются разложению, в отличии от органических, которые имеют относительно не высокую температуру плавления. Органические вещества имеют достаточно объемную молекулярную массу.
Еще важным отличием является то, что только органические вещества имеют способность формировать соединения с одинаковым набором молекул и атомов, но которые имеют различные варианты расположения. Таким образом, получаются совершенно разные вещества, отличающиеся между собой по физическим и химическим свойствам. То есть органические вещества склонны к такому свойству как изомерия.
vchemraznica.ruРазница между органической и неорганической химией
Разница между органической и неорганической химией
В широком смысле, химию можно классифицировать как раздел физической науки, который объясняет происхождение, структуру и поведение материи и изменение материи от одной формы к другой. Неорганическая и органическая химия — две разные отрасли химии, которые зависят от природы соединений. Основное различие между органической и неорганической химией состоит в том, чтонеорганическая химия — это исследование неорганических соединений, тогда как органическая химия — это изучение органических соединений.
Эта статья объясняет,
1. Что такое неорганическая химия?
— определение, реакции, структура, свойства
2. Что такое органическая химия?
– Определение, реакции, структура, свойства
3. В чем разница между неорганической и органической химией?
Что такое неорганическая химия
В общем, неорганические молекулы — это молекулы, которые не имеют определенной углеводородной структуры (состоящей из атомов углерода и водорода). Они в основном состоят из ионов, и эти ионы действуют как основа их химической реактивности. Ионы образуются, когда молекула или атом имеет меньшее или большее количество электронов, чем их первоначальная электронная конфигурация. Однако ионы образуются для того, чтобы сделать атомы / молекулы более стабильными, придавая им электронную конфигурацию благородного газа. Поэтому, когда атомы достигают электронной конфигурации благородного газа, они становятся либо положительно, либо отрицательно заряженными. Положительно заряженные виды называются катионами, а отрицательно заряженные виды называются анионами. Катионы и анионы естественным образом притягиваются друг к другу посредством ионных взаимодействий, образующих самые сильные типы химических связей, называемых ионными связями. Как правило, все они классифицируются как неорганические соединения. Однако существует также большое количество соединений, связанных ковалентными связями, которые подпадают под категорию неорганических соединений. то есть HCl, CO 2, Ч2О
Основным типом неорганических реакций являются реакции замещения и окислительно-восстановительные реакции. Что происходит в случае реакций замещения, так это то, что катионы и анионы между двумя соединениями обмениваются в зависимости от их реакционного потенциала. С другой стороны, окислительно-восстановительные реакции происходят из-за окисления и восстановления. Следовательно, металлы и их формы весьма значительны в неорганической химии, в том числе в области химии переходных металлов. Неорганические соединения обычно имеют более высокие температуры плавления. Другие методы, такие как перекристаллизация, электрохимия, рентгеновская кристаллография, химия на основе кислот, рН-химия, катализ и т. Д., Имеют дело с неорганической химией.
Структура ионного каркаса в оксиде калия
Что такое органическая химия
Помимо металлоорганических соединений (соединений, которые включают органическую структуру плюс металлы), между органической химией и неорганической химией очень мало совпадений. Как уже упоминалось выше, органические молекулы состоят из углеводородов. Поэтому очень легко различить органическое и неорганическое соединение. До 19го Века считалось, что органические молекулы были естественными и могут быть извлечены только из природы. Однако самый большой прорыв в органической химии произошел, когда Кекуле объяснил существование структуры бензола. Бензольное ядро стало неотъемлемой частью органической химии.
Классификация и реакции органических соединений зависят от их функциональных групп. Длина углеродной цепи будет просто определять физические характеристики соединения. Органические соединения имеют тенденцию плавиться и кипеть, в отличие от неорганических соединений. Методы спектроскопии в основном используются для анализа органических соединений. Органическая химия широко используется в медицинской химии для открытия новых лекарств, химии питания, химии ароматов и ароматизаторов, нефти и т. Д.
Шарообразная модель молекулы метана
Разница между органической и неорганической химией
Определение
Неорганическая химия имеет дело с неорганическими соединениями, обычно такими, которые имеют ионное основание.
Органическая химия занимается органическими соединениями из углеводородов.
Реакции
Неорганическая химия включает кислотно-основные реакции, реакции вытеснения, окислительно-восстановительные реакции и т. д.
Органическая химия включает реакции, которые зависят от функциональной группы, присутствующей на соединении.
Состав
Неорганическая химия в основном занимается солями и кристаллами.
Органическая химия имеет дело с маслами, жирами, сахарами и т. д.
Физические свойства
Неорганические молекулы имеют более высокие температуры плавления и деградируют вместо кипения.
Органические молекулы растопить и варить.
Изображение предоставлено:
«Метан-CRC-MW-3D-шары» Бена Миллса — собственная работа
ru.strephonsays.com
Органическая и неорганическая химия 2019
Органическая и неорганическая химия
Органическая и неорганическая химия являются субдисциплинами в химии. В органической химии научное исследование сосредоточено на углеродных соединениях и других соединениях на основе углерода, таких как углеводороды и их производные. Неорганическая химия связана с научным исследованием всех химических соединений, за исключением углеродной группы. Поэтому, чтобы сократить историю, органическая химия имеет дело с углеродом, в то время как неорганическая химия имеет дело с остальными химическими соединениями, за исключением углерода.
Когда мы говорим о научном изучении органической или неорганической химии, это включает изучение состава, структуры, свойств, подготовки и изучения реакций. Чтобы думать о том, чтобы стать химиком, человек должен быть экспертом во всех упомянутых процессах.
Органическая химия занимается фотохимией, стереохимией, гидрированием, изомеризацией, полимеризацией и ферментацией. С другой стороны, неорганическая химия охватывает широкий круг вопросов. Примерами таких являются: электрохимия, кристаллография, атомная структура, координация соединений, керамика, химическое связывание и реакции на основе кислоты. Всегда говорят, что органическая и неорганическая химия всегда перекрываются.
Органическая химия считается важной субдисциплиной химии. Это связано с тем, что они занимаются жизнью и связанными с ней химическими реакциями. Они также занимаются обширными продуктами, которые могут быть изготовлены из него, такими как улучшение чистящих средств. Неорганическая химия также является важной субдисциплиной. Согласно Р.Т. Сандерсон, неорганическая химия важна, потому что это единственная дисциплина в области химии, которая конкретно рассматривает различия между всеми видами атомов. Примером неорганической химии, в которой она может быть применена, является использование лекарственной неорганической химии, которая изучает значимые и несущественные элементы, которые могут быть использованы при лечении и диагностике заболеваний.
Чтобы стать неорганическим или органическим химиком, требуется степень бакалавра по химии по специальности органическая или неорганическая химия. Затем они могут получить степень магистра или степень доктора, чтобы они могли повысить свои знания. Они могут также преподавать в академии или работать в лабораториях. Химик может заработать до 30 000 долларов США до 130 000 долларов США в зависимости от позиции и опыта на 2009 год. Это сложная степень, хотя и включает в себя терпение, аналитическое и критическое мышление.
Резюме:
1.Органическая химия занимается углеродом и его производными, в то время как неорганическая химия имеет дело с остальными элементами, кроме углерода.
2.Органическая химия занимается фото
ru.esdifferent.com
Органические и неорганические вещества: что это и в чем разница
Каждая наука насыщена понятиями, при не усвоении которых основанные на этих понятиях или косвенные темы могут даваться очень трудно. Одними из понятий, которые должны быть хорошо усвоены каждым человеком, который считает себя более-менее образованным, есть разделение материалов на органические и неорганические. Не важно, сколько человеку лет, эти понятия в списке тех, с помощью которых определяют общий уровень развития на любом этапе человеческой жизни. Для того чтобы понять, в чем отличия этих двух терминов, сначала нужно выяснить, что собой являет каждый из них.
Органические соединения – что это
Органические вещества – группа химических соединений с неоднородной структурой, в состав которых входят элементы углерода, ковалентно связанных между собой. Исключение составляют карбиды, угольные, карбоновые кислоты. Также одними из составляющих веществ, кроме углерода, есть элементы водорода, кислорода, азота, серы, фосфора, галогена.
Такие соединения формируются благодаря способности атомов углерода перебывать в одинарных, двойных и тройных связях.
Сферой обитания органических соединений являются живые существа. Они могут быть как в составе живых существ, так и появится в результате их жизненной деятельности (молоко, сахар).
Продуктами синтеза органических веществ являются продукты питания, лекарства, элементы одежды, материалы для строения, различное оборудование, взрывчатки, различные виды минеральных удобрений, полимеры, добавки для пищи, косметика и другое.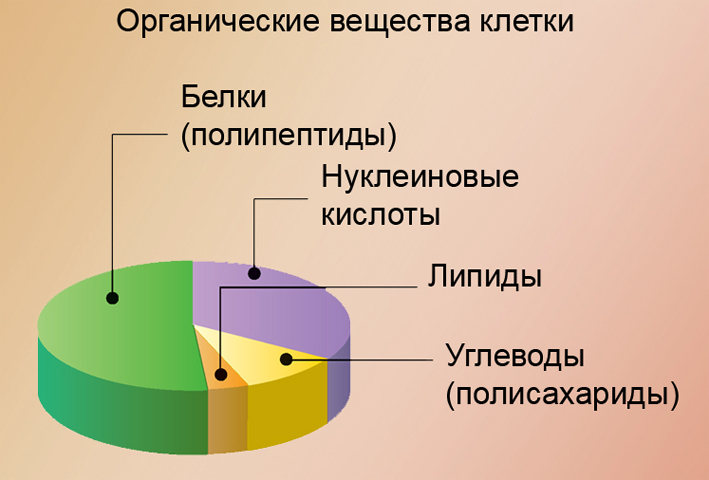
Неорганические вещества – что это
Неорганические вещества – группа химических соединений, которые в своем составе не имеют элементов углерода, водорода или химических соединений, составляющим элементом которых является углерод. Как органические, так и неорганические являются составляющими клеток. Первые в виде дающих жизнь элементов, другие в составе воды, минеральных веществ и кислот, а также газов.
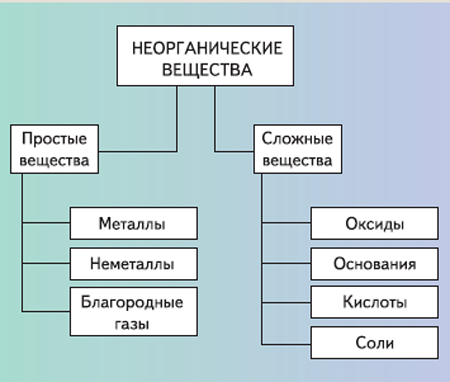
Что общего между органическими и неорганическими веществами
Что может быть общего между двумя, казалось бы, такими понятиями-антонимами? Оказывается, общее и у них имеется, а именно:
- Вещества как органичного, так неорганического происхождения состоят из молекул.
- Органические и неорганические вещества можно получить в результате проведения определенной химической реакции.
Органические и неорганические вещества – в чем разница
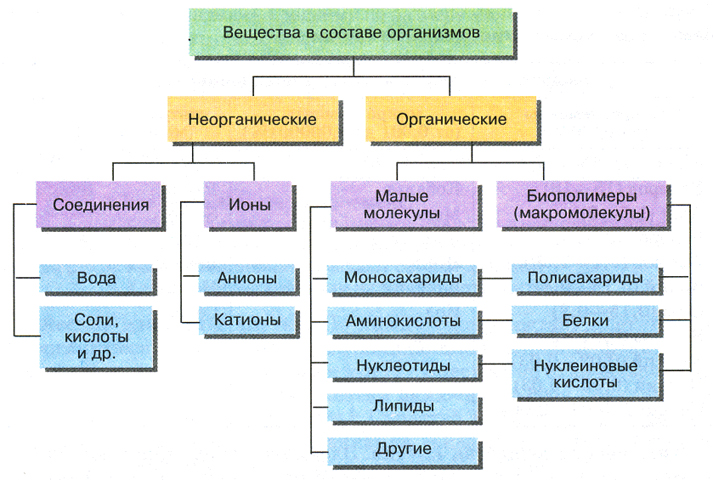
- Органические более известны и исследованы в науке.
- Органических веществ в мире числится намного больше. Количество известных науке органических – около миллиона, неорганических – сотни тысяч.
- Большинство органических соединений связаны между собой с помощью ковалентного характера соединения, связь неорганических между собой возможна с помощью ионного соединения.
- Присутствует отличие и по составу входящих элементов. Органические вещества составляют углеродные, водородные, кислородные, реже – азотные, фосфорные, серные и галогенные элементы. Неорганические – состоят из всех элементов таблицы Менделеева, кроме углерода и водорода.
- Органические вещества намного значительнее поддаются влиянию горячих температур, могут разрушаться даже при незначительных температурах. Большинство неорганических менее предрасположены к воздействию сильного нагревания из-за особенностей типа молекулярного соединения.
- Органические вещества являются составляющими элементами живой части мира (биосферы), неорганические – неживой (гидросферы, литосферы и атмосферы).
- Состав органических веществ является по своему строению сложнее, чем состав неорганических.
- Органические вещества отличаются большим разнообразием возможностей химических превращений и реакций.
- Из-за ковалентного типа связи между органическими соединениями химические реакции по времени продолжаются несколько дольше, чем химические реакции в неорганических соединениях.
- Неорганические вещества не могут быть продуктом питания живых существ, даже более того – некоторые из этого типа сочетаний могут быть смертельно опасны для живого организма. Органические вещества являются продуктом, произведенным живой природой, а также элементом строения живых организмов.
vchemraznica.ru
Неорганическая и органическая химия | Репетиторов.нет — Единая база репетиторов по России и всему миру без посредников и комиссии! Поиск репетитора. Частные анкеты и объявления лучших репетиторов, тренеров и инструкторов.
Неорганическая химия.
Неорганическая химия — раздел химии, в котором изучают свойства различных химических элементов и соединения, которые они образуют, за исключением углеводородов (химических соединений углерода и водорода) и продуктов их замещения, представляющих собой так называемые органические молекулы.
Первые исследования в области неорганической химии были посвящены минералам. Ставилась цель извлечь из них различные химические элементы. Эти исследования позволили разделить все вещества на две большие категории: химические элементы и соединения.
Химические элементы — вещества, состоящие из одинаковых атомов (например, Fe, из которого состоит железный прут, или РЬ, из которого сделана свинцовая труба).
Химические соединения — это вещества, состоящие из различных атомов. Например, вода Н20, сульфат натрия Na2S04, гидроокись аммония Nh5OH…
Атомы, входящие в состав химических элементов и соединений, делят на два класса — атомы металлов и атомы неметаллов.
Атомы неметаллов (азот N, кислород О, сера S, хлор CI.) имеют способность присоединять к себе электроны, забирая их у других атомов. Поэтому атомы неметаллов называют «электроотрицательными».
Атомы металлов, напротив, имеют тенденцию отдавать электроны другим атомам. Поэтому атомы металлов называют электроположительными. Это, например, железо Fe, свинец РЬ, медь Cu, цинк Zn. Вещества, состоящие из двух различных химических элементов обычно содержат атомы металла одного вида (обозначение соответствующего атолла помещается в начало химической формулы) и атомы неметалла также одного вида (в химической формуле обозначение соответствующего атома помещается после атома металла). Например, хлорид натрия NaCI. Если вещество не содержит атом металла, то в начало химической формулы помещается наименее электроотрицательный элемент, например аммиак Nh4.
Система наименований неорганических химических соединений была утверждена в 1960 году Международным союзом IUPAC. Неорганические химические соединения называют, произнося сначала наименование наиболее электроотрицательного элемента (обычно неметалла). Например, соединение с химической формулой KCI называют хлоридом калия. Вещество h3S называется сероводородом, а СаО — оксидом кальция.
Органическая химия.
В начале своего развития эта химия исследовала вещества, входящие в живые организмы — растения и животные (белки, жиры, сахара), либо вещества разложившейся живой материи (нефть). Все эти вещества называли органическими.
Встречающиеся в природе органические вещества относят к различным группам: нефть и ее составляющие, белки, углеводы, жиры, гормоны, витамины и другие.
В начале 19 века были синтезированы первые искусственные органические молекулы. Используя неорганическую соль цианат аммония, Велер в 1828 году получил мочевину. Уксусная кислота была синтезирована Кольбе в 1845 году. Бертло получил этиловый спирт и муравьиную кислоту (1862 год).
Со временем химики научились синтезировать все большее и большее количество природных органических веществ. Были получены глицерин, ванилин, кофеин, никотин, холестерин.
Многие из синтезированных органических веществ не существуют в природе. Это пластмассы, моющие средства, искусственные волокна, многочисленные лекарства, красители, инсектициды.
Углерод образует больше соединений, чем какой либо другой элемент. Имея стабильную внешнюю электронную оболочку, углерод весьма мало склонен становиться положительно или отрицательно заряженным ионом. Эта электронная оболочка возникает в результате образования четырех связей, направленных к вершинам тетраэдра, в центре которого находится ядро атома углерода. Именно поэтому органические молекулы имеют специфическую структуру.
В органических молекулах атом углерода всегда участвует в четырех химических связях. Атомы углерода способны легко объединяться друг с другом, образуя длинные цепи или циклические структуры.
Атомы углерода в органических молекулах могут быть соединены между собой одинарными связями (так называемые насыщенные углеводороды) или кратными, точнее двойными, а также тройными связями (углеводороды ненасыщенные).
Международный союз IUPAC разработал систему наименований органических соединений. Эта система выявляет наиболее длинную неразветвленную углеродную цепь, тип химической связи между атомами углерода, а также наличие различных групп атомов (заместителей), прикрепленных к главной углеродной цепи.
Группы атомов углерода придают органическим молекулам, в которых они содержатся, специфические свойства. Последние позволяют различать многочисленные классы органических соединений, например: углеводороды (вещества из атомов углерода и водорода), спирты, органические кислоты.
Вещества / Органика / Синтез / Химияrepetitorov.net
Разница между неорганическим и органическим углеродом
Основное различие между неорганическим и органическим углеродом является то, что неорганический углерод извлекается из руд и минералов, в то время как органический углерод встречается в природе в растениях и в живых существах.
Углерод — это химический элемент с атомным номером 6. Более того, он является одним из основных химических элементов, которые способствуют генетическому накоплению жизни на Земле. Этот химический элемент может находиться в двух основных источниках: в неорганических источниках и в органических источниках.
Содержание
- Обзор и основные отличия
- Что такое неорганический углерод
- Что такое органический углерод
- В чем разница между неорганическим и органическим углеродом
- Заключение
Что такое неорганический углерод?
Неорганический углерод — это углерод, извлекаемый из руд и минералов. Следовательно, эта форма углерода встречается в неорганических источниках. Неорганические источники — это соединения, в которых необязательно имеются атомы углерода и водорода. Кроме того, углерод может существовать в нескольких аллотропных формах. Это также источники неорганического углерода. Аллотропы — это соединения, которые существуют в одном физическом состоянии с атомами, расположенными по-разному. Примеры углеродных аллотропов включают алмаз, графит и т.д. Поскольку эти материалы демонстрируют различные химические и физические свойства, неорганический углерод отличается друг от друга в зависимости от источника.
Примеры источников неорганического углерода
- Оксиды углерода, такие как монооксид углерода и диоксид углерода.
- Многоатомные ионы, такие как цианид, цианат, тиоцианат, карбонат и т.д.
- Аллотропы углерода, такие как алмаз, графит, фуллерен и т.д.
Что такое органический углерод?
Растения и живые организмы являются источником органического углерода. Соединения, связанные с живыми организмами, являются органическими. Все эти органические соединения содержат углерод в качестве необходимого компонента, в то время как большинство из них также содержат водород. Кроме того, органическое вещество в почве является основным источником органического углерода. Это органическое вещество составляет около 2-10% почвы.
 Круговорот углерода в природе, показывающий как органические, так и неорганические источники углерода
Круговорот углерода в природе, показывающий как органические, так и неорганические источники углеродаПримеры источников органического углерода
- Углерод присутствует в компонентах живых организмов, таких как ДНК, РНК, ферменты и т.д.
- Углеводородное топливо
- Спирты, альдегиды, кетоны, эфиры и др.
- Метан
- Тетрахлорметан мочевина
В чем разница между неорганическим и органическим углеродом?
Неорганический углерод — это углерод, извлеченный из руд и минералов. Следовательно, источники этого типа углерода включают руды, минералы и т.д. Органический углерод содержится в природе в растениях, живых существах, почве и т.д. Это основное различие между неорганическим и органическим углеродом. Некоторыми примерми неорганических углеродов присутствуют в оксидах углерода, многоатомные ионы, такие как карбонат, аллотропы углерода, такие как алмаз, и т.д. В то время как углерод, присутствующий в компонентах живых организмов, таких как ДНК, ферменты, метан, углеводородное топливо и т.д., является примером органического углерода.
Заключение — Неорганический против Органического углерода
Углерод бывает двух видов — органический и неорганический углерод, в зависимости от источника происхождения. Ключевое различие между неорганическим и органическим углеродом состоит в том, что неорганический углерод — это углерод, извлекаемый из руд и минералов, тогда как органический углерод содержится в растениях и живых организмах.
raznisa.ru
Неорганическая химия — это… Что такое Неорганическая химия?
Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим[1]). Различие между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными.[2]Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов новейшей техники. Число неорганических веществ приближается к 400 тысячам.
Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
В России исследованиями в области неорганической химии занимаются Институт неорганической химии им. А. В. Николаева СО РАН (ИНХ СО РАН, Новосибирск), Институт общей и неорганической химии им. Н. С. Курнакова (ИОНХ РАН, Москва), Институт физико-химических проблем керамических материалов (ИФХПКМ, Москва), Научно-технический центр «Сверхтвердые материалы» (НТЦ СМ, Троицк) и ряд других учреждений. Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
История определения
Исторически название неорганическая химия происходит от представления о части химии, которая занимается исследованием элементов, соединений, а также реакций веществ, которые не образованы живыми существами. Однако со времен синтеза мочевины из неорганического соединения цианата аммония (NH4OCN), который совершил в 1828 году выдающийся немецкий химик Фридрих Вёлер, стираются границы между веществами неживой и живой природы. Так, живые существа производят много неорганических веществ. С другой стороны, почти все органические соединения можно синтезировать в лаборатории. Однако деление на различные области химии является актуальным и необходимым, как и раньше, поскольку механизмы реакций, структура веществ в неорганической и органической химии различаются. Это позволяет проще систематизировать методы и способы исследования в каждой из отраслей.
Классификация химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен[3] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и так далее). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Простые вещества
Состоят из атомов одного химического элемента (являются формой его существования в свободном состоянии). Все простые вещества в неорганической химии делятся на две большие группы: Металлы — Неметаллы.
Металлы
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск. Из 118[4]химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
Таким образом, к металлам относится 96 элементов из всех открытых.
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их бо́льшую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. К неметаллам также относят водород и гелий.
Сложные вещества
Большую часть сложных неорганических веществ (то есть состоящих из двух и более химических элементов) можно разделить на следующие группы:
Оксиды
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Соли
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония или гидроксония ) и анионов кислотного остатка. Типы солей:
Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C.
Основания
Основа́ния — класс химических соединений:
Кислоты
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Также можно выделить следующие группы неорганических веществ: карбиды, нитриды, гидриды, интерметаллиды и другие, которые не укладываются в приведённую выше классификацию (более подробно см. Неорганическое вещество).
Карбиды
Карби́ды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения, в которых углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и тому подобные). Карбиды — тугоплавкие твёрдые вещества: карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Нитриды
Нитри́ды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4). Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Гидриды
Гидри́ды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом[5][6].
Интерметаллиды
Интерметалли́д (интерметаллическое соединение) — химическое соединение из двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами. Интерметаллиды обладают, как правило, высокой твёрдостью и высокой химической стойкостью. Очень часто интерметаллиды имеют более высокую температуру плавления, чем исходные металлы. Почти все интерметаллиды хрупки, так как связь между атомами в решётке становится ковалентной или ионной (например, в ауриде цезия CsAu), а не металлической. Некоторые из них имеют полупроводниковые свойства, причём, чем ближе к стехиометрии соотношение элементов, тем выше электрическое сопротивление. Никелид титана, известный под маркой «нитинол», обладает памятью формы — после закалки изделие может быть деформировано механически, но примет исходную форму при небольшом нагреве.
См. также
Примечания
- ↑ К неорганическим соединениям углерода обычно относят некоторые соли (карбонаты, цианиды, цианаты, тиоцианаты) и соответствующие им кислоты, а также оксиды углерода, карбонилы металлов и карбиды.
- ↑ Spencer L. Seager, Michael R. Slabaugh. Chemistry for Today: general, organic, and biochemistry. // Thomson Brooks/Cole, 2004. — Р. 342. ISBN 0-534-39969-X
- ↑ В книге В. М. Потапов, Г. Н. Хомченко «Химия», М. 1982 (стр. 26) утверждается, что их более 400.
- ↑ Международный химический союз признал 112-й химический элемент
- ↑ Гидриды. XuMuK.ru. Архивировано из первоисточника 22 июня 2012. Проверено 15 июля 2010.
- ↑ onium compounds // IUPAC Gold Book
Литература
- Капустинский А. Ф. Очерки по истории неорганической и физической химии в России. М.-Л., 1949
- Жамбулова М. Ш. Развитие неорганической химии (Историко-методологический аспект). Алма-Ата, 1981.- 187 с.
- Неорганическое материаловедение в СССР. Под ред. И. В. Тананаева — Киев: Наукова думка, 1983. — 720 с.
- Популярная библиотека химических элементов. Т. 1,2. / Под ред. И. В. Петрянова-Соколова — М.: Наука, 1983. — 575 с., — 572 с.
- Реми Г. Курс неорганической химии. Т. 1. М.: Изд-во иностранной ли-тературы, 1963. — 920 с.
- Реми Г. Курс неорганической химии. Т. 2. М.: Мир, 1974. — 775 с.
- Шрайвер Э. Неорганическая химия. Т. 1,2. / Э. Шрайвер, П. Эткинс — М.: Мир, 2004. — 679 с., — 486 с.
- Энциклопедия неорганических материалов / Под ред. И. М. Федорчен-ко. В 2-х т. — Киев: Укр. сов. энциклопедия, 1977. — 1652 с.
- Аблесимов Н. Е. Синопсис химии: Справочно-учебное пособие по общей химии — Хабаровск: Изд-во ДВГУПС, 2005. — 84 с. — http://www.neablesimov.narod.ru/pub04c.html
- Аблесимов Н. Е. Сколько химий на свете? ч. 1. // Химия и жизнь — XXI век. — 2009. — № 5. — С. 49-52.
Ссылки
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 мая 2011. |
dic.academic.ru