Исторический обзор возникновения и развития представлений о строении органических соединений
из «Курс органической химии»
Уже в течение первых десятилетий XIX в. число известных органических веществ начало возрастать с каждым годом. Было установлено, что многие органические соединения обладают значительно более сложным строением, чем неорганические вещества, и открыто явление изомерии (см. стр. 27). Это поставило перед исследователями, казалось бы, неразрешимую задачу объяснить и систематизировать все многочисленные новые явления. Великие ученые того времени — Берцелиус, Дюма и Либих ясно видели все значение стремительно развивающейся органической химии и пытались вместе с другими исследователями постепенно систематизировать все вновь открытые соединения и рассмотреть их с какой-нибудь определенной точки зрения. Это стремление нашло свое выражение в теории радикалов и ее предшественнице — этериновой теории.
Берцелиус называл радикалы подражателями элементов . [c.18]
Берцелиус назвал радикал С2Н4, лежащий в основе всех указанных производных, этерином и отметил аналогию между продуктами присоединения, образуемыми этим радикалом, и продуктами присоединения аммиака (МНз-НгО, ННз-НС1 и т.
 д.). [c.18]
д.). [c.18]
От Берцелиуса, однако, не укрылось и то обстоятельство, что между производными этерина и производными аммиака имеется лишь формальное сходство, и, в частности, то, что основной характер гидрата аммиака, представляющий собой его самое замечательное свойство, соверщенно отсутствует у гидратов этерина (у спирта и эфира). [c.18]
Представление о существовании химических типов , поддающихся изменению и способных к реакциям замещения, подготовило путь для дальнейшего развития учения о строении химических соединений и привело к возникновению т е о р и и т и п о в. [c.20]
В основе всех этих соединений лежит одно и то же материнское вещество, иначе говоря, все они принадлежат к типу аммиака. [c.20]
Лишь значительно позднее стали известны некоторые факты, особенно случаи изомерии, которые не могли быть объяснены даже при помощи подобных структурных формул.

Вернуться к основной статье
Химия! — литература
Неорганическая химия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область охватывает все химические соединения, за исключением органических веществ (класса соединений, в которые входит углерод, за исключением нескольких простейших соединений, обычно относящихся к неорганическим). Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества (кроме органических соединений). Обеспечивает создание материалов
новейшей техники. Число известных на 2013 г. неорганических веществ
приближается к 500 тысячам.
Обеспечивает создание материалов
новейшей техники. Число известных на 2013 г. неорганических веществ
приближается к 500 тысячам.Теоретическим фундаментом неорганической химии является периодический закон и основанная на нём периодическая система Д. И. Менделеева. Важнейшая задача неорганической химии состоит в разработке и научном обосновании способов создания новых материалов с нужными для современной техники свойствами.
В России исследованиями в области неорганической химии занимаются Институт неорганической химии им. А. В. Николаева СО РАН (ИНХ СО РАН, Новосибирск), Институт общей и неорганической химии им. Н. С. Курнакова (ИОНХ РАН, Москва), Институт физико-химических проблем керамических материалов (ИФХПКМ, Москва), Научно-технический центр «Сверхтвёрдые материалы» (НТЦ СМ, Троицк) и ряд других учреждений. Результаты исследований публикуются в журналах («Журнал неорганической химии» и др.).
Органическая химия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза.
 Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P.
Способность углерода соединяться с большинством элементов и
образовывать молекулы различного состава и строения обусловливает
многообразие органических соединений. 24 мая 1999 года число известных
химических соединений превышало 19 млн., из них 12 млн были
органическими, ко 2 мая 2014 года общее число известных неорганических и органических соединений превысило 87 млн. Органические соединения играют ключевую роль в существовании живых организмов. Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления:
Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P.
Способность углерода соединяться с большинством элементов и
образовывать молекулы различного состава и строения обусловливает
многообразие органических соединений. 24 мая 1999 года число известных
химических соединений превышало 19 млн., из них 12 млн были
органическими, ко 2 мая 2014 года общее число известных неорганических и органических соединений превысило 87 млн. Органические соединения играют ключевую роль в существовании живых организмов. Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления:- Выделение индивидуальных веществ из растительного, животного или ископаемого сырья
- Синтез и очистка соединений
- Определение структуры веществ
- Изучение механизмов химических реакций
- Выявление зависимостей между структурой органических веществ и их свойствами
Предмет органической химии
Органическими называют соединения углерода с другими элементами.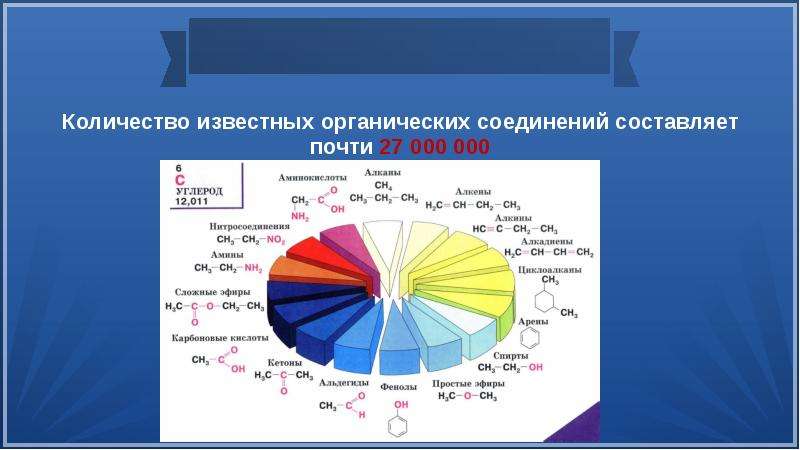 Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений. 24 мая 1999 года число известных химических соединений превышало 19 млн., из них 12 млн были органическими, ко 2 мая 2014 года общее число известных неорганических и органических соединений превысило 87 млн. Органические соединения играют ключевую роль в существовании живых организмов.
Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений. 24 мая 1999 года число известных химических соединений превышало 19 млн., из них 12 млн были органическими, ко 2 мая 2014 года общее число известных неорганических и органических соединений превысило 87 млн. Органические соединения играют ключевую роль в существовании живых организмов.
Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления:
— выделение индивидуальных веществ из растительного, животного или ископаемого сырья;
— синтез и очистка соединений;
— определение структуры веществ;
— изучение механизмов химических реакций;
выявление зависимостей между структурой органических веществ и их свойствами.
Гомологи
Гомологи – это соединения, принадлежащие одному классу органических соединений и отличающиеся друг от друга по составу на несколько групп СН2. Совокупность всех гомологов образует гомологический ряд.
Изомерия органических соединений
Изомеры – это вещества, имеющие одинаковый состав (одинаковую молекулярную формулу), но разное строение молекул. Все изомеры делят на два больших класса – структурные изомеры (изомерия углеродного скелета, изомерия положения функциональной группы или кратной связи, межклассовая изомерия) и пространственные изомеры (цис-транс-изомерия, оптическая изомерия).
Структурными называют изомеры с разным порядком соединения атомов.
Пространственные изомеры отличаются взаимным расположением атомов в пространстве при одинаковом порядке их соединения.
Среди структурных изомеров выделяют три группы:
— соединения, отличающиеся строением углеродных скелетов
CH3-CH(CH3)-CH3
CH3-CH2-CH2-CH3
— соединения, отличающиеся положением заместителя или кратной связи в молекуле
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
— соединения, относящиеся к различным классам органических соединений.
Пространственные изомеры можно разделить на два типа: цис-транс изомеры и оптические изомеры.
Цис-транс изомерия характерна для соединений, содержащих двойную связь или цикл:
Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным изображением. Таким свойством обладают молекулы, имеющие асимметрический центр – атом углерода, связанный с четырьмя различными заместителями.
Классификация органических реакций
Реакции органических веществ классифицируют по типу разрыва связей на:
— радикальные реакции, протекающие с гомолитическим разрывом ковалентной связи
А:В → А. + В.
— ионные реакции, протекающие с гетеролитическим разрывом ковалентной связи
А:В → А:— + В+
По типу реакции:
— присоединение
RCH=CH2 +XY → RCHX + CH2Y
— замещение
RCH2X + Y → RCHY + X
— отщепление (элеменирование)
RCHX-CH2Y → RCH=CH2 + XY
— полимеризация
N(CH
Окисление и восстановление в органической химии связывают с потерей и приобретением водорода и кислорода. Вещество окисляется, если оно теряет атомы Н и приобретает атомы О. Окислитель в общем виде обозначают [O].
Вещество окисляется, если оно теряет атомы Н и приобретает атомы О. Окислитель в общем виде обозначают [O].
Вещество восстанавливается, если оно приобретает атом Н и (или) теряет атомы О. Восстановитель в общем виде обозначается [H].
Примеры решения задач
Предмет органической химии. Органические вещества
1. Предмет органической химии
Органические вещества2. Органическая химия — это
• химия веществ, полученных изорганизмов растений и животных
• химия углеводородов и их производных,
т.е. продуктов, образующихся при замене
водорода другими атомами или группами
атомов
• химия соединений углерода
3. Отличительные особенности органических веществ
Органических веществ известно очень много, бесконечно многоВ их состав входят
углерод и водород
Все они горят, при горении
образуют СО2 и Н2О
Построены более сложно, имеют огромную молекулярную массу,
например белки, жиры, углеводы
Органические вещества можно расположить в ряд сходных по
составу, строению и свойствам – гомологов
Для органических веществ характерной является изомерия, очень
редко встречающаяся среди неорганических веществ.

4. Значение органической химии
Без знаний органической химии невозможно понять, как осуществляетсяфункционирование систем, образующих живой организм,
т.е. сложно понимание биологии и медицины.
С помощью органического синтеза получают разнообразные органические
вещества: искусственные и синтетические волокна, каучуки, пластмассы,
красители, пестициды, синтетические витамины, гормоны, лекарства и.т.д.
Многие современные продукты и материалы, без которых мы не можем
обходиться, являются органическими веществами
Развитие биотехнологии, генной инженерии, создание новых
видов высокопродуктивных организмов было бы невозможно без достижения
органической химии.
5. Органические вещества
Вещества, содержащиеся в организмахживотных и растений
Для их получения необходима особенная
«жизненная сила»
6. Учение о жизненной силе
ВитализмЕго автор — Й.Я. Берцелиус
Он определил органическую химию как химию растительных
или животных веществ, образующихся под влиянием
«жизненной силы»
Крах «витализма»
7.
 Некоторые природные и синтетические вещества Природные вещества
Некоторые природные и синтетические вещества Природные веществаСинтетические
вещества
Белки, углеводы, жиры
Пищевые добавки,
стимуляторы
Витамины
Синтетические витамины
Ферменты
Катализаторы
Гормоны
Гормональные препараты
Лекарства растительного и
природного происхождения
Синтетические
лекарства
8. Гомологи
вещества, сходные по строению ихимическими свойствам
они образуют гомологический ряд, если расположены в порядке
возрастания относительных молекулярных масс
каждый член гомологического ряда отличается
от предыдущего на гомологическую разность — СН2
9. Изомерия
• явление существования разныхвеществ –изомеров с одинаковым
качественным и количественным
составом, т.е. одинаковой молекулярной
формулой, но разным строением.
10. Крах «витализма»
• Ф. Вёлер в 1824 г. осуществил первый синтезорганических веществ — получил щавелевую
кислоту
• в 1828 г.
 Вёлер, нагревая водный раствор
Вёлер, нагревая водный растворцианата аммония, получил мочевину – продут
жизнедеятельности живых организмов
11. Рост числа известных органических соединений
ГОД1880
Число известных органических
соединений
12 000
1910
150 000
1940
500 000
1960
1 000 000
1970
2 000 000
1980
5 500 000
2000
18 000 000
12. Биотехнологии
— технологии получения органическихвеществ не из живых организмов, а
из клеточных культур (например,
получение белков с помощью
дрожжей на основе углеводородного
сырья)
13. Генная инженерия
— синтез важнейших соединенийбелковой природы (например, синтез
инсулина, интерферона)
Основные понятия и законы органической химиии
Трудно представить прогресс в какой бы то ни было области хозяйства без химии – в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией.
Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям).
Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных изучала вещества, входящие в состав животных организмов; растительная – вещества, входящие в состав растений; минеральная – вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция – в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов.
В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину – органическую химию.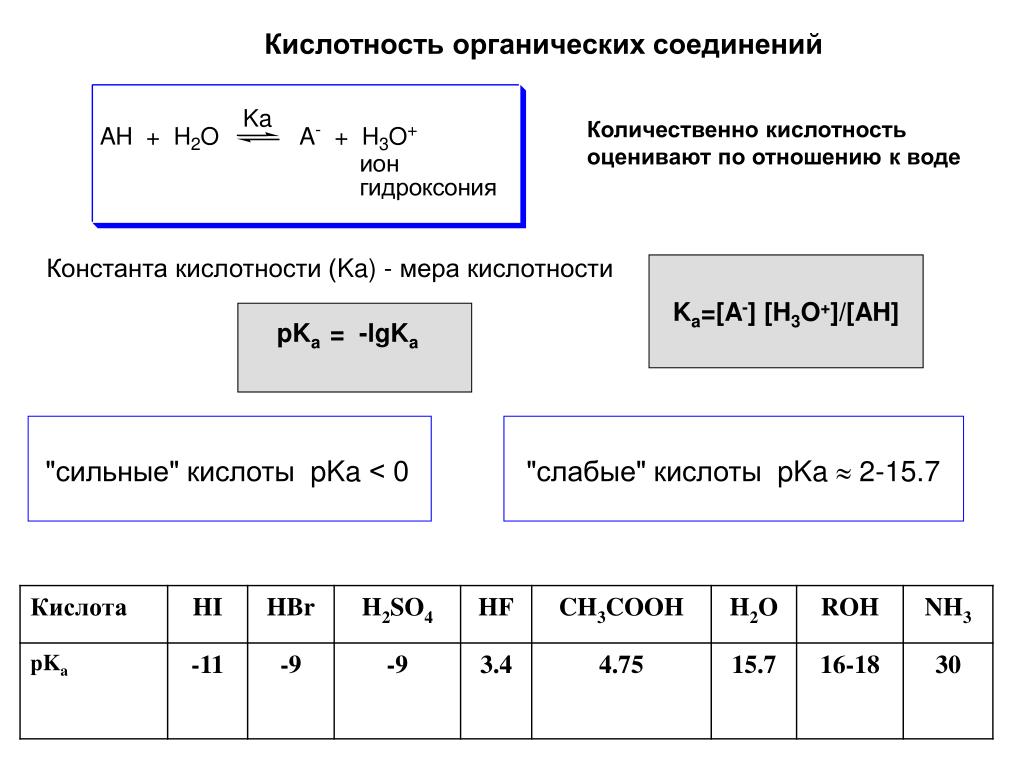
Среди ученых в то время господствовало виталистическое мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной «жизненной силы». Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом.
В 1828 г. немецкий химик Вёлер, работая с циановокислым аммонием, случайно получил мочевину
O
II
Nh3–C–Nh3.
В 1854 г. француз Бертло синтезировал вещества, относящиеся к жирам, а в 1861 г. русский ученый Бутлеров синтезировал вещества, относящиеся к классу сахаров. Это были тяжелые удары по виталистической теории, окончательно разбивающие убеждение о невозможности синтеза органических соединений.
Эти и другие достижения химиков требовали теоретического объяснения и обобщения возможных путей синтеза органических соединений и связи их свойств со строением.
Исторически первой теорией органической химии стала теория радикалов (Ж.Дюма, Ю.Либих, И.Берцелиус). По мнению авторов, многие превращения органических соединений протекают так, что некоторые группы атомов (радикалы), не изменяясь, переходят из одного органического соединения в другое. Однако, вскоре было установлено, что в органических радикалах атомы водорода могут замещаться даже на такие отличные от водорода по химической природе атомы, как атомы хлора, и при этом тип химического соединения сохраняется.
Теорию радикалов сменила более совершенная и охватывающая больший экспериментальный материал теория типов (О.Лоран, Ш.Жерар, Ж.Дюма). Теория типов классифицировала органические вещества по типам превращений. К типу водорода относили углеводороды, к типу хлороводорода – галогенопроизводные, к типу воды – спирты, эфиры, кислоты и их ангидриды, к типу аммиака – амины. Однако накапливающийся огромный экспериментальный материал уже не укладывался в известные типы и, кроме того, теория типов не могла предсказать существование и пути синтеза новых органических соединений. Развитие науки требовало создания новой, более прогрессивной теории, для рождения которой уже существовали некоторые предпосылки: установлена четырехвалентность углерода (А.Кекуле и А.Кольбе, 1857 год), показана способность атома углерода образовывать цепочки атомов (А.Кекуле и А.Купер, 1857 год).
Однако накапливающийся огромный экспериментальный материал уже не укладывался в известные типы и, кроме того, теория типов не могла предсказать существование и пути синтеза новых органических соединений. Развитие науки требовало создания новой, более прогрессивной теории, для рождения которой уже существовали некоторые предпосылки: установлена четырехвалентность углерода (А.Кекуле и А.Кольбе, 1857 год), показана способность атома углерода образовывать цепочки атомов (А.Кекуле и А.Купер, 1857 год).
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе «О химическом строении вещества».
Основные положения теории химического строения А.М.Бутлерова можно свести к следующему.
1. Все атомы в молекуле органического соединения связаны друг с другом в определенной последовательности в соответствии с их валентностью. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3–О–СН3) и этиловый спирт (С2Н5ОН).
Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3–О–СН3) и этиловый спирт (С2Н5ОН).
2. Свойства веществ зависят от их химического строения. Химическое строение – это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга – как соседних, так и через другие атомы. В результате каждое вещество имеет свои особые физические и химические свойства. Например, диметиловый эфир – это газ без запаха, нерастворимый в воде, t°пл. = -138°C, t°кип. = 23,6°C; этиловый спирт – жидкость с запахом, растворимая в воде, t°пл. = -114,5°C, t°кип. = 78,3°C.
Данное положение теории строения органических веществ объяснило явление изомерии, широко распространенное в органической химии. Приведенная пара соединений – диметиловый эфир и этиловый спирт – один из примеров, иллюстрирующих явление изомерии.
3. Изучение свойств веществ позволяет определить их химическое строение, а химическое строение веществ определяет их физические и химические свойства.
4. Атомы углерода способны соединятся между собой, образовывая углеродные цепи различного вида. Они могут быть как открытыми, так и замкнутыми (циклическими), как прямыми, так и разветвленными. В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с одинарными связями) или ненасыщенными (с двойными и тройными связями).
5. Каждое органическое соединение имеет одну определенную формулу строения или структурную формулу, которую строят, основываясь на положении о четырехвалентном углероде и способности его атомов образовывать цепи и циклы. Строение молекулы как реального объекта можно изучить экспериментально химическими и физическими методами.
А.М.Бутлеров не ограничился теоретическими объяснениями своей теории строения органических соединений. Он провел ряд экспериментов, подтвердив предсказания теории получением изобутана, трет. бутилового спирта и т.д. Это дало возможность А.М.Бутлерову заявить в 1864 году, что имеющиеся факты позволяют ручаться за возможность синтетического получения любого органического вещества.
Он провел ряд экспериментов, подтвердив предсказания теории получением изобутана, трет. бутилового спирта и т.д. Это дало возможность А.М.Бутлерову заявить в 1864 году, что имеющиеся факты позволяют ручаться за возможность синтетического получения любого органического вещества.
В дальнейшем развитии и обосновании теории строения органических соединений большую роль сыграли последователи Бутлерова — В.В.Марковников, Е.Е.Вагнер, Н.Д.Зелинский, А.Н.Несмеянов и др.
Современный период развития органической химии в области теории характеризуется все возрастающим проникновением методов квантовой механики в органическую химию. С их помощью решаются вопросы о причинах тех или иных проявлений взаимного влияния атомов в молекулах. В области развития органического синтеза современный период характеризуется значительными успехами в получении многочисленных органических соединений, в число которых входят природные вещества — антибиотики, разнообразные лекарственные соединения, многочисленные высокомолекулярные соединения. Органическая химия глубоко проникла в сферу физиологии. Так, с химической точки зрения изучена гормональная функция организма, механизм передачи нервных импульсов. Ученые вплотную подошли к разрешению вопроса о строении и синтезе белка.
Органическая химия глубоко проникла в сферу физиологии. Так, с химической точки зрения изучена гормональная функция организма, механизм передачи нервных импульсов. Ученые вплотную подошли к разрешению вопроса о строении и синтезе белка.
Органическая химия как самостоятельная наука продолжает существовать и интенсивно развиваться. Это объясняется следующими причинами:
1. Многообразием органических соединений, обусловленным тем, что углерод в отличие от других элементов способен соединяться друг с другом, давая длинные цепочки (изомеры). В настоящее время известно около 6 млн. органических соединений, в то время как неорганических — только около 700 тысяч.
2. Сложностью молекул органических веществ, содержащих до 10 тысяч атомов (например, природные биополимеры — белки, углеводы).
3. Специфичностью свойств органических соединений по сравнению с неорганическими (неустойчивостью при сравнительно невысоких температурах, низкой – до 300°С – температурой плавления, горючестью).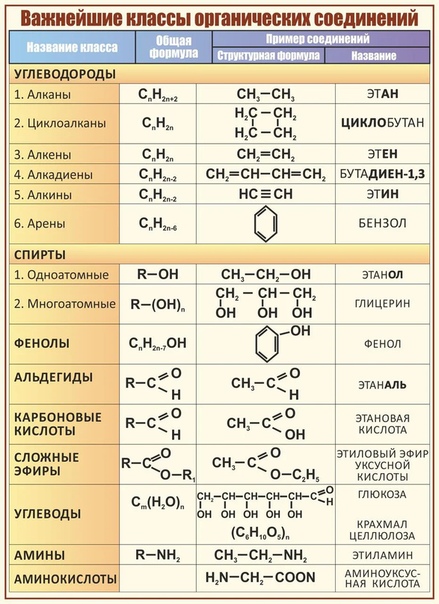
4. Медленно идущими реакциями между органическими веществами по сравнению с реакциями, характерными для неорганических веществ, образованием побочных продуктов, спецификой выделения получающихся веществ и технологическим оборудованием.
5. Огромным практическим значением органических соединений. Они — наша пища и одежда, топливо, разнообразные лекарственные препараты, многочисленные полимерные материалы и т.д.
Классификация органических соединений
Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп.
На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
Органические соединения
¯
¯
Ациклические (алифатические)
(соединения с открытой цепью)
Циклические
(соединения с замкнутой цепью)
¯
¯
¯
¯
Насыщенные (предельные)
Ненасыщенные (непредельные)
Карбоциклические (цикл состоит только из атомов углерода)
Гетероциклические (цикл состоит из атомов углерода и других элементов)
¯
¯
Алициклические (алифатические циклические)
Ароматические
Простейшими представителями ациклических соединений являются алифатические углеводороды — соединения, содержащие только атомы углерода и водорода. Алифатические углеводороды могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Алифатические углеводороды могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Простейшим представителем алициклических углеводородов служит циклопропан, содержащий цикл из трех углеродных атомов.
Ароматический ряд объединяет ароматические углеводороды — бензол, нафталин, антрацен и т.д., а также их производные.
Гетероциклические соединения могут содержать в цикле, кроме атомов углерода, один или несколько атомов других элементов — гетероатомов (кислород, азот, серу и др.).
В каждом представленном ряду органические соединения делятся на классы в зависимости от состава и строения. Наиболее простым классом органических соединений являются углеводороды. При замене атомов водорода в углеводородах на другие атомы или группы атомов (функциональные группы) образуются другие классы органических соединений данного ряда.
Функциональная группа — атом или группа атомов, устанавливающие принадлежность соединения к классам органических соединений и определяющие главнейшие направления его химических превращений.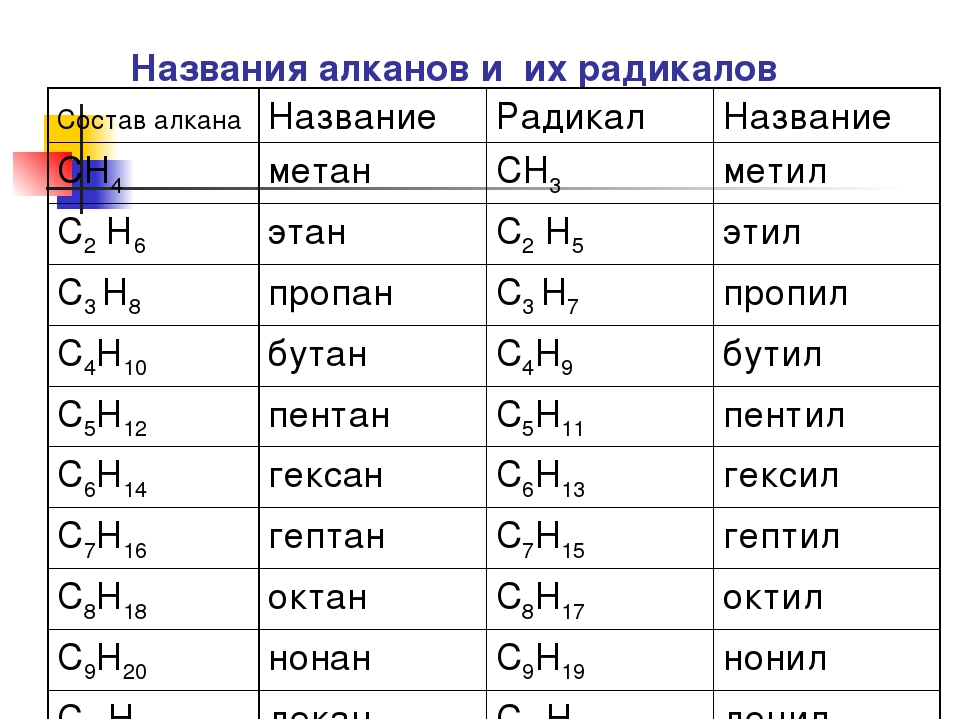
Соединения с одной функциональной группой называются монофункциональными (метанол СН3–ОН), с несколькими одинаковыми функциональными группами — полифункциональными (глицерин
СН2–
I
OH СН–
I
OH СН2),
I
OH
с несколькими разными функциональными группами — гетерофункциональными (молочная кислота
СН3–
СН–СООН).
I
OH
Соединения каждого класса составляют гомологические ряды. Гомологический ряд – это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).
Основные классы органических соединений следующие:
I. Углеводороды (R–H).
II. Галогенопроизводные (R–Hlg).
III. Спирты (R–OH).
O
//
IV. Эфиры простые и сложные (R–O–R’, R–C ).
\
OR’
O
//
V.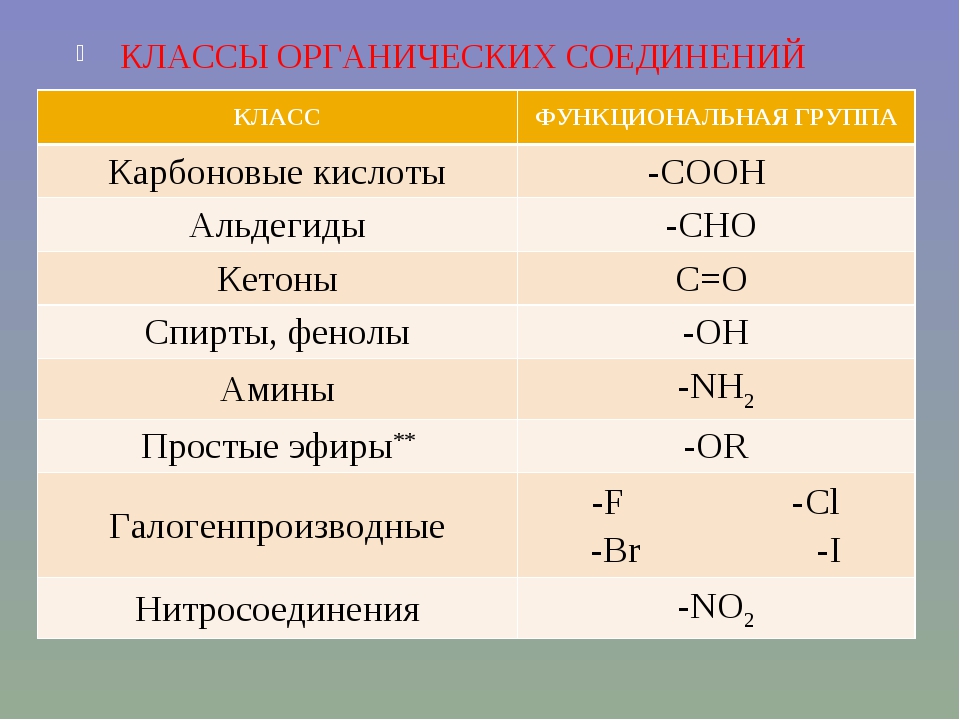 Карбонильные соединения (альдегиды и кетоны) (R–C
Карбонильные соединения (альдегиды и кетоны) (R–C
\
H
O
II
, R–C–R).
O
//
VI. Карбоновые кислоты R–C ).
\
OH
R
I
VII. Амины (R–Nh3, NH, R–N–R’).
I I
R’ R’’
VIII. Нитросоединения (R–NO2).
IX. Сульфокислоты (R–SO3H).
Число известных классов органических соединений не ограничивается перечисленными, оно велико и с развитием науки все время увеличивается.
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращений функциональных групп без изменения углеродного скелета.
Классификация реакций органических соединений по характеру химических превращений
Органические соединения способны к разнообразным химическим превращениям, которые могут проходить как без изменения углеродного скелета, так и с таковым. Большинство реакций проходит без изменения углеродного скелета.
Большинство реакций проходит без изменения углеродного скелета.
I. Реакции без изменения углеродного скелета
К реакциям без изменения углеродного скелета относятся следующие:
1) замещения: RH + Br2 ® RBr + HBr,
2) присоединения: Ch3=Ch3 + Br2 ® Ch3Br – Ch3Br,
3) отщепления (элиминирования): Ch4–Ch3–Cl ® Ch3=Ch3 + HCl,
C2H5ONa
4) изомеризации: Ch4–Ch3–CєСH
––––––®
¬––––––
Ch4–CєС–Ch4
Na
Реакции замещения характерны для всех классов органических соединений. Замещаться могут атомы водорода или атомы любого другого элемента, кроме углерода.
Реакции присоединения характерны для соединений с кратными связями, которые могут быть между атомами углерода, углерода и кислорода, углерода и азота и т. д., а также для соединений, содержащих атомы со свободными электронными парами или вакантными орбиталями.
К реакциям элиминирования способны соединения, содержащие электроотрицательные группировки. Легко отщепляются такие вещества, как вода, галогеноводороды, аммиак.
К реакциям изомеризации без изменения углеродного скелета особенно склонны непредельные соединения и их производные.
II. Реакции с изменением углеродного скелета
К этому типу превращений органических соединений относятся следующие реакции:
1) удлинения цепи,
2) укорачивания цепи,
3) изомеризации цепи,
4) циклизации,
5) раскрытия цикла,
6) сжатия и расширения цикла.
Химические реакции проходят с образованием различных промежуточных продуктов. Путь, по которому осуществляется переход от исходных веществ к конечным продуктам, называется механизмом реакции. В зависимости от механизма реакции они делятся на радикальные и ионные. Ковалентные связи между атомами А и В могут разрываться таким образом, что электронная пара или делится между атомами А и В, или передается одному из атомов. В первом случае частицы А и В, получив по одному электрону, становятся свободными радикалами. Происходит гомолитическое расщепление:
Ковалентные связи между атомами А и В могут разрываться таким образом, что электронная пара или делится между атомами А и В, или передается одному из атомов. В первом случае частицы А и В, получив по одному электрону, становятся свободными радикалами. Происходит гомолитическое расщепление:
А : В ® А• + •В
Во втором случае электронная пара переходит к одной из частиц и образуются два разноименных иона. Поскольку образующиеся ионы имеют различные электронные структуры, этот тип разрыва связи называется гетеролитическим расщеплением:
А : В ® А+ + :В-
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион – так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Изучение условий и методов проведения, а также механизмов реакций органических соединений составляет основное содержание данного курса органической химии.
Вопросы номенклатуры органических соединений, как правило, излагаются во всех учебниках органической химии, поэтому мы сознательно опускаем рассмотрение этого материала, обращая внимание на то, что во всех случаях написания уравнений реакций исходные и образующиеся соединения снабжаются соответствующими названиями. Эти названия со знанием основ номенклатуры позволят каждому самостоятельно решить вопросы, связанные с номенклатурой органических соединений.
Изучение органической химии начинают по обыкновению с алифатического ряда и с наиболее простого класса веществ – углеводородов.
Презентация по химии на тему «Предмет органической химии»
Органическая химия может быть определена как химия углеводородов и их производных. Хотя такое определение весьма четко отражает содержание предмета органической химии, оно не дает возможности провести резкую границу между органическими и неорганическими веществами.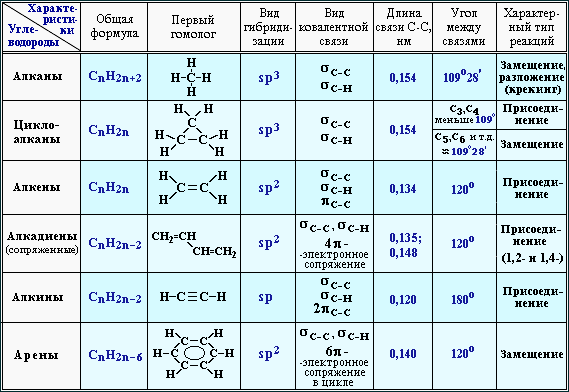 Так как в природе все явления взаимосвязаны, то естественно, что грубое отсечение одной отрасли науки от другой невозможно. Между смежными науками существуют естественные диалектические переходы. Так, на границе между органическими и неорганическими соединениями находятся вещества сода, сероуглерод, мочевина, оксид углерода (IV) и т. д., некоторые из которых можно с равным правом рассматривать в качестве как органических, так и неорганических соединений.
Так как в природе все явления взаимосвязаны, то естественно, что грубое отсечение одной отрасли науки от другой невозможно. Между смежными науками существуют естественные диалектические переходы. Так, на границе между органическими и неорганическими соединениями находятся вещества сода, сероуглерод, мочевина, оксид углерода (IV) и т. д., некоторые из которых можно с равным правом рассматривать в качестве как органических, так и неорганических соединений.
Место органической химии в ряду других наук определяется не только ее генетическими связями с неорганической химией. Изучая и синтезируя сложнейшие органические вещества, играющие важную роль в жизнедеятельности животных и растительных организмов, органическая химия тесно соприкасается и с биологией. В пограничной между этими двумя науками области возникла и успешно развивается молодая наука — биологическая химия. Наконец, вследствие все расширяющегося в настоящее время применения физических методов исследования органических веществ, теснее становится связь органической химии с физикой.
Среди причин выделения органической химии в отдельную науку можно выделить следующие:
Число известных органических соединений (около 16 млн) значительно превышает число соединений всех остальных элементов периодической системы Менделеева. В настоящее время известно около 700 тыс. неорганических соединений, в то же время, примерно 150 тыс. новых органических соединений получают сейчас в один год.
Это объясняется не только тем, что химики особенно интенсивно занимаются синтезом и исследованием органических соединений, но и особой способностью элемента углерода давать соединения, содержащие практически неограниченное число атомов углерода, связанных в цепи и циклы между собой и с атомами других элементов.
Органические вещества имеют исключительное значение вследствие их крайне многообразного практического применения, а особенно потому, что они играют важную роль в процессах жизнедеятельности организмов.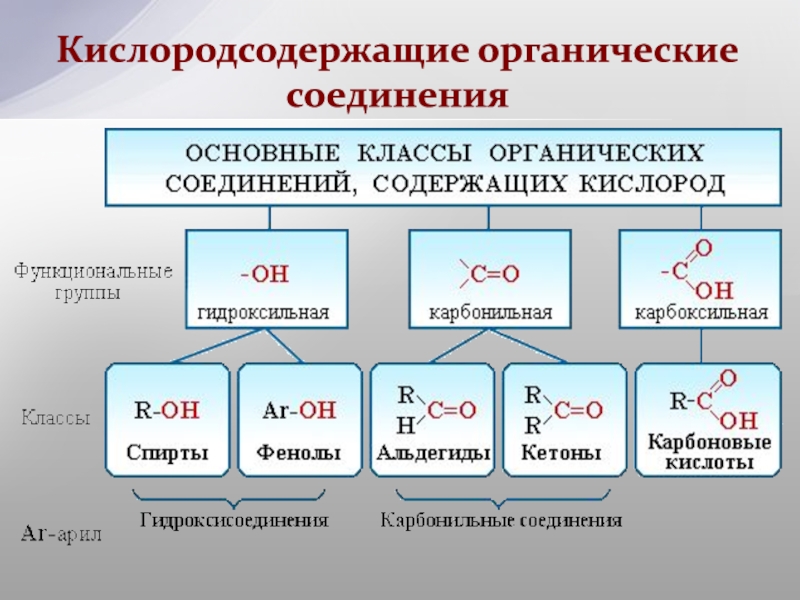
Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических, вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
Проверочная работа. Введение. Предмет органической химии. III вариант
Часть А. Тестовые задания с выбором ответа и на установление соответствия
1 (3 балла). Число известных органических соединений равно:
А. 1 тыс. В. 1 млн.
Б. 100 тыс. Г. 20 млн.
2 (3 балла). Первое органическое вещество, полученное человеком:
А. Белок. В. Жир.
Б. Мочевина. Г. Сахаристое вещество.
3 (3 балла). Отличительный признак органических веществ от неорганических:
А. Хорошая растворимость в воде.
Хорошая растворимость в воде.
Б. Газообразное агрегатное состояние.
В. Обугливание при нагревании.
Г. Вид химической связи между атомами.
4* (3 балла). Численные значения степени окисления и валентности атома углерода не совпадают в веществе, формула которого:
А. СН2О. В. СО2.
Б. СН4. Г. ССI4.
5 (3 балла). Процесс, в результате которого из неорганических веществ получается органическое:
А. Горение. В. Пиролиз (разложение) метана.
Б. Фотосинтез. Г. Окисление глюкозы.
6 (3 балла). Изомером бутана является:
А. Пентан. В. Изобутан.
Б. Пропан. Г. Изопентан.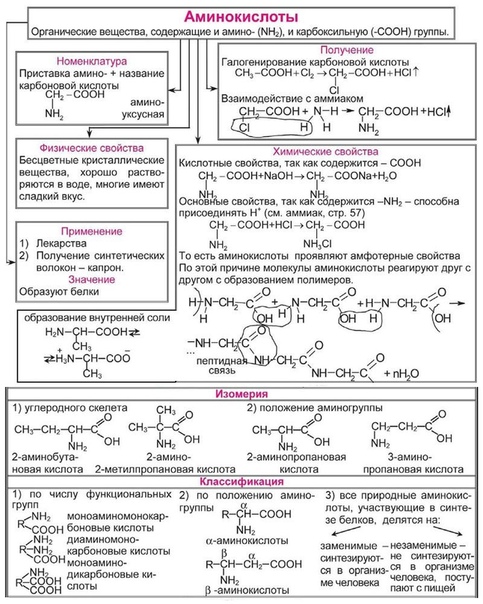
7 (3 балла). Пропан и пентан являются:
А. Изомерами.
Б. Гомологами.
В. Веществами разных классов.
Г. Одним и тем же веществом.
8 (3 балла). Вещество Х в схеме превращений
С2Н5ОН => Х => полиэтилен
является:
А. Этан. В. Этилен.
Б. Диэтиловый эфир. Г. Бутан.
свет
9 (3 балла). Левой части уравнения 6СО2 + 6Н2О => …
соответствует правая часть:
А. 2С3Н6О3.
Б. С6Н12О6 + 6О2.
В. 2С2Н5ОН + 2СО2.
Г. С12Н22О11.
10 (5 баллов). Установите соответствие.
Фамилия ученого:
1. М. Бертло.
2. Ф.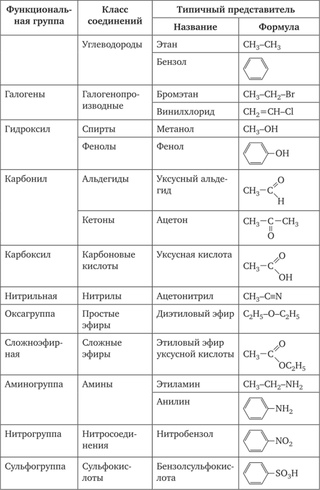 Велер.
Велер.
3. А. Бутлеров.
4. Г. Кольбе
Синтезированное вещество:
А. Сахаристое вещество.
Б. Жир.
В. Мочевина.
Г. Уксусная кислота.
Часть Б. Задания со свободным ответом
11 (2 балла). Дайте определение понятия «гомологический ряд».
12 (8 баллов). Рассчитайте массовые доли элементов в веществе, состав которого выражается формулой СН4О.
13* (8 баллов). Запишите две структурные формулы изомеров состава С6Н14. Дайте названия этих веществ по систематической номенклатуре.
Глава 5 – Введение в органическую химию – Химия
Глава 5 – Введение в органическую химиюЭтот контент также можно загрузить в формате интерактивного PDF. Для интерактивного PDF требуется Adobe Reader для полной функциональности.
Этот текст опубликован в соответствии с лицензией Creative Commons, для ссылки и адаптации, пожалуйста, нажмите здесь.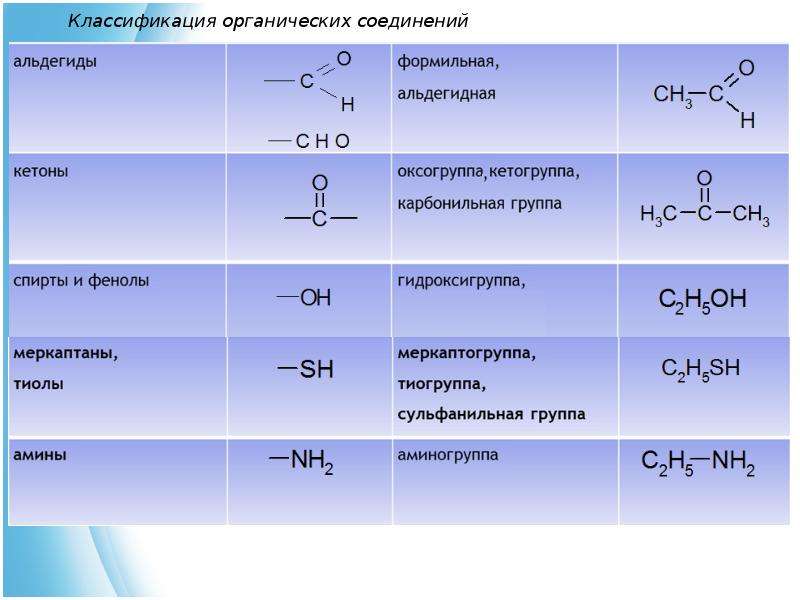
 7 Краткий обзор органической номенклатуры 5.8 Каталожные номера
7 Краткий обзор органической номенклатуры 5.8 Каталожные номера 5.1 Боль, удовольствие и органическая химия
Перец Хабанеро (фото: https://www.flickr.com/photos/jeffreyww/)
Жаркий августовский вечер в парке посреди Северного Гудзона, штат Висконсин, в деревне с населением чуть менее 4000 человек на реке Санта-Крус на западной окраине штата. Линия людей сидит за столами, установленными внутри брезентовой палатки.На глазах у ликующей толпы друзей, семьи и соседей эти смельчаки собираются вступить в бой. . .с фруктовой тарелкой.
К несчастью для участников, речь идет о хабанеро, одном из самых острых сортов перца чили, обычно встречающемся на рынках Северной Америки. В этом конкретном случае команды из пяти человек будут соревноваться, чтобы первыми съесть целый фунт перца. Когда начинается еда, сначала все кажется хорошо. Однако в течение тридцати секунд то, что начинает происходить, совершенно предсказуемо и понятно любому, кто когда-либо по ошибке наливал на обеденную тарелку слишком много острого соуса.
Лица краснеют, начинают течь пот и слезы, проглатывается обильное количество холодной воды.
Хотя технически участники соревнуются друг с другом, настоящим противником в этом состязании — причиной всей боли и страданий — является химическое соединение капсаицин, источник остроты острого перца чили.
Состоящий из четырех элементов: углерода, водорода, кислорода и азота, капсаицин вырабатывается растением перца с целью защиты от голодных млекопитающих.Молекула связывается и активирует рецепторный белок млекопитающих под названием TrpV1, который в нормальных условиях выполняет функцию обнаружения высоких температур и отправки сигнала в мозг — «жарко, держись подальше!» Эта стратегия работает достаточно хорошо на всех видах млекопитающих, кроме Первый: мы, люди (по крайней мере, некоторые из нас), кажется, единственные в своей склонности на самом деле искать жжение острого перца в нашей еде.
Интересно, что у птиц также есть белок теплового рецептора, который очень похож на рецептор TrpV1 у млекопитающих, но птицы совершенно не чувствительны к капсаицину. В этом есть эволюционная логика: перцу выгодно быть съеденным птицей, а не млекопитающим, потому что птица может распространить семена перца на гораздо большую территорию. Область рецептора, отвечающая за чувствительность к капсаицину, оказывается весьма специфичной. В 2002 году ученым удалось вставить небольшой сегмент (чувствительного к капсаицину) гена крысиного рецептора TrpV1 в нечувствительную куриную версию гена, и полученный химерный (смешанного вида) рецептор был чувствителен к капсаицину ( Cell ). 2002 , 108 , 421).
В этом есть эволюционная логика: перцу выгодно быть съеденным птицей, а не млекопитающим, потому что птица может распространить семена перца на гораздо большую территорию. Область рецептора, отвечающая за чувствительность к капсаицину, оказывается весьма специфичной. В 2002 году ученым удалось вставить небольшой сегмент (чувствительного к капсаицину) гена крысиного рецептора TrpV1 в нечувствительную куриную версию гена, и полученный химерный (смешанного вида) рецептор был чувствителен к капсаицину ( Cell ). 2002 , 108 , 421).
Вернувшись на перечный фестиваль North Hudson Pepperfest, те, у кого немного больше здравого смысла, отказываются от болезненных последствий перегрузки капсаицином и вместо этого предаются более приятным химическим явлениям. Маленькая девочка, наслаждающаяся рожком мороженого, отчасти реагирует на химическое действие другого органического соединения, называемого ванилином.
Что такого особенного в капсаицине и ванилине, из-за чего эти два соединения оказывают столь разительно различное воздействие на наше сенсорное восприятие? Оба производятся растениями, и оба состоят из элементов углерода, водорода, кислорода и (в случае капсаицина) азота. С момента зарождения химии как науки химики были очарованы — и на протяжении большей части своей истории — озадачены бесчисленными свойствами соединений, происходящих из живых существ. Термин «органический» от греческого organikos применялся к этим соединениям, и считалось, что они содержат некую «жизненную силу», которая отличает их от «неорганических» соединений, таких как минералы, соли и металлы. , и что позволило им работать на совершенно другом наборе химических принципов.Как иначе, кроме как под действием «жизненной силы», такая небольшая подгруппа элементов могла объединиться в соединения с таким множеством различных свойств?
С момента зарождения химии как науки химики были очарованы — и на протяжении большей части своей истории — озадачены бесчисленными свойствами соединений, происходящих из живых существ. Термин «органический» от греческого organikos применялся к этим соединениям, и считалось, что они содержат некую «жизненную силу», которая отличает их от «неорганических» соединений, таких как минералы, соли и металлы. , и что позволило им работать на совершенно другом наборе химических принципов.Как иначе, кроме как под действием «жизненной силы», такая небольшая подгруппа элементов могла объединиться в соединения с таким множеством различных свойств?
Сегодня, как вы, вероятно, уже знаете, термин «органический» — применительно к химии — относится не только к молекулам живых существ, но и ко всем соединениям, содержащим элемент углерода, независимо от происхождения. Начиная с начала 19 века, когда химики путем тщательных экспериментов узнали о составе и свойствах «органических» соединений, таких как жирные кислоты, уксусная кислота и мочевина, и даже выяснили, как синтезировать некоторые из них, начиная с исключительно «неорганических» компонентов. , они начали понимать, что концепция «жизненной силы» неверна и что свойства как органических, так и неорганических молекул на самом деле можно понять, используя одни и те же фундаментальные химические принципы.
, они начали понимать, что концепция «жизненной силы» неверна и что свойства как органических, так и неорганических молекул на самом деле можно понять, используя одни и те же фундаментальные химические принципы.
Они также начали более полно ценить уникальные свойства элемента углерода, которые делают его столь важным в химии живых существ, в той мере, в какой он оправдывает свое собственное подразделение химии. Углерод образует четыре стабильные связи либо с другими атомами углерода, либо с водородом, кислородом, азотом, серой, фосфором или галогеном. Характерные способы связывания углерода позволяют ему служить скелетом или каркасом для построения больших сложных молекул, включающих цепи, разветвления и кольцевые структуры.
Хотя «органическая химия» больше не означает исключительно изучение соединений живых существ, тем не менее, желание понять и повлиять на химию жизни является движущей силой большей части работы химиков-органиков, независимо от того, является ли их целью изучение чего-то принципиально нового. о реактивности углерод-кислородной связи, открыть новый лабораторный метод, который можно использовать для синтеза лекарства, спасающего жизнь, или лучше понять сложный химический танец, происходящий в активном центре фермента или рецепторного белка.Хотя люди веками ели острый перец и продукты со вкусом ванили, мы только сейчас, в последние несколько десятилетий, начинаем понимать, как и почему один вызывает жгучую боль, а другой — чистое вкусовое удовольствие. Мы понимаем, что точное геометрическое расположение четырех элементов в капсаицине позволяет ему поместиться внутри связывающего кармана теплового рецептора TrpVI, но на сегодняшний день у нас еще нет подробного трехмерного изображения белка TrpVI, связанного с капсаицином.Мы также знаем, что различное расположение атомов углерода, водорода и кислорода в ванилине позволяет ему связываться со специфическими обонятельными рецепторами, но опять же, многое еще предстоит выяснить о том, как именно это происходит.
о реактивности углерод-кислородной связи, открыть новый лабораторный метод, который можно использовать для синтеза лекарства, спасающего жизнь, или лучше понять сложный химический танец, происходящий в активном центре фермента или рецепторного белка.Хотя люди веками ели острый перец и продукты со вкусом ванили, мы только сейчас, в последние несколько десятилетий, начинаем понимать, как и почему один вызывает жгучую боль, а другой — чистое вкусовое удовольствие. Мы понимаем, что точное геометрическое расположение четырех элементов в капсаицине позволяет ему поместиться внутри связывающего кармана теплового рецептора TrpVI, но на сегодняшний день у нас еще нет подробного трехмерного изображения белка TrpVI, связанного с капсаицином.Мы также знаем, что различное расположение атомов углерода, водорода и кислорода в ванилине позволяет ему связываться со специфическими обонятельными рецепторами, но опять же, многое еще предстоит выяснить о том, как именно это происходит.
В этой главе вы познакомитесь с некоторыми из наиболее фундаментальных принципов органической химии. С понятиями, которые мы изучаем, мы можем начать понимать, как углерод и очень небольшое количество других элементов в периодической таблице могут комбинироваться предсказуемым образом, создавая практически безграничный химический репертуар.
С понятиями, которые мы изучаем, мы можем начать понимать, как углерод и очень небольшое количество других элементов в периодической таблице могут комбинироваться предсказуемым образом, создавая практически безграничный химический репертуар.
По мере прочтения вы обнаружите, что глава содержит много обзоров тем, которые вы, вероятно, уже изучили на вводном курсе химии, но, вероятно, также будет несколько новых для вас понятий, а также некоторые темы. которые вам уже знакомы, но рассматриваются более подробно и с большим акцентом на биологически значимых органических соединениях.
Мы начнем с напоминания о том, как химики изображают связи в органических молекулах с помощью условного рисунка «структуры Льюиса», сосредоточив внимание на концепции «формального заряда».Мы рассмотрим общие схемы связывания шести элементов, необходимых для всех форм жизни на Земле: углерода, водорода, азота, кислорода, серы и фосфора, а также галогенов (фтора, хлора, брома и йода). Затем мы продолжим с некоторыми из основных навыков, связанных с рисованием и обсуждением органических молекул: понимание соглашения о рисовании «линейной структуры» и других полезных способов сокращения и упрощения структурных рисунков, изучение функциональных групп и изомеров, а также изучение как систематически называть простые органические молекулы. Наконец, мы объединим все это с обзором структур наиболее важных классов биологических молекул — липидов, углеводов, белков и нуклеиновых кислот, — на которые мы будем постоянно ссылаться на протяжении оставшейся части книги.
Наконец, мы объединим все это с обзором структур наиболее важных классов биологических молекул — липидов, углеводов, белков и нуклеиновых кислот, — на которые мы будем постоянно ссылаться на протяжении оставшейся части книги.
( Наверх )
5.2 Рисование органических молекул
Как видно из приведенных выше молекул капсаицина и ванилина, наиболее распространенными атомами в органических соединениях являются углерод и водород.Другие атомы, которые обычно образуют ковалентные связи в органических структурах, также включают кислород, азот, серу и фосфор. Реже галогены, такие как хлор, бром и йод, также могут быть включены в органические молекулы. Вспомним из главы 4, что правило октета помогло нам определить, что углерод обычно образует четыре ковалентные связи, азот и фосфор образуют по три, кислород и сера образуют по две, а галогены образуют только одну связь. Водород является исключением из правила октета, так как это самый маленький элемент, а его валентная оболочка заполнена двумя электронами.Таким образом, водород может образовывать одну связь с другим атомом. Сера и фосфор также могут иметь образцы связывания, которые являются исключениями из правила октета. Они оба имеют расширенную орбитальную связь с фосфором, который также обычно образует пять ковалентных связей, а сера способна образовывать четыре или шесть ковалентных связей. В таблице 5.1 представлено графическое представление этих шаблонов. Когда вы рисуете органические молекулы, важно обращать внимание на правила связывания, чтобы все атомы достигли предпочтительных состояний связывания.
Водород является исключением из правила октета, так как это самый маленький элемент, а его валентная оболочка заполнена двумя электронами.Таким образом, водород может образовывать одну связь с другим атомом. Сера и фосфор также могут иметь образцы связывания, которые являются исключениями из правила октета. Они оба имеют расширенную орбитальную связь с фосфором, который также обычно образует пять ковалентных связей, а сера способна образовывать четыре или шесть ковалентных связей. В таблице 5.1 представлено графическое представление этих шаблонов. Когда вы рисуете органические молекулы, важно обращать внимание на правила связывания, чтобы все атомы достигли предпочтительных состояний связывания.
Таблица 5.1. Модели ковалентных связей атомов, обычно встречающихся в органических молекулах
*Примечание: водород на самом деле не следует правилу октетов, так как его валентная оболочка заполнена 2 e –
Поиск лучшей структуры Льюиса
По мере того, как мы продвигаемся вперед в изучении органических молекул, мы обнаруживаем, что они становятся намного сложнее, чем простые ионные и ковалентные соединения, обсуждавшиеся в главе 3. Из-за этой сложности органические соединения часто имеют более одного определенного структурного состояния, в котором они могут существовать, и нередко молекула может переходить из одного состояния в другое. Когда электроны в молекуле могут перемещаться из одной области молекулы в другую, создавая эти альтернативные структуры. Это определено как резонанс, и результирующие состояния от этих сдвигов как резонансных структур . Обратите внимание, что резонансные структуры дают химикам более конкретное представление о молекулах.Однако настоящие молекулы не существуют в том или ином структурном состоянии. Вместо этого они существуют в более аморфном переходном состоянии, которое находится где-то посередине между всеми возможными комбинациями. Некоторые формы резонанса могут быть более стабильными, чем другие, и будут оказывать большее влияние на общую структуру молекулы, чем другие формы резонанса. Таким образом, нам нужен способ точно предсказать, какие резонансные структуры могут возникнуть внутри молекулы и какие состояния будут наиболее стабильными.
Из-за этой сложности органические соединения часто имеют более одного определенного структурного состояния, в котором они могут существовать, и нередко молекула может переходить из одного состояния в другое. Когда электроны в молекуле могут перемещаться из одной области молекулы в другую, создавая эти альтернативные структуры. Это определено как резонанс, и результирующие состояния от этих сдвигов как резонансных структур . Обратите внимание, что резонансные структуры дают химикам более конкретное представление о молекулах.Однако настоящие молекулы не существуют в том или ином структурном состоянии. Вместо этого они существуют в более аморфном переходном состоянии, которое находится где-то посередине между всеми возможными комбинациями. Некоторые формы резонанса могут быть более стабильными, чем другие, и будут оказывать большее влияние на общую структуру молекулы, чем другие формы резонанса. Таким образом, нам нужен способ точно предсказать, какие резонансные структуры могут возникнуть внутри молекулы и какие состояния будут наиболее стабильными.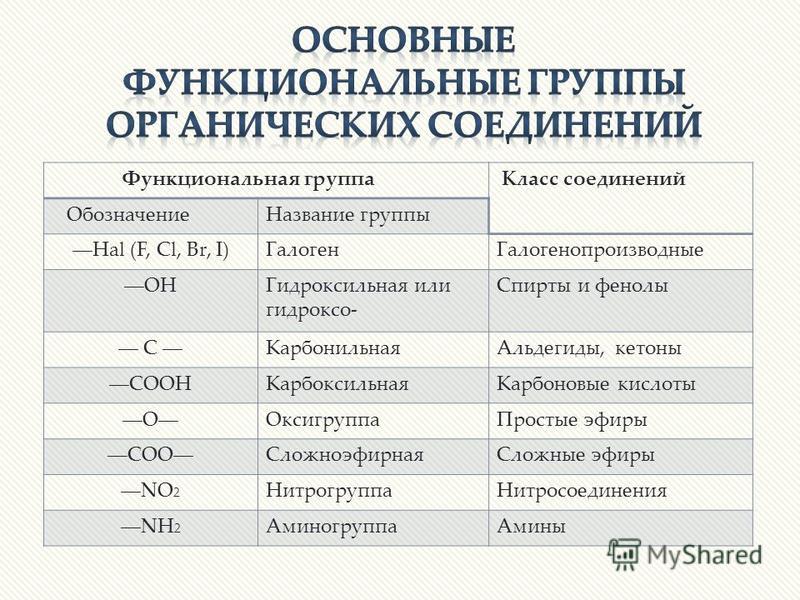 Это можно сделать, используя метод формального начисления рисования структур Льюиса. Формальный заряд атома рассчитывается как количество валентных электронов атома минус количество электронов, которыми атом «владеет». Количество электронов, принадлежащих атому, можно рассчитать, добавив количество неподеленных электронов + половину количества общих электронов. Помните, что 2 e – являются общими для каждой линии, проведенной между двумя атомами (одна линия = 2 e – ).Например, если кислород связан с двумя другими атомами, мы могли бы рассчитать формальный заряд кислорода, вычитая количество электронов, «принадлежащих» кислороду, из числа электронов на его валентной оболочке:
Это можно сделать, используя метод формального начисления рисования структур Льюиса. Формальный заряд атома рассчитывается как количество валентных электронов атома минус количество электронов, которыми атом «владеет». Количество электронов, принадлежащих атому, можно рассчитать, добавив количество неподеленных электронов + половину количества общих электронов. Помните, что 2 e – являются общими для каждой линии, проведенной между двумя атомами (одна линия = 2 e – ).Например, если кислород связан с двумя другими атомами, мы могли бы рассчитать формальный заряд кислорода, вычитая количество электронов, «принадлежащих» кислороду, из числа электронов на его валентной оболочке:
Что, если кислород связан вот так?
Как бы вы рассчитали официальное обвинение?
Это не предпочтительная конфигурация для кислорода, но поскольку кислород настолько электроотрицательен, он может легче нести отрицательный формальный заряд, чем атомы с меньшей электроотрицательностью.
Теперь рассмотрим структуру аниона фосфата (PO 4 3- ). Это самая распространенная форма фосфора, встречающаяся во всех живых организмах на планете, включая человека. Он обычно входит в состав органических молекул, таких как ДНК, белки и АТФ (аденозинтрифосфат), хранилище энергии клетки (рис. 5.1).
Рисунок 5.1 Структуры аденозинтрифосфата (АТФ) и дезоксирибонуклеиновой кислоты (ДНК). Ион фосфата является важным компонентом как (A.) структура АТФ и (Б.) структура ДНК.
Диаграмма модели ДНК предоставлена: Zephyris — собственная работа, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=15027555
Как нам нарисовать структуру Льюиса для иона фосфата?
(1) Определите наименее электроотрицательный(е) элемент(ы) в молекуле. Это будет центральный атом (атомы), вокруг которого связаны другие, более электроотрицательные атомы. (Обратите внимание, что водород никогда не может быть центральным атомом, поскольку он может образовывать только одну ковалентную связь).
Для PO 4 3- перечислите все атомы, в центре которых находится фосфор. Кроме того, перечислите любые дополнительные электроны из-за отрицательного заряда всей молекулы и ваши ожидания относительно связывающей способности каждого атома для достижения октета. Обратите внимание, что у нас есть четыре атома кислорода, которые должны быть связаны с фосфором. Таким образом, мы ожидаем, что P будет находиться в состоянии связи 5 для этой молекулы (т.е. 3 будет недостаточно). Обратите внимание, что неподеленная пара электронов в P расщеплена, и каждый электрон используется для расширенной орбитальной связи с другими атомами.
(2) Подсчитайте общее количество валентных электронов, присутствующих в молекуле. Для этого сложите все валентные электроны для каждого присутствующего атома.
- Если на молекуле нет общего заряда, это число будет представлять общее количество валентных электронов в молекуле.

- Если на молекуле имеется суммарный отрицательный заряд, добавьте дополнительные электроны к числу валентных электронов для всех присутствующих атомов, чтобы вычислить общее число валентных электронов в молекуле.Эта молекула будет существовать в виде аниона.
- Если молекула имеет суммарный положительный заряд, вычтите общий положительный заряд из числа валентных электронов для всех присутствующих атомов, и это будет представлять общее число валентных электронов в молекуле. Эта молекула будет существовать в виде катиона.
(3) Постройте оболочку для связанных атомов с центральным атомом (атомами) и рассчитайте формальный заряд (заряды).
Установите связи между внешними атомами и центральным атомом
Добавьте все оставшиеся электроны, чтобы завершить правило октета/дуэта (или расширенные орбитали, если необходимо) для оставшихся атомов
Если у вас закончились электроны до того, как все атомы заполнили валентные оболочки, начинают образовывать двойные связи там, где это необходимо
Рассчитайте формальный заряд каждого атома в молекуле, а затем используйте сумму для расчета формального заряда всей молекулы.

Посмотрите приведенный выше видеоурок, который поможет вам нарисовать структуру фосфата по Льюису. Вы увидите, что начинать нужно с центрального фосфора. Обратите внимание, что нужно использовать правило расширенной орбиты вместо октета, чтобы иметь возможность связываться со всеми атомами кислорода. Что касается фосфора, мы знаем, что он образует 5 связей в расширенном орбитальном формате (таблица 5.1) и требует в общей сложности 10 электронов вместо обычных 8, которые мы привыкли видеть с помощью правила октетов.Итак, начните с рисования этих 5 связей. Вы заметите, что вам нужно создать одну двойную связь с одним из атомов кислорода, чтобы завершить 5 связей. После этого заполните неподеленную пару электронами для всех атомов, пока не получите в общей сложности 32 электрона. (убедитесь, что каждый кислород достигает состояния октета. Далее рассчитайте формальные заряды на каждом атоме. Как показано выше, кислород, который имеет 2 связанные пары электронов и две заимствованные пары, имеет формальный заряд ноль, в то время как кислород, который имеет одну связанную пару пара электронов и три неподеленные пары имеют формальный заряд 1 90 216 — 90 217 . Если мы вычислим формальный заряд фосфора, мы увидим, что P имеет 5 валентностей e- за вычетом электронов неподеленной пары и половины электронов связанной пары. P не имеет неподеленных пар и имеет 10 электронов связанных пар. Таким образом, половина от 10 = 5, 5 – 5 = 0. Таким образом, P имеет формальный заряд, равный нулю. Поскольку три атома кислорода имеют заряд 1 – , а два других атома равны нулю, общий заряд молекулы равен 3 – . Завершенная структура Льюиса для фосфата должна выглядеть так:
Если мы вычислим формальный заряд фосфора, мы увидим, что P имеет 5 валентностей e- за вычетом электронов неподеленной пары и половины электронов связанной пары. P не имеет неподеленных пар и имеет 10 электронов связанных пар. Таким образом, половина от 10 = 5, 5 – 5 = 0. Таким образом, P имеет формальный заряд, равный нулю. Поскольку три атома кислорода имеют заряд 1 – , а два других атома равны нулю, общий заряд молекулы равен 3 – . Завершенная структура Льюиса для фосфата должна выглядеть так:
(4) При необходимости нарисуйте резонансные структуры.
Для нашей фосфатной (PO 4 3-) структуры выше, если мы рассмотрим каждый из атомов кислорода внутри молекулы, они по своей сути не отличаются друг от друга. Таким образом, каждый кислород, окружающий фосфор, должен иметь равные возможности для образования положения двойной связи. Мы показали, что двойная связь образуется в нижнем положении, но она имеет равновероятную вероятность образования с любым из трех других атомов кислорода. Таким образом, мы можем показать структуру с положением двойной связи во всех других возможных конформациях:
Таким образом, мы можем показать структуру с положением двойной связи во всех других возможных конформациях:
На самом деле ни одна из резонансных структур не представляет собой истинную структуру.Истинная структура находится где-то посередине между всеми возможными резонансными конформациями. Однако рисование резонансных структур дает ученым возможность обсудить истинную конформацию структуры и дает возможность предсказать химическую реактивность молекулы.
(наверх)
5.3 Различные представления органических молекул Молекулярные формулы
Органические молекулы, по сравнению с простыми солями и ковалентными соединениями, показанными в главах 3 и 4, могут быть довольно большими и разветвленными структурами с множеством ответвлений.Таким образом, важно понимать, как рисовать органические молекулы, чтобы понимать трехмерную форму молекулы. Молекулярная формула — это самый простой способ представить соединение, подсчитав все различные типы атомов и перечислив их по порядку. Например, сахар глюкоза содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Тогда молекулярная формула будет записана как C 6 H 12 O 6 . По соглашению углерод указывается первым, водород вторым, за ним следуют кислород, азот, сера, фосфор и, наконец, любые галогены.Однако для органической химии молекулярные формулы не дают много информации. Они просто предоставляют количество атомов каждого типа, присутствующих в молекуле, но ничего не говорят вам о том, как атомы соединяются вместе в пространстве. Таким образом, молекулярные формулы очень редко используются в органической химии, поскольку они не дают полезной информации о связи в молекуле. Одно из немногих мест, где вы можете их встретить, это уравнения горения простых углеводородов, например:
Например, сахар глюкоза содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Тогда молекулярная формула будет записана как C 6 H 12 O 6 . По соглашению углерод указывается первым, водород вторым, за ним следуют кислород, азот, сера, фосфор и, наконец, любые галогены.Однако для органической химии молекулярные формулы не дают много информации. Они просто предоставляют количество атомов каждого типа, присутствующих в молекуле, но ничего не говорят вам о том, как атомы соединяются вместе в пространстве. Таким образом, молекулярные формулы очень редко используются в органической химии, поскольку они не дают полезной информации о связи в молекуле. Одно из немногих мест, где вы можете их встретить, это уравнения горения простых углеводородов, например:
C 5 H 12 +8O 2 →5CO 2 +6H 2 O
В подобных случаях порядок связывания в органической молекуле не важен. Однако для большинства биологически важных реакций форма молекулы обычно имеет решающее значение для функции молекулы, очень похожей на ключ, вставляемый в замок. Таким образом, порядок соединения становится очень важным. Например, C 5 H 12 , показанные в приведенном выше уравнении, могут быть связаны друг с другом более чем одним способом:
Однако для большинства биологически важных реакций форма молекулы обычно имеет решающее значение для функции молекулы, очень похожей на ключ, вставляемый в замок. Таким образом, порядок соединения становится очень важным. Например, C 5 H 12 , показанные в приведенном выше уравнении, могут быть связаны друг с другом более чем одним способом:
Две указанные выше структуры представляют собой допустимые структуры с молекулярной формулой C 5 H 12 .Однако каждая из этих структур представляет собой другую молекулу с немного отличающимися химическими свойствами. Когда соединения имеют одинаковую молекулярную формулу, но имеют разный порядок связывания атомов, они известны как структурные изомеры . (вы также можете увидеть термин конституциональных изомеров ). Перечислили ли мы все возможные структурные изомеры формулы C 5 H 12 ? Нет! Используйте приведенный ниже пример, чтобы увидеть, можете ли вы создать третий структурный изомер.
(наверх)
Структурные формулы и трехмерные модели
Структурная формула показывает, как связаны различные атомы, и может быть более полезной, чем просто написание молекулярной формулы соединения. Существуют различные способы рисования структурных формул, и вам необходимо ознакомиться со всеми из них. Они включают отображаемую формулу, сокращенные формулы и линейные структуры.
Отображаемые формулы Формула , отображаемая , показывает все связи в молекуле в виде отдельных строк, где каждый атом написан в конце каждой строки с использованием аббревиатуры элемента из периодической таблицы.Все структуры C 6 H 12 выше записаны в виде отображаемых формул . Вы должны помнить, что каждая линия представляет собой пару общих электронов. Например, на рисунке 5.2 ниже показана отображаемая формула метана рядом с трехмерными представлениями.
Рис. 5.2: Три разных представления CH 4 Слева — модель мяча и стержня, в центре — отображаемая формула, а справа — заполняющая пространство модель.
Обратите внимание, что отображаемая формула метана не представляет трехмерную форму молекулы, показанную на диаграмме заполнения пространства справа. Метан не плоский с валентными углами 90°. Это несоответствие между тем, что вы рисуете, и тем, как на самом деле выглядит молекула, может привести к проблемам, если вы не будете осторожны. Таким образом, для органической химии важно начать думать о структурах в их трехмерной форме. Чем больше вы практикуетесь, тем больше вы сможете визуализировать и вращать молекулу в своей голове.Например, рассмотрим простую молекулу с молекулярной формулой CH 2 Cl 2 . Вы могли бы подумать, что есть два разных способа расположения этих атомов, если бы вы нарисовали отображаемую формулу.
Но на самом деле эти две структуры совершенно одинаковы.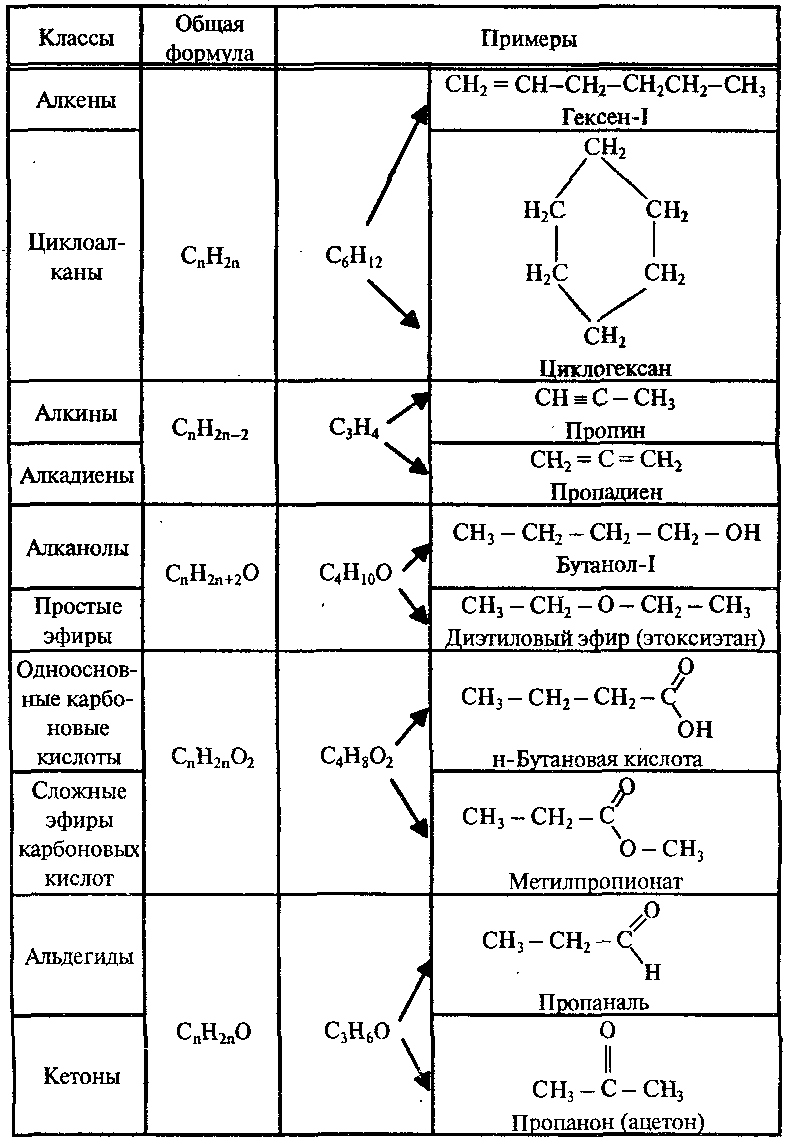 Наше моделирование VSEPR из главы 4 показало, что углерод принимает тетраэдрическое подтверждение, где каждый валентный угол составляет 109 o . Молекула не плоская, в плоскости бумаги.Воспроизведите видео ниже, чтобы увидеть, как они выглядят как вращающиеся модели мяча и клюшки.
Наше моделирование VSEPR из главы 4 показало, что углерод принимает тетраэдрическое подтверждение, где каждый валентный угол составляет 109 o . Молекула не плоская, в плоскости бумаги.Воспроизведите видео ниже, чтобы увидеть, как они выглядят как вращающиеся модели мяча и клюшки.
Одна структура на самом деле является простым вращением другой. Рассмотрим немного более сложную молекулу C 2 H 5 Cl. Отображаемая формула может быть записана в любом из следующих вариантов:
.
Но, опять же, это одно и то же. Посмотрите на модели ниже.
По мере того, как вы продолжаете практиковаться в построении структурных формул, вы научитесь лучше распознавать и различать изомеры, которые действительно отличаются друг от друга, и версии одной и той же молекулы, написанные с разных трехмерных точек зрения.
Концентрированные формулы Для чего-либо, кроме самых простых молекул, рисование полностью отображаемой формулы может быть громоздким и занимать слишком много места, особенно для всех углерод-водородных связей. Вы можете упростить — или сократить — формулу, написав, например, CH 3 или CH 2 вместо того, чтобы показывать все связи C-H. Например, этановая кислота (C 2 H 4 O 2 ) может быть показана в полностью выведенной форме, частично конденсированной форме и полностью конденсированной форме.
Вы можете упростить — или сократить — формулу, написав, например, CH 3 или CH 2 вместо того, чтобы показывать все связи C-H. Например, этановая кислота (C 2 H 4 O 2 ) может быть показана в полностью выведенной форме, частично конденсированной форме и полностью конденсированной форме.
Обратите внимание, что частично конденсированная структура по-прежнему дает очень четкое представление о том, где каждый из атомов связан в пространстве. Однако с полностью уплотненной структурой может быть сложно точно увидеть схемы склеивания. Полностью конденсированная форма содержит больше информации о порядке связывания, чем молекулярная формула, так что атомы, которые непосредственно связаны с соседним атомом, располагаются рядом с этим атомом в конденсированной форме, а не простой подсчет всего атомного вида как в молекулярной формуле.
Работая в обратном направлении, мы можем использовать конденсированную структуру этановой кислоты в качестве примера, чтобы воссоздать частично конденсированную структуру. Глядя на положение первого атома углерода, видно, что с первым атомом углерода связаны три атома водорода и один углерод:
Глядя на положение первого атома углерода, видно, что с первым атомом углерода связаны три атома водорода и один углерод:
Обратите внимание, что это удовлетворяет правилу октета для первого атома углерода (четыре связи с другими атомами). Три атома водорода также заполнены своими одинарными связями с первым углеродом. Второму углероду теперь назначена одна связь с первым углеродом.Нам нужно присвоить оставшиеся три связи.
Из сокращенной формулы видно, что первый кислород присоединен ко второму углероду, однако после этого мы становимся неуверенными в положении второго кислорода.
Мы можем ясно сделать вывод, что последний атом водорода связан со вторым кислородом, поскольку он находится в этом положении. Однако, поскольку кислород может образовывать две связи, мы не можем быть уверены, основываясь только на конденсированной структуре, что второй кислород связан со вторым углеродом или с первым кислородом.
Если вы не уверены, какой атом с каким связан, лучше всего нарисовать потенциальные структуры и оценить их потенциальную правильность.
Из приведенного выше анализа потенциальных структур становится ясно, что ни одна из структур не удовлетворяет правилу октета для одного или нескольких атомов внутри молекулы, как это написано в настоящее время. Однако нижняя структура менее удовлетворительна, чем верхняя структура, поскольку у второго атома углерода отсутствуют 2 ковалентные связи, в то время как все остальные атомы удовлетворяют требованиям октета к связыванию.На верхней диаграмме и у второго атома углерода, и у первого атома кислорода отсутствует одна связь. Эта структура легко удовлетворяет правилу октета, помещая двойную связь между углеродом 2 и кислородом 1 внутри молекулы. Принимая во внимание, что решение проблемы отсутствия двух углеродных связей для второго атома углерода в нижней структуре исправить нелегко. Таким образом, верхняя структура является более вероятной, чем нижняя структура с добавлением двойной связи между углеродом и кислородом.
Хотя сгущенные структуры легче записывать, чем отображаемые или частично сгущенные структуры, они могут оказаться немного более сложными для определения трехмерного рисунка связи атомов.
Линии или скелетные формулы
В строке или формуле скелета все атомы водорода не показаны и все атомы углерода не помечены, а указаны в конце или изгибе в каждой строке, оставляя только углеродный скелет с присоединенными к нему функциональными группами. . Любые гетероатомы (любой другой атом, кроме углерода или водорода) и атомы водорода, присоединенные к гетероатомам, показаны в сжатой форме.Например, отображаемая структура, частично конденсированная структура и линейная формула для 2-бутанола (C 4 H 10 O) выглядят так:
В линейной или скелетной диаграмме могут быть сделаны следующие предположения:
на стыке каждой линии и в конце каждой линии есть атом углерода.
к каждому углероду присоединено столько атомов водорода, что общее число связей на этом углероде равно 4.

все гетероатомы (и атомы водорода, присоединенные к гетероатомам) показаны в сжатом виде на скелетной структуре.
В рамках органической химии и биохимии ученые обычно используют комбинацию этих различных форматов для представления химических структур. Важно ознакомиться с рисованием и интерпретацией всех возможных представлений.
Как рисовать структурные формулы в трехмерном пространствеБывают случаи, когда важно иметь возможность показать точное трехмерное расположение частей некоторых молекул при использовании структурного представления.Для этого облигации показаны условными обозначениями:
.
Например, вы можете захотеть показать трехмерное расположение групп вокруг атома углерода, имеющего группу -ОН в 2-бутаноле.
(наверх)
Чертежи сокращенных органических структур
Часто при рисовании органических структур химики считают удобным использовать букву «R» для обозначения части молекулы за пределами интересующей области. Если мы просто хотим в целом сослаться на функциональную группу, не рисуя конкретную молекулу, например, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Если мы просто хотим в целом сослаться на функциональную группу, не рисуя конкретную молекулу, например, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Группа R — это удобный способ сокращения структур больших биологических молекул, особенно когда нас интересует что-то, что происходит конкретно в одном месте молекулы. Например, в главе 15, когда мы рассматриваем биохимические окислительно-восстановительные реакции с участием молекулы флавина, мы будем сокращать большую часть структуры флавина (т.R = FAD), который вообще не меняется в интересующих реакциях:
В качестве альтернативы мы можем использовать символ «разрыв», чтобы указать, что мы смотрим на небольшой кусочек или секцию более крупной молекулы. Это обычно используется в контексте рисования групп на больших полимерах, таких как белки или ДНК.
Наконец, группы R можно использовать для краткой иллюстрации ряда родственных соединений, таких как семейство антибиотиков на основе пенициллина.
Правильное использование аббревиатур — очень важный навык, который необходимо развивать при изучении органической химии в биологическом контексте, потому что, хотя многие биомолекулы очень большие и сложные (и рисовать их можно целую вечность!), обычно мы сосредотачиваемся только на одной небольшой части молекулы. где происходит изменение.
Как правило, вы никогда не должны сокращать любой атом, участвующий в разрыве или образовании связи.
Например, углерод № 2 в приведенном ниже реагенте/продукте определенно участвует в изменении связи, и поэтому его не следует включать в группу «R».
Если вы не уверены, следует ли рисовать часть структуры или сокращать ее, безопаснее всего будет нарисовать ее.
(наверх)
5.4 Стереоизомеры, энантиомеры и хиральность
Как видно из раздела 5.3, органическая химия включает в себя бесконечно разнообразные структуры, возникающие из-за того, как атомы собраны в 3-мерном пространстве. Предоставления только молекулярной формулы соединения часто недостаточно для определения соединения, поскольку многие молекулярные формулы имеют множество структурных изомеров. Например, молекулярная формула C 2 H 6 O, молекула всего из 9 атомов, может относиться к диметиловому эфиру или этанолу, в зависимости от того, находится ли кислород в середине или на конце углеродной цепи.
Предоставления только молекулярной формулы соединения часто недостаточно для определения соединения, поскольку многие молекулярные формулы имеют множество структурных изомеров. Например, молекулярная формула C 2 H 6 O, молекула всего из 9 атомов, может относиться к диметиловому эфиру или этанолу, в зависимости от того, находится ли кислород в середине или на конце углеродной цепи.
Помните, что структурных изомеров имеют одинаковые атомы, но порядок, в котором атомы связаны друг с другом, различен, что приводит к различным физическим и химическим свойствам. Например, этанол является жидкостью при комнатной температуре, тогда как диэтиловый эфир представляет собой газ.
Если атомы соединения, связанные вместе, имеют один и тот же порядок, но их трехмерное расположение в пространстве различается, они считаются изомером особого типа, называемым стереоизомером . Молекулы сахара глюкоза и галактоза являются стереоизомерами. Они отличаются положением одной группы -ОН, как показано на диаграмме ниже:
Они отличаются положением одной группы -ОН, как показано на диаграмме ниже:
Существует особый вид стереоизомеров, называемых энантиомерами , которые являются зеркальными отражениями друг друга, но не накладываются друг на друга. Это означает, что как бы вы ни поворачивали их в пространстве, вы никогда не сможете поставить их друг на друга и получить одно и то же соединение. Одним из примеров является 2-бутанол , который можно изобразить в виде пары энантиомеров (рис.5.3).
Рисунок 5.3: Энантиомеры 2-бутанола. Энантиомеры показаны в трехмерной структурной формуле на верхней диаграмме и в модели шара и стержня на нижней диаграмме.
(наверх)
Хиральность Говорят, что
энантиомеры обладают свойством c гиральности . Хиральность — это термин, который дается объектам, которые являются зеркальными отражениями, но не накладываются друг на друга. Термин «хиральный» происходит от греческого слова «ручность», т.е. праворукость или леворукость. Ваши руки хиральны: ваша правая рука является зеркальным отражением вашей левой руки, но если вы положите одну руку поверх другой, обеими ладонями вниз, вы увидите, что они не накладываются друг на друга. (рис. 5.4). Таким образом, хиральные объекты являются зеркальными отображениями друг друга, но не могут быть наложены друг на друга. Углерод становится хиральным, когда к нему присоединены четыре различных заместителя. В приведенном выше примере вы заметите, что к центральному углероду присоединены четыре разные группы: группа -OH, группа -H, группа -CH 3 и группа -CH 2 CH 3 .
Термин «хиральный» происходит от греческого слова «ручность», т.е. праворукость или леворукость. Ваши руки хиральны: ваша правая рука является зеркальным отражением вашей левой руки, но если вы положите одну руку поверх другой, обеими ладонями вниз, вы увидите, что они не накладываются друг на друга. (рис. 5.4). Таким образом, хиральные объекты являются зеркальными отображениями друг друга, но не могут быть наложены друг на друга. Углерод становится хиральным, когда к нему присоединены четыре различных заместителя. В приведенном выше примере вы заметите, что к центральному углероду присоединены четыре разные группы: группа -OH, группа -H, группа -CH 3 и группа -CH 2 CH 3 .
Рисунок 5.4: Природа хиральности. Углерод становится хиральным, когда с ним связаны четыре разных заместителя. Как бы вы ни вращали молекулу слева, вы не можете наложить ее на молекулу справа.
Источник: Хиральность руками.jpg: Неизвестная производная работа: — πϵρ ήλιο ℗ — Хиральность руками. jpg
jpg
Стереоизомеры, которые не являются энантиомерами, такие как глюкоза и галактоза, показанные выше, до имеют хиральные центры и не накладываются друг на друга, но они не являются зеркальным отображением друг друга.Только стереоизомеры, которые также являются зеркальными отражениями и не накладываются друг на друга, называются энантиомерами. Энантиомеры очень трудно отделить друг от друга. Они почти идентичны по своим физическим и химическим свойствам. У них одинаковая молекулярная масса, одинаковая полярность, одинаковые температуры плавления и кипения и т. д. На самом деле энантиомеры настолько похожи, что даже имеют одно и то же название! На рис. 5.3 показаны два энантиомера 2-бутанола. Обе молекулы представляют собой 2-бутанол. Но это , а не – точно такая же молекула, точно так же, как ваш левый ботинок не в точности такой же, как ваш правый.Они являются несовместимыми зеркальными отображениями друг друга. Как мы сообщаем об этой разнице?
Одно небольшое различие между энантиомерами заключается в направлении, в котором поляризованный свет будет вращаться, когда попадет на молекулу. Один энантиомер будет вращать свет по часовой стрелке, а другой — против часовой стрелки. Версия по часовой стрелке обозначается буквой «D» для правовращающего (или правостороннего), а версия против часовой стрелки обозначается буквой «L» для левовращающего (или левостороннего).Однако вращение света нельзя использовать для предсказания абсолютной стереоконфигурации молекулы (т. е. вы не можете сказать, какой энантиомер будет вращать свет вправо или влево, пока вы не проведете эксперимент).
Один энантиомер будет вращать свет по часовой стрелке, а другой — против часовой стрелки. Версия по часовой стрелке обозначается буквой «D» для правовращающего (или правостороннего), а версия против часовой стрелки обозначается буквой «L» для левовращающего (или левостороннего).Однако вращение света нельзя использовать для предсказания абсолютной стереоконфигурации молекулы (т. е. вы не можете сказать, какой энантиомер будет вращать свет вправо или влево, пока вы не проведете эксперимент).
Таким образом, для описания абсолютной конфигурации требуется другая система. Система приоритетов Кана-Ингольда-Прелога (CIP) была разработана для определения абсолютной стереоконфигурации энантиомеров как зловещей (S) или прямой (R). В этой системе группам, присоединенным к хиральному углероду, отдается приоритет в зависимости от их атомного номера ( Z ).Атомы с более высоким атомным номером (больше протонов) имеют более высокий приоритет (т. е. S > P > O > N > C > H).
Для определения стереохимии поместите группу с самым низким приоритетом от себя так, чтобы остальные три группы были обращены к вам.
Назначить приоритет остальным группам.
Правила этой системы стереохимической номенклатуры на первый взгляд довольно просты. В качестве первого примера мы будем использовать простой трехуглеродный сахарный глицериновый альдегид.Попробуйте сделать модель стереоизомера глицеральдегида, показанную ниже. Если у вас нет набора для химического моделирования, простой альтернативой являются зубочистки и леденцы. Убедитесь, что вы делаете правильный энантиомер!
Первое, что мы должны сделать, это присвоить приоритет каждому из четырех заместителей, связанных с хиральным углеродом . В этой номенклатурной системе приоритеты основаны на атомном номере, причем более высокие атомные номера имеют более высокий приоритет.Сначала рассмотрим атомы, непосредственно связанные с хиральным углеродом: это Н, О (в гидроксиле), С (в альдегиде) и С (в группе СН 2 ОН).
Два приоритета просты: водород с атомным номером 1 является самым низким (№4) приоритетом, а гидроксильный кислород с атомным номером 8 является приоритетом №1. Углерод имеет атомный номер 6. Какая из двух групп «C» является приоритетной № 2, альдегидная или CH 2 OH? Чтобы определить это, отодвинем от стереоцентра еще одну связь: для альдегида мы имеем двойную связь с кислородом, а на группе СН 2 ОН мы имеем одинарную связь с кислородом.Если атом один и тот же, двойные связи имеют более высокий приоритет, чем одинарные связи. Следовательно, альдегидной группе назначается приоритет №2, а группе CH 2 OH — приоритет №3. Распределив наши приоритеты, мы следим за тем, чтобы приоритетная группа № 4 (водород) была направлена от нас, в плоскость страницы (это уже так).
Углерод имеет атомный номер 6. Какая из двух групп «C» является приоритетной № 2, альдегидная или CH 2 OH? Чтобы определить это, отодвинем от стереоцентра еще одну связь: для альдегида мы имеем двойную связь с кислородом, а на группе СН 2 ОН мы имеем одинарную связь с кислородом.Если атом один и тот же, двойные связи имеют более высокий приоритет, чем одинарные связи. Следовательно, альдегидной группе назначается приоритет №2, а группе CH 2 OH — приоритет №3. Распределив наши приоритеты, мы следим за тем, чтобы приоритетная группа № 4 (водород) была направлена от нас, в плоскость страницы (это уже так).
Затем мы обводим круг, определяемый группами приоритетов №1, №2 и №3, в порядке возрастания. В нашем примере с глицеральдегидом этот круг расположен по часовой стрелке, что говорит нам о том, что этот углерод имеет конфигурацию «R» и что эта молекула представляет собой (R)-глицеральдегид.Для (S)-глицеральдегида круг, описанный приоритетными группами № 1, № 2 и № 3, направлен против часовой стрелки (но сначала мы должны перевернуть молекулу так, чтобы буква Н указывала в плоскость страницы) .
В случае 2-бутанола (рис. 5.5) легко определить первый и четвертый приоритеты. -OH имеет первый приоритет, а -H — четвертый приоритет. Как вы назначаете 2-й и 3-й приоритет, поскольку оба этих атома являются углеродом? Если приоритет для прикрепленного атома одинаков, вам нужно посмотреть на следующий уровень и оценить приоритет там.Для 2-бутанола одна группа представляет собой -CH 3 , а одна группа представляет собой -CH 2 CH 3 . В первой ситуации, если мы посмотрим на следующий уровень, этот углерод связан с тремя другими атомами водорода (все они имеют очень низкий приоритет). Во второй ситуации углерод связан с двумя атомами водорода и одним углеродом. Поскольку C имеет более высокий приоритет, чем H, группа -CH 2 CH 3 будет иметь более высокий приоритет, чем группа -CH 3 . Когда всем группам будет присвоен приоритет, вы сможете определить, в каком направлении он будет двигаться.Если это в направлении по часовой стрелке, молекуле дается обозначение «R». Приоритетное движение против часовой стрелки обозначается буквой «S». В нашем примере 2-бутанол слева показывает приоритет движения против часовой стрелки, что дает S-энантиомер. Молекула справа показывает R-энантиомер с приоритетом движения по часовой стрелке.
Приоритетное движение против часовой стрелки обозначается буквой «S». В нашем примере 2-бутанол слева показывает приоритет движения против часовой стрелки, что дает S-энантиомер. Молекула справа показывает R-энантиомер с приоритетом движения по часовой стрелке.
Рисунок 5.5: Стереохимия 2-бутанола. Систему приоритетов CIP можно использовать для определения абсолютной стереоконформации энантиомеров
(наверх)
Талидомид – история непредвиденных последствий
Интересно, что энантиомеры имеют одинаковые физические свойства и точно такие же химические свойства, , за исключением , когда они реагируют с другими хиральными молекулами.Таким образом, хиральные молекулы имеют потенциально радикальные различия в физиологии и медицине. Например, в 1960-х годах в Западной Европе для облегчения утреннего недомогания у беременных женщин широко прописывался препарат под названием талидомид.
Талидомид ранее использовался в других странах в качестве антидепрессанта и считался безопасным и эффективным. Однако вскоре врачи поняли, что что-то пошло не так: многие дети, рожденные женщинами, принимавшими талидомид во время беременности, страдали тяжелыми врожденными дефектами.
B aby рожден от матери, принимавшей талидомид во время беременности.
Позднее исследователи поняли, что проблема заключалась в том, что талидомид поставлялся в виде смеси двух разных изомерных форм, называемой рацемической смесью .
Один из изомеров является эффективным лекарством, а другой вызывает побочные эффекты. Обе изомерные формы имеют одинаковую молекулярную формулу и одинаковую связь между атомами, поэтому они не являются просто структурными изомерами.Они отличаются расположением в трехмерном пространстве около одного тетраэдрического хирального углерода. Таким образом, эти две формы талидомида представляют собой энантиомеров .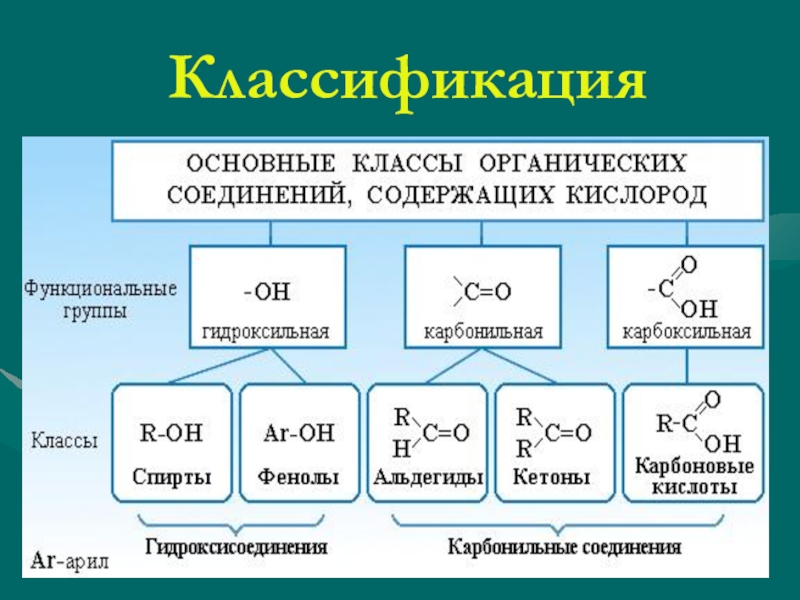
Обратите внимание, что рассматриваемый углерод имеет четыре разных заместителя (два из них просто связаны кольцевой структурой). Тетраэдрические атомы углерода с четырьмя различными группами заместителей называются стереоцентрами .
Глядя на структуры того, что мы называем двумя изомерами талидомида, вы можете быть не совсем уверены, что на самом деле это две разные молекулы.Чтобы убедиться, что они действительно разные, давайте создадим общую картину тетраэдрического углеродного стереоцентра с четырьмя заместителями, обозначенными R 1 -R 4 . Два стереоизомера нашей упрощенной модели выглядят так:
. Если вы внимательно посмотрите на рисунок выше, то заметите, что молекула А и молекула В являются зеркальными отражениями друг друга (линия, обозначенная буквой «σ», представляет собой зеркальную плоскость). Кроме того, они не накладываются друг на друга : если мы возьмем молекулу А, перевернем ее и поместим рядом с молекулой В, мы увидим, что две структуры не могут быть наложены друг на друга. Это две разные молекулы!
Это две разные молекулы!
Если вы сделаете модели двух стереоизомеров талидомида и проделаете то же самое, вы увидите, что они тоже являются зеркальными отображениями и не могут быть наложены друг на друга (это поможет взглянуть на цветную версию рисунка ниже).
Талидомид представляет собой хиральную молекулу .
Вот еще несколько примеров хиральных молекул, которые существуют в виде пар энантиомеров. В каждом из этих примеров имеется единственный стереоцентр, указанный стрелкой.(Многие молекулы имеют более одного стереоцентра, но до этого мы доберемся чуть позже!)
Вот несколько примеров молекул, которые ахиральны (не хиральны). Обратите внимание, что ни у одной из этих молекул нет стереоцентра (атома, связанного с четырьмя разными заместителями).
При оценке молекулы на хиральность важно понимать, что использование штрихового/сплошного клина не обязательно означает, что молекула является хиральной. Хиральные молекулы иногда рисуют без использования клиньев. И наоборот, клинья можно использовать для атомов углерода, не являющихся стереоцентрами — посмотрите, например, на рисунки глицина и цитрата на рисунке выше. Просто потому, что вы видите пунктирные и сплошные клинья в структуре, не следует автоматически предполагать, что вы смотрите на стереоцентр.
Хиральные молекулы иногда рисуют без использования клиньев. И наоборот, клинья можно использовать для атомов углерода, не являющихся стереоцентрами — посмотрите, например, на рисунки глицина и цитрата на рисунке выше. Просто потому, что вы видите пунктирные и сплошные клинья в структуре, не следует автоматически предполагать, что вы смотрите на стереоцентр.
Другие элементы помимо углерода могут быть стереоцентрами. Фосфорный центр иона фосфата и органических эфиров фосфорной кислоты, например, имеет тетраэдрическую форму и, таким образом, потенциально является стереоцентром.
Проблемы с визуализацией хиральности и энантиомеров? Может быть полезно посмотреть это
видеоурок
(наверх)
5.5 Важность хиральности во взаимодействиях белков
Талидомид, который использовался в 1960-х годах для лечения депрессии и утренней тошноты, продавался в виде смеси 50:50 энантиомеров R и S – это называется рацемической смесью . «Волнистая» связь в химической структуре указывает на рацемическую смесь — таким образом, рацемический ( R/S ) талидомид будет выглядеть как:
«Волнистая» связь в химической структуре указывает на рацемическую смесь — таким образом, рацемический ( R/S ) талидомид будет выглядеть как:
Проблема с рацемическим талидомидом, как мы узнали выше, заключается в том, что только энантиомер R является эффективным лекарством, в то время как энантиомер S вызывает мутации у развивающегося плода. Каким образом такая, казалось бы, тривиальная структурная вариация приводит к таким драматическим (и в данном случае трагическим) различиям в биологической активности? Практически все лекарства работают, так или иначе взаимодействуя с важными белками в наших клетках: они могут связываться с белками болевых рецепторов, чтобы, например, блокировать передачу болевых сигналов, или закупоривать активный центр фермента, который участвует в синтезе боли. холестерин.Белки представляют собой хиральные молекулы и очень чувствительны к стереохимии: так же, как правая перчатка не налезет на левую руку, белок, способный прочно связываться с ( R )-талидомидом, может вообще плохо связываться.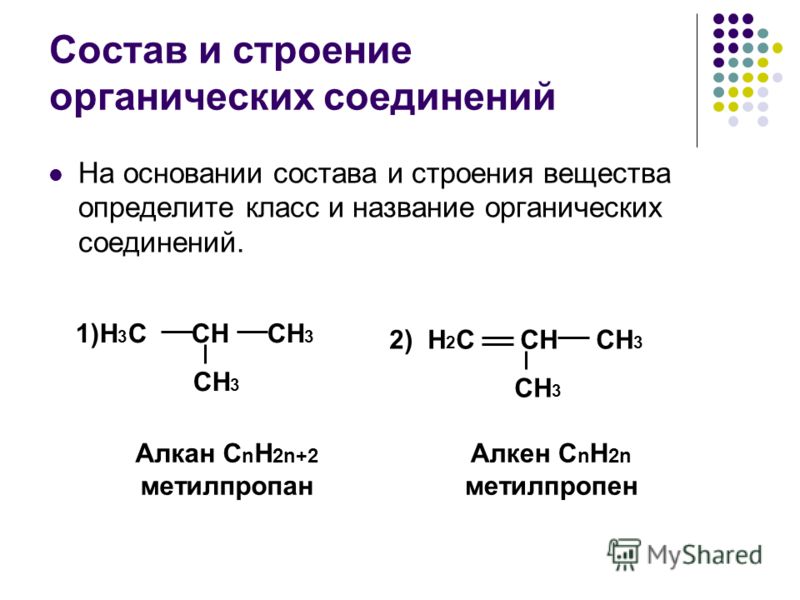 к ( S )-талидомид (это поможет просмотреть цветную версию рисунка ниже).
к ( S )-талидомид (это поможет просмотреть цветную версию рисунка ниже).
Вместо этого кажется, что ( S )-талидомид каким-то образом взаимодействует с белком, участвующим в развитии растущего плода, в конечном итоге вызывая наблюдаемые врожденные дефекты.
Рисунок 5.5. Сайты связывания лекарств на белках стереоспецифичны.
Источник: www.kshitij-iitjee.com/Study/Chemistry/Part2/Chapter3/109.jpg
Болеутоляющее средство ибупрофен, отпускаемое без рецепта, в настоящее время продается в виде рацемической смеси, но эффективен только энантиомер S .
К счастью, энантиомер R не вызывает каких-либо опасных побочных эффектов, хотя его присутствие, по-видимому, увеличивает время, необходимое для того, чтобы ( S )-ибупрофен начал действовать.
С помощью инструктора вы можете лично убедиться в биологической важности стереоизомерии. Карвон представляет собой хиральную молекулу растительного происхождения, которая пахнет мятой колосовой в форме R и тмином (пряностью) в форме S .
Карвон представляет собой хиральную молекулу растительного происхождения, которая пахнет мятой колосовой в форме R и тмином (пряностью) в форме S .
Два энантиомера по-разному взаимодействуют с белками обонятельных рецепторов в вашем носу, генерируя передачу различных химических сигналов в обонятельный центр вашего мозга.
(наверх)
5.6 Распознавание общих органических функциональных групп
Количество известных органических соединений довольно велико. На самом деле органических соединений известно во много раз больше, чем всех других (неорганических) соединений, открытых до сих пор, всего около 7 миллионов органических соединений. К счастью, органические химические вещества состоят из относительно небольшого числа одинаковых частей, объединенных по-разному, что позволяет нам предсказать, как может реагировать соединение, которое мы никогда раньше не видели, путем сравнения того, как другие молекулы, содержащие те же самые типы частей, реагируют.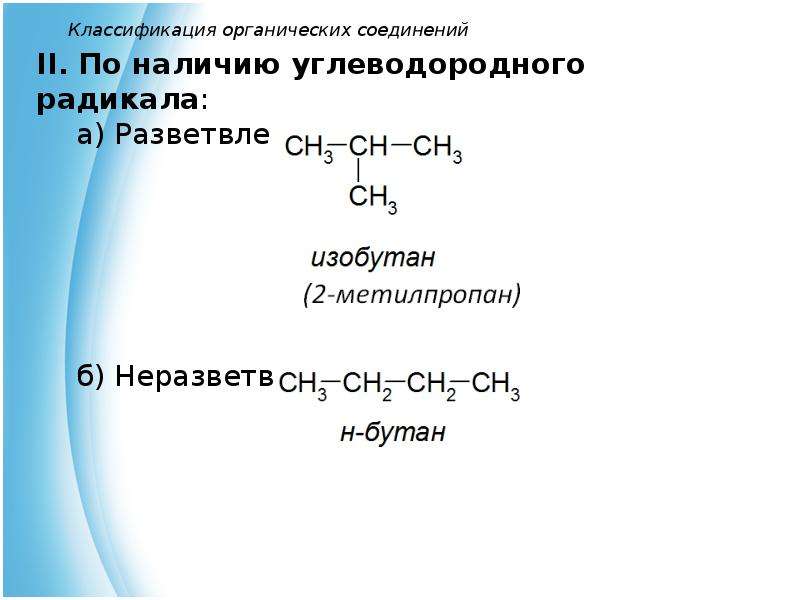
Эти части органических молекул называются функциональными группами и состоят из определенных моделей связи с атомами, наиболее часто встречающимися в органических молекулах (C, H, O, N, S и P). Идентификация функциональных групп и способность прогнозировать реакционную способность на основе свойств функциональных групп является одним из краеугольных камней органической химии.
Функциональные группы представляют собой определенные атомы, ионы или группы атомов, обладающие постоянными свойствами.Функциональная группа составляет часть большей молекулы.
Например, -ОН, гидроксильная группа, характерная для спиртов, представляет собой кислород с присоединенным водородом. Его можно найти на любом количестве различных молекул.
Точно так же, как элементы обладают отличительными свойствами, функциональные группы имеют характерный химический состав. Функциональная группа -ОН на одной молекуле будет иметь тенденцию реагировать аналогично, хотя, возможно, и не идентично, с -ОН на другой молекуле.
Органические реакции обычно происходят в функциональной группе, поэтому изучение реакционной способности функциональных групп подготовит вас к пониманию многих других аспектов органической химии.
Функциональные группы — это структурные единицы в органических соединениях, которые определяются особыми связями между определенными атомами. Структура капсаицина, соединения, обсуждавшегося в начале этой главы, включает в себя несколько функциональных групп, обозначенных на рисунке ниже и поясняемых в этом разделе.
По мере нашего продвижения в изучении органической химии будет чрезвычайно важно уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакцию органических молекул .На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению того, как различные функциональные группы ведут себя в органических реакциях.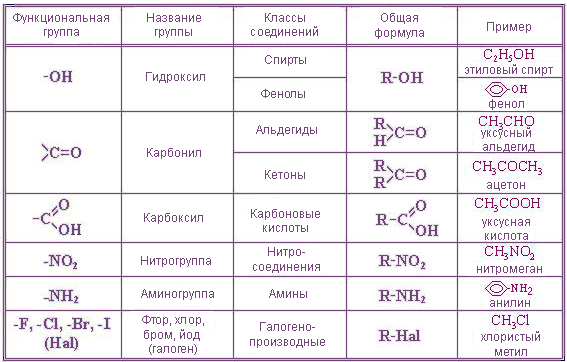 Ниже приводится краткое введение в основные органические функциональные группы.
Ниже приводится краткое введение в основные органические функциональные группы.
(наверх)
Алканы
«По умолчанию» в органической химии (по сути, отсутствие каких-либо функциональных групп) дается термин алкан , характеризующийся одинарными связями между углеродом и углеродом или между углеродом и водородом.Метан, CH 4 , — это природный газ, который вы можете сжигать в своей печи. Октан, C 8 H 18 , является компонентом бензина.
Алкены и алкины
Алкены (иногда называемые олефинами) имеют двойные углерод-углеродные связи, а алкины имеют тройные углерод-углеродные связи. Этен, простейший пример алкена, представляет собой газ, который служит клеточным сигналом во фруктах, чтобы стимулировать созревание. (Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком — яблоко выделяет газ этен (также называемый этиленом), запуская процесс созревания в бананах). Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
(Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком — яблоко выделяет газ этен (также называемый этиленом), запуская процесс созревания в бананах). Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
В главе 6 мы изучим природу связи в алкенах и алкинах и узнаем, что связь в алкенах является тригонально-плоской, а в алкинах — линейной. Кроме того, многие алкены могут принимать две геометрические формы: цис или транс .Формы цис и транс данного алкена представляют собой разные изомеры с разными физическими свойствами, потому что, как мы узнаем в главе 6, существует очень высокий энергетический барьер для вращения вокруг двойной связи. В приведенном ниже примере очевидна разница между цис- и транс--алкенами.
Алканы, алкены и алкины классифицируются как углеводороды , поскольку они состоят исключительно из атомов углерода и водорода. Алканы называются насыщенными углеводородами , потому что углероды связаны с максимально возможным числом атомов водорода — другими словами, они насыщены атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньше атомов водорода, связанных с ними, поэтому они называются ненасыщенными углеводородами . Как мы увидим в следующей главе, водород может присоединяться к двойным и тройным связям в ходе реакции, называемой «гидрированием».
Алканы называются насыщенными углеводородами , потому что углероды связаны с максимально возможным числом атомов водорода — другими словами, они насыщены атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньше атомов водорода, связанных с ними, поэтому они называются ненасыщенными углеводородами . Как мы увидим в следующей главе, водород может присоединяться к двойным и тройным связям в ходе реакции, называемой «гидрированием».
(наверх)
Ароматические соединения
Примерами ароматической группы являются бензол (который раньше был широко используемым растворителем в органической лаборатории, но который оказался канцерогенным) и нафталин, соединение с характерным запахом «нафталина». Ароматические группы представляют собой плоские (плоские) кольцевые структуры и широко распространены в природе.
Когда углерод алкана связан с одним или несколькими атомами галогена, группа обозначается как алкилгалогенид или галогеналкан .Хлороформ — полезный растворитель в лаборатории и один из первых анестетиков, использовавшихся в хирургии. Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогенидные группы довольно редко встречаются в биомолекулах.
Спирты, фенолы и тиолы
В функциональной группе спирта углерод связан одинарной связью с группой ОН (группа ОН, когда она является частью более крупной молекулы, называется гидроксильной группой ).За исключением метанола, все спирты можно разделить на первичные, вторичные и третичные. В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно присоединена к ароматическому кольцу, полученная группа называется фенолом. Сернистый аналог спирта называется тиолом (от греческого thio — сера).
В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно присоединена к ароматическому кольцу, полученная группа называется фенолом. Сернистый аналог спирта называется тиолом (от греческого thio — сера).
Обратите внимание, что определение фенола гласит, что гидроксильный кислород должен быть непосредственно присоединен к одному из атомов углерода ароматического кольца. Таким образом, указанное ниже соединение представляет собой , а не фенол — это первичный спирт.
Различие важно, потому что, как мы увидим позже, существует значительная разница в реакционной способности спиртов и фенолов
(наверх)
Простые эфиры и сульфиды
В функциональной группе простого эфира кислород связан с двумя атомами углерода. Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые стали использовать в качестве анестетика во время операций. Серный аналог эфира называется тиоэфиром или сульфидом .
Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые стали использовать в качестве анестетика во время операций. Серный аналог эфира называется тиоэфиром или сульфидом .
(наверх)
Амины
Амины характеризуются атомами азота с одинарными связями с водородом и углеродом.Так же, как существуют первичные, вторичные и третичные спирты, существуют первичные, вторичные и третичные амины. Аммиак — это особый случай, в котором нет атомов углерода.
Одним из наиболее важных свойств аминов является то, что они являются основными и легко протонируются с образованием катионов аммония. В случае, когда азот имеет четыре связи с углеродом (что несколько необычно для биомолекул), его называют ионом четвертичного аммония.
Примечание. Не смущайтесь тем, как термины «первичный», «вторичный» и «третичный» применяются к спиртам и аминам — это разные определения.В спиртах важно, со сколькими другими атомами углерода связан углерод спирта , а в аминах важно, со сколькими атомами углерода связан азот .
(наверх)
Органические фосфаты
Фосфат и его производные функциональные группы широко распространены в биомолекулах. Фосфат, связанный с одной органической группой, называется фосфатным эфиром ; когда он имеет две связи с органическими группами, он называется фосфатным диэфиром.Связь между двумя фосфатами создает ангидрид фосфата.
Альдегиды и кетоны
Существует ряд функциональных групп, содержащих двойную углерод-кислородную связь, которую обычно называют карбонилом . Кетоны и альдегиды представляют собой две близкородственные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетон атом углерода карбонила связан с двумя другими атомами углерода.В альдегиде , карбонильный углерод связан с одной стороны с водородом, а с другой стороны с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
Кетоны и альдегиды представляют собой две близкородственные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетон атом углерода карбонила связан с двумя другими атомами углерода.В альдегиде , карбонильный углерод связан с одной стороны с водородом, а с другой стороны с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
(наверх)
Карбоновые кислоты и их производные
Когда карбонильный углерод связан с одной стороны с углеродом (или водородом), а с другой стороны с кислородом, азотом или серой, функциональная группа считается одним из «производных карбоновой кислоты», обозначение, которое описывает набор связанных функциональных групп.Основным членом этого семейства является функциональная группа карбоновой кислоты , в которой карбонил связан с гидроксильной группой.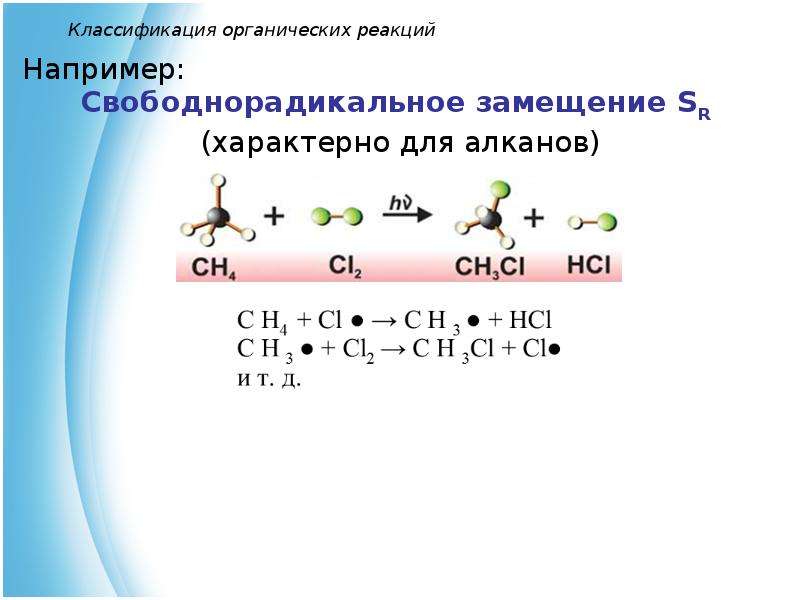 Форма карбоксилат-иона пожертвовала H + раствору. Другими производными являются сложные эфиры карбоновых кислот (обычно называемые просто сложными эфирами), тиоэфиры, амиды, ацилфосфаты, хлорангидриды кислот и ангидриды кислот . За исключением хлорангидридов и ангидридов кислот, производные карбоновых кислот очень распространены в биологических молекулах и/или метаболических путях, и их структура и реакционная способность будут более подробно обсуждаться в следующих главах.
Форма карбоксилат-иона пожертвовала H + раствору. Другими производными являются сложные эфиры карбоновых кислот (обычно называемые просто сложными эфирами), тиоэфиры, амиды, ацилфосфаты, хлорангидриды кислот и ангидриды кислот . За исключением хлорангидридов и ангидридов кислот, производные карбоновых кислот очень распространены в биологических молекулах и/или метаболических путях, и их структура и реакционная способность будут более подробно обсуждаться в следующих главах.
Наконец, нитрил группа характеризуется тройной связью углерод-азот, как показано в структуре ацетонитрила.
Практика распознавания функциональных групп в молекулах Одно соединение часто содержит несколько функциональных групп, особенно в биологической органической химии. Молекулы сахара с шестью атомами углерода, глюкоза и фруктоза, например, содержат альдегидные и кетоновые группы соответственно, и обе содержат пять спиртовых групп. Соединение с несколькими спиртовыми группами часто называют полиолом .
Соединение с несколькими спиртовыми группами часто называют полиолом .
Гормон тестостерон, аминокислота фенилаланин и метаболит гликолиза дигидроксиацетонфосфат содержат несколько функциональных групп, как указано ниже.
Хотя это и не полный список, этот раздел охватывает большинство важных функциональных групп, с которыми мы столкнемся в биохимии.В Таблице 5.2 представлены сводные данные обо всех группах, перечисленных в этом разделе.
Таблица 5.2 Общие органические функциональные группы
Упражнение 5.6.1
Определите функциональные группы (кроме алканов) в следующих органических соединениях. Укажите, являются ли спирты и амины первичными, вторичными или третичными.
Упражнение 5.6.2
Нарисуйте по одному примеру каждого соединения, соответствующего описанию ниже, используя линейные структуры. Обязательно укажите местонахождение всех ненулевых формальных сборов. Все атомы должны иметь полные октеты (фосфор может превышать правило октетов). Для них существует множество возможных правильных ответов, поэтому обязательно уточните свои структуры у своего инструктора или репетитора.
Обязательно укажите местонахождение всех ненулевых формальных сборов. Все атомы должны иметь полные октеты (фосфор может превышать правило октетов). Для них существует множество возможных правильных ответов, поэтому обязательно уточните свои структуры у своего инструктора или репетитора.
а) соединение с молекулярной формулой C 6 H 11 NO, которое включает функциональные группы алкена, вторичного амина и первичного спирта
b) ион с молекулярной формулой C 3 H 5 O 6 P 2-, который включает альдегидные, вторичные спиртовые и фосфатные функциональные группы.
c) Соединение с молекулярной формулой C 6 H 9 NO, имеющее амидную функциональную группу и не имеющее , а не алкеновую группу.
(наверх)
5.7 Краткий обзор органической номенклатуры
Международный союз теоретической и прикладной химии (IUPAC, обычно произносится как глаз -you-pack ) разработал систему для обозначения органических соединений. Хотя система ИЮПАК удобна для обозначения относительно небольших простых органических соединений, она обычно не используется для обозначения биомолекул, которые имеют тенденцию быть довольно большими и сложными. Однако неплохо (даже для биологов) ознакомиться с базовой структурой системы IUPAC и уметь рисовать простые структуры на основе их названий IUPAC.
Хотя система ИЮПАК удобна для обозначения относительно небольших простых органических соединений, она обычно не используется для обозначения биомолекул, которые имеют тенденцию быть довольно большими и сложными. Однако неплохо (даже для биологов) ознакомиться с базовой структурой системы IUPAC и уметь рисовать простые структуры на основе их названий IUPAC.
Название органического соединения обычно начинается с определения того, что называется «родительской цепью» , которая представляет собой самую длинную прямую цепь атомов углерода.Мы начнем с простейших структур алканов с прямой цепью. CH 4 называется метан , а C 2 H 6 этан . В приведенной ниже таблице продолжаются названия более длинных алканов с прямой цепью: обязательно запомните их, поскольку они являются основой для остальной части номенклатурной системы ИЮПАК (а также широко используются для обозначения биомолекул).
Наименования алканов с прямой цепью:1 углерод: метан
2 атома углерода: этан
3 атома углерода: пропан
4 атома углерода: бутан
5 атомов углерода: пентан
6 атомов углерода: гексан
7 атомов углерода: гептан
8 атомов углерода: октан
9 атомов углерода: нонан
10 атомов углерода: декан
Заместители, ответвляющиеся от основной исходной цепи, расположены по числу атомов углерода, при этом используются наименьшие возможные числа (например, обратите внимание ниже, что соединение слева называется 1-хлорбутан, а не 4-хлорбутан). Когда заместителями являются малые алкильные группы, используются термины метил , этил и пропил .
Когда заместителями являются малые алкильные группы, используются термины метил , этил и пропил .
Другие распространенные названия углеводородных заместителей включают изопропил, трет--бутил и фенил .
Обратите внимание, что в приведенном ниже примере «этильная группа» (синяя) не рассматривается как заместитель, а включается как часть исходной цепи, а метильная группа рассматривается как заместитель.Название ИЮПАК для углеводородов с прямой цепью всегда основано на максимально возможной исходной цепи , которая в данном случае состоит из четырех атомов углерода, а не из трех.
Циклические алканы называются циклопропан, циклобутан, циклопентан, циклогексан и т. д.:
В случае нескольких заместителей используются префиксы di , tri и tetra .
Функциональные группы имеют характерные суффиксы.Спирты, например, имеют « ол », добавленное к названию исходной цепи вместе с номером, обозначающим расположение гидроксильной группы. Кетоны обозначаются как « один ».
Алкены обозначаются окончанием «ен» и, при необходимости, указываются расположение и геометрия двойной связи. Соединения с несколькими двойными связями называются диенами, триенами и т. д.
Некоторые группы могут присутствовать только на концевом атоме углерода, поэтому порядковый номер не требуется: альдегиды оканчиваются на «al», карбоновые кислоты — на «ойовую кислоту», а карбоксилаты — на «оат».
Эфиры и сульфиды обозначаются двумя группами по обе стороны от кислорода или серы.
Если амид имеет незамещенную группу –NH 2 , суффикс будет просто «амид».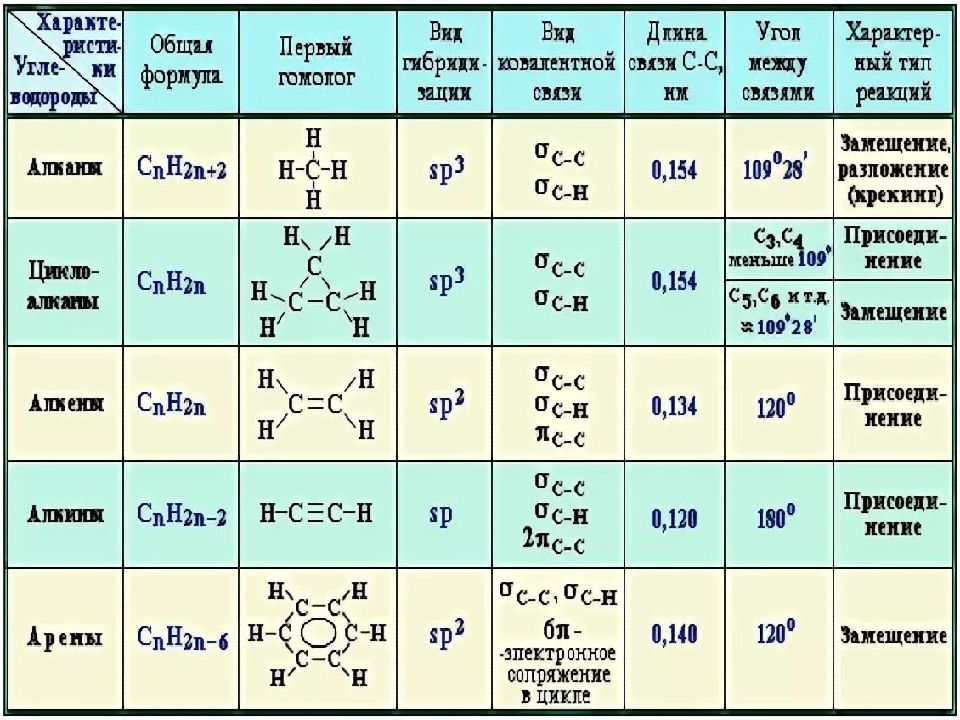 В случае замещенного амида группа, присоединенная к азоту амида, называется первой вместе с буквой « N », чтобы уточнить, где находится эта группа. Обратите внимание, что приведенные ниже структуры основаны на трехуглеродной (пропановой) исходной цепи.
В случае замещенного амида группа, присоединенная к азоту амида, называется первой вместе с буквой « N », чтобы уточнить, где находится эта группа. Обратите внимание, что приведенные ниже структуры основаны на трехуглеродной (пропановой) исходной цепи.
Для сложных эфиров используется суффикс «оат». Группа, присоединенная к кислороду, названа первой.
Все примеры, которые мы видели до сих пор, были простыми в том смысле, что в каждой молекуле присутствовала только одна функциональная группа. Конечно, в системе ИЮПАК гораздо больше правил, и, как вы можете себе представить, именование ИЮПАК больших молекул с несколькими функциональными группами, кольцевыми структурами и заместителями может очень быстро стать очень громоздким.Незаконный наркотик кокаин, например, имеет название IUPAC «метил (1 R , 2 R , 3 S , 5 S )-3-(бензоилокси)-8-метил-8-азабицикло[ 3.2. 1] октан-2-карбоксилат (это название включает обозначения для стереохимии).
1] октан-2-карбоксилат (это название включает обозначения для стереохимии).
Вы можете понять, почему система ИЮПАК мало используется в биохимии — молекулы слишком большие и сложные. Еще одна сложность заключается в том, что даже вне биологического контекста многие простые органические молекулы почти повсеместно известны под их «общим названием», а не под названием ИЮПАК.Соединения уксусная кислота, хлороформ и ацетон являются лишь несколькими примерами.
В биохимии обычно используются несистематические названия (такие как «кокаин», «капсаицин», «пируват» или «аскорбиновая кислота»), и когда используется систематическая номенклатура, она часто специфична для класса рассматриваемой молекулы: разные системы имеют эволюционировали, например, для жиров и для углеводов. В этом тексте мы не будем слишком подробно сосредотачиваться на номенклатуре ИЮПАК или какой-либо другой системе номенклатуры, но если вы предпримете более углубленное изучение органической или биологической химии, от вас могут ожидать более подробного изучения одной или нескольких систем наименования.
Каталожные номера:
Материалы главы 5 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1. Викиучебники. (2015) Органическая химия. Доступно по ссылке: https://en.wikibooks.org/wiki/Organic_Chemistry.
2. Кларк Дж. (2014) Как рисовать органические молекулы. Доступно по адресу: http://chem.libretexts.org/Core/Organic_Chemistry/Fundamentals/How_to_Draw_Organic_Molecules
.3.Содерберг, Т.
(2016).
Органическая химия с биологическим акцентом. Опубликовано Creative Commons by-nc-sa 3.0.
4. Анонимно. (2012) Введение в химию: общая, органическая и биологическая (V1.0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
.
Перечень важных органических соединений
Органическое соединение | Использование органических соединений |
Метан | Черный цвет, используемый в производстве автомобильных шин и типографских красок, производстве света и энергии, производстве метилового спирта, формальдегида, хлороформа и т. |
Бутан | В жидком состоянии используется в качестве сжиженного нефтяного газа. |
Этилен | Применяется при созревании и консервации плодов, горчичном газе, а также в виде анестезии, в кислородно-этиленовом пламени. |
Ацетилен | При производстве легкого оксиэтиленового пламени, в виде анестезии Марселин, при производстве неопрена (искусственного каучука), при искусственном созревании и т. д. |
Полиэтилен | Применяется для получения электрического сопротивления в проводах и кабелях, для создания слоев в крышке бутылки при производстве небьющихся бутылок, труб, ведер и т. д. |
Полистирол | Применяется для изготовления крышек бутылок с кислотой, при изготовлении корпусов аккумуляторных батарей и др. |
Этилбром | Для местной анестезии. |
Хлороформ | При хирургических операциях в качестве анестезии, в виде растворителя каучука, жира, лака и т. д., в качестве инсектицида и т. д. |
Спирт метиловый | При производстве метилового спирта, искусственных красителей, лаков и полиролей, смешивании с бензином и использовании в качестве топлива для двигателей и т. д. |
Небосвод | При изготовлении лекарств от горла при изготовлении жевательных таблеток. |
Спирт этиловый | Применяется для изготовления вин и других ликеро-водочных изделий, настоек, лаков и полиролей, в виде растворителей, в денатурате, в искусственных красителях, в парфюмерных и фруктовых ароматизаторах, в прозрачных мылах, в спиртовках и печках, в виде автомобильного топлива при очистке ран, в виде инсектицида и т. |
Глицерин | Применяется для изготовления нитроглицерина, при очистке деталей часов, в чернилах для печати, в средствах для чистки обуви и в косметике, в прозрачном мыле, в обезболивающих препаратах любых сломанных частей органов тела, в сладостях, вине консервация фруктов и т.д. |
Формальдегид | При изготовлении инсектицидов, при фиксации желатиновой пленки на фотопластинках, при изготовлении водонепроницаемых салфеток путем смешивания ее с внешней белой частью яиц и т. д. |
Ацетальдегид | В производстве цветных лекарств, в производстве мета-ацетальдегида, используемого для сна, в производстве пластмасс. |
Ацетон | При производстве лака, кордита, клодиевой целлюлозы, искусственного шелка, синтетического каучука, сульфона, хлортона, хлороформа, йодоформа и т. |
Муравьиная кислота | В производстве инсектицидов, консервации фруктовых соков, в торговле кожей, каучуком и т. д. |
Уксусная кислота | В качестве лабораторного реактива, в виде уксуса, при приготовлении соусов, желе и т. д. |
Ацетилхлорид | При производстве ацетамида, уксусного ангидрида и т. д. |
Ангидрид уксусной кислоты | В цветной промышленности, при производстве лекарств, таких как аспирин, при изготовлении искусственного или синтетического шелка из целлюлозы и т. д. |
Ацетамид | При смягчении кожи, ткани и при распылении целлюлозы и бумаги. |
Этилацетат | При изготовлении лекарств, искусственных духов и т. д. |
Мочевина | В виде удобрений, при производстве формальдегидных и карбамидных пластмасс, лекарств и т. д. |
Щавелевая кислота | При окрашивании и печати тканей, при подкрашивании чернил и каменноугольной смолы, при отбеливании кожи, при очистке пятен от чернил 10%-ным раствором и т. д. |
Глюкоза | При изготовлении различных видов вина, сладостей и консервации фруктовых соков, лекарственных средств, таких как глюконат и т. д. |
Бензол | В виде растворителя, в химической чистке, путем смешивания с бензином и в качестве топлива для двигателей и т. |
Толуол | В химической чистке, в виде растворителя, в производстве лекарств, при изготовлении взрывчатых веществ и т. д. |
Хлорбензол | При производстве анилина, фенола и т. д. |
Нитробензол | При производстве мыла в виде мирбанового масла, при изготовлении полиролей и т. д. |
Анилин | В торговле красителями, производстве лекарств и т. д. |
Фенол | При производстве карболового мыла, в виде инсектицида, бакелита, предестина, аспирина, целолала и т.д. |
Бензальдегид | В производстве красок, парфюмерии и т. |
Бензойная кислота | При изготовлении лекарств, консервации фруктовых соков и т. д. |
Бензолсульфоновая кислота | При производстве сахарина, при производстве растворенных красителей, при изготовлении сульфаниламидных препаратов и т. д. |
Эфир | В качестве анестезирующего средства, растворителя, охлаждающей жидкости, при производстве спирта и т. д. |
Четыреххлористый углерод | В виде огнетушителя. |
Уротропин | При лечении урологических заболеваний. |
Гаммексен | В форме гермицида/инсектицида |
Органическое соединение – определение и примеры
Определение
сущ.
множественное число: органические соединения Водород (CH) (например, в углеводородах)
Детали
Обзор
Химическое соединение относится к любому веществу, состоящему из двух или более элементов, которые химически связаны друг с другом.Элемент, в свою очередь, относится к тому, что состоит только из атомов одного типа. Элементы, которые удерживаются вместе химической связью, образуют соединение . Одним из способов классификации соединений является их идентификация как органических или неорганических . В общем, органическое соединение представляет собой тип соединения, которое содержит атом углерода. И наоборот, неорганическим соединением будет соединение, не содержащее углерода.
Витализм
На протяжении многих веков многие люди верили в витализм , преобладающее представление о том, что живые существа имеют жизненную силу или жизненную силу – vis-vitalis – что отличает их от неживых вещи. Эта сила якобы позволяла живым существам производить определенные химические вещества. В противном случае эти химические вещества не образовались бы. Согласно витализму, только живые организмы — поскольку они обладают жизненной силой — будут единственными, кто способен производить такие соединения. Даже Луи Пастер 1822–1895, который помог положить конец теории спонтанного зарождения своими экспериментами по брожению и чья работа привела к началу пастеризации, считал, что брожение является жизненно важным действием, на которое способна только жизнь. 1 Виталисты (сторонники витализма) называли такие соединения органическими , а те, которые можно было получить химическими манипуляциями, называли неорганическими .
Эта сила якобы позволяла живым существам производить определенные химические вещества. В противном случае эти химические вещества не образовались бы. Согласно витализму, только живые организмы — поскольку они обладают жизненной силой — будут единственными, кто способен производить такие соединения. Даже Луи Пастер 1822–1895, который помог положить конец теории спонтанного зарождения своими экспериментами по брожению и чья работа привела к началу пастеризации, считал, что брожение является жизненно важным действием, на которое способна только жизнь. 1 Виталисты (сторонники витализма) называли такие соединения органическими , а те, которые можно было получить химическими манипуляциями, называли неорганическими .
Витализм в конце концов потерял свою поддержку, когда современные эксперименты поставили под сомнение его достоверность. Одним из них был Friedrich Wöhler 1800 – 1882, который в 1828 году обнаружил, что мочевина может быть получена химическим путем из неорганических солей цианата калия и сульфата аммония. Виталисты считали, что мочевина представляет собой органических соединений, находящихся в моче и вырабатываемых только живыми организмами.
Виталисты считали, что мочевина представляет собой органических соединений, находящихся в моче и вырабатываемых только живыми организмами.
Неясности
Современное определение органических соединений больше не основывается на их источнике. Скорее, органическое соединение — это соединение, в котором соединение содержит атомы углерода, связанные с другими атомами посредством ковалентной связи. Однако химики не могут прийти к единому мнению относительно абсолютного определения органического соединения. Определение органического соединения как любого соединения, содержащего атом углерода, будет включать соединения, которые классифицируются как неорганические .
Углеродосодержащие соединения, считающиеся неорганическими, следующие: карбонаты, цианиды, цианаты, карбиды, тиоцианаты, окись углерода и двуокись углерода. Аллотропы углерода (например, алмаз, графит, уголь) также являются исключением. Они состоят только из одного типа элемента, которым является углерод, и, следовательно, не могут быть классифицированы как органические соединения, поскольку они, во-первых, не соединение, а чистый элемент.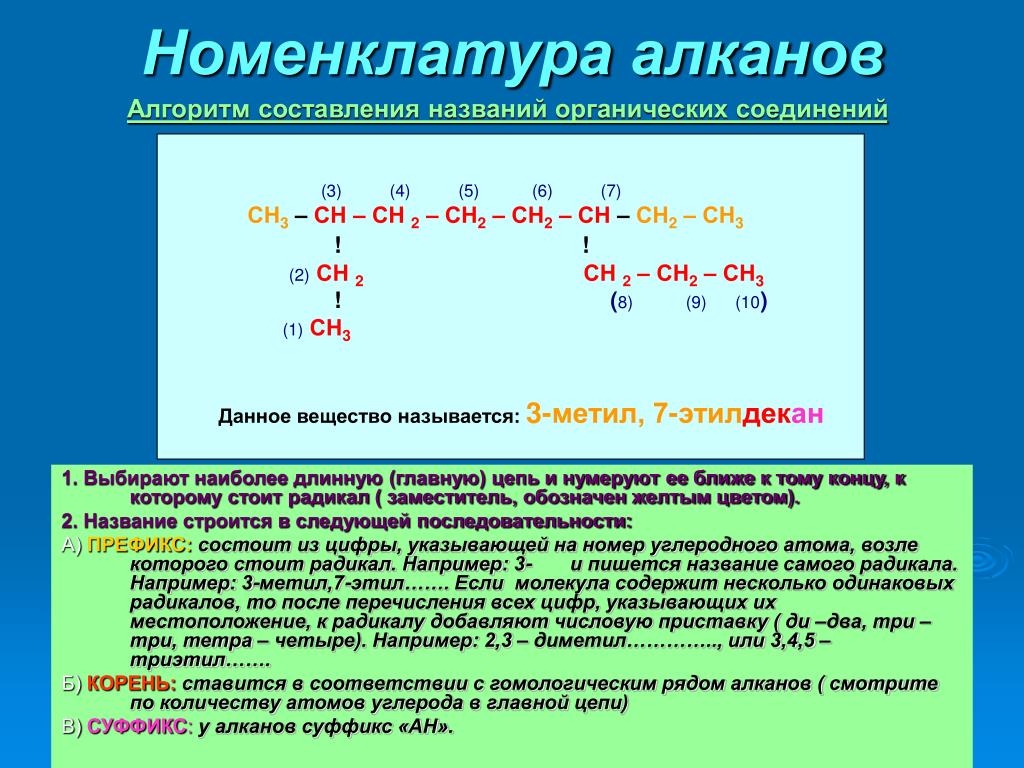
Органические вещества
По сравнению с другими компонентами, составляющими земную кору, органические соединения составляют небольшой ее процент. Тем не менее, они имеют жизненно важное значение, потому что все живые существа основаны на этих соединениях.Примерами органических соединений являются углеводы, липиды, белки и нуклеиновые кислоты.
Поскольку живые существа состоят из соединений на основе углерода, они могут быть разбиты на более мелкие и простые соединения путем разложения, когда они умирают. Живые организмы также выделяют или выделяют материал, который считается органическим материалом (веществом). Органическое вещество относится к любому из углеродсодержащих соединений, встречающихся в природе. Это органическое вещество от живых существ становится частью окружающей среды.Таким образом, в экосистеме изобилует органическое вещество, т.е. почвенная экосистема. Он перемещается в почву или в основную воду, где затем служит источником питания для живых организмов.
Натуральные и синтетические органические соединения
Существует множество способов классификации органических соединений. Один из них основан на том, как они синтезируются. Натуральное органическое соединение (или просто природное соединение) — это соединение, которое производится естественным образом, например растениями или животными. Синтетическое органическое соединение (или синтетическое соединение) представляет собой органическое соединение, которое получают химическими манипуляциями (химическими реакциями).
Природные соединения — это органические соединения, которые могут быть получены из природных источников. Они могут быть произведены искусственно, но процесс их производства сделает их довольно дорогими. Примерами природных соединений являются сахара, ферменты, гормоны, липиды, антигены, жирные кислоты, нейротрансмиттеры, нуклеиновые кислоты, белки, пептиды, аминокислоты, витамины, лектины, некоторые алкалоиды и терпеноиды и т. д.
д.
Синтетические соединения получают, допуская соединения взаимодействовать в химической реакции. Они могут иметь аналоги в природных соединениях или без них.Многие полимеры (например, пластмассы, каучуки) производятся синтетическим путем.
Небольшие органические молекулы в сравнении с крупными органическими соединениями
Органические соединения также могут быть классифицированы как малые органические молекулы или большие органические молекулы (например, полимеры) в зависимости от размера или длины соединения.
Небольшая молекула представляет собой небольшое органическое соединение с молекулярной массой < 900 дальтон. 2 Многие из них участвуют в регуляции биологического процесса. Примером малых молекул являются фармацевтические препараты.Небольшие молекулы не следует путать с биомолекулами (например, белками, полисахаридами, нуклеиновыми кислотами, аминокислотами, ДНК и РНК), которые представляют собой более крупные структуры.
Примером крупного органического соединения является полимер (или макромолекула). Полимер состоит из множества повторяющихся субъединиц.
Исследования
Изучение свойств и синтеза органических соединений известно как органическая химия . Биотехнология представляет собой набор биологических методов, разработанных в ходе фундаментальных исследований и применяемых в настоящее время для исследований и разработки продуктов.Некоторые органические соединения производятся с помощью биотехнологии, в частности, путем изменения ДНК организма для экспрессии желаемых органических соединений, например. инсулин и другие соединения, которые не существуют в природе.
Дополнительные
Этимология
- названа после раннего понятия, что органические соединения могут быть только синтезированы в живых организмах через Vis-Vitalis (жизненная сила)
Дальше чтение
Сравнить
См. Также
Ссылка
- Bechtel, W.
 и Уильямсон, Р. К. (2018). Витализм. Получено по ссылке
и Уильямсон, Р. К. (2018). Витализм. Получено по ссылке - Macielag, MJ (2012). «Химические свойства антибактериальных средств и их уникальность». В Догерти Т.Дж., Пуччи М.Дж. Открытие и разработка антибиотиков. стр. 801–2. ISBN 978-1-4614-1400-1.
© Biology Online. Контент предоставлен и модерируется Biology Online Editors
Organic Sections of CA | КАС
Номера секций и описания
21 Общая органическая химия
Этот раздел включает общие синтетические процессы (например,например, гидрирование, синтез под высоким давлением), процедуры обработки (препаративная хроматография), реакции, номенклатура и компьютерные приложения, применимые к широкому спектру классов органических соединений. Сюда включены обзоры, дискуссии, книги, технические отчеты и материалы конференций, представляющие общий интерес для химиков-органиков, а также исследования органических соединений неизвестной структуры.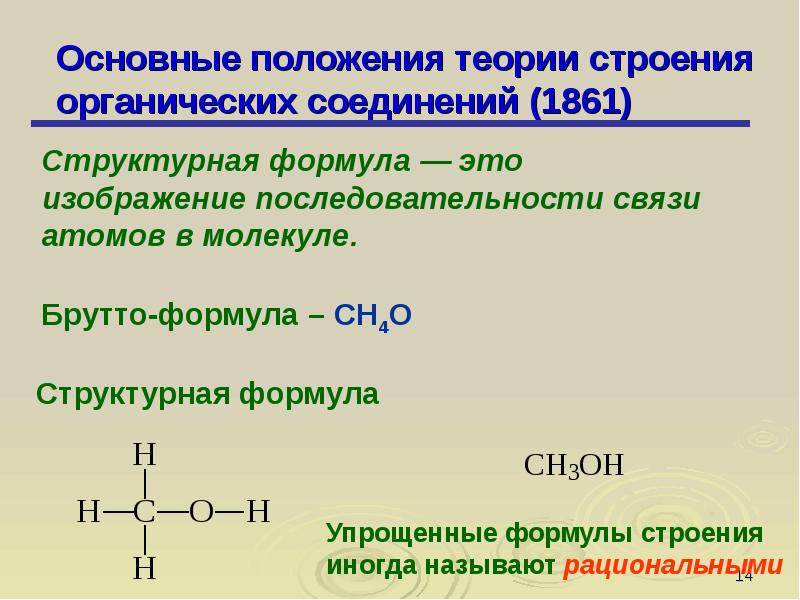 Физико-органические исследования общего характера помещены в раздел 22. Промышленное производство и переработка соединений, обычно встречающихся в этом разделе, включены в раздел 45.
Физико-органические исследования общего характера помещены в раздел 22. Промышленное производство и переработка соединений, обычно встречающихся в этом разделе, включены в раздел 45.
22 Физическая органическая химия
Этот раздел включает исследования по механизму и кинетике реакций алифатических, циклоалифатических, ароматических и гетероциклических соединений, а также спектральные, стереохимические и термодинамические исследования, корреляционный анализ и квантовую механику с упором на реакцию. Физико-органические исследования металлоорганических соединений и органических природных продуктов находятся в разделах 26 и 29-34. Если указывается явное биологическое значение, исследование включается в соответствующий раздел биохимии.Фундаментальные принципы квантовой механики, термодинамики и спектров без явной ссылки на органические структуры или реакции включены в разделы 65, 69 и 73 соответственно.
23 Алифатические соединения
Этот раздел включает синтез, очистку, стабилизацию, реакции и определение молекулярной структуры ациклических соединений углерода. Физико-органические исследования включены в раздел 22. Циклические производные алифатических кислот, такие как лактамы и лактоны, включены в раздел 27 или 28.Производство, переработка и свойства обычных мономеров включены в разделы 35, 36, 37 и 39. Производство алифатических соединений специально для использования в качестве топлива или топливных продуктов включено в раздел 51. Промышленное производство и переработка соединений обычно найденные в этом разделе, включены в раздел 45.
Физико-органические исследования включены в раздел 22. Циклические производные алифатических кислот, такие как лактамы и лактоны, включены в раздел 27 или 28.Производство, переработка и свойства обычных мономеров включены в разделы 35, 36, 37 и 39. Производство алифатических соединений специально для использования в качестве топлива или топливных продуктов включено в раздел 51. Промышленное производство и переработка соединений обычно найденные в этом разделе, включены в раздел 45.
24 Алициклические соединения
Этот раздел включает синтез, очистку, стабилизацию, реакции и определение молекулярной структуры алициклических соединений углерода, в том числе полностью гидрированных производных полиядерных конденсированных соединений бензола и таких ароматических соединений, как азулены, фульвены и тропоны.Физико-органические исследования включены в раздел 22. Циклические производные алициклических кислот, такие как лактамы и лактоны, включены в раздел 27 или 28. Простагландины и другие алициклические натуральные продукты или их синтетические аналоги включены в раздел 26.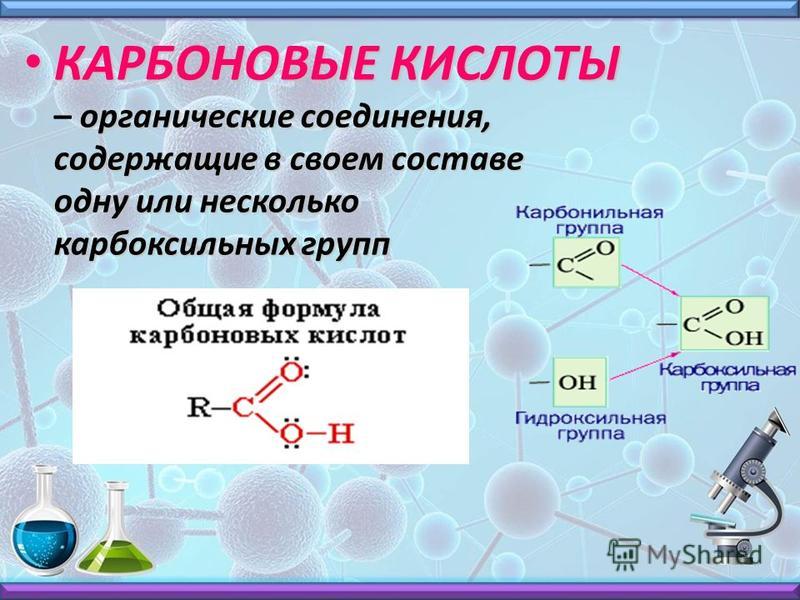 Промышленное производство и переработка соединения, обычно встречающиеся в этом разделе, включены в раздел 45.
Промышленное производство и переработка соединения, обычно встречающиеся в этом разделе, включены в раздел 45.
25 Бензол, его производные и конденсированные бензоидные соединения
Этот раздел включает синтез, очистку, стабилизацию и реакции бензола и его производных, а также конденсированных карбоциклических соединений, содержащих по крайней мере одно конденсированное бензольное кольцо.Физико-органические исследования включены в Раздел 22. Циклические производные кислот, такие как ангидриды и лактоны, включены в Раздел 27 или 28. Производство бензола и его производных специально для использования в качестве или в топливных продуктах включено в Раздел 51. производство, переработка и свойства обычных мономеров включены в разделы 35, 36, 37 и 39. Промышленное производство и переработка соединений, обычно встречающихся в этом разделе, включены в раздел 45.
26 Биомолекулы и их синтетические аналоги
Этот раздел включает синтез, реакции, физико-органические исследования и определение молекулярной структуры встречающихся в природе β-лактамов и других антибиотиков, простагландинов, флавоноидов, порфиринов, феромонов и витаминов, включая аналоги и промежуточные соединения в их синтезе, но исключая природные товары, размещенные в более конкретных разделах.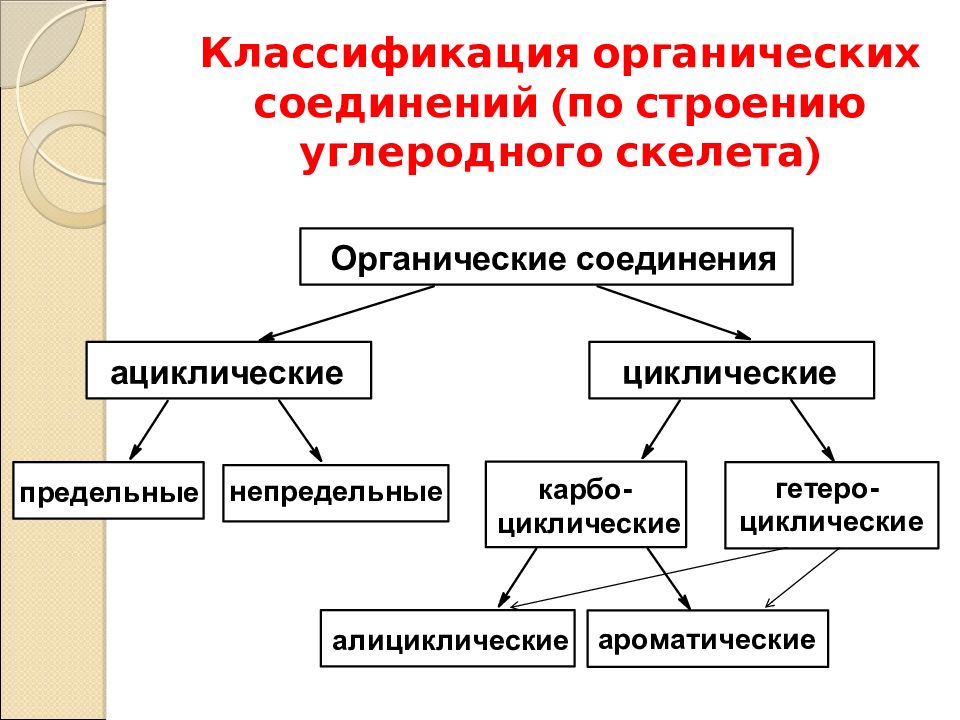 Простые биомолекулы, когда они используются для целей, отличных от биологических, например, небиологические применения этанола, лимонной кислоты, кумарина и фурфурола, включаются в соответствующий раздел биохимии, органической химии или другой раздел. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другие разделы биохимии. Химические синтезы, в которых стадия ферментации является предметом исследования, включены в раздел 16.
Простые биомолекулы, когда они используются для целей, отличных от биологических, например, небиологические применения этанола, лимонной кислоты, кумарина и фурфурола, включаются в соответствующий раздел биохимии, органической химии или другой раздел. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другие разделы биохимии. Химические синтезы, в которых стадия ферментации является предметом исследования, включены в раздел 16.
27 гетероциклических соединений (один гетероатом)
Этот раздел включает синтез, очистку, стабилизацию, реакции и определение молекулярной структуры циклических соединений, содержащих два или более атомов углерода в одном кольце и не более одного гетероатома (азота, кислорода, серы и галогенов). , а также спиросоединения с одним гетероатомом в каждом кольце.Физико-органические исследования включены в Раздел 22. Исследования по получению, обработке и свойствам капролактама, этиленоксида, пропиленоксида и аналогичных обычных мономеров, если явно не указано неполимерное применение, включены в Раздел 35 или 36. Промышленное производство и обработка соединений, обычно встречающихся в этом разделе, включены в Раздел 45.
Промышленное производство и обработка соединений, обычно встречающихся в этом разделе, включены в Раздел 45.
28 гетероциклических соединений (более одного гетероатома)
Этот раздел включает синтез, очистку, стабилизацию, реакции и определение молекулярной структуры циклических соединений, содержащих один или несколько атомов углерода в одном кольце и в общей сложности два или более гетероатомов (азот, кислород, серу и галогены).Физико-органические исследования включены в Раздел 22. Цефалоспорины, пенициллины, их аналоги и промежуточные соединения при их получении включены в Раздел 26. Нуклеозиды и нуклеотиды включены в Раздел 33. Промышленное производство и обработка соединений, обычно встречающихся в этом разделе, включены в Раздел 45.
29 Металлоорганические и металлоорганические соединения
Этот раздел включает синтез, стабилизацию, очистку, физико-органические исследования, реакции и определение молекулярной структуры соединений, содержащих одну или несколько ковалентных (сигма- и пи) связей углерод-металл или углерод-металлоид. Гетероциклы металлов, не содержащие связи углерод-металл в кольце, например боразин, фосфазен и циклотрисилоксан, или гомоциклы, например циклопентагерман, также включены сюда. Простые карбонилы металлов, цианиды, карбиды и цианаты включены в разделы 49 или 78.
Гетероциклы металлов, не содержащие связи углерод-металл в кольце, например боразин, фосфазен и циклотрисилоксан, или гомоциклы, например циклопентагерман, также включены сюда. Простые карбонилы металлов, цианиды, карбиды и цианаты включены в разделы 49 или 78.
30 Терпены и терпеноиды
Этот раздел включает синтез, реакции, физико-органические исследования, характеристику и изучение структуры терпенов и терпеноидов, соединений, обладающих углеродным скелетом, который по большей части можно рассматривать как построенный путем слияния двух или более изопреновых звеньев.Сюда включены стероидные терпеноиды, а также канифоль, талловое масло, смоляные кислоты и скипидар, если выделены или охарактеризованы специфические терпеноидные компоненты. Терпеноидные алкалоиды включены в Раздел 31. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другой раздел биохимии.
31 Алкалоиды
Этот раздел включает синтез, реакции, физико-органические исследования, характеристику и изучение структуры алкалоидов (азотистых оснований растительного, животного или микробного происхождения, с характерной физиологической активностью), включая их аналоги и промежуточные соединения в их синтезе. Сюда включены терпеноидные и пептидные алкалоиды. Стероидные алкалоиды включены в Раздел 32. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другой раздел биохимии. Биологические амины (такие как фенетиламин и тирамин) и производные пурина (такие как кофеин, теобромин и теофиллин) включены в Раздел 26.
Сюда включены терпеноидные и пептидные алкалоиды. Стероидные алкалоиды включены в Раздел 32. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другой раздел биохимии. Биологические амины (такие как фенетиламин и тирамин) и производные пурина (такие как кофеин, теобромин и теофиллин) включены в Раздел 26.
32 Стероиды
Этот раздел включает синтез, характеристику, физико-органические исследования и исследования структуры стероидов, веществ, содержащих циклопента(а)фенантреновую структуру, которые могут иметь растительное, животное или микробное происхождение, и близкородственных соединений.Сюда входят стероидные алкалоиды. Терпеноидные стероиды включены в Раздел 30, а стероидные сапонины — в Раздел 33. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в Раздел 11 или другой раздел биохимии.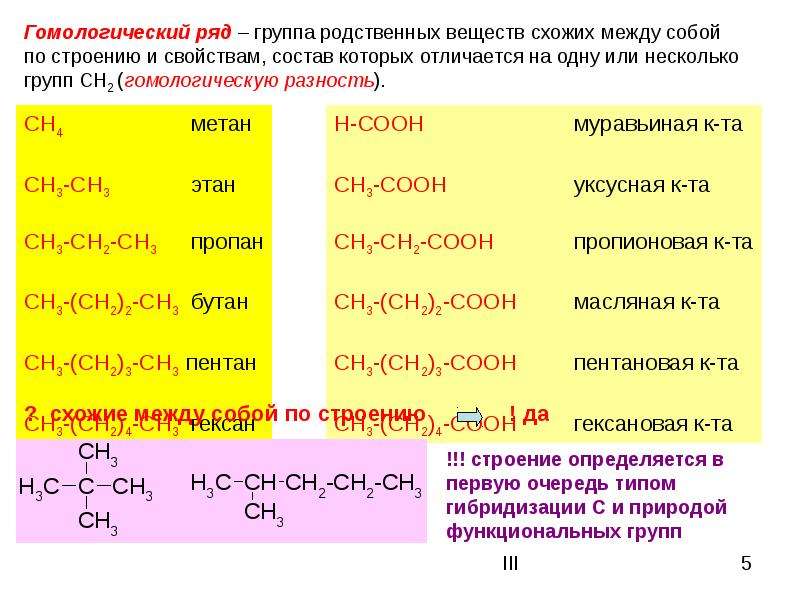 Химические синтезы, в которых стадия ферментации является предметом исследования, включены в раздел 16.
Химические синтезы, в которых стадия ферментации является предметом исследования, включены в раздел 16.
33 Углеводы
Этот раздел включает непромышленный синтез, реакции, физико-органические исследования и исследования строения трехчленных и высших углеводов, их производных и полимеров.Сюда же относятся нуклеозиды, нуклеотиды, стероидные сапонины, химический синтез и полусинтез нуклеиновых кислот. Исследования выделения и исследования, в которых сообщается как о выделении, так и о характеристике или выяснении структуры, включены в раздел 11 или другой раздел биохимии. Химические синтезы, в которых ферментативная стадия является точкой исследования, включены в раздел 16. Гликопептиды и гликопротеины включены в раздел 34 или раздел биохимии. Углеводы коммерческого и промышленного значения, такие как тростниковый и свекловичный сахар, меласса, крахмалы, камеди, слизи и пектины, включены в раздел 44 или раздел биохимии.
34 Аминокислоты, пептиды и белки
Этот раздел включает синтез, реакции, характеристику, физические органические исследования и исследования структуры аминокислот и пептидов растительного, животного или микробного происхождения и их производных, включая поли(аминокислоты) и последовательные полипептиды, полученные из встречающихся в природе аминокислот. . Сюда входят гликопептиды и химический синтез и полусинтез белков и гликопротеинов. Другие исследования белков и гликопротеинов, включая аминокислотный состав и последовательность, а также функциональные группы и перекрестные связи, включены в Раздел 6.Синтез и свойства поли(аминокислот) или их производных, которые в первую очередь используются или могут использоваться в качестве пластмасс или волокон или которые получают и изучают на предмет их макромолекулярных свойств, включены в разделы 35, 36 или 40.
. Сюда входят гликопептиды и химический синтез и полусинтез белков и гликопротеинов. Другие исследования белков и гликопротеинов, включая аминокислотный состав и последовательность, а также функциональные группы и перекрестные связи, включены в Раздел 6.Синтез и свойства поли(аминокислот) или их производных, которые в первую очередь используются или могут использоваться в качестве пластмасс или волокон или которые получают и изучают на предмет их макромолекулярных свойств, включены в разделы 35, 36 или 40.
1
1ВВЕДЕНИЕ
«Сегодня органическая химия почти сводит меня с ума.
Мне кажется, что это первобытный тропический лес
полный замечательных вещей, ужасный бесконечный
джунгли, в которые не смеют войти, ибо там
кажется, что выхода нет»
Вёлер 1835
Цель курса «Органический» — дать вам понимание:
- Основные органические химические реакции и как они происходят
- Структуры и формы органических молекул
- Спектроскопические методы определения органических структур
Определение органической химии
- Органическая химия занимается соединениями, в которых углерод является основным элементом
- Органические вещества возникают в самых разных местах — растениях, животных, продуктах питания, лекарствах, промышленности, исследовательских лабораториях
- Каждый живой организм состоит из органических химических веществ
- 14 миллионов органических веществ — число увеличивается на 10 000 в неделю!!
Уникальная природа углеродных связей в органическом углероде
- Катетерация — атомы углерода могут соединяться вместе, образуя
- Стабильные вытянутые цепочки атомов
- Кольца
- Множественные облигации
- Углерод имеет атомный номер = 6
- Электронная конфигурация: 1s 2 2s 2 2p 2
- Валентность 4 четырех связей для полного заполнения внешней электронной оболочки углерода
- Углерод образует связи с
- Одинарная, двойная, тройная
- Металлы Na, K, Fe, Cu, Mg
- Гетероатомы N, P, O, S, X (галогены)
- С-С и С-Н связи прочные
С-С | 356 кДж моль -1 |
C-H | 412 кДж моль -1 |
Си-Си | 176 кДж моль -1 |
Н-Н | 163 кДж моль -1 |
О-О | 146 кДж моль -1 |
И-И | 152 кДж моль -1 |
- С-С и С-Н связи неполярны
- Сочетание прочности и неполярности делает связи C-C и C-H нереакционноспособными
Существует четыре экспериментально наблюдаемых соединения углерода:
Вид облигаций | Гибридизация | Геометрия | Примеры |
4 одинарных облигации | сп 3 | Тетраэдрический | КХ 4 , КХ 3 КХ 3 |
2 одинарных, 1 двойная связь | сп 2 | Тригональная планарная | СН 2 =СН 2 , СН 2 =О |
1 одинарная, 1 тройная связь 2 двойные связи | сп | Линейный | Н-С С-НСН 2 =С=О |
Если важно представить трехмерную форму молекулы, принимается следующее соглашение:
Существует несколько способов изображения органических молекул, и важно ознакомиться с различными представлениями
Представление органических молекул
В представлении палочки:
- Атомы углерода обычно не показывают, но предполагают, что они находятся на пересечении 2 или более связей и в конце каждой линии.

- Атомы водорода, связанные с углеродом, не показаны, но число определено как число, необходимое для увеличения валентности углерода до 4. Показаны
- гетероатомов (O, N, F, Cl, B, I, S и т. д.).
- При рисовании нейтральных органических молекул:
- C всегда имеет валентность 4
- N всегда имеет валентность 3
- O всегда имеет валентность 2
- X (галоген) всегда имеет валентность 1
Функциональные группы в органической химии
C и полярные связи от углерода к гетероатомам более реакционноспособны, чем связи C-C или CH и, следовательно, где имеет место химия.Эта часть молекулы называется функциональной группой .

- Сочетание способности образовывать широкий спектр нереакционноспособных углеродных каркасов, к которым могут быть добавлены специальные реакционноспособные центры, дает разнообразие органической химии.
- Функциональные группы придают характерные химические и физические свойства соединениям, которые их содержат.
- Функциональные группы вступают в одни и те же химические реакции независимо от типа содержащей их молекулы.
- Молекула, содержащая несколько функциональных групп, демонстрирует реакции, представляющие собой сумму реакций каждой функциональной группы.
Функциональные группы
Органические соединения классифицируются по функциональным группам , которые отвечают за химическое поведение.Функциональные группы участвуют в названии органических соединений.
R — общее сокращение от «остальной части молекулы».
Название класса | Общая формула | Примеры |
алк ане |
РЧ 3 |
CH 4 CH 3 CH 2 CH 2 CH 3
|
алк ен
|
R 2 C=CR 2 |
|
алк yne
|
RC CR |
|
ароматическое соединение (арен) |
|
|
спирт ол
|
Р-ОН |
|
эфир
|
Р-О-Р |
|
амин
|
Р 3 Н |
|
альдегид |
|
|
комплект один |
|
|
карбоновая кислота
|
|
|
хлорангидрид |
|
|
сложный эфир |
|
|
амид |
|
|
Вопросы по функциональным группам
Вернуться к индексу
Функциональные группы и классы органических соединений
24.
 1 Функциональные группы и классы органических соединений
1 Функциональные группы и классы органических соединенийЦель обучения
- Знать основные классы органических соединений и определять важные функциональные группы.
В главе 2 «Молекулы, ионы и химические формулы» и главе 5 «Изменение энергии в химических реакциях» вы познакомились с несколькими структурными единицами, которые химики используют для классификации органических соединений и предсказания их реакционной способности. Эти функциональные группы Структурные единицы, которые химики используют для классификации органических соединений и прогнозирования их реакционной способности при заданном наборе условий., которые определяют химическую активность молекулы при заданном наборе условий, могут состоять из одного атома (например, Cl) или группы атомов (например, CO 2 H). Основные семейства органических соединений характеризуются своими функциональными группами. На рис. 24.1 «Основные классы органических соединений» представлены пять семейств, представленных в предыдущих главах, приведены примеры соединений, содержащих каждую функциональную группу, и перечислены суффиксы или префиксы, используемые в систематической номенклатуре соединений, содержащих каждую функциональную группу.
Рисунок 24.1 Основные классы органических соединений
Первое семейство, перечисленное на рис. 24.1 «Основные классы органических соединений», — это углеводороды. К ним относятся алканы с общей молекулярной формулой C n H 2 n +2 , где n представляет собой целое число; алкены, представленные C n H 2 n ; алкины, представленные C n H 2 n -2 ; и арены.Галогензамещенные алканы, алкены и арены образуют второе большое семейство органических соединений, которое включает алкилгалогениды и арилгалогениды. Кислородсодержащие органические соединения, третье семейство, можно разделить на два основных типа: те, которые содержат хотя бы одну связь С–О, к которым относятся спирты, фенолы (производные бензола) и простые эфиры, и те, которые содержат карбонильную группу. (C=O), которые включают альдегиды, кетоны и карбоновые кислоты. Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо алкоксигруппой (–OR) с образованием сложного эфира, либо амидогруппой (–NRR′, где R и R’ могут быть H и/или алкильными группами), образуя амид.Азотсодержащие органические соединения пятого семейства включают амины; нитрилы, имеющие связь C≡N; и нитросоединения, содержащие группу –NO 2 .
(C=O), которые включают альдегиды, кетоны и карбоновые кислоты. Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо алкоксигруппой (–OR) с образованием сложного эфира, либо амидогруппой (–NRR′, где R и R’ могут быть H и/или алкильными группами), образуя амид.Азотсодержащие органические соединения пятого семейства включают амины; нитрилы, имеющие связь C≡N; и нитросоединения, содержащие группу –NO 2 .
Как вы узнали из главы 2 «Молекулы, ионы и химические формулы», раздела 2.4 «Название ковалентных соединений», систематическая номенклатура органических соединений указывает положения заместителей, используя наименьшие возможные числа для определения их местоположения в углеродной цепи исходное соединение. Если два соединения имеют одно и то же систематическое название, то это одно и то же соединение.Хотя систематические названия предпочтительнее, поскольку они недвусмысленны, многие органические соединения известны под их общими названиями, а не под их систематическими названиями. В общей номенклатуре используется префикс формы — для соединений, не содержащих атомов углерода, кроме тех, что входят в функциональную группу, и ацет — для соединений, содержащих дополнительно один атом углерода [два в случае ацетона, (CH 3 ) 2 С=О]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
В общей номенклатуре используется префикс формы — для соединений, не содержащих атомов углерода, кроме тех, что входят в функциональную группу, и ацет — для соединений, содержащих дополнительно один атом углерода [два в случае ацетона, (CH 3 ) 2 С=О]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Напомним, что в систематической номенклатуре ароматических соединений положения групп, присоединенных к ароматическому кольцу, обозначаются цифрами, начиная с 1 и продолжая движение по кольцу в направлении наименьшего возможного числа. Например, положение первой группы CH 3 в диметилбензоле обозначено цифрой 1, а вторая группа CH 3 , которую можно поместить в любое из трех положений, дает 1,2-диметилбензол, 1 ,3-диметилбензол или 1,4-диметилбензол (рис. 24.2 «Общая номенклатура заменителей ароматических колец»). В обычной номенклатуре, напротив, префиксы орто -, мета — и пара — используются для описания относительного положения групп, присоединенных к ароматическому кольцу.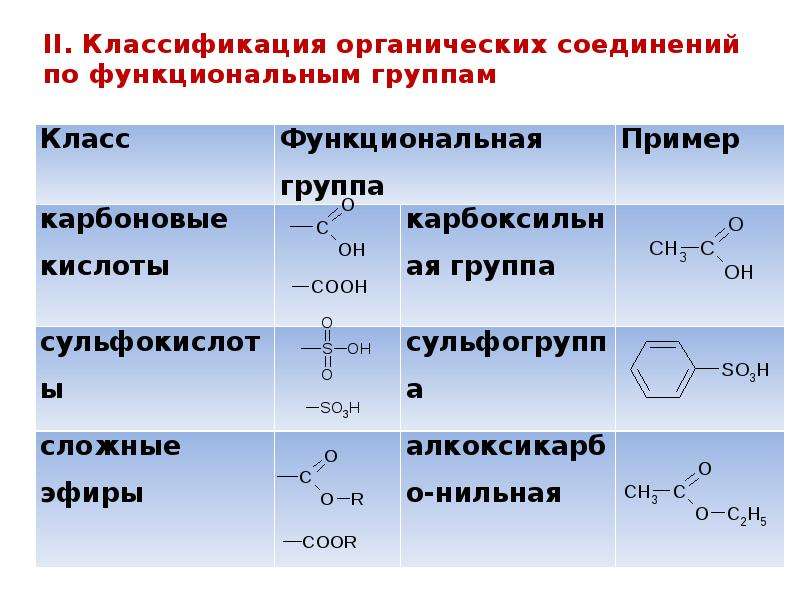 Если группы СН 3 в диметилбензоле, известном как ксилол, расположены рядом друг с другом, то соединение обычно называют орто -ксилол, сокращенно o -ксилол. Если они расположены напротив друг друга в кольце, соединение обычно называют пара -ксилол или р -ксилол.Когда расположение является промежуточным между соединениями орто-— и -пара--, название -мета--ксилол или m -ксилол.
Если группы СН 3 в диметилбензоле, известном как ксилол, расположены рядом друг с другом, то соединение обычно называют орто -ксилол, сокращенно o -ксилол. Если они расположены напротив друг друга в кольце, соединение обычно называют пара -ксилол или р -ксилол.Когда расположение является промежуточным между соединениями орто-— и -пара--, название -мета--ксилол или m -ксилол.
Рисунок 24.2 Общая номенклатура заменителей ароматических колец
Мы начнем обсуждение структуры и реакционной способности органических соединений с изучения структурных вариаций простых насыщенных углеводородов, известных как алканы. Эти соединения служат каркасом, к которому чаще всего присоединяются различные функциональные группы.
Резюме
Функциональные группы представляют собой структурные единицы, определяющие химическую активность молекулы при заданном наборе условий. Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают на положение функциональных групп в основном углеводородном каркасе. Многие органические соединения также имеют общие названия, в которых используется префикс формы — для соединения, не содержащего атомов углерода, кроме тех, которые входят в функциональную группу, и ацет — для тех, которые имеют один дополнительный атом углерода.
Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают на положение функциональных групп в основном углеводородном каркасе. Многие органические соединения также имеют общие названия, в которых используется префикс формы — для соединения, не содержащего атомов углерода, кроме тех, которые входят в функциональную группу, и ацет — для тех, которые имеют один дополнительный атом углерода.
Ключ на вынос
- Функциональные группы определяют химическую активность органической молекулы.
Концептуальные проблемы
Могут ли два вещества иметь одно и то же систематическое название и быть разными соединениями?
Является ли кратная связь углерод-углерод функциональной группой?
Углерод — Почему углерод особенный — атомы, электроны, молекула и атом
В настоящее время химикам известно более десяти миллионов органических соединений. В природе, несомненно, существует гораздо больше, и химики-органики постоянно создают (синтезируют) новые. Углерод — единственный элемент, который может образовывать так много различных соединений, потому что каждый атом углерода может образовывать четыре химические связи с другими атомами, а также потому, что атом углерода имеет такой маленький размер, чтобы удобно вписываться в состав очень больших молекул.
В природе, несомненно, существует гораздо больше, и химики-органики постоянно создают (синтезируют) новые. Углерод — единственный элемент, который может образовывать так много различных соединений, потому что каждый атом углерода может образовывать четыре химические связи с другими атомами, а также потому, что атом углерода имеет такой маленький размер, чтобы удобно вписываться в состав очень больших молекул.
Имея атомный номер 6, каждый атом углерода имеет в общей сложности шесть электронов. Два находятся на завершенной внутренней -орбите , а остальные четыре представляют собой валентных электронов — внешних электронов, которые доступны для образования связей с другими атомами.
Четыре валентных электрона атома углерода могут быть общими для других атомов, у которых есть общие электроны, таким образом образуя ковалентные связи (с общими электронами). Они даже могут быть общими для других атомов углерода, которые, в свою очередь, могут делиться электронами с другими атомами углерода и так далее, образуя длинные цепочки атомов углерода, связанные друг с другом, как звенья в цепи. Кремний (Si), еще один элемент 14-й группы периодической таблицы, также имеет четыре валентных электрона и может образовывать большие молекулы, называемые силиконами, но его атомы слишком велики, чтобы вписаться в столь же большое разнообразие молекул, как атомы углерода.
Кремний (Si), еще один элемент 14-й группы периодической таблицы, также имеет четыре валентных электрона и может образовывать большие молекулы, называемые силиконами, но его атомы слишком велики, чтобы вписаться в столь же большое разнообразие молекул, как атомы углерода.
Способность углерода образовывать длинные углерод-углеродные цепи является первой из пяти причин, по которым может существовать так много различных углеродных соединений; молекула, отличающаяся хотя бы одним атомом, — это, конечно, молекула другого соединения. Вторая причина поразительной способности углерода образовывать соединения заключается в том, что атомы углерода могут связываться друг с другом не только прямыми цепями, но и сложными разветвлениями, как ветви дерева . Они могут даже соединяться «голова к хвосту», образуя кольца из атомов углерода.Практически нет ограничений на количество или сложность ветвей или количество колец, которые могут быть к ним присоединены, и, следовательно, нет ограничений на количество различных молекул, которые могут быть образованы.
Третья причина заключается в том, что атомы углерода могут иметь не только один общий электрон с другим атомом, образуя одинарную связь, но также могут иметь два или три общих электрона, образуя двойную или тройную связь. Это создает огромное количество возможных комбинаций связей в разных местах, создавая огромное количество различных возможных молекул.А молекула, отличающаяся хотя бы одним атомом или положением связи, — это молекула другого соединения.
Четвертая причина заключается в том, что один и тот же набор атомов и связей, но в другом геометрическом расположении внутри молекулы, образует молекулу с другой формой и, следовательно, с другими свойствами. Эти различные молекулы называются изомерами.
Пятая причина заключается в том, что все электроны, которые не используются для связывания атомов углерода в цепочки и кольца, могут быть использованы для образования связей с атомами некоторых других элементов.Наиболее распространенным другим элементом является водород, что делает семейство соединений известным как углеводороды.



 д.
д.
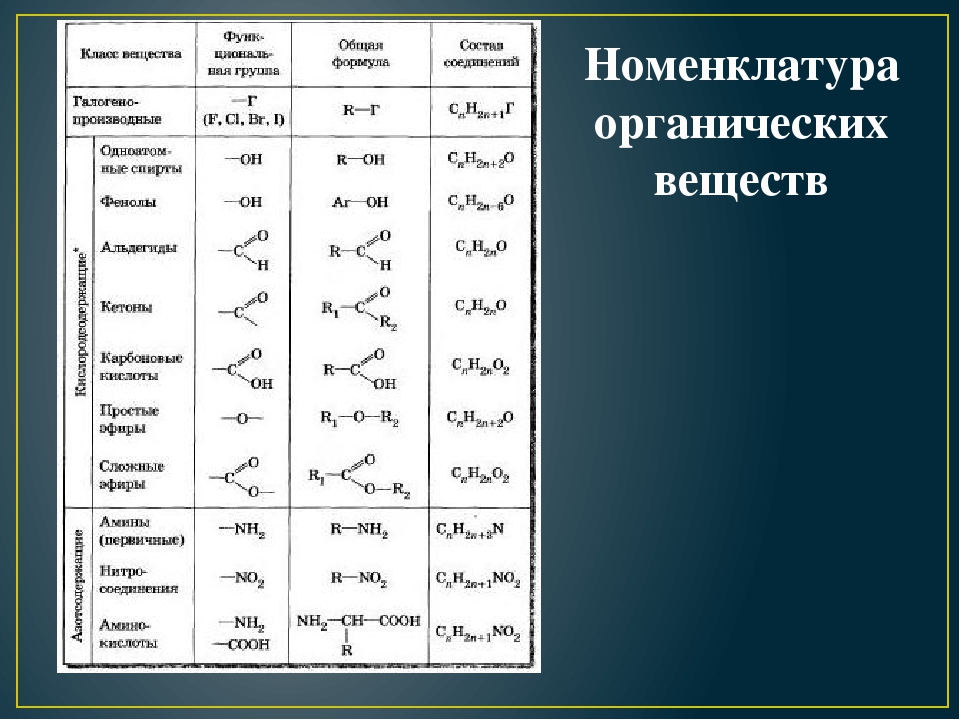 д.
д. д.в качестве лекарств и т. д.
д.в качестве лекарств и т. д.
 д.
д. д.
д. и Уильямсон, Р. К. (2018). Витализм. Получено по ссылке
и Уильямсон, Р. К. (2018). Витализм. Получено по ссылке