Химические элементы, названные в честь российских ученых и топонимов. Досье — Биографии и справки
ТАСС-ДОСЬЕ. 30 ноября Международный союз теоретической и прикладной химии (The International Union of Pure and Applied Chemistry, IUPAC) объявил об утверждении названий новооткрытых элементов периодической таблицы Менделеева.
113-й элемент получил имя нихониум (символ — Ni, в честь Японии), 115-й — московием (Mc, в честь Московской обл.), 117 — теннесином (Ts, в честь штата Теннеси) и 118-й — оганессоном (Og, в честь российского ученого Юрия Оганесяна).
Редакция ТАСС-ДОСЬЕ подготовила список других химических элементов, названных в честь российских ученых и топонимов.
Рутений
Рутений (Ruthenium, символ — Ru) — химический элемент с атомным номером 44. Представляет собой переходный металл платиновой группы серебристого цвета. Используется в электронике, химии, для создания износостойких электрических контактов, резисторах. Добывается из платиновой руды.
Был открыт в 1844 г. профессором Казанского университета Карлосом Клаусом, который решил назвать элемент в честь России (Ruthenia — один из вариантов средневекового латинского названия Руси).
Самарий
Самарий (Samarium, Sm) — химический элемент с атомным номером 62. Представляет собой редкоземельный металл из группы лантаноидов. Широко используется для изготовления магнитов, в медицине (для борьбы с раком), для изготовления аварийных регулирующих кассет в ядерных реакторах.
Был открыт в 1878-1880 гг. французским и швейцарским химиками Полем Лекоком де Буабодраном и Жаном Галиссар де Мариньяком. Они обнаружили новый элемент в найденном в Ильменских горах минерале самарските и назвали его самарием (как производное от минерала).
Однако сам минерал, в свою очередь, был назван по имени русского горного инженера, начальника штаба Корпуса горных инженеров Василия Самарского-Быховца, который передал его иностранным химикам для изучения.
Менделевий
Менделевий (Mendelevium, Md) — синтезированный химический элемент с атомным номером 101. Представляет собой высокорадиоактивный металл.
Представляет собой высокорадиоактивный металл.На эту тему
Наиболее из стабильных изотопов элемента имеет период полураспада 51,5 суток. Может быть получен в лабораторных условиях при бомбардировке атомов эйнштейния ионами гелия. Был открыт в 1955 г. американскими учеными из Национальной лаборатории имени Лоуренса в Беркли (США).
Несмотря на то, что в это время США и СССР находились в состоянии холодной войны, первооткрыватели элемента, среди которых был один из основателей ядерной химии, Гленн Сиборг, предложили назвать его в честь создателя периодической таблицы — русского ученого Дмитрия Менделеева. Правительство США согласилось с этим, в том же году IUPAC присвоил элементу название Менделевий.
Дубний
Дубний (Dubnium, Db) — синтезированный химический элемент с атомным номером 105, радиоактивный металл. Наиболее стабильный из изотопов имеет период полураспада около 1 часа. Получается при бомбардировке ядер амереция ионами неона. Был открыт в 1970 г.
После более чем 20-летнего спора о первенстве в открытии, IUPAC в 1993 г. принял решение признать оба коллектива первооткрывателями элемента и назвать его в честь Дубны (при этом в Советском Союзе предлагали назвать его нильсборием в честь датского физика — Нильса Бора).
Флеровий
Флеровий (Flerovium, Fl) — синтезированный химический элемент с атомным номером 114. Сильнорадиоактивное вещество с периодом полураспада не более 2,7 секунд. Впервые был получен группой физиков Объединенного института ядерных исследований в Дубне под руководством Юрия Оганесяна с участием ученых из Ливермоской национальной лаборатории США) путем слияния ядер кальция и плутония.
Назван по предложению российских ученых в честь одного из основателей института в Дубне, Георгия Флерова.
Московий и оганессон
8 июня комитет Международного союза теоретической и прикладной химии рекомендовал назвать 115-й элемент таблицы Менделеева московием в честь Московской области, где находится Объединенный институт ядерных исследований (город Дубна).
На эту тему
118-й элемент организация предложила называть оганессоном в честь его первооткрывателя, академика РАН Юрия Оганесяна.
Оба химических элементов являются синтезированными с периодом полураспада, не превышающим несколько долей секунд. Были открыты в Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне в ходе экспериментов в 2002-2005 гг. Предложенные IUPAC названия прошли публичное обсуждение и были утверждены им же 28 ноября 2016 г.
Также до 1997 г. в СССР и России синтезированный элемент с атомным номером 104 носил название курчатовий, в честь физика Игоря Курчатова, однако IUPAC принял решение назвать его в честь британского физика Эрнеста Резерфорда — резерфордием.
Почему 118-й химический элемент назвали в честь российского учёного
Это круче, чем Нобелевская премия! Впервые за 200 лет химический элемент назван в честь действующего российского учёного.
Международный союз теоретической и прикладной химии (IUPAC) утвердил названияновых четырёх элементов таблицы Менделеева: 113-го, 115-го, 117-го и 118-го. Последний назван в честь российского физика, академика Юрия Оганесяна. Учёные попадали «в клеточку» и раньше: Менделеев, Эйнштейн, Бор, Резерфорд, чета Кюри… Но лишь второй раз в истории это произошло при жизни учёного. Прецедент случился в 1997 году, когда такой чести удостоился Гленн Сиборг. Юрию Оганесяну давно прочат Нобелевскую премию. Но, согласитесь, получить собственную клеточку в таблице Менделеева куда круче.
Последний назван в честь российского физика, академика Юрия Оганесяна. Учёные попадали «в клеточку» и раньше: Менделеев, Эйнштейн, Бор, Резерфорд, чета Кюри… Но лишь второй раз в истории это произошло при жизни учёного. Прецедент случился в 1997 году, когда такой чести удостоился Гленн Сиборг. Юрию Оганесяну давно прочат Нобелевскую премию. Но, согласитесь, получить собственную клеточку в таблице Менделеева куда круче.
В нижних строках таблицы вы легко найдёте уран, его атомный номер 92. Все последующие элементы, начиная с 93-го, — это так называемые трансураны. Некоторые из них появились примерно 10 миллиардов лет назад в результате ядерных реакций внутри звёзд. Следы плутония и нептуния были обнаружены в земной коре. Но большинство трансурановых элементов давно распалось, и теперь можно лишь предсказывать, какими они были, чтобы потом пытаться воссоздать их в лабораторных условиях.
Первыми это сделали в 1940 году американские учёные Гленн Сиборг и Эдвин Макмиллан. Родился плутоний.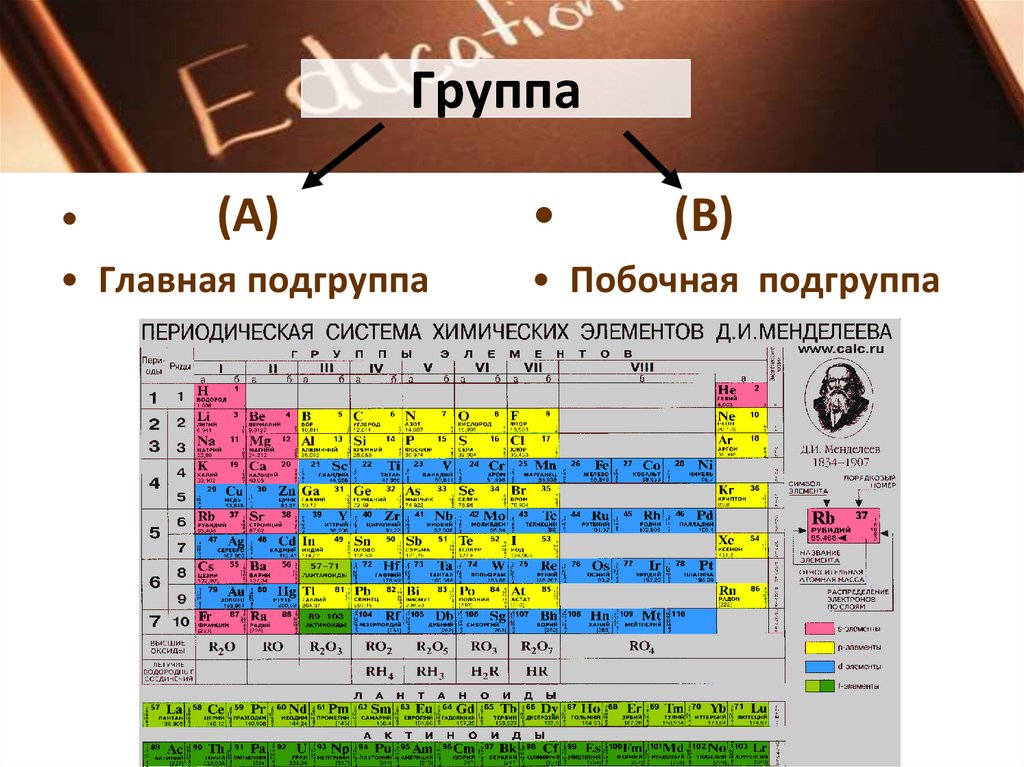 Позднее группа Сиборга синтезировала америций, кюрий, берклий… К тому времени чуть ли не весь мир включился в гонку за сверхтяжёлыми ядрами.
Позднее группа Сиборга синтезировала америций, кюрий, берклий… К тому времени чуть ли не весь мир включился в гонку за сверхтяжёлыми ядрами.
Юрий Оганесян (р. 1933). Выпускник МИФИ, специалист в области ядерной физики, академик РАН, научный руководитель лаборатории ядерных реакций ОИЯИ. Председатель Научного совета РАН по прикладной ядерной физике. Имеет почётные звания в университетах и академиях Японии, Франции, Италии, Германии и других стран. Награждался Государственной премией СССР, орденами Трудового Красного Знамени, Дружбы народов, «За заслуги перед Отечеством» и пр. Фото: wikipedia.org
В 1964 году новый химический элемент с атомным номером 104 впервые синтезировали в СССР, в Объединённом институте ядерных исследований (ОИЯИ), который находится в подмосковной Дубне. Позднее этот элемент получил имя «резерфордий». Руководил проектом один из основателей института Георгий Флёров. Его имя тоже вписано в таблицу: флеровий, 114.
Юрий Оганесян был учеником Флёрова и одним из тех, кто синтезировал резерфордий, потом дубний и более тяжёлые элементы. Благодаря успехам советских учёных Россия вырвалась в лидеры трансурановой гонки и сохраняет этот статус до сих пор.
Благодаря успехам советских учёных Россия вырвалась в лидеры трансурановой гонки и сохраняет этот статус до сих пор.
Научный коллектив, работа которого привела к открытию, направляет своё предложение в IUPAC. Комиссия рассматривает аргументы «за» и «против», исходя из следующих правил: «…вновь открытые элементы могут быть названы: (а) по имени мифологического персонажа или понятия (включая астрономический объект), (б) по названию минерала или аналогичного вещества, (в) по названию населённого пункта или географической области, (г) в соответствии со свойствами элемента или (д) по имени учёного».
Названия четырём новым элементам присваивали долго, почти год. Дата объявления решения несколько раз отодвигалась. Напряжение нарастало. Наконец 28 ноября 2016 года, по истечении пятимесячного срока для приёма предложений и возражений общественности, комиссия не нашла причин отвергнуть нихоний, московий, теннессин и оганесон и утвердила их.
Кстати, суффикс «-он-» не очень типичен для химических элементов. Для оганесона он выбран потому, что по химическим свойствам новый элемент аналогичен инертным газам — это сходство подчеркивает созвучие с неоном, аргоном, криптоном, ксеноном.
Для оганесона он выбран потому, что по химическим свойствам новый элемент аналогичен инертным газам — это сходство подчеркивает созвучие с неоном, аргоном, криптоном, ксеноном.
Рождение нового элемента — событие исторического масштаба. На сегодняшний день синтезированы элементы седьмого периода до 118-го включительно, и это не предел. Впереди 119-й, 120-й, 121-й… Изотопы элементов с атомными номерами более 100 зачастую живут не более тысячной доли секунды. И кажется, чем тяжелее ядро, тем короче его жизнь. Это правило действует до 113-го элемента включительно.
В 1960-х годах Георгий Флёров предположил, что оно не обязано неукоснительно соблюдаться по мере углубления в таблицу. Но как это доказать? Поиск так называемых островов стабильности более 40 лет был одной из важнейших задач физики. В 2006 году коллектив учёных под руководством Юрия Оганесяна подтвердил их существование. Научный мир вздохнул с облегчением: значит, смысл искать всё более тяжёлые ядра есть.
Коридор легендарной Лаборатории ядерных реакций ОИЯИ. Фото: Дарья Голубович/»Кот Шрёдингера»
Фото: Дарья Голубович/»Кот Шрёдингера»
Юрий Цолакович, что же всё-таки представляют собой острова стабильности, о которых много говорят в последнее время?
Юрий Оганесян: Вы знаете, что ядра атомов состоят из протонов и нейтронов. Но только строго определённое количество этих «кирпичиков» связаны друг с другом в единое тело, которое представляет ядро атома. Комбинаций, которые «не срабатывают», оказывается больше. Поэтому, в принципе, наш мир находится в море нестабильности. Да, есть ядра, которые остались со времён образования Солнечной системы, они стабильны. Водород, например. Участки с такими ядрами будем называть «континентом». Он постепенно уходит в море нестабильности по мере того, как мы идём к более тяжёлым элементам. Но, оказывается, если далеко уйти от суши, возникает остров стабильности, где рождаются ядра-долгожители. Остров стабильности — это открытие, которое уже сделано, признано, но точное время жизни долгожителей на этом острове пока не предсказывается достаточно хорошо.
Как были открыты острова стабильности?
Юрий Оганесян: Мы долго их искали. Когда ставится задача, важно, чтобы был однозначный ответ «да» или «нет». Причин нулевого результата на самом деле две: либо ты не дотянулся, либо того, что ищешь, вообще нет. У нас был «ноль» до 2000 года. Мы думали, что, может быть, теоретики и правы, когда рисуют свои красивые картины, но нам до них не дотянуться. В 90-е мы пришли к выводу, что стоит усложнить эксперимент. Это противоречило реалиям того времени: нужна была новая техника, а средств не хватало. Тем не менее к началу ХХI века мы были готовы опробовать новый подход — облучать плутоний кальцием-48.
Почему для вас так важен именно кальций-48, именно этот изотоп?
Юрий Оганесян: Он имеет восемь лишних нейтронов. А мы знали, что остров стабильности там, где избыток нейтронов. Поэтому тяжёлый изотоп плутония-244 облучали кальцием-48. В этой реакции синтезировали изотоп сверхтяжёлого элемента 114 — флеровия-289, который живёт 2,7 секунды. В масштабах ядерных превращений это время считается достаточно длительным и служит доказательством того, что остров стабильности существует. Мы доплыли до него, и по мере продвижения вглубь стабильность только росла.
В масштабах ядерных превращений это время считается достаточно длительным и служит доказательством того, что остров стабильности существует. Мы доплыли до него, и по мере продвижения вглубь стабильность только росла.
Фрагмент сепаратора ACCULINNA-2, на котором изучается структура лёгких экзотических ядер. Фото: Дарья Голубович/»Кот Шрёдингера»
Почему, в принципе, была уверенность, что существуют острова стабильности?
Юрий Оганесян: Уверенность появилась, когда стало понятно, что ядро имеет структуру… Давно, ещё в 1928 году, наш великий соотечественник Георгий Гамов (советский и американский физик-теоретик) высказал предположение, что ядерное вещество похоже на каплю жидкости. Когда эту модель начали проверять, выяснилось, что она удивительно хорошо описывает глобальные свойства ядер. Но потом наша лаборатория получила результат, который коренным образом изменил эти представления. Мы выяснили, что в обычном состоянии ядро не ведёт себя подобно капле жидкости, не является аморфным телом, а имеет внутреннюю структуру. Без неё ядро существовало бы всего 10-19 секунды. А наличие структурных свойств ядерной материи приводит к тому, что ядро живёт секунды, часы, а мы надеемся, что может жить сутки, а может быть даже миллионы лет. Эта надежда, быть может, и слишком смелая, но мы надеемся и ищем трансурановые элементы в природе.
Без неё ядро существовало бы всего 10-19 секунды. А наличие структурных свойств ядерной материи приводит к тому, что ядро живёт секунды, часы, а мы надеемся, что может жить сутки, а может быть даже миллионы лет. Эта надежда, быть может, и слишком смелая, но мы надеемся и ищем трансурановые элементы в природе.
Один из самых волнующих вопросов: есть ли предел разнообразию химических элементов? Или их бесконечно много?
Юрий Оганесян: Капельная модель предсказывала, что их не более ста. С её точки зрения есть предел существования новых элементов. Сегодня их открыто 118. Сколько ещё может быть?.. Надо понять отличительные свойства «островных» ядер, чтобы делать прогноз для более тяжёлых. С точки зрения микроскопической теории, которая учитывает структуру ядра, мир наш не кончается за сотым элементом уходом в море нестабильности. Когда мы говорим о пределе существования атомных ядер, мы должны обязательно это учесть.
Есть ли достижение, которое вы считаете главным в жизни?
Юрий Оганесян: Я занимаюсь тем, что мне на самом деле интересно. Иногда увлекаюсь очень сильно. Иногда получается что-то, и я радуюсь, что получилось. Это жизнь. Это не эпизод. Я не принадлежу к категории людей, которые мечтали быть научными работниками в детстве, в школе, нет. Но просто у меня как-то хорошо получалось с математикой и физикой, и поэтому я пошёл в тот вуз, где надо было сдавать эти экзамены. Ну, сдал. И вообще, я считаю, что в жизни мы все очень сильно подвержены случайностям. Правда, ведь? Очень многие шаги в жизни мы делаем совершенно случайным образом. А потом, когда ты становишься взрослым, тебе задают вопрос: «Почему ты это сделал?». Ну, сделал и сделал. Это моё обычное занятие наукой.
Иногда увлекаюсь очень сильно. Иногда получается что-то, и я радуюсь, что получилось. Это жизнь. Это не эпизод. Я не принадлежу к категории людей, которые мечтали быть научными работниками в детстве, в школе, нет. Но просто у меня как-то хорошо получалось с математикой и физикой, и поэтому я пошёл в тот вуз, где надо было сдавать эти экзамены. Ну, сдал. И вообще, я считаю, что в жизни мы все очень сильно подвержены случайностям. Правда, ведь? Очень многие шаги в жизни мы делаем совершенно случайным образом. А потом, когда ты становишься взрослым, тебе задают вопрос: «Почему ты это сделал?». Ну, сделал и сделал. Это моё обычное занятие наукой.
«Мы можем за месяц получить один атом 118-го элемента»
Сейчас ОИЯИ строит первую в мире фабрику сверхтяжёлых элементов на базе ускорителя ионов DRIBs-III (Dubna Radioactive Ion Beams), самого мощного в своей области энергий. Там будут синтезировать сверхтяжёлые элементы восьмого периода (119, 120, 121) и производить радиоактивные материалы для мишеней. Эксперименты начнутся в конце 2017 — начале 2018 года. Андрей Попеко, из лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ, рассказал, зачем всё это нужно.
Эксперименты начнутся в конце 2017 — начале 2018 года. Андрей Попеко, из лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ, рассказал, зачем всё это нужно.
Андрей Георгиевич, как предсказывают свойства новых элементов?
Андрей Попеко: Основное свойство, из которого следуют все остальные, — это масса ядра. Предсказать её очень сложно, но, исходя из массы, уже можно предположить, как ядро будет распадаться. Есть разные экспериментальные закономерности. Вы можете изучать ядро и, скажем, пытаться описать его свойства. Зная что-то о массе, можно говорить об энергии частиц, которые будет испускать ядро, делать предсказания о времени его жизни. Это довольно громоздко и не очень точно, но более-менее надёжно. А вот если ядро делится спонтанно, прогнозирование становится делом гораздо более сложным и менее точным.
Что мы можем сказать о свойствах 118-го?
Андрей Попеко: Он живёт 0,07 секунды и испускает альфа-частицы с энергией 11,7 МэВ. Это измерено. В дальнейшем можно сравнивать экспериментальные данные с теоретическими и поправлять модель.
В дальнейшем можно сравнивать экспериментальные данные с теоретическими и поправлять модель.
На одной из лекций вы говорили, что таблица, возможно, заканчивается на 174-м элементе. Почему?
Андрей Попеко: Предполагается, что дальше электроны просто упадут на ядро. Чем больше заряд ядра, тем сильнее оно притягивает электроны. Ядро — плюс, электроны — минус. В какой-то момент ядро притянет электроны настолько сильно, что они должны упасть на него. Наступит предел элементов.
Могут ли такие ядра существовать?
Андрей Попеко: Полагая, что существует 174-й элемент, мы полагаем, что существует и его ядро. Но так ли это? Уран, 92-й элемент, живёт 4,5 млрд лет, а 118-й — меньше миллисекунды. Собственно, раньше считалось, что таблица заканчивается на элементе, время жизни которого пренебрежимо мало. Потом выяснилось, что не всё так однозначно, если двигаться по таблице. Сначала время жизни элемента падает, потом, у следующего, немножко увеличивается, потом опять падает.
Рулоны с трековыми мембранами — наноматериалом для очистки плазмы крови при лечении тяжёлых инфекционных заболеваний, устранении последствий химиотерапии. Эти мембраны разработали в Лаборатории ядерных реакций ОИЯИ ещё в 1970-е годы. Фото: Дарья Голубович/»Кот Шрёдингера»
Когда увеличивается — это и есть остров стабильности?
Андрей Попеко: Это указание на то, что он есть. На графиках это хорошо видно.
Тогда что же такое сам остров стабильности?
Андрей Попеко: Некоторая область, в которой находятся ядра изотопов, обладающие более долгим по сравнению с соседями временем жизни.
Эту область ещё предстоит найти?
Андрей Попеко: Пока только самый краешек зацепили.
Что вы будете искать на фабрике сверхтяжёлых элементов?
Андрей Попеко: Эксперименты по синтезу элементов занимают много времени. В среднем полгода непрерывной работы. Мы можем за месяц получить один атом 118-го элемента. Кроме того, мы работаем с высокорадиоактивными материалами, и наши помещения должны отвечать специальным требованиям. Но когда создавалась лаборатория, их ещё не было. Сейчас строится отдельное здание с соблюдением всех требований радиационной безопасности — только для этих экспериментов. Ускоритель сконструирован для синтеза именно трансуранов. Мы будем, во-первых, подробно изучать свойства 117-го и 118-го элементов. Во-вторых, искать новые изотопы. В-третьих, пробовать синтезировать ещё более тяжёлые элементы. Можно получить 119-й и 120-й.
Кроме того, мы работаем с высокорадиоактивными материалами, и наши помещения должны отвечать специальным требованиям. Но когда создавалась лаборатория, их ещё не было. Сейчас строится отдельное здание с соблюдением всех требований радиационной безопасности — только для этих экспериментов. Ускоритель сконструирован для синтеза именно трансуранов. Мы будем, во-первых, подробно изучать свойства 117-го и 118-го элементов. Во-вторых, искать новые изотопы. В-третьих, пробовать синтезировать ещё более тяжёлые элементы. Можно получить 119-й и 120-й.
Планируются эксперименты с новыми материалами для мишеней?
Андрей Попеко: Мы уже начали работать с титаном. На кальций потратили в общей сложности 20 лет — получили шесть новых элементов.
К сожалению, научных областей, где Россия занимает ведущие позиции, не так много. Как нам удаётся побеждать в борьбе за трансураны?
Андрей Попеко: Собственно, здесь лидерами всегда были Соединённые Штаты и Советский Союз. Дело в том, что основным материалом для создания атомного оружия был плутоний — его требовалось как-то получать. Потом задумались: а не использовать ли другие вещества? Из ядерной теории следует, что нужно брать элементы с чётным номером и нечётным атомным весом. Попробовали кюрий-245 — не подошёл. Калифорний-249 тоже. Стали изучать трансурановые элементы. Так получилось, что первыми этим вопросом занялись Советский Союз и Америка. Потом Германия — там в 60-е годы была дискуссия: стоит ли ввязываться в игру, если русские с американцами уже всё сделали? Теоретики убедили, что стоит. В итоге немцы получили шесть элементов: со 107-го по 112-й. Кстати, метод, который они выбрали, разрабатывал в 70-е годы Юрий Оганесян. И он, будучи директором нашей лаборатории, отпустил ведущих физиков помогать немцам. Все удивлялись: «Как это?» Но наука есть наука, здесь не должно быть конкуренции. Если есть возможность получить новые знания, надо участвовать.
Дело в том, что основным материалом для создания атомного оружия был плутоний — его требовалось как-то получать. Потом задумались: а не использовать ли другие вещества? Из ядерной теории следует, что нужно брать элементы с чётным номером и нечётным атомным весом. Попробовали кюрий-245 — не подошёл. Калифорний-249 тоже. Стали изучать трансурановые элементы. Так получилось, что первыми этим вопросом занялись Советский Союз и Америка. Потом Германия — там в 60-е годы была дискуссия: стоит ли ввязываться в игру, если русские с американцами уже всё сделали? Теоретики убедили, что стоит. В итоге немцы получили шесть элементов: со 107-го по 112-й. Кстати, метод, который они выбрали, разрабатывал в 70-е годы Юрий Оганесян. И он, будучи директором нашей лаборатории, отпустил ведущих физиков помогать немцам. Все удивлялись: «Как это?» Но наука есть наука, здесь не должно быть конкуренции. Если есть возможность получить новые знания, надо участвовать.
Сверхпроводящий ECR-источник — при помощи которого получают пучки высоко-зарядных ионов ксенона, йода, криптона, аргона. Фото: Дарья Голубович/»Кот Шрёдингера»
Фото: Дарья Голубович/»Кот Шрёдингера»
В ОИЯИ выбрали другой метод?
Андрей Попеко: Да. Оказалось, что тоже удачный. Несколько позже подобные эксперименты стали проводить японцы. И синтезировали 113-й. Мы получили его почти на год раньше как продукт распада 115-го, но не стали спорить. Бог с ними, не жалко. Эта группа японская стажировалась у нас — многих из них мы знаем лично, дружим. И это очень хорошо. В некотором смысле это наши ученики получили 113-й элемент. Они же, кстати, подтвердили наши результаты. Желающих подтверждать чужие результаты немного.
Для этого нужна определённая честность.
Андрей Попеко: Ну да. А как по-другому? В науке, наверное, вот так.
Каково это — изучать явление, которое по-настоящему поймут от силы человек пятьсот во всём мире?
Андрей Попеко: Мне нравится. Я всю жизнь этим занимаюсь, 48 лет.
Большинству из нас невероятно сложно понять, чем вы занимаетесь. Синтез трансурановых элементов — не та тема, которую обсуждают за ужином с семьёй.
Андрей Попеко: Мы генерируем новые знания, и они не пропадут. Если мы можем изучать химию отдельных атомов, значит, обладаем аналитическими методами высочайшей чувствительности, которые заведомо пригодны для изучения веществ, загрязняющих окружающую среду. Для производства редчайших изотопов в радиомедицине. А кто поймёт физику элементарных частиц? Кто поймёт, что такое бозон Хиггса?
Да. Похожая история.
Андрей Попеко: Правда, людей, понимающих, что такое бозон Хиггса, всё же больше, чем разбирающихся в сверхтяжёлых элементах… Эксперименты на Большом адронном коллайдере дают исключительно важные практические результаты. Именно в Европейском центре ядерных исследований появился интернет.
Интернет — любимый пример физиков.
Андрей Попеко: А сверхпроводимость, электроника, детекторы, новые материалы, методы томографии? Всё это побочные эффекты физики высоких энергий. Новые знания никогда не пропадут.
Боги и герои. В честь кого называли химические элементы
В честь кого называли химические элементы
Ванадий, V (1801 г.). Ванадис — скандинавская богиня любви, красоты, плодородия и войны (как у неё всё это получается?). Повелительница валькирий. Она же Фрейя, Гефна, Хёрн, Мардёлл, Сюр, Вальфрейя. Это имя дано элементу потому, что он образует разноцветные и очень красивые соединения, а богиня вроде тоже очень красивая.
Ниобий, Nb (1801 г.). Изначально назывался колумбием в честь страны, откуда привезли первый образец минерала, содержащего этот элемент. Но потом был открыт тантал, который практически по всем химическим свойствам совпадал с колумбием. В итоге решено было назвать элемент именем Ниобы, дочери греческого царя Тантала.
Палладий, Pd (1802 г.). В честь открытого в том же году астероида Паллада, название которого тоже восходит к мифам Древней Греции.
Кадмий, Cd (1817 г.). Изначально этот элемент добывали из цинковой руды, греческое название которой напрямую связано с героем Кадмом. Сей персонаж прожил яркую и насыщенную жизнь: победил дракона, женился на Гармонии, основал Фивы.
Прометий, Pm (1945 г.). Да, это тот самый Прометей, который отдал огонь людям, после чего имел серьёзные проблемы с божественными властями. И с печенью.
Самарий, Sm (1878 г.). Нет, это не совсем в честь города Самары. Элемент был выделен из минерала самарскита, который предоставил европейским учёным горный инженер из России Василий Самарский-Быховец (1803-1870). Можно считать это первым попаданием нашей страны в таблицу Менделеева (если не брать в расчёт её название, конечно).
Гадолиний, Gd (1880 г. Назван в честь Юхана Гадолина (1760-1852), финского химика и физика, открывшего элемент иттрий.
Тантал, Ta (1802 г.). Греческий царь Тантал обидел богов (есть разные версии, чем именно), за что в подземном царстве его всячески мучили. Примерно так же страдали учёные, пытаясь получить чистый тантал. На это ушло больше ста лет.
Торий, Th (1828 г.). Первооткрывателем был шведский химик Йёнс Берцелиус, который и дал элементу имя в честь сурового скандинавского бога Тора.
Кюрий, Cm (1944 г.). Единственный элемент, названный в честь двух человек — нобелевских лауреатов супругов Пьера (1859-1906) и Марии (1867-1934) Кюри.
Эйнштейний, Es (1952 г.). Тут всё понятно: Эйнштейн, великий учёный. Правда, синтезом новых элементов никогда не занимался.
Фермий, Fm (1952 г). Назван в честь Энрико Ферми (1901-1954), итало-американского учёного, внёсшего большой вклад в развитие физики элементарных частиц, создателя первого ядерного реактора.
Менделевий, Md (1955 г.). Это в честь нашего Дмитрия Ивановича Менделеева (1834-1907). Странно только, что автор периодического закона попал в таблицу не сразу.
Нобелий, No (1957 г.). Вокруг названия этого элемента долго шли споры. Приоритет в его открытии принадлежит учёным из Дубны, которые назвали его жолиотием в честь ещё одного представителя семейства Кюри — зятя Пьера и Марии Фредерика Жолио-Кюри (тоже нобелевского лауреата). Одновременно с этим группа физиков, работавших в Швеции, предложила увековечить память Альфреда Нобеля (1833-1896). Довольно долго в советской версии таблицы Менделеева 102-й значился как жолиотий, а в американской и европейской — как нобелий. Но в итоге ИЮПАК, признавая советский приоритет, оставил западную версию.
Довольно долго в советской версии таблицы Менделеева 102-й значился как жолиотий, а в американской и европейской — как нобелий. Но в итоге ИЮПАК, признавая советский приоритет, оставил западную версию.
Лоуренсий, Lr (1961 г.). Примерно та же история, что и с нобелием. Учёные из ОИЯИ предложили назвать элемент резерфордием в честь «отца ядерной физики» Эрнеста Резерфорда (1871-1937), американцы — лоуренсием в честь изобретателя циклотрона физика Эрнеста Лоуренса (1901-1958). Победила американская заявка, а резерфордием стал 104-й элемент.
Резерфордий, Rf (1964 г.). В СССР он назывался курчатовием в честь советского физика Игоря Курчатова. Окончательное название было утверждено ИЮПАК только в 1997 году.
Сиборгий, Sg (1974 г.). Первый и единственный до 2016 года случай, когда химическому элементу присвоили имя здравствующего учёного. Это было исключение из правила, но уж больно велик вклад Гленна Сиборга в синтез новых элементов (примерно десяток клеток в таблице Менделеева).
Борий, Bh (1976 г.). Тут тоже была дискуссия о названии и приоритете открытия. В 1992 году советские и немецкие учёные договорились назвать элемент нильсборием в честь датского физика Нильса Бора (1885-1962). ИЮПАК утвердил сокращённое название — борий. Это решение нельзя назвать гуманным по отношению к школьникам: им приходится запомнить, что бор и борий — это совершенно разные элементы.
Мейтнерий, Mt (1982 г.). Назван в честь Лизы Мейтнер (1878-1968), физика и радиохимика, работавшей в Австрии, Швеции и США. Кстати, Мейтнер была одним из немногих крупных учёных, отказавшихся участвовать в Манхэттенском проекте. Будучи убеждённой пацифисткой, она заявила: «Я не стану делать бомбу!».
Рентгений, Rg (1994 г.). В этой клеточке увековечен открыватель знаменитых лучей, первый в истории нобелевский лауреат по физике Вильгельм Рентген (1845-1923). Элемент синтезировали немецкие учёные, правда, в исследовательскую группу входили и представители Дубны, в том числе Андрей Попеко.
Коперниций, Cn (1996 .). В честь великого астронома Николая Коперника (1473-1543). Как он оказался в одном ряду с физиками XIX-XX века, не совсем понятно. И уж совсем непонятно, как называть элемент по-русски: коперниций или коперникий? Допустимыми считаются оба варианта.
Флеровий, Fl (1998 г.). Утвердив это название, международное сообщество химиков продемонстрировало, что ценит вклад российских физиков в синтез новых элементов. Георгий Флёров (1913-1990) руководил лабораторией ядерных реакций в ОИЯИ, где были синтезированы многие трансурановые элементы (в частности, от 102-го до 110-го). Достижения ОИЯИ увековечены также в названиях 105-го элемента (дубний), 115-го (московий — в Московской области расположена Дубна) и 118-го (оганесон).
Оганесон, Og (2002 г.). Первоначально о синтезе 118-го элемента заявили американцы в 1999 году. И предложили назвать его гиорсий в честь физика Альберта Гиорсо. Но их эксперимент оказался ошибочным. Приоритет открытия признали за учёными из Дубны. Летом 2016 года ИЮПАК рекомендовал дать элементу название оганесон в честь Юрия Оганесяна.
Приоритет открытия признали за учёными из Дубны. Летом 2016 года ИЮПАК рекомендовал дать элементу название оганесон в честь Юрия Оганесяна.
Спирты — химические свойства, формулы и получение
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2.Взаимодействие со щелочами: С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
проводят реакцию в кислой среде;
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
применяют кислоты Льюиса.

R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O.Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.
Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
Окисление йодной кислотой и ее солями
Образование эфиров с азотной кислотой
Вопросы для самопроверки
Что такое спирты?
Что образуется при межмолекулярной дегидратации спиртов?
Какую качественную реакцию имеют многоатомные спирты?
Какой характерной реакцией можно получить этанол?
Напишите все виды изомерии для пентанола-1.

Как классифицируют спирты?
1.2: Функциональная группа — Химия LibreTexts
Цели обучения
- Определение функциональной группы .
- Определите функциональную группу (группы), присутствующую в органических соединениях.
При наличии более двадцати миллионов известных органических соединений было бы очень сложно запомнить химические реакции для каждого из них. К счастью, молекулы с похожими функциональными группами склонны вступать в сходные реакции. Функциональная группа определяется как атом или группа атомов в молекуле, которая имеет сходные химические свойства, когда она появляется в различных соединениях.Даже если другие части молекулы сильно отличаются, определенные функциональные группы имеют тенденцию реагировать определенным образом.
Мы уже рассмотрели алканы, но они, как правило, нереакционноспособны. Мы в основном используем алканы в качестве источника энергии при их сжигании. Хотя в состав большинства функциональных групп входят атомы, отличные от углерода и водорода, мы также рассмотрим некоторые из них, включающие только углерод и водород. Некоторые из наиболее распространенных функциональных групп представлены в следующих разделах.
Хотя в состав большинства функциональных групп входят атомы, отличные от углерода и водорода, мы также рассмотрим некоторые из них, включающие только углерод и водород. Некоторые из наиболее распространенных функциональных групп представлены в следующих разделах.
Органические молекулы сильно различаются по размеру, и, сосредоточив внимание на функциональных группах, мы хотим направить наше внимание на атомы, входящие в состав функциональной группы. В результате в некоторых примерах используется аббревиатура R . Буква R используется в молекулярных структурах для обозначения « R эст молекулы». Он состоит из группы атомов углерода и водорода любого размера. Он используется как аббревиатура, поскольку группа атомов углерода и водорода не влияет на функциональность соединения.В некоторых молекулах вы увидите R, R’ или R’’ , что указывает на то, что группы R в молекуле могут отличаться друг от друга. Например, R может быть –CH 2 CH 3 , а R’ – –CH 2 CH 2 CH 2 CH 3 .
Структура капсаицина, соединения, отвечающего за жгучесть перца, включает несколько функциональных групп, обозначенных на рисунке ниже и поясняемых в этом разделе.
В таблице ниже приведены структуры, которые будут обсуждаться в этой главе:
Таблица \(\PageIndex{1}\) Избранные органические функциональные группы
Пример \(\PageIndex{1}\)
Определите общие функциональные группы для АТФ.
Решение
Общими функциональными группами для АТФ являются гидроксил , эфир и амин . Остальные функциональные группы изучаются в высших курсах органической химии.
Упражнение \(\PageIndex{1}\)
Определите функциональные группы (кроме алканов) в следующих органических соединениях. Укажите, являются ли спирты и амины первичными, вторичными или третичными.
- Ответить
Резюме
- Функциональные группы состоят из одного атома (например, Cl) или группы атомов (например, CO 2 H).
 Он может определить химическую активность молекулы при заданном наборе условий
Он может определить химическую активность молекулы при заданном наборе условий - Основные семейства органических соединений характеризуются своими функциональными группами.
Авторы и авторство
Libretext: Chemistry for Allied Health (Soult)
TextMap: Органическая химия (Уэйд).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. - Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Группы IIA, IIIA и IVA
Группы IIA, IIIA и IVA
Группа IIA: Щелочно-земельные металлы
Все элементы группы IIA (Be, Mg, Ca, Sr, Ba и Ra)
металлы, и все, кроме Be и Mg, являются активными металлами.Эти элементы
часто называют щелочноземельными металлами. Терм щелочной отражает тот факт, что многие соединения этих металлов являются основными
или щелочной. Термин земля исторически использовался для
описывают тот факт, что многие из этих соединений нерастворимы в
вода. Большая часть химии щелочноземельных металлов (группа
IIA) можно предсказать по поведению щелочных металлов (группа IA). Три точки должны быть
однако имейте в виду.
Терм щелочной отражает тот факт, что многие соединения этих металлов являются основными
или щелочной. Термин земля исторически использовался для
описывают тот факт, что многие из этих соединений нерастворимы в
вода. Большая часть химии щелочноземельных металлов (группа
IIA) можно предсказать по поведению щелочных металлов (группа IA). Три точки должны быть
однако имейте в виду.
- Щелочноземельные металлы имеют тенденцию терять два электрона, чтобы форма M 2+ ионы (Be 2+ , Mg 2+ , Ca 2+ и так далее).
- Эти металлы менее реакционноспособны, чем соседние щелочной металл. Магний менее активен, чем натрий; кальций менее активен, чем калий; и так далее.
- Эти металлы становятся более активными по мере продвижения вниз по колонке.Магний более активен, чем бериллий; кальций больше активнее магния; и так далее.
Щелочноземельные металлы реагируют с неметаллами с образованием
продукты, ожидаемые от электронных конфигураций
элементы.
Mg( с ) + Cl 2 ( г ) MgCl 2 ( с )
3 мг( с ) + N 2 ( г ) Мг 3 Н 2 ( с )
Ca( s ) + H 2 ( г ) CaH 2 ( с )
Поскольку они не так активны, как щелочные металлы, большинство эти элементы образуют оксиды.
2 мг( с ) + О 2 ( г ) 2 MgO( с )
Кальций, стронций и барий также могут образовывать перекиси.
Ва( с ) + О 2 ( г ) БаО 2 ( с )
Более активные представители группы IIA (Ca, Sr и Ba) реагируют
с водой комнатной температуры. Продукты этих реакций
то, что мы могли бы ожидать. Кальций, например, теряет два
электроны с образованием ионов Ca 2+ при взаимодействии с водой.
Ca Ca 2+ + 2 e —
Эти электроны подхватываются молекулами воды, образуя H 2 газ и ионы ОН — .
2 H 2 O + 2 e — H 2 + 2 OH —
Объединение двух половин реакции так, чтобы электроны сохраняется, дает следующий результат.
Ca( s ) + 2 H 2 O( l ) Ca 2+ ( водный раствор ) + 2 OH — ( водный раствор ) + Н 2 ( г )
Хотя Mg не реагирует с водой при
комнатной температуре, он будет реагировать с паром.Продукция этого
реакция не может быть водной Mg 2+ и ионы OH — потому что вокруг нет жидкой воды, чтобы стабилизировать эти ионы.
Продуктами этой реакции являются газ H 2 и магний. оксид, MgO.
оксид, MgO.
Mg( с ) + H 2 O( г ) MgO( с ) + H 2 ( г )
| Практическая задача 2: Магний реагирует с водородом с образованием соединения A , которое представляет собой белое твердое вещество при комнатной температуре.Он также реагирует с соляной кислоты с образованием газа B и водного раствор соединения C . Определить продукты из этих реакций и написать сбалансированные уравнения для каждой реакция. Нажмите здесь, чтобы проверить свой ответ на практическое задание 2 |
Группа IIIA: Химия Алюминий
Элементы группы IIIA (B, Al, Ga, In и Tl) могут быть
разделены на три класса.
- Бор — единственный элемент в этой группе, не являющийся металл. Он ведет себя как полуметалл или даже неметалл.
- Алюминий является третьим наиболее распространенным элементом в мире. земной коры. Он лишь немного менее реактивен, чем активные металлы.
- Остальные три элемента этой группы являются активными металлами. но их так мало, что они представляют ограниченный интерес. Галлий, индий и таллий вместе взятые менее 10 -10 % земной коры.
Таким образом, обсуждение металлов группы IIIA вращается вокруг химия алюминия, которую можно понять, предположив что металл реагирует с образованием соединений, в которых он имеет степень окисления +3.
2 Al( s ) + 3 Br 2 ( l ) Ал 2 Бр 6 ( с )
4 Al( s ) + 3 O 2 ( г ) 2 Ал 2 О 3 ( с )
16 Ал( с ) + 3 С 8 ( с ) 8 Ал 2 С 3 ( с )
Алюминий реагирует с концентрированными кислотами с образованием Al 3+ ионы и газ H 2 .
2 Al( s ) + 6 H + ( aq ) 2 Al 3+ ( водный ) + 3 H 2 ( г )
Он также реагирует с концентрированными основаниями с образованием H 2 газ и ион алюмината, Al(OH) 4 — , в алюминий находится в степени окисления +3.
2 Al( s ) + 2 OH — ( водный ) + 6 H 2 O( l ) 2 Al(OH) 4 — ( водный ) + 3 H 2 ( g )
Группа IVA: олово и свинец
Элементы группы IVA можно разделить на три класса:
- углерод, который является неметаллом;
- кремний и германий, которые являются полуметаллами; и
- олово и свинец, которые являются металлами.
 Олово и свинец входят в число
древнейшие известные металлы.
Олово и свинец входят в число
древнейшие известные металлы.
Олово и свинец гораздо менее реакционноспособны, чем любая из групп IA, Металлы IIA или IIIA. Согласно утверждению, что элементы стать более металлическим а значит более активно по мере того, как мы спускаемся по столбцу таблицы Менделеева, свинца должно быть больше реактивнее олова.
Свинец реагирует с воздухом с образованием тонкого покрытия из PbO и/или PbCO 3 , который защищает металл от дальнейшей реакции.
2 Pb( с ) + O 2 ( г ) 2 PbO( с )
PbO( с ) + CO 2 ( г ) PbCO 3 ( с )
В тонкоизмельченном виде свинец пирофорен он воспламеняется в присутствии кислорода.
Олово не реагирует ни с воздухом, ни с водой при комнатной температуре.
температура. При нагревании до белого каления олово вступает в реакцию с воздухом.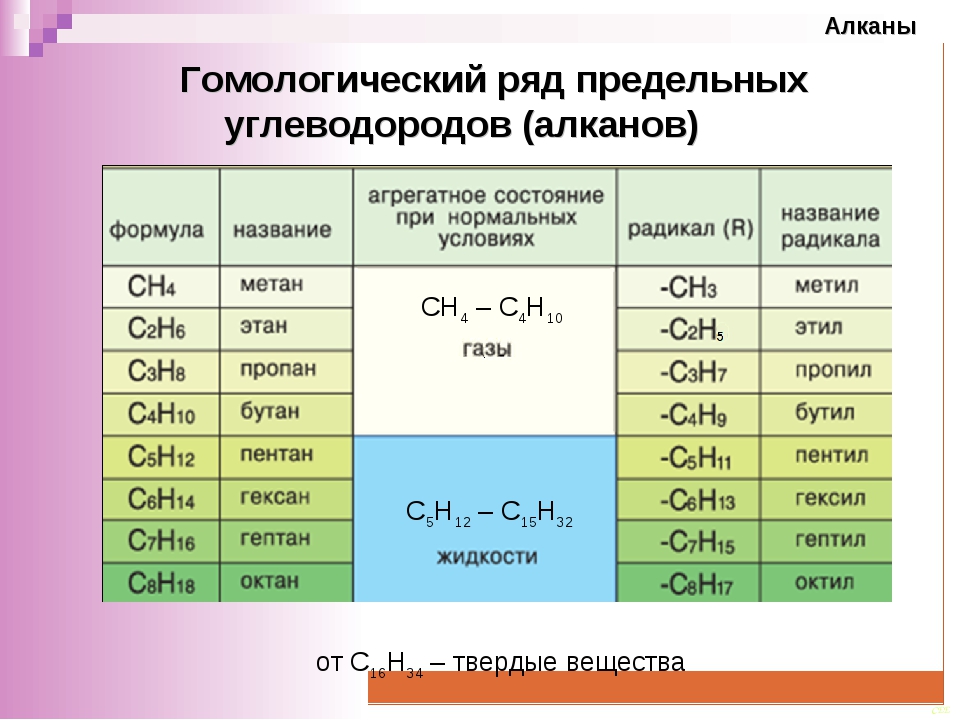 форма СнО 2 .
форма СнО 2 .
Sn( с ) + O 2 ( г ) СнО 2 ( с )
При высоких температурах он также реагирует с паром с образованием SnO 2 .
Sn( s ) + 2 H 2 O( г ) SnO 2 ( с ) + 2 H 2 ( г )
Олово и свинец менее активны, чем алюминий. Ни металл реагирует либо с разбавленной соляной кислотой, либо с разбавленной серной кислоты при комнатной температуре.Олово при нагревании реагирует либо с концентрированная соляная кислота или концентрированная серная кислота.
Sn( с ) + 2 H + ( водный ) Sn 2+ ( водный ) + H 2 ( г )
Свинец медленно реагирует с соляной кислотой при комнатной температуре. и концентрированной серной кислотой при температуре выше 200С.
Pb( с ) + 2 H + ( водный ) Pb 2+ ( водный раствор ) + H 2 ( г )
Олово и свинец являются металлами основной группы, образующими соединения в более
чем одна степень окисления. Как правило, низшая степень окисления
становится более стабильным по мере того, как мы спускаемся вниз по столбцу периодической таблицы.
Свинец, например, чаще встречается в +2 окислении.
состоянии, чем олово. Таким образом, в то время как олово реагирует с кислородом при высоких
температуры с образованием SnO 2 , свинец образует PbO. (ПбО 2 не может быть образован прямой реакцией между свинцом и кислородом.)
Как правило, низшая степень окисления
становится более стабильным по мере того, как мы спускаемся вниз по столбцу периодической таблицы.
Свинец, например, чаще встречается в +2 окислении.
состоянии, чем олово. Таким образом, в то время как олово реагирует с кислородом при высоких
температуры с образованием SnO 2 , свинец образует PbO. (ПбО 2 не может быть образован прямой реакцией между свинцом и кислородом.)
Никель — информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: никель
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Мира Сентилингам
На этой неделе даже в художественных галереях могут начаться химические или элементарные дискуссии. Андреа Селла.
Андреа Селла.
Андреа Селла
Несколько лет назад я пошел с другом на небольшую выставку в лондонской Национальной галерее. Это была редкая возможность увидеть шедевры из галереи Дориа Памфилии в Риме. Центральным элементом был знаменитый портрет Папы Иннокентия X работы Веласкеса, эффектный снимок одного из самых могущественных людей своего времени, сурового вида персонаж на позолоченном троне, с аккуратной бородкой и свирепым и бескомпромиссным блеском в глазах. .
Напротив него висели тревожные «Три кричащих папы» Фрэнсиса Бэкона, кошмарные варианты на тему Веласкеса. Картины были такими уродливыми и жестокими, что я инстинктивно моргнул и посмотрел в сторону, вверх. Неожиданно мой взгляд упал на набор золотых букв над дверным проемом. Я хихикнула, и мой друг сказал мне: «Что смешного? Эти фотографии просто ужасны».
«Монд, — ответил я, — как бы найти его здесь».
‘Кто?’ — спросила она, выглядя озадаченной.
— Монд, — ответил я. «Эта галерея была создана Людвигом Мондом, химиком, который сделал никель доступным для всего мира». Я ожидал, что она закатит глаза и бросит на меня тот сочувствующий взгляд, который женщины приберегают для момента, когда настоящий ботаник в мужчине, наконец, раскрывается.
«Эта галерея была создана Людвигом Мондом, химиком, который сделал никель доступным для всего мира». Я ожидал, что она закатит глаза и бросит на меня тот сочувствующий взгляд, который женщины приберегают для момента, когда настоящий ботаник в мужчине, наконец, раскрывается.
Но ничего этого не было.
— Никогда о нем не слышала, — сказала она. — Он обнаружил это?
‘Нет. Он этого не сделал. Никель был известен задолго до этого — из него делали сталь в Китае и Перу.Но только в 19 веке два шведских химика, Кронштедт и Бергманн установили, что это элемент. Он был назван никелем в честь одной из его руд, красноватого материала, который немецкие горняки называли купферникель — медь Святого Николая.
‘Но разве никель не противен? Не было ли проблем с украшениями из никеля? — спросил мой друг.
‘Да. Никель уже давно используется в сплавах и для покрытия других металлов — никель обеспечивает прочное, стойкое и блестящее покрытие, которое защищает объект от коррозии. ‘
‘
‘О, вы имеете в виду что-то вроде хромирования’.
‘Да, немного похоже на хром, но менее вульгарно — хром дает ослепительный блеск. Никель немного более сдержанный».
‘Ты имеешь в виду классный’.
‘Думаю, да. Но проблема в том, что при контакте с кожей, как и в ювелирных изделиях, крошечного количества никеля, растворяющегося в поте владельца, было достаточно, чтобы вызвать кожные реакции у некоторых людей, и использование никеля оказалось не очень хорошей идеей. ‘
‘А как же Монд?’
‘О да.Правильно.’ Я ответил. «Монд был немецким химиком, переехавшим в Великобританию. И у него была проблема — он пропускал угарный газ через никелевые клапаны, а они постоянно выходили из строя и протекали. То, что Монд и его помощник Лангер обнаружили, было чем-то замечательным: его клапаны ржавели, потому что металл вступал в реакцию с окисью углерода, образуя соединение, называемое карбонилом никеля».
‘Ну и что?’
‘Ну, карбонил никеля оказался очень летучей бесцветной жидкостью, которая кипит чуть ниже комнатной температуры.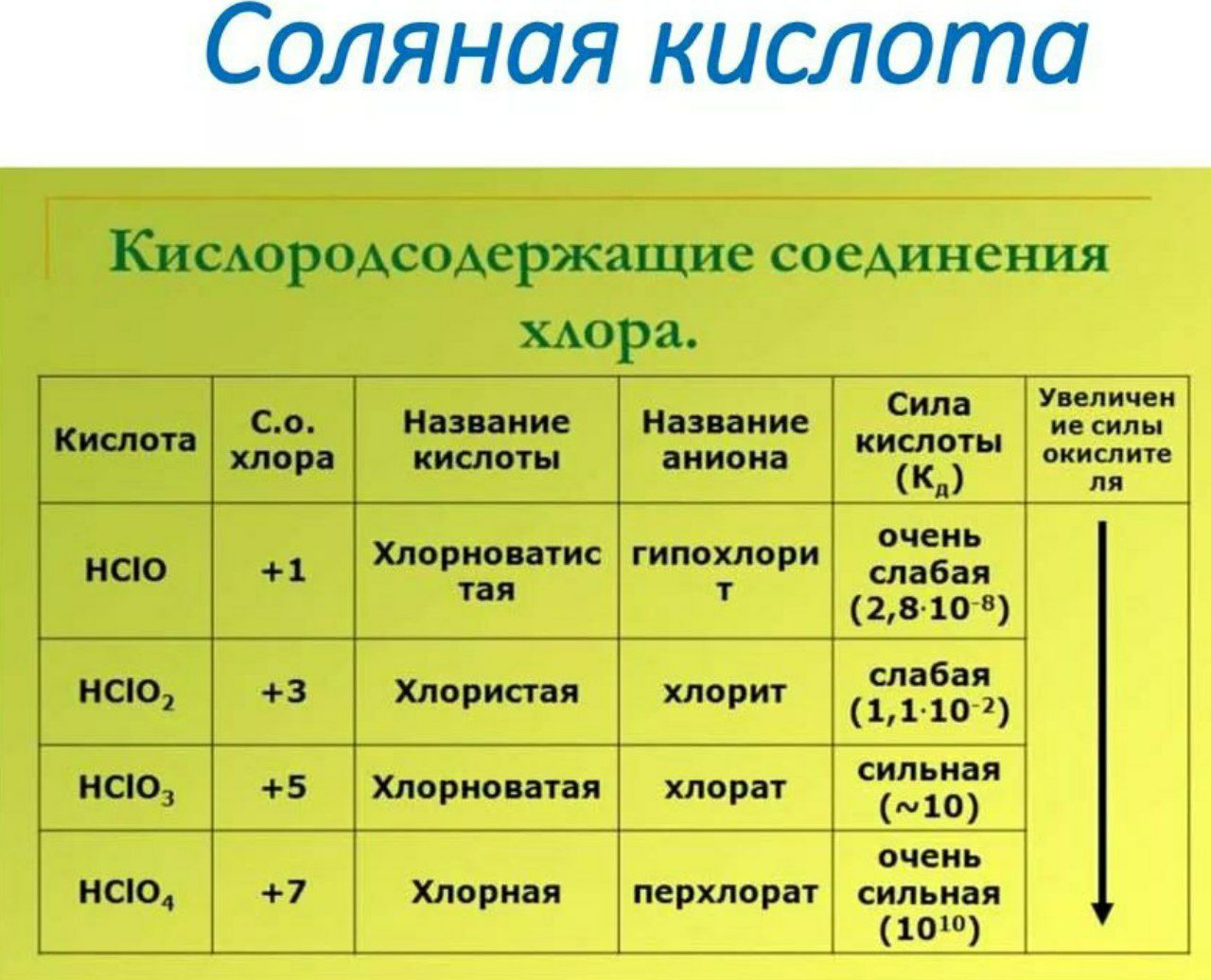 ‘
‘
‘Хммм. Звучит немного противно, — с сомнением сказала она.
‘О да. Очень. Поскольку он очень летучий, вам нужно быть очень осторожным, когда вы обращаетесь с ним, так как если вы вдохнете его, он разложится, выпустив ядовитый угарный газ и выбрасывая металлический никель в ваши легкие. Так что это действительно очень опасно. Но в некотором смысле в этом и прелесть: карбонил никеля невероятно хрупок. Если его нагреть, он рассыплется на куски, и вы получите обратно и никель, и угарный газ.Итак, у Монда был восхитительно простой способ отделить и очистить никель от любого другого металла. И более того, он мог перерабатывать угарный газ».
‘Вау.’
‘Монд был не просто наблюдательным химиком. Он также был довольно опытным бизнесменом. Он запатентовал свой процесс и занялся продажей чистейшего никеля по гораздо более низким ценам, чем кто-либо другой. Он заработал огромное состояние, а затем неуклонно расширялся в другие области химии. Его фирма в конечном итоге станет ядром Imperial Chemical Industries, ICI, конгломерата, созданного для защиты британских интересов от, как это ни парадоксально, натиска бурно развивающейся немецкой химической промышленности.
— Так что же сегодня делают с никелем, если он такой гадкий, — спросила она.
‘Ну, на самом деле это не так уж и противно, если вы будете осторожны в том, для чего вы его используете. В 1960-х годах другой немецкий химик по имени Уилке разработал соединения никеля в качестве дешевых и простых катализаторов для нефтехимической промышленности, позволяющих связывать вместе небольшие молекулы углерода. Он также используется во всех видах сплавов. Есть инвар, разновидность металлического пирекса, который не расширяется и не сжимается при изменении температуры.Есть монель, сталь, настолько устойчивая к коррозии, что она выдерживает даже фтор, который проедает практически все. И есть действительно странный металл с памятью, сплав, который независимо от того, как сильно вы его крутите и сгибаете, запоминает свою первоначальную форму и возвращается к ней. А еще есть суперсплавы из никеля и алюминия с примесью бора, которые очень легкие и на самом деле становятся жестче при нагревании — поэтому они используются в авиационных и ракетных турбинах».
Я видел, что зашел слишком далеко.Мы повернулись к Папе. — Он, должно быть, был хулиганом, — сказал я.
‘Знаешь, что мне в тебе нравится?’ — спросил мой друг, сжимая мою руку. «Это то, что мы ходим смотреть картины, и в итоге я слышу о странных вещах».
— А ты знаешь, что мне в тебе нравится, — ответил я. — Дело в том, что ты подшучиваешь надо мной, когда я ухожу.
Вы, наверное, ждете, что я скажу, что все закончилось благополучно. Это не так, и я не видел ее много лет. Но как ни странно, каждый раз, когда я думаю о никеле, я думаю о ней.И грязный взгляд Папы на меня.
Мира Сентилингам
Итак, суперсплавы, отношения и папа, какие разнообразные химические мысли и истории вызывает никель. Это была Андреа Селла из UCL с современной историей никеля. Теперь на следующей неделе открытие ксенона.
Peter Wothers
История ксенона начинается в 1894 году, когда лорд Рэлей и Уильям Рамзи исследовали, почему азот, извлеченный из химических соединений, примерно на полпроцента легче, чем азот, извлеченный из воздуха. Это наблюдение впервые сделал Генри. Кавендиш 100 лет назад.Рамзи обнаружил, что после реакции атмосферного азота с горячим металлическим магнием остается крошечная часть более тяжелого и даже менее реактивного газа. Они назвали этот газ аргоном от греческого слова «ленивый» или «неактивный», чтобы отразить его крайнюю инертность. Проблема заключалась в том, как этот новый элемент вписывался в периодическую таблицу элементов Менделеева? Не было никаких других известных элементов, на которые он был похож, что заставило их подозревать, что существует целое семейство элементов, которые еще предстоит открыть. Что примечательно, так оно и оказалось.
Это наблюдение впервые сделал Генри. Кавендиш 100 лет назад.Рамзи обнаружил, что после реакции атмосферного азота с горячим металлическим магнием остается крошечная часть более тяжелого и даже менее реактивного газа. Они назвали этот газ аргоном от греческого слова «ленивый» или «неактивный», чтобы отразить его крайнюю инертность. Проблема заключалась в том, как этот новый элемент вписывался в периодическую таблицу элементов Менделеева? Не было никаких других известных элементов, на которые он был похож, что заставило их подозревать, что существует целое семейство элементов, которые еще предстоит открыть. Что примечательно, так оно и оказалось.
Мира Сентилингам
И услышать, как эта история закончилась, приведя к открытию нового семейства элементов, а также ксенона, которые будут освещать наши дороги и приводить в движение космические корабли, присоединяйтесь к Питеру Уотерсу из Кембриджского университета на следующей неделе. Химия в своей стихии. А пока спасибо за внимание, я Мира Сентилингам
(Промо)
(Конец промо)
Хлор — информация об элементе, свойства и использование
Стенограмма:
Химия в ее элементе: хлор
(Промо)
Вы слушаете Химия в ее элементе , представленный вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет. То, что содержит три изотопа, сохраняет бассейны чистыми, повреждает озоновый слой и используется в большем количестве химических реакций синтеза, чем вы можете потрясти бензольным кольцом. Ну человек с ответом Тим Харрисон.
Тим Харрисон
Хлор — это то, что можно описать как элемент Джекила и Хайда; это друг химиков-синтетиков, и он нашел применение в ряде «хороших» применений, таких как дезинфекция питьевой воды и поддержание чистоты наших плавательных бассейнов.У него есть и неприятная сторона, поскольку он является первым боевым отравляющим веществом и берет на себя часть вины за истощение озонового слоя Земли.
Элементарный хлор представляет собой бледный желто-зеленый газ при комнатной температуре. Именно греческое слово khlôros, означающее «желтовато-зеленый», использовалось в качестве вдохновения сэром Хамфри Дэви, когда он назвал этот элемент в 19 веке.
Этот элемент был впервые выделен в 1774 году швейцарско-немецким химиком Карлом Вильгельмом Шееле путем взаимодействия соляной кислоты с оксидом марганца (IV).Но он не смог реализовать свое достижение, ошибочно полагая, что оно также содержит кислород. Именно Дэви в 1810 году окончательно пришел к выводу, что Шееле создал элементарный хлор.
Хлор находится в группе 17 периодической таблицы, также называемой галогенами, и не встречается в природе как элемент — только в виде соединения. Наиболее распространенными из них являются соль или хлорид натрия, а также соединения калия сильвит (или хлорид калия) и карналлит (гексагидрат хлорида калия-магния). Также подсчитано, что существует около двух тысяч органических соединений хлора.
Хлор имеет два стабильных изотопа хлор-35 и хлор-37, причем хлор-35 составляет примерно 3 из каждых 4 встречающихся в природе атомов хлора. Хлор-36 также известен в природе и представляет собой радиоактивный изотоп с периодом полураспада около 30 000 лет.
Хлор играет важную роль в синтетической органической химии, участвуя в трех наиболее распространенных механизмах реакций. В первой из них, фотохимической реакции замещения, хлор реагирует с алканом, замещая один из атомов водорода, присоединенных к углероду, образуя хлоралкан.Эта радикальная реакция инициируется использованием солнечного или ультрафиолетового света для расщепления двухатомного хлора на два радикала.
Хлор также может реагировать с алкенами по механизму электрофильного присоединения. На этот раз два атома хлора присоединяются к молекуле через богатую электронами углерод-углеродную двойную связь. Эту реакцию необходимо проводить в темноте, чтобы избежать осложнений с конкурирующими свободнорадикальными заменами.
Третьим распространенным механизмом является электрофильное замещение, которое происходит, когда хлор реагирует с бензольным кольцом, замещая атом водорода с образованием хлорбензола и хлороводорода.Эта реакция наиболее известна как реакция Фридаля-Крафтса.
Хлор также имеет множество промышленных применений. Включая производство сыпучих материалов, таких как изделия из отбеленной бумаги, пластики, такие как ПВХ, и растворители тетрахлорметан, хлороформ и дихлорметан. Он также используется для изготовления красителей, текстиля, лекарств, антисептиков, инсектицидов и красок.
Однако наиболее известное его применение, вероятно, связано с изготовлением отбеливателей, таких как «Доместос», и с очисткой питьевой воды и воды в плавательных бассейнах, чтобы сделать их безопасными для использования, и, конечно же, с его ролью в качестве боевого отравляющего вещества.
Обработка воды хлором началась в Лондоне после вспышки холеры в 1850 году, когда врач и новатор в области гигиены Джон Сноу определил источник вспышки в колодце в Сохо. Хлор до сих пор используется в большинстве очистных сооружений.
Сноу также использовал соединение хлора — хлороформ с формулой CHCl3 — в качестве анестетика при родах двух детей королевы Виктории.
Использование газообразного хлора в качестве химического оружия было впервые применено немецким химиком Фрицем Хабером, более известным своими работами с аммиаком.Впервые он был использован против солдат союзников в битве при Ипре во время Первой мировой войны. Хотя его быстро заменили более смертоносными фосгеном и горчичным газом, газообразный хлор использовался в качестве оружия еще в 2007 году в Ираке во время второй войны в Персидском заливе.
Хлор также когда-то использовался для производства ряда аэрозольных растворителей и хладагентов, называемых хлорфторуглеродами или CFC. Однако их использование было прекращено, как только стало очевидно, что в атмосфере эти соединения поглощают ультрафиолетовый свет и вызывают расщепление гомолитической связи с образованием свободного радикала хлора, который, в свою очередь, реагирует с озоном.
Это привело к снижению концентрации озона в так называемом озоновом слое и, следовательно, к снижению защиты тех из нас, кто живет на поверхности планеты, что делает нас более восприимчивыми к раку кожи. Итак, хлор — элемент Джекла и Хайда с чрезвычайно широким спектром применения.
Итак, хлор — элемент Джекла и Хайда с чрезвычайно широким спектром применения.
Крис Смит
Так что наденьте солнцезащитный крем. Тим Харрисон рассказывал историю об Элементе номер 17, и это хлор. Тим работает в лаборатории ChemLabs Бристольского университета.На следующей неделе штука, которая дает себе рентген.
Брайан Клегг
Этот серый металлический элемент испускает бета-частицы при распаде. Они могут вызывать радиоактивные повреждения сами по себе, но прометей, вероятно, наиболее опасен, потому что эти бета-частицы генерируют рентгеновские лучи, когда они сталкиваются с тяжелыми ядрами, заставляя образец прометия омывать свое окружение постоянным рентгеновским пучком низкой дозы. Первоначально он использовался для замены радия в светящихся циферблатах. Хлорид прометия был смешан с люминофорами, которые светятся желто-зеленым или синим цветом при попадании на них излучения.Однако по мере того, как опасность радиоактивных свойств элемента стала очевидной, он также был исключен из внутреннего рынка светящихся в темноте и теперь используется только в специальных приложениях.
Крис Смит
И вы можете услышать, каковы некоторые из этих применений, когда Брайан Клегг рассмотрит историю прометия в выпуске Chemistry in its Element на следующей неделе. В то же время другие элементы доступны из Chemistry в подкасте Element, который доступен в iTunes или в Интернете на сайте chemistryworld.орг/элементы. Я Крис Смит, большое спасибо за внимание и до свидания.
(Акция)
(Конец акции)
Элементы группы 5А: определение и свойства — видео и расшифровка урока
Свойства элементов группы 5A
Элементы объединены в группы, потому что они имеют сходные свойства, поэтому, прежде чем мы рассмотрим все варианты использования каждого элемента в группе 5A, давайте посмотрим, что у них общего.Кстати, группы — это вертикальные столбцы периодической таблицы.
За исключением азота, все эти элементы являются твердыми при комнатной температуре. Все они имеют 5 валентных электрона , которые являются самыми внешними электронами, наиболее удаленными от центра атома. Эти валентные электроны помогают определить, с кем элемент может связываться или прикрепляться, а также его свойства.
Все они имеют 5 валентных электрона , которые являются самыми внешними электронами, наиболее удаленными от центра атома. Эти валентные электроны помогают определить, с кем элемент может связываться или прикрепляться, а также его свойства.
Все элементы группы 5А становятся более металлическими по мере продвижения вниз по группе. На самом деле азот и фосфор, которые находятся в верхней части группы, вообще не являются металлами.Они относятся к категории неметаллов. Мышьяк является металлоидом, то есть обладает свойствами металлов и неметаллов. В зависимости от того, с кем вы разговариваете, сурьму можно классифицировать как металл или металлоид, а висмут — как металл.
Элементы приобретают или теряют свои валентные электроны, чтобы достичь стабильности. Например, азот может получить 3 электрона от другого элемента, что дает 8 валентных электронов (это магическое число для стабильности элемента).
Когда азот получает 3 электрона, он становится -3 анионом , что означает, что это атом с отрицательным зарядом. Вы также можете услышать, что эти заряды называются степенями окисления.
Вы также можете услышать, что эти заряды называются степенями окисления.
Иногда элементы группы 5А теряют электроны и образуют катионы или атом с положительным зарядом. В зависимости от элемента группы 5А может быть много степеней окисления, отличных от -3, включая: +5, +3, +2 и +1.
На этом я остановлюсь, но главная идея здесь в том, что элементы в группе 5А могут иметь много разных степеней окисления, так что, я думаю, у них есть это общее!
Элементы этой группы обычно образуют ковалентных связей с другими элементами, что означает, что электроны в этой связи являются общими.Но некоторые также могут образовывать 90 144 ионных связей 90 145 , что означает, что электроны захватываются и отдаются в связи.
Как вы начинаете видеть, члены этой группы довольно сильно различаются, так что давайте взглянем на отдельные элементы.
Отдельные элементы группы 5А
Наиболее важным элементом в этой группе, вероятно, является азот. Я уже упоминал, что он составляет около 78% воздуха, которым вы дышите, но вот забавный факт: в земной атмосфере содержится 4000 триллионов тонн азота! Для сравнения, это более 100 триллионов серых китов.
Как упоминалось ранее, азот является единственным членом этой группы, который является газом при комнатной температуре. На самом деле азот остается в виде газа, пока он не охладится примерно до -320 градусов по Фаренгейту! Вот почему жидкий азот такой холодный!
Из-за холода жидкий азот используется для быстрой заморозки продуктов, хранения клеток для исследований и в качестве хладагента. Но азот можно использовать и в нежидком виде, например, в удобрениях, во взрывчатых веществах и даже в красителях!
Азот также содержится в аминокислотах в организме.Примерно 20% человеческого тела состоит из белка, а аминокислоты являются строительными блоками белка. Таким образом, я думаю, вы могли бы сказать, что азот очень важен для вашего общего благополучия! Это также главная достопримечательность азотного цикла, когда азот перемещается из воздуха в почву и в организмы.
Так что, возможно, азот не так уж и неузнаваем. По мере продвижения вниз по группе следующим членом группы 5А является фосфор. Как и азот, фосфор является неметаллом, но в отличие от азота при комнатной температуре находится в твердом состоянии.
Как и азот, фосфор является неметаллом, но в отличие от азота при комнатной температуре находится в твердом состоянии.
Он более реакционноспособен, чем азот, и не встречается в чистом виде в природе, то есть связан с другими элементами. Если вы уделите минутку, держу пари, вы сможете найти что-то, что использовало фосфор в производственном процессе, в вашем собственном доме! Если вы заглянете в свой шкаф, вы можете найти пищевую соду и тонкий фарфор. Пищевая сода содержит фосфор, а тонкий фарфор использует фосфор в производственном процессе. Он также используется в фейерверках и в удобрениях.
Продолжим просмотр таблицы Менделеева.Далее мышьяк. В отличие от первых двух членов этой группы, мышьяк является металлоидом, и там, где азот и фосфор являются важными питательными веществами для человека, мышьяк может убить вас мгновенно! Видите, я говорил вам, что в этой группе много вариаций! Некоторые неметаллы, некоторые металлоиды, некоторые металлы, некоторые полезны для здоровья, а некоторые убивают вас! Вы можете найти мышьяк в фейерверках, в лазерах, в камнях и, как вы могли догадаться. .. в ядах.
.. в ядах.
Продолжая движение по группе, мы приземляемся на сурьму.Теперь мы действительно входим в незнакомое с сурьмой. Я бы сказал, что это определенно не нарицательное имя, но, верьте или нет, когда-то из-за него велась война (но мы вернемся к этому позже).
Сурьма немного сбивает с толку. Некоторые люди классифицируют его как металл, но, поскольку он не всегда ведет себя как металл, некоторые люди классифицируют его как металлоид. Например, в отличие от обычных металлов, он плохо проводит электричество и тепло. Сурьма используется по-разному, например, в качестве ингредиента в батареях и антипиренах.Его можно найти в форме, называемой антимонитом, которая представляет собой сурьму, связанную с атомами серы. В Древнем Египте антимонит смешивали с жиром для макияжа глаз!
Подробнее об этой войне. Так что, возможно, я немного ввел вас в заблуждение. Не было настоящей войны, где люди физически сражались. Войны за сурьму произошли в 17 веке, когда химики во Франции и Германии спорили, является ли сурьма ядом или ингредиентом в медицине. Хотя они не нападали друг на друга физически, Войны сурьмы получили свое название, потому что они нападали друг на друга с помощью пера через письменные документы и статьи.И если вам интересно, сурьма токсична, так что я думаю, это немного прискорбно для тех, кто использовал ее в качестве лекарства.
Хотя они не нападали друг на друга физически, Войны сурьмы получили свое название, потому что они нападали друг на друга с помощью пера через письменные документы и статьи.И если вам интересно, сурьма токсична, так что я думаю, это немного прискорбно для тех, кто использовал ее в качестве лекарства.
Последним элементом является висмут, беловато-розовый металл. Даже если вы, вероятно, не слышали об этом, вы, вероятно, использовали его раньше! Он добавляется в косметику и входит в состав лекарств от расстройства желудка.
Резюме урока
Теперь, когда вы знаете немного больше об этих не очень известных элементах, давайте рассмотрим некоторые важные идеи.
- Элементы группы 5А содержат 5 валентных электронов
- Имеют несколько различных степеней окисления
- Они обычно образуют ковалентные связи, но могут также образовывать ионные связи
- Они включают неметаллы, металлоиды и металлы
- Все твердые вещества при комнатной температуре, кроме азота
Итак, от окружающего вас воздуха до состава древних египтян, эта группа элементов на самом деле довольно интересна! Так что, подобно кислороду, хлору и олову, возможно, вы сможете использовать их в своем повседневном языке. Я слышу это сейчас:
Я слышу это сейчас:
- О, азот так приятно действует на мою кожу!
- Тебе не нравится этот оттенок макияжа? В нем много висмута!
- Фейерверк на основе фосфора был просто прекрасен
Я мог бы продолжать и продолжать!
Результаты обучения
Теперь, когда вы закончили этот урок, решите следующие задачи:
- Назовите элементы группы 5A периодической таблицы
- Понять общие свойства этих элементов
- Поймите, почему азот отличается от других членов группы 5А
- Охарактеризуйте элементы, включенные в группу 5А
Основная группа Химия – обзор
2.2.4.2 Стратегии синтеза и отдельные методы
Достижения в стратегиях расширения кольца, индуцированных аза-клайзеновской перегруппировкой: (17AJOC1117).
Успехи в синтезе ароматических и гетероароматических карбоновых кислот и их эфиров: (17ZOK1101).
Применение шестичленных кольцевых продуктов реакций циклометаллирования: (17JOM(848)184).
Каталитические стратегии диастереодивергентного синтеза: (17CEJ6464).
Каталитический синтез хиральных органогетероатомных соединений кремния, фосфора и серы посредством асимметрической функционализации С–Н, катализируемой переходными металлами: (17CCR(330)37).
Имидирование C–H: отдельная перспектива образования связи C–N: (17OBC1282).
Конъюгированные добавки литийорганических соединений к олефинам с низким содержанием электронов: простой и полезный подход к синтезу сложных молекул: (17COC190).
Конвергентный синтез конденсированных кольцевых систем в больших полициклических эфирах: (17YZ1095).
Пересечение кольца: путь нитрозоеновой реакции (главным образом, данные группы авторов): (17SL762).
Циклизация, катализируемая трифлатом висмута(III): (17EJOC761).
Декарбоксилирование как ключевой этап в реакциях образования связи C–C: (17CEJ7382).
Дизайн и синтез спироциклов с использованием метатезиса, циклоприсоединения и других процессов: (17EJOC5316).
Диалкилдицианофумараты и дицианомеаты как универсальные строительные блоки для синтеза 5- и 6-членных гетероциклов и механистических исследований: (17BJOC2235).
От экологически чистых многоразовых комплексов на основе рутения с ионными метками к промышленно значимым гомогенным катализаторам: к устойчивому метатезису олефинов (главным образом, результаты авторов): (17SL773).
Гликолурилы в синтезе конденсированных полигетероциклических соединений: (17KGS116).
Гетерогенно-катализируемый синтез гетероциклических соединений: (17АНС(121)173).
Йодоаминирование алкенов и йодаминоциклизация в синтезах различных гетероциклов: (17S981).
ipso — Циклизация: новый инструмент для многофункциональных спироциклогексадиенонов: (17OBC3130).
Катализируемое металлами азидирование органических молекул: (17EJOC1152).
Современные аспекты перегруппировки Смайлса, внутримолекулярной реакции S N Ar, разрыва одинарной связи C–X и образования новой связи C–X или C–C посредством замены ipso : (17CEJ8992).
Стратегия азотирования для синтеза N-содержащих соединений: (17MI9).
Опосредованные литием органические реакции циклизации для доступа к гетеро- и карбоциклам: (17NJC7824).
Прогресс в легкой форме Csp 3 –Дегидрирующая или (моно)окислительная функционализация Н-связи: (17OBC1294).
Последние достижения в области органокаталитического энантиоселективного гидрирования с переносом: (17OBC2307).
Последние достижения в области асимметрического синтеза гетероциклов, катализируемого родием: (17OBC1029).
Реакция Риттера для синтеза гетероциклов: (17KGS1167).
2.2.4.2.1 Общие проблемы
Достижения в области химии фосфасилена (аналог имина, содержащий высокореакционноспособную двойную связь SiP): (17CEJ12014).
Циклизация винил- и арилазидов в пирролы, индолы, карбазолы и родственные конденсированные пирролы: (17OR(92)413).
Энантиоселективный синтез атропоизомеров с пятичленным кольцом: (17CC12385).
Ферментативное галогенирование: своевременная стратегия региоселективной активации C–H: (17CEJ12064).
Зеленый синтез гетероциклов промышленного значения. 5-Гидроксиметилфурфурол в качестве базового химического вещества: (17AHC(121)247).
N-гетероциклические карбены: от лабораторных диковинок до эффективных синтетических средств: (17MI12).
Гетеромультиметаллический катализ для устойчивого органического синтеза: (17CSR7399).
Многостадийный органический синтез: Руководство по экспериментам: (17MI11).
Новые механистические интерпретации реакционной способности нитрона: (17OBC3364).
Последние достижения в получении и характеристике Te,N-содержащих гетероциклов: (17MI13).
Региодивергентный катализ: мощный инструмент селективного катализа: (17CEJ19).
Подход ретросинтеза для биокатализа в органическом синтезе: (17CEJ12040).
Стратегия и тактика в органическом синтезе: (17МИ8).
Синтез и применение солей циклического диарилиодония для одностадийной бифункционализации: (17EJOC3023).
Синтез гетероциклов реакциями метатезиса: (17THC(47)1).
Синтез полностью арилированных (гетеро)аренов: (17CC1568).
Синтез полициклических (гетеро)ароматических соединений посредством циклизации Фриделя-Крафтса/Брэдшера: (17KGS11).
Синтез гетероциклов, содержащих связи Se–N + и Te–N + : (17KGS1061).
Синтез замещенных бензилов [ди(гет)арил-1,2-дикетонов] окислением диарилалкинов: (17S504).
Соли винилфосфония и 2-аминовинилфосфония – получение и применение в синтезе карбо- и гетероциклических систем: (17BJOC2710).
2.2.4.2.2 Синтетическое применение фотореакций и альтернативного подвода энергии
Электрохимический синтез гетероциклов посредством каскадных реакций: (17COC1427).
Синтетические органические электрохимические методы с 2000 г.: На пороге возрождения: (17CRV13230).
Различные фотохимические процессы в синтезе гетероциклов: (17AG(E)16126, 17COS398, 17COS972, 17CRV13353, 17EJOC2008, 17EJOC2072, 17MI14, 17OBC9954).
2.2.4.2.3 Синтетическое применение реакций, катализируемых металлами
Общие данные о реакциях, катализируемых металлами, предположительно катализируемых переходными металлами: 17CRV8649, 17CRV8864, 17CRV8908, 17CRV8977, 17CRV9163, 17CRV9247, 17CRV9333, 17CRV9404, 17CRV13039, 17CSR761, 17CSR1103, 17CSR4135, 17CSR4299, 17CSR4845, 17S2361, 17T4011).
Стратегии катализируемой палладием ненаправленной и направленной функционализации связи C–H: (17MI10).
Катализируемая кобальтом функционализация связи C–H: (17CC3165, 17CCR(350)117, 17S1419).
Избранные катализируемые медью реакции образования связей C–N, C–O, C–S и C–C: (17AG(E)16136, 17CCR(353)1, 17COC660, 17JOC11311, 17S225, 17S1905, 17S5081) .
Катализ золота в органических превращениях: (17AG(E)1994, 17CEJ467, 17COC1530, 17OR(92)1, 17SC735, 17SL2230, 17UK689).
Катализируемая железом активация связи C–H и образование связи C–N: (17CRV9086, 17T1769).
Табурет для фортепиано (полусэндвич) N-гетероциклические карбеновые комплексы железа: синтез, реакционная способность и каталитическое применение: (17CCR(352)1).
Висмуторганические реагенты: синтез, свойства и применение в органическом синтезе: (17S1707).
Рутениевые инденилиденовые катализаторы в реакциях метатезиса: (17COS1022).
Последовательные и повторяющиеся реакции кросс-сочетания, катализируемые Pd, в органическом синтезе: (17MC3).
Катализируемые индием(III) превращения алкинов: реакции карбо- и гетероциклизации: (17S4931).
Катализируемый иридием асимметричный, ориентированный на мишень и атомно-эффективный синтез: (17ACR2539, 17YGK421).
Настройка оптоэлектронных свойств фосфоресцентных комплексов иридия(III): (17CC807).
Соединения молибдена в органическом синтезе: (17UK128).
Различные синтезы, катализируемые палладием: (17ACR1114, 17AHC(121)207, 17AJOC27, 17AJOC636, 17CC6544, 17CEJ2973, 17EJOC7204, 17S1767, 17S2803, 17S44G3, 18).
Синтез несимметричных соединений HetAr–X–HetAr’ (X = O, S, CH 2 ), а также соединений HetAr–F с помощью катализируемых родием реакций гетероарильного обмена: (17H(94)2179).
Энантиоселективное, катализируемое родием 1,4-присоединение борорганических реагентов к электронодефицитным алкенам: (17OR(93)1).
Недавние достижения в катализируемом рутением (II) хелатировании с помощью C–H олефинирования замещенных ароматических соединений, алкенов и гетероароматических соединений с алкенами по пути депротонирования: (17CC8931).
Sc(OTf) 3 катализирует реакции образования связи С–С и С–гетероатом: (17ARK(1)25).
Катализируемый оловом синтез N-гетероциклов с использованием изоцианатов: (17YGK757).
Твердые цинкорганические пивалаты, в частности, арил, бензил, гетероарил, аллил цинка пивалаты: новый класс цинкорганических соединений со значительно повышенной устойчивостью к воздуху и влаге: (17S3215).
Каталитическая деароматизация N-гетероаренов соединениями кремния и бора: (17AG(E)7720).
Дигапто-координированные деароматизаторы группы 6 для органического синтеза (2005–2017): 17CRV13721.
2.2.4.2.4 Синтез гетероциклов посредством реакций циклоприсоединения и многокомпонентных реакций
Полностью углеродные (4 + 2) аннелирования, катализируемые N-гетероциклическими карбенами: (17SL415).
Реакции циклоприсоединения и циклизации в построении хиральных и ахиральных карбо- и гетероциклов: (17ACR2621, 17CSR1080, 17CSR5425, 17EJOC2561, 17EJOC4512, 17SL1695).
Биоортогональные циклоприсоединения: вычислительный анализ с использованием модели искажения/взаимодействия и предсказания реактивности: (17ACR2297).
Каскадные реакции с участием ароматических N-гетероциклов: образование связи C–N как ключевой шаг к синтезу N-конденсированных полициклических гетероциклов: (17COC1342).
Ацетилиды металлов в реакциях циклоприсоединения: (17S1168).
Многокомпонентные реакции Манниха: общие аспекты, методология и приложения: (17T6977).
Сиднон-алкиновое циклоприсоединение: Применение в синтезе и биоконъюгации: (17CC11515).
Синтез конденсированных фуранов и тиофенов посредством рутениево-катализируемого переноса атома [2 + 2 + 1] циклоприсоединения α,ω-диинов (обзор исследований группы авторов): (17SL1250).
Достижение молекулярной сложности с помощью стереоселективных множественных домино-реакций, стимулируемых органическим катализатором на основе вторичного амина: (17ACR2809).
Дильса-Альдера и формальные реакции циклоприсоединения Дильса-Альдера инаминов и амидов: (17EJOC6816).
орто- -Хинонметиды как ключевые промежуточные соединения в каскадных гетероциклизациях: (17UK625).
Последние разработки в области синтеза MCR пиридопиримидинов и спиропиридопиримидинов: (17JHC1700).
Катализируемая переходными металлами функционализация связи C–H в многокомпонентных реакциях: инструмент для молекулярного разнообразия: (17OBC9031).
Каскадные реакции на основе изоцианидов в синтезе азагетероциклов: Брак по расчету: (17COC1440).
2.2.4.2.5 Прочие методы
Обновленная информация о прямой функционализации связи C–H азотсодержащих конденсированных гетероциклов: (17S4562).
Применение 3-метилиден- и 3-(монозамещенных) алкилиденоксиндолов в синтезе гетероциклических соединений: (17СОС1292).
Перегруппировка Димрота N-, O-, S-, Se-гетероциклов — старый, но не устаревший: (17COC2515).
Гетероциклизация карбокси- и сульфаниламидов путем окислительного присоединения к ненасыщенным субстратам: (17IZV2212).
Сульфенилирование связей C–H для образования связи C–S в условиях отсутствия металлов: (17EJOC6576).
Сульфонилгидразиды как источники сульфонила в органическом синтезе, в частности, гетероциклов: (17TL487).
Последние достижения в каталитических реакциях борилирования C–H: (17T7123).
Путь управления: перегруппировка Кетене-Кляйзена — 1978–2016: (17T2173).
Последние достижения в реакциях карбонилирования: Личный кабинет: (17SL175).
Последние достижения в области арилирования и алкенилирования связей N–O: (17S933).
Синтез гетероциклов, катализируемый наночастицами оксида железа: (17H(94)595).
Новые синтетические реакции с использованием йодтитанирующей способности тетраиодида титана: (17YGK1226).
Новые алкилирующие реагенты, разработанные по характеристикам 1,3,5-триазинов: (17YGK1023).
Модификация реакции Фишера для синтеза гетероциклов и природных продуктов: (17SL1).
2.2.4.4 Синтез колец из негетероциклических соединений
Применение винилазидов в химическом синтезе: последнее обновление: (17JOC11981).
Циклизация с образованием малых, средних и больших колец с использованием катализируемых и некатализируемых азид-алкиновых циклоприсоединений: (17EJOC4678).
Циклизация алкоксиалленов: механизмы, промежуточные продукты, продукты — решенные и нерешенные проблемы с уникальными строительными блоками алленов: (17S3291).
Эфиры α-диазооксима для синтеза N-гетероцикла: (17CC6054).
N,N -Диметилиденаминокетоны в качестве синтонов для различных гетероциклов: (17RSCA14562).
Этилидентиосемикарбазиды в гетероциклическом синтезе: (17COS3).
Молекула Лоусона (2-гидроксинафталин-1,4-дион): достижения в области синтеза и реакций: (17JHC2155).
Ионы нитрила – синтез и применение: (17OBC10134).
Фосфонирование функциональных групп C = X с использованием алкилфосфитов: (17SC1631).
Реагенты для синтеза гетероаренов: (17MI15).
Последние достижения в реакциях арилсульфонилизоцианатов: (17OBC1753).
N -(Силилметил)мочевины: синтез, свойства и строение: (17IZV2199).



 Он может определить химическую активность молекулы при заданном наборе условий
Он может определить химическую активность молекулы при заданном наборе условий Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. Олово и свинец входят в число
древнейшие известные металлы.
Олово и свинец входят в число
древнейшие известные металлы.