Глава 14. Термодинамика
Изучение энергетических превращений в молекулярных системах составляет содержание термодинамики. Для решения задач на термодинамику необходимо знать определения внутренней энергии, количества теплоты, теплоемкости и ряда других величин. Необходимо также понимать и уметь использовать в простейших случаях первый закон термодинамики как балансовое соотношение, описывающее процессы превращения энергии из одних форм в другие. Также нужно знать основные свойства процессов перехода вещества из одних агрегатных состояний в другие. Рассмотрим эти вопросы.
Внутренней энергией тела называется сумма кинетической энергии молекул и потенциальной энергии их взаимодействия друг с другом. Для жидкостей и твердых тел из-за сильного взаимодействия молекул друг с другом вычислить внутреннюю энергию не удается. Внутреннюю энергию можно вычислить только для идеальных газов, в которых можно пренебречь энергией взаимодействия молекул друг с другом и считать, что внутренняя энергия равна сумме кинетических энергий молекул.
(14.1) |
где — количество вещества газа (число молей), — универсальная газовая постоянная, — абсолютная температура. Заметим, что с помощью закона Клапейрона-Менделеева формула (14.1) может быть преобразована к виду
(14.2) |
где — давление, — объем газа.
Внутренняя энергия тела может измениться при теплообмене, когда молекулы тела сталкиваются с более быстрыми или более медленными молекулами других тел и получают от них или отдают им энергию, или в процессе совершения механической работы над этим телом внешними силами. В связи с эти вводят следующие определения. Количеством теплоты, переданным некоторому телу, называют энергию, переданную этому телу в процессе хаотических столкновений молекул.
(14.3) |
где — изменение внутренней энергии тела, — количество переданной этому телу теплоты. Поскольку изменение внутренней энергии тела может быть и положительным , и отрицательным , из закона (14.3) следует, что количеству теплоты следует придать алгебраический смысл: если энергия передается телу, количество переданной этому телу теплоты нужно считать положительным , если забирается — отрицательным .
Внутренняя энергия тела изменяется при сжатии тела, трении и ряде других механических процессах. В этом случае на изменение внутренней энергии расходуется работа , совершаемая над телом внешними силами
(14. |
(конечно, здесь подразумевается, что работа не расходуется на энергию движения тела как целого, а только на изменение внутреннего движения, т.е. все перемещения тела как целого или его макроскопических частей должны происходить бесконечно медленно). Очевидно, работа внешних сил положительна, если эти силы сжимают тело и его объем уменьшается, и отрицательна — если объем тела увеличивается. В первом случае, как это следует из (14.4), внутренняя энергия тела возрастает (), во втором убывает ().
Одновременно с внешними силами при сжатии или расширении тел совершают работу и сами эти тела. Рассмотрим, например, газ, находящийся в цилиндрическом сосуде и отделенный от атмосферы поршнем (см. рисунок). И при сжатии, и при расширении газа силы, действующие на поршень со стороны газа, совершают над ним работу (в первом случае отрицательную, во втором положительную). При этом, поскольку поршень перемещается бесконечно медленно, силы, действующие на него со стороны газа и внешние силы практически равны друг другу как при сжатии, так и при расширении газа (в противном случае в балансе энергии необходимо было учитывать кинетическую энергию, приобретенную поршнем). Поэтому работа, совершенная газом и внешними силами над газом равны по величине, но отличаютсязнаком
Поэтому работа, совершенная газом и внешними силами над газом равны по величине, но отличаютсязнаком
При решении задач на термодинамику следует помнить одно важное свойство работы газа, которое во многих случаях позволяет ее легко вычислить. Работа газа в некотором процессе численно равна площади фигуры под графиком зависимости давления от объема в этом процессе. В частности в изобарическом процессе при давлении , в котором объем газа изменился от значения до значения , газ совершает работу (см. рисунок; площадь графика, соответствующая работе, выделена):
(14.5) |
где — количество вещества газа, — изменение температуры в рассматриваемом процессе.
Если газ участвует в процессе, в котором одновременно имеет место и теплообмен, и совершается работа, то справедливо соотношение
(14. |
которое называется первым законом термодинамики (здесь — работа газа).
Закон (14.6) позволяет найти одну из входящих в него величин, если заданы две других. Если задается только одна из величин, входящих в закон (14.6), но как-то определяется процесс, происходящий с газом, то две остальные величины могут быть определены. Например, в изохорическом процессе не совершается работа, поэтому
(14.7) |
В изотермическом процессе не меняется внутренняя энергия газа, поэтому
(14.8) |
(14.9) |
В изобарическом процессе есть связь между изменением внутренней энергии газа и его работой. Из формул (14.1) и (14.5) заключаем, что работа одноатомного идеального газа и изменение его внутренней энергии в изобарическом процессе связаны соотношением
Из формул (14.1) и (14.5) заключаем, что работа одноатомного идеального газа и изменение его внутренней энергии в изобарическом процессе связаны соотношением
(14.10) |
Для характеристики процессов нагрева-остывания тела вводят понятие теплоемкости тела , которая определяется как
(14.11) |
где — количество теплоты, сообщенное телу в некотором процессе, — изменение его температуры в этом процессе. Подчеркнем, что и в формуле (14.11) не независимы, а связаны друг с другом: — это то изменение температуры, которое происходит благодаря сообщению телу количества теплоты . Поэтому теплоемкость (14.11) не зависит от и , а зависит от свойств тела и происходящего с ним процесса.
Если тело однородно, то его теплоемкость пропорциональна его массе . Поэтому отношение является характеристикой вещества тела и называется его удельной теплоемкостью. Удельная теплоемкость представляет собой экспериментально измеряемую (табличную) характеристику веществ. Из определения удельной теплоемкости следует, что если телу массой , изготовленному из вещества с удельной теплоемкостью , сообщить количество теплоты , то будет справедливо соотношение
Поэтому отношение является характеристикой вещества тела и называется его удельной теплоемкостью. Удельная теплоемкость представляет собой экспериментально измеряемую (табличную) характеристику веществ. Из определения удельной теплоемкости следует, что если телу массой , изготовленному из вещества с удельной теплоемкостью , сообщить количество теплоты , то будет справедливо соотношение
(14.12) |
Приведем теперь решения данных в первой части задач.
В задаче 14.1.1 внутренняя энергии газа увеличится согласно формуле (14.1) — ответ 1.
Для ответа на вопрос задачи 14.1.2 удобно использовать формулу для внутренней энергии газа в виде (14.2). По этой формуле находим, что внутренняя энергия увеличилась в 3/2 раза (ответ 2). Обратим внимание читателя, что причина изменения давления и объема может быть любой — ответ от этого не зависит. Может измениться или температура газа, или количество вещества, или и то и другое одновременно.
Может измениться или температура газа, или количество вещества, или и то и другое одновременно.
Поскольку температура и количество вещества газа не изменялись в рассматриваемом в задаче 14.1.3 процессе, внутренняя энергия газа не изменилась (ответ 3).
В задаче 14.1.4
следует воспользоваться определением теплоемкости (14.11). Для этого рассмотрим, например, ин-тервал времени , выделенный жирным на оси времени (см. рисунок). За этот интервал оба тела получили одинаковое количество теплоты , поскольку нагреватели одинаковы. Изменение температур тел и можно определить по графику — эти величины отмечены фигурными скобками на оси температур. Поскольку из формулы (14.11) заключаем, что — ответ 2.В задаче 14.1.5 следует воспользоваться определением удельной теплоемкости. По формуле (14.12) находим
(ответ 1).
Для совершения работы необходимо механическое движение. Поскольку объем газа в задаче 14.1.6 не меняется, механическое движение отсутствует, работа газа равна нулю (ответ 4).
Поскольку объем газа в задаче 14.1.6 не меняется, механическое движение отсутствует, работа газа равна нулю (ответ 4).
Применяя к рассматриваемому в задаче 14.1.7
В изотермическом процессе не меняется внутренняя энергия идеального газа. Поэтому , и работа , совершенная над газом, определяется соотношением (14.4), (14.6): (задача 14.1.8 — ответ 2).
Адиабатический процесс происходит без теплообмена с окружающими телами: . Поэтому из первого закона термодинамики (14.6) получаем в задаче 14.1.9 для работы газа (ответ 2).
Применяя первый закон термодинамики (14.6) к процессу, происходящему с газом в задаче 14.1.10, найдем, что внутренняя энергия газа увеличилась на 10 Дж (ответ 2).
Для решения задачи 14. 2.1 можно использовать то обстоятельство, что работа газа численно равна площади фигуры, ограниченной графиком зависимости давления от объема и осью объемов. Из рисунка следует, что наибольшей является площадь под графиком процесса 1. Поэтому бóльшую работу газ совершает в процессе 1 (ответ 1).
2.1 можно использовать то обстоятельство, что работа газа численно равна площади фигуры, ограниченной графиком зависимости давления от объема и осью объемов. Из рисунка следует, что наибольшей является площадь под графиком процесса 1. Поэтому бóльшую работу газ совершает в процессе 1 (ответ 1).
В задаче 14.2.2 следует применить ко всем трем процессам, графики которых даны на рисунке к решению предыдущей задачи, первый закон термодинамики (14.6) . Учитывая, что начальная и конечная температура газа во всех трех процессах одинакова, и, следовательно, одинаковы изменения внутренней энергии газа , а работа наибольшая в процессе 1 (см. решение предыдущей задачи), заключаем, что газ получил большее количество теплоты в процессе 1 (ответ 1).
Работа газа положительна, если газ расширяется. Для доказательства этого утверждения представим газ в сосуде, ограниченном подвижным поршнем. Если газ расширяется, то и перемещение поршня и сила, действующая на него со стороны газа, направлены одинаково, поэтому работа газа положительна. При сжатии газа его работа отрицательна. Поэтому в задаче 14.2.3 работа газа положительна в процессе 3 (ответ 3).
При сжатии газа его работа отрицательна. Поэтому в задаче 14.2.3 работа газа положительна в процессе 3 (ответ 3).
Так как графики процессов 1–2 и 3–4 в задаче 14.2.4 — прямые, проходящие через начало координат, эти процессы — изохорические, и газ не совершает в них работу. А поскольку изменение внутренней энергии газа в этих процессах одинаково, то одинаковы и количества теплоты, сообщенные газу в этих процессах (ответ 3).
Задача 14.2.5 аналогична предыдущей. Рассматриваемый процесс — изохорический, поэтому изменение внутренней энергии газа равно сообщенному количеству теплоты = 100 кДж (ответ 2).
Вычисляя площадь под графиком процесса в задаче 14.2.6, находим работу газа (ответ 2).
В условии задачи 14.2.7 дано количество теплоты , которое забрали у газа. Первый закон термодинамики, в который входит эта величина, имеет вид
где — работа, совершенная над газом в рассматриваемом процессе. Подставляя в эту формулу данные в условии величины, находим = –5 Дж (ответ 1).
Подставляя в эту формулу данные в условии величины, находим = –5 Дж (ответ 1).
Чтобы понять, расширялся или сжимался газ в рассматриваемом в задаче 14.2.8 процессе, из первого закона термодинамики найдем работу газа: если она окажется положительной, газ расширялся, если отрицательной — сжимался. Из закона (14.6) находим
Поэтому газ сжимался (ответ 1).
Чтобы найти долю количества теплоты, которая пошла на увеличение внутренне энергии газа в изобарическом процессе (задача 14.2.9) воспользуемся формулой (14.5) для работы газа в этом процессе . Поскольку изменение внутренней энергии одноатомного идеального газа равно , заключаем, что изменение внутренней энергии газа составляет 3/2 от его работы. Поэтому 2/5 количества теплоты, сообщенного газу в изобарическом процессе тратится на работу, 3/5 — на изменение внутренней энергии газа (ответ 3).
Чтобы найти теплоемкость газа в изотермическом процессе (задача 14. 2.10), применим к этому процессу определение теплоемкости (14.11)
2.10), применим к этому процессу определение теплоемкости (14.11)
Поскольку в изотермическом процессе при ненулевом количестве сообщенной теплоты, то теплоемкость газа равна бесконечности. Это означает следующее — в изотермическом процессе газу сообщают теплоту, а он не нагревается, что и означает бесконечную теплоемкость газа (теплота расходуется только на совершение работы).
Внутренняя энергия — О’Пять пО физике!
Согласно MKT все вещества состоят из частиц, которые находятся в непрерывном тепловом движении и взаимодействуют друг с другом. Поэтому, даже если тело неподвижно и имеет нулевую потенциальную энергию, оно обладает энергией (внутренней энергией), представляющей собой суммарную энергию движения и взаимодействия микрочастиц, составляющих тело. В состав внутренней энергии входят:
- кинетическая энергия поступательного, вращательного и колебательного движения молекул;
- потенциальная энергия взаимодействия атомов и молекул;
- внутриатомная и внутриядерная
энергии.

В термодинамике рассматриваются процессы при температурах, при которых не возбуждается колебательное движение атомов в молекулах, т.е. при температурах, не превышающих 1000 К. В этих процессах изменяются только первые две составляющие внутренней энергии. Поэтому под внутренней энергией в термодинамике понимают сумму кинетической энергии всех молекул и атомов тела и потенциальной энергии их взаимодействия.
Внутренняя энергия тела определяет его тепловое состояние и изменяется при переходе из одного состояния в другое. В данном состоянии тело обладает вполне определенной внутренней энергией, не зависящей от того, в результате какого процесса оно перешло в данное состояние. Поэтому внутреннюю энергию очень часто называют функцией состояния тела.
Внутренняя
энергия — величина, характеризующая термодинамическое состояние тела. Каждое
тело состоит из частиц, которые постоянно движутся и взаимодействуют друг с
другом. Внутренняя энергия тела является суммой кинетической энергии движения
частиц вещества и потенциальной энергии их взаимодействия.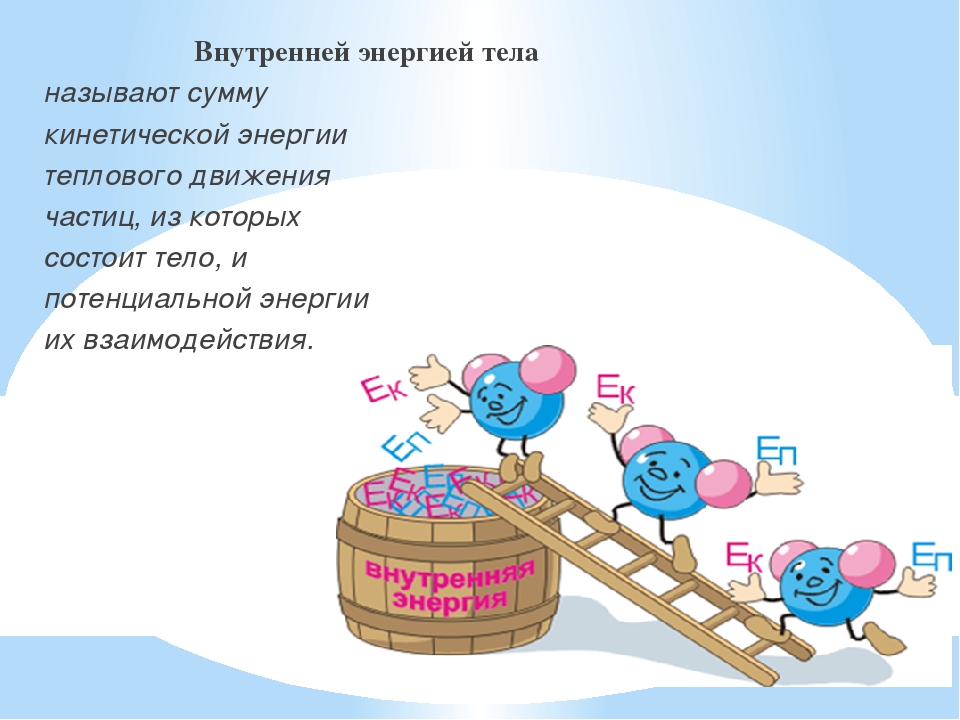
Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве и обозначается i.
Как видно, положение материальной точки (одноатомной молекулы) задаётся тремя координатами, поэтому она имеет три степени свободы: i = 3
Внутренняя энергия зависит от температуры. Если изменяется температура, значит изменяется внутренняя энергия.
Изменение внутренней энергии
Для решения практических вопросов существенную роль играет не сама внутренняя энергия, а ее изменение ΔU = U2 — U1. Изменение же внутренней энергии рассчитывают, исходя из законов сохранения энергии.
Внутренняя энергия тела может изменяться двумя способами:
1. При совершении механической работы.
а) Если
внешняя сила вызывает деформацию тела, то при этом изменяются расстояния между
частицами, из которых оно состоит, а следовательно, изменяется потенциальная
энергия взаимодействия частиц. При неупругих деформациях, кроме того,
изменяется температура тела, т.е. изменяется кинетическая энергия теплового
движения частиц. Но при деформации тела совершается работа, которая и является
мерой изменения внутренней энергии тела.
При неупругих деформациях, кроме того,
изменяется температура тела, т.е. изменяется кинетическая энергия теплового
движения частиц. Но при деформации тела совершается работа, которая и является
мерой изменения внутренней энергии тела.
б) Внутренняя энергия тела изменяется также при его неупругом соударении с другим телом. Как мы видели раньше, при неупругом соударении тел их кинетическая энергия уменьшается, она превращается во внутреннюю (например, если ударить несколько раз молотком по проволоке, лежащей на наковальне, — проволока нагреется). Мерой изменения кинетической энергии тела является, согласно теореме о кинетической энергии, работа действующих сил. Эта работа может служить и мерой изменения внутренней энергии.
в) Изменение внутренней энергии тела происходит под действием силы трения, поскольку, как известно из опыта, трение всегда сопровождается изменением температуры трущихся тел. Работа силы трения может служить мерой изменения внутренней энергии.
2. При помощи теплообмена.
Например, если тело поместить в пламя горелки, его температура изменится,
следовательно, изменится и его внутренняя энергия. Однако никакая работа здесь
не совершалась, ибо не происходило видимого перемещения ни самого тела, ни его
частей.
При помощи теплообмена.
Например, если тело поместить в пламя горелки, его температура изменится,
следовательно, изменится и его внутренняя энергия. Однако никакая работа здесь
не совершалась, ибо не происходило видимого перемещения ни самого тела, ни его
частей.
Изменение внутренней энергии системы без совершения работы называется теплообменом (теплопередачей).
Существует три вида теплообмена: теплопроводность, конвекция и излучение.
а) Теплопроводностью называется процесс теплообмена между телами (или частями тела) при их непосредственном контакте, обусловленный тепловым хаотическим движением частиц тела. Амплитуда колебаний молекул твердого тела тем больше, чем выше его температура. Теплопроводность газов обусловлена обменом энергией между молекулами газа при их столкновениях. В случае жидкостей работают оба механизма. Теплопроводность вещества максимальна в твердом и минимальна в газообразном состоянии.
б) Конвекция представляет собой теплопередачу нагретыми потоками жидкости или газа от одних
участков занимаемого ими объема в другие.
в)
Теплообмен при излучении осуществляется на расстоянии посредством
электромагнитных волн.
1. Найдите внутреннюю энергию 2 кг водорода при температуре 200 °С.
А) 6,1 кДж; Б) 6,1 МДж; В) 610 000 Дж.
2. Найдите внутреннюю энергию 5 м3 гелия при давлении 105 Па.
А) 7,5 МДж; Б) 7,5 кДж; В) 750 000 Дж.
3. Сравните внутреннюю энергию 32 г кислорода и 2 г водорода при температуре 23 °С.
А) UО > UН; Б) UО < UН ; В) UО = UН.
4. Сравните внутреннюю энергию 1 моля кислорода и 1 моля аргона при одной и той же температуре.
А) UО > UAr; Б) UО < UAr; В) UО = UAr.
5. От каких величин зависит внутренняя энергия газа?
А) только от Т; Б) только от V; В) от Т и V.
Тренажер 1
Тренажер 2
Тренажер 3
Тренажер 4
Тренажер 5
Энергия тела внутренняя — Энциклопедия по машиностроению XXL
В параграфе Новые количества… автор пишет … сводя вместе различные количества, введенные в физику учением о теплоте как движении, мы видим, что они суть энергия тела, внутренняя работа, живая сила температурного движения молекул, энтропия . [c.48]Сумма кинетических и потенциальных энергий атомов, молекул и других частиц называется внутренней энергией тела. Внутренняя энергия идеального газа пропорциональна его температуре. [c.33]
Таким образом, в результате работы тепловой машины Карно по прямому циклу в окружающей среде происходит изменение внутренней и внешней (кинетической или потенциальной) энергии тел. Внутренняя энергия рабочего тела не изменяется.
 [c.25]
[c.25]Тепловое излучение есть результат превращения внутренней энергии тел в энергию электромагнитных колебаний. При попадании тепловых лучей (волн) на другое тело их энергия частично поглощается им, снова превращаясь во внутреннюю. Так осуществляется лучистый теплообмен между телами. [c.90]
В начальный момент тело А имеет внутреннюю энергию температуру и величина W для него будет Wa тело В имеет внутреннюю энергию Eg, температуру Гд и величина W для него будет Wq. Для бесконечно малого количества теплоты, переданного от тела А к телу В, изменение внутренней энергии тела А может быть вычислено согласно уравнению (6-1) [c.190]
Изменение внутренней энергии тела В [c.190]
Внутренняя энергия является аддитивным или экстенсивным параметром, так как ее величина зависит от массы тела. Внутренняя энергия сложной системы равна сумме внутренних энергий ее отдельных составляющих, т. е.
[c. 54]
54]
Изменение внутренней энергии тела не зависит от пути процесса и целиком определяется начальным и конечным состоянием, т. е. [c.54]
Полученное уравнение является математическим выражением первого закона термодинамики. Оно формулируется так изменение внутренней энергии термодинамической системы равно алгебраической сумме полученной системой энергии в форме теплоты dq и совершенной ею внешней работы dl, или подведенная к рабочему телу энергия в форме теплоты расходуется на изменение внутренней энергии тела и на совершение телом внешней работы. [c.63]
Вся внешняя теплота расходуется только на изменение внутренней энергии тела. [c.90]
Часть сообщенной теплоты q , равная piv —vi), переходит в работу расширения, а другая часть идет на увеличение внутренней энергии тела. [c.92]
Как и в случае газа Ван-дер-Ваальса, энтропию твердого тела можно выразить через полную среднюю энергию атома и = E/N, где —внутренняя энергия тела. Величина и складывается из рассмотренной средней энергии колебаний и энергии связи
[c.63]
Величина и складывается из рассмотренной средней энергии колебаний и энергии связи
[c.63]
Рассмотрим теперь процесс установления теплового равновесия, т.е. выравнивание температуры с количественной точки зрения. Если сделать тепловой контакт между телами достаточно слабым, можно добиться, чтобы скорость изменения их температуры стала сколь угодно мала. При этом можно считать, что каждое тело само по себе все время находится в состоянии термодинамического равновесия . Эти состояния можно характеризовать соответствующими значениями энтропии, и 5 2, которые будут функциями внутренних энергий тел, 1] и (72> и их объемов, и 1 2- предыдущей главе мы видели на конкретных примерах, каким образом равновесная энтропия зависит от этих двух параметров. [c.73]
У обычных тел, внутренняя энергия которых непременно включает в себя кинетическую энергию частиц, такого максимума, очевидно, не существует.
 Их внутренняя энергия может быть сколь угодно велика. Поэтому они не могут иметь отрицательную абсолютную температуру. У спиновых же систем внутренняя энергия вовсе не связана с обычным движением частиц, и при заданных внешних условиях существует ее верхняя граница, которая и соответствует состоянию с Т — — 0.
[c.78]
Их внутренняя энергия может быть сколь угодно велика. Поэтому они не могут иметь отрицательную абсолютную температуру. У спиновых же систем внутренняя энергия вовсе не связана с обычным движением частиц, и при заданных внешних условиях существует ее верхняя граница, которая и соответствует состоянию с Т — — 0.
[c.78]Но внутренняя энергия тела тоже меняется, и независимо от изменения объема это приводит к изменению его энтропии на величину = дЗ/ди Аи. Входящая сюда частная производная имеет смысл, аналогичный вышеуказанному. [c.81]
Внутренняя энергия тел, принимающих участие в тепловых процессах, может изменяться как за счет работы внешних сил, так и вследствие теплообмена. В предьщущей главе мы уже рассматривали эти процессы по отдельности вообще же они могут идти одновременно. Поэтому закон сохранения энергии для каждого тела, участвующего в процессе, принято записывать в виде [c.101]
При еще более низких температурах существуют магнитные газы в парамагнитных твердых телах. Речь идет о веществах, частицы которых имеют произвольно ориентированные в отсутствие поля магнитные моменты, так что в среднем образец такого вещества не поляризован. При включении поля происходит ориентация элементарных магнитиков и вещество приобретает суммарный магнитный момент. Адиабатическое размагничивание таких тел эквивалентно адиабатическому расширению газа, так как работа размагничивания производится за счет внутренней энергии тела и оно должно охлаждаться. Для количественной характеристики процесса, основываясь на (9.30), введем функцию состояния, обобщенную энтальпию, Н = Н—УЖЖ, дифференциал которой при постоянном давлении и химическом составе системы
[c.163]
Речь идет о веществах, частицы которых имеют произвольно ориентированные в отсутствие поля магнитные моменты, так что в среднем образец такого вещества не поляризован. При включении поля происходит ориентация элементарных магнитиков и вещество приобретает суммарный магнитный момент. Адиабатическое размагничивание таких тел эквивалентно адиабатическому расширению газа, так как работа размагничивания производится за счет внутренней энергии тела и оно должно охлаждаться. Для количественной характеристики процесса, основываясь на (9.30), введем функцию состояния, обобщенную энтальпию, Н = Н—УЖЖ, дифференциал которой при постоянном давлении и химическом составе системы
[c.163]
Внешние силы, деформирующие упругое тело, совершают работу. При статическом нагружении работа внешних сил целиком обращается во внутреннюю энергию тела, называемую потенциальной энергией деформации. [c.181]
Закон взаимосвязи массы и энергии. Из формулы (7.7) следует, что приращение кинетической энергии частицы сопровождается пропорциональным приращением ее релятивистской массы. Вместе с тем известно, что при протекании различных процессов в природе одни виды энергии могут преобразовываться в другие. Например, кинетическая энергия сталкивающихся частиц может преобразоваться во внутреннюю энергию образовавшейся частицы. Поэтому естественно ожидать, что масса тела будет возрастать не только при сообщении ему кинетической энергии, но и вообще при любом увеличении общего запаса энергии тела независимо от того, за счет какого конкретного вида энергии это увеличение происходит.
[c.218]
Вместе с тем известно, что при протекании различных процессов в природе одни виды энергии могут преобразовываться в другие. Например, кинетическая энергия сталкивающихся частиц может преобразоваться во внутреннюю энергию образовавшейся частицы. Поэтому естественно ожидать, что масса тела будет возрастать не только при сообщении ему кинетической энергии, но и вообще при любом увеличении общего запаса энергии тела независимо от того, за счет какого конкретного вида энергии это увеличение происходит.
[c.218]
Два способа изменения внутренней энергии — теплопередача и совершение механической работы. Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. При механическом взаимодействии тел мерой энергии, переданной от одного тела к другому, является работа А. [c.95]
Первый закон термодинамики. Рассмотрим три тела — 1,2 и 3. Пусть между телом 1 и телом 2 осуществляется теплопередача, а между телом 1 и телом 3 происходит механическое взаимодействие (рис. 105). При теплопередаче количества теплоты Q внутренняя энергия тела 2 изменится на AU2——Q, а внутренняя энергия тела 3 в результате совершения работы изменится на Д /з= —А. В результате теплопередачи и механиче-
[c.95]
105). При теплопередаче количества теплоты Q внутренняя энергия тела 2 изменится на AU2——Q, а внутренняя энергия тела 3 в результате совершения работы изменится на Д /з= —А. В результате теплопередачи и механиче-
[c.95]
Отсюда изменение внут]1ен-ней энергии тела 1 равно сумме изменений внутренней энергии взаимодействующих с ним тел [c.95]
Удельная теплоемкость. Если процесс теплопередачи не сопровождается работой ( А = О), то на основании первого закона термодинамики количество теплоты Q равно изменению внутренней энергии тела hU [c.96]
Следует заметить, что плотность энергии электромагнитного поля внутри полости не равна объемной плотности тепловой энергии, сосредоточенной в находящихся там телах внутренней энергии, которая определяется тепловым движением частиц тела и зависит не только от температуры, но и от свойств тела). При невысокой температуре (например, 300 К) объемная плотность тепловой энергии тела на несколько порядков больше плотности энергии электромагнитного поля в полости, но в условиях равновесия соотношение между ними остается постоянным, так как тело получает от поля и отдает ему одну и ту же энергию. [c.400]
[c.400]
Входящий в (11,2) вектор А связан определенным образом с полным импульсом и с полной энергией жидкости, обтекающей движущееся в ней тело. Полная кинетическая энергия жидкости (внутренняя энергия несжимаемой жидкости постоянна) есть [c.49]
Тепловое излучение. Вокруг любого тела существует излучение, возникаюш,ее в результате испускания телом электромагнитных волн за счет внутренней (тепловой) энергии тела . Это излучение называют тепловым или, иначе, температурным. С ростом температуры тела плотность излучения увеличивается. Тепловое излучение наблюдается при любых температурах однако при невысоких температурах, например комнатных, испускаются практически лишь длинные (инфракрасные) электромагнитные волны. [c.36]
Отсюда изменение массы при изменении скорости равно живой силе, деленной на с Это указывает на тождественность массы и энергии для покоящегося наблюдателя (тс — внутренняя энергия тела) т=Е/с . Принцип сохранения массы превратился в принцип сохранения энергии.
[c.346]
Принцип сохранения массы превратился в принцип сохранения энергии.
[c.346]
В комнату с улицы вносится холодное тело. Показать, что при этом внутренняя энергия тела увеличивается за счет энергии наружного, а не комнатного воздуха и что при отоплении внутренняя энергия и энтропия комнатного воздуха уменьшаются. [c.86]
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объемом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы У аналогично внутренней энергии имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния [c.31]
Рассмотрим это уравнение первого закона термодинамики. В этом уравнении изменение внутренней энергии тела равно [c.42]
Таким образом, при принятых допущениях первый закон термодинамики говорит о том, что подводимая извне теплота идет на изменение внутренней энергии тела и на работу расширения. Полный дифференциал внутренней энергии по (2.7)
[c.43]
Полный дифференциал внутренней энергии по (2.7)
[c.43]
Предметом изучения термодинамики являются закономерности превращения энергии в различных физических, химических и других процессах можно сказать, что термодинамика представляет собой в самом общем смысле науку об энергии. Термодинамика не ограничивается анализом каких-либо отдельных или частных видов энергии, как это имеет место, например, в механике, где изучается лишь энергия механического движения (т. е. кинетическая и потенциальная энергия тела), но рассматривает все существующие виды энергии и всевозможные ее превращения. Отличительной чертой термодинамики является введение в совокупность исследуемых видов энергии внутренней энергии тел, что собственно и делает термодинамику общей наукой о превращениях энергии. Действительно, любой макроскопический процесс сопровождается изменением внутренней энергии участвующих в процессе тел, вследствие чего превращение внутренней энергии является наиболее общей особенностью макроскопических процессов. Так как внутренняя энергия обусловлена движением составляющих тело частиц, называемым тепловым, то содержание термодинамики можно формулировать как изучение теплового движения, понимаемого в самом широком смысле.
[c.7]
Так как внутренняя энергия обусловлена движением составляющих тело частиц, называемым тепловым, то содержание термодинамики можно формулировать как изучение теплового движения, понимаемого в самом широком смысле.
[c.7]
Исторически термодинамика возникла в результате анализа превращения теплоты в работу в паровых машинах со своего основания до наших дней изучение закономерностей превращения внутренней энергии тел в работу и теплоту и взаимных превращений теплоты и работы составляет главное содержание термодинамики. [c.7]
Чтобы установить физическое содержание функций и и I, сравним сначала уравнение (2.7) с уравнением (2.3), описывающим изменение полной энергии системы. Из этого сопоставления следует, что внутренняя энергия есть собственная энергия тела, присущая ему как таковому. [c.30]
При сжатии тела работа силы давления идёт на увеличение энергии тела внутренней — при пзоэнтропий-ном процессе и свободной — при изотермическом. Статич. сжатие, при к-ром тел1п-ра быстро выравнивается, относят обычно к изотермич. процессам. Если в результате сжатия темп-ра тела повышается, то в нём развивается большее Д. в., чем прп изотермпч, сжатии (при одинаковых нач. условиях и относительном изменении объёма).
[c.140]
Статич. сжатие, при к-ром тел1п-ра быстро выравнивается, относят обычно к изотермич. процессам. Если в результате сжатия темп-ра тела повышается, то в нём развивается большее Д. в., чем прп изотермпч, сжатии (при одинаковых нач. условиях и относительном изменении объёма).
[c.140]
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению попенциаль-ной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу 6L против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии [c.14]
Принято обозначать полную внутреннюю энергию тела буквой и (дж), а удельную внутреннюю энергию, отнесенную к 1 кг — и дж1кг). [c.54]
Согласно первому закону термодинамики, работа изменения объема в адиабатном процессе получается за счет убыли внутренней энергии тела при onst
[c. 97]
97]
В каждом реальном газе имеются силы притяжения между молекулами, и если газ расширяется, то на увеличение расстояния меж-ду частицами или на изменение внутренней потенциальной энергии тела всегда затрачивается работа, что связано с изменением тем-пературы. [c.220]
Поскольку для адиабатного процесса дросселирования справедливо равенство ij = I2, т. е. Ui -f piVi = U2 + или Uj — = р2 2 — PiVi, ТО отсюда следует, что внешняя работа (работа проталкивания) в этом процессе совершается за счет убыли внутренней энергии тела. [c.220]
Здесь индекс V служит напоминанием того, что изменение внутренней энергии тела происходит при неизменном его объеме и что, когда мы говорим о тепле, мы имеем в виду только способ, каким меняется внутренняя энергия, и ничегр больше. Отметим, что согласно [c.72]
В 4.1 мы отмечали, что в силу принятого определения температуры, внутренняя энергия тел всегда растет с повышением температуры.
 Поэтому всегда положительна. При этом ее численные значения оказываются порядка единицы. В самом деле, если воспользоваться формулами (7.17) и (7.18) для внутренней энергии, соответственно, одноатомного идеального газа и таердого тела, получим = 3 / 2 в первом случае и = 3 во втором. Более подробно о величине теплоемкости и ее зависимости от температуры мы поговорим в следующих параграфах.
[c.170]
Поэтому всегда положительна. При этом ее численные значения оказываются порядка единицы. В самом деле, если воспользоваться формулами (7.17) и (7.18) для внутренней энергии, соответственно, одноатомного идеального газа и таердого тела, получим = 3 / 2 в первом случае и = 3 во втором. Более подробно о величине теплоемкости и ее зависимости от температуры мы поговорим в следующих параграфах.
[c.170]Если изменения внутренней энергии тел происходили только в результате теплообмена, то на основании первого закона термодинамики можно записать Af7i=Qi и AU2 = Q i. Отсюда Qi +Q2=-0 или [c.97]
Допустим, что в полость, окруженную оболочкой с идеально отражающими стенками, помещено тело. Излучение, иепускаемое телом, не рассеивается по всему пространству, а, отражаясь от стенок, сохраняется в полости, падая вновь на тело и частично поглощаясь в нем. В таких условиях никакой потери энергии в системе тело — излучение не происходит. Однако это еще не означает, что тело и излучение находятся в равновесии между собой. Энергия такой системы содержится частично в виде энергии излучения, т. е. электромагнитных волн, а частично — в виде внутренней энергии тела. Состояние системы будет равновесным, если с течением времени распределение энергии между телом и излучением не меняется. Поместим внутрь полости нагретое тело (твердое, жидкое или газообразное). Если в единицу времени тело испускает больше, чем поглощает (или наоборот), то температура его понижается (или повышается). При этом испускание
[c.130]
Энергия такой системы содержится частично в виде энергии излучения, т. е. электромагнитных волн, а частично — в виде внутренней энергии тела. Состояние системы будет равновесным, если с течением времени распределение энергии между телом и излучением не меняется. Поместим внутрь полости нагретое тело (твердое, жидкое или газообразное). Если в единицу времени тело испускает больше, чем поглощает (или наоборот), то температура его понижается (или повышается). При этом испускание
[c.130]
Высокая чувствительность метода Этвеша позволила ответить еще на один вопрос. Как было показано в 31, по крайней мере часть инертной массы всякого тела обусловлена внутренней энергией тела. В связи с этим возник вопрос, распространяется ли на эту часть инертной массы утверждение о равенстве инертной и тяжелой масс. Если бы на эту часть инертной массы, которая обусловлена внутренней энергией тела, не распространялось утверждение о равенстве инертной и тяжелой масс, то различие между ними было бы заметно в телах, обладающих большой внутренней энергией, в частности в радиоактивных телах. Однако опыт Этвеша, повторенный Саузернсом с радиоактивными веществами, дал тот же результат никакого различия между тяжелой и инертной массой не было обнаружено. Значит, и та часть инертной массы, которая обусловлена внутренней энергией тел, обладает равной ей гравитационной массой. Опыт Этвеша был повторен Дикке в 1961 г., причем точность была улучшена до 1 10 С этой точностью никаких различий между инертной и тяжелой массой обнаружено не было.
[c.383]
Однако опыт Этвеша, повторенный Саузернсом с радиоактивными веществами, дал тот же результат никакого различия между тяжелой и инертной массой не было обнаружено. Значит, и та часть инертной массы, которая обусловлена внутренней энергией тел, обладает равной ей гравитационной массой. Опыт Этвеша был повторен Дикке в 1961 г., причем точность была улучшена до 1 10 С этой точностью никаких различий между инертной и тяжелой массой обнаружено не было.
[c.383]
В настоящей книге рассматриваются ь основном проблемы преобразования внутренней энергии тел в полезную внещнюЮ работу, что предопределило энергетический аспект книги в целом. [c.5]
Внутренняя энергия взаимодействие между системам
Внутренней энергией системы называется сумма потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергии их движения, т. е. внутренняя энергия системы складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергии вращения электронов в атомах, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия и других видов энергии. Внутренняя энергия — это общий запас энергии системы за вычетом кинетической энергии системы в целом и ее потенциальной энергии положения. Абсолютная величина внутренней энергии тела неизвестна, но для применения химической термодинамики к изучению химических явлений важно знать только изменение внутренней энергии при переходе системы из одного состояния в другое. [c.85]
Внутренняя энергия — это общий запас энергии системы за вычетом кинетической энергии системы в целом и ее потенциальной энергии положения. Абсолютная величина внутренней энергии тела неизвестна, но для применения химической термодинамики к изучению химических явлений важно знать только изменение внутренней энергии при переходе системы из одного состояния в другое. [c.85]
При математическом описании потенциальной энергии ее разделяют на внешнюю и внутреннюю. Внешняя потенциальная энергия системы материальных частиц обусловлена действием на нее внешних потенциальных сил, т. е. сил, приложенных со стороны тел, не входящих в систему. Внутренняя потенциальная энергия системы обусловлена внутренними силами взаимодействия между частицами и связана у жидкостей и газов с объемной деформацией [c.19]
Рассмотрим баланс внутренней энергии однородной многокомпонентной системы, полагая, что любой процесс в ней сводится к обмену обобщенными координатами между компонентами — подсистемами, а всякое взаимодействие ее с окружающей средой — [c. 60]
60]
Первое слагаемое представляет изменение внутренней энергии систем (1) и (2) при переходе от изолированных систем к взаимодействующей паре (1) — -(2). Второе слагаемое дает ту часть энергии взаимодействия, которая непосредственно зависит от электростатического взаимодействия между системами (1) и (2). [c.38]
Надо отметить, что величина АН характеризует как изменение внутренней энергии AU, так и изменение объема AF системы нри растворении. Если энергия взаимодействия между разнородными молекулами больше, чем между однородными, происходит выделение тепла при растворении (экзотермическое смешение, AU взаимодействие между разнородными молекулами меньше, то происходит поглощение тепла (эндотермическое растворение, AU 0). В случае нулевого теплового эффекта — атермическое растворение. Величина S характеризует расположение элементов в системе. При уменьшении упорядоченности расположения элементов в системе S растет (Д5 > 0). [c.57]
Описание растворов электролитов основывается на знании внутренней потенциальной энергии этой системы. Указанная величина, в свою очередь, однозначно определяется энергией взаимодействия между ионами и функцией их радиального распределения в растворе. [c.12]
Указанная величина, в свою очередь, однозначно определяется энергией взаимодействия между ионами и функцией их радиального распределения в растворе. [c.12]
Не вдаваясь в детали, мы можем сказать, что вероятность этих внутренних изменений в единицу времени пропорциональна квадрату матричного элемента энергии взаимодействия между полем и атомами. Матричный элемент берется в представлении, в котором состояния обеих частей классифицированы с помощью квантовых чисел. При этом используется тот элемент, первый индекс которого характеризует начальное состояние, а второй индекс характеризует конечное состояние. Полная вероятность перехода будет очень мала, за исключением случая, когда начальное и конечное состояния всей системы имеют одинаковую (или почти одинаковую) энергию. [c.86]
Необходимо отметить, что в противоположность работе и теплоте, само понятие о которых предполагает взаимодействие между системой и средой, внутренняя энергия не связана со средой, а зависит только от состояния системы, т.
 е. является функцией ее состояния. При переходе от одного состояния к другому внутренняя энергия изменяется на определенную величину, зависящую только от начального и конечного состояний и, в противоположность работе и теплоте, не зависящую от пути перехода. По этим причинам функцию и можно рассматривать как характеристическую, определяющую энергетическое состояние системы. Таким образом, для конечного процесса из уравнения (1) получаем [c.12]
е. является функцией ее состояния. При переходе от одного состояния к другому внутренняя энергия изменяется на определенную величину, зависящую только от начального и конечного состояний и, в противоположность работе и теплоте, не зависящую от пути перехода. По этим причинам функцию и можно рассматривать как характеристическую, определяющую энергетическое состояние системы. Таким образом, для конечного процесса из уравнения (1) получаем [c.12]При элементарном акте взаимодействия между системой и окружающей средой внутренняя энергия системы изменится на бесконечно малую величину йИ. Уравнение (4.1) для этого случая напишется в виде [c.16]
Газовое состояние вещества — более вероятное при высоких температурах — характеризуется большим запасом энтальпии и высокими значениями энтропии. Это говорит о полном беспорядке в системе, состоящей из частиц, совершающих индивидуальные поступательные движения с различными скоростями и практически не взаимодействующих друг с другом. Чем меньше энергия взаимодействия между двумя частицами, находящимися в контакте (слабые связи), тем больше запас внутренней энергии оистемы, и тогда уже при низких температурах вещество способно находиться в газовом состоянии. К таким веществам относятся прежде всего инертные газы, атомы которых испытывают друг к другу очень слабое притяжение (см. 4 этой главы). По мере увеличения размеров частиц вещества их способность к взаимному притяжению (в частности, из-за более легкой поляризации) возрастает. Это проявляется в повышении температур кипения веществ (рис, 40) с возрастанием массы их частиц, [c.99]
Чем меньше энергия взаимодействия между двумя частицами, находящимися в контакте (слабые связи), тем больше запас внутренней энергии оистемы, и тогда уже при низких температурах вещество способно находиться в газовом состоянии. К таким веществам относятся прежде всего инертные газы, атомы которых испытывают друг к другу очень слабое притяжение (см. 4 этой главы). По мере увеличения размеров частиц вещества их способность к взаимному притяжению (в частности, из-за более легкой поляризации) возрастает. Это проявляется в повышении температур кипения веществ (рис, 40) с возрастанием массы их частиц, [c.99]
Из соотношений (1.15), (1.16) следует, что если взаимодействие между системой и средой происходит в условиях адиабатической изоляции, то изменение внутренней энергии системы обусловлено только работой, производимой системой над окружающей средой [c.27]
Если же взаимодействие между системой и средой происходит в условиях диатермической изоляции, приращение внутренней энергии системы определяется величиной поглощенной теплоты [c. 28]
28]
Внутренняя энергия. Химическая система может состоять из различных частиц молекул, атомов или ионов. Каждая из частиц обладает энергией, которая обусловлена ее поступательными и вращательными движениями, колебаниями атомов и атомных групп в молекулах (рис. 5.1), силами притяжения и отталкивания, действующими как внутри частиц, так и между ними, внутриядерными взаимодействиями и т. д. Суммарный запас энергии системы, складывающийся из сильно различающихся энергий отдельных частиц, называют внутренней энергией системы. Ее обозначают буквой II. Внутренняя энергия — функция состояния системы, т. е. ее характеристика, в отличие от физических условий существования системы, которые называют параметрами. К числу параметров системы относятся температура Т, давление р и объем V. Определить экспериментально абсолютное значение внутренней энергии невозможно. Однако можно измерить изменение внутренней энергии [c.41]
Наиболее общими характеристиками систем являются масса вещества т, содержащегося в системе, и внутренняя энергия Е системы. Масса вещества системы определяется совокупностью масс молекул, из которых она состоит. Внутренняя энергия системы представляет собой сумму энергий теплового движения молекул и энергии взаимодействия между ними. [c.11]
Масса вещества системы определяется совокупностью масс молекул, из которых она состоит. Внутренняя энергия системы представляет собой сумму энергий теплового движения молекул и энергии взаимодействия между ними. [c.11]
Внутренняя энергия. Внутренней энергией мы называем энергию, заключенную в системе. При этом обычно не учитывается кинетическая энергия системы в целом и потенциальная энергия системы во внешнем поле (хотя в некоторых случаях потенциальную энергию можно рассматривать как часть внутренней энергии). При микроскопическом рассмотрении это означает, что внутренняя энергия равна сумме кинетической энергии отдельных молекул и энергии взаимодействия между ними. Однако термодинамика обычно не затрагивает вопроса о природе внутренней энергии. Первый закон термодинамики утверждает, что внутренняя энергия является функцией состояния. Аддитивную постоянную, входящую во внутреннюю энергию, можно фиксировать, выбрав некоторое исходное состояние за нулевую точку отсчета внутренней энергии. На фиг. 2 изображена внутренняя энергия воздуха как функция температуры и давления. Точка С является критической (см. пример 8). [c.17]
На фиг. 2 изображена внутренняя энергия воздуха как функция температуры и давления. Точка С является критической (см. пример 8). [c.17]
Это значит, что изотермическое разбавление такого раствора (добавление к нему растворителя) не изменяет внутреннюю энергию и энтальпию системы, не сопровождается поглощением или выделением теплоты. Средние расстояния между частицами растворенного вещества так велики, что можно не принимать во внимание взаимодействие между ними. Взаимодействие между молекулами растворителя (п и растворенного вещества (По) в общем случае следует учитывать. Добавление к раствору, например, одного моля растворяемого вещества соответствует такому изменению энтропии н других термодинамических функций, как если бы этот моль [c.234]
В результате взаимодействия системы с окружающей средой происходит обмен энергией между ними, и внутренняя энергия системы V изменяется на величину АП.
 Такой обмен может происходит в двух формах теплоты и работы. [c.14]
Такой обмен может происходит в двух формах теплоты и работы. [c.14] При системном анализе процессы измельчения- смешения сыпучих материалов [4] определяются как процессы взаимодействия ансамбля измельчаемых и смешиваемых частиц различного сорта и различных размеров с несущей средой и между собой при наличии внешних воздействий на двух уровнях иерархии. На локальном (микро) уровне действуют внешние поверхностные и массовые силы и силы взаимодействия между несущей фазой и частицами (силы Архимеда, Стокса, Жуковского и Магнуса). При определенных свойствах обрабатываемых веществ и несущей среды возможны дополнительные электромагнитные силы. В результате этого в системе происходит перенос массы, импульса, энергии и заряда. Внешняя механическая энергия или энергия другого вида, превращенная в нее внутри системы, расходуется на работу против сил молекулярного сцепления и электростатического взаимодействия, преодоление сил взаимодействия внутри частицы, на накопление упругих деформаций, переходящих в пластические и во внутреннюю энергию. Частично энергия упругих деформаций создает в системе дефекты, микронапряжения и микротрещины. [c.113]
Частично энергия упругих деформаций создает в системе дефекты, микронапряжения и микротрещины. [c.113]
В термодинамике все рассуждения относятся к системам и процессам, протекающим в них. Под системой понимают ограниченную часть пространства (выделяемую физически или мысленно), в которой все составляющие и фазы находятся во взаимодействии. Термодинамической называется система, в которой совокупность тел может обмениваться между собой энергией и веществом с физическим и химическим превращением веществ. Поверхность раздела отделяет внутреннюю среду от внешней. Система, которая не обменивается с внешней средой энергией, называется адиабатической. [c.7]
Зависимость (212.2) может быть представлена графически в трехмерном пространстве или в виде изоэнергетических линий в двухмерной системе координат п и гг. Расчет энергии такой системы, состоящей из 3 ядер и 3 электронов, был сделан методом МО ССП с расширенным базисом. На рис. 188 приведены результаты одного из таких расчетов. Изоэнергетические линии системы вычерчены при изменении п и гг. Диаграмма подобна топографической карте. Рассмотрим, как будет изменяться внутренняя энергия при столкновении молекулы АВ с атомом С. Внутренняя энергия исходного состояния молекулы АВ (На) принята равной —440 кДж/моль, энергия атома С (атома Н) — равной нулю. Пусть кинетическая энергия поступательного движения молекулы АВ и атома С по линии, соединяющей центры атомов, будет равна (,. Примем за исходное состояние системы состояние, обозначенное на рис. 188 точкой 1. В этом состоянии атом С находится на расстоянии г% =2 10 м. Энергия межмолекулярного взаимодействия между АВ и С невелика, поэтому внутреннюю энергию системы можно принять равной энергии исходного состояния. При приближении атома С к молекуле АВ преодолеваются силы отталкивания между одноименно заряженными ядрами атомов В и С. Внутренняя энергия системы при этом возрастает. Точка, характеризующая состояние системы, будет двигаться по линии минимальных энергетических градиентов, изображенной на рис.
Изоэнергетические линии системы вычерчены при изменении п и гг. Диаграмма подобна топографической карте. Рассмотрим, как будет изменяться внутренняя энергия при столкновении молекулы АВ с атомом С. Внутренняя энергия исходного состояния молекулы АВ (На) принята равной —440 кДж/моль, энергия атома С (атома Н) — равной нулю. Пусть кинетическая энергия поступательного движения молекулы АВ и атома С по линии, соединяющей центры атомов, будет равна (,. Примем за исходное состояние системы состояние, обозначенное на рис. 188 точкой 1. В этом состоянии атом С находится на расстоянии г% =2 10 м. Энергия межмолекулярного взаимодействия между АВ и С невелика, поэтому внутреннюю энергию системы можно принять равной энергии исходного состояния. При приближении атома С к молекуле АВ преодолеваются силы отталкивания между одноименно заряженными ядрами атомов В и С. Внутренняя энергия системы при этом возрастает. Точка, характеризующая состояние системы, будет двигаться по линии минимальных энергетических градиентов, изображенной на рис. 188 пунктиром. В интервале между точками 2 ж 4 система находится на перевале, разъединяющем исходное и конечное состояния. На вершине энергетического барьера, в точке Система находится в переходном состоянии (см. 210). Однако в состоянии атомов А и С есть существенное различие. Атом С продолжает движение по направлению к атому В за счет кинетической энергии поступательного движения, а атом А совершает колебательное движение относительно атома В. На вершине потенциального барьера возникает взаимодействие в форме притяжения между атомом С и молекулой АВ, обусловленное обменным взаимодействием энергетических уровней молекулы АВ и атома С. В точке 4 система находится в состоянии мо-кулы ВС и атома А. На пути от точки 4 к точке 5 энергия отталкивания переходит в энергию поступательного движения молекулы ВС и атома А. Внутренняя энергия системы уменьшается до энергии конечного состояния (молекулы ВС и атома А), равной —440 кДж/моль. [c.570]
188 пунктиром. В интервале между точками 2 ж 4 система находится на перевале, разъединяющем исходное и конечное состояния. На вершине энергетического барьера, в точке Система находится в переходном состоянии (см. 210). Однако в состоянии атомов А и С есть существенное различие. Атом С продолжает движение по направлению к атому В за счет кинетической энергии поступательного движения, а атом А совершает колебательное движение относительно атома В. На вершине потенциального барьера возникает взаимодействие в форме притяжения между атомом С и молекулой АВ, обусловленное обменным взаимодействием энергетических уровней молекулы АВ и атома С. В точке 4 система находится в состоянии мо-кулы ВС и атома А. На пути от точки 4 к точке 5 энергия отталкивания переходит в энергию поступательного движения молекулы ВС и атома А. Внутренняя энергия системы уменьшается до энергии конечного состояния (молекулы ВС и атома А), равной —440 кДж/моль. [c.570]
Таким образом, на основании опытов Гей-Люссака и Джоуля мы подошли к понятию о внутренней энергии идеального газа. При объяснении результатов этих опытов следует подчеркнуть особенности идеального газа. Идеальный газ отличается полной независимостью всех движущихся частиц друг от друга, что обусловлено отсутствием каких бы то ни было сил притяжения или отталкивания между ними. Поэтому для такой системы безразлично, в каком объеме она распределена. Запас энергии системы определяется суммой энергий движения частиц. Поэтому плотность идеального газа не играет роли, ибо энергия данной системы будет одна и та же для частиц, близко расположенных друг от друга (газ большой плотности), и для частиц, располагающихся на значительном рас— стоянии (разреженный газ с малой плотностью), так как между частицами нет взаимодействия. Поэтому внутренняя энергия идеального газа не зависит от объема и давления. [c.32]
При объяснении результатов этих опытов следует подчеркнуть особенности идеального газа. Идеальный газ отличается полной независимостью всех движущихся частиц друг от друга, что обусловлено отсутствием каких бы то ни было сил притяжения или отталкивания между ними. Поэтому для такой системы безразлично, в каком объеме она распределена. Запас энергии системы определяется суммой энергий движения частиц. Поэтому плотность идеального газа не играет роли, ибо энергия данной системы будет одна и та же для частиц, близко расположенных друг от друга (газ большой плотности), и для частиц, располагающихся на значительном рас— стоянии (разреженный газ с малой плотностью), так как между частицами нет взаимодействия. Поэтому внутренняя энергия идеального газа не зависит от объема и давления. [c.32]
Курс состоит из двух частей. В первой части рассматривается строение вещества. Здесь проводится подход к химической системе как системе из взаимодействующих электронов и ядер, из которых формируются атомы, многоатомные частицы, а затем и макроскопические вещества. В неразрывной связи со строением описывается состояние соответствующих систем. С этой целью авторы отказались от традиционной компоновки материала. В частности, понятия внутренней энергии и энтропии вводятся в первой части курса в связи с изложением вопросов строения и состояния макроскопических систем. Это же касается некоторых понятий теории растворов, как представления о предельно разбавленном и идеальном растворе, которое связано именно с особенностями строения растворов, природой взаимодействия между частицами раствора. Вторая часть посвящена теории химического процесса. В ней рассматриваются термодинамика и кинетика химических реакций. [c.3]
В неразрывной связи со строением описывается состояние соответствующих систем. С этой целью авторы отказались от традиционной компоновки материала. В частности, понятия внутренней энергии и энтропии вводятся в первой части курса в связи с изложением вопросов строения и состояния макроскопических систем. Это же касается некоторых понятий теории растворов, как представления о предельно разбавленном и идеальном растворе, которое связано именно с особенностями строения растворов, природой взаимодействия между частицами раствора. Вторая часть посвящена теории химического процесса. В ней рассматриваются термодинамика и кинетика химических реакций. [c.3]
Важнейшее свойство идеального газа — свободное движение частиц в пространстве при отсутствии взаимодействия между молекулами. Поэтому энергия и энтропия каждого компонента зависят только от его природы, объема системы и температуры, но не от наличия других компонентов. При этом внутренняя энергия [c.83]
Окружающие нас тела обладают определенным запасом энергии. Эта энергия слагается из энергии вращательного и поступательного движения молекул, энергии внутримолекулярного колебания атомов, движения электронов вокруг ядра, внутриядерной энергии, энергии взаимодействия молекул между собой и др. Все перечисленные виды энергии, за исключением кинетической энергии системы в целом и потенциальной энергии положения ее в пространстве, составляют внутреннюю энергию, системы и. Величина внутренней энергии зависит от природы составляющих ее веществ, их массы и внешних условий. Абсолютное значение внутренней энергии любой системы не может быть измерено, одна ко опытным путем удается установить изменение внутренней энергии (АО) при переходе системы из одного состояния в другое, что оказывается достаточным для целей термодинамики [c.11]
Эта энергия слагается из энергии вращательного и поступательного движения молекул, энергии внутримолекулярного колебания атомов, движения электронов вокруг ядра, внутриядерной энергии, энергии взаимодействия молекул между собой и др. Все перечисленные виды энергии, за исключением кинетической энергии системы в целом и потенциальной энергии положения ее в пространстве, составляют внутреннюю энергию, системы и. Величина внутренней энергии зависит от природы составляющих ее веществ, их массы и внешних условий. Абсолютное значение внутренней энергии любой системы не может быть измерено, одна ко опытным путем удается установить изменение внутренней энергии (АО) при переходе системы из одного состояния в другое, что оказывается достаточным для целей термодинамики [c.11]
Каждая система характеризуется ее внутренней энергией (обозначается П). Эта энергия складывается из энергий образующих ее составных частей, в том числе молекул, атомов, электронов, ядер, внутриядерных частиц и т. д. Она представляет собой сумму кинетической энергии движения указанных частиц и потенциальной энергии их взаимодействия между собой, а также соб- [c.162]
д. Она представляет собой сумму кинетической энергии движения указанных частиц и потенциальной энергии их взаимодействия между собой, а также соб- [c.162]
Важнейшей характеристикой термодинамической системы является ее внутренняя энергия. Хотя классическая термодинамика не рассматривает строения вещества на молекулярном уровне и по существу не раскрывает физического смысла внутренней энергии, полезно указать здесь, что под этим понятием прдразумева-ет молекулярная физика. Внутренняя энергия включает в себя все виды энергии частиц внутри системы (энергию ядер, электронов, энергию связей атомов в молекулы, энергию взаимодействия между молекулами, вращательную, поступательную, колебательную и т. д.). Она не включает только кинетическую и потенциальную энергию всей системы как целого. Если включить и эти виды энергии, то получится полная энергия системы. [c.10]
Молекулы жидкости и газа находятся в состоянии хаотического движения, обладая при этом кинетической энергией и энергией взаимодействия между собой. Суммарную энергию хаотических движущихся молекул будем называть внутренней энергией жидкостей. Внутреннюю энергию единицы массы жидкости (удельная внутренняя энергия) обозначим через е. Ее размерность в системе СИ [Дж/кг], в системе МКГСС [ккал/кГ]. Величина е характеризует только запас внутренней энергии, но не определяет процесс передачи ее от одной части жидкости к другой. Для этого служит другая величина, также определяемая хаотическим движением молекул, — температура Т. Измеряется она в градусах по шкале Кельвина (К). Удельная внутренняя энергия связана с температурой соотношением [c.22]
Суммарную энергию хаотических движущихся молекул будем называть внутренней энергией жидкостей. Внутреннюю энергию единицы массы жидкости (удельная внутренняя энергия) обозначим через е. Ее размерность в системе СИ [Дж/кг], в системе МКГСС [ккал/кГ]. Величина е характеризует только запас внутренней энергии, но не определяет процесс передачи ее от одной части жидкости к другой. Для этого служит другая величина, также определяемая хаотическим движением молекул, — температура Т. Измеряется она в градусах по шкале Кельвина (К). Удельная внутренняя энергия связана с температурой соотношением [c.22]
Внутренняя энергия складывается из кинетической энергии движения частиц изучаемой системы (атомов, молекул, ионов, электронов и др.) и энергии взаимодействий. между ними (внутри- и межмолеку.тарных). В термодинамике определяется лишь из.менение внутренней энергии в различных процессах (Д /). Внутренняя энергия, как функцш состояния систе.мы вводится первым началом термодинамики, согласно которому разность. 1ежду теплотой ЪО, переданной систе.ме, и работой 5IV, совершаемой системой, зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. представляет собой изменение функции состояния [c.57]
1ежду теплотой ЪО, переданной систе.ме, и работой 5IV, совершаемой системой, зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. представляет собой изменение функции состояния [c.57]
Молекулы жидкости и газа находятся в состоянии хаотического движения, обладая при этом кинетической энергией и энергией взаимодействия между собой. Суммарную энергию хаотически движуш,ихся молекул будем называть внутренней энергией газа. Внутреннюю энергию единицы массы жидкости или газа (удельная внутренняя энергия) обозначают через е. Ее единица в СИ — Дж/кг, в системе МКГСС — м /с1 Соотношение различньгх единиц энергии (работы, теплоты) представлено в прил. 3.2. [c.147]
В газах наблюдается обратное соотношение кинетическая энергия настолько велика по сравнению со средней энергией взаимодействия между частицами, что частицы газа могут удерживаться в некотором объеме только благодаря наличию внешних непроницаемых для частиц стенок распределение частиц в объеме газа близко к хаотическому. При не очень высоких давлениях газообразному состоянию соответствует малая плотность системы. В жидкостях средняя потенциальная и средняя кинетическая энергии частицы близки по величине. Для жидкости характерна плотность того же порядка, что и для кристаллов, а следовательно, того же порядка энергия межмолекулярных взаимодействий. Но у жидкостей, в отличие от кристаллов, отсутствует правильная периодическая структура. Средняя потенциальная энергия вещества в жидком состоянии (соответственно внутренняя энергия) выше, чем в твердом при той же температуре плавление сопровождается возрастанием внутренней энергии (и энтальпии) А(/пл >0, > 0. Энтропия жидкости также больше, чем энтропия кристалла при той же температуре (А5пл > 0)- Если в кристаллах движение молекул сводится практически к колебаниям около положений равновесия, то в жидкостях существенную роль играет трансляционное движение молекул. Молекулы жидкости удерживаются вместе благодаря силам притяжения, но в то же время они очень подвижны.
При не очень высоких давлениях газообразному состоянию соответствует малая плотность системы. В жидкостях средняя потенциальная и средняя кинетическая энергии частицы близки по величине. Для жидкости характерна плотность того же порядка, что и для кристаллов, а следовательно, того же порядка энергия межмолекулярных взаимодействий. Но у жидкостей, в отличие от кристаллов, отсутствует правильная периодическая структура. Средняя потенциальная энергия вещества в жидком состоянии (соответственно внутренняя энергия) выше, чем в твердом при той же температуре плавление сопровождается возрастанием внутренней энергии (и энтальпии) А(/пл >0, > 0. Энтропия жидкости также больше, чем энтропия кристалла при той же температуре (А5пл > 0)- Если в кристаллах движение молекул сводится практически к колебаниям около положений равновесия, то в жидкостях существенную роль играет трансляционное движение молекул. Молекулы жидкости удерживаются вместе благодаря силам притяжения, но в то же время они очень подвижны. Этим объясняется характерное свойство жидкости сохранять свой объем, но не форму (текучесть). [c.393]
Этим объясняется характерное свойство жидкости сохранять свой объем, но не форму (текучесть). [c.393]
Особо важное значение в химических процессах имеет термодинамический потенциал, т. е. изменение свободной энергии системы (А/ ). Выражая собой ту часть внутренней энергии системы, которая способна превращаться в полезную работу, величина ДР данного химического процесса служит тем самым мерой химического сродства реагирующих компонентов, т. е. мерой их реакционной способности. Чем больше абсолютная величина изменения свободной энергии или, что то же, чем больше значение максималыюи работы данного химического процесса, тем полнее они вступают между собой в химическое взаимодействие. Если мы говорим, что данные вещества реагируют между собой недостаточно энергично, то это означает, что они имеют небо,пьшое изменение свободной энергии в наблюдаемом процессе химического взаимодействия или, что то же, максимальная работа, которую требуется затратить на этот процесс, очень велика [c. 167]
167]
В этой конформации две группы атомов водорода по обе стороны плоскости кольца сближены по направлению к центру молекулы и конформационно взаимодействуют между собой. Благодаря этим взаимодействиям в молекуле создается дополнительное внутреннее напряжение. При этом сближение двух Н-атомов приводит к перекрыванию их ван-дер-ваальсовых радиусов. Удаление этих сближенных атомов и образование новой С—С-связи уменьшает энергию системы, делая ее менее напряженной. Указанные стерические факторы и энергетический эффект благоприятствуют протеканию трансаннулярной Сз-дегидроциклизации циклооктана с образованием системы пенталана. Протекание этой реакции в присутствии Pt/ осуществляется, как нам кажется, через промежуточное образование циклического переходного состояния. Образование последнего происходит, по-видимому, по схеме, сходной с механизмом гидрогенолиза циклопентанов и Сз-дегидроциклизацни алканов (для упрощения схемы на ней не показаны атомы катализатора, соединенные со сближенными атомами Н и С адсорбционными связями) [c. 155]
155]
Из этого соотношения следует, что работа сил трения йА для выделенного элементарного объема системы превраш,ается в теплоту dQ, а кроме того, расходуется на увеличение внутренней энергии на химическое взаимодействие (%1с1п1г) и некоторые другие виды превращений. Указанные параметры тесно связаны между собой. Исходя из энергетической гипотезы, изнашивание (отделение) материала наступает тогда, когда внутренняя энергия 7 достигает критического значения. Однако в общем случае в присутствии химически активных компонентов износ определяется также глубиной химических превращений. В свою очередь, оба перечисленных фактора зависят от dQ. [c.250]
Феноменологический состоит в изучении свойств взаимодействующих объектов системы путем анализа условий и количественных зависимостей превращений энергии, происходящих в системе. Этот подход не связан с какими-либо конкретными представлениями о внутреннем строении объектов системы, силах взаимодействия между ними и характере их движения. Подход макроскопичен от начала до конца и в его основе лежат некоторые априорно вводимые постулаты (начала или законы термодинамики), которые получены на основании громадной экспериментальной практики, не противоречат ни одному из известных физических явлений и обладают, таким образом, очень высокой степенью общности. Феноменологический [c.23]
Подход макроскопичен от начала до конца и в его основе лежат некоторые априорно вводимые постулаты (начала или законы термодинамики), которые получены на основании громадной экспериментальной практики, не противоречат ни одному из известных физических явлений и обладают, таким образом, очень высокой степенью общности. Феноменологический [c.23]
При сближении двух тел до расстояний, сопоставимых с дальностью действия межмолекулярных сил, между ними возникают поверхностные силы взаимодействия, которые действуют лишь в сфере молекулярного поля и на расстояниях от поверхности раздела, превышающих радиус этой сферы, равны нулю. Эти силы, являющиеся следствием ненасыщенности межмолекулярных сил на поверхности фаз и зависящие от природы когезионных сил в фазах, всегда выступают как силы притяжения. Ненасыщен-ность межмолекулярного взаимодействия на внешней поверхности частицы приводит к образованию избыточной поверхностной энергии между фазами. Наличие определенного избытка свободной энергии, сосредоточенной в поверхностньге слоях на границе раздела фаз и пропорциональной этой поверхности, обусловливает стремление любых дисперсных систем занять минимальную поверхность раздела фаз. Следствием такого свойства дисперсных систем является стремление в изотермических условиях жидких частиц к коалесценции и твердых частиц к агрегированию, сопровождающихся понижением свободной поверхностной энергии пропорционально убыли поверхности. Термодинамически поверхностную энергию можно характеризовать через уравнение для внутренней энергии и=Р+Тз. Применительно к процессу образования новой поверхности и есть поверхностная энергия, Р — свободная энергия образования поверхности и Тз — тепловой эффект процесса, где 8 = с1Р МТ — температурный коэффициент свободной энергии образования поверхности. Известно, что внутренняя энергия системы является результатом взаимодействия частиц и их кинетической энергии. В изотермических процессах определяемая температурой кинетическая энергия частиц остается постоянной, поэтому все изменения внутренней [c.93]
Следствием такого свойства дисперсных систем является стремление в изотермических условиях жидких частиц к коалесценции и твердых частиц к агрегированию, сопровождающихся понижением свободной поверхностной энергии пропорционально убыли поверхности. Термодинамически поверхностную энергию можно характеризовать через уравнение для внутренней энергии и=Р+Тз. Применительно к процессу образования новой поверхности и есть поверхностная энергия, Р — свободная энергия образования поверхности и Тз — тепловой эффект процесса, где 8 = с1Р МТ — температурный коэффициент свободной энергии образования поверхности. Известно, что внутренняя энергия системы является результатом взаимодействия частиц и их кинетической энергии. В изотермических процессах определяемая температурой кинетическая энергия частиц остается постоянной, поэтому все изменения внутренней [c.93]
Конформационные переходы цепи с кинк-изомерамп, свободная энергия которой при наличии напряжения представляется сплошной линией (рис. 5.1), термодинамически необратимы, а внутренняя энергия переходит в тепло. Представляет интерес постоянная времени процесса перехода если она мала по сравнению со временем, в течение которого происходит растяжение цепи, то кривая напряжение—деформация не слишком сильно отличается от кривой, соответствующей сплошной линии на рис. 5.1, а если постоянная времени слишком велика, то переходы могут быть запрещены и цепи деформируются эластично. Однако при промежуточных значениях постоянных времени наибольшие напряжения не полностью вытянутых цепей будут зависеть от скорости, с которой происходят конформационные переходы, снимающие напряжение. Детальное рассмотрение данного явления потребовало бы изучения формы и взаимодействия цепных молекул, основ термодинамики необратимых процессов [15] и анализа потенциала вторичных, или вандерваальсовых, связей между сегментами [16]. Это привело бы к рассмотрению неупругого деформирования полимеров, которое не является предметом данной книги. Тем не менее все же представляет интерес некоторая информация относительно скорости переходов между различными кинк-изомерами, сопровождающихся релаксацией напряжения в системе.
5.1), термодинамически необратимы, а внутренняя энергия переходит в тепло. Представляет интерес постоянная времени процесса перехода если она мала по сравнению со временем, в течение которого происходит растяжение цепи, то кривая напряжение—деформация не слишком сильно отличается от кривой, соответствующей сплошной линии на рис. 5.1, а если постоянная времени слишком велика, то переходы могут быть запрещены и цепи деформируются эластично. Однако при промежуточных значениях постоянных времени наибольшие напряжения не полностью вытянутых цепей будут зависеть от скорости, с которой происходят конформационные переходы, снимающие напряжение. Детальное рассмотрение данного явления потребовало бы изучения формы и взаимодействия цепных молекул, основ термодинамики необратимых процессов [15] и анализа потенциала вторичных, или вандерваальсовых, связей между сегментами [16]. Это привело бы к рассмотрению неупругого деформирования полимеров, которое не является предметом данной книги. Тем не менее все же представляет интерес некоторая информация относительно скорости переходов между различными кинк-изомерами, сопровождающихся релаксацией напряжения в системе. Так как любые переходы, приводящие к движению только одного кинк-изомера, обычно не вызывают удлинения цепи вдоль ее оси, то приходится учитывать по крайней мере одновременную активацию н аннигиляцию двух кинк-изомеров. Подобный процесс состоит из поворота четырех гош-связей и передачи поворота сегмента между кинк-изомерами можно оценить энергию связи, необходимую для преодоления потенциального барьера, которая должна составлять 33,5 кДж/моль для поворота гош-связи [7] и (2,1—5) кДж/моль для вращения СНг-группы [17, 18]. Следовательно, чтобы преобразовать весь кинк-изомер tgtgttgtgt в транс-конформацию, необходима энергия активации 46—63,6 кДж/моль. Можно предположить, что подобные преобразования напряженных цепей ПЭ к состоянию, свободному от напряжений, действительно происходят при скорости деформирования по крайней мере 1 с при температуре ниже точки плавления, т. е. при 400 К. Теперь молрассчитать скорость данного процесса при 300 К с помощью выражения (3.22), которая оказывается равной 0,0018 с .
Так как любые переходы, приводящие к движению только одного кинк-изомера, обычно не вызывают удлинения цепи вдоль ее оси, то приходится учитывать по крайней мере одновременную активацию н аннигиляцию двух кинк-изомеров. Подобный процесс состоит из поворота четырех гош-связей и передачи поворота сегмента между кинк-изомерами можно оценить энергию связи, необходимую для преодоления потенциального барьера, которая должна составлять 33,5 кДж/моль для поворота гош-связи [7] и (2,1—5) кДж/моль для вращения СНг-группы [17, 18]. Следовательно, чтобы преобразовать весь кинк-изомер tgtgttgtgt в транс-конформацию, необходима энергия активации 46—63,6 кДж/моль. Можно предположить, что подобные преобразования напряженных цепей ПЭ к состоянию, свободному от напряжений, действительно происходят при скорости деформирования по крайней мере 1 с при температуре ниже точки плавления, т. е. при 400 К. Теперь молрассчитать скорость данного процесса при 300 К с помощью выражения (3.22), которая оказывается равной 0,0018 с . При деформировании цепи энергия активации вращения сегмента только убывает, а скорость переходов, сопровождающихся ослаблением напряжения, возрастает [19]. С учетом подобного [c.130]
При деформировании цепи энергия активации вращения сегмента только убывает, а скорость переходов, сопровождающихся ослаблением напряжения, возрастает [19]. С учетом подобного [c.130]
В основе практически всех приближенных вариантов метода псевдопотенциала для молекул с несколькими валентными электронами лежит простая и естественная модель. Все электроны молекулы делятся на внутренние (остовные) и внеишие (валентные). Ядро каждого атома и относящиеся к нему внутренние электроны образуют атомный остов. Молекуле сопоставляют модель — взаимодействующие между собой валентные электроны движутся в поле атомных остовов. Чтобы этой моделью можно было пользоваться, для каждой конкретной молекулы надо задать оператор энергии взаимодействия валентного электрона с атомным остовом (т.е. псевдопотенциал атомного остова) и оператор энергии взаимодействия валентных электронов Между собой. Если сможем задать эти взаимодействия, то получим модель, обладающую несомненными достоинствами. В этой модели для однотипных молекул,, различающихся только атомами, стоящими в одном и тот же столбце системы Менделеева, оператор Гамильтона будет иметь одну и ту же структуру, и число электронов будет одним и тем же. Поэтому, например расчет молекулы, содержащей атом иода, будет не сложнее расчета такой же молекулы, но содержащей атом фтора хотя в первой из этих молекул на 44 электрона больще, чем во второй, все эти 44 электрона относятся к остову. Более того, поскольку модели таких молекул различаются только псевдопотенциалами атомных остовов, то изменение свойств при переходе от одной молекулы к другой можно связать с изменением характеристик псевдопотенциалов при переходе от одного атома к другому. В этом случае свойства молекул находят свое объяснение через свойства атомов, но не непосредственно, а через характеристики псевдопотенциалов атомных остовов. [c.292]
В этой модели для однотипных молекул,, различающихся только атомами, стоящими в одном и тот же столбце системы Менделеева, оператор Гамильтона будет иметь одну и ту же структуру, и число электронов будет одним и тем же. Поэтому, например расчет молекулы, содержащей атом иода, будет не сложнее расчета такой же молекулы, но содержащей атом фтора хотя в первой из этих молекул на 44 электрона больще, чем во второй, все эти 44 электрона относятся к остову. Более того, поскольку модели таких молекул различаются только псевдопотенциалами атомных остовов, то изменение свойств при переходе от одной молекулы к другой можно связать с изменением характеристик псевдопотенциалов при переходе от одного атома к другому. В этом случае свойства молекул находят свое объяснение через свойства атомов, но не непосредственно, а через характеристики псевдопотенциалов атомных остовов. [c.292]
Интересующие нас квантовые системы, как мы видели, обладают свойством изменять частоту излучения, вообще трансформировать энергию. Их внутренняя энергия складывается из электронной и вибрационной (тепловой) энергии, причем запас ее может пополняться или уменьщаться при взаимодействии, с излучением и с соприкасающимися веществами — другими квантовыми системами. Изменение уровня электронной энергии сопровождается изменением уровня вибрационной энергии и, наоборот, увеличение или уменьшение запаса последней влечет за собой соответствующее изменение электронной энергии. Дело в том, что упругие силы, действующие между атомами, зависят от энергетического состояния электронов в то же время шругие колебания атомов деформируют электронные оболочки, т. е. изменяют уровень энергии электронов. Другими словами, в твердом веществе существует электронно-фононное взаимодействие, причем передача и трансформация энергии происходят путем столкновения электронов с фононами. Представляя собой систему большого числа взаимосвязанных вибраторов, твердое вещество имеет сплошные спектры поглощения. Благодаря этому соударение с твердым телом возбужденных молекул или комплексов, в частности продуктов экзотермических реакций, позволяет им освобождаться от избыточной энергии, прежде чем наступает их диссоциация.
Их внутренняя энергия складывается из электронной и вибрационной (тепловой) энергии, причем запас ее может пополняться или уменьщаться при взаимодействии, с излучением и с соприкасающимися веществами — другими квантовыми системами. Изменение уровня электронной энергии сопровождается изменением уровня вибрационной энергии и, наоборот, увеличение или уменьшение запаса последней влечет за собой соответствующее изменение электронной энергии. Дело в том, что упругие силы, действующие между атомами, зависят от энергетического состояния электронов в то же время шругие колебания атомов деформируют электронные оболочки, т. е. изменяют уровень энергии электронов. Другими словами, в твердом веществе существует электронно-фононное взаимодействие, причем передача и трансформация энергии происходят путем столкновения электронов с фононами. Представляя собой систему большого числа взаимосвязанных вибраторов, твердое вещество имеет сплошные спектры поглощения. Благодаря этому соударение с твердым телом возбужденных молекул или комплексов, в частности продуктов экзотермических реакций, позволяет им освобождаться от избыточной энергии, прежде чем наступает их диссоциация. Твердое тело может вместе с тем легко передавать из своих запасов дополнительную энергию адсорбированным молекулам или атомам и таким путем активировать их, что при определенных условиях позволяет ему служить катализатором химических реакций. [c.132]
Твердое тело может вместе с тем легко передавать из своих запасов дополнительную энергию адсорбированным молекулам или атомам и таким путем активировать их, что при определенных условиях позволяет ему служить катализатором химических реакций. [c.132]
В случаях систем жидкость — газ (пар) можно пренебречь взаимодействием между поверхностными молекулами жидкости, и молекулами газа вследствие разреженности газовой фазы. Таким образом, поверхностное натяжение в системе жидкость — газ (Ж—Г) целиком определяется притяжением поверхностного слоя со стороны жидкой фазы, т. е. внутренним давлением жидкости. Если заменить газовую фазу второй жидкостью, не смешивающейся с первой, то притяжение со стороны второй жидкой фазы приведет к уменьшению некомпенсированности молекулярных сил в поверхностном слое и, следовательно, к уменьшению свободной поверхностной энергии. В результате межфазное натяжение 012 на границе раздела двух абсолютно несмешивающихся жидкостей будет равно разности поверхностных натяжений о°1 и чистых жидкостей на границе с собственным паром [c. 25]
25]
Примем за исходное состояние системы такое состояние, которое на рис. 17.10 обозначено точкой //. В этом состоянии значение велико, т, е. имеем молекулы А—В, не взаимодействующие с атомом С. При приближении атома С к молекуле А—В преодолеваются силы отталкивания между одноименно заряженными ядрами атомов В и С. Внутренняя энергия системы при этом возрастает. Точка, характеризующая состояние системы, будет двигаться по линии минимальных энергетических градиентов, изображенной на рис. 17.10 пунктиром. Когда расстояние Лд в велико, то имеем молекулу В—С и атом А (точка К). Точка К соответствует конечному состоянию, также характеризующемуся минимальной энергией. В интервале между точками Н и К система находится на перевале, разъединяющем начальное и конечное состояния. [c.289]
Тест по физике 8 класс «Внутренняя энергия и способы ее изменения»
Ф.И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 1
1. Внутренняя энергия тела зависит…
Внутренняя энергия тела зависит…
А. От скорости движения тела.
Б. От энергии движения частиц, из которых состоит тело.
В. От энергии взаимодействия частиц, из которых состоит тело.
Г. От энергии движения частиц и от энергии их взаимодействия.
2. Первый стакан с водой охладили, получив от него 1 Дж количества теплоты, а второй стакан подняли вверх, совершив работу в 1 Дж. Изменилась ли внутренняя энергия воды в первом и втором стаканах?
А. Ни в одном стакане не изменилась.
Б. В 1 — уменьшилась, во 2 — не изменилась.
В. В 1 — не изменилась, во 2 — увеличилась.
Г. В обоих стаканах уменьшилась.
Д. В 1 — уменьшилась, во 2 — увеличилась.
3. После того как распилили бревно, пила нагрелась. Каким способом изменили внутреннюю энергию пилы?
А. При совершении работы. Б. При теплопередаче.
4. Чтобы увеличить внутреннюю энергию автомобильной шины, нужно…
А. Выпустить из шины воздух.
Б. Накачать в шину воздух.
5. Два одинаковых пакета с молоком вынули из холодильника. Один пакет оставили на столе, а второй перелили в кастрюлю и вскипятили. В каком случае внутренняя энергия молока изменилась меньше?
А. В обоих случаях не изменилась.
Б. В обоих случаях изменилась одинаково.
В. В первом случае.
Г. Во втором случае
Ф.И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 2
1. Каким способом можно изменить внутреннюю энергию тела?
А. Только совершением работы.
Б. Совершением работы и теплопередачей.
В. Только теплопередачей.
Г. Внутреннюю энергию тела изменить нельзя.
2. Первая пластина перемещалась по горизонтальной поверхности и в результате действия силы трения нагрелась, а вторая пластина была поднята вверх над горизонтальной поверхностью. В обоих случаях была совершена одинаковая работа. Изменилась ли внутренняя энергия пластин?
В обоих случаях была совершена одинаковая работа. Изменилась ли внутренняя энергия пластин?
А. У первой пластины не изменилась, у второй увеличилась.
Б. У обеих пластин увеличилась.
В. У первой пластины увеличилась, а у второй не изменилась.
Г. Не изменилась ни у первой, ни у второй пластин.
3. Сок поставили в холодильник и охладили. Каким способом изменили внутреннюю энергию сока?
А. При совершении работы. Б. При теплопередаче.
4. Резиновую нить слегка растянули. Чтобы внутренняя энергия нити увеличилась ее надо…
А. Растянуть сильнее. Б. Отпустить.
5. Два алюминиевых бруска массами 100 и 300 г, взятых при комнатной температуре, нагрели до одинаковой температуры. У какого бруска внутренняя энергия изменилась больше?
A. У обоих не изменилась.
Б. У обоих одинаково.
B. У первого бруска.
Г. У второго бруска.
Ф.И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 3
1. Внутренней энергией тела называют…
Внутренней энергией тела называют…
A. Энергию движения и взаимодействия частиц, из которых состоит тело.
Б. Энергию движущегося тела.
B. Энергию взаимодействия молекул.
Г. Энергию тела, поднятого над Землей.
Д. Энергию движения молекул.
2. Два одинаковых камня лежали на земле. Первый камень подняли и положили на стол, а второй подбросили вверх. Изменилась ли внутренняя энергия камней?
А. У первого камня не изменилась, у второго – увеличилась.
Б. У обоих камней увеличилась.
В. У первого камня увеличилась, а у второго не изменилась.
Г. У обоих камней не изменилась.
3. Чайник с водой поставили на огонь и вскипятили воду. Каким способом изменилась внутренняя энергии воды?
А. При теплопередаче. Б. При совершении работы.
4. В сосуде находится газ. Чтобы внутренняя энергия газа уменьшилась, нужно…
A. Сжать газ. Б. Увеличить объем газа.
5. В две одинаковые кастрюли налили одинаковое количество воды. В первой кастрюле воду довели до кипения, а во второй слегка подогрели. В каком случае внутренняя энергия воды изменилась меньше?
В две одинаковые кастрюли налили одинаковое количество воды. В первой кастрюле воду довели до кипения, а во второй слегка подогрели. В каком случае внутренняя энергия воды изменилась меньше?
А. В обоих случаях не изменилась.
Б. В первой кастрюле.
B. Во второй кастрюле.
Г. В обоих случаях одинаково.
Ф.И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 4
1. От чего зависит внутренняя энергия тела?
А. От энергии взаимодействия частиц, из которых состоит тело.
Б. От энергии движения этих частиц.
В. От энергии движения частиц и от энергии их взаимодействия.
Г. От скорости движения тела.
2. Один стакан с водой подняли вверх, совершив работу 1 Дж, а второй нагрели, передав ему 1 Дж количества теплоты. Изменилась ли внутренняя энергия воды в каждом стакане?
А. В обоих стаканах увеличилась.
В обоих стаканах увеличилась.
Б. В первом стакане уменьшилась, во втором увеличилась.
В. Нигде не изменилась.
Г. В первом увеличилась, во втором не изменилась.
Д. В первом не изменилась, во втором увеличилась.
3. При затачивании топор нагревается. Каков способ изменения внутренней энергии топора?
А. При теплопередаче. Б. При совершении работы.
4. В каком из перечисленных случае внутренняя энергия воды не меняется: 1) воду несут в ведре; 2) воду переливают из ведра в чайник; 3) воду нагревают до кипения.
А. 1. Б. 2. В. 3. Г. 1 и 2. Д. 1 и 3. Е. 2 и 3. Ж. 1, 2, 3.
5. Два медных бруска массами 400 и 200 г, взятых при комнатной температуре, охладили до одной и той же температуры. У какого бруска внутренняя энергия изменилась больше?
А. У первого бруска.
Б. У второго бруска.
В. У обоих одинаково.
Г. У обоих не изменилась.
Ф. И._______________________________________ 8 — «___» кл
И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 5
1. Каким способом можно изменить внутреннюю энергию тела?
А. Совершением работы и теплопередачей.
Б. Внутреннюю энергию тела изменить нельзя.
В. Только совершением работы.
Г. Только теплопередачей.
2. Первую пластину подняли вверх над горизонтальной поверхностью, а вторую несколько раз изогнули, в результате чего она нагрелась. Работа в обоих случаях была совершена одинаковая. Изменилась ли внутренняя энергия пластин?
А. У первой пластины увеличилась, а у второй не изменилась.
Б. Нигде не изменилась.
В. У первой не изменилась, а у второй увеличилась.
Г. У обеих пластин увеличилась.
3. Кувшин с молоком отнесли в погреб, где оно охладилось. Каким способом изменилась внутренняя энергия молока?
А. При совершении работы. Б. При теплопередаче.
При совершении работы. Б. При теплопередаче.
4. Пружину слегка сжали. Что нужно сделать, чтобы увеличить внутреннюю энергию пружины?
А. Сжать пружину сильнее. Б. Отпустить пружину.
5. Одну из двух одинаковых серебряных ложек опустили в стакан с кипятком, а другую в стакан с тёплой водой. В каком случае внутренняя энергия ложки изменится меньше?
А. В обоих случаях не изменится.
Б. И обоим случаях одинаково.
В. В первом случае.
Г. Во втором случае.
Ф.И._______________________________________ 8 — «___» кл
Внутренняя энергия и способы ее изменения
Вариант 6
1. Энергию движения и взаимодействия частиц, из которых состоит тело, называют…
A. Механической энергией.
Б. Кинетической энергией.
B. Потенциальной энергией.
Г. Внутренней энергией.
2. Два камня лежали на столе. Первый камень начал падать со стола, а второй взяли и положили на землю. Изменилась ли внутренняя энергия камней?
Первый камень начал падать со стола, а второй взяли и положили на землю. Изменилась ли внутренняя энергия камней?
А. У первого увеличилась, а у второго не изменилась.
Б. У обоих камней уменьшилась.
В. У первого не изменилась, а у второго уменьшилась.
Г. Ни у одного камня не изменилась.
3. После того как деталь обработали напильником, деталь нагрелась. Каким способом изменили внутреннюю энергию детали?
А. При совершении работы. Б. При теплопередаче.
4. В каком из перечисленных случаев внутренняя энергия чашки не изменилась: 1) чашку переставили из шкафа на стол; 2) чашку передвинули по столу; 3) в чашку налили горячий чай.
А. 1,2, 3. Б. 1. В. 2. Г. 3. Д. 1 и 2. Е. 1 и 3. Ж. 2 и 3.
5. Два железных бруска массами 200 и 300 г, взятых при комнатной температуре, охладили до одинаковой температуры.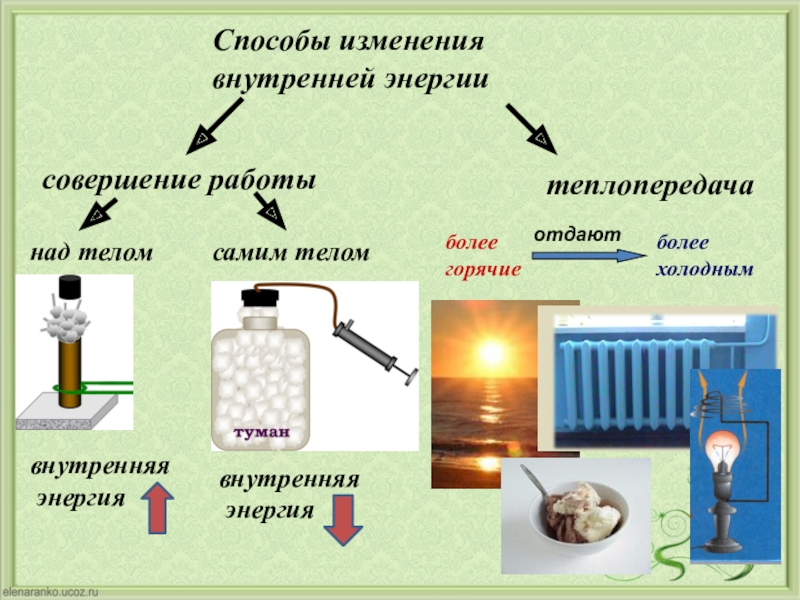 У какого бруска внутренняя энергия изменилась больше?
У какого бруска внутренняя энергия изменилась больше?
А. У первого бруска.
Б. У второго бруска.
В. У обоих не изменилась.
Г. У обоих одинаково.
ОТВЕТЫ НА ТЕСТ
Физика — 8
Так как внутренняя энергия тела равна сумме кинетических и потенциальных энергий составляющих его молекул, то при одинаковых прочих условиях (при неизменных значениях температуры н давления) тело большей массы будет обладать большей внутренней энергией.
ПРИМЕНИТЕ ИЗУЧЕННОЕ
ИССЛЕДОВАНИЕ-2
- В какой из колб внутренняя анергия воздуха больше?
Две одинаковые колбы соединены с манометрами. Одну колбу помещают в сосуд с горячей водой, а другую — в сосуд с холодной водой.
Определите:
1. В каком сосуде температура воды выше?
2. В какой колбе внутренняя энергия воздуха увеличилась, а в какой — уменьшилась? Почему?
КЛЮЧЕВЫЕ СЛОВА
Внутренняя энергия
Механическая энергия
Кинетическая энергия тела
Кинетическая энергия молекул
Потенциальная энергия тела
Потенциальная энергия молекул
ЧТО ВЫ УЗНАЛИ?
Перерисуйте схему в рабочие листы и заполните её, используя ключевые слова.
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
1. Какую энергию называют внутренней энергией тела?
Какую энергию называют внутренней энергией тела?
2. Какие составные части образуют полную энергию тела?
3. От чего зависит внутренняя энергия тела?
4. Приведите примеры превращения механической энергии во внутреннюю анергию.
Давайте вспомним 1 Что называется внутренней энергией тела
Давайте вспомним: 1. Что называется внутренней энергией тела? 2. Что называется количеством теплоты? Какой буквой обозначается, в в каких единицах измеряется? 3. По озеру на большой скорости плывет катер. Изменяется ли при этом внутренняя энергия воды в озере? А. Нет. Б. Да, она увеличивается. В. Да, она уменьшается. 4. На рисунке показано направление теплопередачи для трёх тел, находящихся при различных температурах. Какое тело имеет большую температуру? Меньшую? 1 2 3
1 3 2 4 Опишите превращения энергии в данных примерах.
• Что произойдет с пробкой при нагревании воды? Почему?
Археологи установили: остаткам первых костров около 400 000 лет! Тогда огонь получали случайно: удар молнии и старались поддерживать его.
Как добывали огонь древние люди? Когда-то чтобы добыть огонь, люди брали острую деревянную палочку, упирали её в деревянный брусок и быстро вращали. При достаточном упорстве через некоторое время в месте трения появлялся дым, начиналось тление и возгорание образовавшихся опилок и подложенного, например, сухого мха. .
Первые спички были изобретены в 1830 году 19 -летним французским химиком Шарлем Сориа. Это были фосфорные спички. Эти спички загорались даже от взаимного трения в коробке и при трении о любую твёрдую поверхность, например, подошву сапога. Эти спички были вредны для здоровья, так как белый фосфор очень ядовит. Головка современной спички на 60% состоит из бертолетовой соли, а также из горючих веществ — серы или сульфидов металлов. Чтобы воспламенение головки происходил медленно и равномерно, без взрыва, к массе добавляют так называемые наполнители — стеклянный порошок, оксид железа и т. д.
ИСПОЛЬЗОВАНИЕ ОГНЯ Обогрев жилища, приготовление пищи, плавка металлов, тепловые двигатели
Энергия топлива
Топливо – это вещество, при сгорании которого выделяется большое количество теплоты. водород
водород
Какой элемент является основным, входящим в состав всех видов топлива? Вид топлива Углерод Водород Кислород Азот Дрова 50% 6% 44% 0, 1% Торф 60% 5% 33, 5% 1, 5% Бурый уголь 70% 6% 23% 1% Каменный уголь 80% 5% 13, 5% 1, 5% Антрацит 95% 2% 2, 5% 0, 5% Нефть 84% 13% 2% 1% Природный газ 80% 15% 3% 2% Топливо содержат в большом количестве УГЛЕРОД!!!
С точки зрения химии горение — это реакция, протекающая с выделением света и тепла. Для того, чтобы зажечь вещество, его необходимо нагреть до температуры, которая называется температурой воспламенения. Например, для угля эта температура равняется 350°С. Q О О С Молекула углекислого газа (СО 2) О С С + О 2 =СО 2+Q О
Реакция горения С + О 2 =СО 2+Q При горении топлива один атом углерода соединяется с двумя атомами кислорода, образуется молекула углекислого газа При образовании этой молекулы выделяется э н е р г и я. Т. е часть внутренней энергии топлива превращается в тепловую Q =qm q-удельная теплота сгорания показывает, какое количество теплоты выделяется при полном сгорании 1 кг топлива. Внутренняя энергия топлива переходит в тепловую. =1 Дж / кг.
Внутренняя энергия топлива переходит в тепловую. =1 Дж / кг.
Удельная теплота сгорания топлива (q) – это физическая величина, показывающая, какое количество теплоты (Q) выделяется при полном сгорании топлива массой 1 кг. [c] = [Дж/кг] Дрова 1 кг => 1, 0 • 107 Дж Уголь 1 кг => 2, 7 • 107 Дж Нефть 1 кг => 4, 4 • 107 Дж Торф 1 кг => 1, 4 • 107 Дж Природный газ 1 кг => 4, 4 • 107 Дж
Выводы: 1. Использование топлива основано на явлении выделения энергии при соединении атомов в молекулу. 2. Топливом считать лишь те горючие вещества, которые обладают большой удельной теплотой сгорания, низкой температурой воспламенения. отсутствием вредных продуктов сгорания, широко распространены в природе, просты в добыче и транспортировке.
Как отличаются различные виды топлива друг от друга по количеству выделяемой энергии? Удельная теплота сгорания некоторых видов топлива, Дж/кг Порох Дрова сухие Торф Каменный уголь Спирт Антрацит 0, 38 • 107 1, 0 • 107 1, 4 • 107 2, 7 • 107 3, 0 • 107 Древесный уголь Природный газ Нефть Бензин Водород 3, 4 • 107 4, 6 • 107 12 • 107 Из таблицы видно, что, например, при сгорании 1 кг бензина выделяется 4, 6 • 107 Дж количества теплоты.
При расчете различных двигателей инженеру необходимо точно знать, какое количество теплоты может выделить сжигаемое топливо. ДЛЯ ЭТОГО НАДО ОПЫТНЫМ ПУТЕМ НАЙТИ, КАКОЕ КОЛИЧЕСТВО ТЕПЛОТЫ ВЫДЕЛИТСЯ ПРИ ПОЛНОМ СГОРАНИИ ОДНОГО КИЛОГРАММА ТОПЛИВА РАЗНЫХ ВИДОВ.
Интенсивное использование природного топлива ведет к истощению природных ресурсов и загрязнению окружающей среды. Количество сжигаемого топлива таково, что выделяемые при горении продукты изменяют меняется состав атмосферы: накапливается углекислый газ, выбрасываются миллионы тонн сажи, азотистых и сернистых, что приводит к запылению атмосферы, усиливая парниковый эффект, к выпадению кислотных дождей. И последствия этого загрязнения мы уже ощущаем на себе: болезни, изменение климата. Экологически чистое топливо – только водород. Ископаемые виды топлива являются невозобновляемыми. Они ограничены в предложении и в один прекрасный день будут истощены.
Человек, как биологическое существо также получает энергию. Что является для него топливом? • Энергия, за счет которой поддерживаются обменные функции организма человека, выделяется в ходе химических реакций окисления содержащихся в пище углеводов, жиров и белков. Роль топлива в человеческом организме играет пища. Разные виды пищи, как и разные виды топлива, содержат различный запас энергии. • Жиры – самый эффективный источник энергии. При «сгорании» в организме 1 г жиров выделяется примерно столько же энергии, как и при сгорании 1 г бензина. 1 ккал = 4, 2 к. Дж.
Что является для него топливом? • Энергия, за счет которой поддерживаются обменные функции организма человека, выделяется в ходе химических реакций окисления содержащихся в пище углеводов, жиров и белков. Роль топлива в человеческом организме играет пища. Разные виды пищи, как и разные виды топлива, содержат различный запас энергии. • Жиры – самый эффективный источник энергии. При «сгорании» в организме 1 г жиров выделяется примерно столько же энергии, как и при сгорании 1 г бензина. 1 ккал = 4, 2 к. Дж.
ЗАПОМНИ! Чтобы подсчитать количество теплоты Q, выделившееся при полном сгорании топлива любой массы m, нужно удельную теплоту сгорания q умножить на массу сгоревшего топлива: Q = qm m = Q/q q = Q/m
Закрепление 1. Какой элемент является основным, входящим в состав всех видов топлива? 2. Почему же, спеша нагреть воду в чайнике, увеличивают пламя, открывая кран горелки? 3. Кусок железа тоже можно сжечь при высокой начальной температуре и с большим количеством кислорода, почему оно не является топливом? 4. Как называют количество теплоты, которое выделяется при полном сгорании топлива массой 1 кг? А. Удельной теплоемкостью. Б. Удельной теплотой сгорания. В. Удельной теплотой плавления В. Удельной теплотой парообразования. 5. Какое топливо используется в топках домов, в двигателях автомобилей, в двигателях самолетов, в котлах электростанций? 6. Что должен знать человек о процессе горения, чтобы человек мог не только использовать горение для своего блага, но и защитить себя от пожара?
Как называют количество теплоты, которое выделяется при полном сгорании топлива массой 1 кг? А. Удельной теплоемкостью. Б. Удельной теплотой сгорания. В. Удельной теплотой плавления В. Удельной теплотой парообразования. 5. Какое топливо используется в топках домов, в двигателях автомобилей, в двигателях самолетов, в котлах электростанций? 6. Что должен знать человек о процессе горения, чтобы человек мог не только использовать горение для своего блага, но и защитить себя от пожара?
7. Каков состав дыма при горении различных веществ и их вред для окружающей среды. 8. ДАВАЙТЕ РАЗБЕРЕМСЯ! При подготовке уроков расходуется 6 к. Дж энергии в час на 1 кг массы. Сколько сахара надо съесть для обеспечения полноценной подготовки уроков в течении 2 -х часов. При сгорании 1 кг сахара выделяется 17 150 к. Дж энергии
Домашнее задание: • § 10 • Упр. 5 (1, 2, 3)
Внутренняя энергия — Простая английская Википедия, бесплатная энциклопедия кинетической энергии, обусловленной движением молекул (поступательное, вращательное, колебательное) и потенциальной энергии, связанной с колебательной и электрической энергией атомов внутри молекул или кристаллов.
 Она включает в себя энергию всех химических связей и энергию свободных электронов проводимости в металлах.
Она включает в себя энергию всех химических связей и энергию свободных электронов проводимости в металлах.Внутренняя энергия представляет собой термодинамический потенциал, и для замкнутой термодинамической системы с постоянной энтропией она будет минимизирована.
Можно также рассчитать внутреннюю энергию электромагнитного излучения или излучения абсолютно черного тела. Это функция состояния системы, экстенсивная величина. Единицей энергии в СИ является джоуль, хотя другие исторические, традиционные единицы все еще используются, такие как (малая и большая) калория для тепла. (Калории, которые указаны на классических этикетках продуктов питания, на самом деле являются килокалориями.)
Внутренняя энергия не включает поступательную или вращательную кинетическую энергию тела в целом . Он также не включает релятивистский эквивалент массы-энергии E = mc 2 . Он исключает любую потенциальную энергию, которую может иметь тело из-за его нахождения во внешнем гравитационном или электростатическом поле, хотя учитывается потенциальная энергия, которую оно имеет в поле из-за индуцированного электрического или магнитного дипольного момента, как и энергия деформации твердых тел ( стресс-перенапряжение).
Принцип равнораспределения энергии в классической статистической механике утверждает, что каждая молекулярная степень свободы получает 1/2 kT энергии, результат, который был изменен, когда квантовая механика объяснила некоторые аномалии; например, в наблюдаемых теплоемкостях кристаллов (при ч ν > кТл ). Для одноатомного гелия и других благородных газов внутренняя энергия состоит только из поступательной кинетической энергии отдельных атомов. Одноатомные частицы, конечно, не вращаются (ощутимо) и не вибрируют, и не возбуждаются электронным способом до более высоких энергий, за исключением очень высоких температур.
С точки зрения статистической механики внутренняя энергия равна среднему по ансамблю полной энергии системы.
- Льюис, Гилберт Ньютон; Рэндалл, Мерл: отредактировано Питцером, Кеннетом С. и Брюэром, Лео (1961). Термодинамика (2-е изд.). Нью-Йорк, штат Нью-Йорк, США: McGraw-Hill Book Co. ISBN 0-07-113809-9 .
 CS1 maint: несколько имен: список авторов (ссылка)
CS1 maint: несколько имен: список авторов (ссылка)
- Ландау, Л. Д.; Лифшиц, Э.М. (1986). Теория упругости (Курс теоретической физики Том 7) . (Перевод с русского Дж. Б. Сайкса и У. Х. Рейда) (Третье изд.). Бостон, Массачусетс: Баттерворт Хайнеманн. ISBN 0-7506-2633-X .
Как увеличить (внутреннюю) энергию и усилить психологию
Майкл Хетерингтон (BHlthSci) — целитель, психотерапевт, специалист по акупунктуре китайской медицины, преподаватель и йог тхэквондо.
Он помогает людям, испытывающим сомнения, беспокойство и замешательство, и приводит их к ясности, сосредоточенности и уверенности.
Майкл выступал на темы, связанные с энергетической медициной, энергетической психологией и китайской медициной, на многочисленных мероприятиях и фестивалях по всему миру, включая The Bali Spirit Festival в Индонезии и Omega Institute в Нью-Йорке вместе с доктором Сью Мортер, доктором , Дэвид Файнштейн и Донна Иден.
Он родом из Брисбена, Австралия, и теперь его можно найти на семинарах и мероприятиях в Австралии, Таиланде, Бали и Германии.
Майкл имеет степень бакалавра медицинских наук Университета Чарльза Стерта, диплом продвинутого уровня в области акупунктуры Австралийского института прикладных наук и сертификат учителя йоги Центра йоги Байрона.Он преподает йогу с 2008 года и был лектором восточной медицины в Австралийском институте прикладных наук с 2014 по 2015 год.
Когда ему было немного за двадцать, он страдал от регулярных мигренозных головных болей, депрессии и хронических болей в пояснице, которые он преодолел в основном с помощью практики йоги, релаксации и медитации.
Майкла всегда привлекала восточная философия, и именно этот интерес привлек его в раннем возрасте к учениям и практикам йоги, боевых искусств и китайской медицины.После поездки в Китай, чтобы преподавать английский язык в течение года, он вернулся в Австралию в 2004 году, чтобы начать изучать китайскую медицину, лечебный массаж и практиковать йогу Оки-До (форма японской йоги, разработанная доктором Масахиро Оки) под руководством Питера Мастерса.
Вдохновленный учениями многих, он понял, что беззаботный и заботливый подход к жизни приносит наибольшую пользу.
Другие интересы Майкла включают танцы под звездами, путешествия, времяпрепровождение на природе и чаепитие.
Глава 1 — Основные понятия (обновлено 04.01.12)
Глава 1 — Основные понятия (обновлено 04.01.12)Глава 1: Вводные понятия, единицы измерения и Определения
В этой главе различные соответствующие понятия и вводятся определения, которые будут использоваться на протяжении всего курса.
Термодинамика и энергия
Термодинамика наука об энергии, в том числе о хранении энергии и
энергия в пути. Консервация Энергетического принципа говорится, что энергия
не может быть создан или уничтожен, а может только изменить свою форму.То
нас больше всего интересуют три формы хранения энергии: Потенциальная энергия (ПЭ), Кинетик
Энергия (KE) и Внутренний
Энергия (U), которую мы представим ниже. Мы рассматриваем две формы транзитной энергии: Работа (Вт) и Нагрев (Q), и взаимодействия между этими различными формами
энергии определяются в терминах First
Закон термодинамики , который мы
представить в главе 3 .
Мы рассматриваем две формы транзитной энергии: Работа (Вт) и Нагрев (Q), и взаимодействия между этими различными формами
энергии определяются в терминах First
Закон термодинамики , который мы
представить в главе 3 .
Несколько слов о подразделениях
В этом курсе мы используем Международную систему (SI)
единиц исключительно, с редкими промахами.В США это
непрекращающаяся битва, вызывающая большую путаницу в глобальном техническом
среды (см. википедия на эту тему). Даже Национальный совет экзаменаторов
для инженерно-геодезических изысканий ( NCEES) кажется, запутался в этом пункте — Основы
Справочное руководство по инженерному делу (FE) и экзамен содержат исключительно SI
единицы, а затем, когда вы достигнете зрелости и будете готовы принять
Экзамен Professional Engineering (PE), вы обнаружите, что английская система
единиц (USCS) допустимо, а в некоторых случаях используется исключительно.Эта путаница достигла нового апогея, когда осенью 1999 года НАСА
125 миллионов долларов Марс
Климатический орбитальный аппарат разбился на Марсе
атмосферы, потому что ученые одного из субподрядчиков НАСА не смогли
перевести важные данные из английской системы в систему СИ
единицы.
Сила и работа
Начнем с Ньютона. Второй закон , а именно:
Вес тела – это сила, действующая на это тело из-за ускорение свободного падения (g = 9.807 [м/с 2 ]), в соответствии с Универсальной Теорией Гравитации, разработанной Исаак Ньютон. Легенда гласит, что Ньютон был вдохновлен яблоко падает ему на голову, как показано в восхитительной анимации Майк Гидри из Университета Теннесси. Что ж, эта легенда крайне актуальна, так как
вес маленького яблока примерно один ньютон. Более того,
масса пластиковой бутылки, содержащей один литр воды, равна
примерно один килограмм. |
В этот момент мы замечаем, что существует путаница о единицах массы и веса , в
Особенно с английской системой единиц. Это произошло потому, что
решения определить массу и вес независимо как 1 фунт
(фунт), хотя на самом деле они связаны вторым законом Ньютона.
Чтобы обосновать это, необходимо отдельно определить массу фунта.
(lbm) и фунт силы (lbf), таким образом, поскольку ускорение из-за
гравитация г = 32.2 [фут/с 2 ]
у нас есть:
Это произошло потому, что
решения определить массу и вес независимо как 1 фунт
(фунт), хотя на самом деле они связаны вторым законом Ньютона.
Чтобы обосновать это, необходимо отдельно определить массу фунта.
(lbm) и фунт силы (lbf), таким образом, поскольку ускорение из-за
гравитация г = 32.2 [фут/с 2 ]
у нас есть:
Одной из попыток решить этот парадокс была введение новой единицы массы, пули , таким образом:
1 пуля = 32,2 фунта
однако я призываю всех пойти в продуктовый магазин и попросите кусок картофеля.
Теперь рассмотрим выполненную работу (Вт), энергию в транзит, требующий как приложенной силы (F), так и движения (x). Если сила (F) постоянна на пройденном расстоянии (x), тогда совершенная работа дано:
Однако в общем случае сила (F) непостоянна
на расстоянии x, поэтому нам нужно суммировать всю дополнительную работу
процессы с учетом изменения силы (F). Это приводит к эквивалентной интегральной форме для определения выполненной работы
(W) следующим образом:
Это приводит к эквивалентной интегральной форме для определения выполненной работы
(W) следующим образом:
Комплект выживания для американских студентов
За годы работы мы разработали базовые Единицы Набор для выживания (для оспариваемых SI), чтобы помочь преобразовать между система единиц USCS (английская) и система единиц SI (международная), а также развивать чувство величины различных единиц.
Быстрая викторина — мы все знаем
(судя по нашим спидометрам), что 50 миль в час эквивалентны 80
км/ч.
1. Какова точность этого преобразования?
2. Используйте это
информация, показывающая, что 9 миль в час эквивалентны 4 м/с.
Мы обнаруживаем, что с указанным выше набором для выживания мы можем определить множество преобразований единиц между единицами SI и английскими единицами, обычно, как показано в следующем блоке:
По мере нашего продвижения и изучения новых концепций мы будем добавлять
этот набор для выживания.
Формы энергии
Мы представляем различные формы энергии интереса нам в терминах твердого тела, имеющего массу m [кг].К ним относятся потенциальная, кинетическая и внутренняя энергия. Потенциальная энергия (PE) равна связано с возвышением тела и может быть оценено в работу, проделанную для подъема тела с одного исходного уровня на другой при постоянном ускорении свободного падения g [м/с 2 ], следующим образом:
Кинетическая энергия (КЭ) тела связана с его скорость [РС] и может быть оценена с точки зрения работы, необходимой для изменения скорость тела, следующим образом:
Внутренняя энергия (U) тела связана с молекулярная активность тела, на которую указывает его температура T [°C] и может быть оценено с точки зрения тепла, необходимого для изменения температура тела, обладающего удельной теплоёмкостью C [Дж/кг.°С], следующим образом:
Приготовление пищи с потенциальной энергией
Чтобы получить интуитивное понимание
относительные величины различных форм энергии мы рассматриваем
(насмешливый) пример попытки приготовить индейку потенциальным
энергия. Индейку заносят на крышу 100-метрового здания (около
30 этажей), а затем упал с уступа. Потенциальная энергия
таким образом преобразуется в кинетическую энергию, и, наконец, при ударе кинетическая
энергия превращается во внутреннюю энергию.Увеличение внутреннего
энергия представлена повышением температуры, и, надеюсь,
если этот эксперимент повторить достаточное количество раз, температура повысится
позволит индейке приготовиться. Этот замечательный эксперимент был впервые
сообщили R.C.Gimmi и Gloria J Browne — «Кулинария
с потенциальной энергией» , опубликованной в
журнал о невоспроизводимых результатах (том 33, 1987 г.,
стр. 21-22).
Индейку заносят на крышу 100-метрового здания (около
30 этажей), а затем упал с уступа. Потенциальная энергия
таким образом преобразуется в кинетическую энергию, и, наконец, при ударе кинетическая
энергия превращается во внутреннюю энергию.Увеличение внутреннего
энергия представлена повышением температуры, и, надеюсь,
если этот эксперимент повторить достаточное количество раз, температура повысится
позволит индейке приготовиться. Этот замечательный эксперимент был впервые
сообщили R.C.Gimmi и Gloria J Browne — «Кулинария
с потенциальной энергией» , опубликованной в
журнал о невоспроизводимых результатах (том 33, 1987 г.,
стр. 21-22).
Какое разочарование! При 0,33°C за осень будет требуется повторить эксперимент 600 раз только для того, чтобы дойти до готовки температура 200°С.
Термодинамические системы
В целях анализа мы рассматриваем два типа Термодинамические системы:
Закрытая система — обычно упоминается как Система или контроль Масса .
 Этот тип системы
отделена от своего окружения физической границей. Энергия в
транзит в виде работы или тепла может проходить через систему
границы, однако массовый поток через границу быть не может. Один
типичным примером системы является устройство поршень/цилиндр, в котором
система определяется как фиксированная масса жидкости, содержащейся внутри
цилиндр.
Этот тип системы
отделена от своего окружения физической границей. Энергия в
транзит в виде работы или тепла может проходить через систему
границы, однако массовый поток через границу быть не может. Один
типичным примером системы является устройство поршень/цилиндр, в котором
система определяется как фиксированная масса жидкости, содержащейся внутри
цилиндр.Открытая система — обычно упоминается как Control Том . В этом случае в дополнение к работы или теплоты, мы имеем массовый расход рабочего тела через границы системы через впускные и выпускные порты. В этом курсе мы будет касаться исключительно устойчивых объемов управления потоком, в что чистая масса рабочей жидкости в границах системы остается постоянным (т.е. массовый расход на входе [кг/с] = массовый расход на выходе [кг/с]). Следующие разделы относятся в основном к системам — мы рассмотрим контрольные объемы более подробно, начиная с главы 4а .
Свойства системы
Показанная выше закрытая система может быть определена
различные свойства ,
такие как его давление (P), температура (T), объем (V) и масса (m). Мы введем и определим различные свойства термодинамических
интерес по мере необходимости в контексте. Кроме того, свойства могут быть
либо расширенный или Интенсивный (или Конкретный ).
Экстенсивное свойство – это свойство, значение которого зависит от массы
системы, в отличие от интенсивного свойства (такого как давление или
температура), которая не зависит от массы системы.Специфический
свойство есть интенсивное свойство, полученное путем деления
свойство экстенсивности по массе системы. Далее следуют два примера
— обратите внимание, что конкретные свойства всегда будут иметь килограммы (кг) в
знаменатель единиц.
Мы введем и определим различные свойства термодинамических
интерес по мере необходимости в контексте. Кроме того, свойства могут быть
либо расширенный или Интенсивный (или Конкретный ).
Экстенсивное свойство – это свойство, значение которого зависит от массы
системы, в отличие от интенсивного свойства (такого как давление или
температура), которая не зависит от массы системы.Специфический
свойство есть интенсивное свойство, полученное путем деления
свойство экстенсивности по массе системы. Далее следуют два примера
— обратите внимание, что конкретные свойства всегда будут иметь килограммы (кг) в
знаменатель единиц.
Одним из часто используемых исключений из приведенных выше определений является концепция удельного веса, определяемая как вес на единицу объем. Мы не будем использовать это понятие в тексте.
Состояние и равновесие
Состояние системы определяется значениями различных
интенсивные свойства системы. Состояние Постулат утверждает, что если два
определяются независимые интенсивные значения свойств, то все остальные
интенсивные значения свойств (и, следовательно, состояние системы) также
определенный. Это может значительно упростить графическое представление
системы, так как требуются только двумерные графики. Обратите внимание, что
давление и температура не обязательно являются независимыми свойствами,
Таким образом, кипящая жидкость изменит свое состояние с жидкого на парообразное при
постоянная температура и давление.
Состояние Постулат утверждает, что если два
определяются независимые интенсивные значения свойств, то все остальные
интенсивные значения свойств (и, следовательно, состояние системы) также
определенный. Это может значительно упростить графическое представление
системы, так как требуются только двумерные графики. Обратите внимание, что
давление и температура не обязательно являются независимыми свойствами,
Таким образом, кипящая жидкость изменит свое состояние с жидкого на парообразное при
постоянная температура и давление.
Предположим, что во всей системе Равновесие условия преобладают, таким образом, нет температуры или градиенты давления или переходные эффекты. В любой момент весь система находится в химическом и фазовом равновесии.
Процесс и цикл
А Процесс это изменение состояния системы из начального в
конечное состояние за счет взаимодействия энергии (работы или теплоты) с его
окрестности. Например, на следующей диаграмме система имеет
подвергался процессу сжатия в поршне-цилиндровом устройстве.
Процесс Путь определяет тип процесса подвергся Типичные пути процесса:
Изотермический (процесс с постоянной температурой)
Изохорный или Изометрический (процесс постоянного объема)
Изобарический (процесс постоянного давления)
Адиабатический (отсутствие потока тепла в систему или из системы во время процесса)
Мы предполагаем, что все процессы квазистатические в котором равновесие достигается после каждого приращения шаг процесса.
Система проходит цикл когда он проходит через последовательность процессов, которые приводят систему вернуть в исходное состояние.
Давление
Основной единицей давления является Паскаль [Па]. однако практическими единицами измерения являются килопаскаль [кПа], бар [100 кПа] или атм. (атмосфера) [101,32 кПа]. Датчик (или Вакуум ) давление связано с Абсолютным давление, как показано на диаграмме ниже:
Основным методом измерения давления является Манометр , как показано ниже:
Атмосферное давление измеряется с помощью Ртутный барометр следующим образом:
Решено
Проблема 1.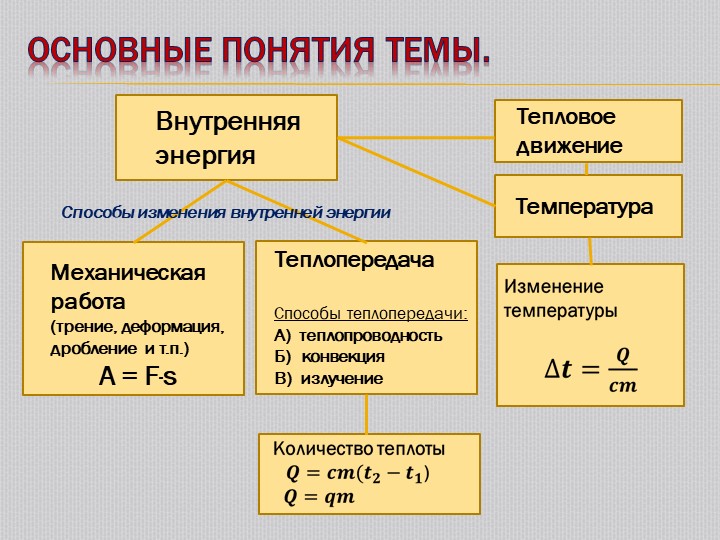 1 — Использование барометра для
определить высоту здания это
решенная задача позволяет определить высоту здания в
по разнице атмосферного давления между верхней и
нижняя часть здания. Отметим, что по легенде, когда это
задача была поставлена перед лауреатом Нобелевской премии Нильсом Бором (тогда еще
студент), он придумал интересный ответ, как показано на
следуя австралийскому веб-сайту Virtual
Учитель .
1 — Использование барометра для
определить высоту здания это
решенная задача позволяет определить высоту здания в
по разнице атмосферного давления между верхней и
нижняя часть здания. Отметим, что по легенде, когда это
задача была поставлена перед лауреатом Нобелевской премии Нильсом Бором (тогда еще
студент), он придумал интересный ответ, как показано на
следуя австралийскому веб-сайту Virtual
Учитель .
Проблема 1.2 — Использование двух манометров для измерения падение давления и выходное давление сжатого воздуха, протекающего в труба
Температура
Температура является мерой молекулярной активности и разница температур между двумя соприкасающимися телами (например, непосредственное окружение и система) является движущей силой, ведущей к теплообмену между ними.
Оба по Фаренгейту и по Цельсию весы широко используются в США, поэтому важно уметь конвертировать между ними.Кроме того, мы будем обнаружить, что в некоторых случаях нам требуется Абсолют ( Ранкин и Кельвина ) температурные шкалы (например, при использовании уравнения идеального газа состояние), поэтому мы считаем удобным изобразить все четыре шкалы как следует:
Обратите внимание на график, что -40°C равно -40°F, что приводит к удобным формулам для преобразования между двумя шкалами следующим образом:
Быстрая викторина — The
температура в Чикаго зимой может опускаться до 14°F. Что
температура в °C, K и °R. [-10°С,
263 K, 474°R] Обратите внимание, что по соглашению 263
K читается как «263 Кельвина», а не как «263 градуса Кельвина».
Что
температура в °C, K и °R. [-10°С,
263 K, 474°R] Обратите внимание, что по соглашению 263
K читается как «263 Кельвина», а не как «263 градуса Кельвина».
__________________________________________________________________________________________
Инженерная термодинамика Израиля
Уриэли находится под лицензией Creative
Commons Attribution-Noncommercial-Share Alike 3.0 США
Лицензия
Внутренняя энергия — Тепловая энергия | Определение
Потенциальная энергия и кинетическая энергия , которые обсуждались в предыдущих главах – это макроскопические формы энергии .Они зависят от макроскопических переменных, таких как положение и скорость объектов.
В термодинамике внутренняя энергия (также называемая тепловой энергией ) определяется как энергия, связанная с микроскопическими формами энергии . Это экстенсивная величина, и она зависит от размера системы или от количества содержащегося в ней вещества. Единицей СИ внутренней энергии является джоулей (Дж) . Это энергия, содержащаяся внутри системы, за вычетом кинетической энергии движения системы в целом и потенциальной энергии системы. Микроскопические формы энергии включают в себя формы, обусловленные вращением , вибрацией, перемещением и взаимодействиями между молекулами вещества. Ни одна из этих форм энергии не может быть измерена или оценена напрямую. Тем не менее, были разработаны методы оценки изменения общей суммы всех этих микроскопических форм энергии.
Единицей СИ внутренней энергии является джоулей (Дж) . Это энергия, содержащаяся внутри системы, за вычетом кинетической энергии движения системы в целом и потенциальной энергии системы. Микроскопические формы энергии включают в себя формы, обусловленные вращением , вибрацией, перемещением и взаимодействиями между молекулами вещества. Ни одна из этих форм энергии не может быть измерена или оценена напрямую. Тем не менее, были разработаны методы оценки изменения общей суммы всех этих микроскопических форм энергии.
Кроме того, энергия может накапливаться в химических связях между атомами, из которых состоят молекулы. Этот запас энергии на атомном уровне включает энергию, связанную с электронными орбитальными состояниями, ядерным спином и силами связи в ядре.
Внутренняя энергия представлена символом U , а изменение внутренней энергии в процессе равно U 2 – U 1 .
Микроскопическая энергия
Внутренняя энергия включает энергию в микроскопическом масштабе . Его можно разделить на микроскопическую потенциальную энергию, U pot , и микроскопическую кинетическую энергию, U kin , компоненты:
U = U pot + U kin , где 902 kin кинетическая энергия, U kin , включает в себя движений всех частиц системы для системы центра масс.Для идеального одноатомного газа это просто поступательная кинетическая энергия линейного движения атомов. Одноатомные частицы не вращаются и не вибрируют. Кинетическая теория газов хорошо описывает поведение системы. Кинетическая теория основана на том факте, что при упругом столкновении молекулы с большой кинетической энергией и молекулы с малой кинетической энергией часть энергии передается молекуле с меньшей кинетической энергией. Однако для многоатомных газов есть вращательная и колебательная кинетическая энергия .
Однако для многоатомных газов есть вращательная и колебательная кинетическая энергия .
Микроскопическая потенциальная энергия, U pot , включает химических связей между атомами, из которых состоят молекулы, силы связи в ядре и поля физических сил внутри системы (например, электрические или магнитные поля).
Существует значительная составляющая потенциальной энергии, связанная с межмолекулярными силами притяжения в жидкостях и твердых телах.
Удельная внутренняя энергия
Удельная внутренняя энергия (u) вещества представляет собой его внутреннюю энергию на единицу массы.Это интенсивное свойство . Он равен полной внутренней энергии (U), деленной на общую массу (m).
u = U/м
где:
u = удельная внутренняя энергия (Дж/кг)
U = внутренняя энергия (Дж)
m = масса (кг)
9 900 Идеальный газ
«Что
Идеальный газ определяется как газ, в котором все столкновения между атомами или молекулами являются абсолютно упругими и в котором отсутствуют межмолекулярные силы притяжения . Идеальный газ можно представить себе как набор из 90 059 совершенно твердых 90 060 сфер, которые сталкиваются, но в остальном не взаимодействуют друг с другом. В действительности ни один реальный газ не похож на идеальный газ, и, следовательно, никакие реальные газы полностью не следуют закону или уравнению идеального газа.
Идеальный газ можно представить себе как набор из 90 059 совершенно твердых 90 060 сфер, которые сталкиваются, но в остальном не взаимодействуют друг с другом. В действительности ни один реальный газ не похож на идеальный газ, и, следовательно, никакие реальные газы полностью не следуют закону или уравнению идеального газа.При температурах, близких к точке кипения газа, повышение давления вызовет конденсацию и резкое уменьшение объема. При очень высоких давлениях межмолекулярные силы газа значительны.
Однако большинство газов примерно совпадают при давлениях и температурах выше их точки кипения.Закон идеального газа используется инженерами, работающими с газами, потому что он прост и приближает поведение реального газа.
В идеальном газе молекулы не имеют объема и не взаимодействуют. Согласно закону идеального газа давление изменяется линейно с температурой и количеством и обратно пропорционально объему.
PV = NRT
, где:
P — это абсолютное давление газа
N — это количество вещества
T — абсолютная температура
V объем
R является идеальной или универсальной газовой постоянной, равной произведению постоянной Больцмана и постоянной Авогадро,
В этом уравнении символ R представляет собой постоянную, называемую универсальной газовой постоянной , имеет одинаковое значение для всех газов, а именно, R=8. 31 Дж/моль К. Мы можем переписать предыдущее уравнение в альтернативной форме, используя константу, называемую константой Больцмана k, которая определяется как:
31 Дж/моль К. Мы можем переписать предыдущее уравнение в альтернативной форме, используя константу, называемую константой Больцмана k, которая определяется как:
k = R / N A = [8,31 Дж/моль K ] / [6,02 x 10 23 моль -1 ] = 1,38 x 10 -23 Дж/К
Внутренняя энергия есть сумма всей энергии, связанной с движением атомов или молекул в система. Микроскопические формы энергии включают в себя те, что обусловлены вращением , вибрацией , поступательным движением и взаимодействиями между молекулами вещества.
Одноатомный газ
Для одноатомного идеального газа (такого как гелий, неон или аргон) единственный вклад в энергию вносит поступательная кинетическая энергия . Средняя поступательная кинетическая энергия отдельного атома зависит только от температуры газа и определяется уравнением:
К ср = 3/2 кТл.
внутренняя энергия n молей идеального одноатомного (один атом на молекулу) газа равна средней кинетической энергии на молекулу, умноженной на общее число молекул, N:
E int = 3/ 2 NkT = 3/2 nRT
, где n — количество молей, каждое направление (x, y и z) дает вклад (1/2)nRT во внутреннюю энергию.Вот тут-то и появляется идея равнораспределения энергии – любой другой вклад в энергию также должен вносить вклад (1/2)nRT. Как видно, внутренняя энергия идеального газа зависит только от температуры и количества молей газа.
Двухатомная молекула
Если молекулы газа содержат более одного атома, существует три направления поступательного движения и вклад кинетической энергии вращения , но только для вращения вокруг двух из трех перпендикулярных осей.Пять вкладов в энергию (пять степеней свободы) дают:
Двухатомный идеальный газ:
E int = (5/2)NkT = (5/2)nRT
Это только приближение и применяется при промежуточных температурах. При низких температурах вносит вклад только поступательная кинетическая энергия, а при более высоких температурах два дополнительных вклада (кинетическая и потенциальная энергия) исходят от вибрации.
При низких температурах вносит вклад только поступательная кинетическая энергия, а при более высоких температурах два дополнительных вклада (кинетическая и потенциальная энергия) исходят от вибрации.
Внутренняя энергия будет больше при заданной температуре, чем для одноатомного газа, но она все равно будет функцией только температуры для идеального газа.
Внутренняя энергия реальных газов также в основном зависит от температуры. Тем не менее, подобно закону идеального газа , внутренняя энергия реальных газов в некоторой степени зависит от давления и объема. Все реальные газы приближаются к идеальному состоянию при низких давлениях (плотностях). При низком давлении молекулы находятся достаточно далеко друг от друга, чтобы не взаимодействовать друг с другом. Внутренняя энергия жидкостей и твердых тел довольно сложна, так как включает электрическую потенциальную энергию, связанную с силами (или «химическими» связями) между атомами и молекулами.
Второй закон Джоуля
Для любого газа, уравнение состояния которого точно определяется выражением pV = nRT (или pv = RT), удельная внутренняя энергия зависит только от температуры. Это правило было первоначально найдено в 1843 году Джоулем экспериментально для реальных газов и известно как Второй закон Джоуля :
Это правило было первоначально найдено в 1843 году Джоулем экспериментально для реальных газов и известно как Второй закон Джоуля :
Внутренняя энергия фиксированной массы идеального газа зависит только от его температуры (а не от давления или объема).
Удельная энтальпия газа, описываемая pV = nRT, также зависит только от температуры.Обратите внимание, что энтальпия — это термодинамическая величина, эквивалентная общему содержанию тепла в системе. Она равна внутренней энергии системы плюс произведение давления на объем. Таким образом, в интенсивных переменных второй закон Джоуля задается формулой h = h(T) = u(T) + pv = u(T) + RT.
Эти три уравнения составляют модель идеального газа, обобщенную следующим образом:
Внутренняя энергия и первый закон термодинамики
В термодинамике понятие энергии расширено для учета других наблюдаемых изменений.Принцип сохранения энергии расширен и включает широкий спектр способов взаимодействия систем с окружающей средой. Единственными способами изменения энергии замкнутой системы являются передача энергии за счет работы или за счет теплоты . Кроме того, на основе экспериментов Джоуля и других фундаментальный аспект концепции энергии состоит в том, что энергия сохраняется. Этот принцип известен как первый закон термодинамики . Первый закон термодинамики можно записать в различных формах:
Единственными способами изменения энергии замкнутой системы являются передача энергии за счет работы или за счет теплоты . Кроме того, на основе экспериментов Джоуля и других фундаментальный аспект концепции энергии состоит в том, что энергия сохраняется. Этот принцип известен как первый закон термодинамики . Первый закон термодинамики можно записать в различных формах:
Прописью:
Физическая схема четырех основных устройств, используемых в цикле Ренкина и основных передачах энергии.
Форма уравнения:
9009 = Q — W = Q — W
, где E int представляет собой внутреннюю энергию материала, который зависит только от материала состояние (температура, давление и объем). Q — это полезное тепло, добавленное в систему, а Вт — это чистая работа, выполненная системой. Мы должны быть осторожны и последовательны в соблюдении соглашений о знаках для Q и W.Поскольку W в уравнении — это работа, совершаемая системой, то, если над системой совершается работа, W будет отрицательным, а E int увеличится.
Q — это полезное тепло, добавленное в систему, а Вт — это чистая работа, выполненная системой. Мы должны быть осторожны и последовательны в соблюдении соглашений о знаках для Q и W.Поскольку W в уравнении — это работа, совершаемая системой, то, если над системой совершается работа, W будет отрицательным, а E int увеличится.
Аналогично, Q положительна для тепла, добавляемого в систему, поэтому, если тепло уходит из системы, Q отрицательно. Это говорит нам о следующем: внутренняя энергия системы имеет тенденцию к увеличению, если система поглощает тепло или если над системой совершается положительная работа. И наоборот, внутренняя энергия имеет тенденцию к уменьшению, если система теряет тепло или если над системой совершается отрицательная работа.Следует добавить, что Q и W зависят от пути, а E int не зависит от пути.
Дифференциальная форма:
dE int = dQ – dW
Внутренняя энергия E int системы имеет тенденцию к уменьшению, если энергия добавляется в виде тепла Q и имеет тенденцию к работа W совершается системой.
См. также: Открытая система – Закрытая система – Изолированная система
Различие температуры, тепла и внутренней энергии
Используя кинетическую теорию, можно провести четкое различие между этими тремя свойствами.
- Температура связана с кинетической энергией молекул материала. Это средняя кинетическая энергия отдельных молекул.
- Внутренняя энергия относится к полной энергии всех молекул внутри объекта. Таким образом, это экстенсивное свойство , когда два горячих стальных слитка одинаковой массы могут иметь одинаковую температуру, но два из них имеют вдвое большую внутреннюю энергию, чем один.
- Наконец, теплота — это количество энергии, самопроизвольно перетекающей от одного тела к другому из-за разницы их температур.
Его необходимо добавить, и когда разница температур существует, тепло самопроизвольно перетекает из более теплой системы в более холодную .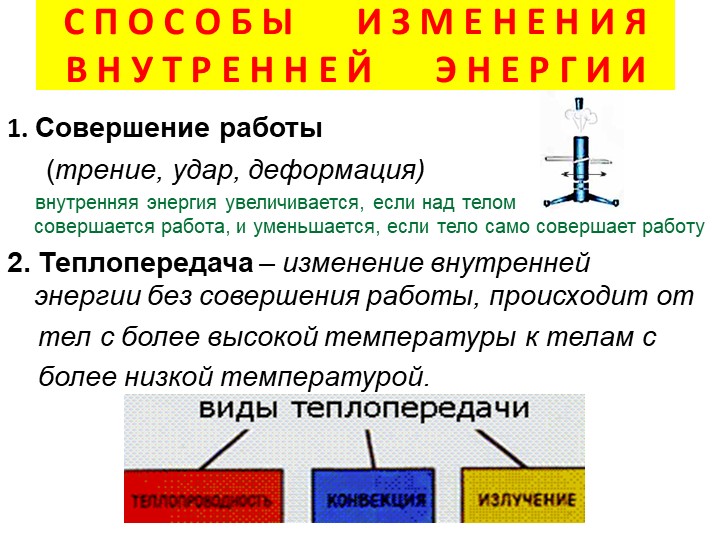 Таким образом, если 5-килограммовый куб стали при 100°C поместить в контакт с 500-килограммовым кубом стали при 20°C, то теплота перетечет от куба при 300°C к кубу при 20°C, хотя внутренняя энергия кубов с температурой 20°C намного больше, потому что их намного больше.
Таким образом, если 5-килограммовый куб стали при 100°C поместить в контакт с 500-килограммовым кубом стали при 20°C, то теплота перетечет от куба при 300°C к кубу при 20°C, хотя внутренняя энергия кубов с температурой 20°C намного больше, потому что их намного больше.
Особенно важным понятием является термодинамическое равновесие .В общем, когда два объекта приведены в тепловой контакт , тепло будет течь между ними до тех пор, пока они не придут в равновесие друг с другом.
3 простых метода использования вашей внутренней энергии
Возможно, это не всегда так (я говорю вам, понедельник), но через тело проходит постоянный поток энергии. Когда вы чувствуете себя здоровым, сильным и энергичным, эта энергия или прана движется беспрепятственно; когда вы чувствуете себя вялым, унылым или больным, оно становится застойным, даже заблокированным.
Чтобы заставить эту жизненную энергию работать в оптимальном режиме, вам не нужно выпивать галлон кофе или окунать голову в ведро ледяной воды; все, что вам нужно сделать, это научиться задействовать бандх .
Так что же такое
Бандха ?Термин «бандха» относится к одной из трех областей тела, которые работают как энергетические замки. Когда вы задействуете один (или все три) из этих замков, энергия временно задерживается; при освобождении замка накопленная энергия вытекает наружу, как открываются шлюзы, и очищает блокировку.
Эту технику «собери-и-расслабься» легко выполнять с задержкой дыхания и мышечным сокращением.
Джаландхара Бандха – Горловой замокЧтобы выполнить горловой замок, удобно сядьте, скрестив ноги. Медленно вдохните через нос, задержите дыхание, а затем опустите подбородок к груди (вы создадите двойной подбородок). Задержитесь так долго, как вам удобно, поднимите подбородок и вдохните.
Джаландхара бандха стимулирует сердечно-сосудистую и дыхательную системы; он растягивает шею, укрепляет щитовидную железу и помогает сбалансировать обмен веществ.
Уддияна бандха – Брюшной замок Для выполнения уддияна бандха встаньте, наклонив туловище вперед, руки на бедрах, ступни слегка расставлены; или сядьте в удобное положение со скрещенными ногами, слегка наклонитесь вперед и расслабьте руки по бокам. Глубоко вдохните через нос, резко выдохните и втяните живот вверх, выпустив как можно больше воздуха. Сделайте паузу и задержите дыхание, не напрягаясь, а затем медленно выдохните.
Глубоко вдохните через нос, резко выдохните и втяните живот вверх, выпустив как можно больше воздуха. Сделайте паузу и задержите дыхание, не напрягаясь, а затем медленно выдохните.
Желудочный замок не только укрепляет пресс, но также улучшает пищеварение и выделение крови, стимулируя приток крови к животу.Это также улучшает иммунную систему.
Мула-бандха – Корневой замокЧтобы задействовать корневой замок, удобно сядьте со скрещенными ногами. Расслабляться. Сделать вдох через нос; медленно выдохните и мягко задействуйте мышцы промежности.
Промежность (также называемая тазовым дном) — это область между анусом и вульвой (девочки) или мошонкой (парни). Работайте сзади вперед и представьте, что вы сокращаете мышцы, чтобы избежать выхода газов, а затем усиливаете сокращение, чтобы задержать мочеиспускание.Это тонкое сжатие и подъем; ягодицы должны оставаться расслабленными. Дышите нормально, задержите дыхание на 10 секунд, а затем отпустите.
Активация мула бандхи омолаживает весь организм и успокаивает нервную систему. Нарушается основная сила, а также проблемы с недержанием мочи и сексуальной функцией.
Нарушается основная сила, а также проблемы с недержанием мочи и сексуальной функцией.
Практикуйте энергетические замки, чтобы усилить, очистить и обновить свой энергетический поток. Со временем ваше дыхание станет более эффективным, и вы сможете удерживать замок дольше.
Как только вы освоите три замка, попробуйте Маха Бандху или Великий Замок. Выдохните полностью и выполните каждую бандху в тандеме, продвигаясь вниз по телу для полной перестройки системы.
Бандхи — отличный инструмент для использования перед медитацией, чтобы успокоить ум и активировать чакры. —Карен
Составные части, значение и характеристики
Наука > Химия > Химическая термодинамика и энергетика > Понятие внутренней энергии Внутреннюю энергию можно определить как сумму всех возможных видов энергий, которыми обладает система.Каждая химическая реакция связана с тепловым превращением. Тепло либо выделяется, либо поглощается.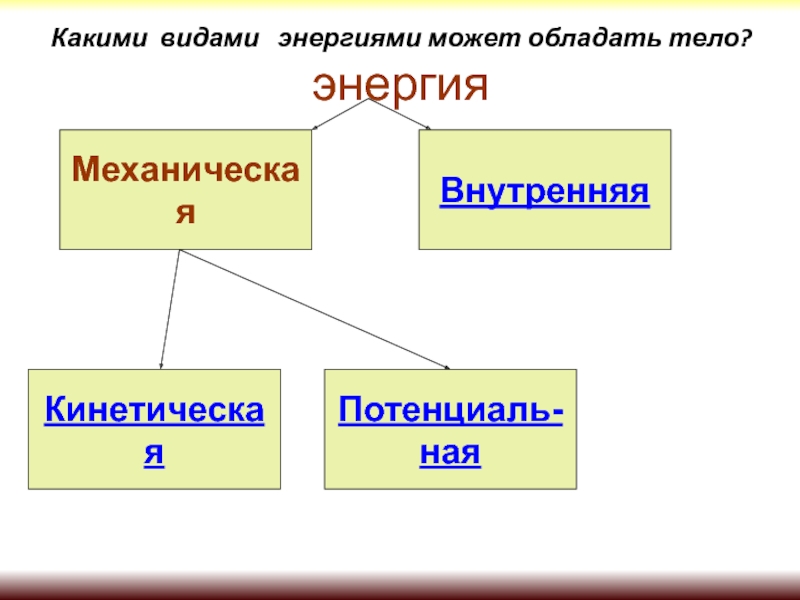 Это возможно только тогда, когда каждое вещество, участвующее в химической реакции, обладает определенным фиксированным количеством энергии, называемой внутренней энергией. Любое вещество состоит из молекул, атомов и субатомных частиц. Положение и движения молекул, атомов и субатомных частиц являются источником внутренней энергии.
Это возможно только тогда, когда каждое вещество, участвующее в химической реакции, обладает определенным фиксированным количеством энергии, называемой внутренней энергией. Любое вещество состоит из молекул, атомов и субатомных частиц. Положение и движения молекул, атомов и субатомных частиц являются источником внутренней энергии.
Составляющие внутренней энергии:
Кинетическая или тепловая энергия:
Энергия которой тело обладает благодаря своим движениям, называется кинетической энергией.С кинетическая энергия зависит от температуры и называется тепловой энергией. Тепловая энергия прямо пропорциональна температуре. К.Э. является трех видов
Поступательная энергия (E транс ):
Энергия
связаны с молекулами из-за непрерывных, быстрых, случайных движений
по прямолинейному пути называется поступательной энергией. Молекулы газов или
жидкости находятся в состоянии постоянного хаотического движения. Следовательно, молекулы
газы и жидкости обладают поступательной энергией.
Вибрационная энергия (E вибрация ):
Энергия связанный с молекулами вследствие колебаний атомов, называется колебательным. энергия.
Есть сила отталкивания между ядрами двух атомов и электронами двух атомов. Между ядром одного атома и электроны других атомов и наоборот. В результате этих аттракционов и отталкивания, атомы находятся в состоянии движения вперед и назад. Вибрации бывают двух типов, а именно.вибрация растяжения и изгиба.
Вращательная энергия (E rot ):
Энергия связанный с молекулами в силу их вращения вокруг своей оси, называется вращательной энергией. Все двухатомные и многоатомные молекулы вращаются вокруг ось, перпендикулярная оси молекулы.
Таким образом полная кинетическая энергия системы равна
К.Э. = E транс + E вибрация + E вращение
Потенциальная энергия или энергия связи:
Энергия
связанная с телом в силу своего положения, называется потенциальной
энергия. Потенциальная энергия не зависит от температуры. Это возникает
за счет связи между атомами в молекуле. Он классифицируется на два
типы.
Потенциальная энергия не зависит от температуры. Это возникает
за счет связи между атомами в молекуле. Он классифицируется на два
типы.
Межмолекулярная энергия (E межмолекулярная ):
Количество энергии, необходимой для отделения молекул друг от друга, называется межмолекулярная энергия. В твердых и жидких телах молекулы удерживаются вместе посредством слабых физических сил притяжения, называемых силами Вандер-Ваальса. Эти силы в твердых телах сильны, следовательно, межмолекулярная энергия больше в твердых телах, чем в жидкостях.
Внутримолекулярная энергия (E внутримолекулярная ):
Энергия
необходимого для разложения молекулы на составляющие ее атомы, называется
внутримолекулярная энергия. Атомы удерживаются вместе в молекуле определенными
электростатическая сила притяжения называется химической связью. Так
внутримолекулярная энергия есть не что иное, как энергия, необходимая для разрушения химического
связи, чтобы изолировать составляющие атомы друг от друга.
Таким образом, полная потенциальная энергия системы равна
P.E. = E межмолекулярный + E интрамоль .
Суммарная внутренняя энергия системы:
Внутренняя энергия есть сумма К.Э. и П.Е. Абсолютное значение этого не может быть определено, но может быть определено его изменение.
Значение Внутренняя энергия:
- Зависит от количества вещества, следовательно, это экстенсивное свойство.
- Изменение представляет собой теплоту, выделяющуюся или поглощаемую в реакции при постоянной температуре и постоянном объеме.
- Для изотермического процесса изменение в нем равно нулю.
- Для процесса, связанного с выделением энергии, изменение в нем отрицательно, а для процесса, связанного с поглощением энергии, изменение в нем положительно.
Характеристики Внутренняя энергия:
- Внутренняя энергия системы является экстенсивным свойством.
- Является государственной собственностью.
 Изменение внутренней энергии не зависит от выбранного пути.
Изменение внутренней энергии не зависит от выбранного пути. - Изменение в нем циклического процесса равно нулю.
Примечания:
- На практике абсолютное значение внутренней энергии (U) неизвестно и не может быть измерено, поскольку очень сложно точно определить большинство величин, влияющих на внутреннюю энергию системы. Но в термодинамике не важна величина внутренней энергии (U), важно ее изменение (ΔU).
- Величина изменения внутренней энергии (ΔU) связана со многими другими термодинамическими величинами простыми математическими соотношениями.Используя эти соотношения, можно определить изменение внутренней энергии (ΔU). Такими соотношениями являются ΔH = ΔU + PΔV и ΔH = ΔU + ΔnRT. Отсюда можно определить изменение внутренней энергии (ΔU).
Предыдущая тема: Виды химических процессов
Следующая тема: Работа давление-объем
Естествознание > Химия > Химическая термодинамика и энергетика > Концепция внутренней энергииВнутренняя энергия системы: определение и измерение — видео и стенограмма урока
Типы энергии
Эти виды систем могут представлять собой коробку, полную газообразного кислорода или жидкости внутри тормозной магистрали велосипеда. Что бы это ни было, частицы, содержащиеся внутри системы, обладают определенной суммой полной энергии. Точнее, внутренняя энергия системы есть сумма кинетической энергии или энергии движения частиц и потенциальной или позиционной энергии частиц.
Что бы это ни было, частицы, содержащиеся внутри системы, обладают определенной суммой полной энергии. Точнее, внутренняя энергия системы есть сумма кинетической энергии или энергии движения частиц и потенциальной или позиционной энергии частиц.
Частицы внутри газа всегда движутся. Вы знаете, эта стрельба повсюду, как астероиды и метеоры, часто изображаемые в научно-фантастических шоу, или как бильярдные шары, отскакивающие от подушек бильярдного стола.Все, что движется, содержит энергию, также известную как кинетическая энергия. Чем быстрее они движутся, тем большей кинетической энергией обладают частицы. Но объекты и частицы также обладают потенциальной энергией. Когда вы поднимаете мяч в воздух и отпускаете, он падает на землю. Причина, по которой это происходит, заключается в том, что шар, находящийся выше, содержит гравитационную потенциальную энергию. Когда вы отпускаете его, эта гравитационная потенциальная энергия высвобождается. Частицы газа одинаковы. Исходя из положения относительно других частиц, они обладают потенциальной энергией. Чем больше вы разделяете частицы, тем больше у них потенциальной энергии из-за притяжения между ними. Сложите эти два числа — кинетическую энергию плюс потенциальную энергию — для каждой частицы в системе, и вы получите полную внутреннюю энергию этой системы.
Чем больше вы разделяете частицы, тем больше у них потенциальной энергии из-за притяжения между ними. Сложите эти два числа — кинетическую энергию плюс потенциальную энергию — для каждой частицы в системе, и вы получите полную внутреннюю энергию этой системы.
Измерение внутренней энергии системы
Хорошо, в теории это хорошо, но как это сделать на самом деле? Что нужно для измерения внутренней энергии системы?
Что ж, нам придется измерять кинетическую энергию и потенциальную энергию отдельно.Кинетическая энергия частиц — это то, что вы можете определить в повседневной жизни. Оно проявляется как свойство, которое мы слышим всякий раз, когда смотрим прогноз погоды: температура. Когда воздух горячее, молекулы воздуха движутся быстрее. Вот что такое температура. Таким образом, температура является мерой кинетической энергии частиц. Чем выше температура, тем больше внутренней энергии должна иметь система.
Потенциальную энергию немного сложнее измерить. Но одна вещь, связанная с потенциальной энергией, — это фаза или состояние вещества. Твердые тела, такие как лед или дерево, содержат плотно упакованные частицы, расположенные близко друг к другу. Это означает, что у них меньше потенциальной энергии, например, когда мяч находится близко к земле. Жидкости имеют частицы, которые скользят вокруг друг друга и более разделены, чем твердые тела. У них немного больше потенциальной энергии. А в газах есть частицы, которые разнесены, что дает им много потенциальной энергии, например, когда мяч поднимается далеко над землей. Когда мы заставляем твердое вещество плавиться в жидкость или жидкость кипеть в газ, мы добавляем энергию в систему за счет тепла.Отсюда берется потенциальная энергия молекул. Итак, когда вы смотрите на температуру и состояние системы, это две подсказки, которые говорят вам о содержащейся в ней внутренней энергии.
Твердые тела, такие как лед или дерево, содержат плотно упакованные частицы, расположенные близко друг к другу. Это означает, что у них меньше потенциальной энергии, например, когда мяч находится близко к земле. Жидкости имеют частицы, которые скользят вокруг друг друга и более разделены, чем твердые тела. У них немного больше потенциальной энергии. А в газах есть частицы, которые разнесены, что дает им много потенциальной энергии, например, когда мяч поднимается далеко над землей. Когда мы заставляем твердое вещество плавиться в жидкость или жидкость кипеть в газ, мы добавляем энергию в систему за счет тепла.Отсюда берется потенциальная энергия молекул. Итак, когда вы смотрите на температуру и состояние системы, это две подсказки, которые говорят вам о содержащейся в ней внутренней энергии.
Резюме урока
Система представляет собой набор связанных частей. Это могут быть части двигателя, но в термодинамике мы обычно говорим о частицах, которые находятся близко друг к другу, так что между ними может передаваться энергия.
 4)
4) 6)
6)
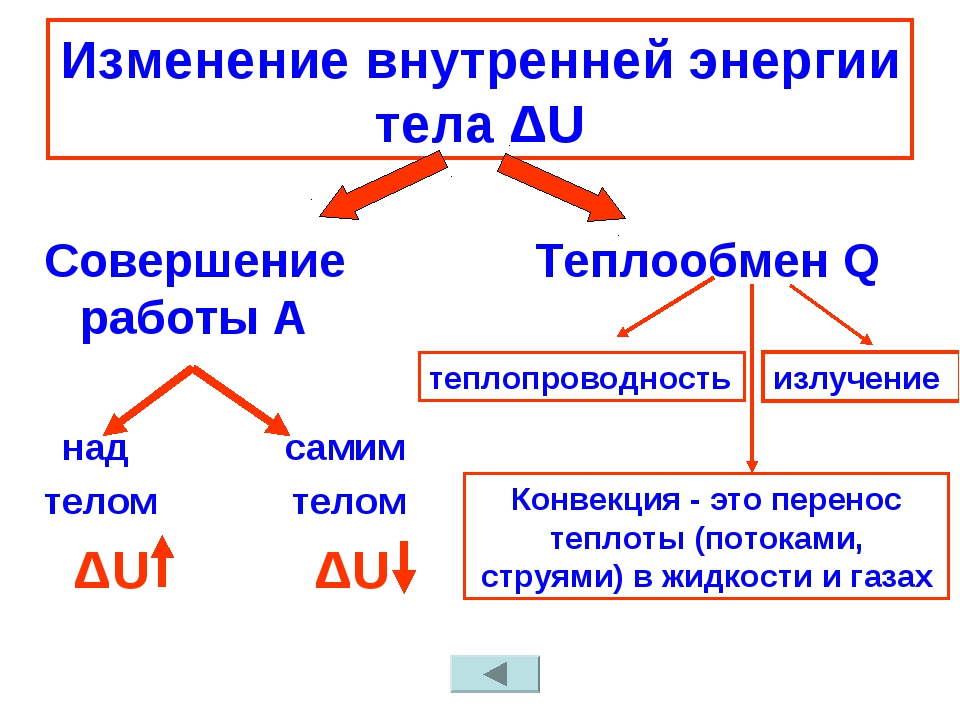 CS1 maint: несколько имен: список авторов (ссылка)
CS1 maint: несколько имен: список авторов (ссылка) Этот тип системы
отделена от своего окружения физической границей. Энергия в
транзит в виде работы или тепла может проходить через систему
границы, однако массовый поток через границу быть не может. Один
типичным примером системы является устройство поршень/цилиндр, в котором
система определяется как фиксированная масса жидкости, содержащейся внутри
цилиндр.
Этот тип системы
отделена от своего окружения физической границей. Энергия в
транзит в виде работы или тепла может проходить через систему
границы, однако массовый поток через границу быть не может. Один
типичным примером системы является устройство поршень/цилиндр, в котором
система определяется как фиксированная масса жидкости, содержащейся внутри
цилиндр. Изменение внутренней энергии не зависит от выбранного пути.
Изменение внутренней энергии не зависит от выбранного пути.