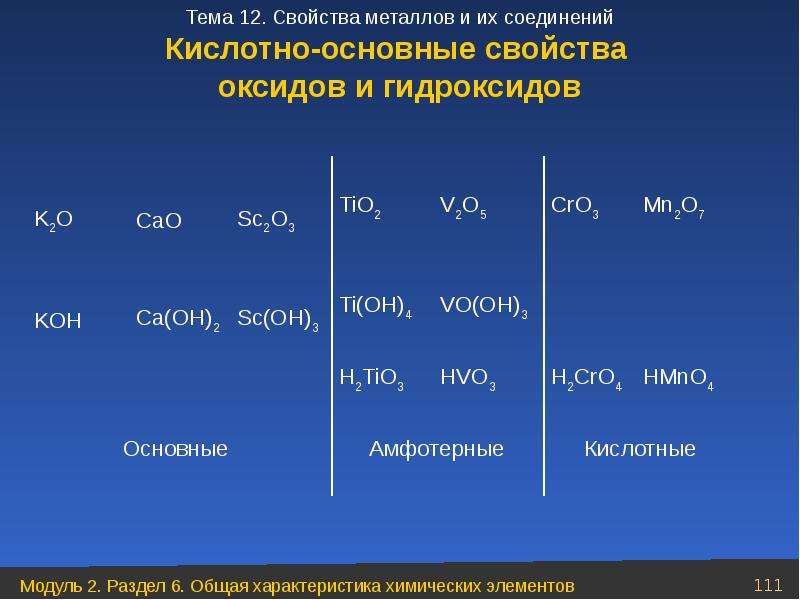
Оксиды и гидроксиды металлов
Для всех металлов известны их оксиды и гидроксиды, а у d-элементов различные степени окисления, поэтому они образуют множество оксидов и гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения металла в периодической системе, от его активности и степени окисления металла. Таким образом, все металлы образуют солеобразующие оксиды.
Известно, что чем ярче выражены металлические свойства, тем сильнее основные свойства оксидов и гидроксидов.
Для s- и p-элементов слева направо по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов и гидроксидов металлов. В IA группе сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего уровня образуются катионы. Естественно, что степень окисления у этих элементов не изменяется, а основный характер оксидов усиливается.
Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов 3 периода, то следует отметить, что

Например, оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так, оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом углерода (IV) образуется соль – карбонат натрия, в реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
По группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные свойства их оксидов.
Например,
в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он
легко растворяется в растворах кислот и щелочей. Например, в реакции оксида
бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции
оксида бериллия с раствором гидроксида натрия образуется комплексная соль –
тетрагидроксобериллат натрия.
Соединения бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.
Характер гидроксида зависит также от степени окисления и радиуса иона. Чем больше степень окисления, тем меньше радиус иона.
Поэтому в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных свойств и усиление кислотных
Например, в I A группе сверху вниз увеличивается радиус иона, степень окисления не изменяется, поэтому усиливаются основные свойства. В ряду от гидроксида лития до гидроксида цезия основные свойства будут усиливаться.
Переходные элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные свойства.
Получим
гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль
алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид
алюминия.
Сначала в растворимую соль
алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид
алюминия.
Затем разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй части осадка добавим гидроксид калия – осадок также растворяется, потому что образуется растворимая соль – тетрагидроксоалюминат калия.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + KOH = K[Al(OH)4]
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твёрдыми основаниями при сплавлении.
Например,
при сплавлении гидроксида хрома (III) с гидроксидом
калия образуется соль – метахромит калия и вода, при сплавлении гидроксида
хрома (III) с оксидом калия образуется метахромит калия
и вода, при сплавлении гидроксида хрома (III) с
карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.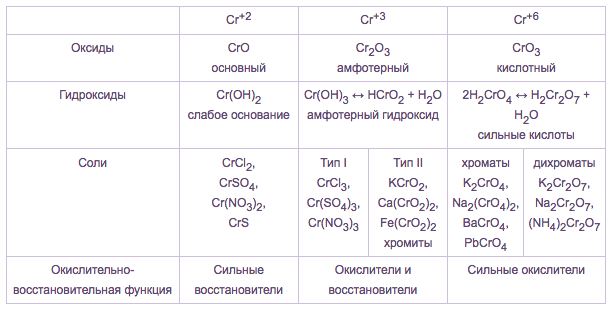
Аналогично оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и гидроксида калия образуется соль – металюминат калия и вода, при сплавлении гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и вода.
Оксид и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и серной кислоты образуется соль – сульфат бериллия и вода.
Большое влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления металла, поэтому с увеличением степени окисления металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6.
В
оксиде CrO и гидроксиде Cr(OH)2 степень окисления
хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства. В оксиде Cr2O3
В оксиде Cr2O3
Тоже
самое наблюдается и в соединениях марганца. Например, в оксиде MnO и в гидроксиде Mn(OH)2 степень окисления марганца +2 – это низшая
степень оксиления, поэтому эти соединения проявляют основные свойства, в
оксиде MnO2 и гидроксиде Mn(OH)4 марганец имеет степень окисления равную +4 –
это промежуточная степень окисления, поэтому эти соединения будут проявлять амфотерные
свойства. Если у марганца будет степень окисления +6 или +7, то его оксиды
и гидроксиды будут проявлять кислотные свойства. Это такие оксиды, как MnO3 и Mn2O7, а также их гидроксиды H
Таким образом, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основных через амфотерные к кислотным.
ГИДРОКСИДЫ — это… Что такое ГИДРОКСИДЫ?
ГИДРОКСИДЫ — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ — ГИДРОКСИДЫ, неорганические химические соединения, содержащие ион ОН , проявляющие свойства ОСНОВАНИЙ (веществ, присоединяющих протоны и реагирующих с кислотой, образующих при этом соль и воду). Сильные неорганические основания, такие как… … Научно-технический энциклопедический словарь
ГИДРОКСИДЫ — хим.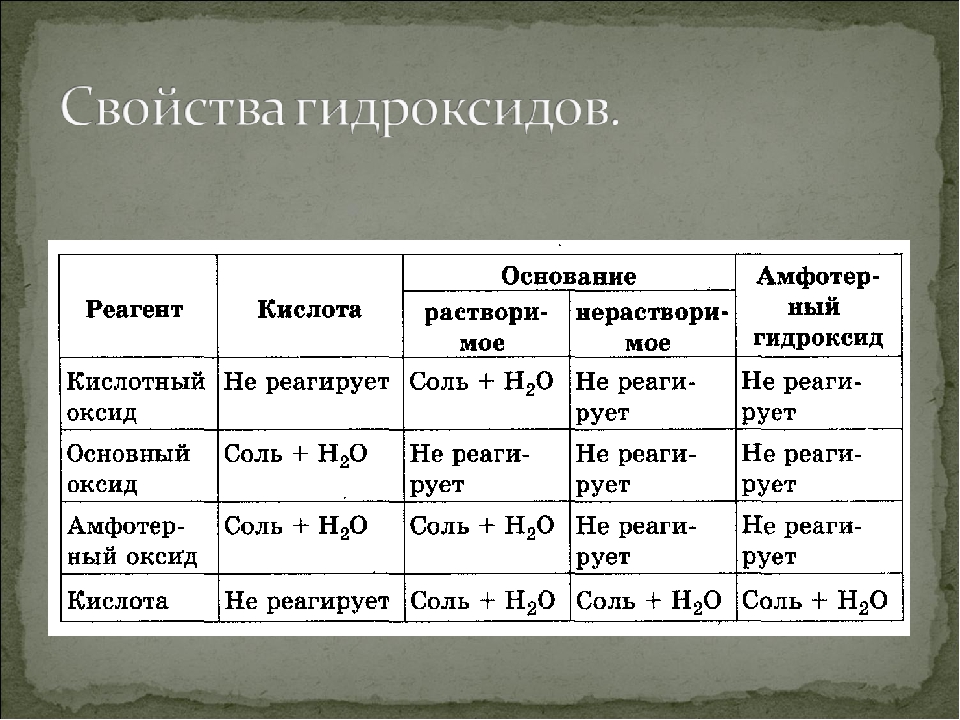 соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
Гидроксиды — (гидроокиси) соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами. Классификация В… … Википедия
гидроксиды — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
ГИДРОКСИДЫ — неорг. соед. металлов общей ф лы М(ОН)n, где и степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
ГИДРОКСИДЫ — неорганич. соединения, содержащие одну или неск. групп ОН. Могут быть основаниями или амфотерными соединениями (см. Амфотерность). Г. встречаются в природе в виде минералов, например гидраргиллит А1(ОН)3, брусит Mg(OH)2 … Большой энциклопедический политехнический словарь
ГИДРОКСИДЫ — хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
гидроксиды — гидрокс иды, ов, ед. ч. с ид, а … Русский орфографический словарь
гидроксиды — мн., Р. гидрокси/дов; ед. гидрокси/д (2 м) … Орфографический словарь русского языка
гидрокси/д (2 м) … Орфографический словарь русского языка
Гидроксиды: свойства и все характеристики
Характеристики и физические свойства гидроксидов
Большинство оснований – твердые вещества с различной растворимостью в воде. Гидроксид меди (II) голубого цвета (рис. 1), гидроксид железа (III) бурого, большинство других белого цвета.
Рис. 1. Гидроксид меди (II). Внешний вид.
Получение гидроксидов
Растворимые основания (щелочи) в лаборатории можно получить при взаимодействии активных металлов и их оксидов с водой:
CaO + H2O = Ca(OH)2
Щелочи гидроксид натрия и гидроксид кальция получают электролизом водных растворов хлорида натрия и хлорида калия.
Нерастворимые в воде основания получают по реакции солей с щелочами в водных растворах:
FeCl3 + 3NaOHaq = Fe(OH)3↓ + 3NaCl.
Химические свойства гидроксидов
Растворимые и нерастворимые основания имеют общее свойства: они реагируют с кислотами с образованием солей и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O;
Cu(OH)2 + 2HCl = CuCl2 + H2O.
Растворы щелочей изменяют цвет некоторых веществ – лакмуса, фенолфталеина и метилового оранжевого, называемых индикаторами (табл. 1).
Таблица 1. Изменение цвета индикаторов под воздействием растворов кислот и оснований.
|
Индикатор |
Цвет индикатора в среде |
||
|
кислой |
щелочной |
нейтральной |
|
|
Лакмус |
Красный |
Синий |
Фиолетовый |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метиловый оранжевый |
Розовый |
Желтый |
Оранжевый |
Кроме общего свойства, щелочи и нерастворимые в воде основания обладают также специфическими. Например, при нагревании голубого осадка гидроксида меди (II) образуется вещество черного цвета – это оксид меди (II):
Например, при нагревании голубого осадка гидроксида меди (II) образуется вещество черного цвета – это оксид меди (II):
Cu(OH)2 = CuO + H2O.
Щелочи, в отличие от нерастворимых оснований, при нагревании обычно не разлагаются. Их растворы действуют на индикаторы, разъедают органические вещества, реагируют с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4;
2KOH + CO2 = K2CO3 + H2O.
Применение гидроксидов
Гидроксиды находят широкое применение в промышленности и быту. Например, большое значение имеет гидроксид кальция. Это белый рыхлый порошок. При смешивании его с водой образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диокисда углерода. Гашеную известь применяют дляприготовления бордосской смеси –средства борьбы с болезнями и вредителями растений. Известковое молоко широко используют в химической промышленности, например при производстве сахара, соды и других веществ.
Гашеную известь применяют дляприготовления бордосской смеси –средства борьбы с болезнями и вредителями растений. Известковое молоко широко используют в химической промышленности, например при производстве сахара, соды и других веществ.
Гидроксид натрия применяют для очистки нефти, производства мыла, в текстильной промышленности. Гидроксид калия и гидроксид лития используют в аккумуляторах.
Примеры решения задач
СПЕЦПРЕДЛОЖЕНИЯ Принимаем заявки на поставку Гипохлорита натрия марки А по ГОСТ 11086-76 в автоцистернах по 23 тонны. |
|
Страница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл., г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.

- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.

- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Урок для 8 класса. Основания
Тема 6. Урок №3 Основания – гидроксиды основных оксидов
Когда много учишься,
не только лицо, но и тело
приобретает умное
выражение.
(Ф. Ницше)
Цель: сформировать представление о классе сложных веществах -основаниях, их составе, названиях, растворимости в воде; познакомить с физическими свойствами, применением. Научить составлять формулы оснований. Сформировать понятие об индикаторах, работать со щелочами, соблюдая правила т/б.
Образовательные задачи: сформировать понятия об основаниях, рассмотреть состав, навания и классификацию оснований. Дать понятие об индикаторах.
Развивающие задачи: развитие логического мышления, речи, памяти, умения самостоятельно готовить материал, делать выводы.
Воспитательные задачи: формирование навыков сотрудничества, мировоззрения. Умения работать с лабораторной посудой, соблюдая правила т/б.
Оборудование: образцы оснований, индикаторы, вода, карточки с химическими формулами оксида кальция, оксида углерода (IV), оксида натрия, оксида серы (IV), гидроксида натрия, гидроксида железа (III). батарейки, аккумулятор мобильнго телефона, мыло, сахар.
батарейки, аккумулятор мобильнго телефона, мыло, сахар.
ХОД УРОКА
I. Организационный момент
Учитель проверяет готовность класса к занятию. Акцентирует внимание на то, что нельзя трогать реактивы, стоящие на столах без разрешения учителя.
II. Актуализация знаний (мотивация урока)
На демонстрационном столе химическая копилка. Я собираю в неё карточки с химическими формулами веществ, принадлежащих к различным классам соединений. Мне необходимы два консультанта для того, чтобы назвать все предложенные здесь вещества. В копилке: карточки с химическими формулами
Какие из веществ вы ранее подробно не изучали? (Гидроксид натрия и т.д.)
Действительно, эти вещества относятся к классу оснований.
Сформулируйте определение, какие вещества называются основаниями?
III.Изучение нового материала
Сегодня мы познакомимся еще с одним классом неорганических веществ – с основаниями. Запишите в тетрадь тему урока: «Основания – гидроксиды основных оксидов»
1. введение в тему
введение в тему
Познакомимся с основаниями и рассмотреть классификацию, состав и номенклатуру оснований.
Ообратите внимание, я принесла сегодня на урок батарейки, аккумулятор мобильнго телефона, мыло, сахар. Что общего между такими разными предметами? Сегодня мы попытаемся выяснить на уроке.
Актуальность темы: почему основания изучаются нами? Основания – один из классов неорганических веществ, который наряду с кислотами, оксидами и солями составляет основу неорганической химии. Они широко используются в разных областях химии и химической промышленности. С их помощью получают удобрения, строительные материалы, стекло. Без них мы бы лишились легких и экономичных щелочных аккумуляторов, многих медицинских препаратов. Основания имеют огромное значение.
«В некотором царстве, Химическом государстве, на противоположных сторонах говорливой реки Ионки расположились две деревеньки – Металловка и Гидроксид-ионовка. Жители Металловки всем служили примером: и веселые, и активные, и работящие. Как ни крути – со всех сторон положительные! Так их и называли Катионы Металловы. А жители Гидроксид-ионовки были им полной противоположностью: работать не хотели, всех задирали, со всеми ссорились. Одним словом – Гидроксид-анионы. И решили Катионы Металловы усмирить буйный нрав Гидроксид — анионов; перешли они реку Ионку по мосту Химической связи – и появились вещества новые, Основаниями называемые».
Жители Металловки всем служили примером: и веселые, и активные, и работящие. Как ни крути – со всех сторон положительные! Так их и называли Катионы Металловы. А жители Гидроксид-ионовки были им полной противоположностью: работать не хотели, всех задирали, со всеми ссорились. Одним словом – Гидроксид-анионы. И решили Катионы Металловы усмирить буйный нрав Гидроксид — анионов; перешли они реку Ионку по мосту Химической связи – и появились вещества новые, Основаниями называемые».
2.определение оснований
К сложным веществам относятся не только бинарные соединения, но и соединения, которые образованы большим количеством атомов химических элементов
Познакомимся с соединениями, которые образованы тремя химическими элементами: металлом, кислородом и водородом. Кислород и водород в эти соединения входят в виде группы ОН, которая называется гидроксогруппой. Суммарный заряд гидроксогруппы равен -1: (О⁻2 Нᶧ)⁻ .
Гидроксогруппа – это сложный ион, или гидроксид-ион (ОН) ⁻. Общая формула оснований: Мᶧn(ОН)n, где М – металл, n— число групп ОН⁻ и в то же время численное значение заряда иона (с.о.) металла.
Основания – это сложные вещества, состоящие из ионов металла и связанных с ними гидроксид-ионов.
Название основания состоит из слова гидроксид и названия металла в родительном падеже с с.о., если она переменная. Например, NaOH – гидроксид натрия, Cu(OH)₂ — гидроксид меди (II).
Алгоритм составления химической формулы основания:
I IIKOH Ca OH
г) Число гидроксогрупп равно валентности металла.
Если число больше 1, обведите гидроксогруппу круглыми скобками и в правом нижнем углу отметьте индекс.
I II
КОН Са (ОН)2
гидроксид гидроксид
калия кальция
Составьте формулы оснований по названиям:
гидроксид лития, гидроксид меди (II), гидроксид бария.
Ответ: LiOH, Cu(OH)₂, Ba(OH)2
3.Классификация оснований.
По растворимости в воде основания делятся на хорошо растворимые – щелочи, малорастворимые и нерастворимые. Чтобы определить растворимость того или иного основания в воде, следует обратиться к таблице «Растворимость кислот, оснований и солей в воде», которая размещена на форзаце учебника. (Учащиеся работают с таблицей и определяют растворимость тех оснований, которые называет и демонстрирует учитель.)
Учащиеся работают со схемой и приводят примеры
Классификация оснований (см. таблицу растворимости)
Основания
Растворимые в воде основания Нерастворимые основания
(щелочи) Fe(OH)3, Cu(OH)2, Al(OH)3
KOH, NaOH, Ca(OH)2
4. номенклатура
номенклатура
5. Техника безопасности при работе со щелочами!!!
Растворимые основания – щелочи – могут вызвать химический ожог при попадании на незащищенные участки кожи рук и лица. Они могут разъесть кожу, ткань, бумагу и другие материалы.
(Обратить внимание учащихся на правила ТБ: обращаться с едкими щелочами необходимо осторожно, чтобы они не попали на одежду и кожу.)
В случае попадания щелочи на одежду или участок кожи следует немедленно сообщить учителю о случившемся и сделать следующее: тщательно и обильно промыть участок кожи водой из-под крана, затем обработать это место нейтрализующим раствором борной кислоты, вновь промыть водой и смазать место ожога вазелиновым маслом
Щелочи – это едкие вещества, поэтому при работе с ними будьте осторожны!
Если вещество с щелочными свойствами попадает в глаза, то немедленно следует их промыть большим количеством воды.
Если кто-то выпил щелочь, то пострадавшему дают 1-2% раствор лимонной или уксусной кислоты, чтобы нейтрализовать щелочь.
Если щелочь попала на руки или на одежду немедленно смойте её небольшим количеством воды.
6. Действие на индикаторы Лабораторный опыт. «Испытание растворов щелочей индикаторами»
Вещества: лакмус, фенолфталеин, метиловый оранжевый, раствор гидроксида натрия
Работапо инструкции:
Разделите содержимое пробирки с раствором гидроксида натрия (калия) на три части, отлив понемногу в две чистые пробирки (ТБ!).
К содержимому первой пробирки добавьте 1- 2 капли лакмуса.
К содержимому второй пробирки добавьте 1- 2 капли метилоранжа.
К содержимому третьей пробирки добавьте 1- 2 капли фенолфталеина.
Полученные результаты зафиксируйте в таблице:
Что наблюдаете? Сделайте вывод. Учащиеся проводят эксперимент и оформляют результаты в виде таблицы.
Затем комментируют полученные результаты.
IV.Закрепление
Вопросно – ответная игра «Веришь-не веришь».
Верите ли вы, что🙁 Если верят — встают с места, если нет — сидят.)
В состав оснований входят катионы металла и гидроксид — анионы.
Гидроксид — ион — это сложный анион.
Основание — это бинарное соединение.
Гидроксид меди(II) –растворимое в воде основание.
Лакмус в щелочах меняет окраску с фиолетовой на жёлтую.
В щелочной среде бесцветный фенолфталеин становится малиновым.
Гидроксид натрия имеет формулу- Na(OH)2
Гидроксид железа(III) является щелочью.
V. Домашнее задание: §34
VI. Рефлексия.
Рефлексия.
Вид оценочной доски «Наши достижения».
Да, трудно все-таки учиться!
Урок полезен, все понятно.
Лишь кое-что чуть-чуть неясно
Еще придется потрудиться.
Тема 3. Амфотерные оксиды и гидроксиды.
Часть I
1. Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
2. Амфотерные гидроксиды – это гидроксиды, например, элементов с порядковыми номерами 4, 13, 30 – Be, Al, Zn. Каждый гидроксид проявляет , в зависимости от условий реакций, свойства то основания, то кислоты.
а) Как основание, амфотерный гидроксид взаимодействует с кислотой, образуя соль и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций).
б) Как кислота, амфотерный гидроксид взаимодействует со щёлочью, образуя соль (входит в состав кислотного остатка) и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций):
3. Амфотерным гидроксидам соответствуют амфотерные оксиды.
4. Генетический ряд переходного металла:
5. Запишите формулы оксида и гидроксида, а также уравнения реакций переходов в молекулярной и ионной формах.
Часть II
1. Дайте характеристику элемента алюминия по плану, с которым вы познакомились на первых уроках:
1) Al – это элемент III А группы малого периода.
2) +13 Al, 2е, 8е, 3е.
3) Это восстановитель, который получают с. о. +3.
4-5) Al – металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:
6) аллотропия для алюминия нехарактерна.
7) Как металл, алюминий менее активный, чем магний, но более активный, чем кремний.
8) Как металл, алюминий более активный, чем бор, но менее активный, чем галлий.
9) Оксид алюминия имеет амфотерный характер, поэтому взаимодействует и с кислотой, и с щёлочью, образуя соль и воду.
10) Амфотерный гидроксид является и основанием, и кислотой, которая имеет формулу
взаимодействует (напишите уравнения в молекулярной, полной и сокращённой ионной формах):
2. Оксид хрома (II) CrO проявляет основные свойства, поэтому взаимодействует с кислотными оксидами, кислотами.
Приведите уравнения соответствующих реакций.
3. Оксид хрома (VI) проявляет кислотные свойства, поэтому взаимодействует с основными оксидами, основаниями (щёлочами).
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
4. Оксид хрома (III) проявляет амфотерные свойства, поэтому взаимодействует и с кислотами, и со щелочами. Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
Оксид хрома (III) проявляет амфотерные свойства, поэтому взаимодействует и с кислотами, и со щелочами. Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
5. Верны ли следующие суждения?
А) Все гидроксиды металлов (I) имеют только основный характер.
Б) Гидроксиды металлов (II) могут быть как основаниями, так и амфотерными гидроксидами.
1) оба суждения верны.
6. Верны ли следующие суждения?
А) Характер гидроксидов переходных металлов VI B и VII B групп зависит от с. о. металлов:
— с низшей с. о. – носит основный характер;
— с промежуточной с. о. – амфотерный характер;
— с высшей с. о. – кислотный характер.
Б. Оксиды и гидроксиды неметаллов всегда имеют кислотный характер.
2) верно только А.
7. Формула высшего оксида марганца а формула его гидроксида – Оба соединения имеют кислотный характер (для подтверждения приведите по два уравнения возможных реакций в молекулярной и ионной формах):
месторождений полезных ископаемых | Британника
месторождение полезных ископаемых , агрегат минерала с необычно высокой концентрацией.
Около половины известных химических элементов обладают некоторыми металлическими свойствами. Термин металл , однако, зарезервирован для тех химических элементов, которые обладают двумя или более характерными физическими свойствами металлов (непрозрачность, пластичность, пластичность, плавкость), а также являются хорошими проводниками тепла и электричества. Приблизительно 40 металлов становятся доступными благодаря добыче и плавке полезных ископаемых, в которых они встречаются.
Некоторые виды минералов плавятся легче, чем другие; их обычно называют рудными минералами. Рудные минералы обычно концентрируются в небольших локализованных массивах горных пород, которые образуются в результате особых геологических процессов, и такие локальные скопления называются месторождениями полезных ископаемых. Месторождения полезных ископаемых — это то, что ищут старатели. Термины рудный минерал и месторождение минералов первоначально применялись только к минералам и месторождениям, из которых извлекаются металлы, но в настоящее время их использование включает несколько неметаллических минералов, таких как барит и флюорит, которые встречаются в тех же месторождениях, что и металлические минералы.
Месторождение не состоит полностью из одного рудного минерала. Всегда есть примеси бесполезных минералов, которые собирательно называются пустой породой. Чем более концентрирован рудный минерал, тем ценнее месторождение полезных ископаемых. Для каждого месторождения полезных ископаемых существует набор условий, таких как уровень концентрации и размер месторождения, которые должны быть достигнуты, если месторождение будет разрабатываться с прибылью. Месторождение полезных ископаемых, которое достаточно богато, чтобы работать с прибылью, называется рудным месторождением, а в рудном месторождении совокупность рудных минералов и пустой породы называется рудой.
Все рудные месторождения относятся к месторождениям полезных ископаемых, но обратное неверно. Рудное месторождение — экономический термин, а месторождение полезных ископаемых — геологический термин. Является ли данное месторождение полезных ископаемых также рудным, зависит от многих факторов, помимо уровня концентрации и размера месторождения; Также необходимо учитывать все факторы, влияющие на добычу, переработку и транспортировку руды. К таким факторам относятся форма месторождения, его глубина под поверхностью, его географическая удаленность, доступ к транспорту, политическая стабильность региона и рыночные факторы, такие как цена на металл в мировой торговле и стоимость заимствования деньги нужны для разработки рудника.Поскольку рыночные факторы постоянно меняются, данное месторождение полезных ископаемых может иногда быть рудным, но в других случаях оно может быть нерентабельным и, следовательно, не рудным.
К таким факторам относятся форма месторождения, его глубина под поверхностью, его географическая удаленность, доступ к транспорту, политическая стабильность региона и рыночные факторы, такие как цена на металл в мировой торговле и стоимость заимствования деньги нужны для разработки рудника.Поскольку рыночные факторы постоянно меняются, данное месторождение полезных ископаемых может иногда быть рудным, но в других случаях оно может быть нерентабельным и, следовательно, не рудным.
Залежи полезных ископаемых были обнаружены как в породах, лежащих под океанами, так и в породах, которые образуют континенты, хотя единственные месторождения, которые фактически разрабатывались, находятся в континентальных породах. (Разработка океанических отложений — дело будущего.) Толщина континентальной коры составляет в среднем 35–40 километров (20–25 миль), а под корой лежит мантия.В мантии могут встречаться месторождения полезных ископаемых, но при нынешних технологиях их обнаружить невозможно.
Геохимически богатые и дефицитные металлы
Металлы, используемые в промышленности и технологиях, можно разделить на два класса в зависимости от их содержания в земной коре. Геохимически богатые металлы, из которых пять (алюминий, железо, магний, марганец и титан), составляют более 0,1 процента от веса земной коры, в то время как геохимически дефицитные металлы, которые включают в себя все другие металлы (включая такие знакомые) как медь, свинец, цинк, золото и серебро), составляют менее 0.1 процент. Почти в каждой породе с помощью чувствительного химического анализа можно обнаружить хотя бы крошечные количества всех металлов. Тем не менее, существуют важные различия в способах обнаружения обильных и дефицитных металлов в обычных породах. Геохимически многочисленные металлы, как правило, присутствуют в качестве основных компонентов в минералах. Например, базальт, обычная магматическая порода, состоит в основном из минералов оливина и пироксена (оба силиката магния-железа), полевого шпата (силикат натрия-кальция-алюминия) и ильменита (оксид железа-титана).Тщательный химический анализ базальта также покажет присутствие большинства геохимически дефицитных металлов, но никакие поиски не выявят минералы, в которых один или несколько дефицитных металлов являются важным компонентом.
Геохимически богатые металлы, из которых пять (алюминий, железо, магний, марганец и титан), составляют более 0,1 процента от веса земной коры, в то время как геохимически дефицитные металлы, которые включают в себя все другие металлы (включая такие знакомые) как медь, свинец, цинк, золото и серебро), составляют менее 0.1 процент. Почти в каждой породе с помощью чувствительного химического анализа можно обнаружить хотя бы крошечные количества всех металлов. Тем не менее, существуют важные различия в способах обнаружения обильных и дефицитных металлов в обычных породах. Геохимически многочисленные металлы, как правило, присутствуют в качестве основных компонентов в минералах. Например, базальт, обычная магматическая порода, состоит в основном из минералов оливина и пироксена (оба силиката магния-железа), полевого шпата (силикат натрия-кальция-алюминия) и ильменита (оксид железа-титана).Тщательный химический анализ базальта также покажет присутствие большинства геохимически дефицитных металлов, но никакие поиски не выявят минералы, в которых один или несколько дефицитных металлов являются важным компонентом.
Геохимически дефицитные металлы редко образуют минералы в обычных породах. Вместо этого они переносятся в структуры обычных породообразующих минералов (большинство из них силикаты) в процессе атомного замещения. Этот процесс включает случайную замену атома в минерале чужеродным атомом с таким же ионным радиусом и валентностью без изменения атомной упаковки минерала-хозяина.Например, атомы меди, цинка и никеля могут замещать атомы железа и магния в оливине и пироксене. Однако, поскольку замещение чужеродных атомов вызывает деформации в атомной упаковке, у этого процесса есть пределы, которые определяются температурой, давлением и различными химическими параметрами. Действительно, пределы замещения для большинства дефицитных металлов в обычных силикатных минералах низкие — во многих случаях только несколько сотен замещающих атомов на каждый миллион атомов-хозяев, — но даже эти пределы редко превышаются в обычных породах.
Одним из важных следствий того, как обильные и дефицитные металлы встречаются в обычных породах, является то, что рудные минералы с большим количеством металлов можно найти во многих обычных породах, в то время как рудные минералы с дефицитными металлами можно найти только там, где какой-то особый, ограниченный геологический процесс образуются локализованные обогащения, превышающие пределы атомного замещения.
Два фактора определяют, подходит ли данный минерал в качестве рудного минерала. Во-первых, это легкость, с которой минерал может быть отделен от пустой породы и сконцентрирован для плавки.Процессы концентрирования, основанные на физических свойствах минерала, включают магнитную сепарацию, гравитационную сепарацию и флотацию. Второй фактор — это плавление, то есть освобождение металла от других элементов, с которыми он химически связан в минерале. Процессы плавки обсуждаются ниже, но первостепенное значение при рассмотрении пригодности рудного минерала имеет количество энергии, необходимое для разрыва химических связей и высвобождения металла. Как правило, для плавки сульфидных, оксидных или гидроксидных минералов требуется меньше энергии, чем для плавления силикатного минерала.По этой причине некоторые силикатные минералы являются рудными минералами. Поскольку основная масса земной коры (около 95 процентов) состоит из силикатных минералов, сульфидные, оксидные и гидроксидные рудные минералы в лучшем случае являются лишь второстепенными составляющими земной коры, а во многих случаях — очень редкими составляющими.
Предпочтительными рудными минералами как геохимически богатых, так и геохимически редких металлов являются самородные металлы, сульфиды, оксиды, гидроксиды или карбонаты. В некоторых случаях силикатные минералы необходимо использовать в качестве рудных минералов, потому что металлы либо не образуют более желательные минералы, либо образуют желательные минералы, которые редко встречаются в крупных месторождениях.
гидроксида против оксида — в чем разница?
Гидроксид является производным от оксида .В контексте | химии | lang = en термины разница между гидроксидом и оксидом
состоит в том, что гидроксид (химия) является одновалентным анионом (oh -1 ) на основе гидроксильной функциональной группы, а оксид ( химия) бинарное химическое соединение кислорода с другим химическим элементом.Как существительные, разница между
гидроксидом и оксидом состоит в том, что гидроксид (химия) является одновалентным анионом (oh -1 ) на основе гидроксильной функциональной группы, в то время как оксид (химия) является бинарным химическим веществом. соединение кислорода с другим химическим элементом.
соединение кислорода с другим химическим элементом.Другие сравнения: в чем разница?
АнглийскийСуществительное( Википедия гидроксид ) ( ru имя существительное )Производные термины* гидроксид алюминия, гидроксид алюминия * гидроксид аммония * гидроксид бария * гидроксид бериллия * гидроксид цезия, гидроксид цезия * гидроксид кадмия * гидроксид кальция * гидроксид галлия * гидроксид индия * гидроксид железа * гидроксид лития * гидроксид магния * гидроксид метилртути * гидроксид никеля * гидроксид свинца * гидроксид калия * гидроксид четвертичного аммония * гидроксид радия * гидроксид рубидия * гидроксид натрия * гидроксид олова * гидроксид олова * гидроксид стронция * гидроксид таллия * гидроксид хромата цинка * гидроксид цинка * гидроксид цирконияСм.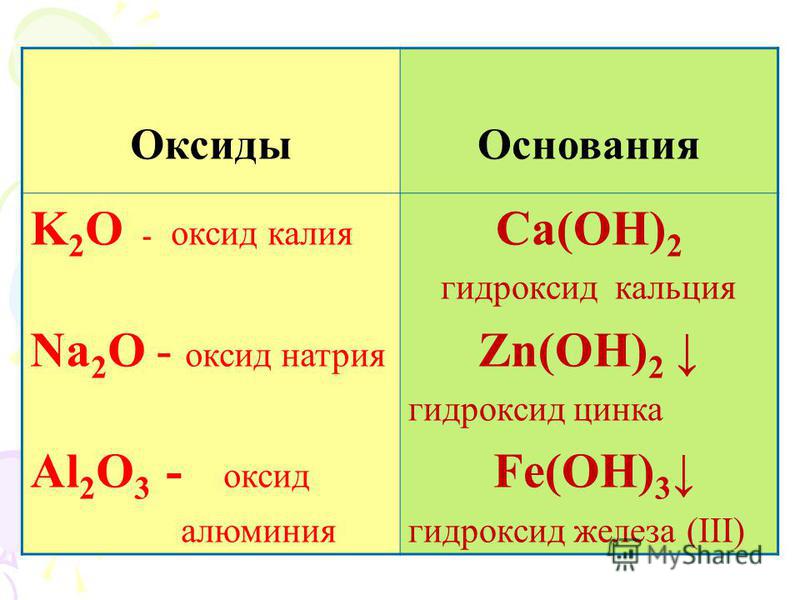 Также * гидроний
* ион водорода
* pOH
* pH Также * гидроний
* ион водорода
* pOH
* pH | Альтернативные формы* ( все редкие )Существительное( ru имя существительное )Производные термины* оксид алкилена * оксид алюминия, оксид алюминия * оксид алюминия гидроксид, оксид алюминия гидроксид * оксид сурьмы * оксид антимониозо-сурьмы * оксид сурьмы * оксид сурьмы * оксид сурьмы * оксид серебра * оксид мышьяка * оксид ауры * оксид золота * оксид бария-меди * оксид бария * оксид бериллия-алюминия, оксид бериллия-алюминия * оксид бериллия * оксид висмута * оксид висмута * оксид висмута * висмут, стронций, кальций, медь, оксид * оксид бора * оксид бора * какодил оксид * оксид кадмия * оксид кальция * оксид калифорния * оксид углерода * оксид углерода * оксид керамики * оксид церия * оксид церия * оксид церия * оксид хлора * оксид хлора * оксид хлора * оксид хрома * оксид хрома * оксид хрома * оксид кобальта * оксид кобальта * оксид меди * кубический оксид циркония * оксид меди * закись меди * оксид кюрия * оксид дейтерия * оксид дигидрогена * диметиленоксид * оксид диазота * диоксид * оксид диспрозия * окись этилена * эпоксид * оксид эрбия * окись этилена * оксид европия * оксид железа * оксид железа и железа * закись железа * оксид фтора * гептаоксид, гептаоксид * гексоксид * оксид гольмия * оксид водорода * оксид водорода * гидроксид * хлорноватистый оксид * оксид индия * оксид индия и олова * оксид иридия * радужный оксид * оксид иридия * оксид железа * изопропоксид * оксид лантана * оксид свинца * оксид лития * оксид лютеция * оксид магния-алюминия, оксид магния-алюминия * оксид магния * оксид марганца * оксид ртути * оксид ртути * оксид ртути * метиленоксид * смешанный оксид * оксид молибдена * монооксид * оксид ниобия * оксид ниобия * оксид азота * оксид азота * оксид азота * октоксид * осмический оксид * кислородный * оксидиметрия * окислять, окислять * оксид палладия * палладий оксид * пятиокись * перекись * оксид платины * оксид платины * оксид свинца * полиэтиленоксид * оксид калия * оксид пропилена * протоксид * оксид радия * красный оксид железа * оксид родия * оксид родоса * оксид рубидия * оксид рутения * оксид самария * оксид скандия * оксид селена * полуторный оксид * оксид кремния * оксид серебра * оксид натрия * оксид олова * оксид олова * оксид стронция * субоксид * оксид серы, оксид серы * оксид серы, оксид серы * оксид серы, оксид серы * супероксид * оксид тантала * оксид тантала * оксид тантала * оксид теллура * оксид теллура * оксид тербия * четырехокись * оксид таллия * оксид таллия * оксид таллия * оксид тория * оксид тулия * оксид олова * оксид титана * оксид титана * оксид титана * оксид трибутилолова * триоксид * оксид вольфрама * оксид вольфрама * оксид вольфрама * оксид урана * оксид урана * уранозо-оксид урана * оксид урана * оксид уранила * оксид ванадия * оксид ванадия * оксид иттербия * оксид иттрия, бария, меди * оксид иттрия * оксид цинка * оксид цинка * оксид циркония * оксид цирконияСвязанные термины( Связанные термины ) * окисляемый * окислитель * оксидаза * окислить * оксидоредуктазаСписок литературы—- |
Кислотно-основной характер оксидов и гидроксидов
- Последнее обновление
- Сохранить как PDF
- Оксиды металлов:
- Оксиды полуметаллов:
- Оксиды неметаллов
- Ионные гидриды
- Ковалентные гидриды
- Участники
Слева направо в периодической таблице, кислотно-основной характер оксидов и гидроксиды переходят от основных к кислым.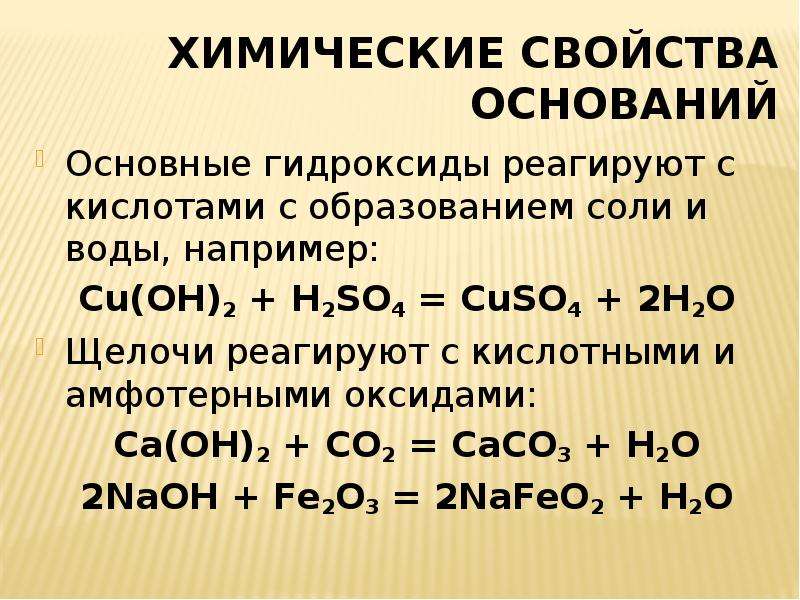
- Увеличение заряда аниона увеличивает производство основных растворов.
- По мере увеличения электроотрицательности производство ионных катионов увеличивается, потому что элементы лучше усваивают катион.
- По мере увеличения энергии ионизации кислотная природа увеличивается.
Оксиды металлов:
— Ионная связь: нет распределения электронной волновой функции
— Ионные оксиды обычно являются основными (элемент действует как основание при взаимодействии с h3O)
Na2O (т) + h3O (l) -> 2NaOH (водн.) -> 2Na + (водн.) + 2OH- (водн.)
Б.(3+) (водн.)
— (OH -) -> [Al (OH) 4] — (водн.)
Оксиды неметаллов
— Ковалентное связывание: почти полное распределение электронной волновой функции
— Ковалентные оксиды обычно кислые (элементы действуют как кислоты при взаимодействии с h3O)
SO3 + h3O (l) -> h3SO4 (водн.) -> H + + HSO4-
А. Оксид А Гидроксид
Ионные гидриды
Типы гидридов— Ионная связь: нет распределения электронной волновой функции
— Bronsted Basic, потому что они будут реагировать с протоном
— Lewis Basic, потому что они могут быть лигандами
Cah3 + 2h3O -> 2h3 + Ca (OH) 2
H- H + h3
-В этом случае Cah3 является основным, потому что он реагирует с водой (в данном случае с кислотой) с образованием многих гидридов за счет восстановления протона.
Ковалентные гидриды
— Ковалентное связывание: почти полное распределение электронной волновой функции
HF + h3O -> F- + h4O + …. можно также записать как HF (aq) <--> H + (aq) + F- (aq)
ч + ч + ч +
— HF — слабая кислота, которая является кислотой Бронстеда, потому что она теряет протон. Следовательно, HF — это слабая кислота, в которой вода действует как тихая вода, а F- — слабое сопряженное основание.
реакций кислот с оксидами и гидроксидами металлов
Обратите внимание, что на этот раз я описал гидроксид-ион как находящийся в растворе.Это потому, что мы обычно используем эту реакцию для растворимых гидроксидов — в основном гидроксидов натрия, калия и аммония.
Все гидроксиды металлов, твердые или находящиеся в растворе, являются основаниями, поскольку содержат ионы гидроксида. Растворимое основание , такое как гидроксид натрия, называется щелочью .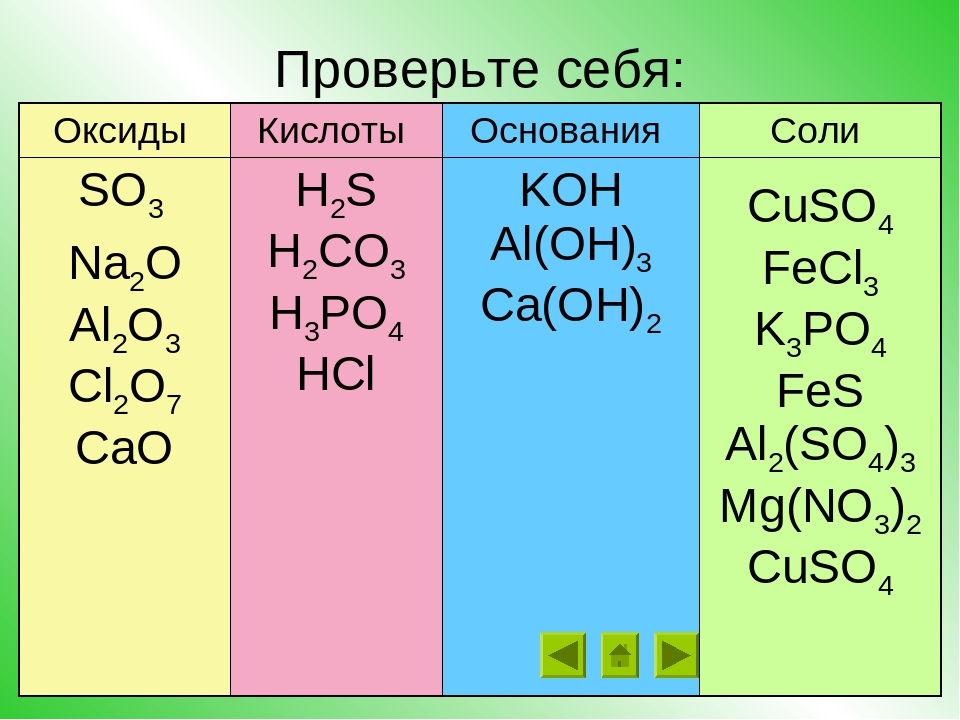
Гидроксиды металлов, подобные этому, описываются как основные гидроксиды .
Полное уравнение реакции между раствором гидроксида натрия и разбавленной серной кислотой:
2NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + 2H 2 O (л)
Эти реакции происходят мгновенно на холоде.
Если вы пытаетесь получить таким образом, скажем, чистые кристаллы сульфата натрия, сложно добиться правильных пропорций, потому что все представляет собой бесцветный раствор.
Мы рассмотрим это подробно на следующей странице.
Комментарий о разбавленной азотной кислоте
Вы, вероятно, помните, что азотная кислота реагирует с металлами иначе, чем другие распространенные кислоты.
С оксидами и гидроксидами металлов азотная кислота ведет себя точно так же, как и другие кислоты, на этот раз с образованием нитратов.
Так, например, с оксидом меди (II):
CuO (т. ) + 2HNO 3 (водн.) Cu (NO 3 ) 2 (водн.) + H 2 O (л)
) + 2HNO 3 (водн.) Cu (NO 3 ) 2 (водн.) + H 2 O (л)
. . . и с раствором гидроксида натрия:
NaOH (водн.) + HNO 3 (водн.) NaNO 3 (водн.) + H 2 O (л)
Комментарий об этих реакциях и серии реактивности
Ряд реакционной способности не имеет никакого отношения к реакциям кислот, кроме их реакций с металлами.
Оксиды или гидроксиды металлов ниже водорода в ряду реакционной способности реагируют точно так же, как соединения металлов в средней или самой верхней части ряда реакционной способности.
Суммарное уравнение
оксид или гидроксид металла + соль кислоты + вода
Гидроксид — обзор | ScienceDirect Topics
6.6 Биотехнология
LDH может заключать в себе многие сложные биомолекулы, такие как аминокислоты, нуклеозиды, олигонуклеотиды, одно- или двухцепочечные ДНК, белки, ферменты и целые клетки (Choy et al. , 2006; Форано и др., 2006; Рен и др., 2006; Форано и Прево, 2008). Как сообщалось в недавних обзорах, эти биогибридные материалы на основе ЛДГ обладают функциональными возможностями для доставки лекарств и генов в терапевтических целях (Evans, Duan, 2006; Choy et al., 2007, 2008; Del Hoyo, 2007), для разработки биосенсоров (Mousty, 2010), а также для биоремедиации и биоконверсии.
, 2006; Форано и др., 2006; Рен и др., 2006; Форано и Прево, 2008). Как сообщалось в недавних обзорах, эти биогибридные материалы на основе ЛДГ обладают функциональными возможностями для доставки лекарств и генов в терапевтических целях (Evans, Duan, 2006; Choy et al., 2007, 2008; Del Hoyo, 2007), для разработки биосенсоров (Mousty, 2010), а также для биоремедиации и биоконверсии.
Ladewig et al. (2009) обобщили преимущества и недостатки использования наночастиц LDH в качестве носителей для нуклеиновых кислот и лекарств, подчеркнув проблемы, которые необходимо преодолеть, прежде чем эти наночастицы можно будет использовать в клинических условиях.С 2007 года в некоторых статьях сообщалось об использовании ЛДГ в сочетании с ДНК. Интеркаляция ДНК в Mg 2 Al-LDH может происходить с помощью трех промежуточных структур (Thyveetil et al., 2008). ДНК может быть обратимо интеркалирована в ЛДГ в хлоридной форме посредством ионного обмена, что еще раз демонстрирует роль гена-носителя ЛДГ. MgAl использовали в качестве носителя для доставки ДНК-вакцины для повышения эффективности иммунизации ДНК-вакциной in vivo (Li et al., 2011). Жизнеспособность клеток для тестов доставки гена in vitro является решающим моментом.Пятьдесят процентов жизнеспособности клеток при 500 мкг / мл наночастиц LDH было получено для HEK 293 T, что намного выше, чем 50–100 мкг / мл, использованные для тестов доставки (Xu et al., 2007). Текстурные свойства ЛДГ позволяют также адсорбировать ДНК и действовать в селективном разделении биомакромолекул, конкурируя с анионами (Kim et al., 2011a). Действительно, плазмиды определенных размеров не были существенно интеркалированы в ЛДГ, а только обернуты вокруг отдельных частиц, которые агрегировались (Ladewig et al., 2010). Однако сильное взаимодействие между наночастицами ЛДГ и ДНК позволяет частицам действовать как агенты трансфекции для клеток млекопитающих. Используя суперскрученные плазмиды pEF-eGFP (примерно 6100 пар оснований), довольно низкая эффективность доставки была объяснена агрегацией наночастиц LDH, вызванной длинноцепочечной плазмидной ДНК (Xu et al.
MgAl использовали в качестве носителя для доставки ДНК-вакцины для повышения эффективности иммунизации ДНК-вакциной in vivo (Li et al., 2011). Жизнеспособность клеток для тестов доставки гена in vitro является решающим моментом.Пятьдесят процентов жизнеспособности клеток при 500 мкг / мл наночастиц LDH было получено для HEK 293 T, что намного выше, чем 50–100 мкг / мл, использованные для тестов доставки (Xu et al., 2007). Текстурные свойства ЛДГ позволяют также адсорбировать ДНК и действовать в селективном разделении биомакромолекул, конкурируя с анионами (Kim et al., 2011a). Действительно, плазмиды определенных размеров не были существенно интеркалированы в ЛДГ, а только обернуты вокруг отдельных частиц, которые агрегировались (Ladewig et al., 2010). Однако сильное взаимодействие между наночастицами ЛДГ и ДНК позволяет частицам действовать как агенты трансфекции для клеток млекопитающих. Используя суперскрученные плазмиды pEF-eGFP (примерно 6100 пар оснований), довольно низкая эффективность доставки была объяснена агрегацией наночастиц LDH, вызванной длинноцепочечной плазмидной ДНК (Xu et al. , 2007). Экстракцию ДНК проводили из иммобилизованной ЛДГ на поликарбонатной подложке (Chan et al., 2008). Экстракция была эффективной даже при крайне низких концентрациях в растворе.Инкапсулированные молекулы ДНК высвобождались при растворении ЛДГ слабой кислотой и амплифицировались полимеразной цепной реакцией. Вся система действовала как специфический детектор ДНК для быстрой диагностики заболеваний.
, 2007). Экстракцию ДНК проводили из иммобилизованной ЛДГ на поликарбонатной подложке (Chan et al., 2008). Экстракция была эффективной даже при крайне низких концентрациях в растворе.Инкапсулированные молекулы ДНК высвобождались при растворении ЛДГ слабой кислотой и амплифицировались полимеразной цепной реакцией. Вся система действовала как специфический детектор ДНК для быстрой диагностики заболеваний.
Антитело (B-антиказеин) также иммобилизовали в материалах LDH с использованием сборки LbL с сохранением его морфологии в течение 15 дней в фосфатном буферном растворе, что является многообещающим для будущих разработок биосенсоров (Baccar et al., 2009).
Белки, такие как сывороточный бычий альбумин, представляют собой биохимические соединения, состоящие из одного или нескольких полипептидов, обычно свернутых в глобулярную или волокнистую форму.Ферменты — это белки с биологическими каталитическими свойствами (перенос электронов, молекулярная изомеризация, расщепление или образование связей), которые используются в сенсорных устройствах (биосенсорах) или в нанореакторах для реакций биокатализа. Иммобилизация ферментов на твердых носителях рассматривается как стратегия, позволяющая повторно использовать ферменты и улучшать долгосрочную стабильность и стабильность pH. Ключевыми моментами, которые необходимо достичь, является полное сохранение биологической активности и хороших диффузионных свойств субстратов. Большая панель ферментов, имеющих низкие изоэлектрические точки и несущих общий отрицательный заряд при их оптимальном pH, была иммобилизована на матрице хозяина LDH.Гемопротеины или гемоферменты с изоэлектрическими точками, близкими к 7, также были иммобилизованы на ЛДГ. Различные процессы мягкой химии, такие как адсорбция, адсорбция LbL, прокаливание / переупаковка, расслоение / переупаковка, химическая прививка, соосаждение и электроосаждение, были использованы для приготовления этих биогибридных материалов на основе фермента и ЛДГ, используемых в биосенсорах (Mousty, 2010) или для биокатализа. приложения (Форано и Прево, 2008). Целью было создание биогибридных материалов с контролируемыми свойствами (химический состав, ионообменные и адсорбционные свойства, кислотно-основные свойства, электроактивность, морфология и пористость) для получения максимальных каталитических характеристик.
Иммобилизация ферментов на твердых носителях рассматривается как стратегия, позволяющая повторно использовать ферменты и улучшать долгосрочную стабильность и стабильность pH. Ключевыми моментами, которые необходимо достичь, является полное сохранение биологической активности и хороших диффузионных свойств субстратов. Большая панель ферментов, имеющих низкие изоэлектрические точки и несущих общий отрицательный заряд при их оптимальном pH, была иммобилизована на матрице хозяина LDH.Гемопротеины или гемоферменты с изоэлектрическими точками, близкими к 7, также были иммобилизованы на ЛДГ. Различные процессы мягкой химии, такие как адсорбция, адсорбция LbL, прокаливание / переупаковка, расслоение / переупаковка, химическая прививка, соосаждение и электроосаждение, были использованы для приготовления этих биогибридных материалов на основе фермента и ЛДГ, используемых в биосенсорах (Mousty, 2010) или для биокатализа. приложения (Форано и Прево, 2008). Целью было создание биогибридных материалов с контролируемыми свойствами (химический состав, ионообменные и адсорбционные свойства, кислотно-основные свойства, электроактивность, морфология и пористость) для получения максимальных каталитических характеристик. Как правило, принятая стратегия может меняться в зависимости от природы исследуемого фермента. Агрегация частиц ЛДГ может заметно влиять на адсорбцию ферментов. Чтобы решить эту проблему, коллоидные дисперсии ЛДГ использовались для улавливания ферментов путем переупаковки или для формирования ультратонких пленок с помощью сборки LbL. ЛДГ, содержащие поверхностно-активные вещества (DDS) или альгинат, могут улучшить биосовместимость по сравнению с активностью фермента. Улучшение также можно получить с помощью композитов на основе ЛДГ / биополимеров (хитозан или альгинат) или ЛДГ / гидрогеля (поли (акриловая кислота- со -акриламидом)).Путь соосаждения, который заключается в образовании ЛДГ в присутствии фермента при постоянном pH, является очень настраиваемым процессом для сохранения фермента. Этот метод позволяет выбирать различные условия (pH, температура, природа реагента и концентрация), тем самым избегая структурных изменений и денатурации фермента. Интересные результаты были также получены с захватом глюкозооксидазы (GOx) во время электроосаждения NiAl – NO 3 .
Как правило, принятая стратегия может меняться в зависимости от природы исследуемого фермента. Агрегация частиц ЛДГ может заметно влиять на адсорбцию ферментов. Чтобы решить эту проблему, коллоидные дисперсии ЛДГ использовались для улавливания ферментов путем переупаковки или для формирования ультратонких пленок с помощью сборки LbL. ЛДГ, содержащие поверхностно-активные вещества (DDS) или альгинат, могут улучшить биосовместимость по сравнению с активностью фермента. Улучшение также можно получить с помощью композитов на основе ЛДГ / биополимеров (хитозан или альгинат) или ЛДГ / гидрогеля (поли (акриловая кислота- со -акриламидом)).Путь соосаждения, который заключается в образовании ЛДГ в присутствии фермента при постоянном pH, является очень настраиваемым процессом для сохранения фермента. Этот метод позволяет выбирать различные условия (pH, температура, природа реагента и концентрация), тем самым избегая структурных изменений и денатурации фермента. Интересные результаты были также получены с захватом глюкозооксидазы (GOx) во время электроосаждения NiAl – NO 3 .
Большинство готовых ферментов-ЛДГ находят применение в электрохимических биосенсорных устройствах (амперометрических и кондуктометрических биосенсорах) для прямого обнаружения субстратов, таких как глюкоза, производные фенола, мочевина, нитрит, холестерин, лактат и перекись водорода (Mousty, 2010).С пероксидазой хрена, лакказой, нитритредуктазой и GOx окислительно-восстановительные медиаторы, интеркалированные в LDH, играют роль переносчиков электронов между электродом и ферментами и улучшают этап электрохимической трансдукции. Органические электроактивные молекулы, несущие анионную группу, такую как моно и дисульфонат антрахинона, 2,2′-азинобис-3-этилбензотиазолин-6-сульфонат (ABTS) и производные ферроцена, могут быть интеркалированы в ЛДГ, делая общую гибридную структуру электроактивной. Недавно было предложено новое применение этих окислительно-восстановительно-активных СДГ в преобразовании энергии.Редокс-активные гибридные материалы (Zn 2 Cr – ABTS и Zn 2 Al – Fe (CN) 6 LDH) были использованы для электрического соединения лакказы и GOx в устройствах на биотопливных элементах (Ding et al. , 2010; Зебда и др., 2011). Чувствительные биосенсоры на основе фермента-LDH были разработаны для обнаружения цианида, арсената, фторида и нитрита в наномолярных концентрациях на основе накопления этих анионов внутри фермент-LDH-мембраны (Shan et al., 2004a, b; Cosnier et al. ., 2006; Mousty et al., 2007; Chen et al., 2008). Наконец, частицы LDH могут обеспечивать прямой перенос электронов между окислительно-восстановительными белками, такими как гемоглобин или HRP, и поверхностью электрода.
, 2010; Зебда и др., 2011). Чувствительные биосенсоры на основе фермента-LDH были разработаны для обнаружения цианида, арсената, фторида и нитрита в наномолярных концентрациях на основе накопления этих анионов внутри фермент-LDH-мембраны (Shan et al., 2004a, b; Cosnier et al. ., 2006; Mousty et al., 2007; Chen et al., 2008). Наконец, частицы LDH могут обеспечивать прямой перенос электронов между окислительно-восстановительными белками, такими как гемоглобин или HRP, и поверхностью электрода.
В последнее время возрос интерес к применению этих интеллектуальных биогибридных материалов в биокатализе. Термическая стабильность и стабильность при хранении обычно повышались за счет иммобилизации ферментов на ЛДГ. Липаза, адсорбированная на MgAl-LDH, была исследована для производства биодизельного топлива (Yagiz et al., 2007; Zeng et al., 2009). Эффективная иммобилизация транкетолазы из Saccharomyces cerevisiae (TK) (Benaissi et al., 2011) и фруктозо-6-фосфатальдолазой (FSA) (Guérard-Hélaine et al.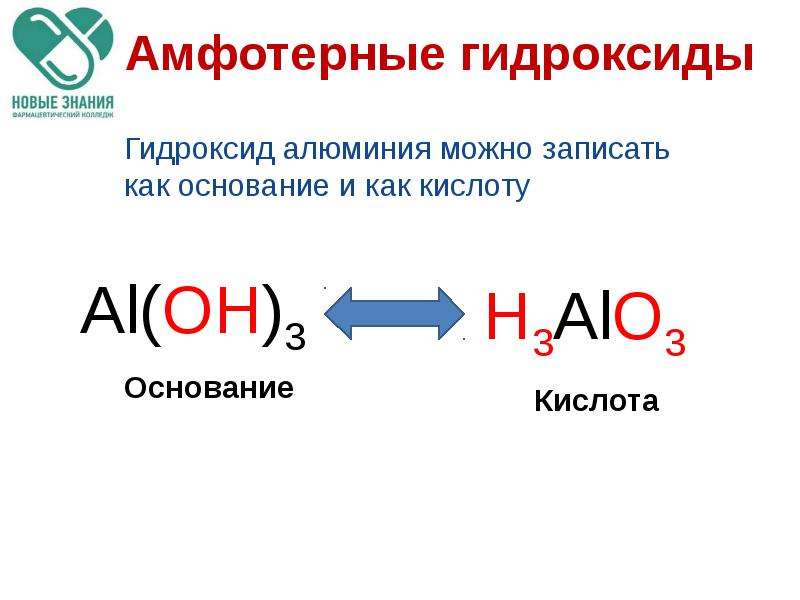 , 2011) на LDH проводили совместным осаждением in situ . Приготовленный биоматериал TK-LDH был протестирован на синтез l-эритрулозы и FSA-LDH в альдольных реакциях. Эти ферменты-ЛДГ, по-видимому, являются такими же эффективными катализаторами, как и свободные ферменты, и могут использоваться повторно несколько раз без заметной потери активности. Липоксигеназа, адсорбированная на ZnAl-азелате, сохраняла более 60% исходной активности после восьми циклов (Morales Borges et al., 2009).
, 2011) на LDH проводили совместным осаждением in situ . Приготовленный биоматериал TK-LDH был протестирован на синтез l-эритрулозы и FSA-LDH в альдольных реакциях. Эти ферменты-ЛДГ, по-видимому, являются такими же эффективными катализаторами, как и свободные ферменты, и могут использоваться повторно несколько раз без заметной потери активности. Липоксигеназа, адсорбированная на ZnAl-азелате, сохраняла более 60% исходной активности после восьми циклов (Morales Borges et al., 2009).
LDH были определены как эффективные материалы для удаления бактерий и вирусов из воды (Jin et al., 2007; Park et al., 2010). Недавно Бессе-Хогган с соавторами изучали активность биодеградации бактериальных клеток ( Pseudomonas sp. Штамм АДФ), адсорбированных на композитах ЛДГ и ЛДГ / гуминовая кислота (Besse-Hoggan et al., 2009; Alekseeva et al., 2011 ).
Гидроксид металла — обзор
3.4.4.2 Катионная полимеризация
Катионная полимеризация может привести к процессу сшивки, если диэпоксиды взяты в качестве мономеров. Таким образом, широкий спектр соединений может использоваться каталитически в качестве катионных инициаторов отверждения эпоксидных смол, которые действуют с высокой скоростью. Более того, их низкая начальная вязкость и быстрое отверждение делают их хорошими кандидатами для быстрой реактивной обработки.
Таким образом, широкий спектр соединений может использоваться каталитически в качестве катионных инициаторов отверждения эпоксидных смол, которые действуют с высокой скоростью. Более того, их низкая начальная вязкость и быстрое отверждение делают их хорошими кандидатами для быстрой реактивной обработки.
Катионная полимеризация инициируется кислотами Льюиса. Было показано, что активными являются многие галогениды металлов, такие как AlCl3, SnCl4, TiCl4, SbCl5 или BF3, но наиболее часто используемым соединением является трифторид бора. На практике с трифторидом бора трудно обращаться, и реакция протекает слишком быстро.Следовательно, соединение используется в виде комплекса, например, в виде сложного эфира или комплекса амина. Сила комплексов простого эфира и амина может быть связана с основной силой эфира и амина, соответственно. Поскольку реакционная способность комплекса зависит от константы диссоциации, можно сделать некоторые прогнозы активности комплекса.
Вода или спирты вызывают реакции передачи цепи. Спирт атакует положительно заряженный конец растущей полимерной цепи и образует эфирную связь или гидроксильную группу соответственно.Освободившийся протон может инициировать рост другой полимерной цепи. Диолы и триолы дают полимеры с боковыми гидроксильными группами. Следовательно, диэпоксиды или эпоксиды с более высокими функциональными группами полимеризуются в присутствии диолов или триолов и т. Д. Могут появляться разветвленные и сшитые продукты.
Спирт атакует положительно заряженный конец растущей полимерной цепи и образует эфирную связь или гидроксильную группу соответственно.Освободившийся протон может инициировать рост другой полимерной цепи. Диолы и триолы дают полимеры с боковыми гидроксильными группами. Следовательно, диэпоксиды или эпоксиды с более высокими функциональными группами полимеризуются в присутствии диолов или триолов и т. Д. Могут появляться разветвленные и сшитые продукты.
При катионном УФ-отверждении алифатического эпоксидного соединения было обнаружено, что скорость полимеризации сильно снизилась после степени превращения менее 10%. Этот эффект не был вызван температурой стеклования.Однако добавление 1,6-гександиола увеличивало конверсию при комнатной температуре [252].
Каталитические системы бывают фотолатентными и термолатентными. Было рассмотрено большое количество таких катализаторов [253]. Помимо прямого термолиза инициатора, также возможны косвенные методы. В таблице 3.12 представлен список скрытых катализаторов.
Таблица 3.12. Латентные катализаторы
| Составные справочники | |
|---|---|
| Н -Benzylpyrazinium гексафторантимонат | [255] |
| Н -Benzylquinoxalinium гексафторантимонат | [255] |
| Бензил tetrahydrothiophenium гексафторантимонат | [256] |
| o , o -Di- трет -бутил-1-пиперидинилфосфонамидат | [257] |
| o -9000-1-трет-бутил -пиперидинилфосфонамидат | [257] |
| o , o -ди- трет- -Бутилфенилфосфонат | [258] |
| 0007 o , ] |
Спироортокарбонат
Катионная реакция отверждения бисфенола А-типа. эпоксидная смола в присутствии спироортокарбоната (SOC) может быть выполнена с диэтератом трифторида бора. SOC претерпевает реакцию двойного раскрытия кольца [254]. Конверсия эпоксидных групп увеличивается с увеличением содержания SOC.
SOC претерпевает реакцию двойного раскрытия кольца [254]. Конверсия эпоксидных групп увеличивается с увеличением содержания SOC.
3,9-Ди ( p -метоксибензил) -1,5,7,11-тетраоксаспиро- [5.5] ундекан (см. Рис. 3.16) в виде SOC может быть синтезирован по реакции 2-метоксибензил- 1,3-пропандиол с оксидом дибутилолова.
Рисунок 3.16. 3,9-Ди ( p -метоксибензил) -1,5,7,11-тетра-оксаспиро [5.5] ундекан и 3,23-диоксатриспиротрицикло [3.2.1.0 [2.4]] октан-6,5′-1 , 3-диоксан-2 ′, 2 ″ -1,3-диоксан-5 ″, 7 ′ ″ — трицикло [3.2.1.0 [2.4] октан].
Дифференциальная сканирующая калориметрия показывает два пика, которые приписываются полимеризации эпоксидной группы и сополимеризации SOC с эпоксидными группами или гомополимеризации, соответственно. Сополимеры, содержащие SOC, способны давать твердую безусадочную матричную смолу. Примеры этих сополимеров включают 2,3,8,9-ди (тетраметилен) -1,5,7,11-тетраоксаспиро [5.5] ундекан спироортокарбонат и 3,23-диоксатриспиротрицикло [3.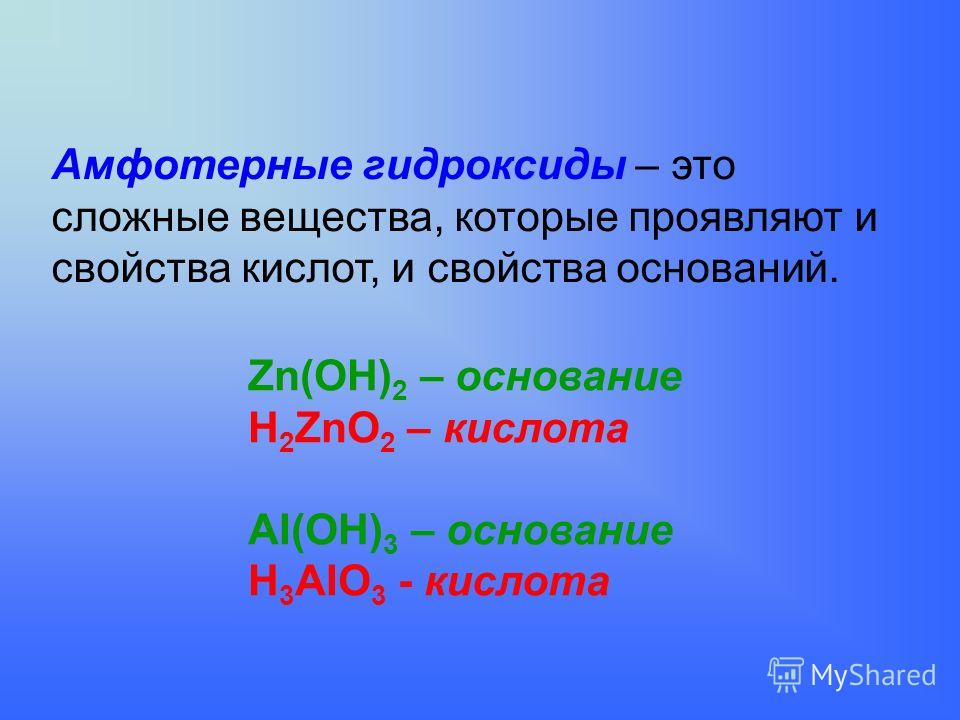 2.1.0 [2.4]] октан- 6,5′-1,3-диоксан-2 ′, 2 ″ -1,3-диоксан-5 ″, 7 ′ ″ — трицикло [3.2.1.0 [2.4] октан] и цис , цис -, цис , транс — и транс , транс -конфигурационные изомеры 2,3,8,9-ди (тетраметилена ) -1,5,7,11-тетраоксаспиро [5.5] ундекан.
2.1.0 [2.4]] октан- 6,5′-1,3-диоксан-2 ′, 2 ″ -1,3-диоксан-5 ″, 7 ′ ″ — трицикло [3.2.1.0 [2.4] октан] и цис , цис -, цис , транс — и транс , транс -конфигурационные изомеры 2,3,8,9-ди (тетраметилена ) -1,5,7,11-тетраоксаспиро [5.5] ундекан.
Было установлено, что эти SOC подвергаются расширению на 3,5% во время гомополимеризации и продемонстрировали приемлемые свойства цитотоксичности и генотоксичности. Эти свойства делают их перспективными компонентами композиционных матричных материалов на основе смол [20].
Соли трифторметансульфоновой кислоты
Трифликовая кислота, т.е.например, трифторметансульфоновая кислота, CF3SO3H, является известной сильной кислотой. Трифлаты лантаноидов являются кислотами Льюиса и сохраняют свою каталитическую активность даже в водном растворе. Сильная электроотрицательность аниона трифторметансульфоната усиливает кислотный характер инициатора Льюиса. Таким образом, трифлаты лантаноидов являются отличными катализаторами раскрытия цикла эпоксидных соединений [259].
Сложные эфиры фосфоновой кислоты
Сложные эфиры фенилфосфоновой кислоты разлагаются на фенилфосфоновую кислоту и соответствующие олефины при 150–170 ° C.В присутствии ZnCl2 они могут инициировать катионную полимеризацию глицидилфенилового эфира (ГФЭ) до молекулярных масс до 2000–7000 Да [258].
Примеры: o , o -ди-1-фенилэтилфенилфосфонат, o , o -ди- трет--бутилфенилфосфонат и o , клофенилфосфонат фенилфосфонат. Эти соединения можно синтезировать из дихлорида фенилфосфоновой кислоты и соответствующих спиртов.
Фосфонамидаты
Фосфонамидаты — это термически скрытые инициаторы, подходящие для полимеризации эпоксидов [257].Эти соединения, такие как o , o -ди- трет--бутил-1-пиперидинилфосфонамидат и o — трет--бутил-ди-1-пиперидинилфосфонамидат и пиперидинилфосфонамидат, могут быть синтезированы из пиперидина присутствие триэтиламина с последующей реакцией с трет-бутиловым спиртом в присутствии гидрида натрия.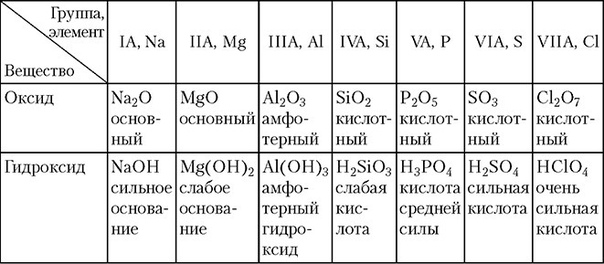 Полимеризация эпоксидных смол не происходит ниже 110 ° C, тогда как отверждение происходит быстро при температуре выше 110 ° C. При комнатной температуре смесь эпоксида и фосфонамидата стабильна в течение нескольких месяцев.
Полимеризация эпоксидных смол не происходит ниже 110 ° C, тогда как отверждение происходит быстро при температуре выше 110 ° C. При комнатной температуре смесь эпоксида и фосфонамидата стабильна в течение нескольких месяцев.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.