Названия химических элементов
Названия химических элементовНазвания химических элементов
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Серебро | |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Прометий | |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннессин |
| 118 | Og | Oganesson | Оганессон |
https://iupac. org/what-we-do/periodic-table-of-elements/
org/what-we-do/periodic-table-of-elements/
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, «Коту» рассказал профессор Сколтеха Артем Оганов.
Артем Оганов — кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, — с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним — активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним — активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение — выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений — веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность — параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость — способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность — способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая — у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х — радиус, а по оси Y — электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности — только расчеты на основе фундаментальных характеристик атомов. Мы назвали это «Универсальной последовательностью элементов», по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения — молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле — его можно назвать химическим пространством — возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, — самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал «Кот Шрёдингера»
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал «Кот Шрёдингера»
Основание (химия) — это… Что такое Основание (химия)?
У этого термина существуют и другие значения, см. Основание.
Основание.Основа́ния — класс химических соединений.
В статье смысл термина «основание» раскрывается в первом, наиболее широко используемом значении — осно́вные гидрокси́ды.
Получение
Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По летучести.

- Летучие: NH3, CH3-NH2
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- По наличию кислорода.
- По типу соединения:
- Неорганические основания: содержат одну или несколько групп -OH.
- Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
- Tl2O3•n H2O — полигидрат оксида таллия(III)
- MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
- это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
- Примечание: реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Основания вступают в обменные реакции (реагируют с растворами солей):
- Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
- Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.

См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9
Микроэлементы. Общая информация
Химические элементы в свободном состоянии и в виде множества химических соединений входят в состав всех клеток и тканей человеческого организма. Они являются строительным материалом, важнейшими катализаторами различных биохимических реакций, непременными и незаменимыми участниками процессов роста и развития организма, обмена веществ, адаптации к меняющимся условиям окружающей среды.
Физиологическое действие различных элементов зависит от их дозы. Поэтому токсичные элементы (мышьяк, ртуть, сурьма, кадмий и др.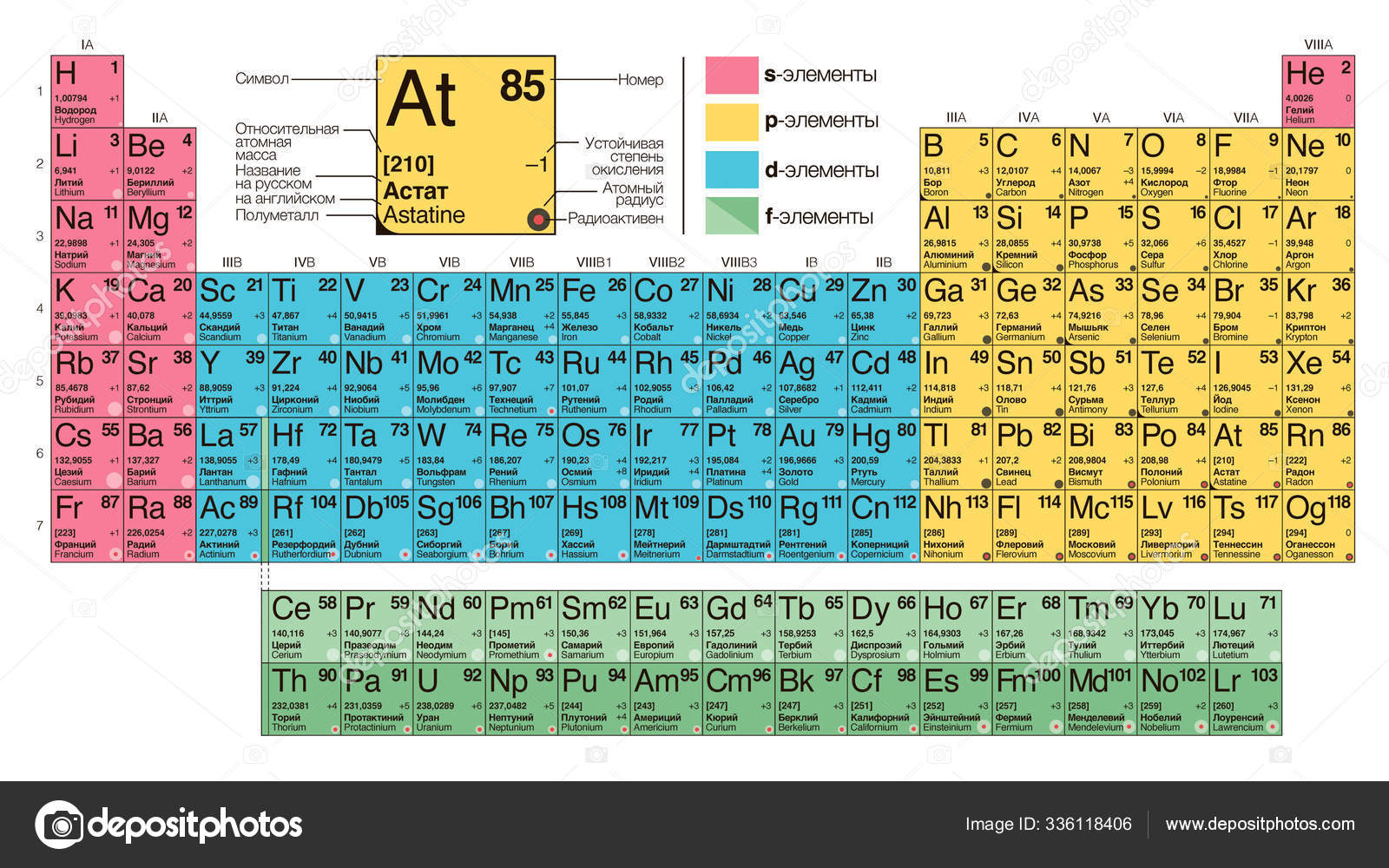 ) при низких концентрациях могут действовать на организм как лекарство (оказывая тем самым саногенетическое воздействие), тогда как натрий, калий, кальций, железо, магний и ряд других элементов в высоких концентрациях могут обладать выраженным токсическим эффектом.
) при низких концентрациях могут действовать на организм как лекарство (оказывая тем самым саногенетическое воздействие), тогда как натрий, калий, кальций, железо, магний и ряд других элементов в высоких концентрациях могут обладать выраженным токсическим эффектом.
Для осуществления жизненно важных функций у каждого элемента существует оптимальный диапазон концентраций. При дефиците или избыточном накоплении элементов в организме могут происходить серьезные изменения, обуславливающие нарушение активности прямо или косвенно зависящих от них ферментов.
В организме химические элементы находятся преимущественно в виде соединений, избыточное образование или распад которых может приводить к нарушению так называемого металло-лигандного гомеостаза, а в дальнейшем и к развитию патологических изменений. Элементы – металлы и лиганды (например, глутаминовая, аспарагиновая, липоевая, аскорбиновая кислоты) могут выступать в качестве активаторов или ингибиторов различных ферментов, что обусловливает их существенную роль в развитии и терапии различных заболеваний.
Для систематизации сведений о содержании и физиологической роли химических элементов в организме в последние десятилетия был предложен ряд классификаций. Не рассматривая их подробно, остановимся лишь на некоторых принципиальных моментах.
Один из принципов классификации – разделение химических элементов на группы, в зависимости от уровня их содержания в организме человека.
Первую группу такой классификации составляют «макроэлементы», концентрация которых в организме превышает 0,01%. К ним относятся O, C, H, N, Ca, P, K, Na, S, Cl, Mg. В абсолютных значениях (из расчета на среднюю массу тела человека в 70 кг), величины содержания этих элементов колеблются в пределах от сорока с лиш ним кг (кислород) до нескольких г (магний). Некоторые элементы этой группы называют «органогенами» (O, H, С, N, P, S) в связи с их ведущей ролью в формировании структуры тканей и органов.
Вторую группу составляют «микроэлементы» (концентрация от 0,00001% до 0,01%).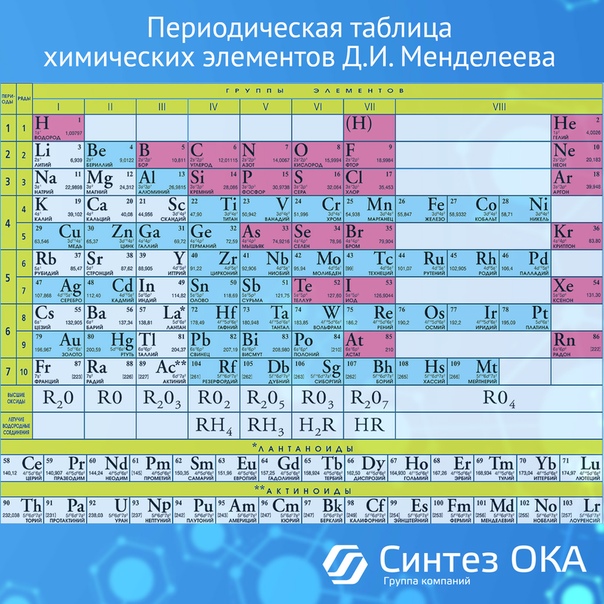 В эту группу входят: Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, B, Rb. Эти элементы содержатся в организме в концентрациях от сотен мг до нескольких г. Однако, несмотря на малое содержание, микроэлементы не случайные ингредиенты биосубстратов живого организма, а компоненты сложной физиологической системы, участвующей в регулировании жизненных функций организма на всех этапах его развития.
В эту группу входят: Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, B, Rb. Эти элементы содержатся в организме в концентрациях от сотен мг до нескольких г. Однако, несмотря на малое содержание, микроэлементы не случайные ингредиенты биосубстратов живого организма, а компоненты сложной физиологической системы, участвующей в регулировании жизненных функций организма на всех этапах его развития.
В третью группу включены «ультрамикроэлементы», концентрация которых ниже 0,000001%. Это Se, Co, V, Cr, As, Ni, Li, Ba, Ti, Ag, Sn, Be, Ga, Ge, Hg, Sc, Zr, Bi, Sb, U, Th, Rh. Содержание этих элементов в теле человека измеряется в мг и мкг. На данный момент установлено важнейшее значение для организма многих элементов из этой группы, таких как, селен, кобальт, хром и др.
В основе другой классификации лежат представления о физиологической роли химических элементов в организме. Согласно такой классификации макроэлементы, составляющие основную массу клеток и тканей, являются “структурными” элементами. К «эссенциальным» (жизненно-необходимым) микроэлементам относят Fe, I, Cu, Zn, Co, Cr, Mo, Se, Mn, к “условно-эссенциальным” – As, B, Br, F, Li, Ni, Si, V. Жизненная необходимость или эссенциальность (от англ. essential – “необходимый”), является важнейшим для жизнедеятельности живых организмов свойством химических элементов. Химический элемент считается эссенциальным, если при его отсутствии или недостаточном поступлении в организм нарушается нормальная жизнедеятельность, прекращается развитие, становится невозможной репродукция. Восполнение недостающего количества такого элемента устраняет клинические проявления его дефицита и возвращает организму жизнеспособность.
К «эссенциальным» (жизненно-необходимым) микроэлементам относят Fe, I, Cu, Zn, Co, Cr, Mo, Se, Mn, к “условно-эссенциальным” – As, B, Br, F, Li, Ni, Si, V. Жизненная необходимость или эссенциальность (от англ. essential – “необходимый”), является важнейшим для жизнедеятельности живых организмов свойством химических элементов. Химический элемент считается эссенциальным, если при его отсутствии или недостаточном поступлении в организм нарушается нормальная жизнедеятельность, прекращается развитие, становится невозможной репродукция. Восполнение недостающего количества такого элемента устраняет клинические проявления его дефицита и возвращает организму жизнеспособность.
К “токсичным” элементам отнесены Al, Cd, Pb, Hg, Be, Ba, Bi, Tl, к “потенциально-токсичным” – Ag, Au, In, Ge, Rb, Ti, Te, U, W, Sn, Zr и др. Результатом воздействия этих элементов на организм является развитие синдромов интоксикаций (токсикопатий).
Оценка элементного статуса человека является основным вопросом определения влияния на здоровье человека дефицита, избытка или нарушения тканевого перераспределения макро- и микроэлементов. Определение элементного состава биосред используется:
Определение элементного состава биосред используется:
- при мониторинге состояния здоровья, оценке уровня работоспособности и эффективности лечения;
- при формировании групп риска по гипо- и гиперэлементозам;
- при подборе рациональной диеты как здоровому, так и больному человеку;
- в скрининг-диагностических исследованиях больших групп населения;
- при картировании территорий по нозологическим и системным формам патологии у детей и других возрастных групп населения;
- при оценке взаимозависимости многосторонних связей цепи “человек–среда обитания”;
- при составлении карт экологического природного и техногенного неблагополучия регионов;
- при изучении воздействия на организм вредных привычек;
- экспертно-криминалистических исследованиях (идентификация личности в судебной медицине, метод выбора в подтверждение исследований по молекуле ДНК и генному коду).
Методы определения микроэлементов в биосубстратах Масс-спектрометрия с индуктивно связанной аргоновой плазмой (ИСП-МС), атомно-абсорбционная спектрофотометрия с электротермической атомизацией (ААС-ЭТА).
Условия взятия и хранения материала для исследования
Взятие и подготовка крови для получения плазмы и сыворотки проводится по общепринятым методикам. Если при заборе проб используют перчатки, то они должны быть не опудренные и не содержать латекса (напр., нитриловые). Кровь может быть получена из локтевой вены или из пальцев рук (капиллярная). Объем отобранной крови должен составлять не менее 1 мл. Образцы сыворотки или плазмы крови хранятся в обычном холодильнике до 3–5 сут (от 0 до 4 °С) либо замораживаются (до -18 °С), либо лиофилизуются, или высушиваются в сушильном шкафу (для длительного хранения). Для длительного хранения образцы помещаются в одноразовые полипропиленовые пробирки с герметичными крышками.
Взятие биологических образцов крови и мочи проводят в соответствии с МУК 4.1.1482-08, МУК 4.1.1483-08.
Кислород
| Кислород | |
|---|---|
| Атомный номер | 8 |
| Внешний вид простого вещества |
газ без цвета, вкуса и запаха голубоватая жидкость (при низких температурах) |
| Свойства атома | |
|
Атомная масса (молярная масса) |
15,9994 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 60 (48) пм |
|
Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p4 |
| Химические свойства | |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
|
Электроотрицательность (по Полингу) |
3,44 |
| Электродный потенциал | 0 |
| Степени окисления | -2, −1, 0 ,+1, +2, -½ |
| Термодинамические свойства простого вещества | |
| Плотность | 0,00142897 г/см³ |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Теплопроводность | 0,027 Вт/(м·K) |
| Температура плавления | 54,8 K |
| Теплота плавления | 0,444 кДж/моль |
| Температура кипения | 90,19 K |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å |
| Отношение c/a | — |
| Температура Дебая | 155 K |
| O | 8 |
| 15,9994 | |
| [He]2s22p4 | |
| Кислород | |
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет.
И. Менделеева, с атомным номером 8. Обозначается символом O (Oxygenium). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Схема атома кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (l’oxygène), предложенного А. Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 %(по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий. При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий. При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
Катализатором также выступает MnO2.
Физические свойства
Холодная вода содержит больше растворенного O2При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Фазовая диаграмма O2
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .
β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å .
Ещё три фазы образуются при высоких давлениях:
δ-О2 интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;
ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.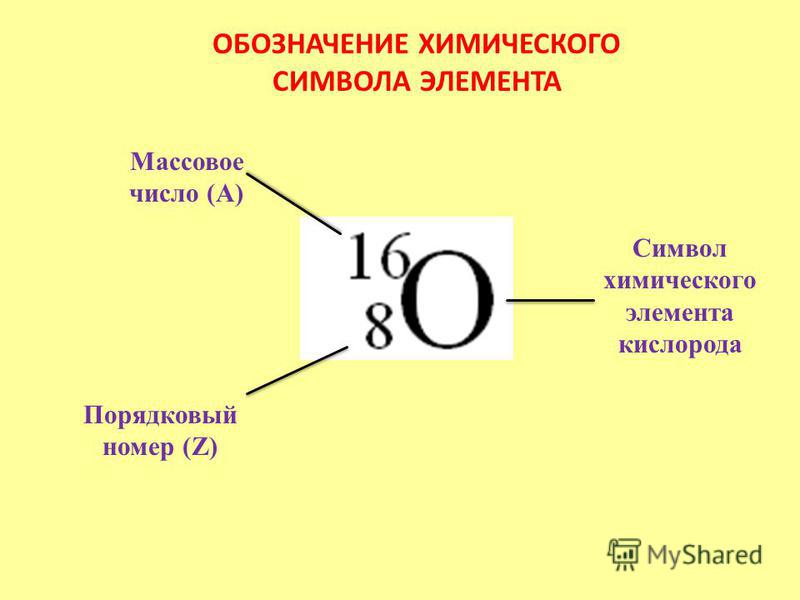
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 → 2K2O
2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 → 2NO2
Окисляет большинство органических соединений:
CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определенных условиях можно провести мягкое окисление органического соединения:
CH3CH2OH + O2 → CH3COOH + H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.
— Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 → Na2O2
— Некоторые окислы поглощают кислород:
2BaO + O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
H2 + O2 → H2O2
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2—). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:
Na2O2 + O2 → 2NaO2
Озониды содержат ион O3— со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:
Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 → КО3 + КОН + O2
Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 → O2PtF6
Фториды кислорода
Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
2F2 + 2NaOH → OF2 + 2NaF + H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Кислород поддерживает процессы дыхания, горения, гниения. В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3 (озон).
Применение кислорода
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).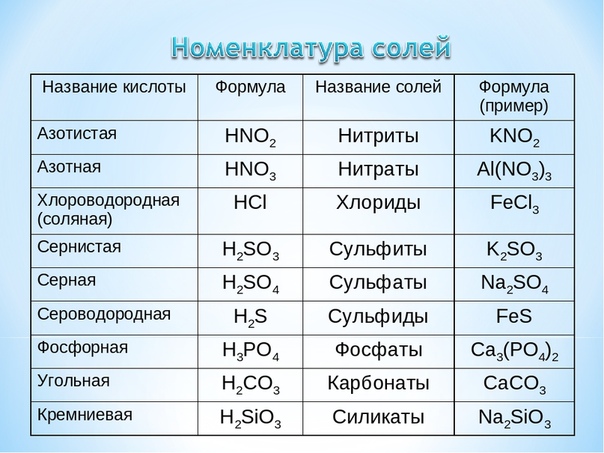
В медицине
Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037% и 0,204% от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Дополнительная информация
Кислород, Oxygenium, O (8)
Открытие кислорода (Oxygen, франц. Oxygene, нем. Sauerstoff) ознаменовало начало современного периода развития химии. С глубокой древности было известно, что для горения необходим воздух, однако многие века процесс горения оставался непонятным. Лишь в XVII в. Майов и Бойль независимо друг от друга высказали мысль, что в воздухе содержится некоторая субстанция, которая поддерживает горение, но эта вполне рациональная гипотеза не получила тогда развития, так как представление о горении, как о процессе соединения горящего тела с некой составной частью воздуха, казалось в то время противоречащим столь очевидному акту, как то, что при горении имеет место разложение горящего тела на элементарные составные части.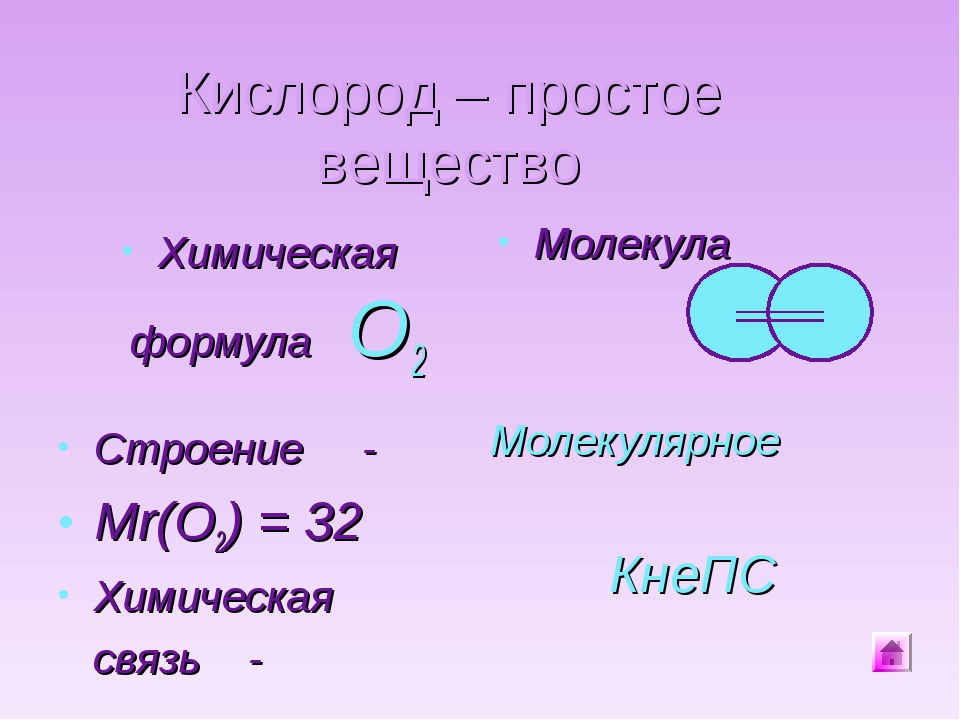 Именно на этой основе на рубеже XVII в. возникла теория флогистона, созданная Бехером и Шталем. С наступлением химико-аналитического периода развития химии (вторая половина XVIII в.) и возникновением «пневматической химии» — одной из главных ветвей химико-аналитического направления — горение, а также дыхание вновь привлекли к себе внимание исследователей. Открытие различных газов и установление их важной роли в химических процессах явилось одним из главных стимулов для систематических исследований процессов горения веществ, предпринятых Лавуазье. Кислород был открыт в начале 70-х годов XVIII в.
Именно на этой основе на рубеже XVII в. возникла теория флогистона, созданная Бехером и Шталем. С наступлением химико-аналитического периода развития химии (вторая половина XVIII в.) и возникновением «пневматической химии» — одной из главных ветвей химико-аналитического направления — горение, а также дыхание вновь привлекли к себе внимание исследователей. Открытие различных газов и установление их важной роли в химических процессах явилось одним из главных стимулов для систематических исследований процессов горения веществ, предпринятых Лавуазье. Кислород был открыт в начале 70-х годов XVIII в.
Первое сообщение об этом открытии было сделано Пристлеем на заседании Английского королевского общества в 1775 г. Пристлей, нагревая красную окись ртути большим зажигательным стеклом, получил газ, в котором свеча горела более ярко, чем в обычном воздухе, а тлеющая лучина вспыхивала. Пристлей определил некоторые свойства нового газа и назвал его дефлогистированным воздухом (daphlogisticated air). Однако двумя годами ранее Пристлея (1772) Шееле тоже получал кислород разложением окиси ртути и другими способами. Шееле назвал этот газ огненным воздухом (Feuerluft). Сообщение же о своем открытии Шееле смог сделать лишь в 1777 г.
Однако двумя годами ранее Пристлея (1772) Шееле тоже получал кислород разложением окиси ртути и другими способами. Шееле назвал этот газ огненным воздухом (Feuerluft). Сообщение же о своем открытии Шееле смог сделать лишь в 1777 г.
В 1775 г. Лавуазье выступил перед Парижской академией наук с сообщением, что ему удалось получить «наиболее чистую часть воздуха, который нас окружает», и описал свойства этой части воздуха. Вначале Лавуазье называл этот «воздух» эмпирейным, жизненным (Air empireal, Air vital) основанием жизненного воздуха (Base де l’air vital). Почти одновременное открытие кислорода несколькими учеными в разных странах вызвало споры о приоритете. Особенно настойчиво признания себя первооткрывателем добивался Пристлей. По существу споры эти не окончились до сих пор. Подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г. Лавуазье в соответствии с этим выводом ввел для кислорода новое название — кислото образующий принцип (principe acidifiant ou principe oxygine). Фигурирующее в этом сложном названии слово oxygine Лавуазье произвел от греч.- кислота и «я произвожу».
Лавуазье в соответствии с этим выводом ввел для кислорода новое название — кислото образующий принцип (principe acidifiant ou principe oxygine). Фигурирующее в этом сложном названии слово oxygine Лавуазье произвел от греч.- кислота и «я произвожу».
Гуранова Наталья ИгоревнаК.Х.Н., младший научный сотрудник |
|
Жмуров Пётр АлександровичК.Х.Н., научный сотрудник |
|
Чупахин Евгений ГеннадьевичК.Х.Н., научный сотрудник |
|
Бубырев Андрей Ивановичлаборант-исследователь |
|
Бурьянова Валерия Константиновна—инженер-исследователь st034288@student. |
|
Еремеева Мария Александровналаборант-исследователь |
|
Жуковский Даниил Дмитриевич—инженер-исследователь |
|
Кантин Григорий ПавловичК.Х.Н., инженер-исследователь |
|
Левашова Екатерина Юрьевналаборант-исследователь |
|
Соловьев Игорь Владимирович—инженер-исследователь |
|
Фирсов Андрей Александровичлаборант-исследователь st044545@student. |
|
Шаронова Татьяна Валерьевна—инженер-исследователь |
«Химия — это наука о веществах и их превращениях»
Научные лаборатории — это образовательный проект Политеха для детей разных возрастов. Более 100 уроков по школьной программе помогут детям лучше понять, запомнить и полюбить тот или иной раздел химии, физики, биологии или математики — дети не только получают необходимые по школьной программе знания, но делают это с удовольствием, самостоятельно проводя научные исследования, опыты и эксперименты. Занятия ведут молодые практикующие ученые и специалисты. В преддверии начала нового учебного сезона сайт Политехнического музея публикует серию интервью с руководителями Научных лабораторий.
Занятия ведут молодые практикующие ученые и специалисты. В преддверии начала нового учебного сезона сайт Политехнического музея публикует серию интервью с руководителями Научных лабораторий.
C руководителем Лабаратории Химии Денисом Жилиным мы поговорили о химии в школе, скуке и радости.
Как вы стали ученым? Когда решили им быть?
Ну, во-первых, я бы не стал называть себя ученым. А вообще так сложилось исторически. В какой-то момент стал интересоваться химией, поступил на химфак. Я начал преподавать и понял, что у нас мало кто умеет преподавать химию. Я стал разбираться, как это нужно делать. Стал заниматься непосредственно методикой преподавания химии, на мой взгляд, она чуть менее, чем полностью заражена вирусом болтологии. Теперь я занимаюсь тем, что устанавливаю границы применимости многочисленных приемов и способов обучения, которые предлагают методисты. И проверяю их на детях.
Стал заниматься непосредственно методикой преподавания химии, на мой взгляд, она чуть менее, чем полностью заражена вирусом болтологии. Теперь я занимаюсь тем, что устанавливаю границы применимости многочисленных приемов и способов обучения, которые предлагают методисты. И проверяю их на детях.
Что самое главное вы хотели бы сказать о своей работе детям?
Дикари-с не поймут-с. Я лучше их химии буду учить (смеется). Вот бы дети мне сказали, что они считают самым главным в моей работе.
Расскажите о причинах ненависти к химии в школе.
Химия — это наука о веществах и их превращениях. Этим и нужно заниматься, изучать вещества и превращать их в другие. Это очень интересно. А в школе людей заставляют работать с непонятными формулами. Всем становится скучно. Если ребенок что-то не понимает и ему неинтересно, искать причину в ребенке нужно в последнюю очередь.
Как же все-таки заинтересовать ребенка химией?
Просто «грузить» ребенка материалом не имеет смысла, ему будет скучно. У возрастного психолога Марии Осориной есть концепция «спонтанных игр», их получается успешно использовать с детьми самых разных возрастов, даже со старшеклассниками. И обязательно ребенок на занятиях должен сам что-то делать, проводить опыты, чувствовать, разбираться, почему это работает так, а не иначе. В психологии это называется «активная деятельность».
У возрастного психолога Марии Осориной есть концепция «спонтанных игр», их получается успешно использовать с детьми самых разных возрастов, даже со старшеклассниками. И обязательно ребенок на занятиях должен сам что-то делать, проводить опыты, чувствовать, разбираться, почему это работает так, а не иначе. В психологии это называется «активная деятельность».
К какому возрасту мы можем с уверенностью говорить о способностях ребенка к той или иной дисциплине?
Вопрос о том, с какого возраста формируются и проявляются те или иные способности школьника — до сих пор в науке дискуссионный. По моему опыту, способности к химии проявляются в 8–9 классах, но их надо развивать.
Что главное в работе руководителя кружка по химии?
Главным, пожалуй, является чувство успеха. Как и чувство провала. Еще совершенно необходимо умение быстро менять подход в случае очевидной неудачи. И не повторять из раза в раз одни и те же ошибки, научиться недостатки обращать на пользу. И, что очень важно, самому педагогу на занятиях не должно быть скучно. В Политехнический музей я пошел работать во многом потому, что здесь не приходится проводить одни и те же занятия из раза в раз, можно создавать что-то новое, ставить новые задачи, экспериментировать. Однообразие утомляет всех: и учителя, и детей.
И, что очень важно, самому педагогу на занятиях не должно быть скучно. В Политехнический музей я пошел работать во многом потому, что здесь не приходится проводить одни и те же занятия из раза в раз, можно создавать что-то новое, ставить новые задачи, экспериментировать. Однообразие утомляет всех: и учителя, и детей.
Лаборатория Химии — старейшая лаборатория Политеха. Основанная еще в XIX веке, сегодня она проводит множество интерактивных занятий, состоящих из лекций и демонстрации химических опытов. Дети узнают, как применять полученные химические знания в реальной жизни — от приготовления пищи до изготовления оловянных солдатиков. Большое количество реактивов и современной посуды позволяют проводить полноценные практические работы в группе. Кроме этого, лаборатория оборудована системой индивидуальных вытяжек, что дает возможность проводить эксперименты с широким набором веществ. Как и все лаборатории Политеха, Лаборатория Химии проводит разовые занятия, как для школьных групп, так и для индивидуальных посетителей, желающих заниматься химией регулярно.
Записаться на занятия можно по телефону: +7 916 008−12−31, +7 495 730−54−38 (доб. 1777) или заполнив форму на нашем сайте.
| Химический символ | Название элемента | Атомный N или | Происхождение символа |
| Ас | Актиний | 89 | |
| Ag | Серебро | 47 | От латинского Argentum , что первоначально означало сияющий металл |
| Al | Алюминий | 13 | |
| Am | Америций | 95 | |
| Ар | Аргон | 18 | |
| Как | Мышьяк | 33 | |
| по адресу | Астатин | 85 | |
| Au | Золото | 79 | От латинского Aurum , что первоначально означало желтый | .
| Б | Бор | 5 | |
| Ba | Барий | 56 | |
| Be | Бериллий | 4 | |
| Bh | Борий | 107 | |
| Би | висмут | 83 | |
| Bk | Беркелиум | 97 | |
| Br | Бром | 35 | |
| К | Углерод | 6 | |
| Ca | Кальций | 20 | |
| Кд | Кадмий | 48 | |
| CE | Церий | 58 | |
| Cf | Калифорний | 98 | |
| Класс | Хлор | 17 | |
| см | Кюрий | 96 | |
| Co | Кобальт | 27 | |
| Кр | Хром | 24 | |
| CS | Цезий | 55 | |
| Cu | Медь | 29 | Из Cuprum , латинское название Кипра, римского источника меди |
| DS | Дармштадтиум | 110 | |
| ДБ | Дубний | 105 | |
| Dy | Диспрозий | 66 | |
| Er | Эрбий | 68 | |
| Es | Эйнштейний | 99 | |
| ЕС | Европий | 63 | |
| Факс | Фтор | 9 | |
| Fe | Утюг | 26 | Из Ferrum , латинское название железа |
| FM | Фермий | 100 | |
| Fr | Франций | 87 | |
| Ga | Галлий | 31 | |
| Gd | Гадолиний | 64 | |
| Ge | Германий | 32 | |
| H | Водород | 1 | |
| He | Гелий | 2 | |
| Hf | Гафний | 72 | |
| Hg | Меркурий | 80 | От латинского Hydragyrum , что означает жидкое серебро | .
| Ho | Гольмий | 67 | |
| HS | Калий | 108 | |
| Я | Йод | 53 | |
| дюйм | Индий | 49 | |
| Ir | Иридий | 77 | |
| К | Калий | 19 | От латинского Kalium , что означает щелочь | .
| Kr | Криптон | 36 | |
| Ла | лантан | 57 | |
| Li | Литий | 3 | |
| Лр | Лоуренсий | 103 | |
| Лю | Лютеций | 71 | |
| Md | Менделевий | 101 | |
| мг | Магний | 12 | |
| млн | Марганец | 25 | |
| Пн | молибден | 42 | |
| млн тонн | Мейтнерий | 109 | |
| N | Азот | 7 | |
| Na | Натрий | 11 | Из Natrium , латинское название карбоната натрия |
| Nb | Ниобий | 41 | |
| Nd | Неодим | 60 | |
| Ne | Неон | 10 | |
| Ni | Никель | 28 | |
| № | Нобелий | 102 | |
| НП | Нептуний | 93 | |
| O | Кислород | 8 | |
| Ос | Осмий | 76 | |
| пол | фосфор | 15 | |
| Па | Протактиний | 91 | |
| Пб | Свинец | 82 | От латинского Plumbum , что означает мягкий белый металл |
| Pd | Палладий | 46 | |
| пм | Прометий | 61 | |
| Po | Полоний | 84 | |
| Пр | празеодим | 59 | |
| Пт | Платина | 78 | |
| Pu | Плутоний | 94 | |
| Ra | Радий | 88 | |
| Руб | Рубидий | 37 | |
| Re | Рений | 75 | |
| Rf | Резерфордий | 104 | |
| Rg | Рентген | 111 | |
| Rh | Родий | 45 | |
| Rn | Радон | 86 | |
| Ру | Рутений | 44 | |
| Ю | Сера | 16 | |
| Сб | Сурьма | 51 | От латинского Stibium , что означает косметическая пудра | .
| SC | Скандий | 21 | |
| SE | Селен | 34 | |
| Sg | Сиборгий | 106 | |
| Si | Кремний | 14 | |
| См | Самарий | 62 | |
| Sn | Олово | 50 | Из Stannum , латинское слово для олова |
| Sr | Стронций | 38 | |
| Ta | Тантал | 73 | |
| Тб | Тербий | 65 | |
| Тк | Технеций | 43 | |
| Te | Теллур | 52 | |
| Чт | торий | 90 | |
| Ti | Титан | 22 | |
| Тл | Таллий | 81 | |
| Тм | Тулий | 69 | |
| U | Уран | 92 | |
| В | Ванадий | 23 | |
| Вт | Вольфрам | 74 | Из Wolfram , старое название элемента, полученного из его руды, Wolframite |
| Xe | Ксенон | 54 | |
| Y | Иттрий | 39 | |
| Yb | Иттербий | 70 | |
| Zn | цинк | 30 | |
| Zr | Цирконий | 40 |
Расшифровка: Химия в ее элементе: кислород(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (конец акции) Крис Смит Здравствуйте! И добро пожаловать в Chemistry in its element, где мы рассмотрим истории, лежащие в основе элементов, из которых состоит мир вокруг нас. Я Крис Смит. На этой неделе мы продолжаем наше путешествие по таблице Менделеева с легким, полным газа, без которого мы не можем обойтись. Он защищает нас от солнечного излучения, сохраняет жизнь и, помогая вещам гореть, согревает. Это, конечно, кислород.И чтобы рассказать свою историю, это Марк Пеплоу. Марк Пеплоу Мало ли эти скромные цианобактерии осознавали, что они делают, когда два с половиной миллиарда лет назад они начали накапливать свои собственные запасы богатых энергией химикатов, комбинируя воду и углекислый газ. С помощью солнечного света они потратили следующие два миллиарда лет на терраформирование всей нашей планеты с помощью отходов фотосинтеза, довольно токсичного газа, называемого кислородом. Кислород составляет около 23% массы атмосферы с парами атомов кислорода, слипшимися вместе, чтобы образовать молекулы дикислорода, но это не только воздух, которым мы дышим. В целом, это самый распространенный элемент на поверхности Земли и третий по распространенности во Вселенной после водорода и гелия. Камни нашей планеты на 46% состоят из кислорода по весу, большая часть которого находится в форме диоксида кремния, который мы чаще всего называем песком. И многие металлы, которые мы добываем из земной коры, также находятся в виде их оксидов, алюминия в боксите или железа в гематите, в то время как карбонаты, такие как известняк, также в значительной степени состоят из кислорода, а океаны, конечно, на 86% состоят из кислорода, связанного с водород как старый добрый H 2 O, едва ли не самый совершенный растворитель для биохимии, который вы только можете себе представить. Кислород также присутствует практически в каждой молекуле вашего тела, включая жиры, углеводы и ДНК. В частности, это атом, который связывает вместе фосфатные группы в молекуле, несущей энергию, АТФ. Кислород, очевидно, очень полезен для поддержания нашей жизнедеятельности, но также широко используется в промышленности в качестве окислителя, где он может отдавать часть солнечной энергии, захваченной растениями и цианобактериями. Поток кислорода может повысить температуру доменной печи более чем на 2000 градусов и позволяет кислородно-ацетиленовой горелке резать металл насквозь.Космический шаттл уносится в космос с невероятной силой, возникающей, когда жидкий кислород и жидкий водород объединяются в воду. Так кто первым заметил эту повсеместную фигню? Конечно, ведутся споры о том, кто первым определил кислород как элемент, отчасти потому, что в то время точное определение элемента еще не было точно определено. Английский химик Джозеф Пристли определенно выделил кислородный газ в 1770-х годах, хотя он пытался определить его как дефлогистированный воздух. Кислород — это не только молекулы двуокиси кислорода, которые нас поддерживают. Существует еще одна форма, триоксиген, также известный как озон, который также очень важен в верхних слоях атмосферы, отвечает за фильтрацию вредных ультрафиолетовых лучей, но, к сожалению, озон также довольно токсичен. Так что это плохая новость, что тонны газа производятся в результате реакций между углеводородами и оксидами азота, которые ежедневно выбрасываются автомобилями. Крис Смит Итак, почему жизнь — это газ? Марк Пеплоу раскрыл секреты элемента, без которого мы не можем жить.В следующий раз, когда мы поговорим о химии в ее стихии, Джонни Болл присоединится к нам, чтобы рассказать историю о химическом веществе, которое так необходимо спортсменам-олимпийцам, которое делает хорошие соединители Hi-Five, а также является фаворитом для пломбировок. И это в зубах, а не в пирогах. Johnny Ball Сегодня один грамм можно превратить в лист квадратного метра толщиной всего 230 атомов, из одного кубического сантиметра можно получить лист 18 квадратных метров, из 1 грамма можно получить 165 метров проволоки всего 1 / 200 мм толщиной миллиметра. Крис Смит Итак, все, что блестит, не золото, а немного золота, и вы можете узнать почему на следующей неделе в химии в ее стихии. Я Крис Смит, спасибо за внимание. Увидимся в следующий раз. (Промо) (Окончание промо) |
Почему некоторые элементы Периодической таблицы представлены буквами, которые не имеют четкой связи с их названиями?
Ответ
Некоторые элементы были известны в древности и поэтому имеют латинские названия.
Периодическая таблица. 2019. Фото Н. Ханачека. Национальный институт стандартов и технологий (NIST).
В периодической таблице одиннадцать элементов представлены буквами, не совпадающими с их названиями:
- Натрий (Na — Natrium)
- Калий (K — Kalium)
- Железо (Fe — Ferrum)
- Медь (Cu — Cuprum)
- Серебро (Ag — Argentum)
- Олово (Sn — Stannum)
- Сурьма (Sb — Stibium)
- Вольфрам (W — Wolfram)
- Золото (Au — Aurum)
- Ртуть (Hg — Hydragery )
- Свинец (Pb — Plumbum)
Почти все эти элементы были известны в древние времена и поэтому имеют латинские названия.Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что по-латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Другие имена имеют разное происхождение. Например, гидраргирум, латинское название ртути (Hg), произошло от оригинального греческого слова гидраргирос, что означало «водное серебро». Элементарная ртуть, также исторически известная как «ртуть», представляет собой блестящий серебряный металл, находящийся в жидком состоянии при комнатной температуре.
Элементарная ртуть, также исторически известная как «ртуть», представляет собой блестящий серебряный металл, находящийся в жидком состоянии при комнатной температуре.
Tungsten получил от немецкого названия Wolfram. Вольфрам происходит из вольфрамита, который был одной из руд, в которой чаще всего находили вольфрам. Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».
Слово «калий» происходит от английского «pot ash», которое использовалось для выделения солей калия. Мы получили K от названия калиум, данного немецким химиком Мартином Генрихом Клапротом, которое произошло от щелочи, происходящей от арабского al-qalyah, или «растительный пепел».
Этимология названий элементов может увести вас в фантастическое приключение, и вы можете быть удивлены тем, где вы оказались. В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
Опубликовано: 05.05.2020. Автор: Справочная секция по науке, Библиотека Конгресса
Химический символ — обзор
3.3.1 Хирургическая нержавеющая сталь
Слово железо, по-видимому, произошло от «кровь» до «кроваво-красный» и «красный металл», вероятно, из-за цвета его оксида. Химический символ железа — Fe (от латинского ferrum ), его стандартный атомный вес ( A r, стандартный ) 55.845 (2) и атомный номер 26. Кованое железо (<0,15 мас.% Углерода), чугун (железоуглеродистый сплав, содержащий 2,1–4 мас.% Углерода, иногда называемый чугунным чугуном) и чистое железо (содержащее максимум 0,006 мас.% углерода при комнатной температуре) имеют при комнатной температуре кристаллическую структуру ОЦК α-феррита железа и являются (ферро) магнитными. Критическая точка Кюри ( T c ), когда чистое железо теряет свои магнитные свойства, составляет 770 ° C. В магнитном железе электронные спины всех доменов вещества выровнены, усиливая друг друга, тогда как при более высоких температурах электронные спины одинаковы только в отдельных, но случайно ориентированных доменах, так что разные домены нейтрализуют магнитные эффекты друг друга.Вышеупомянутые сплавы железа обладают худшими механическими и коррозионными свойствами по сравнению с более современными. Чистое железо слишком мягкое (Mohs 4.0, HV 608 МПа), а чугун (HV около 1500–8500 МПа) слишком хрупкое для большинства механических применений. Обычная углеродистая сталь (от греч. stēlē, — столб) представляет собой сплав железа и углерода, содержащий максимум 1,7 мас.% Углерода, в основном в промежуточных местах. Эта промежуточная (между кованым железом с низким содержанием углерода и чугуном с высоким содержанием углерода) концентрация углерода увеличивает прочность без ущерба для пластичности или способности к закалке.
Критическая точка Кюри ( T c ), когда чистое железо теряет свои магнитные свойства, составляет 770 ° C. В магнитном железе электронные спины всех доменов вещества выровнены, усиливая друг друга, тогда как при более высоких температурах электронные спины одинаковы только в отдельных, но случайно ориентированных доменах, так что разные домены нейтрализуют магнитные эффекты друг друга.Вышеупомянутые сплавы железа обладают худшими механическими и коррозионными свойствами по сравнению с более современными. Чистое железо слишком мягкое (Mohs 4.0, HV 608 МПа), а чугун (HV около 1500–8500 МПа) слишком хрупкое для большинства механических применений. Обычная углеродистая сталь (от греч. stēlē, — столб) представляет собой сплав железа и углерода, содержащий максимум 1,7 мас.% Углерода, в основном в промежуточных местах. Эта промежуточная (между кованым железом с низким содержанием углерода и чугуном с высоким содержанием углерода) концентрация углерода увеличивает прочность без ущерба для пластичности или способности к закалке.
Углеродистая сталь может быть переработана в нержавеющую сталь для уменьшения коррозии. Нержавеющая сталь представляет собой сплав углеродистой стали и хрома и обычно никеля в качестве основных легирующих элементов; нержавеющая сталь обычно содержит ≥ 10,5 мас.% хрома, 8–10 мас.% Ni и не менее 50 мас.% железа. В результате добавления хрома на поверхности стали образуется тонкий и чрезвычайно прочный пассивирующий слой, который защищает нержавеющую сталь от коррозии, то есть ржавчины. Пассивный слой имеет толщину 3–5 нм и в основном состоит из гидратированного оксида хрома (III) (Cr 2 O 3 ), который имеет низкую ионную проводимость.Этот тонкий слой содержит больше хрома по сравнению с составом основного сплава.
Пассивный слой также содержит α-Fe 2 O 3 оксид железа в самой внешней части. Коррозионные свойства могут быть дополнительно улучшены добавлением молибдена. Добавление 2–6 мас.% Мо эффективно увеличивает стойкость к питтинговой коррозии в растворах, содержащих NaCl. Коррозия и биологические жидкости организма влияют на состав пассивирующего слоя. Защитный эффект пассивирующего слоя снижается из-за неоднородностей микроструктуры, например, на месте карбидов хрома и включений неметаллического сульфида марганца (MnS).Дефекты пассивирующего слоя могут привести к локальной коррозии. Никель в нержавеющей стали стабилизирует микроструктуру ГЦК аустенитной стали с γ-железом (стали с Fe-Cr являются ферритными или α-железными сталями с ОЦК микроструктурой).
Коррозия и биологические жидкости организма влияют на состав пассивирующего слоя. Защитный эффект пассивирующего слоя снижается из-за неоднородностей микроструктуры, например, на месте карбидов хрома и включений неметаллического сульфида марганца (MnS).Дефекты пассивирующего слоя могут привести к локальной коррозии. Никель в нержавеющей стали стабилизирует микроструктуру ГЦК аустенитной стали с γ-железом (стали с Fe-Cr являются ферритными или α-железными сталями с ОЦК микроструктурой).
Аустенитная сталь немагнитна, что исключает перемещение, например, сосудистых стентов и нагрев во время МРТ, хотя артефакты, вызванные металлом, остаются. Помимо легирования, свойства сталей могут быть изменены с помощью различных видов термообработки, приводящих к изменениям микроструктуры.Твердая мартенситная сталь, например, фортепианная проволока, образуется путем быстрого охлаждения (закалки) аустенитной стали, поэтому она имеет тот же химический состав, но объемно-центрированную тетрагональную кристаллическую структуру вместо ГЦК, как у аустенитных сталей.
Из-за множества фазовых структур, микроструктур, термических обработок, легирующих элементов и т. Д. Существуют тысячи различных марок стали. Коммерчески доступно не менее 50 различных типов стали, и примерно 20 из них используются в качестве биоматериалов.Однако только некоторые марки, например, аустенитная нержавеющая сталь Американского института железа и стали (AISI) (AISI 316, 0,08 мас.% Углерода) и ее низкоуглеродистая производная AISI 316L (<0,03 мас.% Углерода), широко используются в качестве биоматериалов. . Используемая в медицине железо и низкоуглеродистая, хромосодержащая (17–20 мас.%) Нержавеющая сталь обычно также содержит 2–4 мас.% Молибдена и 12–14 мас.% Никеля и, кроме того, небольшие количества других элементов. Коррозия была уменьшена, чтобы свести к минимуму высвобождение этих компонентов, поскольку они могут вызывать токсические, аллергические и различные другие симптомы.Например, никель может вызывать токсические и аллергические реакции. Выделение железа из нержавеющей стали может способствовать бактериальным инфекциям, выступая в качестве источника железа для бактерий (Carver, 2018). Железо является реакционноспособным переходным металлом, который может приводить к образованию гидроксильных радикалов в реакции Габера-Вейсса. Остатки износа, в частности образование металлических наночастиц, увеличивают эффективную поверхность биоматериала, что увеличивает коррозию. Это может увеличить содержание железа в организме при использовании имплантатов из нержавеющей стали.Обычно в организме содержится примерно 3–4 г железа. Клинический опыт и накопленные знания показывают, что человеческий организм относительно хорошо переносит вымывание из хирургических стальных имплантатов. При использовании в качестве временных имплантатов эти имплантаты удаляются после заживления кости, чтобы избежать защиты от напряжения. Типичные области применения — пластины, костномозговые гвозди, винты, штифты, швы, стальные нити и сети, используемые для фиксации переломов. Использование нержавеющей стали для замены швов уменьшилось, когда начали применяться новые материалы на основе кобальта и титана.
Железо является реакционноспособным переходным металлом, который может приводить к образованию гидроксильных радикалов в реакции Габера-Вейсса. Остатки износа, в частности образование металлических наночастиц, увеличивают эффективную поверхность биоматериала, что увеличивает коррозию. Это может увеличить содержание железа в организме при использовании имплантатов из нержавеющей стали.Обычно в организме содержится примерно 3–4 г железа. Клинический опыт и накопленные знания показывают, что человеческий организм относительно хорошо переносит вымывание из хирургических стальных имплантатов. При использовании в качестве временных имплантатов эти имплантаты удаляются после заживления кости, чтобы избежать защиты от напряжения. Типичные области применения — пластины, костномозговые гвозди, винты, штифты, швы, стальные нити и сети, используемые для фиксации переломов. Использование нержавеющей стали для замены швов уменьшилось, когда начали применяться новые материалы на основе кобальта и титана.
Метод производства и микроструктура металла влияют на его механические свойства. Обычная сталь AISI 316L имеет относительно хороший предел текучести при трении, примерно 200–250 МПа. Если требуется более высокий предел текучести, применяется холодная обработка (ковка). Производственные дефекты и неправильная конструкция увеличивают риск усталостного разрушения. Под усталостью понимается выход из строя имплантата при повторяющихся циклических нагрузках ниже предельного уровня. Металлические имплантаты обычно ломаются из-за усталости, а не из-за механической перегрузки.Для совместной замены крупных несущих узлов сопротивление усталости за 10 7 циклов испытаний должно быть не менее 400 МПа. Хирургическая нержавеющая сталь имеет относительно хорошее сопротивление усталости, примерно 350–400 МПа. Ходьба подвергает бедренный имплантат примерно 10 6 циклам ходьбы в год. Металлический стержень всего бедра легко выдержал бы такую нагрузку. На самом деле тотальные суставы не подвергаются такой большой нагрузке. 400 МПа соответствует 4000 кг / см 2 .Таким образом, на практике металлические хирургические стержни из нержавеющей стали должны служить неограниченно долго. Однако неправильная конструкция, дефекты материала, износ и коррозия могут снизить сопротивление усталости.
400 МПа соответствует 4000 кг / см 2 .Таким образом, на практике металлические хирургические стержни из нержавеющей стали должны служить неограниченно долго. Однако неправильная конструкция, дефекты материала, износ и коррозия могут снизить сопротивление усталости.
Нержавеющая сталь AISI 316L имеет относительно хорошую коррозионную стойкость, но по сравнению со сплавами на основе кобальта и титана чувствительна к щелевой и ямочной коррозии. Поэтому стальные имплантаты должны иметь гладкую или даже полированную поверхность, особенно опасные пористые поверхности. Большая площадь поверхности, то есть пористая поверхность или мусор, увеличивает коррозию и выщелачивание металлических составляющих сплава.
Сталь AISI 316L относительно тяжелая, ее плотность составляет примерно 8,4 г / см. 3 . Коэффициент трения нержавеющей стали по полиэтилену составляет приблизительно 0,10, но в условиях in vivo только 0,02. В соединении с естественной смешанной смазкой коэффициент трения оценивается примерно в 0,001–0,025 (0,001–0,01 для пленочной смазки под давлением и примерно 0,1 для смазки в точке контакта). Высокий коэффициент трения увеличивает образование мусора.В скользящей паре, состоящей из металла и полиэтилена сверхвысокой молекулярной массы (UHMWPE), полимер, естественно, легче изнашивается, чем твердый металл. Сэр Джон Чарнли начал использовать стержни из нержавеющей стали, закрепленные поли (метилметакрилатом) (ПММА), и чашки из полиэтилена. Эта конфигурация до сих пор используется как золотой стандарт при полной замене суставов. Сплавы на основе титана и кобальта обладают лучшей коррозионной стойкостью. Поэтому сплавы на основе титана и кобальта для стержневых имплантатов в значительной степени заменили стержни из AISI 316L.
Высокий коэффициент трения увеличивает образование мусора.В скользящей паре, состоящей из металла и полиэтилена сверхвысокой молекулярной массы (UHMWPE), полимер, естественно, легче изнашивается, чем твердый металл. Сэр Джон Чарнли начал использовать стержни из нержавеющей стали, закрепленные поли (метилметакрилатом) (ПММА), и чашки из полиэтилена. Эта конфигурация до сих пор используется как золотой стандарт при полной замене суставов. Сплавы на основе титана и кобальта обладают лучшей коррозионной стойкостью. Поэтому сплавы на основе титана и кобальта для стержневых имплантатов в значительной степени заменили стержни из AISI 316L.
Нержавеющая сталь примерно в 10 раз жестче кортикальной кости, с модулем упругости примерно 200 ГПа. Когда используется такой жесткий материал, нагрузка, воспринимаемая имплантатом и костью, больше не подвергается нормальной нагрузке. Использование костного цемента в качестве интерфейса снижает этот эффект защиты от напряжений, поскольку модуль упругости костного цемента намного ниже, чем у нержавеющей стали, и цементная мантия образует границу раздела. Поэтому имплантаты из нержавеющей стали всегда используются с цементной фиксацией.
Поэтому имплантаты из нержавеющей стали всегда используются с цементной фиксацией.
Половина мировых запасов элемента 99 используется для раскрытия его химических секретов | Research
Используя менее 200 нанограммов эйнштейния — половины мировых запасов в то время — ученые впервые обнаружили связь и спектроскопические свойства синтетического элемента.
Эйнштейний, обнаруженный среди обломков после взрыва первой водородной бомбы в 1952 году, является высокорадиоактивным актинидом. Поскольку он не встречается на Земле в природе, мало что известно о его химии, кроме того факта, что он образует несколько галогенидных и оксидных солей.Чтобы сделать из него не только следовые количества, необходимо бомбардировать более легкие элементы нейтронами в течение продолжительного периода времени — процесс, который может быть осуществлен только в одном месте в мире, в реакторе с высоким потоком изотопов в Национальной лаборатории Ок-Ридж в Теннесси, США.
Последние усилия лаборатории произвели всего 400 нг элемента 99, половина из которых досталась группе под руководством Ребекки Абергель из Калифорнийского университета в Беркли, Корвина Бута из Национальной лаборатории Лоуренса Беркли и Стоша Козимора из Национальной лаборатории Лос-Аламоса. Несмотря на то, что они работали с менее чем 200 нг элемента, исследователям удалось провести измерения поглощения эйнштейния рентгеновскими лучами, впервые выявив его координационную химию и спектроскопические свойства.
Несмотря на то, что они работали с менее чем 200 нг элемента, исследователям удалось провести измерения поглощения эйнштейния рентгеновскими лучами, впервые выявив его координационную химию и спектроскопические свойства.
В некотором смысле эйнштейний ведет себя аналогично своим более легким соседям по периодической таблице, принимая степень окисления +3 в комплексе с октадентатным гидроксипиридиноновым лигандом. Однако короткая длина связи эйнштейний-кислород в этом соединении стала неожиданностью. Измерения люминесцентной спектроскопии дали еще один неожиданный результат.«То, как [эйнштейний] изменяется при комплексообразовании, имеет противоположное направление с точки зрения сдвига длины волны и энергии, чем то, что происходит с другими актинидами», — объясняет Абергель. В настоящее время команда работает над подтверждением того, почему поведение эйнштейния так отличается от поведения других актинидов.
Обычные правила больше не применяются
«Это говорит о том, что мы не очень хорошо понимаем, какое влияние оказывают релятивистские эффекты на химию этих элементов», — комментирует Дженифер Шафер, эксперт по химии тяжелых актинидов из Колорадской горной школы. НАС.«Обычные правила квантовой механики и электронного упорядочения — такие вещи, как правило Хунда — кажется, растворяются, когда вы попадаете в эту часть периодической таблицы».
НАС.«Обычные правила квантовой механики и электронного упорядочения — такие вещи, как правило Хунда — кажется, растворяются, когда вы попадаете в эту часть периодической таблицы».
Одна из самых захватывающих вещей в химии актинидов заключается в том, что это элементы, которые мы получаем для написания учебника для
.Стош Козимор, Национальная лаборатория Лос-Аламоса
Шафер впечатлен способностью команды Беркли проводить эксперименты.«Я немного работаю с эйнштейнием, но не могу себе представить, как сложно скоординировать получение нескольких сотен нанограммов и получение с их помощью важных химических данных», — говорит она.
«На самом деле вы не можете увидеть [материал, когда он поступает]», — вспоминает исследователь из Калифорнийского университета в Беркли Кэтрин Шилд, которая много занималась лабораторной химией. Он поставляется в маленьком флаконе, но единственный способ узнать, что вы действительно работаете с ним, — это использовать детекторы излучения. со временем они теряли материал.«Вы очень, очень надеетесь, что случайно не уроните одну каплю, пока проводите химию», — говорит Шилд.
со временем они теряли материал.«Вы очень, очень надеетесь, что случайно не уроните одну каплю, пока проводите химию», — говорит Шилд.
Еще до того, как получить эйнштейний, команда тщательно разработала эксперименты, которые они хотели провести, и в каком порядке, чтобы минимизировать материальные потери. «Мы много спланировали заранее, и ничего не шло по этому плану», — смеется Абергель. Обнаружив, что их образец содержит большое количество калифорния, им пришлось отказаться от запланированных экспериментов по дифракции рентгеновских лучей и обратиться к спектроскопии поглощения рентгеновских лучей, которая позволила им игнорировать загрязнение.
После приготовления комплекса эйнштейний в Беркли член группы Кори Картер отвез драгоценный — и опасный — образец в течение часа к Стэнфордскому источнику синхротронного излучения. Оказавшись там, обрабатывать половину мировых запасов эйнштейния было «совершенно ужасно», — вспоминает Козимор. «Это требует хорошо отрепетированной команды и крепких нервов».
«Для меня большая честь заниматься такой наукой», — говорит Абергель. Понимание химического поведения эйнштейния может помочь ученым производить и очищать его с целью создания еще более тяжелых элементов.«Эйнштейниевые мишени сделают более правдоподобным идентификацию острова стабильности, что является огромной проблемой для физиков-ядерщиков», — объясняет Шилд. Остров стабильности — это предсказанный набор сверхтяжелых изотопов, период полураспада которых может быть значительно больше, чем у их ближайших соседей.
На данный момент команда продолжит работу с оставшимся образцом эйнштейния, проводя эксперименты по электронной микроскопии, радиоанализу и разделению. «Одна из самых захватывающих вещей в химии актинидов — это то, что это элементы, для которых мы можем написать учебник.Это действительно исследовательский процесс », — говорит Козимор.
Основы зеленой химии | Агентство по охране окружающей среды США
На этой странице:
Определение зеленой химии
Зеленая химия — это разработка химических продуктов и процессов, которые сокращают или исключают использование или образование опасных веществ. Зеленая химия применяется на протяжении всего жизненного цикла химического продукта, включая его проектирование, производство, использование и окончательную утилизацию. Зеленая химия также известна как устойчивая химия.
Зеленая химия применяется на протяжении всего жизненного цикла химического продукта, включая его проектирование, производство, использование и окончательную утилизацию. Зеленая химия также известна как устойчивая химия.
Зеленая химия:
- Предотвращает загрязнение на молекулярном уровне
- Это философия, которая применима ко всем областям химии, а не к какой-либо одной химической дисциплине
- Применяет инновационные научные решения к реальным экологическим проблемам
- Приводит к сокращению количества источников, поскольку предотвращает загрязнение
- Снижает негативное воздействие химических продуктов и процессов на здоровье человека и окружающую среду
- Уменьшает, а иногда и устраняет опасность от существующих продуктов и процессов
- Разрабатывает химические продукты и процессы для снижения внутренней опасности
Чем экологичная химия отличается от очистки загрязнения
Зеленая химия снижает загрязнение в его источнике за счет минимизации или устранения опасностей, связанных с химическим сырьем, реагентами, растворителями и продуктами.
Это не похоже на очистку от загрязнения (также называемую восстановлением), которая включает в себя очистку потоков отходов (обработка на конце трубы) или очистку от разливов в окружающей среде и других выбросов. Восстановление может включать отделение опасных химикатов от других материалов, затем их обработку, чтобы они больше не представляли опасности, или их концентрацию для безопасной утилизации. Большинство мероприятий по восстановлению не связаны с зеленой химией. Рекультивация удаляет опасные материалы из окружающей среды; с другой стороны, зеленая химия в первую очередь предотвращает попадание опасных материалов в окружающую среду.
Если технология уменьшает или устраняет опасные химические вещества, используемые для очистки загрязнителей окружающей среды, эта технология будет квалифицироваться как технология зеленой химии. Одним из примеров является замена опасного сорбента [химического вещества], используемого для улавливания ртути из воздуха для безопасного удаления, на эффективный, но неопасный сорбент. Использование неопасного сорбента означает, что опасный сорбент никогда не производится, и поэтому технология восстановления соответствует определению зеленой химии.
Использование неопасного сорбента означает, что опасный сорбент никогда не производится, и поэтому технология восстановления соответствует определению зеленой химии.
12 принципов зеленой химии
Эти принципы демонстрируют широту концепции зеленой химии:
1.Предотвращение образования отходов : Разработайте химический синтез для предотвращения образования отходов. Не оставляйте отходы для обработки или очистки.
2. Максимизируйте атомную экономию : Спроектируйте синтезы так, чтобы конечный продукт содержал максимальную долю исходных материалов. Выбросьте мало атомов или совсем не тратите впустую.
3. Разработать менее опасные химические синтезы : Спроектировать синтез для использования и получения веществ с небольшой или нулевой токсичностью для человека или окружающей среды.
4. Создавайте более безопасные химические вещества и продукты : Создавайте химические продукты, которые будут полностью эффективными, но при этом имеют небольшую токсичность или совсем не токсичны.
5. Используйте более безопасные растворители и условия реакции. : Избегайте использования растворителей, разделительных агентов или других вспомогательных химикатов. Если вам необходимо использовать эти химические вещества, используйте более безопасные.
6. Повышение энергоэффективности : По возможности проводите химические реакции при комнатной температуре и давлении.
7. Используйте возобновляемое сырье : используйте возобновляемые, а не истощаемые исходные материалы (также известные как сырье). Источником возобновляемого сырья часто являются сельскохозяйственные продукты или отходы других процессов; Источником истощаемого сырья часто является ископаемое топливо (нефть, природный газ или уголь) или добыча полезных ископаемых.
8. Избегайте химических производных : Избегайте использования блокирующих или защитных групп или любых временных модификаций, если это возможно. Производные используют дополнительные реагенты и образуют отходы.
9. Используйте катализаторы, а не стехиометрические реагенты. : Минимизируйте количество отходов, используя каталитические реакции. Катализаторы эффективны в небольших количествах и могут проводить одну реакцию много раз. Они предпочтительнее стехиометрических реагентов, которые используются в избытке и проводят реакцию только один раз.
10. Создавайте химические продукты и продукты для разложения после использования : Создавайте химические продукты так, чтобы они после использования разлагались на безвредные вещества, чтобы они не накапливались в окружающей среде.
11. Анализируйте в реальном времени для предотвращения загрязнения : Включите внутрипроцессный мониторинг и контроль в реальном времени во время синтеза, чтобы минимизировать или исключить образование побочных продуктов.
12. Сведите к минимуму вероятность аварий : Разработайте химические вещества и их физические формы (твердые, жидкие или газообразные), чтобы минимизировать вероятность химических аварий, включая взрывы, пожары и выбросы в окружающую среду.
Загрузите одностороннюю или двустороннюю закладку, показывающую двенадцать принципов зеленой химии.
«Зеленая химия» уходит корнями в Закон о предотвращении загрязнения от 1990 г.
Прекращение создания загрязнения стало в 1990 г. официальной политикой Америки в связи с Федеральным законом о предотвращении загрязнения.
Закон определяет сокращение источника как любую практику, которая:
- Уменьшает количество любого опасного вещества, загрязняющего вещества или загрязняющего вещества, попадающего в любой поток отходов или иным образом выбрасываемого в окружающую среду (включая неконтролируемые выбросы) перед переработкой, обработкой, или утилизация.
- Снижает опасность для здоровья населения и окружающей среды, связанную с выбросом таких веществ, загрязнителей или загрязняющих веществ.
Термин «сокращение источника» включает:
- Модификации оборудования или технологии
- Изменения в процессе или процедурах
- Модификации, переформулировка или переработка продукции
- Замена сырья
- Улучшения в ведении домашнего хозяйства, технического обслуживания, обучения или управления запасами
Раздел 2 Закона о предотвращении загрязнения устанавливает иерархию предотвращения загрязнения, в которой говорится:
- Конгресс настоящим заявляет, что национальной политикой Соединенных Штатов является предотвращение или уменьшение загрязнения у источника, когда это возможно;
- Загрязнение, которое невозможно предотвратить, по возможности следует утилизировать экологически безопасным способом;
- Загрязнение, которое невозможно предотвратить или переработать, следует обрабатывать экологически безопасным способом, когда это возможно;
- Удаление или другие выбросы в окружающую среду должны использоваться только в крайнем случае и должны осуществляться экологически безопасным способом.

Зеленая химия направлена на разработку и производство конкурентоспособных по стоимости химических продуктов и процессов, которые достигают наивысшего уровня иерархии предотвращения загрязнения за счет сокращения загрязнения в его источнике.
Для тех, кто создает и использует зеленую химию, иерархия выглядит следующим образом:
- Сокращение источников и предотвращение химических опасностей
- Разработка химических продуктов, снижающих опасность для здоровья человека и окружающей среды *
- Изготовление химических продуктов из сырья, реагентов и растворителей, которые менее опасны для здоровья человека и окружающей среды *
- Разработка синтезов и других процессов с уменьшением или даже без химических отходов
- Разработка синтеза и других процессов, использующих меньше энергии или воды
- Использование сырья, полученного из ежегодно возобновляемых ресурсов или из обильных отходов
- Разработка химической продукции для повторного использования или переработки
- Повторное использование или переработка химикатов
- Обработка химикатов для снижения их опасности перед утилизацией
- Утилизация необработанных химикатов безопасно и только в том случае, если другие варианты невозможны
* Менее опасные для здоровья человека и окружающей среды химические вещества:
- Менее токсичны для организмов
- Менее разрушительный для экосистем
- Не является стойким или биоаккумулирующимся в организмах или окружающей среде
- По своей природе более безопасны в обращении и использовании, поскольку они не горючие или взрывоопасные
Различные виды химии — химия и биохимия
По сути, химия — это изучение материи и изменений.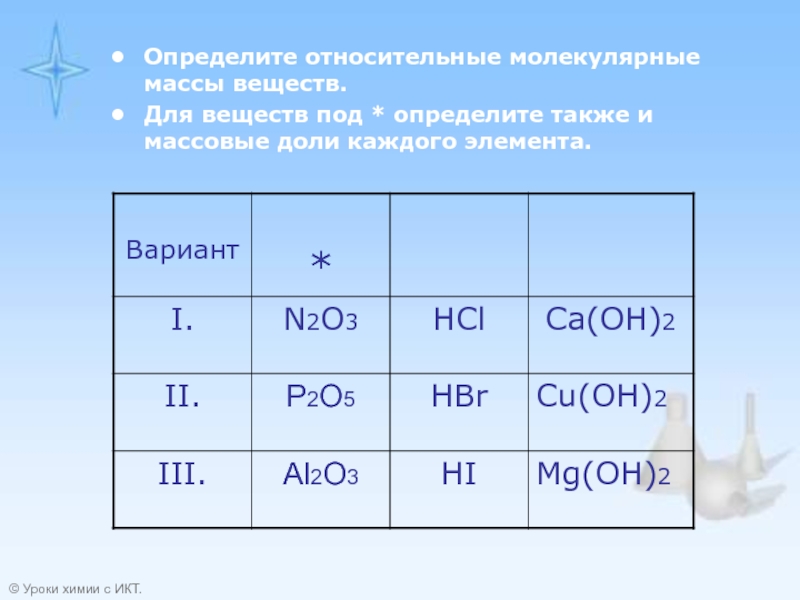 Способы, которыми химики изучают материю и изменения, и типы изучаемых систем сильно различаются. Традиционно химия подразделяется на пять основных дисциплин: органическая, аналитическая, физическая, неорганическая, и , биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, биоорганическую химию, химию окружающей среды и т. Д. Все эти области химии в некоторой степени рассматриваются в наших классах здесь, в UWL, а также в рамках исследовательских интересов нашего факультета на химическом факультете.Следующие ниже описания пяти основных субдисциплин были написаны несколькими преподавателями из их области знаний. Все наши преподаватели будут рады подробно рассказать и / или обсудить другие аспекты химии, которые не описаны ниже! Аккредитованные программы по химии и биохимии UW-La Crosse сочетают в себе практический опыт научных исследований и развитие практических навыков.
Способы, которыми химики изучают материю и изменения, и типы изучаемых систем сильно различаются. Традиционно химия подразделяется на пять основных дисциплин: органическая, аналитическая, физическая, неорганическая, и , биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, биоорганическую химию, химию окружающей среды и т. Д. Все эти области химии в некоторой степени рассматриваются в наших классах здесь, в UWL, а также в рамках исследовательских интересов нашего факультета на химическом факультете.Следующие ниже описания пяти основных субдисциплин были написаны несколькими преподавателями из их области знаний. Все наши преподаватели будут рады подробно рассказать и / или обсудить другие аспекты химии, которые не описаны ниже! Аккредитованные программы по химии и биохимии UW-La Crosse сочетают в себе практический опыт научных исследований и развитие практических навыков.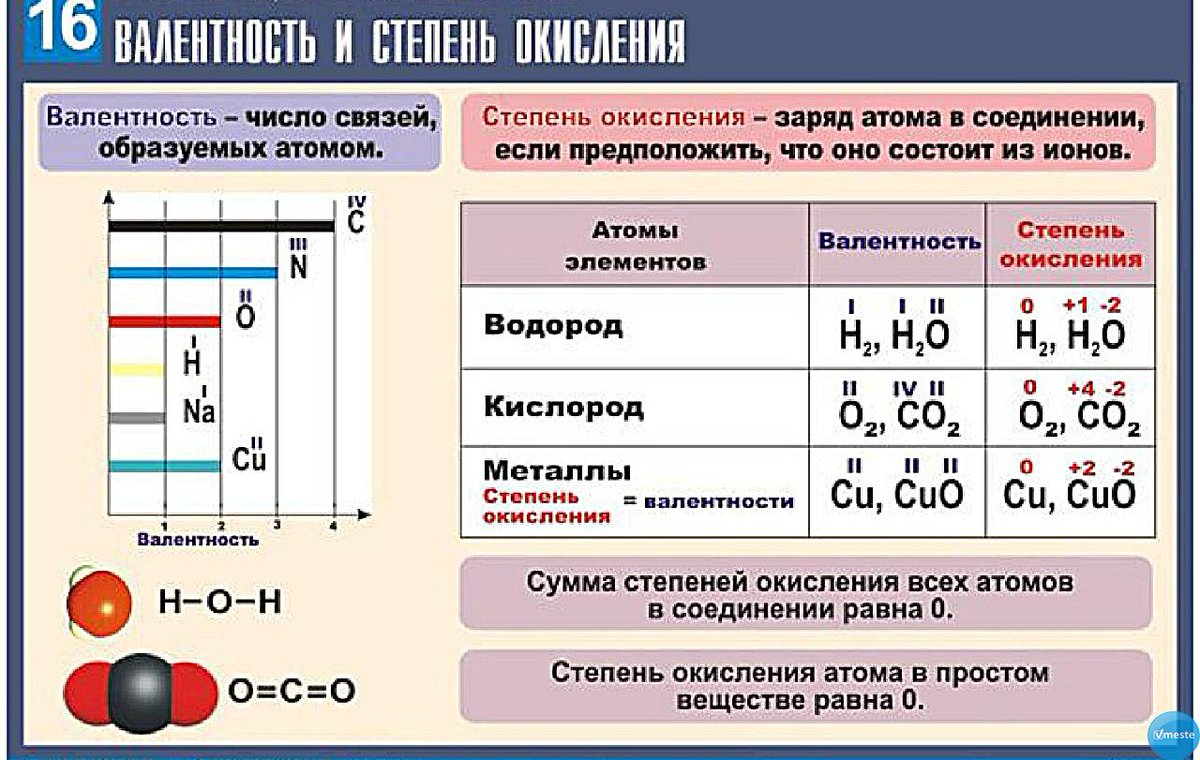
Органическая Органическая химия — это раздел химии, который включает изучение молекул жизни.В основном это касается изучения структуры и поведения этих молекул, которые состоят только из нескольких различных типов атомов: углерода, водорода, кислорода, азота и некоторых других. Эти атомы используются для создания молекул, которые необходимы всем растениям и животным для их выживания. Традиционные химики-органики озабочены синтезом новых молекул и разработкой новых реакций, которые могут сделать эти синтезы более эффективными. Типы молекул, которые синтезируют химики-органики, включают полезные вещества, такие как лекарства, ароматизаторы, консерванты, ароматизаторы, пластмассы (полимеры) и сельскохозяйственные химикаты (удобрения и пестициды), и иногда включают необычные молекулы, встречающиеся в природе, или молекулы, которые могут просто создать проблему для сделать.Кроме того, понимание органической химии необходимо для изучения биохимии и молекулярной биологии, потому что биомолекулы, такие как белки, сахара, жиры и нуклеиновые кислоты (ДНК и РНК), являются органическими молекулами, хотя и очень большими. Студенты, специализирующиеся на органической химии, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, делают карьеру в медицине или могут искать другие связанные вакансии.
Студенты, специализирующиеся на органической химии, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, делают карьеру в медицине или могут искать другие связанные вакансии.
К началу
Аналитическая Аналитическая химия — это наука об идентификации и количественном определении материалов в смеси.Химики-аналитики могут изобретать процедуры анализа, а также использовать или изменять существующие. Они также контролируют, проводят и интерпретируют анализ. Студенты, специализирующиеся на аналитической химии, часто продолжают работать в лабораториях судебной экспертизы, экологических или фармацевтических компаниях, работают, управляют и / или разрабатывают процедуры обеспечения качества, проводят исследования или преподают в колледжах и университетах.
К началу
Физика Физическая химия — это изучение фундаментальных физических принципов, которые определяют поведение атомов, молекул и других химических систем. Физические химики изучают широкий круг вопросов, таких как скорости реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, которые концентрируются на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании.Многие современные исследования физической химии в промышленности и академических кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие происходят столкновения и перегруппировки связей, насколько они быстры, сколько этапов и т. Д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в те формы, которые у них есть, как структура связана с функцией, что заставляет нерв работать и т.
Физические химики изучают широкий круг вопросов, таких как скорости реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, которые концентрируются на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании.Многие современные исследования физической химии в промышленности и академических кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие происходят столкновения и перегруппировки связей, насколько они быстры, сколько этапов и т. Д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в те формы, которые у них есть, как структура связана с функцией, что заставляет нерв работать и т. Д.) — это биофизическая химия. Третьи могут использовать физические методы для характеристики полимеров или изучения систем окружающей среды.
Д.) — это биофизическая химия. Третьи могут использовать физические методы для характеристики полимеров или изучения систем окружающей среды.
К началу
Неорганическая Неорганическая химия обычно считается областью химии, не имеющей отношения к углероду. Однако углерод играет очень важную роль во многих неорганических соединениях, и существует целая область исследований, известная как металлоорганическая химия, которая представляет собой действительно гибрид традиционных дисциплин органической и неорганической химии.Некоторые области неорганической химии, которые особенно важны, — это катализ, химия материалов и биоинорганическая химия. Катализаторы — это химические соединения, которые увеличивают скорость реакции, но не расходуются, и обычно основаны на переходных металлах (обычно) металлоорганических комплексах переходных металлов). Это чрезвычайно важная область для промышленности, и многие из химиков, которые будут идентифицированы поскольку в этой области работают химики-неорганики или химики-металлоорганики.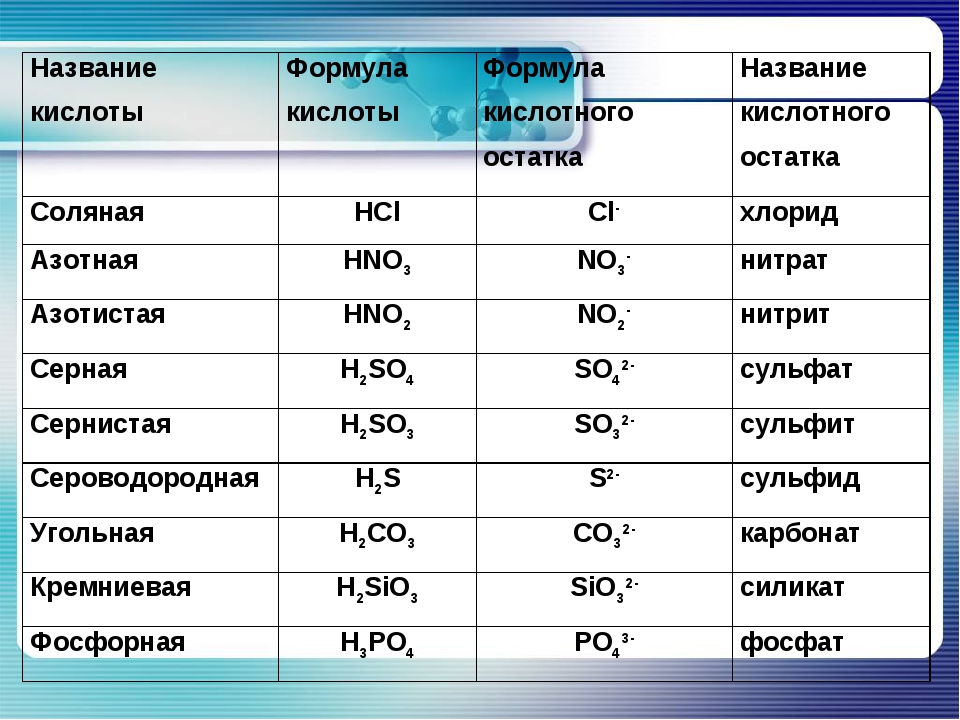 Химия материалов — это область, связанная с разработкой и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества.Часто химики-неорганики, работающие в этой области, занимаются синтезом и характеристикой соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Химики-биоинорганики изучают функцию металлсодержащих соединений в живых организмах. Студенты, специализирующиеся на неорганической химии, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие связанные с этим рабочие места.
Химия материалов — это область, связанная с разработкой и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества.Часто химики-неорганики, работающие в этой области, занимаются синтезом и характеристикой соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Химики-биоинорганики изучают функцию металлсодержащих соединений в живых организмах. Студенты, специализирующиеся на неорганической химии, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие связанные с этим рабочие места.
К началу
Биохимия Биохимия — это исследование химических принципов, лежащих в основе основных биологических систем.По сути, биохимические исследования направлены на определение связи между структурой и функцией биологических макромолекул. В частности, биохимические исследования обеспечили более полное понимание регенеративной медицины, инфекционных заболеваний, трансплантации органов / тканей, клинической диагностики и генетических заболеваний. Студенты, специализирующиеся на биохимии, продолжают делать чрезвычайно успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или правительственные исследовательские учреждения.Некоторые студенты также объединяют свои знания в области биохимии в рамках степени магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше сопоставить затраты и размер прибыли при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» щелкните здесь.
Студенты, специализирующиеся на биохимии, продолжают делать чрезвычайно успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или правительственные исследовательские учреждения.Некоторые студенты также объединяют свои знания в области биохимии в рамках степени магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше сопоставить затраты и размер прибыли при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» щелкните здесь.
К началу
Графические обозначения:
Органическая химия : Восстановление камфоры боргидридом натрия.
Аналитическая химия : Масс-спектр диэтиламина.
Физическая химия : Иллюстрация момента инерции молекулы, такой как этан.


 spbu.ru
spbu.ru spbu.ru
spbu.ru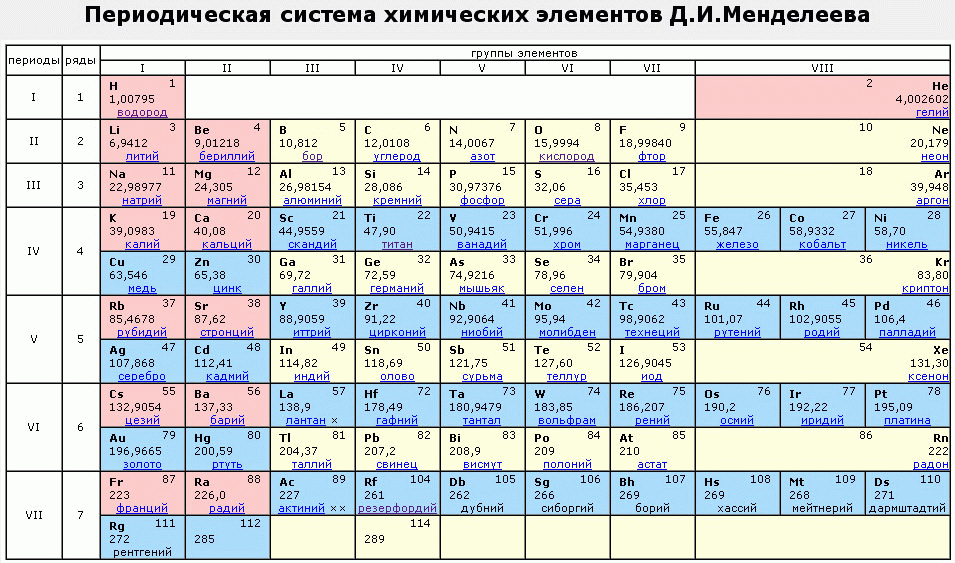


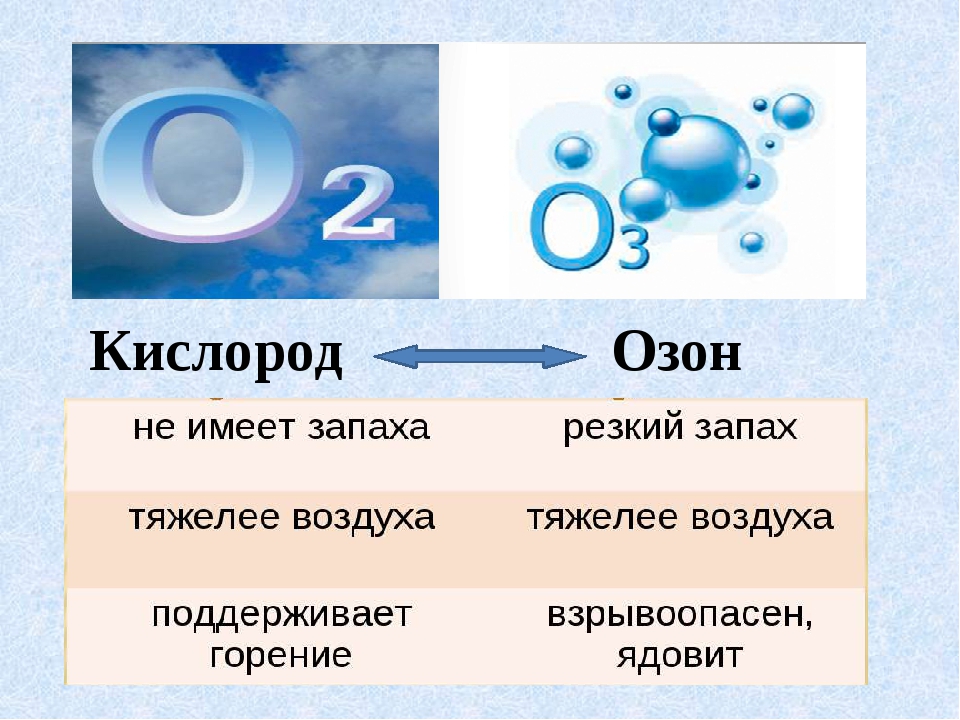
 Фактически, эти трудолюбивые жуки в конечном итоге ответственны за разнообразие жизни, которое мы видим сегодня вокруг нас.
Фактически, эти трудолюбивые жуки в конечном итоге ответственны за разнообразие жизни, которое мы видим сегодня вокруг нас.
 В то время считалось, что флогистон — это какое-то исконное вещество, которое было первопричиной возгорания. Шведский химик Карл Вильгельм Шееле тоже был поклонником флогистона и, вероятно, открыл кислород раньше, чем это сделал Пристли. Но именно Антуан Лавуазье, которого иногда называют отцом современной химии, был первым, кто действительно идентифицировал кислород как элемент, и тем самым он действительно помог укрепить определение, что элемент — это то, что не может быть разрушено никаким вид химического анализа.Это также помогло ему опровергнуть теорию флогистона, которая была решающим шагом в эволюции химии.
В то время считалось, что флогистон — это какое-то исконное вещество, которое было первопричиной возгорания. Шведский химик Карл Вильгельм Шееле тоже был поклонником флогистона и, вероятно, открыл кислород раньше, чем это сделал Пристли. Но именно Антуан Лавуазье, которого иногда называют отцом современной химии, был первым, кто действительно идентифицировал кислород как элемент, и тем самым он действительно помог укрепить определение, что элемент — это то, что не может быть разрушено никаким вид химического анализа.Это также помогло ему опровергнуть теорию флогистона, которая была решающим шагом в эволюции химии. Если бы только мы могли пересадить этот материал прямо в стратосферу! Озон обычно так тонко распространяется в воздухе, что вы не можете увидеть его бледно-голубой цвет, а газообразный кислород бесцветен, если вы не сжижаете его, но есть одно место, где вы можете увидеть газ во всей его красе. Полярное сияние, или полярное сияние, когда частицы солнечного ветра врезаются в молекулы кислорода в верхних слоях атмосферы, создавая кружащиеся зеленые и красные цвета, которые очаровывали людей на протяжении тысячелетий.
Если бы только мы могли пересадить этот материал прямо в стратосферу! Озон обычно так тонко распространяется в воздухе, что вы не можете увидеть его бледно-голубой цвет, а газообразный кислород бесцветен, если вы не сжижаете его, но есть одно место, где вы можете увидеть газ во всей его красе. Полярное сияние, или полярное сияние, когда частицы солнечного ветра врезаются в молекулы кислорода в верхних слоях атмосферы, создавая кружащиеся зеленые и красные цвета, которые очаровывали людей на протяжении тысячелетий. Золотой цвет забора Букингемского дворца на самом деле золотой; золото покрыто, потому что оно длится 30 лет; в то время как золотая краска, которая на самом деле вообще не содержит золота, сохраняется в идеальном состоянии только год или около того.
Золотой цвет забора Букингемского дворца на самом деле золотой; золото покрыто, потому что оно длится 30 лет; в то время как золотая краска, которая на самом деле вообще не содержит золота, сохраняется в идеальном состоянии только год или около того.