Ненасыщенный пар — это… Что такое Ненасыщенный пар?
- Ненасыщенный пар
Пар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества. Процесс возникновения пара из жидкой (твёрдой) фазы — называется «парообразованием».Обратный процесс называется конденсация. При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа. В разговорной речи под словом пар почти всегда понимают водяной пар. Пары прочих веществ оговариваются в явном виде.
Различают следующие виды состояний пара химически чистых веществ:
- Ненасыщенный пар — пар, не достигший динамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
У разных жидкостей динамическое равновесие с паром наступает при различной плотности пара. Причина этого заключается в различии сил межмолекулярного взаимодействия. В жидкостях, у которых силы межмолекулярного притяжения велики, например у ртути, только наиболее «быстрые» молекулы, число которых незначительно, могут вылетать из жидкости. Поэтому для таких жидкостей уже при небольшой плотности пара наступает состояние равновесия. У летучих жидкостей с малой силой притяжения молекул, например у эфира, при той же температуре может вылететь за пределы жидкости множество молекул. Поэтому и равновесное состояние наступает только при значительной плотности пара.
- Перенасыщенный пар
Пар водяной
Пар водяной — газообразное состояние воды.
Таблица 1
Давление пара воды в зависимости от температуры, Бар °C 0 1 2 3 4 5 6 7 8 9 0 0,006351 0,006827 0,007335 0,007876 0,008452 0,009066 0,00972 0,010411 0,011147 0,011929 10 0,01276 0,01364 0,014574 0,015563 0,01661 0,017719 0,018893 0,020135 0,021444 0,022831 20 0,024299 0,025849 0,027481 0,029194 0,031009 0,032926 0,034935 0,037056 0,039289 0,041634 30 0,044102 0,046702 0,049425 0,052290 0,055298 0,058459 0,061763 0,065240 0,068881 0,072694 40 0,076681 0,080872 0,085247 0,089825 0,094618 0,099635 0,104866 0,110342 0,116062 0,122027 50 0,128258 0,134764 0,141534 0,148611 0,155984 0,163662 0,171666 0,180008 0,188685 0,19772 60 0,207101 0,21689 0,227087 0,23759 0,248603 0,260024 0,271852 0,28419 0,296937 0,310295 70 0,324061 0,338336 0,353122 0,368418 0,384325 0,400844 0,417873 0,435616 0,453868 0,472835 80 0,492413 0,512705 0,533711 0,555431 0,577864 0,601011 0,624974 0,649753 0,675347 0,701758 90 0,728882 0,757025 0,786189 0,816168 0,847065 0,878879 0,911816 0,94567 0,980544 1,016743 100 1,053554 1,091793 1,131051 1,171533 1,213239 1,256066 1,300219 1,345596 1,392298 1,440326 110 1,489680 1,540359 1,592567 1,646204 1,701267 1,757861 1,815984 1,875636 1,936920 1,999836 120 2,064383 2,130663 2,198575 2,268323 2,339906 2,413222 2,488476 2,565565 2,644592 2,725658 130 2,808662 2,893705 2,980889 3,070317 3,162090 3,254882 3,350734 3,448625 3,549576 3,652565 140 3,757595 3,870781 3,974791 4,087977 4,202184 4,320469 4,440794 4,564177 4,6896 4,818083 150 4,949624 5,083205 5,219844 5,360563 5,503321 5,649138 5,798014 5,950969 6,105964 6,265037 160 6,426149 6,591341 6,760611 6,931921 7,107309 7,286776 7,469303 7,654888 7,844552 8,038295 170 8,235097 8,436998 8,641958 8,849976 9,063094 9,280290 9,500545 9,725899 9,955331 10,188842 180 10,426433 10,668101 10,913849 11,165715 11,421660 11,681683 11,945786 12,214986 12,489286 12,768683 190 13,052160 13,340735 13,634409 13,933181 14,237051 14,546021 14,860088 15,179254 15,503519 15,833902 200 16,169383 16,510982 16,857680 17,209477 17,567392 17,931425 18,301576 18,676825 19,058193 19,445679 210 19,839283 20,239006 20,644846 21,057825 21,475902 21,900097 22,33245 22,974861 23,21551 23,666217 220 24,125082 24,590066 25,061167 25,540426 26,025803 26,519338 27,018991 27,526802 28,04073 28,562817 230 29,093061 29,629423 30,173943 30,726620 31,286435 31,854408 32,429519 33,013807 33,502244 34,204817 240 34,812558 35,429477 36,053533 36,686767 37,328158 37,977707 38,636433 39,304337 39,980398 40,665636 250 41,359032 42,062625 42,776415 43,500402 44,224389 44,968770 45,713151 46,477926 47,242701 48,017673 260 48,813039 49,608405 50,413968 51,229728 52,055685 52,891839 53,748387 54,604935 55,471680 56,348622 270 57,245958 58,143294 59,050827 59,978754 60,906681 61,855002 62,81352 63,782235 64,761147 65,750256 280 66,749562 67,759065 68,788962 69,818859 70,869150 71,929638 73,000323 74,081205 75,182481 76,293954 290 77,415624 78,547491 79,689555 80,852013 82,024668 83,207520 84,410766 85,624209 86,847849 88,081686 300 89,335917 90,600345 91,885167 93,180186 94,485402 95,800815 97,136622 98,492823 99,849024 101,235816 310 102,622608 104,029794 105,457374 106,895151 108,343125 109,811493 111,300255 112,799214 114,318567 115,848117 320 117,387864 118,958202 120,538737 122,129469 123,740595 125,372115 127,013832 128,675943 130,358448 132,05115 330 133,764246 135,497736 137,241423 139,015701 140,800176 133,427745 144,420111 146,265768 148,121622 149,99787 340 151,894512 153,811548 155,738781 157,696605 159,674823 161,663238 163,682244 165,721644 167,771241 169,851429 350 171,952011 174,072987 176,214357 178,376121 180,558279 182,771028 185,004171 187,257708 189,317502 191,836161 360 194,171274 196,516584 198,902682 201,298977 203,73606 206,193537 208,671408 211,190067 213,72912 216,298764 370 218,909196 221,540022 224,211636 226,913841 229,656834 — — — — — См. также
Литература
- Под ред. Ишлинский А. Ю. Новый политехнический словарь.. — М.: Большая Российская энциклопедия., 2003. — С. 671. — ISBN 5-7107-7316-6
- Под ред. Кокоина И.К. Таблицы физических величин.. — М.: Атомиздат., 1976. — С. 1008.
Wikimedia Foundation. 2010.
- Нун (буква)
- Улица Щорса (Липецк)
Смотреть что такое «Ненасыщенный пар» в других словарях:
ненасыщенный пар — Пар с давлением меньше давления насыщения пара при той же температуре [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN unsaturated steam … Справочник технического переводчика
ненасыщенный пар — nesotieji garai statusas T sritis fizika atitikmenys: angl. unsaturated steam; unsaturated vapor; unsaturated vapour vok. ungesättigter Dampf, m rus. ненасыщенный пар, m pranc. vapeur non saturée, f … Fizikos terminų žodynas
Пар (газообразное состояние) — Пар, название газообразного состояния веществ (см. Газы) в условиях, когда газовая фаза может находиться в равновесии с жидкой (твёрдой) фазой того же вещества. Как правило, термин «пар» применяют в тех случаях, когда фазовое равновесие… … Большая советская энциклопедия
Пар — У этого термина существуют и другие значения, см. Пар (значения). Пар газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества. Процесс возникновения пара из жидкой… … Википедия
Пар — I название газообразного состояния веществ (см. Газы) в условиях, когда газовая фаза может находиться в равновесии с жидкой (твёрдой) фазой того же вещества. Как правило, термин «пар» применяют в тех случаях, когда фазовое равновесие… … Большая советская энциклопедия
Пар — [steam; vapor] газообразное состояние веществ (Смотри Газы) когда газовая фаза может быть равновесна с жидкой (твердой) фазой того же вещества. Как правило, термин «пар» применяют, когда фазовое равновесие осуществляется пр … Энциклопедический словарь по металлургии
ПАР — (1) газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой (твёрдой) фазой того же вещества, т.е. устанавливается динамическое равновесие между процессами (см.) и (см.). Для многих физ. задач понятия … Большая политехническая энциклопедия
nesotieji garai — statusas T sritis fizika atitikmenys: angl. unsaturated steam; unsaturated vapor; unsaturated vapour vok. ungesättigter Dampf, m rus. ненасыщенный пар, m pranc. vapeur non saturée, f … Fizikos terminų žodynas
ungesättigter Dampf — nesotieji garai statusas T sritis fizika atitikmenys: angl. unsaturated steam; unsaturated vapor; unsaturated vapour vok. ungesättigter Dampf, m rus. ненасыщенный пар, m pranc. vapeur non saturée, f … Fizikos terminų žodynas
unsaturated steam — nesotieji garai statusas T sritis fizika atitikmenys: angl. unsaturated steam; unsaturated vapor; unsaturated vapour vok. ungesättigter Dampf, m rus. ненасыщенный пар, m pranc. vapeur non saturée, f … Fizikos terminų žodynas
dic.academic.ru
Ненасыщенный пар Википедия
Выброс пара на Европе в представлении художникаПар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества, то есть при температурах ниже критической температуры вещества. Процесс возникновения пара из жидкой (твёрдой) фазы называется «парообразованием». Обратный процесс называется конденсация. При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа. В разговорной речи под словом «пар» почти всегда понимают водяной пар. Подразумевается, что жидкая или твёрдая фазы могут представлять из себя как индивидуальное вещество так и механическую смесь веществ — влажное вещество[1]. Пары́ прочих веществ оговариваются в явном виде.
Не следует путать оптически однородный и гомогенный пар с туманом — гетерогенной системой, сильно рассеивающей свет.
Различают следующие виды состояний пара химически чистых веществ:
- Ненасыщенный пар — пар, не достигший динамического равновесия (не термодинамического!) со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
- Насыщенный пар — пар, находящийся в динамическом равновесии со своей жидкостью (скорость испарения равна скорости конденсации). Это означает, что при данной температуре в этом объёме не может находиться большее количество пара. Если сжимать пар, находящийся в равновесии с жидкостью под поршнем (при условии, что воздух из сосуда предварительно откачан), то равновесие будет нарушаться. Так как плотность пара в первый момент увеличится, то усилится конденсация (из пара в жидкость начнет переходить большее количество молекул, чем из жидкости в газ). Этот процесс будет продолжаться до тех пор, пока вновь не установятся динамическое равновесие и плотность пара, а следовательно, и концентрация молекул газа не примет прежнее значение.
У разных жидкостей динамическое равновесие с паром наступает при различной плотности пара. Причина этого заключается в различии сил межмолекулярного взаимодействия. В жидкостях, у которых силы межмолекулярного притяжения велики, например у ртути, только наиболее быстрые молекулы, число которых незначительно, могут вылетать из жидкости. Поэтому для таких жидкостей уже при небольшой плотности пара наступает состояние равновесия. У летучих жидкостей с малой силой притяжения молекул, например у эфира, при той же температуре может вылететь за пределы жидкости множество молекул. Поэтому и равновесное состояние наступает только при значительной плотности пара.
Водяной пар
Водяной пар — газообразное состояние воды.
Благодаря своим уникальным свойствам, пар получил широкое распространение в разнообразной деятельности человека.
Примечания
Литература
Ссылки
wikiredia.ru
Ненасыщенный пар Википедия
Выброс пара на Европе в представлении художникаПар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества, то есть при температурах ниже критической температуры вещества. Процесс возникновения пара из жидкой (твёрдой) фазы называется «парообразованием». Обратный процесс называется конденсация. При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа. В разговорной речи под словом «пар» почти всегда понимают водяной пар. Подразумевается, что жидкая или твёрдая фазы могут представлять из себя как индивидуальное вещество так и механическую смесь веществ — влажное вещество[1]. Пары́ прочих веществ оговариваются в явном виде.
Не следует путать оптически однородный и гомогенный пар с туманом — гетерогенной системой, сильно рассеивающей свет.
Различают следующие виды состояний пара химически чистых веществ:
- Ненасыщенный пар — пар, не достигший динамического равновесия (не термодинамического!) со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
- Насыщенный пар — пар, находящийся в динамическом равновесии со своей жидкостью (скорость испарения равна скорости конденсации). Это означает, что при данной температуре в этом объёме не может находиться большее количество пара. Если сжимать пар, находящийся в равновесии с жидкостью под поршнем (при условии, что воздух из сосуда предварительно откачан), то равновесие будет нарушаться. Так как плотность пара в первый момент увеличится, то усилится конденсация (из пара в жидкость начнет переходить большее количество молекул, чем из жидкости в газ). Этот процесс будет продолжаться до тех пор, пока вновь не установятся динамическое равновесие и плотность пара, а следовательно, и концентрация молекул газа не примет прежнее значение.
У разных жидкостей динамическое равновесие с паром наступает при различной плотности пара. Причина этого заключается в различии сил межмолекулярного взаимодействия. В жидкостях, у которых силы межмолекулярного притяжения велики, например у ртути, только наиболее быстрые молекулы, число которых незначительно, могут вылетать из жидкости. Поэтому для таких жидкостей уже при небольшой плотности пара наступает состояние равновесия. У летучих жидкостей с малой силой притяжения молекул, например у эфира, при той же температуре может вылететь за пределы жидкости множество молекул. Поэтому и равновесное состояние наступает только при значительной плотности пара.
Водяной пар[ | ]

Водяной пар — газообразное состояние воды.
Благодаря своим уникальным свойс
ru-wiki.ru
Насыщенный пар. Кипение. Видеоурок. Физика 10 Класс
Из курса физики 8 класса вам хорошо известно, что такое агрегатное состояние вещества. Кроме того, вы хорошо знаете, каким образом вещество может переходить из одного состояния в другое. В частности, вы знаете, что, если жидкость превращается в пар, такой процесс называется парообразованием, обратный же процесс, переход из пара в жидкость, называется конденсацией. Схема таких преобразований представлена на рисунке 1.
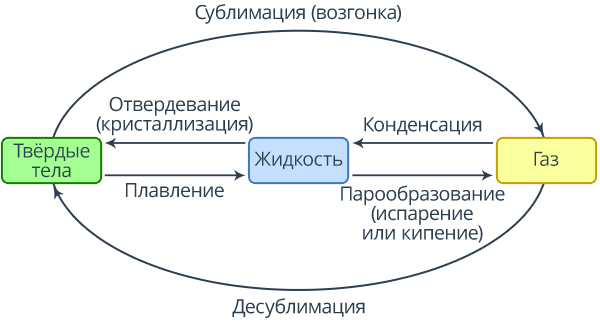
Рис. 1. Схема изменения аргатного состояния вещества
Рекомендую посмотреть соответствующие уроки в разделе физики 8 класса.
Парообразование – свойство капельных жидкостей заменять свое агрегатное состояние и превращаться в пар.
Из материала 8 класса мы знаем, что парообразование делится на два вида:
1. Испарение, которое происходит с поверхности раздела жидкости и окружающего воздуха;
2. Кипение, которое происходит во всем объеме жидкости при определенных условиях.
Теперь рассмотрим эти процессы более серьезно, имея на вооружении знания, которые мы получили в разделе «Молекулярно-кинетическая теория».
Давайте задумаемся над таким вопросом. Как мы знаем, все молекулы жидкости находятся в состоянии непрерывного хаотического движения. Хаотичность, в частности, означает, что направление движения отдельных молекул носит случайный характер. Почему же при этом жидкость сохраняет свой объем, а не распадается на отдельные частицы? Между молекулами действуют силы притяжения, которые не позволяют им покинуть жидкость. Кроме того, очевидно, что значение скоростей молекул также случайны, а следовательно, среди них обязательно найдутся очень быстрые молекулы. Если такая молекула вследствие хаотического перемещения окажется вблизи поверхности раздела жидкости и окружающего воздуха, то ее кинетической энергии может хватить на то, чтобы преодолеть силы притяжения и вырваться наружу (см. рис. 2).
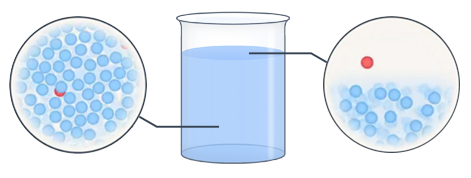
Рис. 2. Наглядное изображение поведения молекул в жидкости
Это и есть упомянутый выше процесс испарения. Когда количество испарившихся молекул становится значительным, они образуют пар. Конечно, может произойти и обратное. Вырвавшиеся за пределы жидкости молекулы вследствие хаотического движения снова вернутся в объем жидкости, такой процесс, как мы знаем, называется конденсацией. Если сосуд с жидкостью будет открыт, то испарившиеся молекулы могут безвозвратно покидать пространство над жидкостью, в результате чего количество последней будет постепенно уменьшаться. Примеры описанного мы можем повсеместно наблюдать вокруг, все процессы высыхания именно так и происходят – жидкость испаряется, а пар обратно не конденсируется вследствие того, что молекулы этого пара удаляются от жидкости.
Проделайте дома очень простой эксперимент: наполните стакан водой и проследите за уровнем воды в течение нескольких дней. Через несколько дней вы увидите, что уровень воды стал значительно ниже, вода испарялась.
Разные жидкости испаряются с разными скоростями. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии их преодолеть и вылететь наружу и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее – вода. Намного медленнее воды испаряются масло и ртуть.
Поскольку испарение – это уход из жидкости самых быстрых молекул, то средняя кинетическая энергия молекул, которые остались в жидкости, естественно уменьшается.
А что такое средняя кинетическая энергия молекул? Это, фактически, температура, т. е. жидкость при испарении остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости, особенно при ветре, когда выходишь из воды. Вода, испаряясь по всей поверхности тела, уносит тепло. Ветер же ускоряет процесс испарения.
А что будет, если мы закроем сосуд с жидкостью? Молекулы пара уже не смогут покидать пространство над ней, по мере испарения их количество сначала будет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
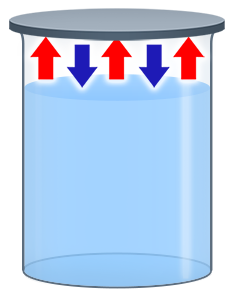
Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде)
Т. е. в такой системе будут идти два конкурирующих процесса (см. рис. 3).
Первый – это процесс испарения, для которого количество покидающих жидкость молекул будет определяться только температурой. Почему? Смотрите ответвление № 1.
Работа выхода
Попробуем разобраться, какими параметрами определяется скорость испарения жидкости, от чего она зависит. Чтобы вырваться из объема жидкости, молекула должна преодолеть притяжение со стороны других молекул той же жидкости. Другими словами, ей необходимо совершить работу против сил межмолекулярного взаимодействия. Величина этой работы зависит от рода жидкости и носит название работы выхода. Таким образом, в парообразное состояние могут перейти те молекулы, чья кинетическая энергия превосходит значение работы выхода, это отражено в формуле:
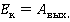
Рис. 4. Процесс испарения (процесс вылета молекулы с поверхности жидкости)
Долю молекул, удовлетворяющих этому условию, можно оценить, зная, так называемое, распределение молекул по скоростям, т. е. долю от общего числа молекул, обладающих данным значением скорости, а значит, и кинетической энергией.
Изучением таких распределений занимается раздел физики, который называется статистическая физика, однако ввиду его математической сложности в курс физики школы он не включен.
В 8 классе вы называли основные факторы, которые повлияют на скорость испарения. Итак, от чего же будет фактически зависеть количество молекул, которые убежали из жидкости? Эти факторы:
1. Род жидкости
2. Температура жидкости
3. Скорость отвода испарившихся молекул от жидкости (вспомните: для того чтобы остудить чай, мы дуем)
4. Площадь поверхности жидкости
На примере с чаем: для того чтобы он остывал быстрее, мы наливаем его в блюдце.
Итак, мы обсудили, какой же параметр характеризует способность молекул той или иной жидкости испаряться – это работа выхода – и какие факторы влияют на скорость испарения.
А второй процесс – это процесс конденсации, в котором количество возвращающихся в жидкость молекул будет, помимо прочего, зависеть и от концентрации молекул пара: чем больше молекул пара, тем большая вероятность, что одна из них вернется в жидкость.
Вначале, пока эта концентрация невелика, количество конденсирующихся молекул за единицу времени будет, естественно, меньше количества испаряющихся молекул, т. е. молекул, покидающих жидкость. Однако по мере роста концентрации пара поток молекул пар – жидкость будет расти, а обратный поток будет оставаться прежним, ведь он определяется только температурой.
В какой-то момент оба количества молекул станут равными. Как говорят физики, в системе установится динамическое равновесие, а пар достигнет состояния так называемого насыщения. Соответственно, пар, который находится в состоянии динамического равновесия со своей жидкостью, мы будем называть насыщенным.
Представьте себе здание с огромным количеством дверей. Какое-то количество людей заходит в это здание, а какое-то количество людей выходит из этого здания. Если количество людей, которые входят в здание, равно количеству людей, которые выходят из здания в единицу времени, то можно сказать, что достигнуто состояние насыщения. Вот точно так же происходит и в случае с паром.
Насыщенный пар – это в некотором смысле предельное состояние пара. Имеется в виду, что значение давления этого пара и его плотности являются максимальными при данном значении температуры. В противном же случае мы будем называть пар ненасыщенным.
До сих пор газообразное состояние мы обсуждали лишь на примере идеального газа, тем более удивительным является тот факт, что некоторые уравнения, которые описывают идеальный газ, вполне подходят и для состояния насыщенного пара.
Оказывается, что состояние насыщенного пара хоть и приближенно, но вполне удовлетворительно описывается уравнением Менделеева – Клапейрона:
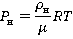
Здесь индекс Н указывает на то, что данные параметры относятся к насыщенному пару, µ – это молярная масса пара.
Теперь обсудим, какими основными свойствами обладает насыщенный пар и как эти свойства отличаются от свойств идеального газа или совпадают с ними. Все то, о чем мы будем говорить ниже, получено экспериментально, однако мы постараемся дать и качественное объяснение этих свойств.
Итак, свойство первое: при постоянной температуре плотность насыщенного пара не зависит от его объема. Понять это свойство легко. Представим себе, что мы, не меняя температуры, уменьшим объем сосуда, в котором находится насыщенный пар (см. рис. 5).
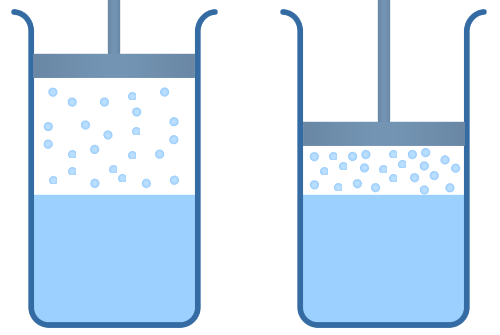
Рис. 5. Процесс сжатия пара в цилиндре (уменьшение обьема)
Количество молекул, переходящих от пара к жидкости в единицу времени, естественно, превысит количество испаряющихся молекул, но при этом часть пара просто сконденсируется, а оставшийся пар снова придет в состояние динамического равновесия. В итоге плотность этого пара будет равна начальной плотности:
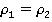
Второе свойство: давление насыщенного пара не зависит от его объема. Этот факт очевиден ввиду простой связи давления и плотности, выраженной уравнением Менделеева – Клапейрона. Как следствие, закон Бойля-Мариотта для насыщенного пара выполняться не будет. Закон Бойля-Мариотта имеет вид:
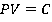
Третье свойство: при неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры. Действительно, при увеличении температуры возрастает скорость испарения жидкости. Динамическое равновесие в первый момент будет нарушено, т. е. произойдет дополнительное испарение некоторой части жидкости. Плотность пара будет возрастать до тех пор, пока динамическое равновесие вновь не восстановится.
А при охлаждении произойдет обратный процесс: часть пара сконденсируется, уменьшая его плотность.
Четвертое свойство: давление насыщенного пара растет с температурой быстрее, чем по линейному закону, как это было в случае идеального газа. В самом деле, с ростом температуры возрастает плотность насыщенного пара, а согласно уравнению Менделеева – Клапейрона давление пропорционально произведению плотности на температуру.
Т. е. в случае идеального газа рост давления обуславливался только ростом температуры, теперь работают два фактора: зависимость давления насыщенного пара от температуры, что представлено участком 1-2 графика (см. рис. 6).
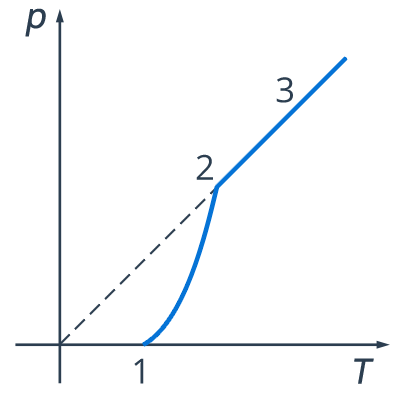
Рис. 6. График зависимости давления насыщенного пара от температуры
Эту зависимость нельзя вывести из законов идеального газа. При изохорном нагревании или охлаждении насыщенного пара его масса меняется. Поэтому закон Шарля в данном случае работать не будет.
Обратите внимание: в точке 2 вся жидкость испаряется. При дальнейшем повышении температуры пар становится ненасыщенным и его давление здесь растет как раз согласно закону Шарля. Это участок 2-3 (см. рис. 6). Закон Шарля имеет вид:
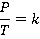
Вспомним, что линейный рост давления идеального газа вызван ростом интенсивности ударов молекул о стенки сосудов. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще, ведь пара становится больше. Именно одновременным действием этих двух факторов и вызван нелинейный рост давления насыщенного пара на участке 1-2.
Если подытожить приведенные выше свойства, то можно сказать, что коренным отличием насыщенного пара от идеального газа является тот факт, что он не является замкнутой системой, т. е. находится в постоянном контакте с жидкостью.
Обсудим еще один вид парообразования – кипение, хорошо знакомое каждому.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. А при нагревании внутрь этих микропузырьков начинают проникать испаряющиеся молекулы жидкости. В итоге пузырьки постепенно увеличиваются в размерах и становятся видимы невооруженным газом. В кастрюле с водой они осаждаются на дне и стенках. В течение короткого времени пар внутри пузырьков становится насыщенным, давление которого, как вы помните, быстро растет с повышением температуры. Чем крупнее становятся пузырьки по мере роста температуры, тем больше действует на них архимедова сила, и с определенного времени начнется отрыв и всплытие пузырьков, так как архимедова сила станет больше, чем сила тяжести, действующая на пузырек. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости, пар в них конденсируется и пузырьки сжимаются. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени, вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар. Шум сменяется бурлением. Мы говорим, что жидкость закипела.
В отличие от испарения, которое происходит при любой температуре, кипение, как мы знаем, происходит только при фиксированной температуре – той температуре, которой достаточно, чтобы пузырек смог вырасти, подняться на поверхность и лопнуть.
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость, чаще всего это атмосферное давление.
Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение (рис. 7).
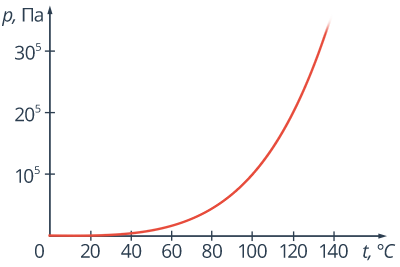
Рис. 7. График зависимости температуры кипенмя воды от давления среды
При нормальном атмосферном давлении, которое составляет приблизительно 100 000 Па, температура кипения воды, как мы знаем, равна 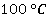 . Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре
. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 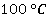 равно 105 или 100 000 Па. Этот факт необходимо знать при решении задач. Очень часто он считается известным по умолчанию.
равно 105 или 100 000 Па. Этот факт необходимо знать при решении задач. Очень часто он считается известным по умолчанию.
Естественно, чем выше мы поднимаемся в атмосфере, тем меньше становится это атмосферное давление. Так, например, на вершине самой высокой горы Кавказа – Эльбруса – атмосферное давление составляет 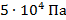 , т. е. в 2 раза меньше, чем нормальное атмосферное давление (см. рис. 8).
, т. е. в 2 раза меньше, чем нормальное атмосферное давление (см. рис. 8).
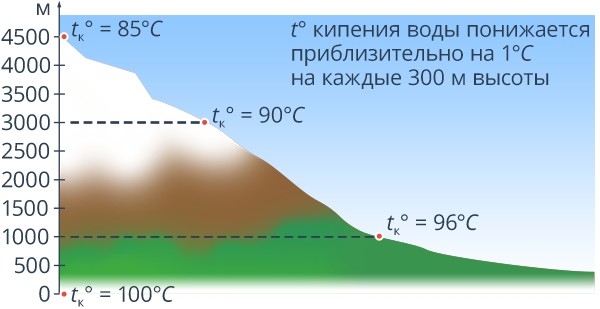
Рис. 8. Наглядное представление зависимости температуры кипения воды от изменения давления с высотой
Естественно, что температура кипения там будет ниже, чем на уровне моря. Вода там закипит при температуре 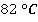 .
.
Температура кипения при нормальном атмосферном давлении является строго определенной для данной жидкости величиной (см. рис. 9).
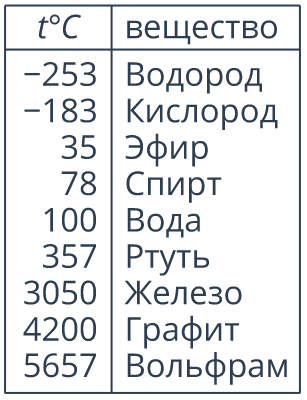
Рис. 9. Температура кипения некоторых веществ (при нормальном атмсоферном давлении)
Так, спирт кипит при 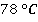 , эфир – при
, эфир – при 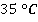 , ртуть – при
, ртуть – при 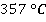 . Обратите внимание, чем более летучей является жидкость, тем ниже ее температура кипения. Например, кислород кипит при
. Обратите внимание, чем более летучей является жидкость, тем ниже ее температура кипения. Например, кислород кипит при 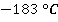 , поэтому при обычных температурах кислород – это газ.
, поэтому при обычных температурах кислород – это газ.
Естественно, если увеличивать давление над жидкостью, то и температура кипения будет расти, именно этот принцип положен в основу работы так называемых скороварок. Искусственным образом над жидкостью создается повышенное давление, и вода начинает кипеть при температурах значительно больше, чем 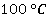 . В этом случае продукты, которые мы хотим приготовить, например картофель, будут приготовлены значительно быстрее, чем в случае нормального атмосферного давления, отсюда и название скороварка.
. В этом случае продукты, которые мы хотим приготовить, например картофель, будут приготовлены значительно быстрее, чем в случае нормального атмосферного давления, отсюда и название скороварка.
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится. Процесс кипения требует непрерывного подвода тепла. Вместе с тем температура воды в чайнике после закипания перестает меняться, оставаясь равной 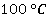 .
.
Куда же при этом девается подводимое тепло, не противоречит ли это закону сохранения энергии? В 8 классе мы уже отвечали на этот вопрос – тепло идет на увеличение потенциальной энергии молекул, в данном случае на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалеку друг от друга, и жидкость будет переходить в газообразное состояние. Следует сделать одно важное замечание: кипение будет невозможным, если в ней отсутствует растворенные газовые пузырьки. Подробнее об этом мы поговорим во втором ответвлении.
Перегретая жидкость
Растворенные в жидкости пузырьки, а также любые другие микроскопические примеси играют роль так называемых центров испарения, и если каким-то образом добиться очистки жидкости, то ее можно нагреть до температур, значительно превышающих температуру кипения при данном внешнем давлении. Такие жидкости называются перегретыми.
Аналогичное утверждение относится и к конденсации: при отсутствии соответствующих центров, пар ненасыщенный можно охладить ниже температуры конденсации. Перегретая жидкость и переохлажденный пар являются примерами так называемых метастабильных состояний.
Внесение малейшей неоднородности в такие среды приводит к моментальному переходу в другое агрегатное состояние, например, если в сосуд с перегретой жидкостью кинуть щепотку соли, то жидкость моментально закипит, т. к. частицы соли станут центрами испарения.
А третье ответвление будет посвящено разбору одной типичной задачи по теме «Насыщенный пар, кипение жидкости».
Разбор задачи
Условие
Давление насыщенного пара эфира при 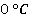 равно 24,7 кПа, а при
равно 24,7 кПа, а при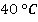 – 123 кПа. Сравнить значения плотности пара при этих температурах.
– 123 кПа. Сравнить значения плотности пара при этих температурах.
Решение
Воспользуемся уравнением Менделеева – Клапейрона в той форме, которую мы приводили на основном уроке:
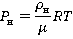
Применим это уравнение к обоим состояниям насыщенного пара для 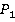 и
и 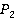 :
:
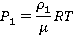
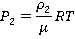
Теперь почленно разделим первое уравнение на второе и получим:
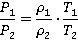
Нам необходимо найти отношение плотностей, выражаем
interneturok.ru
Чем отличается насыщенный пар от ненасыщенного
Прежде, чем отвечать на вопрос, поставленный в названии статьи, разберемся, что такое пар. Образы, возникающие у большинства людей при этом слове: кипящий чайник или кастрюля, парилка, горячий напиток и еще множество подобных картинок. Так или иначе, в наших представлениях присутствует жидкость и газообразная субстанция, поднимающаяся над ее поверхностью. Если вас попросят привести пример пара, вы сразу вспомните водяной пар, пары спирта, эфира, бензина, ацетона.

Существует еще одно слово для обозначения газообразных состояний – газ. Здесь мы обычно вспоминаем кислород, водород, азот и другие газы, не ассоциируя их с соответствующими жидкостями. При этом хорошо известно, что они существуют и в жидком состоянии. На первый взгляд различия заключаются в том, что пар соответствует естественным жидкостям, а газы надо сжижать специально. Однако это не совсем верно. Более того, образы, возникающие при слове пар – паром не являются. Чтобы дать более точный ответ, разберемся, как возникает пар.
Чем отличается пар от газа?
Агрегатное состояние вещества задается температурой, точнее соотношением между энергией, с которой взаимодействуют его молекулы и энергией их теплового хаотического движения. Приближенно, можно считать, что если энергия взаимодействия значительно больше – твердое состояние, если значительно больше энергия теплового движения — газообразное, если энергии сравнимы – жидкое.
Молекула газа
Получается, чтобы молекула могла оторваться от жидкости и участвовать в образовании пара, величина тепловой энергии должна быть больше энергии взаимодействия. Как это может произойти? Средняя скорость теплового движения молекул равна определенному значению, зависящему от температуры. Однако индивидуальные скорости молекул различны: большая их часть обладает скоростями близкими к среднему значению, но некоторая часть имеет скорости больше средней, некоторая — меньше.
Более быстрые молекулы могут иметь тепловую энергию большую, чем энергия взаимодействия, а значит, попав на поверхность жидкости, способны оторваться от нее, образуя пар. Такой способ парообразования называется испарением. Из-за того же распределения скоростей существует и противоположный процесс — конденсация: молекулы из пара переходят в жидкость. Кстати образы, которые обычно возникают при слове пар, это не пар, а результат противоположного процесса — конденсации. Пар увидеть нельзя.

Испарение
Пар при определенных условиях может стать жидкостью, но для этого его температура не должна превышать определенного значения. Это значение называется критической температурой. Пар и газ — газообразные состояния, отличающиеся температурой, при которой они существуют. Если температура не превышает критической — пар, если превышает – газ. Если поддерживать температуру постоянной и уменьшать объем, пар — сжижается, газ – не сжижается.
Что такое пар насыщенный и ненасыщенный
Само слово «насыщенный» несет определенную информацию, трудно насытить большую область пространства. Значит, чтобы получить насыщенный пар, надо ограничить пространство, в котором находится жидкость. Температура при этом должна быть меньше критической для данного вещества. Теперь испарившиеся молекулы остаются в пространстве, где находится жидкость. Сначала большинство переходов молекул будет происходить из жидкости, при этом плотность пара будет повышаться. Это в свою очередь вызовет большее число обратных переходов молекул в жидкость, что увеличит скорость процесса конденсации.
Наконец, устанавливается состояние, для которого среднее число молекул, переходящих из одной фазы в другую будет равным. Такое состояние называется динамическое равновесие. Для этого состояния характерно одинаковое изменение величины и направления скоростей испарения и конденсации. Это состояние соответствует насыщенному пару. Если состояние динамического равновесия не достигнуто, это соответствует ненасыщенному пару.
Начинают изучение какого-то объекта, всегда с самой простой его модели. В молекулярно-кинетической теории это — идеальный газ. Основные упрощения здесь — пренебрежение собственным объемом молекул и энергией их взаимодействия. Оказывается, подобная модель вполне удовлетворительно описывает ненасыщенный пар. Причем чем менее он насыщен, тем правомернее ее применение. Идеальный газ — это газ, он не может стать ни паром, ни жидкостью. Следовательно, для насыщенного пара подобная модель не является адекватной.
Основные отличия насыщенного пара от ненасыщенного
- Насыщенный означает, что данный объект имеет самое большое из возможных значений некоторых параметров. Для пара — это плотность и давление. Эти параметры для ненасыщенного пара имеют меньшие значения. Чем дальше пар от насыщения, тем меньше эти величины. Одно уточнение: температура сравнения должна быть постоянной.
- Для ненасыщенного пара выполняется закон Бойля-Мариотта: если температура и масса газа постоянны, увеличение или уменьшение объема, вызывает уменьшение или увеличение давления во столько же раз, давление и объем — связаны обратно пропорциональной зависимостью. Из максимальности плотности и давления при постоянной температуре вытекает их независимость от объема насыщенного пара, получается, что для насыщенного пара давление и объем — не зависят друг от друга.
- Для ненасыщенного пара плотность не зависит от температуры, и если объем сохраняется, не меняется и значение плотности. Для насыщенного пара при сохранении объема плотность изменяется, если изменяется температура. Зависимость в данном случае прямая. Если увеличивается температура, увеличивается и плотность, если температура уменьшается, так же изменяется плотность.
- Если объем постоянен, ненасыщенный пар ведет себя в соответствии с законом Шарля: при увеличении температуры во столько же раз увеличивается и давление. Такая зависимость называется линейной. У насыщенного пара при увеличении температуры давление возрастает быстрее, чем у ненасыщенного пара. Зависимость имеет экспоненциальный характер.
Подводя итог, можно отметить значительные различия свойств сравниваемых объектов. Основное отличие в том, что пар, в состоянии насыщения, нельзя рассматривать в отрыве от его жидкости. Это двухкомпонентная система, к которой нельзя применять большинство газовых законов.
vchemraznica.ru
2.1.13 Насыщенные и ненасыщенные пары
Видеоурок 1: Испарение и конденсация. Насыщенный пар и его свойства
Видеоурок 2: Температурная зависимость давления пара. Точка росы
Лекция: Насыщенные и ненасыщенные пары
 Парообразование и конденсация
Парообразование и конденсацияТвердые тела отличаются от жидких более устойчивым положением молекул. В жидкостях имеются силы притяжения, однако их не всегда достаточно. Если молекуле некоторого жидкого вещества придать кинетическую энергию, которая позволит структурным единицам стать свободными, то они способны покинуть поверхность жидкости и улететь в газ, который находится сверху. Некоторым молекулам энергии становится недостаточно, и они возвращаются обратно в жидкость.
Процесс, в результате которого молекулы покидают жидкость, называется парообразованием. Процесс, обратный парообразованию, называется конденсацией.
Существует два вида образования парообразного состояния: испарение и кипение.
 Испарение
ИспарениеПроцесс испарения характеризуется способностью молекул жидкости покидать верхние слои при любой температуре. В тот момент, когда молекула покидает поверхность, температура жидкости снижается. Это происходит в результате того, что для отрывания структурной единицы необходима энергия, а когда энергия расходуется, температура падает.
Именно поэтому организм человека выделяет пот. В результате его испарения температура тела падает. Каждый из нас, выходя из реки, моря или другого водоема, ощущал холодок — это происходит в результате испарения.
Скорость процесса испарения зависит:
1. От размера свободной поверхности жидкости. Если взять одинакового объема кружку и тарелку, то с тарелки испарения будет происходить быстрее за счет большей площади.
2. От рода жидкости. Спирт испаряется быстрее, чем вода, например. Его молекулы более активны из-за этого он быстрее диссоциирует с молекулами воздуха. Чем легче структурная единица вещества, тем быстрее происходит испарение.
3. От температуры жидкости. Чем выше температура, тем быстрее протекает процесс.
4. От давления окружающей среды. Если давление большое, то оно не дает жидкости покинуть поверхность, поэтому испарение протекает медленнее.
5. Если жидкость находится в закрытом пространстве, то ей тяжелее испарятся. Поэтому скорость зависит от количества водяного пара над поверхностью жидкости.
 Пары: насыщенный и ненасыщенный
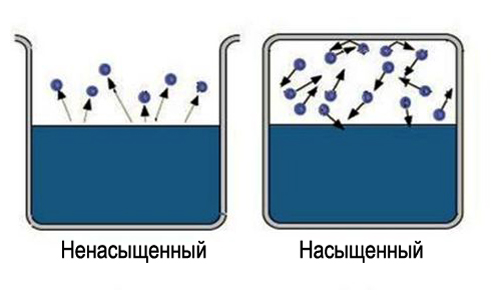
Пары: насыщенный и ненасыщенныйПредставьте, что вы взяли два сосуда. Один из которых закрыли крышкой. В обоих сосудах происходит и испарение и конденсация.
В сосуде, который не закрыт, количество молекул, что испарились, больше тех, что вернулись обратно. Такой пар называется ненасыщенным. В закрытом сосуде количество молекул, покинувших жидкость, равна тем, что вернулись обратно. Такой пар называется насыщенным.

 Кипение
КипениеДанный процесс перехода жидкости в газообразное состояние происходит со всего объема и при определенной температуре. Для каждой жидкости соответствует своя температура кипения. Для воды, например, при нормальном давлении температура кипения 100 градусов. Чем меньше давление, тем меньше температура кипения. Таким образом, на высокой горе закипетить воду можно при более низкой температуре.
Только обратите внимание, приготовить на такой воде мясо практически невозможно — для него нужна температура выше.
Во время кипения пузырьки газа, содержащиеся в жидкости, выходят с её объема. Закипетить повторно воду тяжелее, поскольку данных пузырьков нет. Кипение начинается тогда, когда давление в пузырьках меньше, чем в жидкости — они начинают лопаться.
 Отличие насыщенного пара от идеального газа
Отличие насыщенного пара от идеального газаДля решения задач с насыщенным паром нельзя использовать законы для изопроцессов, поскольку данные газы отличаются по некоторым принципам:
1. Мы знаем, что если запустить идеальный газ в некоторый больший объем, то его давление и плотность уменьшиться. Для насыщенного пара эти параметры остаются неизменными при любом объеме.
2. При изохорном процессе зависимость роста температуры и давления для идеального газа линейная. В случае с насыщенным паром рост давление при увеличении температуры происходит быстрее.

cknow.ru
НАСЫЩЕННЫЙ ПАР — это… Что такое НАСЫЩЕННЫЙ ПАР?
- НАСЫЩЕННЫЙ ПАР
- НАСЫЩЕННЫЙ ПАР
-
(Saturated steam) — пар, находящийся в тепловом равновесии с жидкостью. Увеличение давления пара или понижение температуры вызывает конденсацию части насыщенного пара.
Самойлов К. И. Морской словарь. — М.-Л.: Государственное Военно-морское Издательство НКВМФ Союза ССР, 1941
- Насыщенный пар
-
пар, температура которого равна температуре кипения воды при данном давлении. Используется во вспомогательных механизмах теплообменных аппаратах, системе отопления и ненапряженных паросиловых энергетических установках.
EdwART. Толковый Военно-морской Словарь, 2010
.
- НАСЫПЬЮ
- НАТАЩИТЬ КАНАТ, ЯКОРЦЕПЬ
Смотреть что такое «НАСЫЩЕННЫЙ ПАР» в других словарях:
НАСЫЩЕННЫЙ ПАР — пар, находящийся в термодинамич. равновесии с жидкостью (или тв. телом) того же хим. состава. Жидкость и её Н. п. находятся в состоянии дпнамич. равновесия: число молекул, переходящих из жидкости в пар в ед. времени, равно числу молекул пара,… … Физическая энциклопедия
насыщенный пар — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN saturated vane … Справочник технического переводчика
Насыщенный пар — Насыщенный пар это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава[1]. Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление… … Википедия
насыщенный пар — 3.37 насыщенный пар : Пар, выходящий из барабана котла. Источник … Словарь-справочник терминов нормативно-технической документации
насыщенный пар — sotieji garai statusas T sritis automatika atitikmenys: angl. saturated steam; saturated vapour vok. gesättigter Dampf, m; Sattdampf, m rus. насыщенный пар, m pranc. vapeur saturée, f … Automatikos terminų žodynas
насыщенный пар — sotieji garai statusas T sritis Standartizacija ir metrologija apibrėžtis Garai, esantys termodinaminėje pusiausvyroje su skystąja arba kietąja tos pačios medžiagos faze. atitikmenys: angl. saturated vapor; saturated vapour vok. Sattdampf, m rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas
насыщенный пар — sotieji garai statusas T sritis chemija apibrėžtis Garai, esantys termodinaminėje pusiausvyroje su skystąja arba kietąja tos pačios medžiagos faze. atitikmenys: angl. saturated vapor; saturated vapour rus. насыщенный пар … Chemijos terminų aiškinamasis žodynas
насыщенный пар — sotieji garai statusas T sritis fizika atitikmenys: angl. saturated steam; saturated vapor; saturated vapour vok. gesättigter Dampf, m; Sattdampf, m rus. насыщенный пар, m pranc. vapeur saturée, f … Fizikos terminų žodynas
насыщенный пар — sotusis garas statusas T sritis Energetika apibrėžtis Garas, kurio temperatūra lygi virimo temperatūrai, atitinkančiai tam tikrą slėgį. atitikmenys: angl. saturated state of gas; saturated steam vok. Sattdampf, m rus. насыщенный пар, m pranc.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Насыщенный пар — пар, находящийся в термодинамическом равновесии с жидкостью (или твёрдым телом) того же химического состава. Между жидкостью и её Н. п. существует динамическое равновесие: число молекул, вырывающихся в единицу времени из жидкости и… … Большая советская энциклопедия
dic.academic.ru