Обратимые и необратимые химические реакции
Реакции, идущие до конца и не изменяющие своего направления при изменении температуры и давления, называются необратимыми.
Химические реакции принято считать необратимыми, если:
Один из продуктов реакции выводится из сферы реакции в виде:
А) газа BaCO3 =t= BaO +CO2↑
Б) осадка Pb(NO3)2 + 2NaCl = PbCl2 ↓+ 2NaNO3
В) малодиссоциированного соединения – воды, слабой кислоты или основания, комплексной соли.
KOH +HCl = KCl + H2O
CH3COONa + HNO3 = NaNO3 + CH3COOH
Al(OH)3 NaOH = Na ⌈Al(OH)4⌉
Г) выделяется большое количество тепла, например, реакция горения:
C +О
Однако, большинство химических реакций являются обратимыми: при одних условиях (P, t, kat) они идут в одном направлении, при других – в обратном, а при некоторых промежуточных – протекают одновременно в двух взаимно противоположных направлениях.
Примером обратимых реакций служат реакции термического разложения гидроксида кальция, синтез аммиака:
Ca(OH) ↔ CaO + H2O – Q
N2+3H2 ↔ 2NH3 + Q
Реакцию, идущую слева направо называют прямой, а справа налево – обратной.
Если прямая реакция экзотермическая, то обратная – эндотермическая. Причем, по закону сохранения энергии, количество теплоты, выделившееся в результате прямой реакции, равно количеству теплоты, поглощенному при обратном процессе, а наоборот.
Понятия «обратимая реакция» и «необратимая реакция» относительны: любая обратимая реакция может стать необратимой, если:
- одно из веществ выводить из сферы реакции;
- изменить условия протекания реакции;
С другой стороны, многие реакции, протекающие необратимо, можно сделать обратимыми, изменив условия их протекания.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Необратимые и обратимые реакции
Среди многочисленных классификаций типов реакций, например таких, которые определяются по тепловому эффекту (экзотермические и эндотермические), по изменению степеней окисления веществ (окислительно-восстановительные), по количеству участвующих в них компонентов (разложения, соединения) и так далее, рассматриваются реакции, протекающие в двух взаимных направлениях, иначе, называемых
Реакции обмена между растворами солей, в процессе которых образуются либо нерастворимый осадок – СаСО3:
Са(ОН)2 + К2СО3 → СаСО3↓ + 2КОН (1)
либо газообразное вещество – СО2:
3 К2СО3 + 2Н3РО 4 →2К3РО4 + 3СО2↑ + 3Н2О (2)
или получается малодиссоциируемое вещество – Н2О:
2NaOH + H2SO4 → Na2SO4 + 2H2O (3)
Если рассматривать обратимую реакцию, то она протекает не только в прямом (в реакциях 1,2,3 слева направо), но и в обратном направлении. Примером такой реакции является синтез аммиака из газообразных веществ — водорода и азота:
Примером такой реакции является синтез аммиака из газообразных веществ — водорода и азота:
3H2 + N2 ↔ 2NH3 (4)
Таким образом, химическая реакция называется обратимой, если она протекает не только в прямом(→) , но и в обратном направлении (←) и обозначается символом (↔).
Главной особенностью данного типа реакций является то, что из исходных веществ образуются продукты реакции, но и одновременно из этих же продуктов, обратно, образуются исходные реагенты. Если рассматривать реакцию (4), то в относительную единицу времени одновременно с образованием двух молей аммиака будет происходить их распад с образованием трёх молей водорода и одного моля азота. Обозначим скорость прямой реакции (4) символом V1 тогда выражение этой скорости примет вид:
V1 = kˑ [Н2]3ˑ [N2] , (5)
где величина «k» определяется как константа скорости данной реакции, величины [Н2]3 и [N2] соответствуют концентрациям исходных веществ, возведённых в степени, соответствующие коэффициентам в уравнении реакции.
V2 = kˑ [NН3]2 (6)
В начальный момент времени скорость прямой реакции принимает наибольшее значение. Но постепенно концентрации исходных реагентов уменьшаются и скорость реакции замедляется. Одновременно скорость обратной реакции начинает возрастать. Когда скорости прямой и обратной реакции становятся одинаковыми (V1 = V2) , наступает состояние равновесия, при котором уже не происходит изменения концентраций как исходных, так и образующихся реагентов.
Следует отметить, что некоторые необратимые реакции не следует понимать в буквальном смысле слова. Приведём пример наиболее часто приводимой реакции взаимодействия металла с кислотой, в частности, цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2 ↑ (7)
В действительности, цинк, растворяясь в кислоте, образует соль: хлорид цинка и газообразный водород, но по истечении некоторого времени скорость прямой реакции замедляется, поскольку увеличивается концентрация соли в растворе. Когда реакция практически прекращается, в растворе наряду с хлоридом цинка будет присутствовать некоторое количество соляной кислоты, поэтому реакцию (7) следует приводить в следующем виде:
Когда реакция практически прекращается, в растворе наряду с хлоридом цинка будет присутствовать некоторое количество соляной кислоты, поэтому реакцию (7) следует приводить в следующем виде:
2Zn + 2HCl = 2ZnНCl + H2 ↑ (8)
Или в случае образования нерастворимого осадка, получаемого при сливании растворов Na2SO4 и BaCl2:
Na 2SO4 + BaCl2 = BaSO4↓ + 2NaCl (9)
осажденная соль BaSO4 пусть и в малой степени, но будет диссоциировать на ионы:
BaSO4 ↔ Ba2+ + SO42- (10)
Поэтому понятия необратимой и необратимой реакций является относительным. Но тем не менее, и в природе и в практической деятельности людей данные реакции имеют большое значение. К примеру, процессы горения углеводородов или более сложных органических веществ, например спирта:
К примеру, процессы горения углеводородов или более сложных органических веществ, например спирта:
СН4 + О2 = СО2 + Н2О (11)
2С2Н5ОН + 5О2 = 4СО
являются процессами абсолютно необратимыми. Было бы считать счастливой мечтой человечества, если бы реакции (11) и (12) были бы обратимыми! Тогда бы можно было из СО2 и Н2О опять синтезировать и газ и бензин и спирт! С другой стороны, обратимые реакции, такие как (4) или окисление сернистого газа:
SO2 + O2 ↔ SO3 (13)
являются основными в производстве солей аммония, азотной кислоты, серной кислоты и др. как неорганических, так и органических соединений. Но данные реакции являются обратимыми! И чтобы получать конечные продукты: NH3 или SO3 необходимо использовать такие технологические приёмы, как: изменение концентраций реагентов, изменение давления, повышение или понижение температуры. Но это уже будет являться предметом следующей темы: «Смещение химического равновесия».
Но данные реакции являются обратимыми! И чтобы получать конечные продукты: NH3 или SO3 необходимо использовать такие технологические приёмы, как: изменение концентраций реагентов, изменение давления, повышение или понижение температуры. Но это уже будет являться предметом следующей темы: «Смещение химического равновесия».
Если вы хотите записаться на урок к автору этой статьи, переходите в его профиль:https://www.tutoronline.ru/profile?id=46923
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Что такое обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Что такое обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
| Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении: |
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
| Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄): |
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено.
После прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Принцип Ле Шателье
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т. е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
N2-plus-3h3-tuda-suda-2Nh4-plus-Q-2
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т. е. в сторону прямой реакции.
е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
Открыть структуру Основ химии — теория химии. Базовые понятия химии как науки, основные определения и термины описывающие химические реакции и процессы. Для удобства структурная теоретическая таблица разбита на блоки: основы химии, НЕОРГАНИЧЕСКАЯ химия, ОРГАНИЧЕСКАЯ химия, МЕТОДЫ ПОЗНАНИЯ в химии. ХИМИЯ И ЖИЗНЬ. Каждый блок поделен на разделы. Полезные материалы для подготовки к сдаче теоретических основам химии, в материалах рассматриваются: строение атома, строение электронных оболочек, химические связи, строение веществ, химическая реакции.
Базовые понятия химии как науки, основные определения и термины описывающие химические реакции и процессы. Для удобства структурная теоретическая таблица разбита на блоки: основы химии, НЕОРГАНИЧЕСКАЯ химия, ОРГАНИЧЕСКАЯ химия, МЕТОДЫ ПОЗНАНИЯ в химии. ХИМИЯ И ЖИЗНЬ. Каждый блок поделен на разделы. Полезные материалы для подготовки к сдаче теоретических основам химии, в материалах рассматриваются: строение атома, строение электронных оболочек, химические связи, строение веществ, химическая реакции.
Основные разделы теоретических основ химии
Прочитайте отдельно разделы: теоретические основы, НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, МЕТОДЫ ПОЗНАНИЯ В ХИМИИ, ХИМИЯ И ЖИЗНЬ
Волшебница Химия: НЕОБРАТИМЫЕ И ОБРАТИМЫЕ РЕАКЦИИ
Химические реакции заключаются во
взаимодействии реагентов с образованием продуктов реакции. Не следует,
однако, полагать, что направление химической реакции только одно. В
действительности, химические реакции протекают и в прямом, и в обратном
направлениях:
В
действительности, химические реакции протекают и в прямом, и в обратном
направлениях:
| Реагенты Продукты |
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как
взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле
различие между реагентами и продуктами условное. Направление протекания
химической реакции определяется условиями ее проведения (температурой,
давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для
проведения таких реакций в противоположном направлении требуются
экстремальные условия. В подобных реакциях происходит почти полное
превращение реагентов в продукты.
Пример. Железо и сера при умеренном
нагревании реагируют между собой с образованием сульфида железа (II),
FeS при таких условиях устойчив и практически не разлагается на железо и
серу:
| Fe + S FeS |
Пример.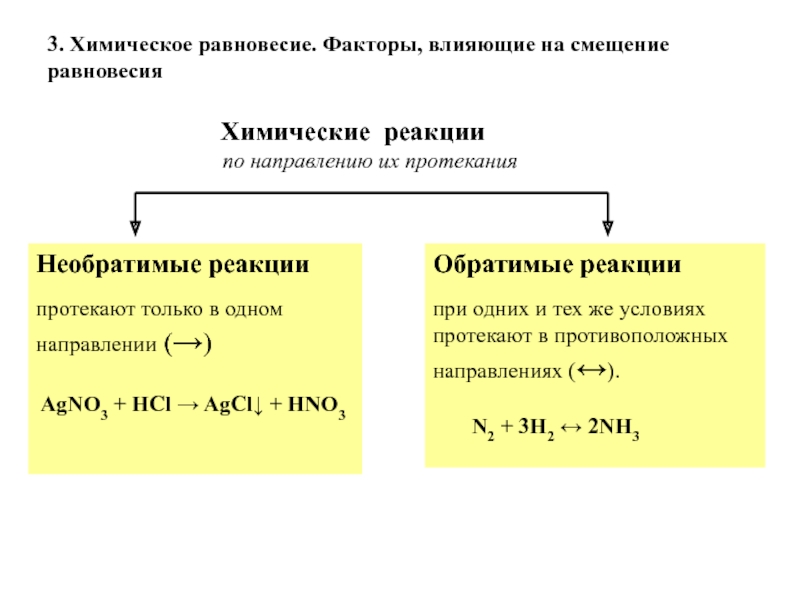 Реакция синтеза аммиака является обратимой:
Реакция синтеза аммиака является обратимой:
| N2 + 3H2 2NH3 |
При 200 атм и 400 С достигается максимальное и
равное 36% (по объему) содержание Nh4 в реакционной смеси. При
дальнейшем повышении температуры вследствие усиленного протекания
обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
Урок 49/2. Обратимые и необратимые реакции.
 Химическое равновесие и способы его смещения | Поурочные планы по химии 8 класс
Химическое равновесие и способы его смещения | Поурочные планы по химии 8 классУрок 49/2. Обратимые и необратимые реакции. Химическое равновесие и способы его смещения
15.06.2013 6464 0Цель: сформировать у учащихся понятие об обратимых и необратимых реакциях,
познакомить с правилом Бертолле, принципом Ле-Шателье.
Оборудование: соляная кислота, фенолфталеин, гидроксид натрия, карбонат натрия.
нитрат серебра, вода, лакмус, мрамор, соляная кислота, прибор для
получения газов, штатив, 5 пробирок.
Ход урока
I. Проверка домашнего задания.
а) Опрос.
— Скорость химической реакции.
-Факторы.
влияющие на скорость реакции.
— Катализаторы, ферменты.
б) Фронтальное решение вопросов после §29.
II. Изучение нового материала.
Химические реакции часто протекают так, что исходные вещества полностью превращаются в конечные продукты. Например, при горении веществ получаются оксиды, исходное вещество полностью сгорает. (Демонстрационный опыт «Горение магния».) Такие реакции являются необратимыми.
Гомогенные реакции являются необратимыми в случаях образования
а) газа; б) осадка; в) воды.
Для примера, демонстрации:
а) взаимодействие карбоната натрия с серной кислотой;
б) хлорид бария с серной кислотой;
в) гидроксид натрия с серной кислотой.
Многие реакции обратимы. Это
значит, что продукты, образовавшиеся в ходе реакции, вновь превращаются в
исходные вещества, то есть реакция одновременно идет в прямом и обратном
направлениях.
Состояние, когда скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Принцип Ле-Шателье (1885 г.): при действии на систему, находящуюся в химическом равновесии внешних факторов, ее равновесие смещается так, чтобы подавить действие этих факторов.
III. Закрепление.
1. Какие условия нужны для полного сгорания угля печи по реакции:
С + СО2 ÛСО + Q
Какова роль дымовой трубы, колосниковой решетки?
2. Каким образом можно сдвинуть химическое равновесие реакции:
2SO2 + О2 Û2SO3 + Q в сторону образования оксида серы (VI)?
3. Почему в темноте фотосинтез у растений прекращается? Какая реакция обратна
фотосинтезу?
IV. Домашнее задание: §32, 33; стр.135, упр.3, 4.
Примеры реакций в жизни и в быту. Реакции по направлению процесса
1.
 Примеры реакций в жизни и в быту Реакции по направлению процессаЯковлева Анастасия 9П-11
Примеры реакций в жизни и в быту Реакции по направлению процессаЯковлева Анастасия 9П-112. Обратимые и необратимые химические реакции Обратимые реакции :
Обратимые реакции — химические реакции, протекающие одновременно в двухпротивоположных направлениях (прямом и обратном), например:
3h3 + N2 ⇆ 2Nh4
Направление обратимых реакций зависит от концентраций веществ — участников
реакции. По завершении обратимой реакции, т. е. при достижении химического
равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих
одновременно элементарных реакций, которые отличаются одна от другой лишь
направлением химического превращения. Направление доступной непосредственному
наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных
реакций имеет большую скорость. Например, простая реакция
N2O4 ⇆ 2NO2
складывается из элементарных реакций
N2O4 ⇆ 2NO2 и 2NO2 ⇆ N2O4
Для обратимости сложной (многостадийной) реакции, необходимо, чтобы были
обратимы все составляющие её стадии.
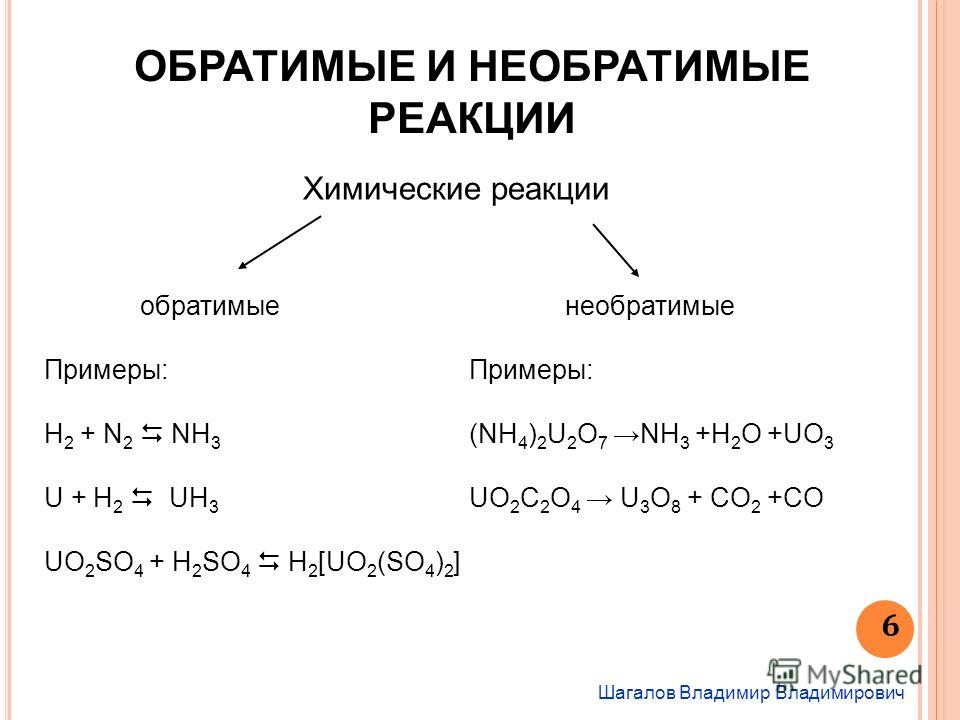
Для обратимых реакций уравнение принято записывать следующим образом А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же
условиях одновременно протекает как прямая, так и обратная реакция, например
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О
3. Пример обратимой реакции
4. Необратимые химические реакции
Необратимыми называют такие химические процессы,продукты которых не способны реагировать друг с другом с
образованием исходных веществ. Примерами необратимых
реакций может служить разложение бертолетовой соли при
нагревании
2КСlО3 > 2КСl + ЗО2,
Необратимыми называются такие реакции, при протекании
которых:
1) образующиеся продукты уходят из сферы реакции выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + h3O
2) образуется малодиссоциированное соединение, например
вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии,
например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
Необратимые реакции — Энциклопедия по машиностроению XXL
Реакции бывают обратимыми и необратимыми. Необратимая реакция протекает только в одном направлении, обратимая — как в одном, так и в противоположном направлениях.
[c.54]
Необратимая реакция протекает только в одном направлении, обратимая — как в одном, так и в противоположном направлениях.
[c.54]Таким образом, вместо системы двух уравнений второго порядка достаточно решить одно уравнение сохранения энергии, которое для необратимой реакции первого порядка, следующей закону Аррениуса, имеет вид [c.353]
В случае недостаточного подвода сульфат-ионов в реакционную зону (например, при наличии большого отрицательного заряда поверхности электрода или низкой концентрации этих ионов) наряду с необратимой реакцией (149) или вместо нее может протекать другая необратимая реакция, например [901 [c.112]
Два закона термодинамики означают существование двух функций состояния рассматриваемой системы ее внутренней энергии и энтропии. Исходя из свойств некомпенсированной теплоты, я в 1922 г. установил существование еще одной функции состояния, связанной с физикохимическими изменениями, а именно сродства А.
 Чтобы получить этот результат, я ввожу понятие координаты химической реакции проходящей в закрытой системе, а также необходимые и достаточные условия, чтобы функция А оставалась постоянной, если меняется тип превращения. Этот метод дает возможность непосредственно использовать классические теоремы термодинамики для необратимых реакций в системе и выявляет роль, которую играет скорость реакции d ldt.
[c.14]
Чтобы получить этот результат, я ввожу понятие координаты химической реакции проходящей в закрытой системе, а также необходимые и достаточные условия, чтобы функция А оставалась постоянной, если меняется тип превращения. Этот метод дает возможность непосредственно использовать классические теоремы термодинамики для необратимых реакций в системе и выявляет роль, которую играет скорость реакции d ldt.
[c.14]До сих пор мы рассматривали необратимые реакции. Введем в 1 хшу (2.53) обратные реакции [c.56]
ОДНОЙ НЕОБРАТИМОЙ РЕАКЦИИ [c.314]
Рассмотрим тепловое взаимодействие потока с однородным телом, на поверхности которого протекает одна необратимая реакция типа [c.314]
V. Тепло выделяется в результате необратимой реакции первого порядка. В этом случае, допуская, что скорость реакции не зависит от температуры, можно считать, что количество тепла, выделяющегося в единицу времени, равно КАС, где А — постоянная, а С — концентрация диффундирующего вещества. Последняя определяется дифференциальным уравнением
[c.400]
Последняя определяется дифференциальным уравнением
[c.400]
Недостижимость абсолютного нуля температуры 7, 90 Неидеальные растворы 192 Ненасыщенный пар 173 Необратимое смешение 128 Необратимые реакции 189 [c.334]
Реакция может быть химически обратимой, если она идет как в прямом, так и в обратном направлении. При горении топлива скорость прямого процесса несоизмеримо больше скорости обратного процесса, поэтому горение топлива практически сопровождается химически необратимыми реакциями. [c.98]
Если отказаться от условий (2.3), то появится также остаточная компонента деформаций и уравнениями (2.2) можно будет описывать также необратимую реакцию (ползучесть). [c.371]
Реакции образования окислов азота из элементов в диапазоне 298—2000° К в действительности являются необратимыми реакциями диссоциации окислов на элементы. [c.298]
Температура равновесия необратимых реакций
[c. 360]
360]
Понятие о необратимых реакциях весьма, условно. С термодинамических позиций следует признать, что необратимых реакций нет. Есть реакции, равновесие которых сильно сдвинуто в сторону необычно высоких (или, наоборот, низких) температур или давлений. [c.360]
Наиболее простым для изучения объектом является скорость гомогенных необратимых реакций, так как в этом случае все молекулы реагирующих веществ находятся в одинаковых условиях (одна фаза) и реакция может развиваться только в одном направлении. Поэтому обычно стараются свести решение задачи к этому случаю, так как иначе получаются уравнения скорости, решаемые в отдельных частных случаях. [c.235]
НЕОБРАТИМЫЕ РЕАКЦИИ — химические процессы, протекающие практически до полного превращения исходных веществ в конечные продукты реакции (ср. Обратимые реакции). [c.89]
ОБРАТИМЫЕ РЕАКЦИИ — химические превращения, в которых продукты взаимодействия исходных веществ (прямая реакция), реагируя друг с другом, снова образуют исходные вещества (обратная реакция). В результате система приходит в состояние химического равновесия, характеризующегося равенством скоростей прямой и обратной реакций. При этом концентрации участвующих в обратимой реакции веществ нри неизменных условиях остаются постоянными сколь угодно долгое время. Теоретически все химические реакции являются обратимыми, однако во многих случаях скорость обратного процесса весьма мала и в целом реакция практически необратима (см. Необратимые реакции).
[c.92]
В результате система приходит в состояние химического равновесия, характеризующегося равенством скоростей прямой и обратной реакций. При этом концентрации участвующих в обратимой реакции веществ нри неизменных условиях остаются постоянными сколь угодно долгое время. Теоретически все химические реакции являются обратимыми, однако во многих случаях скорость обратного процесса весьма мала и в целом реакция практически необратима (см. Необратимые реакции).
[c.92]
Если же учесть необратимые химические реакции, возникающие в образцах из СиО с цинковыми электродами в процессе термообработки, и реакции, возникающие в полупроводящем веществе и у электродов этих термисторов в рабочих условиях, то экспериментальному значению энергии активации можно дать теоретическое объяснение. Действительно, согласно данным Менделеева [4], цинк при нагреве легко окисляется и обладает способностью восстанавливать медь, окисел цинка плавится при 1975° без разложения. Следовательно, в процессе отжига образцов из СиО с цинковыми электродами у их контактов возникают необратимые реакции
[c. 217]
217]
За осно ву действия кислородомера МЭИ принята необратимая реакция взаимодействия растворенного в воде кислорода с вводимой извне окисью азота, в результате чего происходит изменение электропроводности раствора. Окись азота быстро и полно взаимодействует с растворенным в воде кислородом с образованием азотистой кислоты и не вступает в реакцию с водой и ее (примесями. В результате реакции электропроводность раствора увеличивается пропорциональ- [c.160]
Что касается термокинетических колебаний при горемйй угольных частиц, то они были замечены в экспериментах Б. Д. Кацнельсона при горении угольных частиц, падающих в атмосфере, содержащей окислитель. Количественное сравнение экспериментальных и теоретических данных не представляется возможным, однако отмеченные Кацнельсо-ном термокпнетические колебания можно объяснить тем, что характерные времена гомогенных и гетерогенных экзотермических Необратимых реакций значительно меньше характерного аэродинамического времени, которое по порядку величин совпадает с временем тепловой релаксации в пограничном слое (см. 5.4 и 7.8).
[c.423]
5.4 и 7.8).
[c.423]
В ЭТО сложное уравнение объединены четыре самостоятельные реакции, тесно связанные одна с другой. Реакция (1) представляет собой термический распад ионов бикарбоната и ею определяется образование накипи. До осаждения кристалла накипи СаСОз или Mg(OH)o должен произойти термический распад двух ионов бикарбоната. В условиях работы испарителя морской воды — это необратимая реакция, так как освобождающийся СО2 уходит вместе с паром. Скорость термического распада возрастает с повышением температуры. Протекание реакции (2) зависит от произведения растворимости СаСОз и для его осаждения в накипь эта величина должна быть превышена, т. е. [Са++]х[СОз—] должно быть больше произведения растворимости. Точно так же протекание реакции (3) зависит от произведения растворимости Mg (ОН) 2, а произведение [Mg++]X Х[0Н ]2 должно быть больше произведения растворимости Mg (ОН) 2 в концентрированном рассоле до начала осаждения. [c.81]
S-состояниях термодинамического равновесия Ч Для необратимой реакции это означает, что если в G- или 5-состояниях Шок имеет конечную величину, то т оп здесь должно быть равно нулю и, наоборот, для конечных значений Штоп должно быть /тгок= 0. Рассмотрим только несколько вероятных следствий этого допущения.
[c.77]
Рассмотрим только несколько вероятных следствий этого допущения.
[c.77]
Вязкое тело относится к системам с последействием (с нулевой мгновенной реакцией) и с полной необратимой реакцией в этом случае в уравнениях (1.1) Aijmn = ij = 0. При этом естественно считать Вц обычными функциями ац, Zij и Т. В простейшем случае, когда В,, представляют собой линейные функции Oij, получается классическая модель вязкой жидкости. [c.13]
В слое, образованном в системе Ре—Рез04—РегОз — электролит протекает необратимая реакция Ре-1-4Ре20зЗРез04. Принимается, что скорость коррозии лимитируется при этом скоростью растворения Рез04 [295]. [c.105]
Вязкое тело относится к системам с последействием (с нулевой мгновенной реакцией) и с необратимой реакцией при этом в уравнениях (2.1) Aijmn — ij = 0. При ЭТОМ естественно считать B j обычными функциями uij, ij и Г.
 В простейшем случае, когда Bij представляют собой линейные функции Gij, получается классическая модель вязкой жидкости.
[c.370]
В простейшем случае, когда Bij представляют собой линейные функции Gij, получается классическая модель вязкой жидкости.
[c.370]Онсагер (Onaager) Ларе (1903-1976) — американский физик и химик, один из создателей термодинамики неравновесных процессов. Окончил Норвежскую высшую техническую школу (1925 г.), с 1928 г. жил в США работал в Йельском университете и университете в Майами. Установил в 1931 г. одну из основных теорем термодинамики неравновесных процессов и свойство симметрии кинетических коэффициентов (теорема Онсаге ра), разработал теорию термодинамических свойств плоской решетки (теория Онсагера), открыл необратимую реакцию (реакция Онсагера) в термодинамике необратимых ироцессов (Нобелевская премия по химии, 1968 г.). [c.286]
Высокое абсолютное значение константы равновесия говорит о практической необратимости реакции, а положительный знак для lgKp свидетельствует о самопроизвольном течении процесса в сторону образования паров воды до получения исчезающе малых парциальных давлений водорода и кислорода. [c.360]
[c.360]
КИНЕТИКА ХИМИЧЕСКАЯ, отрасль тео-ретич. химии, изучающая скорости химич. реакций. В основе опытной методики этого изучения лежит определение концентрации прореагировавшего либо появляющегося вещества в функциональной зависимости от времени. Различают кинетику о б-ратимых и необратимых реакций. К необратимым относятся те реакции, к-рые практически протекают лишь в одном направлении это имеет место в случаях, когда продукты, к-рые образовались в результате химич. процесса, удаляются из сферы реак -ции и тем самым лишаются возможности обратного взаимодействия или когда обратная реакция протекает лишь с незначительной скоростью. В случае обратимых реакций продукты вступают между собой во взаимодействие, давая исходные вещества прн [c.85]
Вернемся теперь к ядру релаксации, основанному на анализе кинетики процесса взаимодействия релаксаторов и перехода их в нерелаксирующий материал. Ядро (270) получено при условии, что процесс взаимодействия релаксаторов представляет собой односторонгоою необратимую реакцию и-го порядка, т. е, считается, что провзаимодействующие релаксаторы переходят в
[c.301]
е, считается, что провзаимодействующие релаксаторы переходят в
[c.301]
Рассмотренная здесь необратимая реакция сплошной среды полностью описывается уравнениями (6.84) и (6.80). Эти определяющие уравнения были установлены Гогенем-зером и Прагером [16] (см. также Прагер [27], стр. 138). Для их обращения будем исходить из (6.80) и вычислим инвариант [c.114]
Дополнительным важным свойством рассматриваемой модели является влияние обратной реакции на интерпретацию измеряемых времен затухания и т . Если реакция обратима, времена затухания зависят от четырех кинетических констант — Гр, и 8 противоположность этому в случае необратимой реакции ( 2 = 0) из уравнения (12.14) находим т = и = Гр + Для = О измеренные значения времен затухания представляют собой собственное время жизни состояния, образовавшегося в результате реакции (т ), и время жизни первоначально возбужденного состояния (Тр). На затухание флуоресценции из состояния Р обратимость реакции также оказывает влияние. Когда к 4 О, затухание флуоресценции из состояния Р двухэкспоиенциально [уравнение (12.12)]. Однако, когда к — О, из уравнения (12.14) находим, что а из уравнения (12.15) а (у) = О, В отсутствие обратной реакции затухание флуоресценции из состояпия Р становится одноэкспоненциальным.
[c.396]
Когда к 4 О, затухание флуоресценции из состояния Р двухэкспоиенциально [уравнение (12.12)]. Однако, когда к — О, из уравнения (12.14) находим, что а из уравнения (12.15) а (у) = О, В отсутствие обратной реакции затухание флуоресценции из состояпия Р становится одноэкспоненциальным.
[c.396]
Диссоциация 2-нафтола в возбужденном состоянии — поучительный пример обратимой реокции с участием двух состояний. При возбуждении нафтола уменьшается от 9,2 в основном состоянии до 2,0 в возбужденном состоянии [3]. В кислом растворе наблюдается испускание нафтола с максимумом 357 пм (рис. 12.3, кривая V), а в щелочном — испускание нафтолят-аниопа, центр которого находится при 409 нм (кривая 2). При промежуточных значениях рИ испускают оба вида частиц. Из рассмотрения спектров видно, что при 350 нм испускание обусловлено только нафтолом, что как раз и требуется для использования процедуры обратной свертки при различных длинах воли. Реакция диссоциации нафтола в зависимости от pH может быть либо обратимой, либо необратимой. При значениях pH, близких к 3, реакция обратима, а при рИ > 6 необратима [ 15]. Следовательно, эта система пригодна для демонстрации характеристик как обратимых, так и необратимых реакций.
[c.400]
При значениях pH, близких к 3, реакция обратима, а при рИ > 6 необратима [ 15]. Следовательно, эта система пригодна для демонстрации характеристик как обратимых, так и необратимых реакций.
[c.400]
Необратимый процесс – обзор
5 Липиды в CAC, AVC и MVC: патогенные эффекторы и потенциальные терапевтические мишени
Поскольку кальцификация является необратимым процессом, предотвращение или замедление его прогрессирования представляют собой основные цели будущих терапевтических планов. Гиперлипидемия, вероятно, оказывает как прямое, так и косвенное влияние на кальцификацию сосудов и модулирует активность как остеобластов, так и остеокластов [93,94]. Учитывая тесную взаимосвязь между липидами и кальцификацией сердечно-сосудистой системы, прием статинов, снижающих уровень липидов, который, как было показано, снижает смертность от сердечно-сосудистых заболеваний и другие неблагоприятные исходы, считается эффективной целью уменьшения кальцификации.
Тем не менее, в последние годы многие клинические результаты свидетельствуют об обратном эффекте, в основном о том, что статины могут способствовать кальцификации сосудов [20]. И это несмотря на то, что сохраняются условия, при которых кальцификация сосудов увеличивает смертность от сердечно-сосудистых заболеваний, а статины снижают смертность от сердечно-сосудистых заболеваний. Этот конфликт, по-видимому, разрешен благодаря наличию некоторых результатов, свидетельствующих о том, что статины могут положительно влиять на состав бляшек и/или что стимуляция кальцификации сама по себе представляет собой механизм положительного влияния статинов на смертность, в частности, в отношении образования связанные со статинами макроскопические отложения кальция, связанные со стабильностью бляшки [20,95].Этот последний момент важен, учитывая тот факт, что использование статинов не показало значительного влияния на клапанную кальцификацию или функциональность, особенно на средних стадиях заболевания [24,96].
Предполагалось, что статин, вероятно, оказывает двойное действие, которое, несомненно, включает противодействие прогрессированию атеросклеротического повреждения и увеличение макроскопических отложений кальция. Это происходит за счет плейотропных эффектов, в том числе антиоксидантных и противовоспалительных свойств, а также сохранения эндотелиальной функции и целостности.Более того, статины также могут оказывать стабилизирующее действие, усиливая поляризацию М2 макрофагов. Однако существует ли вероятность того, что те же пути фиброкальциноза, связанные со статинами, которые способны предотвращать острые события на сосудистом уровне, при более высоком риске, характеризующемся богатыми липидами бляшками и воспалением, могут способствовать и ускорять патологическое ремоделирование створок клапана? характеризуются костеподобными клетками и более минерализованы (рис. 4). В течение жизни клапанная кальцификация и атеросклероз прогрессируют медленно в течение длительного периода времени. На ранних стадиях обоих заболеваний, вероятно, начало повреждения и прогрессирование развиваются по сходным механизмам, включая рекрутирование лейкоцитов, эндотелиальную дисфункцию и воспаление. Однако по мере прогрессирования заболевания прогрессирующие атеросклеротические поражения характеризуются накоплением липидов с легкой минерализацией и большим накоплением пенистых клеток и воспалительной активностью, чем при кальцификации клапана. Эти результаты могут свидетельствовать о том, что, хотя ранние стадии прогрессирования заболевания сходны на клапанном и сосудистом уровне, состояния средней и поздней стадий сохраняют разные характеристики и развиваются по разным путям.Таким образом, пациентам с высоким риском развития атеросклероза или порока клапанов может быть полезно лечение статинами на ранних стадиях, но использование гиполипидемических и противовоспалительных статинов может быть неэффективным на поздних стадиях клапанной кальцификации. Это говорит о том, что конкретные целевые терапевтические подходы, вероятно, будут различаться по мере прогрессирования двух заболеваний.
На ранних стадиях обоих заболеваний, вероятно, начало повреждения и прогрессирование развиваются по сходным механизмам, включая рекрутирование лейкоцитов, эндотелиальную дисфункцию и воспаление. Однако по мере прогрессирования заболевания прогрессирующие атеросклеротические поражения характеризуются накоплением липидов с легкой минерализацией и большим накоплением пенистых клеток и воспалительной активностью, чем при кальцификации клапана. Эти результаты могут свидетельствовать о том, что, хотя ранние стадии прогрессирования заболевания сходны на клапанном и сосудистом уровне, состояния средней и поздней стадий сохраняют разные характеристики и развиваются по разным путям.Таким образом, пациентам с высоким риском развития атеросклероза или порока клапанов может быть полезно лечение статинами на ранних стадиях, но использование гиполипидемических и противовоспалительных статинов может быть неэффективным на поздних стадиях клапанной кальцификации. Это говорит о том, что конкретные целевые терапевтические подходы, вероятно, будут различаться по мере прогрессирования двух заболеваний. Важно отметить, что эти различия между клапанами и сосудами, связанные с фиброкальцинозным ремоделированием, могут обусловить просчет рисков и преимуществ терапевтической стратегии, такой как гиполипидемическая терапия.В частности, поскольку ИБС и АВК часто сосуществуют у одного и того же пациента, особенно с возрастом, длительное применение статинов может предотвратить острые коронарные и церебральные события, способствующие хронизации ИБС, но потенциально способствует прогрессированию от фиброза к кальцификации на клапанном уровне (рис. 4). ). Таким образом, в частности, в этой группе пациентов, в отсутствие (но в ожидании) доступных биохимических маркеров, КТ с кальцием остается наиболее надежным инструментом для оценки и отслеживания с течением времени нагрузки кальциевыми бляшками, а также прогрессирования кальция на клапанах также в первичной профилактике в дополнение к к оценке функциональности клапанов (ультразвуковая допплерография или магнитно-резонансная томография), к подходу к прецизионной медицине и лучшему медицинскому обслуживанию, ориентированному на пациента (рис.
Важно отметить, что эти различия между клапанами и сосудами, связанные с фиброкальцинозным ремоделированием, могут обусловить просчет рисков и преимуществ терапевтической стратегии, такой как гиполипидемическая терапия.В частности, поскольку ИБС и АВК часто сосуществуют у одного и того же пациента, особенно с возрастом, длительное применение статинов может предотвратить острые коронарные и церебральные события, способствующие хронизации ИБС, но потенциально способствует прогрессированию от фиброза к кальцификации на клапанном уровне (рис. 4). ). Таким образом, в частности, в этой группе пациентов, в отсутствие (но в ожидании) доступных биохимических маркеров, КТ с кальцием остается наиболее надежным инструментом для оценки и отслеживания с течением времени нагрузки кальциевыми бляшками, а также прогрессирования кальция на клапанах также в первичной профилактике в дополнение к к оценке функциональности клапанов (ультразвуковая допплерография или магнитно-резонансная томография), к подходу к прецизионной медицине и лучшему медицинскому обслуживанию, ориентированному на пациента (рис. 4).
4).
Рис. 4. Панель (A) возможных двойных эффектов статинов при прогрессировании заболеваний аорты и кальцификации клапанов. Панель (B) Бессимптомный 75-летний мужчина с сосуществующими коронарными и клапанными кальцификациями и принимающий статины. В этой группе пациентов, при отсутствии подтвержденных биохимических маркеров, бесконтрастный КТ-мониторинг кальция является основным инструментом для отслеживания во времени прогрессирования коронарного и клапанного кальция в двух анатомических областях для наилучшего ведения пациента.
В этом контексте известно, что липопротеин(а) (Lp(a)) усиливает окисление и несет прокальцифицирующие и провоспалительные факторы (например,g., oxPL, аутотаксин, провоспалительный фермент) в места повреждения эндотелия [97]. В частности, большинство oxPL переносятся Lp(a). Однонуклеотидный полиморфизм (SNP) в локусе LPA, кодирующем Lp(a) (rs10455872), показал полногеномное значение для наличия кальцификации и стеноза аортального клапана [98]. Это наблюдение было последовательно подтверждено в других исследованиях [99–101]. Более того, у пациентов с ранее существовавшим АВК высокий уровень Lp(a) является основным фактором более быстрого прогрессирования заболевания [102].Поскольку есть некоторые свидетельства того, что статины могут повышать уровни Lp(a) и oxPL/apoB, низкая эффективность статинов в улучшении состояния при стенозе аортального клапана может быть связана с этими эффектами [103]. Таким образом, в этих условиях возможно нацеливание на Lp(a) для терапевтического вмешательства [104].
Это наблюдение было последовательно подтверждено в других исследованиях [99–101]. Более того, у пациентов с ранее существовавшим АВК высокий уровень Lp(a) является основным фактором более быстрого прогрессирования заболевания [102].Поскольку есть некоторые свидетельства того, что статины могут повышать уровни Lp(a) и oxPL/apoB, низкая эффективность статинов в улучшении состояния при стенозе аортального клапана может быть связана с этими эффектами [103]. Таким образом, в этих условиях возможно нацеливание на Lp(a) для терапевтического вмешательства [104].
К сожалению, современные фармакологические средства для снижения Lp(a) очень ограничены, поскольку имеющиеся препараты обладают неопределенной эффективностью и не одобрены специально для снижения Lp(a). Некоторые доступные данные о снижающем эффекте никотиновой кислоты и ингибиторов PCSK9 (пропротеинконвертазы субтилизин/кексин типа 9) на уровни Lp(a) позволяют предположить, что эти препараты могут быть перспективными также в качестве терапевтических средств против стеноза аортального клапана [105,106]. Более того, в недавнем исследовании (испытание фазы I) антисмысловой олигонуклеотид, нацеленный на мРНК Аро(а), был способен снижать уровни Лп(а) и oxPL дозозависимым образом, что предполагает его возможное применение в качестве нового потенциального аддитивного терапевтического средства. для заболевания аортального клапана [107]. В любом случае, поскольку теперь у нас есть лекарства, чтобы проверить, эффективны ли эти препараты для снижения высоких уровней Lp(a), мы также можем проверить в ближайшем будущем, действительно ли снижение Lp(a) защищает или благотворно влияет на кальцификацию аортального клапана.
Более того, в недавнем исследовании (испытание фазы I) антисмысловой олигонуклеотид, нацеленный на мРНК Аро(а), был способен снижать уровни Лп(а) и oxPL дозозависимым образом, что предполагает его возможное применение в качестве нового потенциального аддитивного терапевтического средства. для заболевания аортального клапана [107]. В любом случае, поскольку теперь у нас есть лекарства, чтобы проверить, эффективны ли эти препараты для снижения высоких уровней Lp(a), мы также можем проверить в ближайшем будущем, действительно ли снижение Lp(a) защищает или благотворно влияет на кальцификацию аортального клапана.
Обратимая реакция: определение, условия и примеры
Что такое обратимая реакция
Обратимая реакция – это химическая реакция, в которой одновременно происходят превращение реагентов в продукты и превращение продуктов в реагенты. Следовательно, в обратимой реакции реагенты и продукты никогда не расходуются полностью, и реакция не завершается. Вместо этого реакция придет к равновесию, если концентрации реагентов и продуктов останутся постоянными. Примером обратимого процесса в нашей повседневной жизни является таяние льда в воду и замерзание воды в лед. [1-6] .
Примером обратимого процесса в нашей повседневной жизни является таяние льда в воду и замерзание воды в лед. [1-6] .
Общее уравнение обратимой реакции
Общая формула обратимой реакции выглядит следующим образом:
А + В ⇋ В + Г
Символ
Обозначение обратимой реакции — двойная стрелка: ⇋
Как работает обратимая реакция
В обратимой реакции молекулы в закрытой системе сталкиваются с энергиями, разрывая химические связи и образуя новые продукты.Однако продукты обладают высокой энергией, и их молекулы также сталкиваются, чтобы разорвать новые связи. В результате образуются новые связи, возвращающие реагенты.
Условия обратимой реакции
Условия обратимой реакции.
- Должна происходить в закрытой емкости
- Ни один из продуктов не должен образовывать осадок
Согласно принципу Ле Шателье обратимая реакция является самокорректирующейся. Предположим, что произошло изменение концентрации, температуры или давления. В этом случае система естественным образом сдвинется к равновесию.
Предположим, что произошло изменение концентрации, температуры или давления. В этом случае система естественным образом сдвинется к равновесию.
Примеры обратимых реакций
Вот несколько примеров обратимой реакции [3-6] .
1. Реакция между водородом (H 2 ) и йодом (I 2 ) с образованием йодистого водорода (HI).
H 2 (ж) + I 2 (ж) ⇋ 2 HI (ж)
2. Азот (N 2 ) реагирует с водородом (H 2 ) с образованием аммиака (NH 3 ).
N 2 (ж) + 3 H 2 (ж) ⇋ 2 NH 3 (ж)
3. Диоксид серы (SO 2 ) реагирует с кислородом (O 2 ) с образованием триоксида серы (SO 3 )
2 SO 2 (ж) + O 2 (ж) ⇋ 2 SO 3 (ж)
Прямая реакция экзотермическая, обратная реакция эндотермическая.
4. Белое твердое вещество хлорида аммония (NH 4 Cl) распадается на аммиак (NH 3 ) и хлороводород (HCl) при нагревании.
NH 4 Cl (т) ⇋ NH 3 (г) + HCl (г)
5. Синий гидратированный сульфат меди (CuSO 4 .5H 2 O) при нагревании превращается в белый безводный сульфат меди (CuSO 4 ).
CuSO 4 .5H 2 O (т) ⇋ CuSO 4 (т) + 5 H 2 O (г)
Прямая реакция эндотермическая, обратная экзотермическая.
Примеры обратимых реакцийОбратимая и необратимая реакция
Химическая реакция, при которой все реагенты превращаются в продукты, называется необратимой реакцией.В отличие от обратимой реакции необратимая реакция протекает только в одном направлении. Реакция завершена и обозначена одиночной стрелкой: →
Примером необратимой реакции является горение топлива, такого как этанол (C 2 H 5 OH), с образованием двуокиси углерода (CO 2 ) и воды (H 2 O).
C 2 H 5 OH (водн. ) + 3 O 2 (г) → 2 CO 2 (г) + 3 H 2 O (г)
) + 3 O 2 (г) → 2 CO 2 (г) + 3 H 2 O (г)
Каталожные номера
- Хим.libretexts.org
- Groups.chem.ubc.ca
- Bbc.co.uk
- Thoughtco.com
- Opentextbc.ca
- Canterbury.ac.nz
13.1 Химические равновесия – химия
Цели обучения
К концу этого раздела вы сможете:
- Описывать природу равновесных систем
- Объясните динамическую природу химического равновесия
Химическая реакция обычно записывается таким образом, что предполагает, что она протекает в одном направлении, в том направлении, в котором мы читаем, но все химические реакции обратимы, и как прямая, так и обратная реакция протекают в той или иной степени в зависимости от условий.В химическом равновесии прямая и обратная реакции протекают с одинаковой скоростью, а концентрации продуктов и реагентов остаются постоянными. Если мы проводим реакцию в закрытой системе, так что продукты не могут улетучиваться, мы часто обнаруживаем, что реакция не дает 100% выхода продуктов. Вместо этого некоторые реагенты остаются после того, как концентрации перестают изменяться. В этот момент, когда концентрации реагентов и продуктов больше не меняются, говорят, что реакция находится в равновесии.Смесь реагентов и продуктов находится в равновесии.
Если мы проводим реакцию в закрытой системе, так что продукты не могут улетучиваться, мы часто обнаруживаем, что реакция не дает 100% выхода продуктов. Вместо этого некоторые реагенты остаются после того, как концентрации перестают изменяться. В этот момент, когда концентрации реагентов и продуктов больше не меняются, говорят, что реакция находится в равновесии.Смесь реагентов и продуктов находится в равновесии.
Например, когда мы помещаем образец тетраоксида диазота (N 2 O 4 , бесцветный газ) в стеклянную трубку, он образует диоксид азота (NO 2 , коричневый газ) по реакции
[латекс]\текст{N}_2\текст{O}_4(г)\;{\rightleftharpoons}\;2\текст{NO}_2(г)[/латекс]
Цвет становится темнее, когда N 2 O 4 преобразуется в NO 2 . Когда система достигает равновесия, присутствуют как N 2 O 4 , так и NO 2 (рис. 1).
Рисунок 1. Смесь NO 2 и N 2 O 4 движется к равновесию. Бесцветный N 2 O 4 реагирует с образованием коричневого NO 2 . По мере приближения реакции к равновесию цвет смеси темнеет из-за увеличения концентрации NO 2 .
Бесцветный N 2 O 4 реагирует с образованием коричневого NO 2 . По мере приближения реакции к равновесию цвет смеси темнеет из-за увеличения концентрации NO 2 . Образование NO 2 из N 2 O 4 представляет собой обратимую реакцию , которая обозначена стрелкой равновесия (⇌).Все реакции обратимы, но многие реакции для всех практических целей протекают в одном направлении до тех пор, пока не будут исчерпаны реагенты, и обратятся только при определенных условиях. Такие реакции часто изображаются стрелкой в одну сторону от реагентов к продуктам. Многие другие реакции, такие как образование NO 2 из N 2 O 4 , являются обратимыми в более легко достижимых условиях и поэтому называются так. В обратимой реакции реагенты могут объединяться с образованием продуктов, а продукты могут реагировать с образованием реагентов.Таким образом, не только N 2 O 4 может разлагаться с образованием NO 2 , но и полученный NO 2 может реагировать с образованием N 2 O 4 . Как только прямая реакция дает NO 2 , начинается обратная реакция и NO 2 начинает реагировать с образованием N 2 O 4 . При равновесии концентрации N 2 O 4 и NO 2 уже не изменяются, поскольку скорость образования NO 2 в точности равна скорости потребления NO 2 , а скорость образования образование N 2 O 4 в точности равно скорости потребления N 2 O 4 . Химическое равновесие — это динамический процесс : Как и в случае с пловцами и загорающими, количество каждого из них остается постоянным, но между ними существует движение вперед и назад (рис. 2).
Как только прямая реакция дает NO 2 , начинается обратная реакция и NO 2 начинает реагировать с образованием N 2 O 4 . При равновесии концентрации N 2 O 4 и NO 2 уже не изменяются, поскольку скорость образования NO 2 в точности равна скорости потребления NO 2 , а скорость образования образование N 2 O 4 в точности равно скорости потребления N 2 O 4 . Химическое равновесие — это динамический процесс : Как и в случае с пловцами и загорающими, количество каждого из них остается постоянным, но между ними существует движение вперед и назад (рис. 2).

В химическом равновесии прямая и обратная реакции не прекращаются, а продолжают протекать с одинаковой скоростью, что приводит к постоянным концентрациям реагентов и продуктов. Графики, показывающие изменение скорости реакции и концентрации во времени, показаны на рисунке 1.
Мы можем обнаружить состояние равновесия, потому что концентрации реагентов и продуктов не меняются. Однако важно убедиться, что отсутствие изменений связано с равновесием, а не со скоростью реакции, которая настолько мала, что изменения концентрации трудно обнаружить.
Мы используем двойную стрелку при написании уравнения обратимой реакции. Такая реакция может быть, а может и не быть равновесной. Например, на рисунке 1 показана реакция:
[латекс]\текст{N}_2\текст{O}_4(г)\;{\rightleftharpoons}\;2\текст{NO}_2(г)[/латекс]
Когда мы хотим говорить об одном конкретном компоненте обратимой реакции, мы используем одну стрелку. Например, в равновесии, показанном на рис. 1, скорость прямой реакции составляет
[латекс] 2 \ текст {NO} _2 (г) \; {\ longrightarrow} \; \ текст {N} _2 \ текст {O} _4 (г) [/латекс]
равно скорости обратной реакции
[латекс]\текст{N}_2\текст{O}_4(г)\;{\longrightarrow}\;2\текст{NO}_2(г)[/латекс]
Равновесие и безалкогольные напитки
Связь между химией и газированными безалкогольными напитками восходит к 1767 году, когда Джозеф Пристли (1733–1804; в основном известный сегодня своей ролью в открытии и идентификации кислорода) открыл метод насыщения воды углекислым газом для получения газированной воды. В 1772 году Пристли опубликовал статью под названием «Пропитывание воды неподвижным воздухом». В статье описано капание купоросного масла (сегодня мы называем это серной кислотой, но какой отличный способ описать серную кислоту: «купоросное масло» буквально означает «жидкая мерзость») на мел (карбонат кальция). Образовавшийся СО 2 падает в емкость с водой под сосудом, в котором протекает первоначальная реакция; перемешивание помогает газообразному CO 2 смешиваться с жидкой водой.
В 1772 году Пристли опубликовал статью под названием «Пропитывание воды неподвижным воздухом». В статье описано капание купоросного масла (сегодня мы называем это серной кислотой, но какой отличный способ описать серную кислоту: «купоросное масло» буквально означает «жидкая мерзость») на мел (карбонат кальция). Образовавшийся СО 2 падает в емкость с водой под сосудом, в котором протекает первоначальная реакция; перемешивание помогает газообразному CO 2 смешиваться с жидкой водой.
[латекс]\text{H}_2\text{SO}_4(l)\;+\;\text{CaCO}_3(s)\;{\longrightarrow}\;\text{CO}_2(g) \;+\;\text{H}_2\text{O}(l)\;+\;\text{CaSO}_4(водн.)[/latex]
Углекислый газ мало растворим в воде.{+}(водный)[/латекс]
Сегодня CO 2 можно нагнетать в безалкогольные напитки, устанавливая равновесие, показанное выше. Однако как только вы открываете контейнер с напитком, происходит каскад сдвигов равновесия. Во-первых, газ CO 2 в воздушном пространстве над бутылкой выходит, вызывая сдвиг равновесия между газофазным CO 2 и растворенным или водным CO 2 , снижая концентрацию CO 2 в безалкогольный напиток. Меньшее количество CO 2 , растворенного в жидкости, приводит к разложению угольной кислоты на растворенные CO 2 и H 2 O.Пониженная концентрация угольной кислоты вызывает сдвиг конечного равновесия. Пока безалкогольный напиток находится в открытом контейнере, CO 2 пузырится из напитка, высвобождая газ в воздух (рис. 3). Когда бутылка закрыта, реакции CO 2 больше не находятся в равновесии и будут продолжаться до тех пор, пока не останется реагентов. В результате получается безалкогольный напиток со значительно более низкой концентрацией CO 2 , который часто называют «плоским».
Меньшее количество CO 2 , растворенного в жидкости, приводит к разложению угольной кислоты на растворенные CO 2 и H 2 O.Пониженная концентрация угольной кислоты вызывает сдвиг конечного равновесия. Пока безалкогольный напиток находится в открытом контейнере, CO 2 пузырится из напитка, высвобождая газ в воздух (рис. 3). Когда бутылка закрыта, реакции CO 2 больше не находятся в равновесии и будут продолжаться до тех пор, пока не останется реагентов. В результате получается безалкогольный напиток со значительно более низкой концентрацией CO 2 , который часто называют «плоским».
Рассмотрим испарение брома как второй пример системы, находящейся в равновесии.
[латекс]\text{Br}_2(l)\;{\rightleftharpoons}\;\text{Br}_2(g)[/latex]
Равновесие может быть установлено как для физических изменений, таких как переход жидкости в газ, так и для химических реакций. На рис. 4 показан образец жидкого брома, находящегося в равновесии с парами брома в закрытом контейнере.Когда мы наливаем жидкий бром в пустую бутылку, в которой нет паров брома, часть жидкости испаряется, количество жидкости уменьшается, а количество пара увеличивается. Если мы закроем бутылку, чтобы пар не выходил наружу, количество жидкости и пара в конце концов перестанет изменяться, и установится равновесие между жидкостью и паром. Если бы бутылка не была закрыта крышкой, пары брома улетучились бы, и равновесие не было бы достигнуто.
На рис. 4 показан образец жидкого брома, находящегося в равновесии с парами брома в закрытом контейнере.Когда мы наливаем жидкий бром в пустую бутылку, в которой нет паров брома, часть жидкости испаряется, количество жидкости уменьшается, а количество пара увеличивается. Если мы закроем бутылку, чтобы пар не выходил наружу, количество жидкости и пара в конце концов перестанет изменяться, и установится равновесие между жидкостью и паром. Если бы бутылка не была закрыта крышкой, пары брома улетучились бы, и равновесие не было бы достигнуто.
Реакция находится в равновесии, когда количества реагентов или продуктов больше не меняются. Химическое равновесие — это динамический процесс, означающий, что скорость образования продуктов прямой реакции равна скорости, с которой продукты преобразуются в реагенты обратной реакцией.
Химия Упражнения в конце главы
- Что означает описание реакции как «обратимой»?
- Как при написании уравнения отличить обратимую реакцию от необратимой?
- Если реакция обратима, когда можно сказать, что она достигла равновесия?
- Находится ли система в равновесии, если константы скоростей прямой и обратной реакций равны?
- Если концентрации продуктов и реагентов равны, находится ли система в равновесии?
Глоссарий
- равновесие
- в химических реакциях — состояние, при котором превращение реагентов в продукты и превращение продуктов обратно в реагенты происходят одновременно с одинаковой скоростью; состояние баланса
- обратимая реакция
- химическая реакция, которая может протекать как в прямом, так и в обратном направлении при данных условиях
Решения
Ответы на упражнения по химии в конце главы
1. Реакция может протекать как в прямом, так и в обратном направлении.
Реакция может протекать как в прямом, так и в обратном направлении.
3. Когда система достигает равновесия, дальнейших изменений концентраций реагентов и продуктов не происходит; реакции продолжают протекать, но с эквивалентными скоростями.
5. Понятие равновесия не предполагает равных концентраций, хотя и возможно.
Обратимые реакции — Обратимые реакции — AQA — GCSE Combined Science Revision — AQA Trilogy
В некоторых химических реакциях продукты реакции могут реагировать вместе с образованием исходных реагентов.Эти реакции называются обратимыми реакциями. Их можно представить следующим образом:
A + B ⇌ C + D
Символ ⇌ имеет две половины стрелки, по одной в каждом направлении. Он используется в уравнениях, показывающих обратимые реакции:
Реакционная смесь может содержать реагенты и продукты, и их пропорции могут быть изменены путем изменения условий реакции.
Пример
Хлорид аммония
Хлорид аммония представляет собой белое твердое вещество. При нагревании разлагается с образованием аммиака и хлористого водорода. Когда эти два газа достаточно остынут, они реагируют вместе, снова образуя хлорид аммония.
Эту обратимую реакцию можно смоделировать как:
0.$0.$1.$9″> хлорид аммония ⇌ аммиак + хлористый водородNH 4 Cl(s) ⇌ NH 3 (г) + HCl(г)
9044 Вопрос 25 1- 9044 Напишите Вопрос 25 1
- Выявить ответ
NH 4 Cl(s) ⇌ NH 3 (g) + HCl(g)
- прямая и обратная реакции продолжаются
- прямая и обратная реакции имеют одинаковую скорость
- концентрации всех реагирующих веществ остаются постоянными
- Вопрос
Азот реагирует с водородом для получения аммиака: N 2 (г) + 3H 2 (г) ⇌ 2NH 3 (г)
Напишите сбалансированное уравнение обратной реакции.
- Открыть ответ
2nh
2nh 1i5oqsxjls2.0.0.0.1:0.1.0.$0.$1.$23.3.$0.$1″> 3 (G) → N 2 (G) + 3H 2 (G)
- 9044 сбалансированное уравнение прямой реакции разложения хлорида аммония.
Изменение энергии в обратимых реакциях
будет эндотермическим в другом направлении. При прямой и обратной реакциях передается одинаковое количество энергии.
При прямой и обратной реакциях передается одинаковое количество энергии.Сульфат меди
Синий сульфат меди описывается как гидратированный. Ионы меди в своей кристаллической решетке окружены молекулами воды.Эта вода удаляется при нагревании синего гидратированного сульфата меди, оставляя белый безводный сульфат меди. Эта реакция обратима:
гидратированный сульфат меди ⇌ безводный сульфат меди + вода
CuSO 4 .5H 2 O(т) ⇌ CuSO 4 (т) + H 2 O(l5) 900(l5) Прямая реакция эндотермическая, обратная экзотермическая.
1. Гидратированный сульфат меди(II) нагревают
3. Нагрев прекращают и добавляют воду
4.Остатки гидратированного сульфата меди(II)
Динамическое равновесие
Когда в закрытом сосуде происходит обратимая реакция, она достигает динамического равновесия. При равновесии:
Необратимые реакции, характеристики необратимых реакций, химическое равновесие
реакции: Реакция, в которой все количество реагентов превращается в продукты, известна как необратимая реакция .
(i) Характеристики необратимых реакций
(а) Эти реакции протекают только в одном направлении (направление вперед),
(b) Эти реакции могут протекать до конца,
(в) В необратимой реакции D G < 0,
(d) Стрелка в скобках (®) расположена между реагентами и продуктами,
(ii) Примеры необратимых реакций
(a) Нейтрализация сильной кислоты и сильного основания e.г.,
(b) Реакции двойного разложения или реакции осаждения например,
(c) Термическое разложение, например,
(d) Окислительно-восстановительные реакции, т. е.
е.
Справка по химии на основе электронной почты — помощь с домашним заданием в Expertsmind
Вы ищете эксперта по химии для помощи с вопросами необратимых реакций? Тему необратимых реакций не проще освоить без посторонней помощи? Мы на www.expertmind.com предлагает лучший сервис помощи в выполнении заданий по химии и помощь в выполнении домашних заданий по химии. Репетиторы доступны круглосуточно и без выходных, помогая учащимся решать проблемы, связанные с необратимыми реакциями. Мы предоставляем пошаговые ответы на вопросы о необратимых реакциях со 100% свободным от плагиата содержанием. Мы готовим качественный контент и примечания к теме «Необратимые реакции» по теории химии и учебным материалам. Они доступны для подписанных пользователей, и они могут получить преимущества в любое время.
Почему Expertsmind для помощи в назначении
- Сеть обладателей высших степеней и опытных экспертов
- Пунктуальность и ответственность в работе
- Качественное решение со 100% ответами без плагиата
- Время доставки
- Конфиденциальность информации и сведений
- Превосходство в решении задач по химии в формате Excel и Word.

- Лучшая репетиторская помощь 24×7 часов
Виды работ: обратимые и необратимые — видео и стенограмма урока
Обратимая и необратимая работа
Поскольку мы сжимаем эти поршни, есть два варианта: это может быть обратимым или необратимым. Обратимая работа означает, что вся система (включая окружающую систему) может быть возвращена в исходное состояние. Необратимая работа означает, что мы можем вернуть поршень в исходное состояние только в том случае, если изменим окружающую его систему.
Истинная обратимая работа возможна только теоретически. Давайте посмотрим на поршень автомобиля. Он сжимается, и кажется, что ему нужно вернуться в исходное состояние, чтобы он мог продолжать работать, иначе мы смогли бы использовать поршень только один раз, и он больше никогда не заработает. Таким образом, мы ожидаем, что поршень будет двигаться вперед и назад следующим образом:
Но это говорит о том, что поршень возвращается в исходное положение, просто двигаясь назад, используя тот же самый путь, что и раньше, больше ничего не изменилось.На самом деле поршень отдает тепло, его нужно охлаждать извне. Таким образом увеличивается тепло (энтропия) окружающей среды, и система выглядит примерно так:
Он возвращается в исходное положение, но ему нужно выбрать новый маршрут, по которому тепло выделяется в окружающую среду.
Уравнения и графики
Чтобы рассчитать работу, совершаемую обратимым или необратимым процессом, нам нужно использовать различные уравнения.
Уравнение для расчета работы обратимого процесса:
dW = PdV
В этой ситуации давление можно рассчитать непосредственно, используя закон идеального газа, как указано выше: PV = нРТ .
d относится к производной, поэтому мы можем взять производную работы и производную объема, чтобы увидеть изменение во времени.
Уравнение для расчета работы необратимого процесса немного отличается. Так как закон идеального газа на самом деле не работает, нам нужно использовать другое давление для расчета необратимой работы: внешнее давление на поршень для расчета работы.
Давайте посмотрим, что это на самом деле означает. При обратимой работе давление и объем всегда изменяются, начиная с высокого давления при низком объеме и заканчивая более низким давлением при более высоком объеме:
Теперь при необратимой работе нам нужно использовать внешнее давление, чтобы давление всегда оставалось постоянным при увеличении объема:
Так как работа равна производной или площади под кривой, работа обратимой работы больше, чем работа необратимой работы.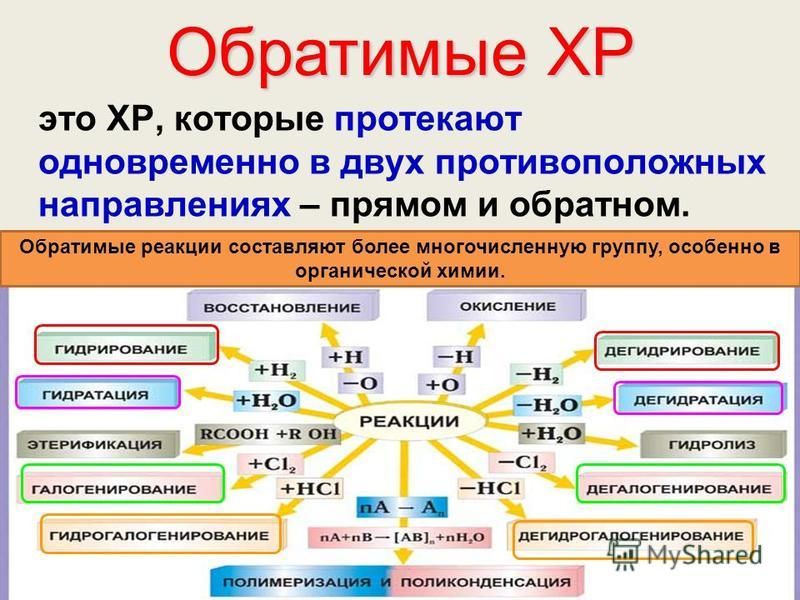 Итак, в действительности проделанная работа (поскольку обратимой работы на самом деле не существует) ниже идеальной обратимой ситуации.
Итак, в действительности проделанная работа (поскольку обратимой работы на самом деле не существует) ниже идеальной обратимой ситуации.
Резюме урока
Работа равна смещению или расстоянию, умноженному на силу. Когда мы измеряем работу, совершаемую в результате химической реакции, мы можем рассчитать работу, умножив давление (которое увеличивается из-за повышения температуры в результате экзотермических реакций) на изменение объема.
Теоретически работу можно обратить вспять.То есть мы можем обратить процесс вспять, не меняя окружающей среды. Это обратимая работа . Но на самом деле этого не существует в действительности, потому что химическая реакция всегда затрагивает окружающую среду. Итак, чтобы вернуться в исходное положение, необходимо изменить окружающую среду, что является необратимой работой . Глядя на производную работы, проделанной обратимо и необратимо, мы видим, что с обратимой работой можно выполнить больше работы, чем с необратимой.
Необратимая реакция
Необратимая реакция — это химическая реакция, протекающая почти одним способом. В этом типе реакции скорость обратной реакции ничтожно мала по сравнению со скоростью прямой реакции. А в некоторых реакциях, таких как реакции с практически нулевым горением,
Необратимая реакция
Реакция протекает до тех пор, пока не будет исчерпан хотя бы один из реагентов, который называется «ограничивающим реагентом». [ 1 ]
Его можно представить следующим химическим уравнением: [ 2 ]
- B}}\rightarrow c{\mbox{C}}+d{\mbox{D}}\,\!}
Это уравнение двух веществ, которые реагируют друг с другом с образованием двух продуктов, , , и и и C , D — это стехиометрические коэффициенты, количество относительных молей реагентов A , B и продукты C , D соответственно. Стрелка указывает единственное направление реакции. [ 3 ]
Стрелка указывает единственное направление реакции. [ 3 ]
Реакции горения являются примером необратимых реакций, в которых K может принимать огромные значения.
Например, масло, которое мы можем обозначить с помощью CnHm{\displaystyle \scriptstyle C_{n}H_{m}\,\!}, или дерево, сгорает в присутствии кислорода (O 2 ), превращаясь в основном в углерод диоксид (CO 2 ) и вода (H 2 O ), выделяя тепловую энергию (экзотермическая реакция).Эти продукты необходимо подвергнуть биологическому процессу фотосинтеза, чтобы вновь превратить в органические вещества, а не превратить самопроизвольно в исходные реагенты. [ 4 ]
Реакции углеводородов (например, нефти и ее производных) можно представить следующим образом:
- CnHm+(n+m4)O2⟶nCO2+m2h3O{\displaystyle {\rm {C_{n } H_ {m} + \ left (n + {\ frac {m} {4}} \ right) {\ rm {O_ {2} \ longrightarrow n {\ rm {CO_ {2} + {\ frac {m} { 2}}{\rm {H_{2}O}}}}}}}}}
Другой необратимой химической реакцией является такая, при которой хотя бы один из продуктов выходит из реагирующей системы, например, как это происходит ( летучий) диоксид углерода в следующей реакции:
- CaCO3 + 2HCl⟶CaCl2 + h3O + CO2 {\ displaystyle {\ rm {CaCO_ {3} + 2HCl \ longrightarrow CaCl_ {2} + H_ {2} O + CO_ {2 }\,\!}}}
Когда константа равновесия обратимой реакции очень велика, для практических целей ее можно считать необратимой и протекающей только в одном направлении. Даже если в равновесии есть обратная реакция, она будет незначительной.
Даже если в равновесии есть обратная реакция, она будет незначительной.
Последние можно считать крайним случаем, «частными случаями» обратимых реакций, в которых константа равновесия имеет большое значение. Когда изменение свободной энергии Гиббса велико, будет велика и константа равновесия, а концентрации реагентов при равновесии будут очень малы. Такая реакция на практике считается необратимой реакцией, хотя в действительности в реакционной системе при равновесии будут присутствовать небольшие количества реагентов.
Другие примеры необратимых химических реакций
- 6O2+C6h22O6⟶6h3O+6CO2{\displaystyle {\rm {6O_{2}+C_{6}H_{12}O_{6}\longrightarrow 6H_{2}O+ 6CO_{2}\,\!}}}
В этом случае глюкоза реагирует с кислородом (O 2 ) с образованием углекислого газа (CO 2 ) и воды (H 2 O), выделяя химическое энергия (экзотермическая реакция), которая будет запасена в АТФ. Это реакция не горения, а окисления. Встречается в природе в живых организмах, использующих глюкозу в качестве основного источника энергии. Углекислый газ (CO 2 ) удаляется с дыханием. Таким образом, чтобы двуокись углерода (CO 2 ) с водой (H 2 O) превращалась в глюкозу, потребуется ряд биологических процессов, которые начинаются с фотосинтеза
Углекислый газ (CO 2 ) удаляется с дыханием. Таким образом, чтобы двуокись углерода (CO 2 ) с водой (H 2 O) превращалась в глюкозу, потребуется ряд биологических процессов, которые начинаются с фотосинтеза
. Хотя приведенный выше пример является хорошим примером необратимой химической реакции органических В химии реакции кислот с сильными основаниями являются необратимыми реакциями неорганической химии:
- NaOH + HCl⟶NaCl + h3O {\ displaystyle {\ rm {NaOH + HCl \ longrightarrow NaCl + H_ {2} O \, \!} }}
Когда сильное основание, такое как гидроксид натрия, реагирует с сильной кислотой, такой как соляная кислота, с образованием соли (хлорида натрия) (NaCl) и воды, константа равновесия настолько велика, что обратная реакция практически невозможна. несуществующий.бывает. SURK
См. также
Примечания и ссылки
- ↑ Iz quierdo, Cunill, Tejero, Monserrat Ibora, Carles Fite. Кинетика химических реакций (издание 2004 г.



