Окислительно-восстановительные реакции — Химия. 9 класс. Григорович
Химия. 9 класс. Григорович
Окисление и восстановление — противоположные процессы
В 7 классе вы уже ознакомились с реакциями окисления. Мы рассматривали их как реакции веществ с Оксигеном с образованием оксидов. Можно сказать, что окисление — это процесс присоединения веществом атомов Оксигена (рис. 15.1, а). Вместе с окислением в природе происходит противоположный процесс, который сопровождается отдачей веществом атомов Оксигена. Этот процесс называют восстановлением. На примере реакции восстановления меди (рис. 15.1, б) становится понятным название этого процесса: поскольку из черного купрум(II) оксида получили блестящий металл, то было логично назвать этот процесс восстановлением металла.
Рис. 15.1. Реакции окисления (а) и восстановления (б) меди
Обратите внимание: Купрум отдает атомы Оксигена и восстанавливается, но одновременно атомы Гидрогена соединяются с атомами Оксигена и окисляются (рис.
Итак, процессы окисления и восстановления — это противоположные взаимосвязанные процессы: восстановление всегда сопровождается окислением, и наоборот. Поэтому используют термин окислительно-восстановительные реакции (сокращенно ОВР).
Электронная природа окислительно-восстановительных реакций
С развитием химии ученые установили электронную природу процессов окисления и восстановления. Одним из первых электронную теорию окислительно-восстановительных процессов предложил наш соотечественник Л. В. Писаржевский. Он сопоставил процессы окисления и восстановления с изменением степеней окисления элементов вследствие перехода электронов от атомов одних элементов к другим.
• Реакции, в которых хотя бы один химический элемент меняет свою степень окисления, называют окислительно-восстановительными.
Рассмотрим еще раз реакцию окисления меди, но на этот раз обратим внимание на степени окисления элементов реагентов и продуктов реакции:
Мы видим, что в результате реакции Купрум повышает свою степень окисления с 0 до +2. Для этого атомы Купрума должны отдать по 2 электрона. Этот процесс можно описать схемой:
Для этого атомы Купрума должны отдать по 2 электрона. Этот процесс можно описать схемой:
• Окисление — это процесс отдачи электронов атомом (ионом) с повышением степени окисления.
В этой реакции Купрум понижает свою степень окисления с 0 до -2. Для этого атомы Оксигена должны принять по 2 электрона:
Так атомы Оксигена дополняют (восстанавливают) свою электронную оболочку.
• Восстановление — это процесс присоединения электронов атомом (ионом) с понижением степени окисления.
Элемент, который отдает электроны и тем самым повышает свою степень окисления, называют восстановителем. Вещество, содержащее элемент-восстановитель, также называют восстановителем. Поскольку восстановитель в ходе реакции отдает электроны, то сам он при этом окисляется.
• Восстановитель — это частица (молекула, атом или ион), которая отдает электроны.
В реакции меди с кислородом атомы Купрума окисляются, поскольку отдают электроны, но они в этой реакции являются восстановителями, поскольку отдают электроны и восстанавливают атомы Оксигена.
Элемент, который присоединяет электроны, а также вещество, в составе которого он содержится, называют окислителем. Поскольку окислитель в ходе реакции присоединяет электроны, то сам он при этом восстанавливается.
• Окислитель — это частица (молекула, атом или ион), которая присоединяет электроны.
В реакции, которую мы рассмотрели, Оксиген восстанавливается, поскольку присоединяет электроны, но одновременно он является окислителем и окисляет Купрум.
В общем случае все определения, которые мы рассмотрели в этом подразделе, можно представить схемой:
Лев Владимирович Писаржевский (1874-1938)
Украинский физико-химик, академик АН СССР и АН УССР. После окончания гимназии готовился стать врачом, но, ознакомившись с учебником Менделеева «Основы химии», решил посвятить себя этой науке. После окончания Одесского университета учился в Лейпциге в лаборатории Оствальда, где защитил диссертацию. Работал в Тарту, Киевском политехникуме, Екатеринославском горном институте (сейчас Национальный горный университет, г. Днепр). В годы гражданской войны сконструировал простой противогаз, сберегший здоровье многих солдат. Разработал теорию окислительно-восстановительных реакций. Был основателем и первым директором института физической химии НАН Украины, названного его именем.
Днепр). В годы гражданской войны сконструировал простой противогаз, сберегший здоровье многих солдат. Разработал теорию окислительно-восстановительных реакций. Был основателем и первым директором института физической химии НАН Украины, названного его именем.
Рассмотрим реакцию хлоридной кислоты со щелочью:
Легко заметить, что в этой реакции ни один химический элемент не меняет свою степень окисления, поэтому данная реакция не является окислительно-восстановительной, как и любая другая реакция ионного обмена. Главное отличие окислительно-восстановительных реакций от реакций ионного обмена заключается в том, что при окислительно-восстановительных реакциях происходит переход электронов от восстановителя к окислителю.
На островах Индонезии обитают сорные куры, или большеноги (alectura lathami). В отличие от большинства птиц они не высиживают свои яйца, а закапывают их в кучу гумуса, листьев и навоза. Яйца развиваются благодаря теплоте, выделяемой при окислительно-восстановительной реакции гниения растений. Благодаря нежной коже внутри клюва самец отслеживает температуру в таком «инкубаторе» и в зависимости от нее раскапывает яйца или засыпает их песком.
Благодаря нежной коже внутри клюва самец отслеживает температуру в таком «инкубаторе» и в зависимости от нее раскапывает яйца или засыпает их песком.
Значение окислительно-восстановительных реакций
Окислительно-восстановительные реакции имеют большое значение в природе и деятельности человека. Они являются основой многих процессов жизнедеятельности живых организмов. В промышленности ОВР — один из главных методов получения новых веществ, в особенности металлов, а также в производстве кислот, лекарств, красителей и т. д.
Значение ОВР в природе
Фотосинтез — это окислительно-восстановительная реакция, обеспечивающая жизнь на планете. Под действием света в зеленых растениях происходит процесс, который можно описать суммарным уравнением: 6CO2 + 6H2O = C6H12O6 + 6O2↑. Окислителем здесь выступает углекислый газ, а восстановителем — атомы Оксигена в составе воды.
Обмен веществ и энергии в клетках происходит в процессе многочисленных окислительно-восстановительных реакций. Процессы дыхания, пищеварения — все это цепи ОВР. Превращение энергии, освобождающейся при ОВР, в энергию химических связей молекул АТФ происходит в митохондриях.
Любая реакция горения является окислительно-восстановительной. С давних времен горение является источником энергии для человека. Горение древесины можно описать уравнением, обратным к процессу фотосинтеза: C6H12O6 + 6O2 = 6CO2 + 6H2O.
Гниение также является окислительно-восстановительным процессом, который происходит при участии бактерий. В результате гниения выделяется энергия, необходимая для жизнедеятельности этих бактерий. Миллионы лет назад благодаря этим процессам сформировались полезные ископаемые.
Брожение — еще один пример природных ОВР. Этот процесс происходит при участии грибов, которые таким способом получают необходимую энергию.
В живых организмах случаются и нежелательные процессы окисления, следствием которых могут быть мутации ДНК и заболевания, в частности рак. Вещества-антиоксиданты, проявляющие восстановительные свойства, взаимодействуют с избыточными окислителями в организме и «нейтрализуют» их. Самый распространенный антиоксидант — витамин C.
Коррозия — это многостадийный окислительновосстановительный процесс, описывающийся уравнением: 4Fe + 3O2 + 6H2O = 4Fe(OH)3. Коррозию можно назвать процессом, противоположным получению металлов на заводах. Этот процесс приводит к повреждению металлических конструкций.
Получение энергии из любого топлива основано на ОВР. Например, в двигателях внутреннего сгорания происходит реакция сгорания бензина. Энергия, выделяющаяся в результате реакции, превращается в механическую энергию для перемещения автомобиля.
Энергия, выделяющаяся в результате реакции, превращается в механическую энергию для перемещения автомобиля.
В обычных батарейках также протекают ОВР, энергия от которых преобразуется в электрическую энергию. Такие источники электрического тока называют гальваническими элементами. Аккумуляторы в автомобилях, ноутбуках и мобильных телефонах — это также гальванические элементы, в которых протекают различные ОВР.
В топливных элементах энергия вырабатывается в результате окислительно-восстановительной реакции горения. Перспективным является топливный элемент, в котором происходит сгорание водорода, поскольку единственный продукт этой реакции — вода. Автомобили с такими топливными элементами будут экологически чистыми.
Окислительно-восстановительные реакции являются основой метода гальванопластики — покрытия поверхности тонким слоем металла. На изделие любой сложности из любого материала наносят слой металла. Этим методом наносят позолоту на деревянные изделия, хромируют детали автомобилей, бытовой техники и т. п.
п.
Металлургические процессы — получение металлов — невозможны без ОВР. Металлы (железо, медь, свинец и др.) восстанавливают из руды коксом (специально обработанным углем). Алюминий из руды восстанавливают электрическим током. По выпуску черных металлов Украина занимает одно из первых мест в мире.
Без ОВР невозможен химический анализ некоторых веществ. Используя различные реагенты, определяют концентрацию кислорода, ионов Феррума или Хрома в смесях. Также с помощью ОВР можно определить содержание витамина C (аскорбиновой кислоты) во фруктах, соках и др.
Реакция азота с водородом N2 + 3H2 = 2NH3 также является окислительно-восстановительной. На этой реакции основано производство азотных удобрений и взрывчатых веществ. Дешевый способ синтеза аммиака позволил повысить урожайность сельскохозяйственных культур. В Украине аммиак синтезируют в больших объемах на предприятиях «Ровноазот», Черкасский «Азот» и другие.
Ключевая идея
Окисление и восстановление — противоположные взаимосвязанные процессы, которые заключаются в обмене электронами.
Контрольные вопросы
- 175. Какие реакции называют окислительно-восстановительными? Приведите примеры окислительно-восстановительных реакций в природе и быту.
- 176. Дайте определение понятиям «окислитель», «восстановитель», «окисление», «восстановление» с точки зрения электронной теории ОВР.
- 177. Можно ли любой процесс окисления охарактеризовать как горение? А можно ли любой процесс горения назвать процессом окисления?
Задания для усвоения материала
178. Определите, какие из приведенных реакций являются окислительно-восстановительными. Для ОВР обозначьте стрелкой направление переноса электронов и их количество, как на схеме на с. 90.
- а) 2Na + 2H2O = 2NaOH + H2↑;
- б) MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O;
- в) 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O;
- г) 6NaOH + P2O5 = 2Na3PO4 + 3H2O;
- д) CuO + 2HCl = CuCl2 + H2O;
- е) Fe + 2HCl = FeCl2 + H2↑;
- ж) 2H2 + O2 = 2H2O;
- з) 2Al + 3S = Al2S3.

179. В каждом уравнении реакции определите элементы, которые являются восстановителями и окислителями:
- а) N2 + O2 = 2NO;
- б) 3Mg + N2 = Mg3N2;
- в) Cl2 + 2KBr = 2KCl + Br2;
- г) Fe+ CuSO4 = FeSO4 + Cu;
- д) 2K + 2H2O = 2KOH + H2↑;
- е) 2Pb(NO3)2 = 2PbO + 4NO2↑ + O2↑;
- ж) Fe + H2SO4 = FeSO4 + H2↑;
- з) 5Cl2 + 2P = 2PCl5.
181. Охарактеризуйте значение ОВР в быту, технике, природе.
182. Изделия из серебра при длительном хранении тускнеют из-за образования на поверхности нерастворимого аргентум(I) сульфида черного цвета. Восстановить блеск серебра можно кипячением изделия в растворе соды вместе с алюминиевой фольгой. Какое вещество в этом случае будет окислителем, а какое — восстановителем? Составьте уравнение этой реакции.
183. Свободные радикалы в организме (частицы с неспаренными электронами) вызывают гибель клеток или их перерождение в раковые клетки. Нейтрализовать действие свободных радикалов могут некоторые вещества, которые называются антиоксидантами, например аскорбиновая кислота. Предположите, какие свойства (окислителей или восстановителей) характерны для свободных радикалов и антиоксидантов.
ГДЗ к учебнику можно найти тут. Окислительно-восстановительные реакции
ТЕХНОЛОГИЧЕСКАЯ КАРТА УЧЕБНОГО ЗАНЯТИЯ
по теме
«Окислительно-восстановительные реакции» (11 класс)
Тимохина Алёна Владимировна
учитель химии
ГОУ ТО «Яснополянский образовательный комплекс
им. Л.Н. Толстого»
Учебно-методический комплект. Габриелян O.C. Химия. 11 класс: учебник для общеобразовательных организаций / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М.: Просвещение, 2019. – 127 с.
— М.: Просвещение, 2019. – 127 с.
Тема урока. Окислительно-восстановительные реакции.
Цель урока. Совершенствование и систематизация знаний и умений учащихся об окислительно-восстановительных процессах, и их механизмах.
Планируемые образовательные результаты.
1. Предметные: продолжить формирование знаний при составлении окислительно-восстановительных реакций, умение расставлять коэффициенты в химических уравнениях методом электронного баланса. Умение записывать окислительно-восстановительные реакции повышенного уровня (окислитель + восстановитель + среда). Умение устанавливать связи между реально наблюдаемыми химическими явлениями, объяснять причины многообразия веществ, зависимость свойств веществ от их строения.
2. Метапредметные:
– Познавательные. Формировать умения самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учёбе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности.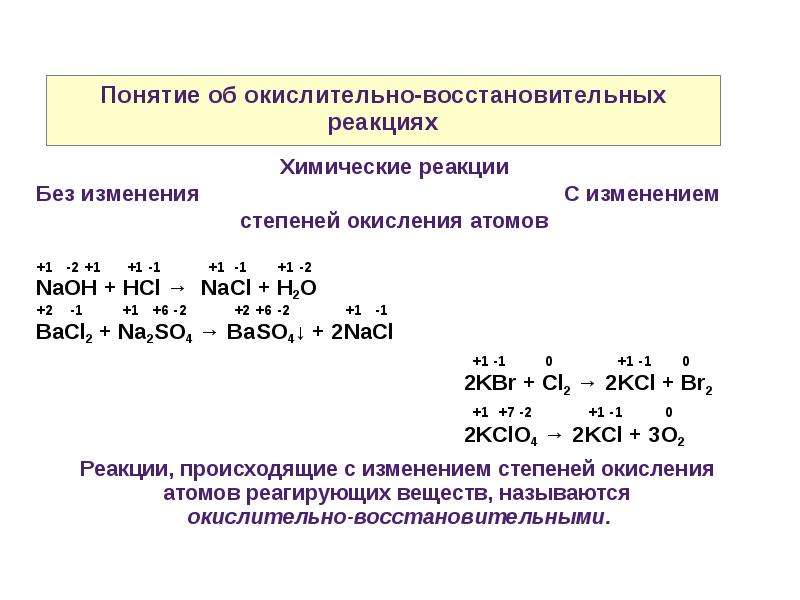
– Регулятивные. Уметь определять понятия, обобщать, устанавливать аналогии и причинно-следственные связи, строить логичные рассуждения, осуществлять сравнение и классификацию; проводить наблюдения; умозаключения, делать выводы.
– Коммуникативные. Выбор оснований и критериев с целью выделения признаков, умение с точностью выражать свои мысли в соответствии с задачами и условиями коммуникации, владение монологической и диалогической формами речи, умение работать в коллективе и находить общие решения.
3. Личностные: понимание значимости естественнонаучных знаний в повседневной жизни, технике, медицине, для решения практических задач. Соблюдение инструкции охраны труда при проведении лабораторных опытов. Умение грамотно обращаться с веществами в химической лаборатории и в быту. Относится бережно к своему здоровью.
Основные понятия, изучаемые на уроке. Степень окисления, окислители, процесс восстановления, восстановители, процесс окисления, метод электронного баланса, окислительно-восстановительные реакции.
Тип урока. Комбинированный урок.
Педагогические технологии. Системно-деятельностное обучение, личностно-ориентированное обучение, ИКТ и медиаобразование.
Формы обучения. Фронтальная (систематизирующая беседа), групповая (урок-игра, лабораторный опыт), индивидуальная (выполнение индивидуальных заданий).
Оборудование и реактивы, ЭОР. Набор реактивов и оборудования для лабораторного опыта, компьютер, мультимедийный проектор, интерактивная доска, презентация по теме урока, дидактические карточки.
Оборудование | Реактивы |
Штатив с пробирками | Раствор сульфата меди CuSO4 |
Спиртовка | Кальций (твердый) Сa |
Спички | Раствор гидроксида натрия NaOH |
Раствор перманганата калия KMnO4 или порошок оксида марганца (IV) MnO2 | |
Раствор пероксида водорода h3O2 | |
Раствор хлорида бария BaCl2 | |
Раствор серной кислоты h3SO4 | |
Железная пластина Fe |
Структура урока.
1. Организационный момент (1 мин).
2. Проверка остаточных знаний (8 мин).
3. Сообщение темы и цели урока (2 мин).
4. Усвоение новых знаний, умений (10 мин).
5. Закрепление и систематизация полученных знаний (10 мин).
6. Рефлексия (подведение итогов работы) (3 мин).
7. Сообщение домашнего задания (1 мин).
Ход урока.
Этапы урока | Содержание и деятельность учителя | Содержание и деятельность ученика | Методы и средства обучения | Планируемые образовательные результаты |
Организационный момент | Учитель приветствует учащихся. Добрый день, ребята! Сегодня наш урок будет необычным, а в виде квест-игры. Квест состоит из 4-ых станций, за каждую правильно отгаданную станцию можно получить по две карты с буквами, которые затем надо объединить в слово. | Обучающиеся приветствуют учителя. Делятся на две равные команды, дают название. | ||
Проверка остаточных знаний | Давайте с Вами вспомним, какую тему мы изучали на прошлом уроке. Так наша первая станция связана с прошлой темой. И имеет название «Кто есть окислитель, кто – восстановитель». Переходим к первому столу, где лежат карточки. Инструкция. Распределить карточки с веществами на две группы: окислители и восстановители. Интерактивная игра в виде карточек и программа Learningapps.org. Интерактивное задание на соответствие Окислители и восстановители https://learningapps.org/watch?v=p4jepszcn21 (Приложение 1). Следующая станция таинственная, здесь вам нужно подумать, какое вещество было зашифровано, и найти его. 2. «По следам неизвестного вещества». Инструкция. Обучающиеся получают карточки с загадками (ситуационными задачами). С помощью этих загадок они должны найти вещество и его место в школе (записать в лист правильный ответ). (Приложение 2). | Наша тема была «Окислительно-восстановительные реакции. А именно мы изучали степени окисления, вещества-окислители и восстановители. Ученики переходят к столу. Начинают выполнять задание. После выполнения по два ученика из команд по очереди показывают свои ответы. Совместно проверяя. | Групповая работа | Предметные. Умения характеризовать реакции без изменения состава веществ и с изменением реагирующих веществ и продуктов реакции. Классифицировать типы реакций в неорганической и органической химии. Умение адекватно воспринимать сообщения обучающихся. Метапредметные. 1. Познавательные: анализировать и отбирать информацию; выдвижение гипотез и их обоснование; построение логической цепи рассуждений. 2. Регулятивные: формировать умение формулировать выводы и заключения. 3. Коммуникативные: выбор оснований и критериев с целью выделения признаков, умение с точностью выражать свои мысли в соответствии с задачами и условиями коммуникации. Личностные. Формировать мировоззрение, соответствующее современному уровню развития науки, коммуникативную компетентность и уважение к иной точке зрения при обсуждении результатов выполненной работы. |
Сообщение темы и цели урока | Давайте отдохнем с Вами и проведем разминку! Нам в этом поможет наш юный Менделеев. Отлично, разминка выдалась веселой! А теперь переходим к другой станции, которая посвящена продолжению изучаемой темы «Окислительно-восстановительные реакции». Давайте подумаем, какая же цель должна стоять перед нами для того, чтобы продолжить изучать тему? . | На прошлом уроке мы повторяли степени окисления и окислитель/восстановители (1 ученик). Значит, на этом уроке перед нами стоит цель закрепить способы расставления коэффициентов в окислительно-восстановительных реакциях методом электронного баланса (2 ученик) | Фронтальная беседа | |
Усвоение новых знаний, умений | Правильно, и для этого мы переходим к станции «Химический пазл». «Химический пазл». Инструкция. Ученики получают карточки с двумя химическими реакциями (коэффициенты, вещества, части электронного баланса). На доске будет теоретический материал, им нужно с помощью слайда уравнять предложенные реакции (Приложение 3). | После того, как соберут пазл, ученики должны дать комментарий к работе. | Объяснение в виде игры. Беседа | Предметные. Умение систематизировать изученный материал по теме, применять знания в незнакомой ситуации. Метапредметные. 1. Познавательные: выбор наиболее эффективных способов решения задач в зависимости от конкретных условий. 2. Регулятивные: контроль в форме самостоятельной и коллективной работы. 3. Коммуникативные: умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации. Личностные. Действие нравственно-этического оценивания усваиваемого содержания, обеспечивающее личностный моральный выбор на основе социальных и личностных ценностей. |
Закрепление и систематизация полученных знаний | Для закрепления пройденного материала осуществим лабораторный опыт. Перед этим ознакомимся с правилами ТБ (Приложение 4), представленными на слайде. Следующая станция «Окислительно-восстановительная путаница». «Окислительно-восстановительная путаница» (лабораторный опыт). Инструкция. Перед учениками находится набор реактивов. (Приложение 5). | Ученики после выполнения опыта выходят к доске и дают комментарии. | Химический эксперимент | |
Рефлексия (подведение итогов работы) | Вот вы и собрали все карточки. Перед вами представлен вопрос. Соберите слово и назовите его. Вопрос к Квесту: Какое вещество самое распространенное и является известным в производстве окислителем? (КИСЛОРОД) Награждение команды, которая угадала слово и победила. Молодцы! Сегодня наш урок прошел в такой нетрадиционной форме, мы с Вами закрепили тему «Окислительно-восстановительные реакции». Вопросы: 1. Из игры вы узнали, что такое окислительно-восстановительные реакции, окислители и восстановители? 2. 3. Изучили многообразие реакций и их практическое применение. Спасибо Вам за урок. До свидания! | Собирают слово. Одна из команд раньше называет, и в итоге одерживает победу. ОВР – это реакции с изменением степеней окисления. Окислители – вещества, которые принимают электроны. Восстановители – вещества, которые отдают электроны. Самый известный способ, с помощью которого можно расставить коэффициенты – это метод электронного баланса. Например, окисление углем или угарным газом оксидных руд, один из промышленных способов получения металлов. Лабораторное получение водорода основано на взаимодействии металлов, либо с кислотой, либо с водой. | Предметные. Обобщение изученного учебного материала. Самоанализ достигнутого результата. Метапредметные. 1. Познавательные: рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности. 2. Регулятивные: выделение и осознание учащимся того, что уже усвоено и что еще подлежит усвоению, оценивание качества и уровня усвоения. 3. Коммуникативные: контроль, коррекция, оценка своих действий и одноклассника. Личностные. Личностное, профессиональное, жизненное самоопределение. | |
Сообщение домашнего задания | Учитель записывает домашнее задание на доске. | Ученики переписывают задание в дневники. |
Список использованной литературы
1. Габриелян O.C. Химия. 11 класс: учебник для общеобразовательных организаций / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М.: Просвещение, 2019. – 127 с.
2. Габриелян, О.С. Химия. 11 класс. Методическое пособие к учебнику О. С. Габриеляна «Химия. 11 класс. Базовый уровень»/ О.С. Габриелян, С.А. Сладков. — 3-е изд., стереотип. — М.: Дрофа, 2018. — 152 с.
Габриеляна «Химия. 11 класс. Базовый уровень»/ О.С. Габриелян, С.А. Сладков. — 3-е изд., стереотип. — М.: Дрофа, 2018. — 152 с.
3. Габриелян О.С. Химия 11 класс: рабочая тетрадь к учебнику О.С. Габриеляна «Химия. Базовый уровень. 11 класс»/ О.С. Габриелян. – М.: Дрофа, 2014. – 174 с.
4. Пузаков С.А. Пособие по химии для поступающих в вузы. Вопросы, упражнения, задачи. Образцы экзаменационных билетов: Учеб.пособие. – 6-е изд., стер./ С.А. Пузаков, В.А. Попков. – М.: Высш.шк., 2009. – 623 с.
Приложение
Приложение 1
Дидактическая карта интерактивного задания «Окислители и восстановители»
Распределить химические вещества на две группы: окислители и восстановители | |
Nh4 | Восстановители |
F2 | |
HCl | |
CO | |
HClO3 | |
Al | |
HNO2 | |
O2 | Окислители |
C | |
K2Cr2O7 | |
h3S | |
HNO3 | |
KMnO4 | |
Приложение 2
Ситуационная задача №1
Это известное вещество издавна использовали для дезинфекции ран и в качестве антисептика. По агрегатному состоянию – это бесцветная жидкость с «металлическим вкусом». Химики используют это вещество как окислитель и реагент для получения кислорода. В своей структуре имеет степень окисления у кислорода −1, что является исключением. Что это за вещество и где его можно обнаружить? Загадываемое вещество: пероксид водорода.
По агрегатному состоянию – это бесцветная жидкость с «металлическим вкусом». Химики используют это вещество как окислитель и реагент для получения кислорода. В своей структуре имеет степень окисления у кислорода −1, что является исключением. Что это за вещество и где его можно обнаружить? Загадываемое вещество: пероксид водорода.
Ситуационная задача №2
Это летучее, темное и кристаллическое вещество может возгоняться в фиолетовые пары. При его недостатке в пище человек может приобрести болезнь щитовидной железы. Малорастворим в воде, однако, легко растворяется в спирте и образует спиртовой раствор. Его могут использовать как дезинфицирующее вещество и восстановить в химии. Что это за вещество и где его можно обнаружить? Загадываемое вещество: йод (спиртовой раствор йода).
Ситуационная задача №3
Это продукт со специфическим запахом и кислым вкусом, представляет собой результат брожения спиртовых и углеводных компонентов, либо скисания вин. Если добавить в раствор данного вещества лакмус, то он окрасится в красный, а если – активный металл, то через некоторое время начнут выделяться пузырьки газа. Что это за вещество и где его можно обнаружить? Загадываемое вещество: уксусная кислота.
Что это за вещество и где его можно обнаружить? Загадываемое вещество: уксусная кислота.
Ситуационная задача №4
Это сложное вещество, представляющее смесь нескольких соединений, получают взаимодействием хлора и гашеной извести. Представляет собой порошок белого цвета с характерным запахом, обладающего отбеливающим действием. Что это за вещество и где его можно обнаружить? Загадываемое вещество: хлорная известь (хлорка).
Приложение 3
Дидактическая карточка с заданием к станции «Химический пазл»
Задание: необходимо правильно расположить карточки с химическим уравнением и методом электронного баланса, опираясь на изученный материал по способам расставления коэффициентов в ОРВ методом электронного баланса.
I. Fe2+3O3-2 + 3C+2O-2 → 2Fe0 + 3C+4O2–2
Fe+3 +3е = Fe0 2 окислитель
C+2 – 2е = C+4 3 восстановитель
2Na0 + 2h3+1O-2 → 2Na+O-2H+1 + h30↑
Na0 – 1e = Na+ 2 восстановитель
2H+ + 2e = h30 1 окислитель
II. C-4h5+1 + 2O20 → C+4O2-2 + 2h3+1O-2
C-4h5+1 + 2O20 → C+4O2-2 + 2h3+1O-2
C-4 – 8e = C+4 1 восстановитель
O20 + 4e =2O-2 2 окислитель
Mg0 + 2H+Cl- → Mg+2Cl2- + h30↑
Mg0 – 2e = Mg+2 1 восстановитель
2H+ + 2e = h30 1 окислитель
Приложение 4
Инструкция охраны труда при проведении лабораторных работ по химии
Перед тем как приступить к выполнению лабораторного опыта, ознакомьтесь с правилами техники безопасности в химической лаборатории.
В лаборатории запрещается …
Выливать или высыпать остатки реактивов в банки, из которых они были взяты.
Запрещается! Есть, пить, пробовать вещества на вкус.
Громко разговаривать, смеяться во время исследования.
Оставлять открытыми склянки с жидкостями и сухими веществами.
Пользоваться открытым огнем и тушить водой пламя спиртовки или горелки.
Оставлять неубранными рассыпанные или разлитые вещества.
Менять пробки и пипетки от различных банок или склянок.
Набирать одной и той же ложкой или пипеткой различные вещества.
Выливать или высыпать отработанные реактивы в раковину.
Смешивать вещества в пробирках после проведения реакции.
Проводить опыты без разрешения учителя.
Приложение 5
Карта-инструкция лабораторной работы «Окислительно-восстановительные реакции»
Цель – практически закрепить знания по теме «Окислительно-восстановительные реакции».
Оборудование | Реактивы |
Штатив с пробирками | Раствор сульфата меди CuSO4 |
Спиртовка | Кальций (твердый) Сa |
Спички | Раствор гидроксида натрия NaOH |
Порошок оксида марганца (IV) MnO2 | |
Раствор пероксида водорода h3O2 | |
Раствор хлорида бария BaCl2 | |
Раствор серной кислоты h3SO4 | |
Железная пластина Fe |
Соблюдайте правила техники безопасности!
Ход работы.
1. Выполнить лабораторный опыт (химическое взаимодействие) между предложенными реактивами. Указать признак реакции.
2. Выбрать из практически осуществимых реакций только окислительно-восстановительные и написать химические уравнения. Составить электронный баланс к каждой реакции.
3. Оформить задание в виде таблицы.
Окислительно-восстановительные реакции | Метод электронного баланса | Признак реакции |
4. Сделать вывод.
Правильное оформление к лабораторной работе.
Окислительно-восстановительные реакции | Метод электронного баланса | Признак реакции |
1. Ca + 2h3O = Ca(OH)2 + h3 | Сa0 – 2e = Ca+2 1 восстановитель 2H+ + 2e = h30 1 окислитель | Выделение газа |
2. | Сa0 – 2e = Ca+2 1 восстановитель 2H+ + 2e = h30 1 окислитель | Выделение газа |
3. 2h3O2 = 2h3O + O2 (MnO2) | O-1 + 1e = O-2 2 окислитель 2O-1 – 2e = O20 1 восстановитель | Выделение газа |
4. CuSO4 + Fe = FeSO4 + Cu | Fe0 – 2e = Fe+2 1 восстановитель Cu+2 + 2e = Cu0 1 окислитель | Образование осадка, изменение цвета |
Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) – это реакции, в которых происходит изменение степени окисления элементов, образующих молекулы реагирующих веществ.
Так как изменение степени окисления атома может произойти только в результате присоединения или отдачи электронов, то окислительно-восстановительные реакции можно определить как реакции, в которых происходит переход электронов от одних атомов к другим.
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями, а сам процесс отдачи электронов называется окислением. При окислении степень окисления элемента повышается.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями, а процесс присоединения электрона называется восстановлением. При восстановлении степень окисления элемента понижается.
Уравнения, которые выражают процессы окисления и восстановления, называются электронными уравнениями. Окисление всегда сопровождается восстановлением, а восстановление – окислением.
В процессе ОВР восстановитель окисляется, а окислитель – восстанавливается.
Признаки окислительно-восстановительных реакций:
- когда в ней участвуют или в результате ее образуются простые вещества – металлы и неметаллы;
- когда в результате реакции изменяется состав ионов, входящих в состав реагирующих веществ;
- в большинстве случаев, когда число исходных веществ не равно числу продуктов реакции.

Окислительно-восстановительные реакции подчиняются не только закону сохранения массы, но и закону сохранения электрического заряда, согласно которому число электронов, отданных в данной реакции восстановителем, должно равняться числу электронов, присоединенных окислителем.
Поэтому расстановку коэффициентов в уравнениях окислительно – восстановительных реакций осуществляют с таким расчетом, чтобы наступил баланс по электронам.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Окислительно-восстановительные реакции Направление окислительно-восстановительных реакций
Окислительно-восстановительные реакции нашли широкое применение в аналитической химии для обнаружения ионов (см. опыт 4, 5, 18, 29), для электролитического разделения элементов и количественного определения, особенно в титриметрическом анализе (см.опыты 11, 56) [1-4]
опыт 4, 5, 18, 29), для электролитического разделения элементов и количественного определения, особенно в титриметрическом анализе (см.опыты 11, 56) [1-4]
НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Направление и полнота окислительно-восстановительной реакции определяется константой равновесия
Равновесный потенциал (Е) связан со стандартным окислительно-восстановительным потенциалом следующим образом (уравнение Нернста):
При образовании малорастворимых соединений
Если заменить активности равновесными концентрациями потенциалопределяющих ионов (ао = f[0] или ав = f[B]), тогда получим
Сумма первых двух членов правой части уравнения соответствует реальному потенциалу полуреакции
(Следовательно, реальный потенциал изменяется в за* симости от ионной силы раствора.
Для сложной системы изменение потенциала связано с влиянием различных факторов (ионной силой раствора, комплексообразованием, диссоциацией, ассоциацией, гилоатаиией и nv>. ) :
) :
где В, А — лиганды, включая Н+ и ОН».
Потенциал для такой системы составляет:
Рис. VIII-2. Диаграмма стандартных окислительно-восстановительных потенциалов (в вольтах).
Eр зависит от концентрации лиганда, Н+, ионной силы и т. п.
Для аналитических целей важны именно реальные потенциалы, позволяющие предвидеть направление химических реакций в растворе; значение их можно определить непосредственно экспериментальным путем.
Реакции, протекающие ступенчато с образованием промежуточных продуктов, и особенно электрохимические реакции, не полностью обратимые, характери-* зуются смешанным потенциалом [1, 2].
Стандартные потенциалы пар измеряются относительно потенциалов электродов сравнения, например стандартного водородного электрода или каломельного полуэлемента. На лекции можно показать рисунки с изображением электродов сравнения (рис. VIII-1). На демонстрационный стол следует поставить потенциометри-ческую установку для измерения потенциалов, а также представить наглядную диаграмму со значениями стандартных потенциалов некоторых окислительно-восстановительных пар (рис. VII1-2) [3].
VII1-2) [3].
Направление реакции v в зависимости от значений стандартных потенциалов окислителя и восстановителя
К оглавлению (Количественный анализ на примерах)
Читать онлайн «Окислительно-восстановительные реакции в органической химии» — автор Людмила Куцапкина
Предисловие
Приступая к работе над этим пособием, я руководствовалась необходимостью внести ясность в понимание сложных для учащихся окислительно — восстановительных реакций в органической химии. Типы и содержание заданий, представленные в данной книге, соотнесены с актуальными на момент сдачи в печать этого небольшого пособия с демонстрационным вариантом и спецификацией ЕГЭ, а также с пособиями, выпущенными ФИПИ. Материал, изложенный ниже, основан, в первую очередь, на наиболее часто встречающихся окислительно-восстановительных реакций в заданиях второй части (вопрос 38) КИМ.
Уравнения, рассмотренные мною, записаны с электронным балансом, рассмотрены с точки зрения окисления- восстановления.
Эта книга предназначена для активного обучения и подготовки к выполнению заданий повышенной сложности, написана с целью оказать помощь как ученикам, так и учителям.
ЖЕЛАЮ УДАЧИ!
Окислители в органической химии
Для окисления веществ в органической химии используют многие соединения (соединения переходных металлов, кислород, озон, перекиси, соединения серы, селена, галогенов, азота и многие другие). В данной работе я уделила внимание, в первую очередь, таким окислителям, как перманганат калия и бихромат аммония.
При окислении органических веществ хром (VI) в любой среде восстанавливается до хрома (III), однако, окисление в щелочной среде в органической химии не находит практического применения.
Перманганат калия в разных средах проявляет себя как сильный окислитель, но его сила увеличивается в кислой среде.
Гидроксид меди (II) обычно используется для окисления альдегидов. Реакция проводится при нагревании, при этом гидроксид меди (II) ярко голубого цвета превращается сначала в гидроксид меди (I) желтого цвета, который затем разлагается до красного оксида меди (I). В качестве окислителя альдегидов также применяют аммиачный раствор гидроксида серебра реакция серебряного зеркала.
В качестве окислителя альдегидов также применяют аммиачный раствор гидроксида серебра реакция серебряного зеркала.
Классы органических веществ и окисление
Часть 1. Окисление алканов
В ЕГЭ пишем — алканы не окисляются!!!
При обычных условиях (комнатной температуре) алканы не окисляются даже сильными окислителями, например такими, как перманганат и дихромат калия. При нагревании до 2000 С в присутствии катализатора (чаще всего соединений марганца) происходит окисление и,в зависимости от условий, образуются спирты, кетоны, альдегиды, карбоновые кислоты. В реакцию вступают наиболее реакционноспособные вторичные или третичные связи С-Н.
СН3- СН (СН3) -СН3кат, О2→ СН3- (СН3) С (ОН) -СН3 (2-метил-пропанол-2)
СН3- СН2-СН2-СН3кат, О2→ Н2О + СН3- СО-СН2-СН3 (бутанон-2)
R- СН2-СН2- Rкат, О2→ R- СООН + R1- СООН
5С10Н14 +24KMn+7O4 +36h3SO4 →
→ 5С6Н5С+3ООН+10CO2+12K2SO4 +24 Mn+2SO4 +56 h3O
При неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
СН3- СН2-СН2-СН3 +3О2 кат, О2→ 2СН3- СООН +2Н2О
Горение алканов приводит к образованию СО2 и Н2О и сопровождается выделением большого количества теплоты (экзотермическая реакция).
Например: СН4 +2О2 → СО2 +2Н2О +880 кДж
Высшие алканы (n> 25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18
Кислорода, содержащегося в воздухе, может оказаться недостаточно при горении высших алканов для их полного окисления до СО2. Тогда образуются продукты частичного окисления: СО или С и вода. Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Примечание:
первичные атомы углерода имеют степень окисления -3;
вторичные атомы углерода имеют степень окисления -2;
третичные атомы углерода имеют степень окисления -1;
четвертичные атомы углерода имеют степень окисления -0;
Часть 2. Окисление алкенов
1. При мягком окислении (нейтральная или слабощелочная среда) алкены превращаются в двухатомные спирты. Восстановителями служат атомы углерода, между которыми двойная связь.
Реакции протекают следующим образом:
Этен
Окисление пероксидом водорода
Пропен
2,3-диметилбутен-2
Окисление циклогексена
2. В жестких условиях (кислая среда) при окислении разрывается углеродная цепь по двойной связи, при этом образуются две кислоты или кислота и углекислый газ.
Пропен
2-метил-пропен
(Пентен-2)
3. В жестких условиях (сильнощелочная среда) при окислении также разрывается углеродная цепь по двойной связи, при этом образуются соль карбоновой кислоты и карбонат.
Пропен
(Пентен-2)
Часть 3. Окисление алкинов
Алкины окисляются в более жестких условиях, чем алкены, при окислении разрывается углеродная цепь по тройной связи, при этом образуются кислоты и углекислый газ. Продукты реакции зависят от условий проведения реакций и природы окислителя. Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их непредельность. Происходит при этом мягкое окисление без разрыва сигма С-С связи. Так получается щавелевая кислота.
Так получается щавелевая кислота.
1. Нейтральная среда
Этин
Окислительно-восстановительные реакции. И зачем мне это учить?
Для многих старшеклассников химия — наука непривлекательная. Не потому, что неинтересная, а потому что сложная. Мало знать только названия веществ и их классификацию. Суть химии именно в том, чтобы иметь чёткое понимание, как эти вещества взаимодействуют друг с другом, а значит, как протекают реакции между ними. Например, некоторые из них образуют соединения сразу же, как окажутся в одной колбе. Для других нужен свет, тепло или электрический ток.
А есть соединения, в ходе которых атом или молекула теряют более одного электрона. Звучит сложно. «Зачем мне это учить?» — спросите вы. Но такие процессы могут использоваться и в более узком смысле, означая реакции, в которых под воздействием кислорода образуется оксид — кислородосодержащие соединения. И называются они реакциями окисления.
Как в жизни
Окисление, а точнее окислительно-восстановительные реакции очень часто можно наблюдать в быту. Конечно, когда мы их наблюдаем, мы редко думаем о химии и о том, как протекают эти процессы между молекулами и атомами окружающих предметов. Но результат очень часто очевиден. Смотрите сами.
Конечно, когда мы их наблюдаем, мы редко думаем о химии и о том, как протекают эти процессы между молекулами и атомами окружающих предметов. Но результат очень часто очевиден. Смотрите сами.
Тёмная полоса
Формула: 4Ag + 2h3S + O2 → 2Ag2S + 2h3O.
Жизнь: Если у вас дома есть что-то серебряное, будь то украшения или посуда, то вы замечали, что часто они покрываются со временем тёмным налётом. И здесь замешана как раз эта самая реакция.
Как это происходит: Мы знаем, что одним из основных составляющих воздуха является кислород. Но мы вдыхаем не только его — вокруг нас витают и другие элементы в незначительных количествах. Например, в воздухе содержится сера. Вступая в реакцию с серебром, она и является виновницей образования потемнений.
И всё-таки зачем? Зная химию, мы можем удалить налёт с серебряных вещей, не покупая специальные средства, а с помощью подручных материалов: алюминиевой фольги, пищевой соды (NaHCOз), соли (NaCl) и кипятка. Нужно поместить потемневший предмет в ёмкость, покрытую фольгой, насыпав туда соду и соль и залив кипятком. При этом важно не допускать прямого контакта серебра с алюминием. Через некоторое время вы заметите, что налёт тускнеет и сходит. Как это объяснить?
При этом важно не допускать прямого контакта серебра с алюминием. Через некоторое время вы заметите, что налёт тускнеет и сходит. Как это объяснить?
Дело в том, что алюминий при взаимодействии с серой образует сульфидные соединения, более прочные, чем между серебром и серой. Поэтому в остатке и получается чистое серебро и «содружество» алюминия и серы. А выглядит это так:
3 Ag2S(т) + 2 Al(т) → 6 Ag(т) + Al2S3(т)
Но причём тогда здесь соль и сода? Сода удаляет тонкий слой гидроксида алюминия, который образуется на поверхности фольги, в результате чего образуются ионы алюминия, а уже потом запускается реакция с серебром. Соль же образует своеобразный мост, по которому циркулируют электроны во время реакции.
Ржавчина
Формула: Fe + O2 + h3O → Fe2O3 · xh3O
Жизнь: Реакции окисления служат причиной налёта не только на серебре, но и, например, на железе. Все когда-то видели ржавчину — это результат.
Как это происходит: Так же, как при контакте серебра с серой, при взаимодействии железа с водой под воздействием кислорода образуется специфический след, который мы и называем ржавчиной или коррозией.
И всё-таки зачем? Если мы с трудом можем удалить все примеси серы из воздуха, то мы можем позаботиться об удалении воды с железосодержащих поверхностей и изначально предотвратить образование ржавчины.
Опасный металл
Формула: 2Hg+O₂ ⟶ 2HgO
Жизнь: Несмотря на то, что сегодня большую популярность набирают электронные градусники, во многих домах, да и медицинских учреждениях пользуются более привычными ртутными. С детства нас учат, что ртуть опасна и с ней нужно быть очень осторожным. Но почему?
Как это происходит: Приведённая выше реакция окисления ртути происходит при экстремальном нагревании до 300०С. Однако этот жидкий металл опасен тем, что он испаряется даже при комнатной температуре, а эти пары попадают в организм при дыхании.
И всё-таки зачем? Эта ситуация вряд ли нуждается в разъяснении. Знание химии позволяет людям делать те же ртутные градусники герметичными: находясь внутри, ртуть никак не может повлиять на здоровье и жизнь человека. Также благодаря этой информации мы понимаем, что с ртутными градусниками нужно быть осторожными, а если они разбиваются, мы не удаляем ртуть голыми руками, а вызываем специальную службу, которая помогает справиться с последствиями безопасным для нас способом.
Также благодаря этой информации мы понимаем, что с ртутными градусниками нужно быть осторожными, а если они разбиваются, мы не удаляем ртуть голыми руками, а вызываем специальную службу, которая помогает справиться с последствиями безопасным для нас способом.
Конечно, химическая индустрия совершила значимый скачок, и, например, чтобы устранить последствия реакций окисления, мы можем купить уже готовое средство в магазине. Однако часто мы можем это сделать быстрее, зная принципы этих взаимодействий между элементами. А это здорово упрощает жизнь. Да и просто освежить в памяти школьные знания тоже бывает полезно.
Материал подготовлен при поддержке
Химия. ОВР — метод полуреакций
Сегодня мы научимся расставлять коэффициенты в окислительно-восстановительных реакциях (сокращенно ОВР) методом электронно-ионного баланса.
Задание обычно звучит так:
Подберите коэффициенты к уравнениям окислительно-восстановительной реакции, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
Для примера разберем следующую ОВР:
Cl2 + K2S + KOH → KCl + K2SO4 + H2O
С чего начать?
Первым делом «растворяем то, что растворяется», иначе говоря, растворимые соединения разбиваем на анионы (отрицательно заряженные ионы) и катионы (положительно заряженные ионы).
Для нашей реакции:
Сl20 + K21+ + S2- + K1+ + OH1- → K1+ + Cl1- + K21+ + SO42- + H2O
Сокращаем те ионы, которые повторяются и слева, и справа и получаем уравнение реакции в ионно-молекулярном виде:
Сl20 + S2- + OH1- → Cl1- + SO42- + H2O
Определим среду нашей ОВР. Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Расставим степени окисления над каждым атомом. Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Сl20 + S2- + O2-H1+ → Cl1- + S6+O42- + H2O2-
Видно, что в ОВР изменяются степени окисления хлора (было 0, стало 1-) и серы (было 2-, стало 6+).
Степень окисления хлора уменьшилась, т.е. он забрал себе лишние электроны. Степень окисления серы увеличилась, т.е. она электроны отдала. Ион, отдавший ионы, называется восстановителем; получивший электроны – окислителем.
Теперь записываем две полуреакции для серы и для хлора:
Cl20 → Cl1- — окислитель, полуреакция восстановления
S2- → SO42- — восстановитель, полуреакция окисления
После десятка-другого ОВР все описанное выше делается в уме за несколько секунд.
Теперь начинаем работать с выделенными полуреакциями.
Cl20 → Cl1-
Шаг первый: уравниваем количество атомов главного элемента (хлора).
Cl20 → 2Cl1-
Шаг второй: уравниваем количество атомов кислорода. У нас кислорода нет, едем дальше.
Шаг третий: уравниваем количество атомов водорода. Водорода тоже нет, едем дальше.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд 0, справа 2 заряда по -1, достаточно очевидно, что нужно добавить 2 электрона слева. Что мы и делаем:
Cl20 + 2е → 2Cl1-
Одна полуреакция готова. Принимаемся за вторую.
S2- → SO42-
Шаг первый: уравниваем количество атомов главного элемента (серы). У нас они уже равны, едем дальше.
Поскольку среда щелочная, шаг второй и шаг третий объединяем: нужно уравнять количества атомов кислорода и водорода, причем делать это нужно, добавляя слева ионы OH-, а справа молекулы воды. Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
S2- + 8OH— → SO42- + 4H2O
Все атомы уравнялись.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд -10, справа -2, вычитаем слева 8 электронов:
S2- + 8OH— — 8e → SO42- + 4H2O
Теперь выписываем наши уравненные полуреакции рядом. Хлор забирает 2 электрона, сера отдает 8 электронов, значит, чтобы все сошлось, необходимо умножить полуреакцию хлора на 4.
А если делать на автомате, то записываем количество электронов, сокращаем (если сокращается) и меняем местами. На получившееся число умножаем полуреакцию и собираем обратно в молекулярно-ионную запись.
Cl20 + 2е → 2Cl— 2→1→4
S2- + 8OH— — 8e → SO42- + 4H2O 8→4→1
4Сl20 + S2- + 8OH— → 8Cl— + SO42- + 4H2O
Проверяем, все ли сходится: хлора – по 8 атомов с каждой стороны, серы – по 1, водорода – по 8, кислорода – по 8.
С теми же коэффициентами переписываем полную ОВР.
4Cl2 + K2S + 8KOH → 8KCl + K2SO4 + 4H2O
Готово.
Для закрепления рассмотрим еще одну реакцию, на этот раз с кислой средой. Не буду расписывать так же подробно, только ключевые моменты.
K2Cr2O7 + Al + H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + H2O
Наметанным глазом сразу видно: степени окисления меняются у алюминия и у хрома. Выписываем полуреакции и уравниваем их.
Первая полуреакция:
Al0 → Al3+
Шаг первый: уравниваем количество атомов главного элемента – выполнено.
Шаг второй: уравниваем количество атомов кислорода – выполнено.
Шаг третий: уравниваем количество атомов водорода – выполнено.
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Al0 – 3e → Al3+
Вторая полуреакция:
Cr2O72- → Cr3+
Шаг первый: уравниваем количество атомов главного элемента.
Cr2O72- → 2Cr3+
Шаг второй: уравниваем количество атомов кислорода с помощью воды.
Cr2O72- → 2Cr3+ + 7H2O
Шаг третий: уравниваем количество атомов водорода c помощью ионов H+, потому что среда кислая. О том, что она кислая, нам говорит наличие кислоты в левой части реакции (если бы мы записали ионно-молекулярную форму реакции, слева остались бы ионы H+)
Cr2O72- + 14H+ → 2Cr3+ + 7H2O
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Выписываем полуреакции рядом и производим манипуляции с электронами:
Al0 – 3e → Al3+ 3→1→2
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O 6→2→1
Собираем две полуреакции в ионно-молекулярную реакцию, домножив, соответственно, на полученные числа.
Cr2O72- + 2Al0 + 14H+ → 2Cr3+ + 2Al3+ + 7H2O
Восстанавливаем полную реакцию, расставляя найденные коэффициенты:
K2Cr2O7 + 2Al + 7H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + 7H2O
Для проверки я обычно считаю, сходятся ли количества атомов кислорода: слева у нас 7+7*4=35 атомов, справа – 3*4+3*4+4+7=35 атомов.
Кислород сошелся, значит, все верно.
Любую ОВР можно уравнять описанным методом. Бывают, конечно, более сложные варианты, но смысл всегда один и тот же.
Дерзайте, и у вас все получится.
Если у Вас есть вопросы по решению данной задачи (или другой), пишите на наш e-mail [email protected], мы всегда готовы помочь.
С уважением, Botva-Project
Руководство по химии FIFA Mobile 21, советы и рекомендации
Сыгранность возвращается в FIFA Mobile 21. Командная сыгранность — это система, которая повышает ваш стартовый XI, когда вы включаете игроков из одного клуба, лиги, страны или особых событий.
В этом руководстве мы объясним вам все, что вам нужно знать о том, как работает химия в FIFA Mobile.
Содержание
Базовое руководство по химии
Командная сыгранность так же важна, как и общий рейтинг команды.Хорошая сыгранность даст вам больше шансов в матчах против атаки (VSA) или лиги против лиги (LvL).
Чтобы получить рейтинг командной сыгранности, у вас должно быть как минимум 2 элитных игрока, связанных чем-то похожим (Клуб/Лига/Нация/Событие).
Химия показана на экране «Начальный 11» цветной линией между игроками. Зеленый цвет указывает на хорошую химию, зеленый (светлый) цвет указывает на отличную химию, а серый цвет указывает на отсутствие химии.
Чтобы просмотреть статистику сыгранности каждого игрока в вашем стартовом составе, щелкните переключатель «Просмотр сыгранности» в правом верхнем углу вкладки «Starting 11».
НАШИ ПОСЛЕДНИЕ ВИДЕО
Умения FIFA Mobile Икс
Для просмотра этого видео включите JavaScript и рассмотрите возможность перехода на веб-браузер, который поддерживает HTML5 видео
Важно отметить, что числа справа от каждого игрока — это химия, которую этот игрок дал всем связанным игрокам, а числа слева — это химия, полученная этим игроком от связанных игроков.
Team Chemistry работает только с игроками с ОБЩ 80+. Это означает, что если вы свяжете бронзового, серебряного или золотого игрока с элитным игроком, это не сработает. Вы должны обучить этого бронзового/серебряного/золотого игрока до элиты.
Индикатор рядом с ОБЩ вашей команды показывает, сколько общей сыгранности вы получили от всех игроков в вашем стартовом составе.
Краеведческая химия
В FIFA Mobile 21 EA изменила способ определения сыгранности игроков. Сыгранность в точных лигах теперь расширена до региональных групп.
Что такое Chem Group Players? Chem Group Players — это региональные химические группы, включающие несколько лиг, так что теперь у вас есть больше возможностей объединить больше игроков для добавления химии. Например, игроки химической группы Германии — это игроки из Бундеслиги, у которых будут химические связи с игроками из Бундеслиги 2, 3. Лиги и наоборот. Игроки Химической группы Италии — это игроки из Серии А TIM, которые будут иметь Химические связи с игроками из «Calcio B», и наоборот.
Региональные химические группы
Ниже приведен полный список игроков региональной химической группы в FIFA Mobile.
Игроки химической группы Англии:
- Премьер-лига
- Чемпионат EFL
- EFL League 1
- EFL League 2
France Chem Group Игроки:
- Лига 1 Uber Eats
- Лига 2 BKT
Италия Chem Group Игроки:
- Serie A TIM
- «Calcio B»
Игроки German Chem Group
- Бундеслига
- Бундеслига 2
- 3.Лига
Испания Chem Group Игроки:
- LaLiga Santander
- LaLiga Smartbank
Western Europe Chem Group Players:
- Liga Nos (Португалия)
- Eredivisie (Нидерланды)
- 1A Pro League (Бельгия)
- Scottish Prem (Шотландия)
- SSE Liewricity Lge (Ирландия)
Восточная Европа Chem Group Players:
- РГБ (Швейцария)
- О.
 Bundesliga (Австрия)
Bundesliga (Австрия) - 3F Superliga (Дания)
- Eliteserien (Норвегия)
- Allsvenskan (Швеция)
- PKO Ektstraklasa (Польша)
- Liga I (Румыния)
- Super Lig (Турция)
- «Finnliga» ( Финляндия)
- «Ческа Лига» (Чехия)
- «Лига России» (Россия)
- «Украина Лиха» (Украина)
- «Лига Хорватская» (Хорватия)
- «Эллада Лига» (Греция) 9004ce
Остальные игроки World Chem Group:
- MLS (США/Канада)
- Liga BBVA MX (Мексика)
- LPF (Аргентина)
- CSL (Китай)
- K-League 1 (Южная Корея)
- A-League (Австралия)6
- Hero ISL (Индия)
- MBS Pro League (Саудовская Аравия)
- United Emirates League (ОАЭ)
- South African FL (Южная Африка)
| Англия | Чемпионат премьер-министр EFL EFL League 1 EFL League 2 | |
| Ligue 1 Uber Eats Ligue 2 BKT | ||
| Италия | Serie Tim » «Кальчо Б» | |
| Германия | Бундеслига Бундеслига 2 3.  Liga Liga | |
| Испания | Laliga Santander Laliga Smartbank | |
| Западная Европа | Liga Nos (Португалия) | Edivisie (Нидерланды) 1a Pro League (Бельгия) Scottish Prom (Шотландия) SSE LGE LGE (Ирландия) ) |
| Восточная Европа | RSL (Швейцария) O. Bundesliga (Австрия) 3F Superliga (Дания) Eliteserien (Норвегия) Allsvenskan (Швеция) PKO Ektstraklasa (Польша) Liga I (Румыния) Super Lig (Турция) «Финнлига» (Финляндия) «Ческа Лига» (Чехия) «Лига России» (Россия) «Украина Лиха» (Украина) «Лига Хорватская» (Хорватия) «Эллада Лига» (Греция) | |
| Остальной мир | MLS (США/Канада) Liga BBVA MX (Мексика) LPF (Аргентина) CSL (Китай) K-League 1 (Южная Корея) A-League (Австралия) /Новая Зеландия) Hero ISL (Индия) MBS Pro League e (Саудовская Аравия) «Объединенные Эмираты Лига» (ОАЭ) «Южно-Африканская Флорида» (ЮАР) |
Как повысить и максимизировать сыгранность вашей команды
Вот несколько советов и приемов, которые вы можете использовать, чтобы повысить и максимизировать сыгранность вашей команды.
Не будь слишком тематическим
Составление команды только из 1 клуба или 1 страны, безусловно, позволяет легко максимизировать командную химию. Но ваш отряд потеряет свою гибкость, и новым игрокам будет сложно войти в него.
Кроме того (когда я пишу эту статью) сейчас только начало сезона и будет много событий, в которых, конечно же, будут участвовать новые и лучшие игроки (TOTY, TOTS, Carniball, Easter, Boxing Day, Heartbreakers, Retro Stars, Лига Европы, День Благодарения и т. д.).
Посмотрите статистику сыгранности, прежде чем покупать игроков на рынке
Химическую статистику можно увидеть в правом нижнем углу страницы профиля. Просматривая статистику сыгранности перед покупкой игроков на рынке, вы можете рассчитать, сколько очков сыгранности игрок даст команде и сколько очков сыгранности он получит. Это потому, что каждая карта имеет разные значения химии.
Если возможно, выбирайте карты из новых событий, а не из базовых или старых событий.

Обычно игроки, участвующие в таких событиях, как UCL, Football Freeze, STPD, Top Transfer, TOTW, Treasure Hunt, National Heroes, Ultimate Memories: Flashbacks или Lunar, получают и дают больше очков сыгранности, чем базовые карты.
При этом, если все игроки в ваших стартовых 11 участвуют в специальных событиях и хорошо связаны (один и тот же клуб/региональные лиги/нация/программа), ваша сыгранность будет расти быстрее.
В середине и конце сезона EA всегда будет выпускать новые карты с более высоким максимальным количеством очков сыгранности.
Участвуйте в турнире лиги и получайте очки навыков
В этом сезоне вы также можете улучшить сыгранность своей команды, используя бонусы. Участвуйте в турнирах лиги и зарабатывайте очки способностей, а затем обменивайте их на усиление сыгранности и максимальную сыгранность. Все о перках читайте здесь.
Максимальная сыгранность в FIFA Mobile составляет 120. Вы можете увеличить этот лимит, используя очки навыков, чтобы получить больше максимальной сыгранности.
Повышение уровня химии против максимального уровня химии
В этом разница между повышением сыгранности и максимальной сыгранностью в FIFA Mobile.Многие из вас сбиты с толку, когда дело доходит до получения этих наград за ваши очки способностей.
Повышение химии
Что такое Повышение химии и что делает Повышение химии в FIFA Mobile?
Повышение сыгранности — это бонус, который вы можете использовать для повышения сыгранности вашей команды. Чтобы усиление сыгранности вступило в силу, сыгранность вашей команды должна быть ниже вашей максимальной сыгранности.
Макс Химия
Что такое Max Chemistry и что делает Max Chemistry в FIFA Mobile?
Max Chemistry — максимальный предел сыгранности вашей команды.Повышая максимальную сыгранность с помощью очков навыков, вы тем выше сможет подняться сыгранность вашей команды.
Я надеюсь, что это руководство по сыгранности в FIFA Mobile 21 Season 5 поможет вам создать лучшую команду. Если у вас есть какие-либо вопросы, сообщите нам об этом в комментариях ниже.
Если у вас есть какие-либо вопросы, сообщите нам об этом в комментариях ниже.
3 способа увеличить общий рейтинг команды и сыгранность в FIFA MOBILE 2020
Одной из самых популярных футбольных игр является FIFA MOBILE , которая доступна в игровом магазине. Эта игра — отличная платформа для любителей футбола.Вы можете создать уникальную команду с различными игроками из разных команд и построить общий рейтинг сыгранности. Есть два типа режимов игры: VSA (против атаки) и h3H (голова 2 головы). Оба режима имеют уровни, и все они такие же, как в PUBG. Как и в случае с Royal Pass, в этой игре есть Star Pass за те же 800 индийских рупий. Одним из недостатков игры является то, что сетка ворот все время будет односторонней. Итак, в этом уроке я собираюсь показать, как создать хороший общий рейтинг и химию. Для всех игроков существует рынок, где вы можете покупать/продавать игроков за монеты FIFA.
Как улучшить общий обзор и сыгранность в FIFA MOBILE 2020?Вот способы сделать это:
Рыночная стратегия: Дело в том, что мы должны купить элиту (игроков с 80+ O O). Отфильтруйте их и купите. Вы можете получить почти 90 OVR, просто покупая хороших игроков. Выбирайте хорошего игрока на каждую позицию и всегда повышайте уровень бустеров навыков.
Отфильтруйте их и купите. Вы можете получить почти 90 OVR, просто покупая хороших игроков. Выбирайте хорошего игрока на каждую позицию и всегда повышайте уровень бустеров навыков.
Вы также можете увеличить общий рейтинг 11 игроков, используя тренировочный опыт и монеты FIFA. Но когда мы будем продавать игроков с увеличенным ОБЩ на рынке, их ОБЩ будет сброшен. Например, если вы покупаете Месси с ОБЩ 94 и увеличиваете его до 96, используя тренировочный опыт и монеты, то по какой-то причине, если вы хотите продать этого Месси на рынке, ему снова будет 94 на рынке. Ваш тренировочный опыт будет потрачен впустую.
Путем улучшения навыков игроков:В верхней части каждого игрока есть такие, как +7, +6 указывает на навыки этих игроков.Бустеры навыков также повышают общий рейтинг команды.
Способы увеличить СХЕМУ : Выбор игроков из одной страны , лиги или команды сделает команду вашей мечты более сыгранной . Зеленая линия указывает на химию между игроками, а толстая линия означает больше химии. Изменив расстановку, химия и ОБЩ также будут изменены.
Зеленая линия указывает на химию между игроками, а толстая линия означает больше химии. Изменив расстановку, химия и ОБЩ также будут изменены.
Вы также можете повысить сыгранность команды, разблокировав бонусы за очки навыков.
Есть способ зарабатывать бонусные очки, ежедневно играя в турнирах лиги. Количество привилегий, присуждаемых за турнир лиги, будет зависеть от известности лиги. Итак, присоединяйтесь к хорошей лиге, которая проводит ежедневные турниры.
Таким образом, мы также получаем бонусы для увеличения сыгранности, ОБЩ и состава.
Для получения дополнительной информации или любых сомнений по поводу игры , комментарий ниже.
А также всегда старайтесь участвовать во всех еженедельных событиях, чтобы получить легендарных игроков с ОБЩ 90 и выше.
Осторожно:
Никогда не пытайтесь использовать монетоприемники или генераторы наличных. Это приведет к блокировке учетной записи FIFA.
Это приведет к блокировке учетной записи FIFA.
А также не заходить ни в какие мод APKS из неизвестных источников.
См. также…
Почему вы должны попробовать бесплатный игровой сервер? (Открывается в новой вкладке браузера)
ПохожиеFIFA Mobile Chemistry – FIFPlay
Сыгранность — это фактор в FIFA Mobile, который повышает эффективность вашей команды на поле, когда ваши игроки в стартовом составе 11 представляют один и тот же клуб, лигу, страну и/или особые события.
После рейтинга OVR командная химия является вторым важным фактором для вашей команды. Чем выше сыгранность, тем больше у вас шансов получить матчи против атаки (VSA) и лиги против лиги (LvL).
Как разблокировать командную химию
Чтобы разблокировать командную химию, вам нужно достичь 7-го уровня. У вас должно быть как минимум 2 элитных игрока, объединенных общими чертами, такими как клуб, лига и/или национальность.
Командная химия доступна только для игроков с ОБЩ 80+.Любые другие игроки, такие как серебро или золото, связанные с элитным игроком (игрок ОБЩ 80+), не получат химии.
Как увидеть командную химию
Сыгранность показана цветными линиями между игроками в вашем стартовом составе 11 (на экране МОЯ КОМАНДА). Зеленая линия означает хорошую химию, ярко-светло-зеленый цвет указывает на лучшую химию, а серый контур означает отсутствие химии.
Количество очков командной сыгранности, которое вы получите за 11 стартовых матчей, отображается в правой части экрана рядом с ОБЩ вашей команды.Максимальный номер химии, который вы можете получить, равен 120.
Химический вид
Вы можете увидеть статистику сыгранности каждого игрока в вашем стартовом составе, включив кнопку «Просмотр сыгранности», которая доступна при нажатии переключателя «Просмотр сыгранности» в правой части экрана МОЯ КОМАНДА.
В представлении сыгранности числа, показанные в правом столбце, представляют собой сыгранность, переданную этим игроком всем связанным игрокам, а числа в левом столбце — это сыгранность, полученная этим игроком от связанных игроков.
Как получить высшую химию
Чтобы максимизировать сыгранность вашей команды, вам необходимо иметь элитных игроков в стартовом составе со следующими факторами:
- Игроки из одного клуба, лиги, страны или игроки из одного турнира
- Игроки заняли свои предпочтительные позиции
Похожие сообщения
Что такое ОВР в современной химии?
Поговорим о том, что такое ОВР в неорганическом и органическом синтезе.
Определение процесса
Окислительно-восстановительные реакции включают те процессы, которые приводят к изменению степени окисления двух или более химических элементов в сложных или простых веществах.
Что такое окисление?
Под окислением понимается такая химическая реакция, в которой атом или определенный ион отдает электроны, понижая при этом свою начальную степень окисления. Этот процесс характерен для металлов.
Что такое восстановление?
Под процессом восстановления понимают химическое превращение, результатом которого будет уменьшение степени окисления в ионе или простом веществе с присоединением электронов. Эта реакция характерна для неметаллов и кислотных остатков.
Эта реакция характерна для неметаллов и кислотных остатков.
Характеристика восстановителя
Рассматривая вопрос, что такое ОВР, нельзя обойти вниманием такое понятие, как «восстановитель».
Под ним понимается нейтральная молекула или заряженный ион, который в результате химического взаимодействия отдаст другому иону или атому электрон, увеличивая при этом степень его окисления.
Определение окислителя
В споре о том, что такое ОВР, также важно упомянуть еще и такой термин, как «окислитель». Под этим принято понимать такие ионы или нейтральные атомы, которые при химическом взаимодействии будут брать отрицательные электроны от других атомов или нейтральных частиц.При этом уменьшится его начальная степень окисления.
Виды ОБР
Рассуждая о том, что такое ОВР, необходимо отметить о тех разновидностях этих процессов, которые чаще всего рассматриваются в неорганическом и органическом синтезе.
Межмолекулярные взаимодействия предполагают такие процессы, при которых атомы как восстановителя, так и окислителя находятся в разных исходных веществах, вступающих во взаимодействие. Примером такого превращения является взаимодействие оксида марганца (4) с соляной кислотой, в результате которого образуются газообразный хлор, двухвалентный хлорид марганца и вода.
Примером такого превращения является взаимодействие оксида марганца (4) с соляной кислотой, в результате которого образуются газообразный хлор, двухвалентный хлорид марганца и вода.
В этом химическом процессе анионы хлора кажутся окисляющими при взаимодействии. Катион марганца (со степенью окисления +4) проявляет окислительные способности, в реакции, принимая два электрона, восстанавливается.
Внутримолекулярное взаимодействие представляет собой такие химические превращения, поскольку и атомы восстановителя, и атомы окислителя первоначально представляют собой одно исходное вещество, а после завершения превращения находятся в различных продуктах реакции.
В качестве примера такого типа реакции можно представить разложение хлората калия.При нагревании это вещество превратится в хлорид калия и кислород. Окислительные свойства будут характерны для хлорат-аниона, который, принимая в реакции пять электронов, будет восстанавливаться до хлорида.
В этом случае анион кислорода будет проявлять восстановительные свойства, окисляясь до молекулярного кислорода. Так что же такое ОВР в данном случае? Это процесс переноса электронов между ионами, приводящий к образованию двух продуктов реакции.
Так что же такое ОВР в данном случае? Это процесс переноса электронов между ионами, приводящий к образованию двух продуктов реакции.
Также к этому виду химических превращений, протекающих с изменением степеней окисления элементов, первоначально встречающихся в одной формуле, относится процесс разложения нитрита аммония.Азот, стоящий в составе катиона аммония, имеющего степень окисления -3, в процессе отдает шесть электронов и окисляется до молекулярного азота. А тот азот, который входит в состав нитрита, забирает шесть электронов, при этом он является восстановителем, а в ходе реакции окисляется.
Что такое ОВР по химии? Рассмотренное выше определение показывает, что это превращения, связанные с изменением у некоторых элементов степеней окисления.
Самоокисление и восстановление (диспропорционирование) предполагают такие процессы, в ходе которых в качестве восстановителя и окислителя присутствует один исходный атом, который будет повышать, и одновременно снижать свою степень окисления после завершения взаимодействия. Рассуждая о том, что такое ОВР в химии, примеры таких превращений можно найти даже в курсе химии в средней школе. Разложение сульфита калия при нагревании приводит к образованию двух солей этого металла: сульфида и сульфата. Сера со степенью окисления +4 проявляет как восстановительные, так и окислительные свойства, повышая и понижая степень окисления.
Рассуждая о том, что такое ОВР в химии, примеры таких превращений можно найти даже в курсе химии в средней школе. Разложение сульфита калия при нагревании приводит к образованию двух солей этого металла: сульфида и сульфата. Сера со степенью окисления +4 проявляет как восстановительные, так и окислительные свойства, повышая и понижая степень окисления.
Чтобы понять, что означает ОВИ в химии, назовем еще один вид таких химических превращений.Противопропорциональность предполагает такие процессы, в результате которых атомы восстановителя и окислителя находятся в составе разных исходных компонентов, но с правой стороны образуют один продукт реакции. Например, при взаимодействии оксида серы (4) с сероводородом будут образовываться сера и вода. Ион серы со степенью окисления +4 примет четыре электрона, а ион серы со степенью окисления -2 потеряет два электрона. В результате они оба превращаются в простое вещество, у которого степень окисления равна нулю.
Заключение
Рассматривая вопрос о том, что такое ОВР в химии, отметим, что это многочисленные превращения, посредством которых функционируют живые организмы, происходят различные природные процессы и явления. Чтобы расставить коэффициенты в таких уравнениях, необходимо составить электронный баланс.
Чтобы расставить коэффициенты в таких уравнениях, необходимо составить электронный баланс.
Какой самый высокий ОБЩ в FIFA Mobile?
Икарди 98 ЛЧ.Как получить ваучер на привилегии?
очка League Matchups можно обменять на эксклюзивные награды в главе «Награды».Чем больше очков за матчи лиги вы заработаете, тем выше вы окажетесь в таблице лидеров. И чем выше ваше место в таблице лидеров, тем больше ваучеров на привилегии вы получите.
Есть ли сезонный режим в FIFA Mobile?
Играя в программу FIFA Mobile Seasons, вы можете играть в реальных мировых лигах, зарабатывать очки и получать такие награды, как сезонные очки, сезонные медали, монеты, улучшения навыков, обычные осколки и карты игроков. Завершив дивизион, вы получите сезонного игрока в награду за дивизион.…
Как разблокировать химию?
Чтобы разблокировать командную химию, вам нужно достичь уровня 7. У вас должно быть как минимум 2 элитных игрока, объединенных общими чертами, такими как клуб, лига и/или национальность. Командная химия доступна только для игроков с ОБЩ 80+.
Командная химия доступна только для игроков с ОБЩ 80+.
Что такое химия в FIFA?
Сыгранность показывает, насколько хорошо игрок будет играть на поле, и показывает связи между товарищами по команде. Высокие показатели сыгранности игроков и команды в целом имеют решающее значение для полной реализации потенциала вашей команды, а более низкие значения сыгранности резко снижают возможности игроков в игре.
Как сменить регион в fifa21?
В главном меню перейдите в «Настройки сети», затем «Параметры подбора игроков» и включите «Приблизительный подбор местоположения». Это использует ваш IP-адрес, чтобы найти противника ближе к вам.
Что такое игроки FGS FIFA 21?
жетона игрока FIFA 21 FGS можно получить, наблюдая за соревнованием FGS на канале EA Twitch, когда ваша учетная запись Twitch связана с Twitch EA. Эти карты игроков не подлежат обмену и могут быть использованы для обмена FIFA 21 SBC FGS.
Как получить монеты в FIFA 21?
Фермерство монет — это когда вы получаете монеты быстро и незаконно, либо используя ботов в аукционном доме, либо обманывая игру, заставляя ее думать, что вы играете в матчи, когда это не так. Когда вы храните много монет на своем счету, это очень круто. При условии, что вы правильно зарабатываете эти монеты в игре.
Когда вы храните много монет на своем счету, это очень круто. При условии, что вы правильно зарабатываете эти монеты в игре.
Когда открывается сыгранность команд в FIFA Mobile 21?
Командная химия разблокируется на уровне 7, и у вас должно быть как минимум 2 элитных игрока, связанных вместе чем-то похожим (Клуб/Лига/Нация/Событие).Сыгранность показана на экране «Starting 11» цветной линией между игроками. Зеленый цвет указывает на хорошую химию, зеленый (светлый) цвет указывает на отличную химию, а серый цвет указывает на отсутствие химии.
Где я могу получить второе дыхание в FIFA 21?
Виртуальный профи — клубы профи: вы можете получить эту черту для своего виртуального профи FIFA Pro Clubs, приобретя черту игрока «Второе дыхание» в дереве физических навыков. Виртуальный профессионал — режим карьеры: вы можете приобрести эту черту для своего профессионала в карьере игрока.
Где взять черты игрока в FIFA 21?
Виртуальный профессионал — режим карьеры: вы можете получить эту черту для своего профессионала в карьере игрока. Виртуальный профи — клубы профи: вы можете получить эту черту для своего виртуального профи FIFA Pro Clubs, приобретя черту Power Header Player в дереве навыков стрельбы. VOLTA FOOTBALL: поведение позиционирования не применяется. Длинное вбрасывание
Виртуальный профи — клубы профи: вы можете получить эту черту для своего виртуального профи FIFA Pro Clubs, приобретя черту Power Header Player в дереве навыков стрельбы. VOLTA FOOTBALL: поведение позиционирования не применяется. Длинное вбрасывание
Каковы правила молодежного футбола в США?
Раздел 1. (a) За исключением случаев, предусмотренных Молодежным футболом США и его ассоциациями штатов, продолжительность игр, периоды овертайма и размер мяча для каждой возрастной группы следующие: (b) В турнирной игре, если игра по-прежнему равна после овертайма для определения победителя применяются правила ФИФА «Удары с пенальти».Раздел 2.
Где я могу найти Soccer Aid World XI?
Футбольный клуб Soccer Aid World XI теперь доступен для версий игры для PlayStation 4, Xbox One и ПК. Как я могу играть за команду Soccer Aid World XI? Играть за команду очень просто: убедитесь, что у вас включена живая форма, а в игре «Быстрый матч» перейдите в категорию «Остальной мир», и там вы найдете команду Soccer Aid.
Когда выйдет FIFA 18?
FIFA 18 — видеоигра-симулятор футбола, выпущенная Electronic Arts как часть серии FIFA.Fifa 18 была выпущена во всем мире 29 сентября 2017 года для Microsoft Windows, PlayStation 3, PlayStation 4, Xbox 360, Xbox One и Nintendo Switch. Это 25-й выпуск в серии FIFA.
Как попасть на сайт молодежного футбола США?
Стрелки вверх и вниз открывают меню основного уровня и переключают ссылки на подуровни. Enter и пробел открывают меню, а escape также закрывает их. Tab перейдет к следующей части сайта, а не к пунктам меню. Кто такой американский молодежный футбол? Кто такой американский молодежный футбол?
апгрейдов — Cordarrelle Patterson — 22 — 90 OVR Vets
- Тупоголовый
- Игроки
- Кордаррелл Паттерсон
- Обновления
Тупоголовые цены
35. 3К
-19,9%
33,1 тыс.
-27,4%
50 тыс.
-1,2%
Обзор
Цены
Обновления Сравнивать
3К
-19,9%
33,1 тыс.
-27,4%
50 тыс.
-1,2%
Обзор
Цены
Обновления Сравнивать Исследуйте свойства
- Фэндом
- Геймпедия
- D&D Beyond
- Футхед
- Тупоголовый
Подписывайтесь на нас
Обзор
- О
- Карьера
- Пресс
- Контакт
- Политика конфиденциальности
- Условия использования
- Условия продажи
- Глобальная карта сайта
- Локальная карта сайта
Сообщество
- Центр сообщества
- Поддержка
- Справка
- Не продавать мою информацию
Реклама
- Медиа-кит
- Контакт
Muthead — это фэндом игрового сообщества.
Как увеличить общий рейтинг и сыгранность в FIFA Mobile 20: получить 100 игроков общего рейтинга в FIFA Mobile
Как увеличить общий рейтинг и сыгранность в FIFA Mobile 20: получить 100 игроков общего рейтинга в FIFA Mobile
Дата: 27.05.2020 08:48
Игроки всегда хотят найти в Google ответ на вопрос: «Как увеличить общее количество очков в FIFA Mobile? & Как вы получаете лучших игроков в FIFA Mobile?» Сегодня мы поможем вам решить эту проблему.
Как улучшить ОБЩ игроков:
Вы также можете повысить общий рейтинг 11 игроков, используя тренировочный опыт и монеты FIFA.Но когда мы будем продавать игроков с увеличенным ОБЩ на рынке, их ОБЩ будет сброшен. Например, если вы покупаете Месси с ОБЩ 94 и увеличиваете его до 96, используя тренировочный опыт и монеты, то по какой-то причине, если вы хотите продать этого Месси на рынке, ему снова будет 94 на рынке. Ваш тренировочный опыт будет потрачен впустую.
Например, если вы покупаете Месси с ОБЩ 94 и увеличиваете его до 96, используя тренировочный опыт и монеты, то по какой-то причине, если вы хотите продать этого Месси на рынке, ему снова будет 94 на рынке. Ваш тренировочный опыт будет потрачен впустую.
Вы можете усиливать своих игроков, повышая их общий рейтинг и атрибуты, повышая уровень усиления навыков. К каждому игроку прикреплено усиление навыков, которое обеспечивает повышенные атрибуты.Полный бонус повышения навыка применяется, когда игрок находится на позиции, а частичный бонус применяется в альтернативной позиции. Усиления не применяются, если игроки находятся слишком далеко от своего исходного положения.
Как улучшить химию:
Химия позволяет вам использовать игроков с похожим опытом, чтобы получить преимущества на поле. Игроки из похожих клубов, лиг или стран дают очки сыгранности всем связанным игрокам. Общая командная сыгранность влияет на производительность вашей команды в VS Attack и Head to Head.
Позиция игрока — Позиция игрока, отмеченная под его карточкой, будет отображаться красным, оранжевым или зеленым цветом. Красный означает, что они полностью не на своей позиции, что снижает сыгранность как игроков, так и команд. Оранжевый означает, что они частично не на своей позиции, что снижает сыгранность игрока и команды. Зеленый означает, что они находятся в своей предпочтительной позиции, увеличивая сыгранность игроков и команд. Ссылки на игроков — Обозначенные цветными линиями между игроками, они снова будут отображаться как красные, оранжевые или зеленые.На этот раз то, что общего у двух связанных игроков (вне клуба, лиги и национальности), определяет цвет связи. Красный не имеет ничего общего, уменьшая сыгранность игрока и команды. Оранжевый означает одну общую черту: повышение сыгранности игроков и команд. Обратите внимание, что это отличается от результата оранжевого индикатора позиции игрока. Зеленый означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на оранжевый цвет. Однако реальный результат определяется всеми ссылками игрока: см. красный как -1, оранжевый как +1 и зеленый как +2.Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии. Лояльность — Игроки, сыгравшие 10 или более матчей за ваш клуб, получат бонус лояльности, повышающий их сыгранность на 1. На это указывает значок зеленого щита на их карточке.
Однако реальный результат определяется всеми ссылками игрока: см. красный как -1, оранжевый как +1 и зеленый как +2.Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии. Лояльность — Игроки, сыгравшие 10 или более матчей за ваш клуб, получат бонус лояльности, повышающий их сыгранность на 1. На это указывает значок зеленого щита на их карточке.
Конечно, чтобы повысить ОБЩ, нужно улучшить атрибут игрока. В этой ситуации вам понадобится помощь FIFA Mobile Coins. Лучшее место для купить дешевые FIFA Mobile Coins — это безопасный рынок z2u.ком , безопасно, дешево, огромный запас.
« Spotify Premium предлагает новым пользователям трехмесячную бесплатную пробную версию до 30 июня. Как получить больше бесплатных монет, бриллиантов и жизней на Fishdom для IOS и Android » .

 Кто первый доберется и отгадает слово, тот и победитель!
Кто первый доберется и отгадает слово, тот и победитель! А в организации станции «По следам неизвестного вещества».
А в организации станции «По следам неизвестного вещества». Давать характеристику химическим уравнениям по известным типам реакций. Умение практически осуществлять генетические цепочки на взаимосвязи веществ в неорганической и органической химии.
Давать характеристику химическим уравнениям по известным типам реакций. Умение практически осуществлять генетические цепочки на взаимосвязи веществ в неорганической и органической химии.
 Перед вами стоит задача, применив те знания, которые вы получили в 8 классе, собрать паззл химических уравнений. Расставить коэффициенты методом электронного баланса.
Перед вами стоит задача, применив те знания, которые вы получили в 8 классе, собрать паззл химических уравнений. Расставить коэффициенты методом электронного баланса.
 Им необходимо осуществить химические превращения между взаимодействующими реагентами и записать только ОВР в карту-инструкцию.
Им необходимо осуществить химические превращения между взаимодействующими реагентами и записать только ОВР в карту-инструкцию. Научились расставлять коэффициенты?
Научились расставлять коэффициенты?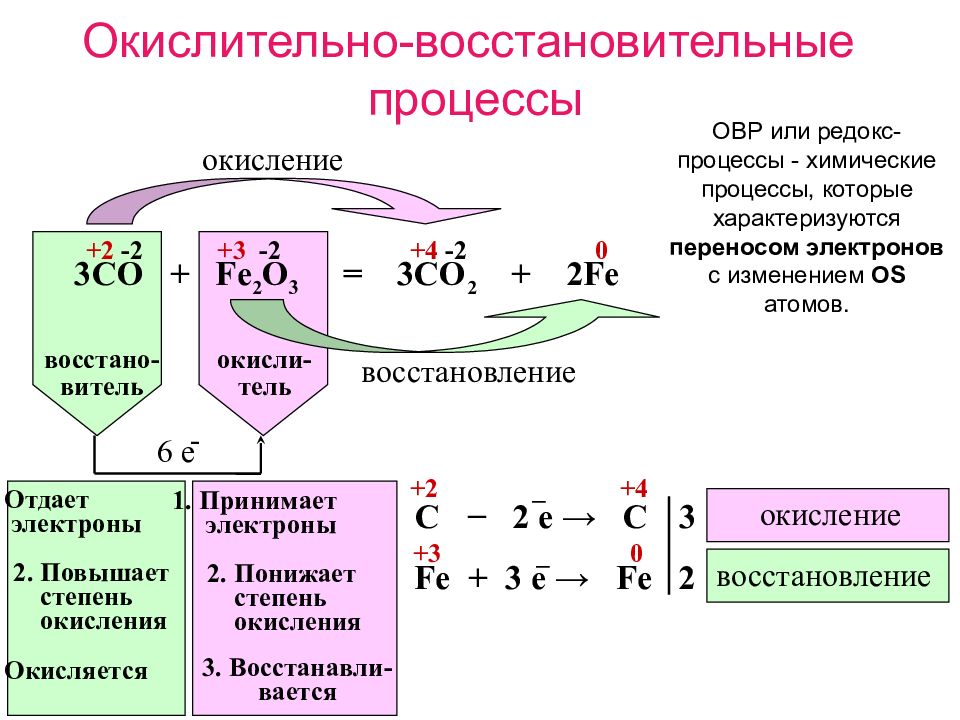
 Ca + h3SO4 = CaSO4 + h3
Ca + h3SO4 = CaSO4 + h3
 Bundesliga (Австрия)
Bundesliga (Австрия)