Хром — это… Что такое Хром?
| Внешний вид простого вещества | |
|---|---|
 Твёрдый металл голубовато-белого цвета | |
| Свойства атома | |
| Имя, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961 а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | -0.74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K |
| Температура кипения | 2945 K |
| Теплота плавления | 21 кДж/моль |
| Теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3[1] Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[2], Бразилии, на Филиппинах[3].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2 место в мире)[3].
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mn, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Физические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром имеет твердость по шкале Мооса 5.[4] Очень чистый хром достаточно хорошо поддаётся механической обработке.
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6. (см. табл.) Практически все соединения хрома окрашены
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Не существует | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3(зелёный) | Cr(OH)3 | Амфотерный | Cr3+ (зеленые или лиловые соли) [Cr(OH)4]— (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3(красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42- (хроматы, желтые) Cr2O72- (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[6]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+ до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (рассплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Интересные факты
- Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[7]
См. также
Примечания
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dic.academic.ru
Шестивалентный хром Википедия
| Хром | |
|---|---|
| ← Ванадий | Марганец → | |
| Твёрдый металл голубовато-белого цвета | |
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3[2] Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Хром — элемент 6-й группы (по устаревшей классификации — побочной подгруппы 6-й группы) 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром — твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам.
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл ( Воклен получил карбид хрома). Он прокалил зелёный оксид Cr2O3 с углём и выделил тугоплавкий металл (с примесью карбидов). Сам оксид Cr2O3 Воклен получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4.
Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах ХХ в.
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,03 % по массе)[3]. Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении[4], Бразилии, на Филиппинах[5].
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире)[5].
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2+4C→Fe+2Cr+4CO{\displaystyle {\mathsf {Fe(CrO_{2})_{2}+4C\rightarrow Fe+2Cr+4CO}}}
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2{\displaystyle {\mathsf {4Fe(CrO_{2})_{2}+8Na_{2}CO_{3}+7O_{2}\rightarrow 8Na_{2}CrO_{4}+2Fe_{2}O_{3}+8CO_{2}}}}
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr2O7+2C→Cr2O3+Na2CO3+CO{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+2C\rightarrow Cr_{2}O_{3}+Na_{2}CO_{3}+CO}}}
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+2Al→Al2O3+2Cr+130kcal{\displaystyle {\mathsf {Cr_{2}O_{3}+2Al\rightarrow Al_{2}O_{3}+2Cr+130kcal}}}
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72−+14H++12e−→2Cr+7h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+14H^{+}+12e^{-}\rightarrow 2Cr+7H_{2}O}}}
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 8.5[6], один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Известны изотопы хрома с массовыми числами от 42 до 67 (количество протонов 24, нейтронов от 18 до 43) и 2 ядерных изомера.
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83.789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Среди искусственных изотопов самый долгоживущий 51Cr (период полураспада 27 суток). Период полураспада остальных не превышает одних суток.
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены[7].
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- 2Cr3+→Zn,HCl[H]2Cr2+{\displaystyle {\mathsf {2Cr^{3+}{\xrightarrow[{Zn,HCl}]{[H]}}2Cr^{2+}}}}
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды[8]. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3++3Nh4+3h3O→Cr(OH)3↓+3Nh5+{\displaystyle {\mathsf {Cr^{3+}+3NH_{3}+3H_{2}O\rightarrow Cr(OH)_{3}\downarrow +3NH_{4}^{+}}}}
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3++3OH−→Cr(OH)3↓{\displaystyle {\mathsf {Cr^{3+}+3OH^{-}\rightarrow Cr(OH)_{3}\downarrow }}}
- Cr(OH)3+3OH−→[Cr(OH)6]3−{\displaystyle {\mathsf {Cr(OH)_{3}+3OH^{-}\rightarrow [Cr(OH)_{6}]^{3-}}}}
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3+2NaOH→2NaCrO2+h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+2NaOH\rightarrow 2NaCrO_{2}+H_{2}O}}}
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3+6HCl→2CrCl3+3h3O{\displaystyle {\mathsf {Cr_{2}O_{3}+6HCl\rightarrow 2CrCl_{3}+3H_{2}O}}}
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6]+3h3O2→2Na2CrO4+2NaOH+8h3O{\displaystyle {\mathsf {2Na_{3}[Cr(OH)_{6}]+3H_{2}O_{2}\rightarrow 2Na_{2}CrO_{4}+2NaOH+8H_{2}O}}}
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O{\displaystyle {\mathsf {2Cr_{2}O_{3}+8NaOH+3O_{2}\rightarrow 4Na_{2}CrO_{4}+4H_{2}O}}}
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42−+2H+→Cr2O72−+h3O{\displaystyle {\mathsf {2CrO_{4}^{2-}+2H^{+}\rightarrow Cr_{2}O_{7}^{2-}+H_{2}O}}}
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72−+2OH−→2CrO42−+h3O{\displaystyle {\mathsf {Cr_{2}O_{7}^{2-}+2OH^{-}\rightarrow 2CrO_{4}^{2-}+H_{2}O}}}
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- h3CrnO3n+1→h3O+nCrO3{\displaystyle {\mathsf {H_{2}Cr_{n}O_{3n+1}\rightarrow H_{2}O+nCrO_{3}}}}
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2++CrO42−→BaCrO4↓{\displaystyle {\mathsf {Ba^{2+}+CrO_{4}^{2-}\rightarrow BaCrO_{4}\downarrow }}}
- 2Ba2++Cr2O72−+h3O→2BaCrO4↓+2H+{\displaystyle {\mathsf {2Ba^{2+}+Cr_{2}O_{7}^{2-}+H_{2}O\rightarrow 2BaCrO_{4}\downarrow +2H^{+}}}}
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+14HCl\rightarrow 2CrCl_{3}+2KCl+3Cl_{2}\uparrow +7H_{2}O}}}
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен[9], металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома.[10] Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании.[11] На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей.[11] В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создаёт гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.[12]
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³).[13][14] В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).[15]
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.[16]
См. также
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 308.
- ↑ 1. Дроздов А. А. и др. Неорганическая химия: В 3 т./Под ред. ЮД Третьякова. T. 2: Химия переходных металлов. – 2004. 2. Greenwood N. N., Earnshaw A. Chemistry of the Elements. – 1984.
- ↑ статья «Минеральные ресурсы» (неопр.). Энциклопедия «Кругосвет». Архивировано 21 августа 2011 года.
- ↑ 1 2 ХРОМ | Онлайн Энциклопедия Кругосвет.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- ↑ Реми Г. Курс неорганической химии. Т. 2. М., Мир, 1966. С. 142—180.
- ↑ Некрасов Б. В. Курс общей химии. М:, ГНХТИ, 1952, С. 334
- ↑ Хром // Большая медицинская энциклопедия : в 30 т. / гл. ред.Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1986. — Т. 27. Хлоракон — Экономика здравоохранения. — 576 с. — 150 000 экз.
- ↑ Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, «Chromium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ 1 2 IARC. Volume 49: Chromium, Nickel, and Welding. — Lyon : International Agency for Research on Cancer, 1999-11-05. — «There is sufficient evidence in humans for the carcinogenicity of chromium[VI] compounds as encountered in the chromate production, chromate pigment production and chromium plating industries.». — ISBN 92-832-1249-5. Архивная копия от 24 декабря 2008 на Wayback Machine
- ↑ Salnikow, K. and Zhitkovich, A., «Genetic and Epigenetic Mechanisms in Metal Carcinogenesis and Cocarcinogenesis: Nickel, Arsenic, and Chromium», Chem. Res. Toxicol., 2008, 21, 28-44. DOI:10.1021/tx700198a
- ↑ OSHA: Small Entity Compliance Guide for the Hexavalent Chromium Standards
- ↑ David Blowes. Tracking Hexavalent Cr in Groundwater (англ.) // Science. — 2002. — Vol. 295. — P. 2024—2025. — DOI:10.1126/science.1070031. — PMID 11896259.
- ↑ ПДК воздуха населённых мест
- ↑ Официальный сайт Эрин Брокович, страница, посвящённая фильму
Литература
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
wikiredia.ru
Хром — Уикипедия
Уикипедия — ашық энциклопедиясынан алынған мәлімет

Хром (лат. Chromіum), Cr — элементтердің периодтық жүйесінің VІ тобындағы химиялық элементі, атомдық номері 24, атомдық массасы 51,996. Тұрақты төрт изотобы 50Cr(4,31%), 52Cr (83,76%), 53Cr (9,55%), 54Cr (2,38%) бар. Олардың ішіндегі маңыздысы жасанды жолмен алынған радиоактивті изотопы 51Cr (T1/2 = 27,8 күн ).
Физикалық қасиеттері[өңдеу]
Хром — ақ, сұр түсті, қатты, ауыр балқитын металл, балқу температурасы 1910°C, қайнау температурасы 2480°C, тығыздығы 7,14 грамм/куб сантиметр.
Химиялық қасиеттері[өңдеу]
Қалыпты температурада фтормен, 600°С-тан жоғары температурада галогендермен, күкіртпен, азотпен, көміртекпен, кремниймен, т.б. көптеген металдармен әрекеттеседі.
Оттекпен өте жоғары температурада әрекеттесіп Cr2O3тотығын түзеді, оның гидрототығы (Cr(OH)3) амфотерлі. Cульфидтері суда гидролизденеді. Сутекпен әрекеттесуге бейім емес, бірақ оны өзіне сіңіріп алады.
Тотығу дәрежелері +1, +3, +6, кейде +1, +4, +6. Қосылыстары күшті тотықсыздандырғыш, тотығу дәрежесі +6 болатын қосылыстары (хром ангридриді CrO3, хроматтар) тотықтырғыш.
Сұйық қышқылдардан сутекті ығыстырады.
Хром кешенді қосылыстар түзуге бейім. Ол құрамда оттек бар қышқылдармен әрекеттесіп нитрат Cr(NO3)3·9H2O, сульфат Cr2(SO4)3·18Н2О тұздарын түзеді.
Хром қолданылуына қарай таза күйінде немесе темірмен қорытпасы — феррохром түрінде (құрамында 60 — 85% Cr) өндіріледі. Оны хром кентастарын тікелей тотықсыздандыру арқылы алады. Таза хром өзінің тотығын Cr2O3 алюминотерм. әдіспен, сондай-ақ кейбір тұздарын электролиздеу арқылы алынады. Тотығу дәрежесі +3 болатын хром көптеген тұздар, ашудастар түзеді. Хром-калий ашудасы былғары илеуде, мата өнеркәсібінде, кино пленкасын жасауда қолданады. Хром металдан жасалған бұйымдардың бетін хромдау үшін пайдаланылады. Құрамында хром бар болат таттанбайды, қажалмайды және үйкеліс пен қызуға төзімді келеді.[2]
Ашылу тарихы[өңдеу]
Хромды 1797 жылы француз химигі Луи-Николя Воклен (фр. Louis-Nicolas Vauquelin; 1763 — 1829) крокоит минералының құрамынан ашқан.
Табиғатта таралуы[өңдеу]
Хром кең тараған элемент. Жер қыртысындағы салмақ мөлшері 2•10–3%.
Өнеркәсіптік маңызды минералы — хромит, оның бай кендері Солтүстік Оралда, Кавказ сыртында, Батыс Қазақстанда кездеседі. Батыс Қазақстандағы кені Ақтөбедегі хром қосылыстары заты мен ферроерітінді затын хроммен қамтамасыз етеді. Оның ішінде Хромтау қаласындағы (Дөң кең байыту комбинаты) Қазақстанға ең үлкен мөлшерде хромды қамтамасыз етеді.
Хром рудалары[өңдеу]
Хром рудалары — металл күйінде хром мен хром қосылыстарын бөліп алуға жарамды табиғи минералдық түзілімдер. Жер қыртысындағы хромның орташа мөлшері 70 г/т. Хром рудаларының минералдарынан саналатын хромпинелидтерге магнохромит, хромпикотит, алюмохромит, феррихромпикотит жатады. Металлургиялық мақсат үшін құрамында хром тотығының мөлшері 45% — тен астам жоғарңы сортты рудалар қажет. Хром рудалары Қазақстанда Қостанайда (Аққарға, Жетіқара, Құндыбай), Ақтөбе[[]]де(Кемпірсай) және Семей (Шар) облыстарының жерінде орналасқан. Барланған және пайдаланудағы ірі өндірістік кендері Кемпірсай хромит кендері тобымен байланысты. Осы кендер негізінде КСРО хромиттің барланған және жылдық өндірілу мөлшері жағынан, Қазақстанның арқасында дүние жүзілік рейтинг бойынша бірінші орынды иеленді. Дүние жүзінің қырық еліне экспортқа шығарылатын осы кендердің рудалары сапасына хром тотығы мөлшері жөнінен жер шарында сыңарлас келетін бір де бірі жоқ. Бұл кен рудалары Ақтөбе хром қосындылары зауыты, Ермак ферроқорытпа зауытында қорытылады.[3]
Дереккөздер[өңдеу]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu.,Atomic weights of the elements 2011 (IUPAC Technical Report)[1]/,Pure and Applied Chemistry,201,10.1351/PAC-REP-13-03-02}}
- ↑ “Қазақ Энциклопедиясы”, II-том
- ↑ Қазақ ССР қысқаша энциклопедиялық-2 том-Қазақ Совет энциклопедиясының бас редакциясы-Алматы,1987-
kk.wikipedia.org
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

В природе хром встречается в виде следующих соединений.
- FeCrO2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3O + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III, реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.

Оксид хрома III реагирует как с растворами щелочей, образуя комплексные соли, так и с кислотами.
Cr2O3 + Ba(OH)2 = Ba(CrO2) + H2O (прокаливание, хромит бария)
Cr2O3 + NaOH + H2O = Na3[Cr(OH)6] (нет прокаливания — в водном растворе, гексагидроксохромат натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления)

Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
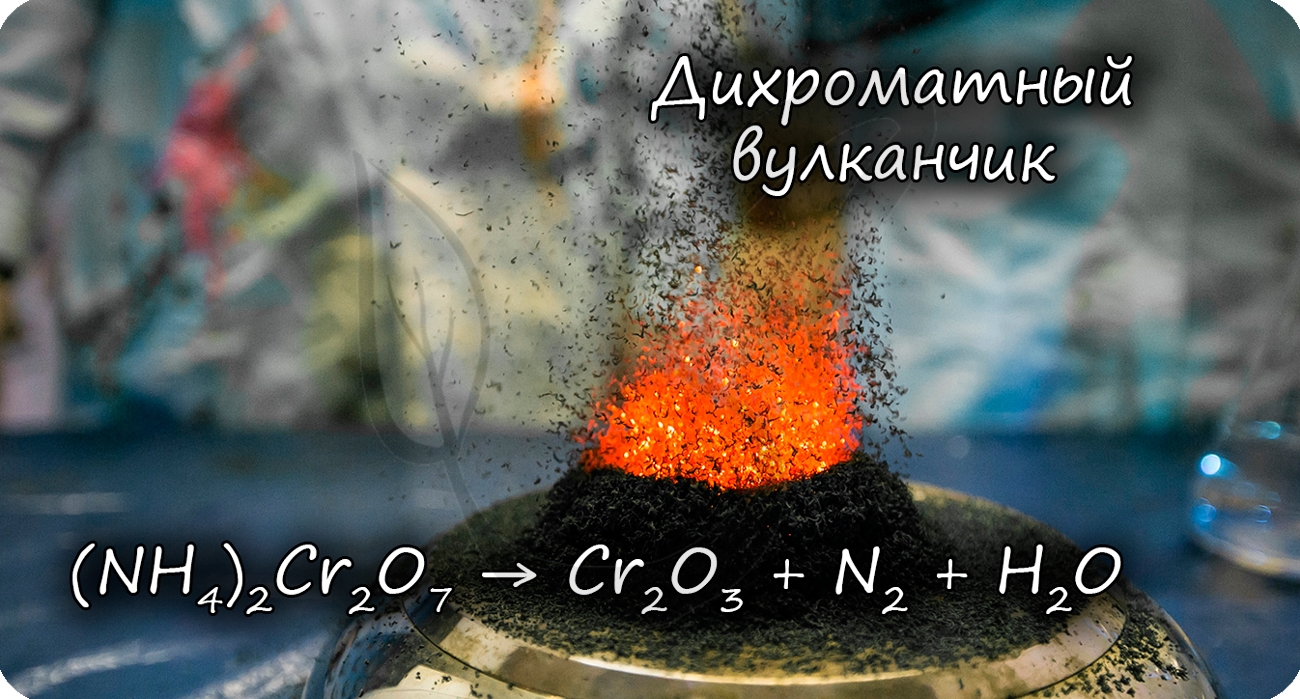
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Na2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t < 700°C)
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
С нагреванием железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа III до II.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа II проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа II распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа II приобретают коричневый цвет из-за окисления до железа III.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом III калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + Na2SO4
Соединения железа III проявляют амфотерные свойства. Осид и гидроксид железа III реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа III — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа III с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
FeCl 3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe2+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + Na2SO4
Соединения железа VI — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Fe + NaOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O

Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) Cu2S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2 + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO 2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди II — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II — (CuOH)2CO3)
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Хром №24 химический элемент
Элемент № 24 хром — один из самых твердых металлов. Обладает высокой химической стойкостью. Один из важнейших металлов, используемых в производстве легированных сталей. Большинство соединений хрома имеет яркую окраску, причем самых разных цветов. За эту особенность элемент и был назван хромом, от греческого «хрома» — цвет, краска.
Минерал, содержащий хром, был открыт близ Екатеринбурга в 1766 г. И. Г. Леманном и назван «сибирским красным свинцом». Сейчас этот минерал называется крокоитом. Известен и его состав — PbCrO4. А в свое время «сибирский красный свинец» вызвал немало разногласий среди ученых. Тридцать лет спорили о его составе, пока, наконец, в 1797 г. французский химик Луи Никола Воклен не выделил из него металл, который (тоже, кстати, после некоторых споров) назвали хромом.
Воклен обработал крокоит поташем K2CO3: хромат свинца превратился в хромат калия. Затем с помощью соляной кислоты хромат калия был превращен в окись хрома и воду (хромовая кислота существует только в разбавленных растворах). Нагрев зеленый порошок окиси хрома в графитовом тигле с углем, Воклен получил новый тугоплавкий металл.
Парижская академия наук по всей форме засвидетельствовала открытие. Но, скорее всего, Воклен выделил не элементный хром, а его карбиды. Об этом свидетельствует иглообразная форма полученных Вокленом светлосерых кристаллов.
Название «хром» предложили друзья Воклена, но оно ему не понравилось — металл не отличался особым цветом. Однако друзьям удалось уговорить химика, ссылаясь на то, что из ярко окрашенных соединений хрома можно получать хорошие краски. (Кстати, именно в работах Воклена впервые объяснена изумрудная окраска некоторых природных силикатов бериллия и алюминия; их, как выяснил Воклен, окрашивали примеси соединений хрома.) Так и утвердилось за новым элементом это название.
Между прочим, слог «хром», именно в смысле «окрашенный», входит во многие научные, технические и даже музыкальные термины. Широко известны фотопленки «изопанхром», «панхром» и «ортохром». Слово «хромосома» означает «тело, которое окрашивается». Есть «хроматическая» гамма (в музыке) и есть гармоника «хромка».
В земной коре хрома довольно много — 0,02%. Основной минерал, из которого промышленность получает хром, — это хромовая шпинель переменного состава с общей формулой (Mg, Fe)O-(Cr, Al, Fe)2O3. Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо). Залежи хромовых руд есть во многих местах. Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд есть и на Урале.
Хромиты идут большей частью на выплавку феррохрома. Это — один из самых важных ферросплавов, абсолютно необходимый для массового производства легированных сталей.
Царская Россия почти не производила ферросплавов. На нескольких доменных печах южных заводов выплавляли низкопроцентные (по легирующему металлу) ферросилиций и ферромарганец. Да еще на реке Сатке, что течет на Южном Урале, в 1910 г. был построен крошечный заводик, выплавлявший мизерные количества ферромарганца и феррохрома.
России в первые годы прошлого века приходилось ввозить ферросплавы из-за рубежа. Такая зависимость от других стран была недопустимой. Уже в 1927-1928 гг. началось сооружение советских ферросплавных заводов. В конце 1930 г. была построена первая крупная ферросплавная печь в Челябинске, а в 1931 г. вступил в строй Челябинский завод — первенец ферросплавной промышленности СССР. В 1933 г. были пущены еще два завода — в Запорожье и Зестафони. Это позволило прекратить ввоз ферросплавов. Всего за несколько лет в Советском Союзе было организовано производство множества видов специальных сталей — шарикоподшипниковой, жароупорной, нержавеющей, автотракторной, быстрорежущей… Во все эти стали входит хром.
Завод на базе Актюбинского месторождения построен позже, в годы Великой Отечественной войны. Первую плавку феррохрома он дал 20 января 1943 г. В сооружении завода принимали участие трудящиеся города Актюбинска. Феррохром нового завода шел на изготовление металла для танков и пушек, для нужд фронта.
Прошли годы. Сейчас Актюбинский ферросплавный завод — крупное предприятие, выпускающее феррохром всех марок. На заводе выросли высококвалифицированные национальные кадры металлургов. Из года в год завод и хромитовые рудники наращивают мощность, обеспечивая нашу черную металлургию высококачественным феррохромом.
В нашей стране есть уникальное месторождение природнолегированных железных руд, богатых хромом и никелем. Оно находится в оренбургских степях. На базе этого месторождения построен и работает Орско-Халиловский металлургический комбинат. В доменных печах комбината выплавляют природнолегированный чугун, обладающий высокой жароупорностью. Частично его используют в виде литья, но большую часть отправляют на передел в никелевую сталь; хром при выплавке стали из чугуна выгорает.
Хромит применяется преимущественно в трех отраслях промышленности: металлургии, химии и производстве огнеупоров, причем металлургия потребляет примерно две трети всего хромита. Сталь, легированная хромом, обладает повышенной прочностью, стойкостью против коррозии в агрессивных и окислительных средах.
Получение чистого хрома — дорогой и трудоемкий процесс. Поэтому для легирования стали применяют главным образом феррохром, который получают в дуговых электропечах непосредственно из хромита. Восстановителем служит кокс. Содержание окиси хрома в хромите должно быть не ниже 48%, а отношение Cr: Fe не менее 3:1.
Полученный в электропечи феррохром обычно содержит до 80% хрома и 4-7% углерода (остальное — железо). Но для легирования многих качественных сталей нужен феррохром, содержащий мало углерода (о причинах этого — ниже, в главе «Хром в сплавах»). Поэтому часть высокоуглеродистого феррохрома подвергают специальной обработке, чтобы снизить содержание углерода в нем до десятых и сотых долей процента.
Из хромита получают и элементный, металлический хром. Производство технически чистого хрома (97-99%) основано на методе алюминотермии, открытом еще в 1865 г. известным русским химиком Н. Н. Бекетовым. Сущность метода — в восстановлении окислов алюминием, реакция сопровождается значительным выделением тепла. Но предварительно надо получить чистую окись хрома Cr2O3. Для этого тонко измельченный хромит смешивают с содой и добавляют к этой смеси известняк или окись железа. Вся масса обжигается, причем образуется хромат натрия:
2Cr2O3 + 4Na2CO3 + 3O2 → 4Na2CrO4 + 4CO2.
Затем хромат натрия выщелачивают из обожженной массы водой; щелок фильтруют, упаривают и обрабатывают кислотой. В результате получается бихромат натрия Na2Cr2O7. Восстанавливая его серой или углеродом при нагревании, получают зеленую окись хрома.
Металлический хром можно получить, если чистую окись хрома смешать с порошком алюминия, нагреть эту смесь в тигле до 500-600°С и поджечь с помощью перекиси бария. Алюминий отнимает у окиси хрома кислород. Эта реакция Cr2О3 + 2Аl → AI2O3 + 2Сг
— основа промышленного (алюминотермического) способа получения хрома, хотя, конечно, заводская технология значительно сложнее. Хром, полученный алюминотермически, содержит алюминия и железа десятые доли процента, а кремния, углерода и серы — сотые доли процента.
Используют также силикотермический способ получения технически чистого хрома. В этом случае хром из окиси восстанавливается кремнием по реакции 2Cr2O3 + 3Si → 3SiO2 + 4Cr.
Эта реакция происходит в дуговых печах. Для связывания кремнезема в шихту добавляют известняк. Чистота силикотермического хрома примерно такая же, как и алюминотермического, хотя, разумеется, содержание в нем кремния несколько выше, а алюминия несколько ниже. Для получения хрома пытались применить и другие восстановители — углерод, водород, магний. Однако эти способы не получили широкого распространения.
Хром высокой степени чистоты (примерно 99,8%) получают электролитически. Технически чистый и электролитический хром идет главным образом на производство сложных хромовых сплавов.
Атомная масса хрома 51,996. В менделеевской таблице он занимает место в шестой группе. Его ближайшие соседи и аналоги — молибден и вольфрам. Характерно, что соседи хрома, так же как и он сам, широко применяются для легирования сталей.
Температура плавления хрома зависит от его чистоты. Многие исследователи пытались ее определить и получили значения от 1513 до 1920°С. Такой большой «разброс» объясняется прежде всего количеством и составом содержащихся в хроме примесей. Сейчас считают, что хром плавится при температуре около 1875°С. Температура кипения 2199°С. Плотность хрома меньше, чем железа; она равна 7,19.
По химическим свойствам хром близок к молибдену и вольфраму. Высший окисел его CrO3 — кислотный, это — ангидрид хромовой кислоты h3CrO4. Минерал крокоит, с которого мы начинали знакомство с элементом № 24, — соль этой кислоты. Кроме хромовой, известна двухромовая кислота H2Cr2O7, в химии широко применяются ее соли — бихроматы.
Что характерно для хрома
Наиболее распространенный окисел хрома Cr2O3 — амфотерен. А вообще в разных условиях хром может проявлять валентности от 2 до 6. Широко используются только соединения трех- и шестивалентного хрома. Хром обладает всеми свойствами металла — хорошо проводит тепло и электрический ток, имеет характерный металлический блеск. Главная особенность хрома — его устойчивость к действию кислот и кислорода.
Для тех, кто постоянно имеет дело с хромом, стала притчей во языцех еще одна его особенность: при температуре около 37°С некоторые физические свойства этого металла резко, скачкообразно меняются. При этой температуре — явно выраженный максимум внутреннего трения и минимум модуля упругости. Почти также резко изменяются электросопротивление, коэффициент линейного расширения, термоэлектродвижущая сила. Объяснить эту аномалию ученые пока не могут. Известны четыре природных изотопа хрома. Их массовые числа 50, 52, 53 и 54. Доля самого распространенного изотопа 52Cr — около 84%.
Соединения хрома
Главная хромовая руда — хромит используется и в производстве огнеупоров. Магнезитохромитовые кирпичи химически пассивны и термостойки, они выдерживают многократные резкие изменения температур. Поэтому их используют в конструкциях сводов мартеновских печей. Стойкость магнезитохромитовых сводов в 2-3 раза больше, чем динасовых.
Химики получают из хромита в основном бихроматы калия и натрия K2Cr2O7 и Na2Cr2O7. Бихроматы и хромовые квасцы KCr(SO4)2 применяются для дубления
кожи. Отсюда и идет название «хромовые» сапоги. Кожа, дубленная хромовыми соединениями, обладает красивым блеском, прочна и удобна в использовании.
Из хромата свинца PbCrO4 изготовляют различные красители. Раствором бихромата натрия очищают и травят поверхность стальной проволоки перед цинкованием, а также осветляют латунь. Хромит и другие соединения хрома широко применяются в качестве красителей керамической глазури и стекла.
Наконец, из бихромата натрия получают хромовую кислоту, которая используется в качестве электролита при хромировании металлических деталей.
Будущее хрома
Хром и в будущем сохранит свое значение как легирующая добавка к стали и как материал для металлопокрытий; не утратят ценности и соединения хрома, используемые в химической и огнеупорной промышленности.
Гораздо сложнее обстоит дело со сплавами на основе хрома. Большая хрупкость и исключительная сложность механической обработки пока не позволяют широко применять эти сплавы, хотя по жаропрочности и износостойкости они могут потягаться с любыми материалами. В последние годы наметилось новое направление в производстве хромсодержащих сплавов — легирование их азотом. Этот обычно вредный в металлургии газ образует с хромом прочные соединения — нитриды. Азотирование хромистых сталей повышает их износостойкость, позволяет уменьшить содержание дефицитного никеля в «нержавейках». Быть может, этот метод позволит преодолеть и «необрабатываемость» сплавов на основе хрома? Или здесь придут на помощь другие, пока не известные методы? Так или иначе, надо думать, что в будущем эти сплавы займут достойное место среди нужных технике материалов.
natural-museum.ru
ХРОМ — это… Что такое ХРОМ?
хром — хром, а … Русский орфографический словарь
хром — хром/ … Морфемно-орфографический словарь
хром — а; м. [от греч. chrōma цвет, краска] 1. Химический элемент (Сr), твёрдый металл серо стального цвета (используется при изготовлении твёрдых сплавов и для покрытия металлических изделий). 2. Мягкая тонкая кожа, выдубленная солями этого металла.… … Энциклопедический словарь
ХРОМ — (от греч. chroma цвет, краска). Металл сероватого цвета, добываемый из хромовой руды. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ХРОМ металл сероватого цвета; в чистом виде х. не употребляется; соединения же с … Словарь иностранных слов русского языка
ХРОМ — см. ХРОМ (Сг). Соединения хрома встречаются в сточных водах многих промышленных предприятий, производящих хромовые соли, ацетилен, дубильные вещества, анилин, линолеум, бумагу, краски, пестициды, пластмассы и др. В воде встречаются трехвалентные… … Болезни рыб: Справочник
хром — ХРОМ, а, муж. 1. Химический элемент, твёрдый светло серый блестящий металл. 2. Род жёлтой краски (спец.). | прил. хромистый, ая, ое (к 1 знач.) и хромовый, ая, ое. Хромистая сталь. Хромовая руда. II. ХРОМ, а, муж. Сорт мягкой тонкой кожи. | прил … Толковый словарь Ожегова
хром — а, м. chrome m. [krom] <новолат. chromium <лат. chroma <гр. краска. 1. Химический элемент твердый серебристый металл, употребляемый при изготовлении твердых сплаво и для покрытия металлических изделий. БАС 1. Металл, открытый Вокеленом,… … Исторический словарь галлицизмов русского языка
ХРОМ — (лат. Chromium) Cr, химический элемент VI группы Периодической системы Менделеева, атомный номер 24, атомная масса 51,9961. Название от греч. chroma цвет, краска (из за яркой окраски Соединения). Голубовато серебристый металл; плотность 7,19… … Большой Энциклопедический словарь
ХРОМ 1 — ХРОМ 1, а, м. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ХРОМ 2 — ХРОМ 2, а, м. Сорт мягкой тонкой кожи. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
big_medicine.academic.ru
Какой химический элемент (атомный номер 24) обозначается символом Cr 4 буквы
Похожие ответы в сканвордах
Вопрос: Желтой краски
Ответ: Хром
Вопрос: Химический элемент твердый светло-серый блестящий металл
Ответ: Хром
Вопрос: Сорт мягкой тонкой кожи
Ответ: Хром
Вопрос: Химический элемент
Ответ: Хром
Вопрос: Металл
Ответ: Хром
Вопрос: Краска
Ответ: Хром
Вопрос: Какой химический элемент (атомный номер 24) обозначается символом Cr
Ответ: Хром
Вопрос: Кожа
Ответ: Хром
Вопрос: Краска; кожа; химический элемент
Ответ: Хром
Вопрос: Металл, название которого можно рассмотреть как краткое прилагательное, описывающее человека с дефектом ноги
Ответ: Хром
Вопрос: Натуральная кожа
Ответ: Хром
Вопрос: Разновидность желтой краски
Ответ: Хром
Вопрос: Химический элемент, твердый светло-серый блестящий металл
Ответ: Хром
Вопрос: Химический элемент с атомной массой 52
Ответ: Хром
Вопрос: Химический элемент, твердый металл серо-стального цвета
Ответ: Хром
Вопрос: Химический элемент, твердый серебристый металл, употребляемый при изготовлении твердых сплавов, красок и т. п
Ответ: Хром
Вопрос: Элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr. Простое вещество хром
Ответ: Хром
Вопрос: И название металла, и краткое прилагательное, приложимое как к людям, так и к животным
Ответ: Хром
Вопрос: Между ванадием и марганцем в таблице
Ответ: Хром
Вопрос: 24-й в таблице химическ. элементов
Ответ: Хром
Вопрос: Хим. элемент для сапог офицеров
Ответ: Хром
Вопрос: 24-й в ряду химических элементов
Ответ: Хром
Вопрос: 24-й химический элемент
Ответ: Хром
Вопрос: 24-й «подопечный» Менделеева
Ответ: Хром
Вопрос: 24-й элемент Менделеева
Ответ: Хром
Вопрос: Металл с блеском
Ответ: Хром
Вопрос: Компонент нержавейки
Ответ: Хром
Вопрос: Металл, легирующая добавка
wordparts.ru