| Приемлемость | Критерии: Критерии включения: Только добровольцы, отвечающие всем следующим критериям, могут быть зачислены в настоящее. испытание: 1. здоровые мужчины европеоидной расы в возрасте от 18 до 55 лет, 2. Не курильщики и не курящие максимум 5 сигарет в день, те, кто не курит и не пьет. кофе в каждый период обучения, 3.Отрицательные результаты дыхательного теста на алкоголь, 4. нормальный физический осмотр во время скринингового визита, 5.Индекс массы тела находится в диапазоне 18,5-30 кг / м2 (см. Приложение I), что соответствует желаемый диапазон в зависимости от возраста, 6. Способность адекватно общаться с самим следователем. представители, 7. способность и согласие соблюдать требования исследования, 8. нормальное артериальное давление и частота сердечных сокращений, измеренные в стабилизированных условиях на скрининговый визит после не менее 5 минут отдыха в положении лежа на спине: САД в пределах 100 до 140 мм рт.  3. Симптоматическая или бессимптомная ортостатическая гипотензия при скрининге или перед первым. при приеме препарата определяется снижение САД более 20 мм рт. ст. или ДСД более 10 между положением сидя / лежа на спине и положением стоя, в мм рт. сочтет необходимым следователь). 4. наличие или наличие в анамнезе мальабсорбции или любых операций на желудочно-кишечном тракте, кроме аппендэктомия или кроме грыжесечения. 5. Субъекты, которые сдали более 400 мл крови в течение последних двух месяцев перед исследованием. первое введение лекарства и субъекты, которые участвовали в любом исследовании наркотиков в течение последних двух месяцев перед первым применением препарата. 6. Субъекты, подозреваемые в высокой вероятности несоблюдения процедуры исследования. и / или завершение исследования по мнению исследователя. 7. субъекты, которые использовали какие-либо из прописанных системных или местных лекарств (включая безрецептурные). лекарства) в течение 2 недель (или шести периодов полувыведения этого лекарства, в зависимости от того, что дольше) до начала исследования (кроме однократных доз анальгетики, не взаимодействующие с исследуемым продуктом). 3. Симптоматическая или бессимптомная ортостатическая гипотензия при скрининге или перед первым. при приеме препарата определяется снижение САД более 20 мм рт. ст. или ДСД более 10 между положением сидя / лежа на спине и положением стоя, в мм рт. сочтет необходимым следователь). 4. наличие или наличие в анамнезе мальабсорбции или любых операций на желудочно-кишечном тракте, кроме аппендэктомия или кроме грыжесечения. 5. Субъекты, которые сдали более 400 мл крови в течение последних двух месяцев перед исследованием. первое введение лекарства и субъекты, которые участвовали в любом исследовании наркотиков в течение последних двух месяцев перед первым применением препарата. 6. Субъекты, подозреваемые в высокой вероятности несоблюдения процедуры исследования. и / или завершение исследования по мнению исследователя. 7. субъекты, которые использовали какие-либо из прописанных системных или местных лекарств (включая безрецептурные). лекарства) в течение 2 недель (или шести периодов полувыведения этого лекарства, в зависимости от того, что дольше) до начала исследования (кроме однократных доз анальгетики, не взаимодействующие с исследуемым продуктом).  15.Положительный анализ крови на ВГВ, ВГС и ВИЧ. 16. Кто имеет отношение к следователю. 17. Кто не подходит ни по одному критерию включения. 18. В анамнезе затруднение глотания. 19. Прием инъекционных растворов депо (включая исследуемые препараты) в течение 6 месяцев. перед началом исследования. 20. прием ферментно-индуцирующих, органотоксичных препаратов или препаратов с длительным периодом полураспада в течение 4 недель до приема препарата. начало исследования. 21. Специальная диета по любой причине, например, вегетарианская. . 15.Положительный анализ крови на ВГВ, ВГС и ВИЧ. 16. Кто имеет отношение к следователю. 17. Кто не подходит ни по одному критерию включения. 18. В анамнезе затруднение глотания. 19. Прием инъекционных растворов депо (включая исследуемые препараты) в течение 6 месяцев. перед началом исследования. 20. прием ферментно-индуцирующих, органотоксичных препаратов или препаратов с длительным периодом полураспада в течение 4 недель до приема препарата. начало исследования. 21. Специальная диета по любой причине, например, вегетарианская. .Пол: Мужчина Минимальный возраст: 18 лет Максимальный возраст: 55 лет Здоровые волонтеры: Принимает здоровых добровольцев |
|---|
Хром и его соединения
Хром
Открытие хрома относится к периоду бурного развития химико-аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе.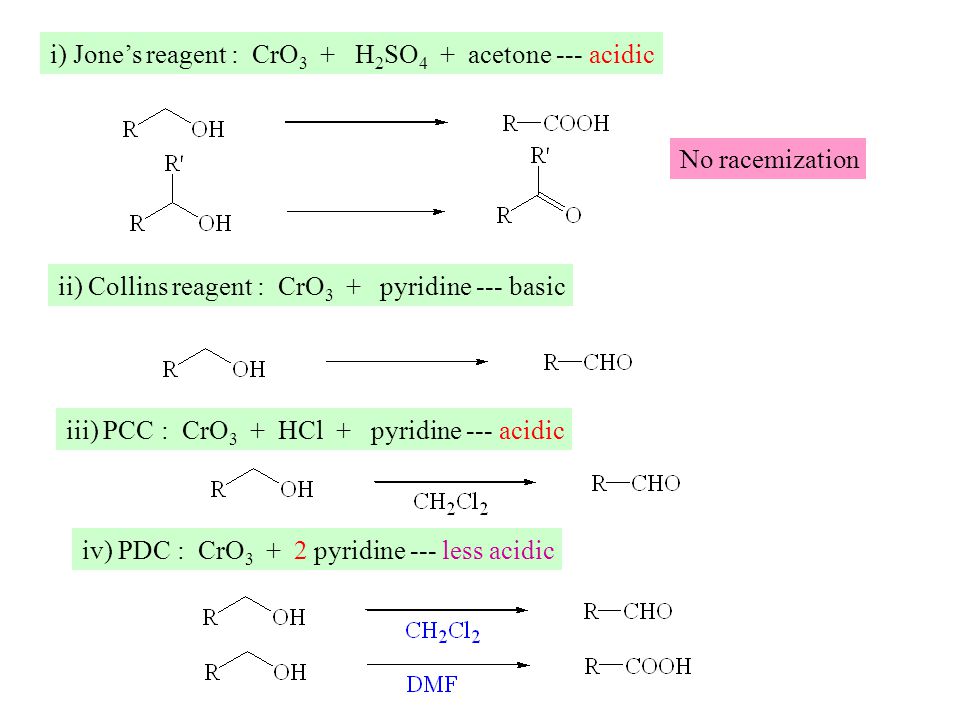 Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром (Chrome) от греческого слова — окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей.
Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром (Chrome) от греческого слова — окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей.
Нахождение в природе.
Важнейшей рудой хрома, имеющей практическое значение, является хромит, приблизительный состав которого отвечает формуле FeCrO4.
Он встречается в Малой Азии, на Урале, в Северной Америке, на юге Африки. Техническое значение имеет также вышеназванный минерал крокоит – PbCrO4.
Физические свойства.
Хром – белый, твердый и хрупкий металл, исключительно химически стойкий к воздействию кислот и щелочей. На воздухе он окисляется, имеет на поверхности тонкую прозрачную пленку оксида. Хром имеет плотность 7,1 г/см3 , его температура плавления составляет +18750С.
Получение.
При сильном нагреве хромистого железняка с углем происходит восстановление хрома и железа:
FeO * Cr2O3 + 4C = 2Cr + Fe + 4CO
В результате этой реакции образуется сплав хрома с железом, отличающийся высокой прочностью. Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Cr2O3 + 2Al = Al 2O3 + 2Cr
В данном процессе обычно используют два оксида – Cr2O3 и CrO3
Химические свойства.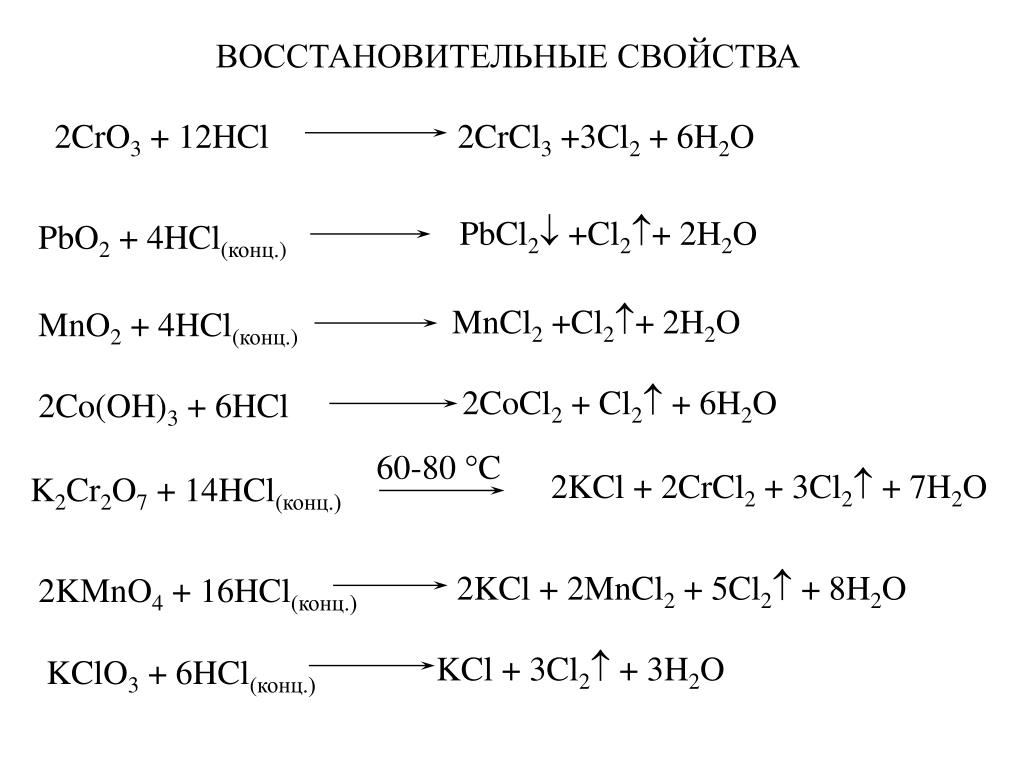
Благодаря тонкой защитной пленке оксида, покрывающей поверхность хрома, он весьма устойчив к воздействию агрессивных кислот и щелочей. Хром не реагирует с концентрированными азотной и серной кислотами, а также с фосфорной кислотой. Со щелочами хром вступает во взаимодействие при t = 600-700оC. Однако хром взаимодействует с разбавленными серной и соляной кислотами, вытесняя водород:
2Cr + 3H2SO4 = Cr2(SO4)3 + 3H2
2Cr + 6HCl = 2CrCl3 + 3H2
При высокой температуре хром горит в кислороде, образуя оксид(III).
Раскаленный хром реагирует с парами воды:
2Cr + 3H2O = Cr2O3 + 3H
Хром при высокой температуре реагирует также с галогенами, галоген — водородами, серой, азотом, фосфором, углем, кремнием, бором, например:
Cr + 2HF = CrF2 + H2
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
Cr + Si = CrSi
Вышеуказанные физические и химические свойства хрома нашли свое применение в различных областях науки и техники. Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.
Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.
Положение хрома в периодической системе химических элементов:
Хром возглавляет побочную подгруппу VI группы периодической системы элементов. Его электронная формула следующая:
+24Cr IS22S22P63S23P63d54S1
В заполнении орбиталей электронами у атома хрома нарушается закономерность, согласно которой сначала должна была бы заполнятся 4S – орбиталь до состояния 4S2. Однако, вследствие того, что 3d – орбиталь занимает в атоме хрома более выгодное энергетическое положение, происходит ее заполнение до значения 4d5. Такое явление наблюдается у атомов некоторых других элементов побочных подгрупп. Хром может проявлять степени окисления от +1 до +6. Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Такое явление наблюдается у атомов некоторых других элементов побочных подгрупп. Хром может проявлять степени окисления от +1 до +6. Наиболее устойчивыми являются cоединения хрома со степенями окисления +2, +3, +6.
Соединения двухвалентного хрома.
Оксид хрома (II) CrO – пирофорный черный порошок (пирофорность – способность в тонкораздробленном состоянии воспламенятся на воздухе). CrO растворяется в разбавленной соляной кислоте:
CrO + 2HCl = CrCl2 + H2O
На воздухе при нагревании свыше 1000С CrO превращается в Cr2O3.
Соли двухвалентного хрома образуются при растворении металлического хрома в кислотах. Эти реакции проходят в атмосфере малоактивного газа (например H2), т.к. в присутствии воздуха легко происходит окисление Cr(II) до Cr(III).
Гидроксид хрома получают в виде желтого осадка при действии раствора щелочи на хлорид хрома (II):
CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
Cr(OH)2 обладает основными свойствами, является восстановителем. Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
4Cr(OH)2 + 2H2O + O2 = 4Cr(OH)3
Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3 – тугоплавкий порошок зеленого цвета. По твердости близок к корунду. В лаборатории его можно получить нагреванием дихромата аммония:
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2
Cr2O3 – амфотерный оксид, при сплавлении со щелочами образует хромиты: Cr2O3 + 2NaOH = 2NaCrO2 + H2O
Гидроксид хрома также является амфотерным соединением:
Cr(OH)3 + HCl = CrCl3 + 3H2O
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Безводный CrCl3 имеет вид листочков темно-фиолетового цвета, совершенно нерастворим в холодной воде, при кипячении он растворяется очень медленно.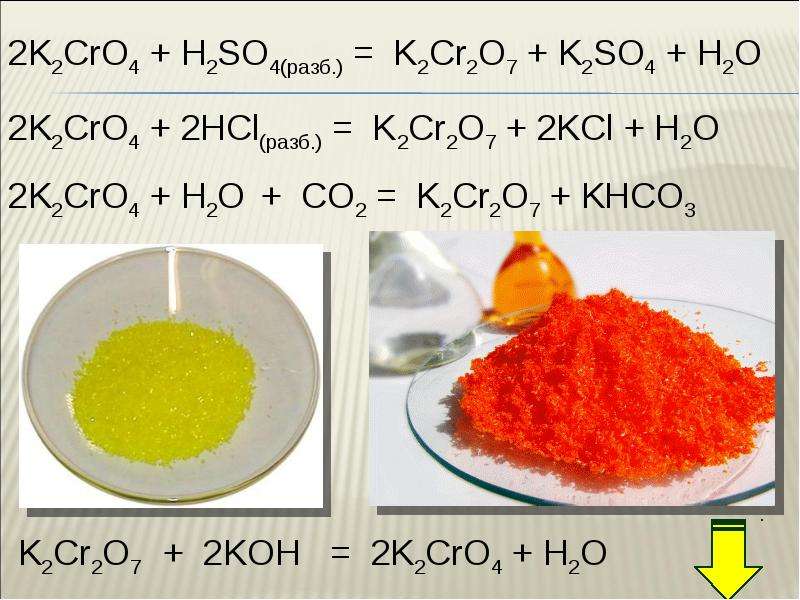 Безводный сульфат хрома (III) Cr2(SO4)3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr2(SO4)3*18H2O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO4)2*12H2O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Безводный сульфат хрома (III) Cr2(SO4)3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr2(SO4)3*18H2O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO4)2*12H2O выкристаллизовываются из растворов, содержащих фиолетовый сульфат хрома и сульфат калия. Раствор хромовых квасцов при нагревании становится зеленым благодаря образованию сульфатов.
Нужна помощь в обучении? Выбирайте репетитора по химии в Санкт-Петербурге на TutorOnline!
Реакции с хромом и его соединениями
Почти все соединения хрома и их растворы интенсивно окрашены. Имея бесцветный раствор или белый осадок, мы можем с большой долей вероятности сделать вывод об отсутствии хрома.
- Сильно нагреем в пламени горелки на фарфоровой чашке такое количество бихромата калия, которое поместится на кончике ножа.
 Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K2CrO4 и зеленый Cr2O3.
Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K2CrO4 и зеленый Cr2O3. - Растворим 3г порошкообразного бихромата калия в 50мл воды. К одной части добавим немного карбоната калия. Он растворится с выделением CO2, а окраска раствора станет светло – желтой. Из бихромата калия образуется хромат. Если теперь по порциям добавить 50% раствор серной кислоты, то снова появится красно – желтая окраска бихромата.
- Нальем в пробирку 5мл. раствора бихромата калия, прокипятим с 3мл концентрированной соляной кислоты под тягой. Из раствора выделяется желто-зеленый ядовитый газообразный хлор, потому, что хромат окислит HCl до Cl2 и H2O.
 Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат.
Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат. - При добавлении раствора нитрата свинца выпадает желтый хромат свинца; при взаимодействии с раствором нитрата серебра образуется красно – коричневый осадок хромата серебра.
- Добавим пероксид водорода к раствору бихромата калия и подкислим раствор серной кислотой. Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром.
 В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Аналитические реакции на ионы хрома.
- К 3-4 каплям раствора хлорида хрома CrCl3 прибавьте 2М раствор NaOH до растворения первоначально выпавшего осадка. Обратите внимание на цвет образовавшегося хромита натрия. Нагрейте полученный раствор на водяно бане. Что при этом происходит?
- К 2-3 каплям р-ра CrCl3 прибавьте равный объем 8М раствора NaOH и 3-4 капли 3% р-ра H2O2. Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Какой осадок образуется, если полученный окрашеный раствор нейтрализовать, добавить к нему CH3COOH, а затем Pb(NO3)2?
- Налейте в пробирку по 4-5 капель растворов сульфата хрома Cr2(SO4)3, IMH2SO4 и KMnO4.
 Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано? - К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 2-3 капли раствора H2O2 и перемешайте. Появляющиеся синее окрашивание раствора обусловлено возникновением надхромовой кислоты H2CrO6:
Cr2O72- + 4H2O2 + 2H+ = 2H2CrO6 + 3H2O
Обратите внимание на на быстрое разложение H2CrO6:
2H2CrO6 + 8H+ = 2Cr3+ + 3O2 + 6H2O
синий цвет зеленый цвет
Надхромовая кислота значительно более устойчива в органических растворителях.
- К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 5 капель изоамилового спирта, 2-3 капли раствора H2O2 и взболтайте реакционную смесь.
 Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H2CrO6 в органической и водных фазах.
Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H2CrO6 в органической и водных фазах. - При взаимодействии CrO42- и ионами Ba2+ выпадает желтый осадок хромата бария BaCrO4.
- Нитрат серебра образует с ионами CrO42- осадок хромата серебра кирпично-красного цвета.
- Возьмите три пробирки. В одну из них поместите 5- 6 капель раствора K2Cr2O7, во вторую – такой же объем раствора K2CrO4, а в третью – по три капли обоих растворов. Затем добавте в каждую пробирку по три капли раствора иодида калия. Объясните полученный результат. Подкислите раствор во второй пробирке. Что при этом происходит? Почему?
Занимательные опыты с соединениями хрома
- Смесь CuSO4 и K2Cr2O7 при добавлении щелочи становится зеленой, а в присутствии кислоты становится желтой.
 Нагревая 2мг глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
Нагревая 2мг глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым. - Поместить в центр консервной банки с термитом «рубиновую смесь» — тщательно растертый и помещенный в алюминиевую фольгу Al2O3 (4,75г) с добавкой Cr2O3(0,25г). Чтобы банка подольше не остывала, необходимо закопать под верхний обрез в песок, а после поджигания термита и начала реакции, накрыть ее железным листом и засыпать песком. Банку выкопать через сутки. В итоге образуется красно – рубиновый порошок.
- 10г бихромата калия растирают с 5г нитрата натрия или калия и 10г сахара. Смесь увлажняют и смешивают с коллодием. Если порошок спрессовать в стеклянной трубке, а затем вытолкнуть палочку и поджечь ее с торца, то начнет выползать «змея», сначала черная, а после охлаждения — зеленая.
 Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз. - Если смешать растворы сульфата меди и дихромата калия и добавить немного раствора аммиака, то выпадет аморфный коричневый осадок состава 4СuCrO4 * 3NH3 * 5H2O, который растворяется в соляной кислоте с образованием желтого раствора, а в избытке аммиака получается зеленый раствор. Если далее к этому раствору добавить спирт, то выпадет зеленый осадок, который после фильтрации становится синим, а после высушивания – сине-фиолетовым с красными блестками, хорошо видимыми при сильном освещении.
- Оставшийся после опытов «вулкан» или «фараоновы змеи» оксид хрома можно регенерировать. Для этого надо сплавить 8г Cr2O3 и 2г Na2CO3 и 2,5г KNO3 и обработать остывший сплав кипятком. Получается растворимый хромат, который можно превратить и в другие соединения Cr(II) и Cr(VI), в том числе и исходный дихромат аммония.

Примеры окислительно – восстановительных переходов с участием хрома и его соединений
1. Cr2O72- — Cr2O3 — CrO2— — CrO42- — Cr2O72-
a) (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2Oб) Cr2O3 + 2NaOH = 2NaCrO2 + H2O
в) 2NaCrO2 + 3Br2 + 8NaOH = 6NaBr +2Na2CrO4 + 4H2O
г) 2Na2CrO4 + 2HCl = Na2Cr2O7 + 2NaCl + H2O
2. Cr(OH)2 — Cr(OH)3 — CrCl3 — Cr2O72- — CrO42-
а) 2Cr(OH)2 + 1/2O2 + H2O = 2Cr(OH)3
б) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
в) 2CrCl3 + 2KMnO4 + 3H2O = K2Cr2O7 + 2Mn(OH)2 + 6HCl
г) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
3. CrO — Cr(OH)2 — Cr(OH)3 — Cr(NO3)3 — Cr2O3 — CrO—2
CrO — Cr(OH)2 — Cr(OH)3 — Cr(NO3)3 — Cr2O3 — CrO—2
Cr2+
а) CrO + 2HCl = CrCl2 + H2O
б) CrO + H2O = Cr(OH)2
в) Cr(OH)2 + 1/2O2 + H2O = 2Cr(OH)3
г) Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
д) 4Сr(NO3)3 = 2Cr2O3 + 12NO2 + O2
е) Cr2O3 + 2 NaOH = 2NaCrO2 + H2O
Элемент хром в роли художника
Химики довольно часто обращались к проблеме создания искусственных пигментов для живописи. В XVIII-XIXвв была разработана технология получения многих живописных материалов. Луи Никола Воклен в 1797г., обнаруживший в сибирской красной руде ранее неизвестный элемент хром, приготовил новую, замечательно устойчивую краску – хромовую зелень. Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Зеленая хромовая – самая прочная и светостойкая краска, не поддающаяся воздействию атмосферных газов. Растертая на масле хромовая зелень обладает большой кроющей силой и способна к быстрому высыханию, поэтому с XIX в. ее широко применяют в живописи. Огромное значение она имеет в росписи фарфора. Дело в том, что фарфоровые изделия могут декорироваться как подглазурной, так и надглазурной росписью. В первом случае краски наносят на поверхность лишь слегка обожженного изделия, которое затем покрывают слоем глазури. Далее следует основной, высокотемпературный обжиг: для спекания фарфоровой массы и оплавления глазури изделия нагревают до 1350 – 14500С. Столь высокую температуру без химических изменений выдерживают очень немногие краски, а в старину таких вообще было только две – кобальтовая и хромовая. Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Помимо хромовой зелени художники применяют краски, полученные из волконскоита. Этот минерал из группы монтмориллонитов (глинистый минерал подкласса сложных силикатов Na(Mo,Al), Si4O10(OH)2 был обнаружен в 1830г. русским минералогом Кеммерером и назван в честь М.Н Волконской – дочери героя битвы при Бородино генерала Н.Н. Раевского, жены декабриста С.Г.Волконского. Волконскоит представляет собой глину, содержащую до 24% оксида хрома, а так же оксиды аллюминея и железа (III). Непостоянство состава минерала, встечающегося на Урале, в Пермской и Кировской областях, обусловливает его разнообразную окраску – от цвета зимней потемневшей пихты до ярко-зеленого цвета болотной лягушки.
Пабло Пикассо обращался к геологам нашей страны с просьбой изучить запасы волконскоита, дающего краску неповторимо свежего тона. В настоящее время разработан способ получения искусственного волконскоита. Интересно отметить, что по данным современных исследований, русские иконописцы использовали краски из этого материала еще в средние века, задолго до его «официального» открытия. Известной популярностью пользовалась у художников и зелень Гинье (создана в 1837г.), хромоформ которой является гидрат окиси хрома Cr2O3 * (2-3) H2O, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает краске изумрудный оттенок.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
HCL Digital Experience
Измените способ привлечения вашей аудитории в любой отрасли и через любой канал взаимодействия!
youtube.com/embed/sE8IOgW9GFo» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>HCL Digital Experience (ранее IBM Digital Experience) – решение помогает создавать, управлять, упрощать и интегрировать ваши процессы в увлекательный онлайн-опыт взаимодействия.
HCL Digital Experience (DX) — это больше, чем просто создание привлекательного внешнего интерфейса. Решение переопределяет способы ведения бизнеса в цепочке создания добавленной стоимости в работе с ключевыми заинтересованными сторонами: вашими клиентами, сотрудниками и партнерами. Это гибкая, масштабируемая платформа, которая объединяет ваш контент, приложения и бизнес-процессы, каждый раз предоставляя мощные, персонализированные возможности для всех ваших цифровых сенсорных точек.
В состав решения HCL Digital Experience входят:
- HCL Portal (ранее IBM WebSphere Portal)
- HCL Content Manager (ранее IBM Web Content Manager)
HCL Portal (ранее IBM WebSphere Portal) предоставляет единую точку доступа к веб-контенту и приложениям и предоставляет индивидуальные персонализированные возможности для каждого пользователя.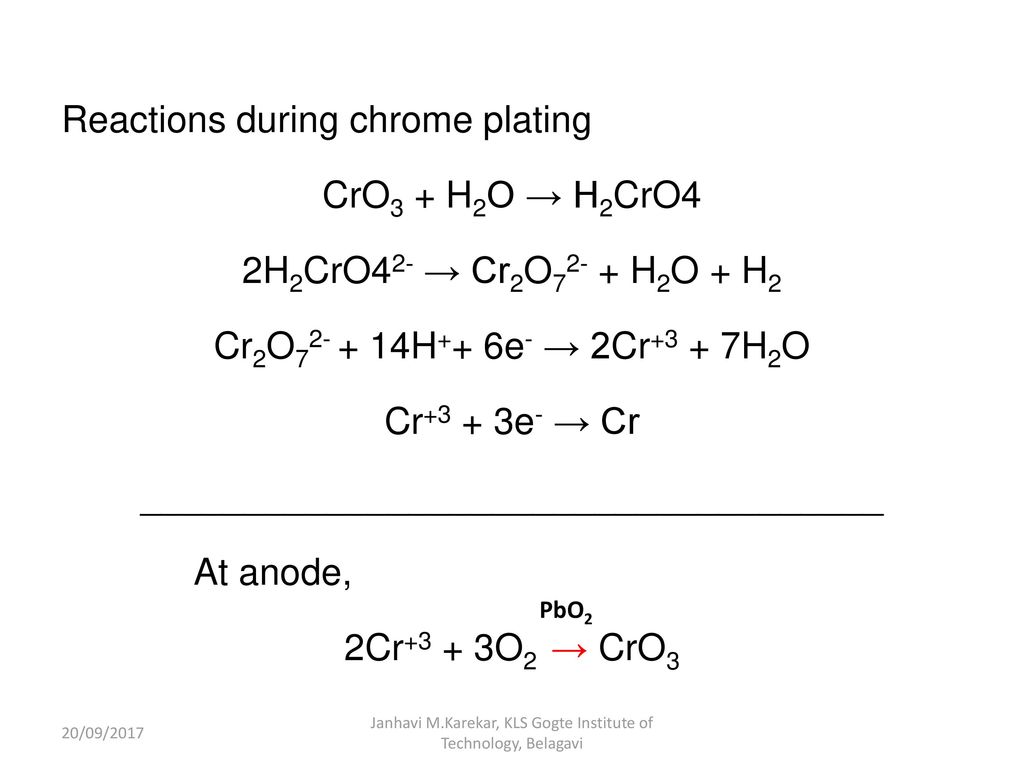 Вы можете настроить портал в соответствии с потребностями вашей организации, пользователей и групп пользователей. Вы можете настроить внешний вид портала в соответствии со стандартами вашей организации и настроить контент веб-страниц для пользователей и групп в соответствии с бизнес-правилами и профилями пользователей.
Вы можете настроить портал в соответствии с потребностями вашей организации, пользователей и групп пользователей. Вы можете настроить внешний вид портала в соответствии со стандартами вашей организации и настроить контент веб-страниц для пользователей и групп в соответствии с бизнес-правилами и профилями пользователей.
HCL Content Manager (ранее IBM Web Content Manager) входит в состав HCL Portal для осуществления устойчивого управления сложным динамичным веб-контентом в больших объемах. Он включает в себя интерфейс разработки, который можно настраивать и расширять, рабочий процесс, управление версиями, таксономию и многое другое. HCL Content Manager повышает эффективность и аккуратность размещения веб-контента. Это достигается путем передачи контента в руки экспертов по контенту, которые самостоятельно без привлечения ИТ-специалистов и разработчиков могут создавать, поддерживать и размещать онлайн-контент, при этом ИТ-служба сохраняет контроль над работой портала.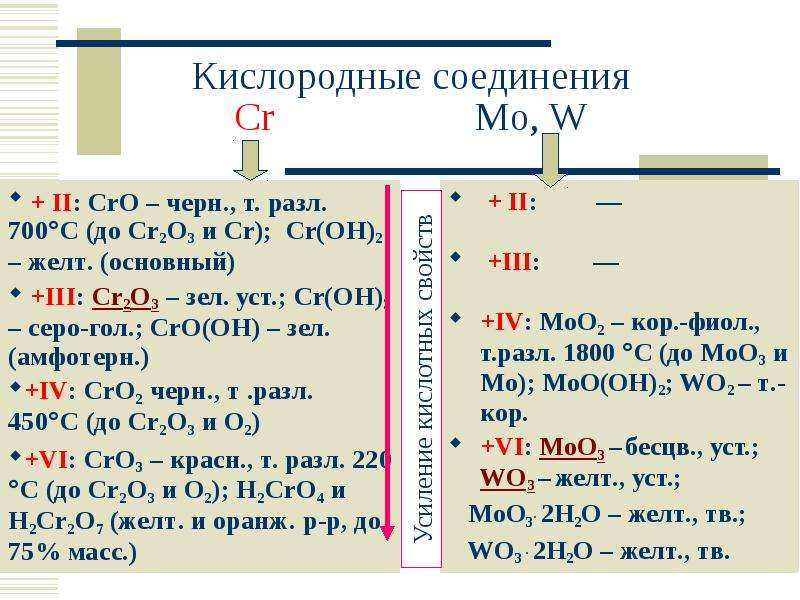
Вы можете легко управлять растущим объемом цифрового контента, который необходим для ведения бизнеса и поддержки критически важных решений, предоставления адаптивного контента, таргетированных предложений, бесшовно интегрированных приложений и утвержденного брендинга по всем каналам взаимодействия через веб и мобильные устройства.
Свяжитесь с нами, чтобы продолжить разговор и назначить встречу!
Отправить запросРавновесие Хромат-Дихромат: 1
Равновесие Хромат-Дихромат: 1Хромат — Дихроматное равновесие
Что произойдет, если мы добавим немного соляной кислоты? Для простоты
символ H + используется для кислотного протона, а не Брнстеда-Лоури
ион гидроксония H 3 O + . Если вы хотите использовать символ H 3 O + ,
тогда вам нужно будет добавить еще H 2 O в правую часть каждого уравнения
для каждого протона кислоты. Все ионы в этих уравнениях являются водными, но символ (aq)
для краткости опущено. Все ионы в этих уравнениях являются водными, но символ (aq)
для краткости опущено. |
Соляная кислота является источником ионов H + . Если было нет химическая реакция, затем добавление HCl должно увеличить количество H + (водн.). Исходный H + в воде увеличился бы стать H +
Если добавить в хромат H + раствора и химической реакции не было:
2 CrO 4 2- + 2 H + Cr 2 O 7 2 — + H 2 O (л) станет 2 CrO 4 2- + 2H + Cr 2 O 7 2 — + H 2 O (л)
Если к дихромату добавить H + раствора и химической реакции не было:
2 CrO 4 2- + 2 H + Cr 2 O 7 2- + H 2 O (l) превратится в 2 CrO 4 2- + 2H + Cr 2 O 7 2- + H 2 O (л)
Мы не увидим никаких изменений цвета, так как H + бесцветен. Но там — это будет химическая реакция. Из Ле Шателье
в принципе, мы знаем, что реакция попытается удалить некоторые из имеющихся у нас H + добавлен. Часть добавленного H + вступает в реакцию с CrO 4 2- ,
удаление части каждого из них и изготовление большего количества Cr 2 O 7 2-.
Но там — это будет химическая реакция. Из Ле Шателье
в принципе, мы знаем, что реакция попытается удалить некоторые из имеющихся у нас H + добавлен. Часть добавленного H + вступает в реакцию с CrO 4 2- ,
удаление части каждого из них и изготовление большего количества Cr 2 O 7 2-.
Для раствора хромата:
Для раствора дихромата:
Авторские права 1998–2008 Дэвид Дайс
Применение для вертикальных конических структур в интегрированных оптоэлектронных устройствах
Селективное влажное травление InGaAs / InGaAsP в растворе HCl / HF / CrO3:
Применение для вертикальных конических структур в интегрированных оптоэлектронных устройствах
Хуэй Хуанг, 兲 Синьян Ван, Сяомин Рен, б 兲 Ци Ван и Юнцин Хуанг 兲
Пекинский университет почты и телекоммуникаций, П. О. Box 66, Пекин 100876, Китай
О. Box 66, Пекин 100876, Китай
共 Получено 8 апреля 2005 г .; принята 31 мая 2005 г .; опубликовано 22 июля 2005 г. 兲
Характеристики травления In0.53Ga0.47As и In0.72Ga0.28As0.6P0.4, которые согласованы по решетке с
подложкой InP, в растворе HCl / HF / CrO3 были исследованы с помощью динамического травильная маска
техника. Для раствора с объемным соотношением HCl / HF / CrO3 x: 0,5: 1 селективность травления
снижается с 42,4 до 1,5 для In0,53Ga0,47As / In0.72Ga0.28As0.6P0.4 с увеличением отношения объемов HCl / CrO3 x
от 0 до 1.0. С помощью селективного травления экспериментально были изготовлены вертикальные конические структуры
с углами от 1,35 ° до 33,7 ° на эпитаксиальном слое
In0,72Ga0,28As0,6P0,4 In0,72Ga0,28As0,6P0,4, шероховатость поверхности травленого конуса составила ⬍1,6 нм. Поведение при травлении можно объяснить с помощью комбинированного механизма химического и химического травления. © 2005 American Vacuum
Society. 关 DOI: 10.1116 / 1.19 兴
关 DOI: 10.1116 / 1.19 兴
I. ВВЕДЕНИЕ
С быстрым развитием оптической связи и оптоэлектронной технологии
вертикальная коническая структура играет все более важную роль во многих приложениях, таких как структурный фотодетектор
1 преобразователь. 2,3 Другими словами,
обычно необходимо изготовить вертикальный конус
,с определенным углом как часть интегрированного устройства. Примерно
производственных технологий, таких как химическое осаждение с помощью лазера., были перенесены
. Для сравнения, метод маски динамического травления, в котором
использует селективное травление различных материалов, отличается простотой, низкой стоимостью и возможностью удобного получения различных углов
за счет регулировки селективности решения
.6
В последнее время лет InP и родственные ему тройные или четвертичные соединения становятся все более важными для применения в оптоэлектронных устройствах с длинной длиной волны
фунтов. До сих пор было опубликовано множество результатов для селективного влажного травления
До сих пор было опубликовано множество результатов для селективного влажного травления
InGaAs / InP с различными растворами, такими как HCl / h4PO4,7
лимонная кислота / h3O2,8h3SO4 / h3O2,9FeCl3, K
3Fe 共 CN兲 6,10 и
OBr-, 11 и т. Д. Для этих растворов селективность обычно
очень высока и не может быть отрегулирована до желаемого значения с помощью
, варьируя состав раствора. Таким образом, травители, упомянутые выше, не подходят для изготовления вертикальных конусов.
В этой статье мы впервые предложили раствор HCl / HF / CrO3solu-
для селективного травления InGaAs / InGaAsP. Характеристики травления
In0.53Ga0.47As и In0.72Ga0.28As0.6P0.4
были исследованы с использованием метода динамической маски травления. Скорость травления
процесса, морфология поверхности конуса
и угол конуса были изучены с помощью сканирующей электронной микроскопии
, сканирующей микроскопии (SEM) и атомно-силовой микроскопии (AFM). Конические конструкции
Конические конструкции
с углами в диапазоне от 1.От 35 ° до 33,7 °
были реализованы на эпитаксиальном слое In0.72Ga0.28As0.6P0.4 путем селективного
влажного травления In0.53Ga0.47As / In0.72Ga0.28As0.6P0.4 и шероховатости поверхности
протравленного слоя In0.72Ga0.28As0.6P0.4
составила 1,6 нм.
II. ЭКСПЕРИМЕНТ
Процесс изготовления конуса был описан, как показано
на рис. 1.6. После нанесения рисунка из фоторезиста и удаления слоя
InP образец травили в растворе HCl / HF / CrO3.
Из-за бокового травления слоя динамической маски все больше и больше
формирующих конус слоев будут постепенно подвергаться воздействию чар
. Вдоль бокового направления травления динамической маски
было получено линейное изменение глубины травления формирующего конус
слоя. Таким образом образуется коническая структура.
Когда слой динамической маски достаточно тонкий, угол
протравленного конуса удовлетворяет уравнению:
tan 共
兲 = VT / VD, 共 1 兲
, где
, VD и VT представляют угол конуса, скорость травления слоя динамической маски
и скорость травления формирующего конус слоя
соответственно.
Чтобы получить плоскую поверхность конуса, скорости травления,
, которые должны быть постоянными в течение всего процесса травления,
должны быть ограничены скоростью реакции.8 Более того, протравленная поверхность
должна быть достаточно гладкой, чтобы соответствуют низким потерям на рассеяние
световой волны на поверхности. Таким образом, очень важно правильно выбрать состав материалов и чары для
.
Образец, использованный в этом исследовании, был выращен методом химического осаждения из газовой фазы.
MOCVD на полуизолирующем материале
a Электронная почта: huihuang @ bupt.edu.cn.
b 兲 Электронная почта: [email protected].
c 兲 Электронная почта: [email protected]. ИНЖИР. 1. Принципиальная схема метода динамической маски травления.
1650 1650 Дж. Vac. Sci. Technol. B 23 „4…, июль / август 2005 г. 0734-211X / 2005/23„ 4… / 1650/4 / $ 22.00 © 2005 American Vacuum Society
Untitled
Untitled
|
Обзор
В этом эксперименте вы исследовали Принцип применительно к шести равновесным системам.
Принцип Ле Штелье гласит, что при изменении система уже находится в равновесии , система реагирует на таким образом, чтобы вернуть в состояние равновесия. Для система химической реакции, когда система «реагирует так, чтобы вернуться в равновесие », это означает, что система будет реагировать либо в направлении вперед, (чтобы произвести дополнительный продукт) или в обратном направлении (чтобы потребить некоторое количество продукта).
Принцип Ле Ле Штелье очень важен в химическом и химическом машиностроении. отрасли. Цель в этих отраслях — получить как можно больше продукции (что может быть затем проданным) для данного количества исходных материалов. Химики и инженеры-химики при разработке новых процессов широко используется принцип Ле Ле Штелье при разработке своих системы
Результаты, пояснения и обсуждения
Поскольку это был «качественный» эксперимент, очевидно, что нет расчеты, которые необходимо выполнить для вашего отчета.
.
Вместо этого давайте попробуем разобраться в каждом шаге процедуры (что вы сделали и наблюдались в лаборатории) и попытайтесь связать это с принципом Ле Штелье. Иногда при длительном студентам было трудно понять, где именно Ле Ле Штелье Принцип входит в дискуссию в некоторых реакциях. Вы должны были приготовить оба ваши страницы данных (страницы 157-161), а также страницы процедур (страницы 149-155) для этого.
Будьте осторожны! В вашем отчете вас просят указать, что подчеркивает было то, что применялось к равновесной реакции.Напряжение , а не добавленное вами химическое вещество, вызвавшее изменение. Стресс может только быть изменением концентрации одного из видов, записанным в уравнение равновесной реакции. Так, например, если вы добавляете в систему HCl, и это вызывает изменение, напряжение составляет , а не «добавление HCl»: стресс должен интерпретироваться с точки зрения составляющих видов только равновесие.
А.Хромат-дихроматное равновесие
Страницы 149-150 и 157.
Равновесие между хромат-ионом (CrO 4 2- ) и дихромат-ионом (Cr 2 O 7 2- ). Указание по какому пути реакция сдвигов при внесении изменений в систему основана на цвете из этих два иона в растворе: ион хромата яркий желтый в растворе, тогда как ион дихромата имеет яркий оранжевый .Итак, если раствор стал оранжевым, когда вы что-то добавили в него, равновесие смещено вправо; если раствор пожелтел, равновесие было смещен влево.
CrO 4 2- (желтый) + 2H + = Cr 2 O 7 2- (оранжевый) + H 2 O
- На этапе A1 на странице 150 вы добавили серную кислоту (H 2 SO 4 ) в
образец хромата калия, K 2 CrO 4 .
 Что случилось с цветом
K 2 CrO 4 когда вы это сделали? (см. ваше наблюдение на странице 157).
Основываясь на изменении цвета, которое вы видели, в какую сторону сместилось равновесие, вправо или влево?
Серная кислота является источником H + : . Любой источник H + будет иметь
вызвал такой же сдвиг в этом равновесии. «Напряжение», примененное к
система , а не добавление серной кислоты! В
«стресс» должен быть объяснен только с точки зрения вида
присутствует в уравнении равновесной реакции: серная кислота является источником водорода
ионов , и это увеличение концентрации ионов водорода , что
вызывает смещение равновесия.
Что случилось с цветом
K 2 CrO 4 когда вы это сделали? (см. ваше наблюдение на странице 157).
Основываясь на изменении цвета, которое вы видели, в какую сторону сместилось равновесие, вправо или влево?
Серная кислота является источником H + : . Любой источник H + будет иметь
вызвал такой же сдвиг в этом равновесии. «Напряжение», примененное к
система , а не добавление серной кислоты! В
«стресс» должен быть объяснен только с точки зрения вида
присутствует в уравнении равновесной реакции: серная кислота является источником водорода
ионов , и это увеличение концентрации ионов водорода , что
вызывает смещение равновесия. - Это пример того, как ученики не могут интерпретировать то, что они сделали, и
как на равновесие влияет то, что было сделано с системой. Прежде всего, NaOH — это
явно , а не один из видов, участвующих в равновесии, написанном выше.
 Тем не менее, когда
вы добавили несколько капель NaOH в смесь, полученную на этапе A1, вы должны были заметить изменение.
Хотя NaOH не является частью равновесия над собой, NaOH реагирует с одним из
компоненты равновесия, эффективно удаляя этот вид из равновесия.NaOH представляет собой сильное основание и реагирует с кислотами : NaOH реагирует с водородом
ион в равновесной системе и удаляет его. Если снять H + с
равновесной системе, система должна будет реагировать в направлении, которое заменяет некоторые из
H + для восстановления равновесия. Соответствует ли это изменение цвета, которое вы
наблюдаемый?
Тем не менее, когда
вы добавили несколько капель NaOH в смесь, полученную на этапе A1, вы должны были заметить изменение.
Хотя NaOH не является частью равновесия над собой, NaOH реагирует с одним из
компоненты равновесия, эффективно удаляя этот вид из равновесия.NaOH представляет собой сильное основание и реагирует с кислотами : NaOH реагирует с водородом
ион в равновесной системе и удаляет его. Если снять H + с
равновесной системе, система должна будет реагировать в направлении, которое заменяет некоторые из
H + для восстановления равновесия. Соответствует ли это изменение цвета, которое вы
наблюдаемый?
H + (из равновесия) + OH — (из NaOH) H 2 O
Изменение в системе произошло при добавлении NaOH, но «напряжение» системы должно быть описано в терминах уравнения для равновесия
CrO 4 2- (желтый) + 2H + = Cr 2 O 7 2- (оранжевый) + H 2 O
Итак, поскольку NaOH эффективно удаляет ион водорода из системы, превратив ее в воду, «стресс» от с точки зрения равновесия было бы уменьшение иона водорода на концентрация.

Б. Равновесие железо (III) — тиоцианат
Страницы 150-151 и 158
Как вы видели в предыдущем эксперименте, ион Fe 3+ и SCN — реагируют друг с другом с образованием красного комплексного иона [FeSCN] 2+ . В предыдущем В эксперименте вы использовали очень разбавленные (0,00200 M ) растворы Fe 3+ и SCN — и поэтому цвет продукта был слабым красновато-оранжевым.В этом эксперименте вы используете гораздо более концентрированные растворы (0,1 M ), поэтому раствор продукта имеет темно-красный цвет. (почти цвета крови).
Fe 3+ (бесцветный) + SCN — (бесцветный) = [FeSCN] 2+ (кроваво-красный)
В этой системе мы можем сказать, в каком направлении смещается равновесие, когда происходит изменение сделано путем мониторинга интенсивности цвета системы.
Если система потемнеет красного цвета, то равновесие должно смещаться вправо (в сторону производства большего количества цветной продукт). Если цвет системы бледнеет (или совсем исчезает), равновесие должно смещаться влево (в сторону бесцветных компонентов). Вы должны были быть очень наблюдательными в этой части, чтобы увидеть изменение в интенсивность красного цвета при добавлении капли реагента: если вы тоже подождали долго, локализованное изменение цвета по мере того, как капля входит в состояние равновесия. реакция угаснет.
- Этот шаг процедуры — это всего лишь настройка системы равновесия: вы смешали
некоторое количество Fe (NO 3 ) 3 и некоторое количество KSCN для создания системы в уравнении
выше. Ионные реакции протекают очень быстро, и система пришла в равновесие за несколько секунд.
секунд, на что указывает появление темно-красного цвета. Поскольку этот цвет
настолько глубоко, что вам сказали разделить смесь на несколько лунок и добавить в нее воды
пока он не будет достаточно разбавлен, чтобы вы могли видеть изменения цвета в
система.

- На этом этапе вы добавили дополнительный Fe (NO 3 ) 3 по каплям в одну из лунки, содержащие окрашенную равновесную смесь. Если был добавлен дополнительный Fe 3+ для системы , которая уже была в равновесии , это было бы слишком много Fe 3+ присутствует в системе. Система должна будет среагировать (либо влево или справа), чтобы удалить часть дополнительного Fe 3+ из смеси.В в каком направлении система отреагирует на удаление Fe 3+ ? Если система отреагировала на удалите излишки Fe 3+ , в результате будет более или менее окрашенный продукт? Основываясь на ваших наблюдениях (Страница 158) относительно того, стала ли смесь темнее или светлее, когда был добавлен дополнительный Fe 3+ , что привело к достижению равновесия сдвиг? Соответствовали ли ваши наблюдения за цветом представлению о том, что система должна убрать какие-то дополнительные Fe 3+ ? Вы должны понимать, что изменение система была бы взята с первая капля дополнительного Fe 3+ добавлено: если бы вы не были внимательны, возможно, вы пропустили смену цвета!
- На этом этапе вы добавили дополнительный KSCN по каплям в одну из лунок, содержащих
цветная равновесная смесь.
 Если в систему были добавлены дополнительные SCN — ,
было уже в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна будет отреагировать на удаление некоторых дополнительных SCN — .
из системы. На основании этого обсуждения и ваших наблюдений за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
слева (меньше товара, меньше цвета).
Если в систему были добавлены дополнительные SCN — ,
было уже в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна будет отреагировать на удаление некоторых дополнительных SCN — .
из системы. На основании этого обсуждения и ваших наблюдений за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
слева (меньше товара, меньше цвета). - Вот ситуация, аналогичная той, что была поднята в разделе A2 выше: NaOH — это , а не .
дана часть равновесной реакции. Однако процедура (Страница 151) имеет особый
Отметим, напомним, что Fe (OH) 3 нерастворим в воде . Если Fe (OH) 3 не растворяется в воде, то добавление NaOH к равновесной системе должно вызвать
происходит следующая реакция: добавление NaOH приводит к осаждению Fe 3+ в виде Fe (OH) 3 из равновесной системы.
 Если Fe 3+ является удаленным из равновесия
система, то система больше не будет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
это обсуждение, в какую сторону сместится равновесие, если Fe 3+ удалить из
система? Будет ли количество окрашенного комплекса увеличиваться или уменьшаться?
Если Fe 3+ является удаленным из равновесия
система, то система больше не будет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
это обсуждение, в какую сторону сместится равновесие, если Fe 3+ удалить из
система? Будет ли количество окрашенного комплекса увеличиваться или уменьшаться?
Fe 3+ (из равновесия) + 3OH — (из NaOH) Fe (OH) 3 (твердый осадок)
С.Равновесие ионов кобальта (II) и хлорида
Мы пропустили эту часть эксперимента!
D. Равновесие в насыщенном растворе NaCl
Стр. 152 и Стр. 159
В частях A и B выше мы рассмотрели равновесные системы, основанные на действительном химическом соединении . реакции. В этой части мы рассматриваем физическое равновесие , основанное на растворимость.
Когда кристаллическое ионное твердое вещество растворяется в воде, частицы твердого вещества попадают в растворитель для образования раствора.Но это происходит только до определенного момента. Поскольку концентрация ионов в растворе увеличивается, вероятность того, что ионы будут притягиваться оставшимися количество ионов в кристалле увеличивается, и ионы, которые были растворены, начинают повторно входить в кристаллы твердого тела. В конце концов, скорость, с которой ионы повторно входят в кристаллы, становится равной к скорости, с которой ионы покидают кристаллы, и «устойчивое состояние» учредил. Как только это установившееся состояние достигнуто, чистые концентрации ионов в раствор больше не увеличивается, и раствор называется «насыщенным».С у нас есть два противоположных процесса, протекающих с одинаковой скоростью, равновесие существует между нерастворенное растворенное вещество и насыщенный раствор.
Na + (в растворе) + Cl — (в растворе) = NaCl (нерастворенное твердое вещество)
- Это просто настройка 24-луночного планшета для следующих тестов.
 Возможно вы заметили
что на дне бутылки с насыщенным раствором NaCl были кристаллы, так как
вы взяли образцы.Это было сделано для того, чтобы раствор был насыщен NaCl.
когда вы взяли немного. Насыщенный NaCl содержит ионы Na + и Cl — каждый при
концентрация 5,4 M (моль / л).
Возможно вы заметили
что на дне бутылки с насыщенным раствором NaCl были кристаллы, так как
вы взяли образцы.Это было сделано для того, чтобы раствор был насыщен NaCl.
когда вы взяли немного. Насыщенный NaCl содержит ионы Na + и Cl — каждый при
концентрация 5,4 M (моль / л). - На этом этапе вы добавили несколько капель концентрированной соляной кислоты (HCl) в одну из ваши насыщенные образцы NaCl. Концентрированная HCl содержит H + и Cl — . ионы каждый в концентрации 12,0 моль / л. Другими словами, когда вы добавили концентрированный HCl к насыщенному раствору NaCl вы добавляли большое количество хлорид-иона, Cl — , к раствору.Равновесие растворимости должно было отреагировать сдвигом направление, которое удалит часть избыточного хлорид-иона из раствора. Что наблюдали ли вы (стр. 159) в своем растворе, что указывает на то, что избыток хлорид-иона был удаляется из раствора?
- В этой части эксперимента вы добавили 3 M HCl во второй образец насыщенного
NaCl.
 Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5.4 M ), в который вы его добавили. При добавлении 3 M HCl к насыщенному раствору NaCl, вы, вероятно, не заметили никаких изменений , а не (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия.
фактически понижает концентрацию хлорид-иона в растворе.
Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5.4 M ), в который вы его добавили. При добавлении 3 M HCl к насыщенному раствору NaCl, вы, вероятно, не заметили никаких изменений , а не (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия.
фактически понижает концентрацию хлорид-иона в растворе.
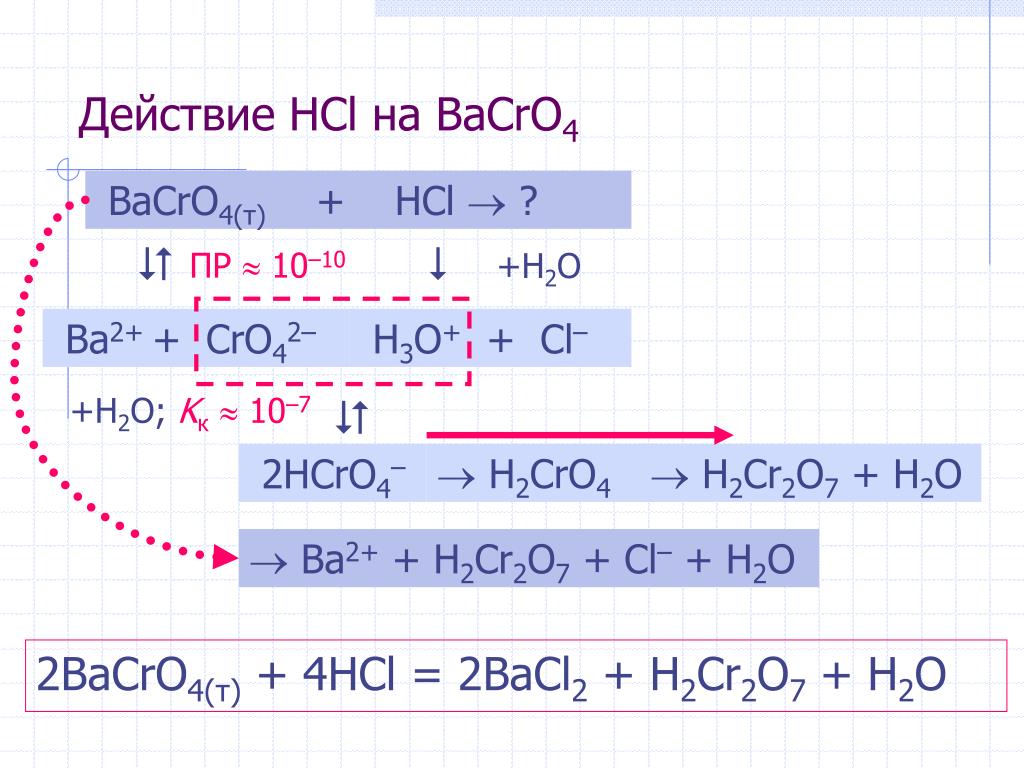
E. Равновесие насыщенного хромата бария
Это еще один пример равновесия растворимости с небольшим «поворотом». наступает на Шаге 2.
Ba 2+ (в растворе) + CrO 4 2- (в решение; желтый) = BaCrO 4 (желтое твердое вещество)
- На этом этапе вы просто создаете равновесие, смешивая BaCl 2 и K 2 CrO 4 решения. Должно было выпасть желтое твердое вещество с прозрачным желтым раствором над ним.
 Прозрачный желтый раствор — это насыщенный раствор BaCrO 4 (см. Ваши наблюдения
на странице 159).
Прозрачный желтый раствор — это насыщенный раствор BaCrO 4 (см. Ваши наблюдения
на странице 159). - На этом этапе вы добавили несколько капель концентрированной соляной кислоты HCl в смесь, приготовленная на этапе 1. Что произошло с осадком BaCrO 4 (см. ваши наблюдения на странице 159), полученные на этапе 1, когда вы это сделали? На странице 159 вы задали вопрос о том, почему HCl влияет на равновесие BaCrO 4 , хотя HCl не появляется как часть приведенной выше равновесной реакции для BaCrO 4 . Оглядываться в части A этого эксперимента и посмотрите, сможете ли вы понять, почему кислота , такая как HCl, влияет на равновесие BaCrO 4 .Что делает добавка кислоты для CrO 4 2- ион в растворе, и как это повлияет на равновесие BaCrO 4 ?
F. Равновесие насыщенного гидроксида железа
В этой части вы действительно изучаете два равновесия с участием иона Fe 3+ и гидроксид-ион, ОН — .
Fe 3+ (в растворе) + 3OH — (в растворе) = Fe (OH) 3 (красноватый осадок)
и
Fe 3+ (в растворе) + 4OH — (в растворе) = Fe (OH) 4 — (в растворе)
, которое также можно записать как
Fe (OH) 3 (красноватое твердое вещество) + OH — (в растворе) = Fe (OH) 4 — (в растворе)
- На этом этапе вы просто создаете первое равновесие, описанное выше.Когда ты к раствору нитрата железа (III) добавляют раствор гидроксида натрия, выпадает красноватый осадок Формируется Fe (OH) 3 (см. Ваши наблюдения на стр. 160).
- Когда вы добавляете HCl (сильную кислоту) к смеси со стадии 1, кислота реагирует с гидроксид-ион по реакции
H + + OH — H 2 O.
- Как указано во введении к Части F, кислота эффективно удаляет OH — из равновесная система.Что случилось с осадком из шага 1, когда вы добавили HCl (см. Ваши наблюдения на стр. 160), и как это согласуется с равновесием?
3. В этой части вы добавляете дополнительных NaOH во вторую лунку, содержащую Fe (OH) 3 вы получили на шаге 1. Добавление дополнительного NaOH приводит в действие второе равновесие. Каковы ваши наблюдения по поводу того, что случилось с осадком Fe (OH) 3 когда добавлен дополнительный NaOH в соответствии со второй (и третьей) реакциями, указанными выше?
г.Равновесие аммиака в воде
Мы пропустили эту часть эксперимента!
H. Равновесие насыщенного AgCl
В этой части вы изучаете два связанных равновесия с участием хлорида серебра. У тебя будет уделить пристальное внимание в следующем обсуждении, чтобы понять, какое равновесие мы говорим, так как процедура довольно сложная.
Когда ион серебра (Ag + ) и хлорид-ион (Cl — ) объединены, a образуется осадок хлорида серебра, оставляя насыщенный раствор AgCl над твердый.Остающиеся в растворе ионы серебра и хлорид-ионы находятся в равновесии с осадок
AgCl (твердый) = Ag + (в растворе) + Cl — (в раствор)
Обратите внимание, что это равновесие растворимости было записано в противоположном смысле равновесия растворимости в частях D и E выше: это не имеет значения, поскольку равновесная реакция «идет в обоих направлениях». Просто держи прямо, что твой объяснения должны быть даны в терминах того, как уравнение реакции дано в этой части.
Ион серебра также находится в равновесии с аммиаком
Ag + (в растворе) + 2NH 3 (в растворе) = Ag (NH 3 ) 2 + (в растворе)
- На этом этапе вы просто создаете первое равновесие, указанное выше (растворимость
равновесие для AgCl).
 Когда вы добавляли HCl (концентрированный ионный раствор Cl — ) в
AgNO 3 , образовался белый осадок AgCl.Раствор над осадком
представлял собой насыщенный раствор ионов Ag + и Cl — .
Когда вы добавляли HCl (концентрированный ионный раствор Cl — ) в
AgNO 3 , образовался белый осадок AgCl.Раствор над осадком
представлял собой насыщенный раствор ионов Ag + и Cl — . - Все, что вы делаете на этом этапе, — удаляет большую часть насыщенного раствора из осадок на этапе 1. Однако следует понимать, что осадок на этапе 1 все еще влажный от насыщенный раствор AgCl после удаления из него основной части жидкости. Решение, которое вы remove представляет собой насыщенный раствор AgCl. Смесь, оставшаяся в лунке после этапа 1, твердая. AgCl все еще находится в равновесии с оставшимся покрытием из насыщенного раствора AgCl.
- На этом этапе вы играете с и из приведенных выше равновесий. При добавлении дополнительных
Раствор AgNO 3 в жидкость, удаленную на этапе 2, это увеличение
концентрация иона Ag + . В каком направлении будет первое равновесие выше
сдвиг, если были добавлены дополнительные ионы Ag + ? Как это отражается в вашем
наблюдение на странице 161? Какой осадок образовался при добавлении AgNO 3 к жидкости из Шага 2? Затем вы добавили в смесь концентрированный аммиак.
 Что
случилось с только что образовавшимся осадком? Это второе равновесие выше:
при добавлении аммиака к раствору, содержащему ион Ag + , аммиак образует
комплекс с ионом Ag + и удаляет его из раствора. Что происходит с
осадок, если ион Ag + удалить из раствора аммиаком?
Что
случилось с только что образовавшимся осадком? Это второе равновесие выше:
при добавлении аммиака к раствору, содержащему ион Ag + , аммиак образует
комплекс с ионом Ag + и удаляет его из раствора. Что происходит с
осадок, если ион Ag + удалить из раствора аммиаком? - Когда вы добавляете аммиак к смеси твердого AgCl и насыщенного раствора AgCl, что происходит с осадком? Как мы видели в шаге 3 выше, аммиак удаляет Ag + ион.Что должно было бы произойти с осадком, если бы ион Ag + был удален из раствора, покрывающего его? Затем вы добавили азотную кислоту (HNO 3 ). Азотный кислота реагирует с аммиаком (аммиак — основание): HNO 3 + NH 3 NH 4 NO 3 . Таким образом, аммиак удален из системы. Если аммиак удалить из второго равновесия выше, как что сдвиг равновесия? Если указанное выше равновесие секунды сдвигается, как это повлиять на равновесие первое ? Это становится действительно сложно, да !!
Химия хрома
Химия хрома12.
 6 Химия хрома
6 Химия хромаПродемонстрированные химические концепции: Cr 2+ , Cr 3+ , amd Степени окисления хрома Cr (IV)
Демонстрация:
|
Наблюдения и пояснения:
| Блюдо | Наблюдение / Пояснение |
| A + B | Фиолетовый раствор Cr (H 2 O) 6 3+ . |
| К | Цвет раствора меняется с фиолетового на «кислотно-зеленый». |
| D | Зеленый Cr (OH) 3 выпадает в осадок из зеленого раствора. Больше основания приведет к повторному растворению твердого вещества. |
| E | Зеленый раствор меняется на оранжевый как CrO 4 2- / Cr 2 O 7 2- ионов сформированы. |
| E + HCl | После добавления HCl серия беспорядочных изменений цвета не наблюдается. Когда реакция завершится, раствор зеленый. |
| A , C и D с HCl | Раствор A остается фиолетовым. Цвет раствора C изменится с зеленого на фиолетовый. Раствор D дает еще один зеленый раствор. |
| B с HCl и Zn | Когда раствор становится
кислой, в блюдо добавляют несколько штук Zn. |
| Исходный раствор + BaCl 2 + Pb (NO 3 ) 2 | Желтый осадок BaCrO 4 сформируется.Добавление HCl приведет к повторному растворению осадка и получению оранжево-желтого цвета. решение. Pb (NO 3 ) 2 дает еще один желтый осадок, PbCrO 4 . |
RACTOPAMINE HCL | THINQ Pharma-CRO PVT Ltd
Ваше сообщение и контактные данные будут отправлены напрямую поставщику, и на него ответят по его усмотрению.
Название вашей компании
Имя
Твой номер телефона
Страна / Область
— Пожалуйста, выберите -AfghanistanAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntarcticaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBoliviaBonaireBosnia HercegovinaBotswanaBouvet IslandBrazilBritish Индийский океан TerritoryBrunei DarussalamBulgariaBurkina FasoBurmaBurundiCambodiaCameroonCanadaCape VerdeCayman IslandsCentral африканских RepublicChadChileChinaChristmas IslandCocos (Килинг) IslandsColombiaComorosCongoCook IslandsCosta RicaCote D’IvoireCroatiaCubaCyprusCzech RepublicDenmarkDjiboutiDominicaDominican RepublicEast TimorEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland (Мальвинские) острова Фарерские IslandsFijiFinlandFranceFrench GuianaFrench PolynesiaFrench Южный TerritoriesGabonGambiaGeorgiaGermanyGhanaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHeard и Mc Donald IslandsHondurasHong Конг, С. AR, ChinaHungaryIcelandIndiaIndonesiaIran (Исламская Республика) IraqIrelandIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Корейская Народно-Демократическая Республика ofKorea, Республика ofKosovoKuwaitKyrgyzstanLao Народная Демократическая RepublicLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacau, ЮАР, ChinaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMawiMexicoMicronesiaMoldova, Республика ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueNamibiaNauruNepalNetherlandsNetherlands AntillesNeutral ZoneNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorth MacedoniaNorthern Mariana IslandsNorwayOmanPakistanPalauPalestinaPanamaPapua Новый GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarReunionRomaniaRussian FederationRwandaSaint Киттс и NevisSaint LuciaSaint Винсент и GrenadinesSamoaSan MarinoSao Фолиант и ПринсипиСаудовская АравияСенегалСербияСейшельские островаСьерра-ЛеонеСингапурСловакияСловенияСоломон Острова СомалиЮжная АфрикаИспанияШри-ЛанкаSt.
AR, ChinaHungaryIcelandIndiaIndonesiaIran (Исламская Республика) IraqIrelandIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Корейская Народно-Демократическая Республика ofKorea, Республика ofKosovoKuwaitKyrgyzstanLao Народная Демократическая RepublicLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacau, ЮАР, ChinaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMawiMexicoMicronesiaMoldova, Республика ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueNamibiaNauruNepalNetherlandsNetherlands AntillesNeutral ZoneNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorth MacedoniaNorthern Mariana IslandsNorwayOmanPakistanPalauPalestinaPanamaPapua Новый GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarReunionRomaniaRussian FederationRwandaSaint Киттс и NevisSaint LuciaSaint Винсент и GrenadinesSamoaSan MarinoSao Фолиант и ПринсипиСаудовская АравияСенегалСербияСейшельские островаСьерра-ЛеонеСингапурСловакияСловенияСоломон Острова СомалиЮжная АфрикаИспанияШри-ЛанкаSt. Елена Пьер и MiquelonSudanSurinameSvalbard и Ян Майен IslandsSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwan, ChinaTajikistanTanzania, Объединенная Республика ofThailandTogoTokelauTongaTrinidad и TobagoTunisiaTurkeyTurkmenistanTurks и Кайкос IslandsTuvaluUgandaUkraineUnited арабских EmiratesUnited KingdomUnited StatesUnited Штаты Экваторияльная IslandsUruguayUzbekistanVanuatuVatican City State (Святой Престол) VenezuelaVietnamVirgin острова (Британские) Виргинские острова (США) Уоллис и Футуна IslandsWestern SaharaYemen, Республика Заир, Замбия, Зимбабве,
Елена Пьер и MiquelonSudanSurinameSvalbard и Ян Майен IslandsSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwan, ChinaTajikistanTanzania, Объединенная Республика ofThailandTogoTokelauTongaTrinidad и TobagoTunisiaTurkeyTurkmenistanTurks и Кайкос IslandsTuvaluUgandaUkraineUnited арабских EmiratesUnited KingdomUnited StatesUnited Штаты Экваторияльная IslandsUruguayUzbekistanVanuatuVatican City State (Святой Престол) VenezuelaVietnamVirgin острова (Британские) Виргинские острова (США) Уоллис и Футуна IslandsWestern SaharaYemen, Республика Заир, Замбия, Зимбабве,
Вопрос № 862f2 | Socratic
Газообразный хлор , # «Cl» _2 #, это , а не , полученный нагреванием хлорид калия , # «KCl» #, дихромат калия , # «K» _2 «Cr» _2 «O» _7 #, и концентрированная серная кислота , # «H» _2 «SO» _4 #.(-) #.
Идея состоит в том, что при нагревании соединения, содержащего хлорид (твердая соль, , а не раствор, содержащий сольватированный анион) с дихроматом калия и концентрированной серной кислотой, в результате реакции образуется хромилхлорид, # «CrO» _2 «Cl» _2 #, красная дымящаяся жидкость.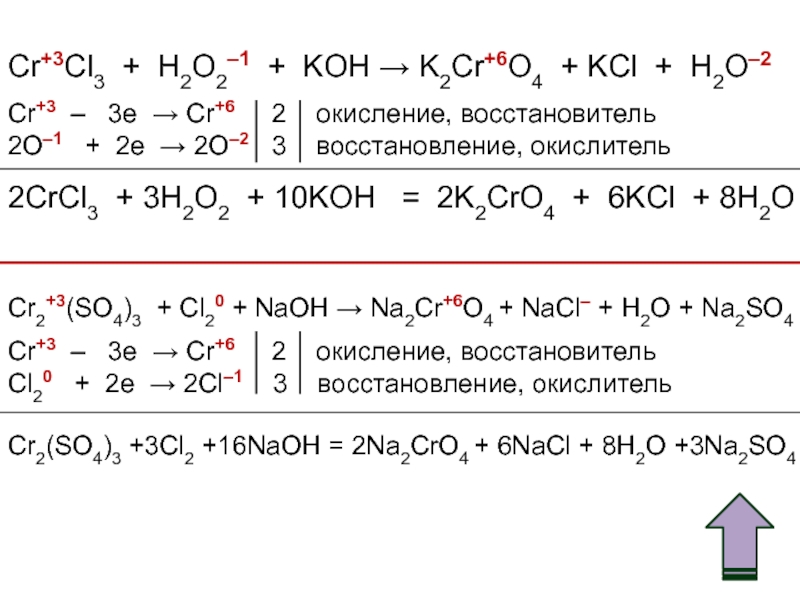
Вычисленное химическое уравнение реакции
# 4 «KCl» _text ((s)) + «K» _2 «Cr» _2 «O» _text (7 (s)) + «H» _2 «SO» _text (4 (aq)) stackrel (color ( красный) (Дельта) цвет (белый) (aa)) (->) 6 «KHSO» _text (4 (aq]) + 2 «CrO» _2 «Cl» _text (2 (g)) + 3 «H» _2 «O» _text ((l)) #
Имейте в виду, это своего рода общее описание реакции.
Вот что на самом деле происходит — серная кислота реагирует с хлоридом калия и дихроматом калия по отдельности, , с образованием соляной кислоты , # «HCl» # и триоксида хрома , # «CrO» _3 #, соответственно.
# «KCl» + «H» _2 «SO» _4 -> «KHSO» _4 + «HCl» #
# «K» _2 «Cr» _2 «O» _7 + 2 «H» _2 «SO» _4 -> 2 «KHSO» _4 + 2 «CrO» _3 + «H» _2 «O» #
Затем реакция между соляной кислотой и триоксидом хрома дает хромилхлорид.
# 2 «HCl» + «CrO» _3 -> «CrO» _2 «Cl» _2 + «H» _2 «O» #
Если сложить эти уравнения вместе (и уравновесить их), вы получите химическое уравнение, описывающее реакцию в целом.
Я думаю, что или газообразный хлор может быть получен здесь как побочный продукт реакции, но даже если это произойдет, эта реакция все равно будет считаться вашим ответом.
Вот очень крутое видео с подробным описанием реакции
Во всех остальных реакциях в качестве основного продукта образуется газообразный хлор, # «Cl» _2 #.
Перманганат калия, # «KMnO» _4 #, будет реагировать с концентрированной соляной кислотой с образованием хлорида калия, # «KCl» #, хлорида марганца (II), # «MnCl» _2 #, газообразного хлора и воды.
http://socratic.org/questions/how-to-balance-an-equation-in-its-molecular-form-eg-kmno4-hcl-gives-kcl-mncl2-h3
Диоксид марганца, # «MnO» _2 #, будет реагировать с концентрированной соляной кислотой с образованием хлорида марганца (II), газообразного хлора и воды
http://socratic. org/questions/hcl-is-added-to-following-oxides-which-one-would-give-h3o2-1-mno2-2-pbo2-3-bao2-
org/questions/hcl-is-added-to-following-oxides-which-one-would-give-h3o2-1-mno2-2-pbo2-3-bao2-
Наконец, хлорид калия будет реагировать с газообразным фтором с образованием газообразного хлора и фторида калия, # «KF» #
Качественный анализ: Катионы — Группа I# «KCl» _text ((s)) + «F» _text (2 (g)) -> 2 «KF» _text ((s)) + «Cl» _text (2 (g)) #
Гэри Л.Бертран
Университет Миссури-Ролла
Если разбавленный
раствор HCl добавляется к раствору, содержащему ВСЕ
из обычных ионов металлов образуется белый осадок. Этот
осадок будет содержать AgCl (s), Hg 2 Cl 2 (s) и
PbCl 2 (т). Если этот раствор центрифугировать для сбора
твердый материал на дне пробирки, надосадочная жидкость может
удалить (декантировать). Оставшееся твердое вещество можно промыть дистиллированной водой.
вода так, чтобы ТОЛЬКО
оставшиеся ионы металлов: Ag + , Hg 2 2+ ,
и Pb 2+ . В
происходят следующие реакции:
В
происходят следующие реакции:
Ag + (водн.) + Cl — (водн.) -> AgCl (т.)
Hg 2 2+ (водн.) + 2 Cl — (водн.) -> Hg 2 Cl 2 (с)
Pb 2+ (водн.) + 2 Cl — (водн.) -> PbCl 2 (т)
Реакции проходят в кислотный раствор, чтобы избежать возможности того, что эти и другие ионы металлов может выпадать в осадок в виде гидроксидов или оксидов.Эта реакция этого группа ионов с хлорид-ионами позволяет отделить их от всех остальных ионы металлов. Серебро, ртуть и свинец ионы были обозначены как катионы группы I.
Если сложение
разбавления HCl до раствора катионов металлов приводит к выпадению осадка,
это неопровержимое доказательство того, что по крайней мере один — а возможно и все —
Группа
I Катионы присутствовали в оригинале
решение. Необходимы дополнительные тесты, чтобы определить, какие из этих
В осадке присутствуют три катиона.
Пока эти три хлорида относительно нерастворимы в холодной воде, свинец обнаружено, что хлорид хорошо растворяется в горячих вода. Следовательно, холодная вода может быть добавлен к осадку, содержащему один или все три хлорида без любой из них повторно растворяется. Однако нагревание этой смеси вызовет хлорид свинца для растворения, если таковой присутствует. Пока еще горячо, пробирку можно центрифугировать, а раствор надосадочной жидкости можно декантировать в еще одна пробирка.Если присутствует какой-либо ион свинца, добавление холодной HCl растворение жидкости вызовет осаждение хлорида свинца белого цвета.
Серебро ion имеет особое свойство, которое отличает его от двух других катионов группы I. При смешивании с аммиаком в основном растворе образуются комплексные ионы (эти комплексы не образуются в кислом растворе, в котором аммиак существует в виде иона аммония):
Ag + (водн.)
+ NH 3 (водн.) = Ag (NH 3 ) + (водн.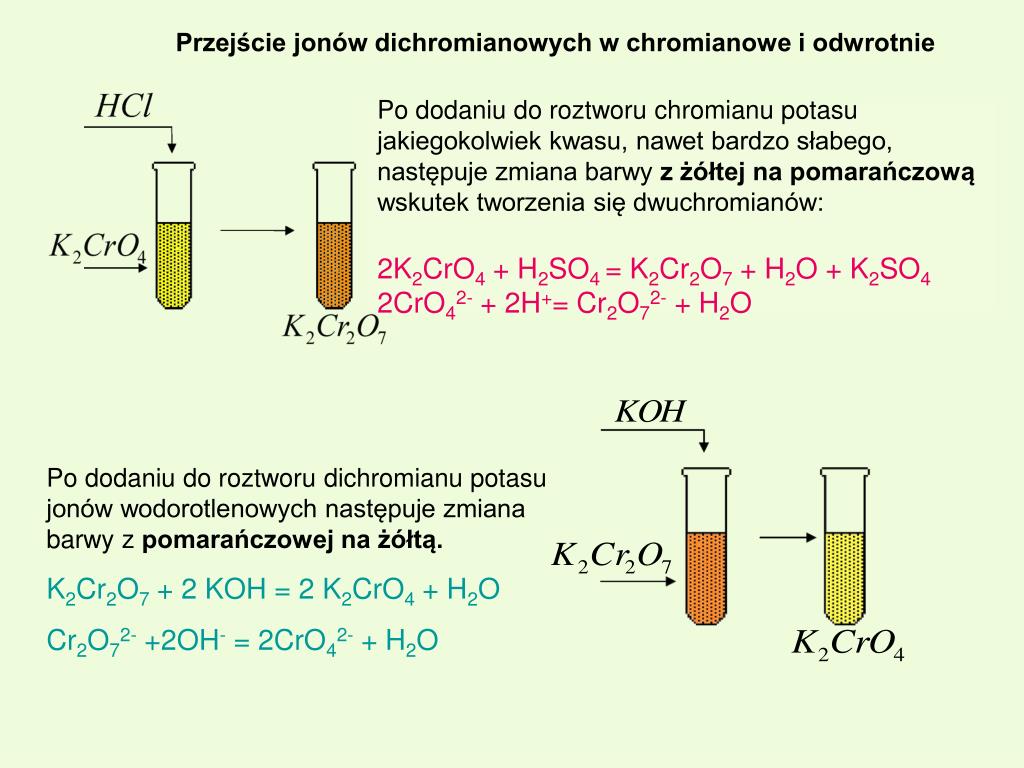 )
)
Ag (NH 3 ) + (водн.) + NH 3 (водн.) = Ag (NH 3 ) 2 + (водн.)
Формирование этих комплексов ионы снижает концентрацию свободных ионов серебра, позволяя осаждать хлорид серебра для растворения:
AgCl (т) + x NH 3 (водн.) -> Ag (NH 3 ) x + (водн.) + Cl — (водн.); х = от 1 до 2.
Таким образом, когда катионы I группы осаждают HCl, к осадку можно добавлять аммиак до тех пор, пока лакмусовая бумажка указывает на то, что решение является основным. Если осадок содержит иона серебра, он растворяется и может быть удален от других центрифугированием. и декантирование надосадочного раствора. Добавление HCl к этому раствору пока лакмусовая бумажка не покажет, что раствор является кислым, будет повторно выпадать осадок ион серебра, если присутствует.
Mercurous
хлорид можно отличить от двух других хлоридов группы I по его
способность сопротивляться повторному растворению при нагревании или добавлении аммиака.
После того, как Группа Катионы I были разделены нагреванием и добавлением аммиака, их присутствие (а) может быть подтверждено их осаждением с хромат-ионом:
Ag + (водн.) + CrO 4 2- (водн.) -> Ag 2 CrO 4 (т) Красный осадок
Hg 2 2+ (водн.) + CrO 4 2- (водн.) -> Hg 2 CrO 4 (т) Желто-коричневый осадок
Pb 2+ (водн.)
+ CrO 4 2- (водн.)
-> PbCrO 4 (т)
Желтый осадок
Предлагаемый эксперимент:
Наблюдения с растворами, содержащими известные катионы:
1. Поместите одну или две капли образца иона Ag + в одну пробирку, образец Hg 2 2+ дюйм вторая пробирка и образец Pb 2+ дюйм третья трубка.
2.
Добавьте 2 капли разбавленной HCl (3 M) в каждую пробирку и наблюдайте за осадками.
3. Центрифугируйте пробирки. Слейте и слейте надосадочную жидкость из каждую трубку.
4. Вымойте осадки, добавив по 2 капли дистиллированной воды в каждую пробирку. Центрифугируйте, декантируйте и слейте надосадочные жидкости.
5. Добавьте по 2 капли дистиллированной воды в каждую пробирку, затем нагрейте пробирки до кипения. водяная баня.
6. Обратите внимание, что раствор, содержащий Pb 2+ очищается. Пробирку можно центрифугировать, и твердые вещества не появятся. Если решение охлаждается добавлением капли дистиллированной воды (или просто постоянием некоторое время) снова появится белый осадок.
7.
Добавьте две капли аммиака (NH 3 ).
раствора в каждую пробирку и проверьте кислотность каждого раствора, окунув
чистой палочкой для перемешивания в жидкость и прикоснувшись к лакмусовой бумажке.
Если растворы не щелочные, добавьте еще нашатырного спирта, пока они не станут красной лакмусовой бумажкой. синий. Обратите внимание на любые изменения в осадках.
синий. Обратите внимание на любые изменения в осадках.
8. Обратите внимание, что раствор, содержащий Ag + , становится прозрачным. Опять же, Пробирка может быть центрифугирована, и твердое вещество не появится.
9. Добавьте каплю разбавленной HCl (3 M) к прозрачному раствору и проверьте лакмусовой бумагой. Если раствор не кислый, добавляйте по каплям еще HCl, пока раствор не становится синей лакмусовой краской. Обратите внимание, что снова появляется белый осадок AgCl. как только раствор станет кислым.
10. Добавьте одну-две капли раствора хромата натрия (Na 2 CrO 4 ) в каждую трубку. Обратите внимание на цвета осадков.
11.Выбросьте все растворы в соответствующие контейнеры для отходов.
Неизвестных:
Есть судебное разбирательство неизвестно и назначенный неизвестный. Неизвестное испытание генерируется программой случайным образом. После выполнения эксперимента нажмите Проверить неизвестное.


 Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K2CrO4 и зеленый Cr2O3.
Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K2CrO4 и зеленый Cr2O3. Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат.
Сам хромат превратится в зеленый хлорид трехвалентного хрома. Его можно выделить выпариванием раствора, а потом, сплавив с содой и селитрой, перевести в хромат. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром. Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано? Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H2CrO6 в органической и водных фазах.
Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H2CrO6 в органической и водных фазах. Нагревая 2мг глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
Нагревая 2мг глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым. Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
 Принцип Ле Штелье гласит, что при изменении
система уже находится в равновесии , система реагирует на таким образом, чтобы вернуть в состояние равновесия. Для
система химической реакции, когда система «реагирует так, чтобы вернуться в
равновесие », это означает, что система будет реагировать либо в направлении вперед, (чтобы произвести дополнительный продукт) или в обратном направлении (чтобы потребить некоторое количество
продукта).
Принцип Ле Штелье гласит, что при изменении
система уже находится в равновесии , система реагирует на таким образом, чтобы вернуть в состояние равновесия. Для
система химической реакции, когда система «реагирует так, чтобы вернуться в
равновесие », это означает, что система будет реагировать либо в направлении вперед, (чтобы произвести дополнительный продукт) или в обратном направлении (чтобы потребить некоторое количество
продукта). .
.
 Что случилось с цветом
K 2 CrO 4 когда вы это сделали? (см. ваше наблюдение на странице 157).
Основываясь на изменении цвета, которое вы видели, в какую сторону сместилось равновесие, вправо или влево?
Серная кислота является источником H + : . Любой источник H + будет иметь
вызвал такой же сдвиг в этом равновесии. «Напряжение», примененное к
система , а не добавление серной кислоты! В
«стресс» должен быть объяснен только с точки зрения вида
присутствует в уравнении равновесной реакции: серная кислота является источником водорода
ионов , и это увеличение концентрации ионов водорода , что
вызывает смещение равновесия.
Что случилось с цветом
K 2 CrO 4 когда вы это сделали? (см. ваше наблюдение на странице 157).
Основываясь на изменении цвета, которое вы видели, в какую сторону сместилось равновесие, вправо или влево?
Серная кислота является источником H + : . Любой источник H + будет иметь
вызвал такой же сдвиг в этом равновесии. «Напряжение», примененное к
система , а не добавление серной кислоты! В
«стресс» должен быть объяснен только с точки зрения вида
присутствует в уравнении равновесной реакции: серная кислота является источником водорода
ионов , и это увеличение концентрации ионов водорода , что
вызывает смещение равновесия. Тем не менее, когда
вы добавили несколько капель NaOH в смесь, полученную на этапе A1, вы должны были заметить изменение.
Хотя NaOH не является частью равновесия над собой, NaOH реагирует с одним из
компоненты равновесия, эффективно удаляя этот вид из равновесия.NaOH представляет собой сильное основание и реагирует с кислотами : NaOH реагирует с водородом
ион в равновесной системе и удаляет его. Если снять H + с
равновесной системе, система должна будет реагировать в направлении, которое заменяет некоторые из
H + для восстановления равновесия. Соответствует ли это изменение цвета, которое вы
наблюдаемый?
Тем не менее, когда
вы добавили несколько капель NaOH в смесь, полученную на этапе A1, вы должны были заметить изменение.
Хотя NaOH не является частью равновесия над собой, NaOH реагирует с одним из
компоненты равновесия, эффективно удаляя этот вид из равновесия.NaOH представляет собой сильное основание и реагирует с кислотами : NaOH реагирует с водородом
ион в равновесной системе и удаляет его. Если снять H + с
равновесной системе, система должна будет реагировать в направлении, которое заменяет некоторые из
H + для восстановления равновесия. Соответствует ли это изменение цвета, которое вы
наблюдаемый?
 Если система потемнеет
красного цвета, то равновесие должно смещаться вправо (в сторону производства большего количества
цветной продукт). Если цвет системы бледнеет (или совсем исчезает),
равновесие должно смещаться влево (в сторону бесцветных компонентов).
Вы должны были быть очень наблюдательными в этой части, чтобы увидеть изменение в
интенсивность красного цвета при добавлении капли реагента: если вы тоже подождали
долго, локализованное изменение цвета по мере того, как капля входит в состояние равновесия.
реакция угаснет.
Если система потемнеет
красного цвета, то равновесие должно смещаться вправо (в сторону производства большего количества
цветной продукт). Если цвет системы бледнеет (или совсем исчезает),
равновесие должно смещаться влево (в сторону бесцветных компонентов).
Вы должны были быть очень наблюдательными в этой части, чтобы увидеть изменение в
интенсивность красного цвета при добавлении капли реагента: если вы тоже подождали
долго, локализованное изменение цвета по мере того, как капля входит в состояние равновесия.
реакция угаснет.
 Если в систему были добавлены дополнительные SCN — ,
было уже в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна будет отреагировать на удаление некоторых дополнительных SCN — .
из системы. На основании этого обсуждения и ваших наблюдений за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
слева (меньше товара, меньше цвета).
Если в систему были добавлены дополнительные SCN — ,
было уже в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна будет отреагировать на удаление некоторых дополнительных SCN — .
из системы. На основании этого обсуждения и ваших наблюдений за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
слева (меньше товара, меньше цвета). Если Fe 3+ является удаленным из равновесия
система, то система больше не будет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
это обсуждение, в какую сторону сместится равновесие, если Fe 3+ удалить из
система? Будет ли количество окрашенного комплекса увеличиваться или уменьшаться?
Если Fe 3+ является удаленным из равновесия
система, то система больше не будет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
это обсуждение, в какую сторону сместится равновесие, если Fe 3+ удалить из
система? Будет ли количество окрашенного комплекса увеличиваться или уменьшаться?
 Возможно вы заметили
что на дне бутылки с насыщенным раствором NaCl были кристаллы, так как
вы взяли образцы.Это было сделано для того, чтобы раствор был насыщен NaCl.
когда вы взяли немного. Насыщенный NaCl содержит ионы Na + и Cl — каждый при
концентрация 5,4 M (моль / л).
Возможно вы заметили
что на дне бутылки с насыщенным раствором NaCl были кристаллы, так как
вы взяли образцы.Это было сделано для того, чтобы раствор был насыщен NaCl.
когда вы взяли немного. Насыщенный NaCl содержит ионы Na + и Cl — каждый при
концентрация 5,4 M (моль / л). Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5.4 M ), в который вы его добавили. При добавлении 3 M HCl к насыщенному раствору NaCl, вы, вероятно, не заметили никаких изменений , а не (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия.
фактически понижает концентрацию хлорид-иона в растворе.
Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5.4 M ), в который вы его добавили. При добавлении 3 M HCl к насыщенному раствору NaCl, вы, вероятно, не заметили никаких изменений , а не (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия.
фактически понижает концентрацию хлорид-иона в растворе. Прозрачный желтый раствор — это насыщенный раствор BaCrO 4 (см. Ваши наблюдения
на странице 159).
Прозрачный желтый раствор — это насыщенный раствор BaCrO 4 (см. Ваши наблюдения
на странице 159).

 Когда вы добавляли HCl (концентрированный ионный раствор Cl — ) в
AgNO 3 , образовался белый осадок AgCl.Раствор над осадком
представлял собой насыщенный раствор ионов Ag + и Cl — .
Когда вы добавляли HCl (концентрированный ионный раствор Cl — ) в
AgNO 3 , образовался белый осадок AgCl.Раствор над осадком
представлял собой насыщенный раствор ионов Ag + и Cl — .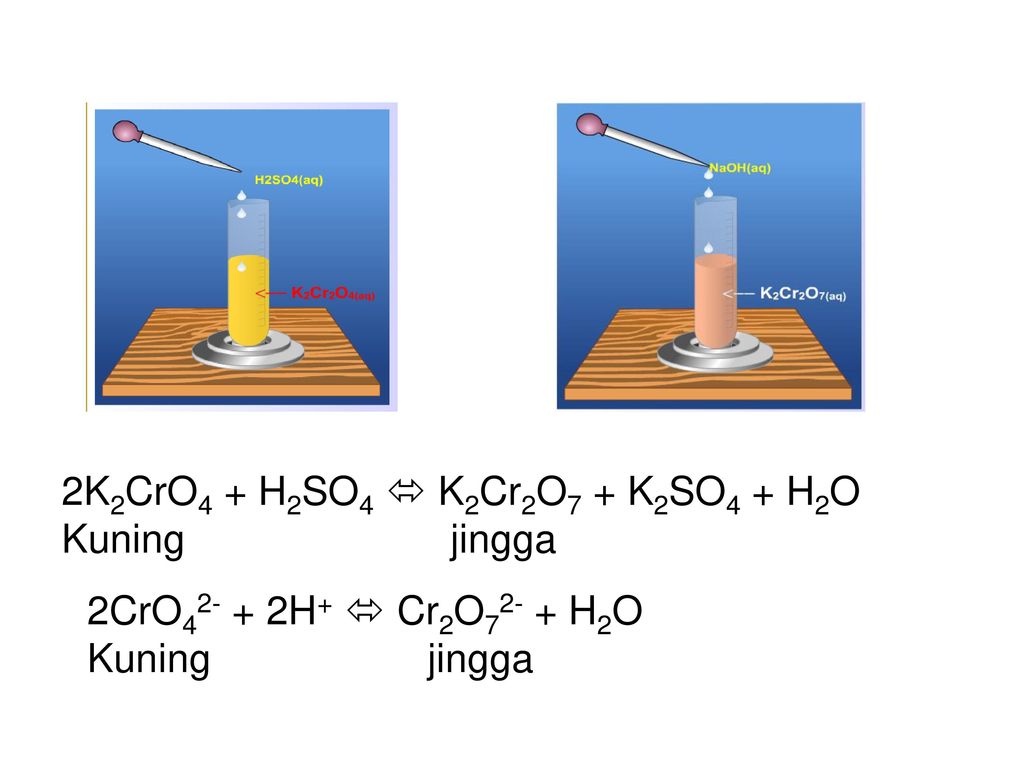 Что
случилось с только что образовавшимся осадком? Это второе равновесие выше:
при добавлении аммиака к раствору, содержащему ион Ag + , аммиак образует
комплекс с ионом Ag + и удаляет его из раствора. Что происходит с
осадок, если ион Ag + удалить из раствора аммиаком?
Что
случилось с только что образовавшимся осадком? Это второе равновесие выше:
при добавлении аммиака к раствору, содержащему ион Ag + , аммиак образует
комплекс с ионом Ag + и удаляет его из раствора. Что происходит с
осадок, если ион Ag + удалить из раствора аммиаком?
 с образованием раствора зеленого хромита Cr (OH) 4 — .
с образованием раствора зеленого хромита Cr (OH) 4 — . Ярко-синий цвет Cr 2+ (водный) будет виден на мгновение, но окисление на воздухе быстро преобразует его в зеленый цвет.
решение.
Ярко-синий цвет Cr 2+ (водный) будет виден на мгновение, но окисление на воздухе быстро преобразует его в зеленый цвет.
решение.