Химия — 8
1. Основные оксиды
2. Кислотные оксиды
3. Смешанные оксиды
a) SO3 b) Fe3O4
c) CuO d) AI2O3 e) CO2
1. Международное название оксида
2. Историческое, тривиальное название
а) оксид железа(III) b) угарный газ
с) оксид натрия d) веселящий газ
е) оксид цинка
1. В международном названии указывается валентность элемента, образующего оксид.
2. В международном названии валентность элемента, образующего оксид, не указывается.
a) CuO b) Al2O3 c) FeO d) MgO e) MnO
1. Амфотерный оксид
2. Основной оксид
3. Кислотный оксид
a) CuO b) ZnO c) NO2
d) Fe2O3 e) CaO f) BeO
1) монооксид азота 2) оксид железа(II) 3) монооксид углерода
4) оксид калия 5) оксид меди (II) 6) монооксид диазота
Оксиды
1. CU 2O
2. Cr2O3
3. P2O5
Вид оксида
a) основной оксид b) амфотерный оксид
c) кислотный оксид d) смешанный оксид

| Формула оксида |
Международное название оксида |
Тип оксида |
|---|---|---|
| NO | ||
| Оксид алюминия | ||
| Cr2O3 | ||
| Оксид меди (II) |
| Оксиды | Агрегатное состояние в нормальных условиях |
Тип оксида |
|---|---|---|
| XO2 | газ | кислотный оксид |
| YO | в твердом состоянии | амфотерный оксид |
| Z2O | в твердом состоянии | основной оксид |
1) C 2) Na 3) Zn
4) S 5) K 6) Be
| Оксиды | ω (X) в оксиде |
|---|---|
| XO | 80% |
a) 12C b) 64Cu c) 56Fe
d) 40Ca e) 65Zn
Химические свойства оксидов
Оксиды бывают:
- солеобразующие
- основные (Na2O, MgO),
- кислотные (SO3, CO2, Mn2O7),
- амфотерные (Al2O3, ZnO)
- несолеобразующие (NO, N2O, CO)
1. Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
Основные оксиды реагируют с кислотами, кислотными оксидами, водой (только оксиды активных металлов)
2. Кислотные оксиды реагируют с водой (кроме SiO2), щелочами, основными оксидами.
3. Амфотерные оксиды реагируют с кислотами, щелочами, кислоными оксидами, основными оксидами (при сплавлении)
4. Несолеобразующие оксиды — не реагируют ни с водой, ни с кислотами, ни со щелочами.
Давайте порассуждаем вместе
1. Какое из веществ взаимодействует с водой при комнатной температуре?
1) оксид кремния (IV)
2) оксид меди (II)
3) оксид серы (VI)
4) сера
Ответ: №3, т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
2. Какое из веществ не взаимодействует с соляной кислотой
1) оксид углерода (IV)
2) оксид кальция
3) нитрат серебра
4) кальций
Ответ: №1, т.
к. с кислотами не взаимодействует кислотный оксид CO2
3. Оксид кальция не взаимодействует с
1) оксидом углерода (IV)
2) гидроксидом натрия
3) водой
4) хлороводородом
Ответ: №2, т.к. основные оксиды не реагируют со щелочами.
4. Соляная кислота реагирует с каждым из оксидов
1) CaO и CO2
2) SO3 и SiO2
3) CO и NO
4) MgO и ZnO
Ответ: №4 с кислотами реагируют основные (MgO) и амфотерные оксиды (ZnO)
MgO + 2HCl = MgCl2 + H2O
ZnO + 2HCl = ZnCl2 + H
2O
5. Оксид магния реагирует с каждым из веществ
1) HCl и SO3
2) SO3 и NaOH
3) NaOH и H2О
4) H2SO4 и KCl
Ответ: №1, т.
к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
6. Оксид серы (IV) реагирует с
1) NaOH
2) NaCl
3) H2SO4
4) P2O5
Ответ: №1, т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
7. С водным раствором гидроксида калия реагируют
1) алюминий
2) медь
3) натрий
4) сульфат меди (II)
5) сульфат натрия
Ответ: 1, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
CuSO4 — растворимая соль, со щелочью дает осадок Cu(OH)2 синего цвета CuSO4 + 2KOH = Cu(OH)2 + K2SO4
8. С разбавленным водным раствором серной кислоты реагируют
С разбавленным водным раствором серной кислоты реагируют
1) алюминий
2) медь 3) оксид меди (II)
4) хлорид калия
5) хлорид бария
Ответ: 1, 3, 5, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
CuO — основный оксид, реагирует с кислотами CuO + H2SO4 = CuSO4 + H2O
BaCl2 — растворимая соль, дает с серной кислотой белый осадок сульфата бария BaCl2 + H2SO4 = 2HCl + BaSO4
9. С водными растворами каких веществ реагирует углекислый газ
1) хлорид натрия
2) карбонат натрия
3) гидроксид кальция
4) соляная кислота
5) гидроксид натрия
Ответ: 2, 3, 5, т.
к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3
Ca(OH)2 и NaOH — щелочи реагируют с кислотными оксидами Ca(OH)2 + CO2 = CaCO3 + H2O ; 2NaOH + CO2 = Na2CO3 + H2O
10. С водным раствором гидроксида натрия реагируют
1) алюминий
2) хлор
3) оксид железа (II)
4) оксид серы (IV)
5) серебро
Ответ: 1, 2, 4, т.к. Al — амфотерный металл, он реагирует и с кислотами и с растворами щелочей 2Al + 2NaOH + 6H
2O = 2Na[Al(OH)4] + 3H2 Cl2 — активный неметалл — галоген реагирует со щелочью и на холоду и при нагревании
Cl2 + 2NaOH = NaCl + NaClO + h3O (холод)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (нагрев)
SO2 — кислотный оксид реагирует со щелочью SO2 + 2NaOH = Na2SO3 + H2O
11. С водным раствором азотной кислоты реагируют
С водным раствором азотной кислоты реагируют
1) медь
2) углекислый газ
3) оксид магния
4) серная кислота
5) оксид алюминия
Ответ: 1,3, 5, т.к. азотная кислота сильный окислитель, она реагирует даже с металлами, стоящими после водорода, выделяя оксиды азота
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
MgO и Al2O3 — основный и амфотерный оксиды соответственно, они реагируют с кислотами с образованием соли и воды
MgO + 2HNO3 = Mg(NO3)2 + H2O
Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O
12. Оксид железа (II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Ответ: №2, т.
к. основные оксиды реагируют с кислотами
FeO + 2HBr = FeBr2 = H2O
Оксиды
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N20, NO.
Солеобразующие оксиды:
Основные. Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi2O3 — оксид висмута (III), Mn2O3 — оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2O3 — оксид алюминия, Cr2O3 — оксид хрома (III), SnO2 — оксид олова (IV), МnO2 — оксид марганца (IV), ZnO — оксид цинка, ВеО — оксид бериллия.
Кислотные.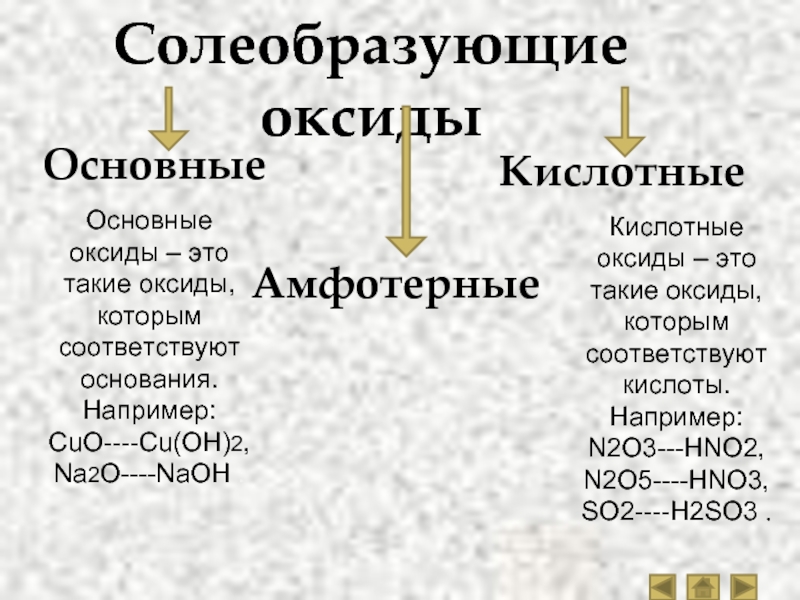 Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р2О3 — оксид фосфора (III), СO2 — оксид углерода (IV), N2O5 — оксид азота (V), SO3 — оксид серы (VI), Cl2O7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).
Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р2О3 — оксид фосфора (III), СO2 — оксид углерода (IV), N2O5 — оксид азота (V), SO3 — оксид серы (VI), Cl2O7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).
Изменение характера оксидов | Cr+2O (осн.) | Cr+32O 3(амф.) | Cr+6O 3(кисл.) |
Mn+2O (осн.) | Mn+4O2 (амф.) | Mn+6O3 (кисл. | |
Mn+32O3 (осн.) | Mn+72O 7 (кисл.) |
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета — твердые вещества. Оксид серы (VI) SO3 — бесцветная летучая жидкость, а оксид углерода (IV) СО2 — бесцветный газ при обычных условиях.
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
в) SiO2
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
Пример:
(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
2. Окислительно — восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. — окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C+2O + O2 = 2C+4O2
2S+4O2 + O2 = 2S+6O3
2N+2O + O2 = 2N+4O2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C+2O + FeO = Fe + 2C+4O2
C+2O + H2O = H2 + 2C+4O2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C+4O2 + C = 2C+2O
2S+6O3 + H2S = 4S+4O2 + H2O
C+4O2 + Mg = C0 + 2MgO
Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
Cu+2O + H2 = Cu0 + H2O
Использование оксидов малоактивных металлов дпя окисления органических веществ.
Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
1. Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
4Li + O2 = 2Li2O;
2Cu + O2 = 2CuO;
S + O2 = SO2
4P + 5O2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
H2SO3 = SO2↑ + H2O
H2SiO3 = SiO2 + H2O
3. Разложение некоторых солей:
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CaCO3 = CaO + CO2↑
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
4. Окисление сложных веществ кислородом:
CH4 + 2O2 = CO2 + H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4NH3 + 5O2 = 4NO + 6H2O
5. Восстановление кислот-окислителей металлами и неметаллами:
Восстановление кислот-окислителей металлами и неметаллами:
Cu + H2SO4 (конц) = CuSO4 + SO2↑ + 2H2O
10HNO3 (конц) + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
2HNO3 (разб) + S = H2SO4 + 2NO↑
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Подборка полезной теории по химии
Химия — предмет, который сдают будущие медики, биологи и технологи. Многие считают его непонятным, но если разобраться в основах, писать реакции и решать задачи будет несложно. Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Соли
Соли — первая часть теории по химии для подготовки к ЕГЭ. Способы получения солей:
Способы получения солей:
- кислотный оксид + основный оксид: SO3 + Na2O → Na2SO4;
- основание + кислота: HCl + NaOH → NaCl + h3O;
- кислота + основный или амфотерный оксид: 2HCl + CuO → CuCl2 + h3O;
- основание + кислотный оксид: CO2 + Cu(OH)2 → CuCO2 + 2h3O;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: 2Na2SO3 + O2 → 2Na2SO4;
- металл + неметалл: Ca + S → CaS;
- металл + кислота: Fe + 2HCl → FeCl2 + h3.
Следующая часть теории по химии по солям — химические свойства:
- диссоциация: CaCl2 → Ca2+ + 2Cl–;
- с кислотными и амфотерными оксидами: K2CO3 + SiO2 → K2SiO3 + CO2↑;
- c кислотами: KCl + h3SO4 → K2SO4 + HCl;
- с щелочами: CuSO4 + 2KOH → Cu(OH)2 + K2SO4;
- с солями: CuSO4 + BaCl2 → BaSO4↓+ CuCl2;
- с металлами, более активными чем металл соли: CuSO4 + Fe → FeSO4 + Cu;
- разложение: 2AgNO3 → 2Ag +2NO2 + O2;
- окисление: 2KI— + 2Cu+2Cl2 → 2KCl + 2Cu+Cl + I20.

Кислоты
Первая часть теории по кислотам в химии — способы получения:
- кислотный оксид + вода: SO3 + h3O → h3SO4;
- неметалл + водород: h3 + Cl2 → 2HCl;
- электролиз солей: 2CuSO4 + 2h3O → 2Cu + 2h3SO4 + O2;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: P + 5HNO3 → h4PO4 + 5NO2 + h3O.
Вторая часть теории по кислотам — химические свойства:
- диссоциация: HCl → H+ + Cl–;
- с основаниями и амфотерными гидроксидами: Cu(OH)2 + 2HBr → CuBr2 + 2h3O;
- с основными и амфотерными оксидами: CuO + 2HBr → CuBr2 + h3O;
- окисление: 2HI— + 2Cu+2Cl2 → 2HCl + 2Cu+Cl + I20;
- с солями: CaCO3 + 2HCl → CaCl2 + h3O + CO2;
- с металлами, стоящими в ряду активности до водорода: Fe + 2HCl → FeCl2 + h3;
- разложение при нагревании: 2HNO2 → NO + h3O + NO2.
Основания
Теория по химии по основаниям включает в себя способы получения:
- основные оксиды + вода: Na2O + h3O → 2NaOH;
- металл + вода: 2K + 2h3O → 2KOH + h3;
- электролиз некоторых солей щелочных металлов: 2NaCl + 2h3O → 2NaOH + h3↑ + Cl2↑;
- щелочь + соль: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.

Далее разберем теорию по химическим свойствам оснований. Первая реакция относится ко всем типам, остальные — только к щелочам:
- с кислотами: NaOH + h4PO4 → Nah3PO4 + h3O;
- с амфотерными оксидами и гидроксидами в расплаве: NaOH + Al(OH)3 → NaAlO2 + 2h3O. И в растворе: NaOH + Al(OH)3 → Na[Al(OH)4];
- с кислотными оксидами: 2NaOH + CO2 → Na2CO3 + h3O;
- с солями: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
- с металлами: 2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3;
- с неметаллами: 2NaOH +Cl2 → NaCl + NaClO + h3O.
Оксиды
Теорию по химии по оксидам мы начнем изучать со способов получения:
- окисление металлов: 4Al + 3O2 → 2Al2O3;
- окисление неметаллов: S + O2 → SO2;
- окисление бинарных соединений: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
- разложение гидроксидов: h3SO3 → h3O + SO2;
- разложение солей при нагревании: Li2CO3 → CO2 + Li2O.
Теорию по химическим свойствам разных типов оксидов представим в таблице:
|
Основные |
Амфотерные |
Кислотные |
|
Al2O3 + 6HCl → 2AlCl3 + 3H2O |
Na2O + SO2 → Na2SO3 |
SO3 + H2O → H2SO4 |
|
CaO + H2O → Ca(OH)2 |
Al2O3 + 2NaOH → 2NaAlO2 + H2O ZnO + 2NaOH + H2O → Na2[Zn(OH)4] |
3SO3 + Al2O3 → Al2(SO4)3 |
|
K2O + Al2O3 → 2KAlO2 |
Al2O3 + Na2O → 2NaAlO2 |
SO3 + CuO → CuSO4 |
|
CaO + 3C → CaC2 + CO |
Na2CO3 + Al2O3 → 2NaAlO2 + CO2 |
CaCO3 + SiO2 → CaSiO3 + CO2 |
|
3ZnO + 2Al → Al2O3 + 3Zn |
2SO2 + O2 → 2SO3 | |
|
4FeO + O2 → 2Fe2O3 |
Электролиз растворов солей
Следующий важный раздел — теория электролиза по химии. Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
- если металл активный (до Al включительно в ряду напряжения), то восстанавливается водород, образуется щелочная среда: 2h3O + 2ē → h3 + 2OH—;
- если металл средней активности (от Al до h3), то восстанавливаются и водород, и металл: Fe2+ + 2ē → Fe0 и 2H+2O +2ē → h30 + 2OH—;
- если металл неактивный (после водорода), то восстанавливается только он: Cu2+ + 2ē → Cu0.
Анодные процессы при электролизе:
- кислотный остаток, не содержащий кислорода: 2Cl— – 2ē → Cl20;
- в случае кислотного остатка, содержащего кислород, или иона F— окисляется вода: 2h3O-2 – 4ē → O20 + 4H+;
- окисление гидроксид-иона: 4O-2H– – 4ē → O20 + 2h3O;
- в случае с остатком карбоновой кислоты окислению подвергается углерод: 2Ch4C+3OO– –2ē → 2C+4O2+ Ch4-Ch4.

Пример написания суммарной реакции электролиза:
- 2Cu2+SO4 + 2h3O-2 → 2Cu0 + 2h3SO4 + O20
- Катод (–): 2H+2O +2ē → h30 + 2OH–
- Анод (+): 2Cl– – 2ē → Cl20
Гидролиз солей
Последняя тема по химии — гидролиз солей, то есть реакция с водой. Он идет в тех случаях, когда ионы соли способны образовать с ионами H+ и OH— (они получаются при диссоциации воды) малорастворимые электролиты. Из этого следует, что соли, образованные сильным основанием и сильной кислотой (например, NaCl), не гидролизуются. Существуют необратимые реакции, но они в школьном курсе не рассматриваются. Как правило, они связаны с взаимным гидролизом нескольких солей. Рассмотрим теорию по обратимому гидролизу для ЕГЭ по химии. В этом случае гидролиз идет по слабому месту. Если это кислота, то по аниону, а если основание — по катиону. В случае, когда обе части соли являются «слабыми», гидролиз идет и по катион
- соль образована сильным основанием и слабой кислотой.
 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH; - соль образована слабым основанием и сильной кислотой. Реакция идет по катиону: Nh5Cl + HOH ↔ Nh5OH + HCl;
- соль образована слабым основанием и слабой кислотой. Гидролиз идет и по аниону, и по катиону, среда ближе к нейтральной: Ch4COONh5 + HOH ↔ Ch4COOH + Nh5OH.
Мы разобрали основные классы неорганических соединений, а также гидролиз и электролиз в химии. Надеемся, что эта шпаргалка поможет вам подготовиться и сдать ЕГЭ. Но не забывайте о важности фундаментальных знаний, которые можно получить в школе или на курсах. Мы уверены, что у вас все получится, и вы обязательно поступите в вуз мечты.
Способы получения и применения оксидов. Способы получения оксидов
Оксиды.
Это – сложные вещества состоящие из ДВУХ элементов, один из которых кислород. Например:
CuO– оксид меди(II)
AI 2 O 3 – оксид алюминия
SO 3 – оксид серы (VI)
Оксиды делятся (их классифицируют) на 4 группы:
Na 2 O– Оксид натрия
СаО – Оксид кальция
Fe 2 O 3 – оксид железа (III)
2). Кислотные – Это оксидынеметаллов .
А иногда и металлов если степень окисления
металла > 4. Например:
Кислотные – Это оксидынеметаллов .
А иногда и металлов если степень окисления
металла > 4. Например:
СО 2 – Оксид углерода (IV)
Р 2 О 5 – Оксид фосфора (V)
SO 3 – Оксид серы (VI)
3). Амфотерные – Это оксиды которые имеют свойства, как основных так и кислотных оксидов. Необходимо знать пять наиболее часто встречающихся амфотерных оксидов:
BeO–оксид бериллия
ZnO– Оксид цинка
AI 2 O 3 – Оксид алюминия
Cr 2 O 3 – Оксид хрома (III)
Fe 2 O 3 – Оксид железа (III)
4). Несолеобразующие (безразличные) – Это оксиды которые не проявляют свойств ни основных, ни кислотных оксидов. Необходимо запомнить три оксида:
СО – оксид углерода (II) угарный газ
NO– оксид азота (II)
N 2 O– оксид азота (I) веселящий газ, закись азота
Способы получения оксидов.
1). Горение, т.е. взаимодействие с кислородом простого вещества:
4Na + O 2 = 2Na 2 O
4P + 5O 2 = 2P 2 O 5
2). Горение, т. е.
взаимодействие с кислородом сложного
вещества (состоящего из двух
элементов )
при этом образуются два
оксида.
е.
взаимодействие с кислородом сложного
вещества (состоящего из двух
элементов )
при этом образуются два
оксида.
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
3). Разложение трех слабых кислот. Другие не разлагаются. При этом образуются – кислотный оксид и вода.
Н 2 СО 3 = Н 2 О + СО 2
Н 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
4). Разложение нерастворимых оснований. Образуются основный оксид и вода.
Mg(OH) 2 = MgO + H 2 O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
5). Разложение нерастворимых солей. Образуются основный оксид и кислотный оксид.
СаСО 3 = СаО + СО 2
МgSO 3 = MgO + SO 2
Химические свойства.
I . Основных оксидов.
щелочь.
Na 2 O + H 2 O = 2NaOH
CaO + H 2 O = Ca(OH) 2
СuO + H 2 O = реакция не протекает, т.к. возможное основание в состав которого входит медь — нерастворимо
2). Взаимодействие
с кислотами, при этом образуется соль
и вода. (Основный оксид и кислоты реагируют
ВСЕГДА)
(Основный оксид и кислоты реагируют
ВСЕГДА)
К 2 О + 2НСI = 2KCl + H 2 O
CaO + 2HNO 3 = Ca(NO 3) 2 + H 2 O
3). Взаимодействие с кислотными оксидами, при этом образуется соль.
Li 2 O + CO 2 = Li 2 CO 3
3MgO + P 2 O 5 = Mg 3 (PO 4) 2
4). Взаимодействие с водородом, при этом образуется металл и вода.
CuO + H 2 = Cu + H 2 O
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
II. Кислотных оксидов.
1). Взаимодействие с водой, при этом должна образоваться кислота. (Только SiO 2 не взаимодействует с водой)
CO 2 + H 2 O = H 2 CO 3
P 2 O 5 + 3H 2 O = 2H 3 PO 4
2). Взаимодействие с растворимыми основаниями (щелочами). При этом образуется соль и вода.
SO 3 + 2KOH = K 2 SO 4 + H 2 O
N 2 O 5 + 2KOH = 2KNO 3 + H 2 O
3). Взаимодействие с основными оксидами. При этом образуется только соль.
N 2 O 5 + K 2 O = 2KNO 3
Al 2 O 3 + 3SO 3 = Al 2 (SO 4) 3
Основные
упражнения.
1). Закончить уравнение реакции. Определить её тип.
К 2 О + Р 2 О 5 =
Решение.
Что бы записать, что образуется в результате – необходимо определить – какие вещества вступили в реакцию – здесь это оксид калия (основный) и оксид фосфора (кислотный) согласно свойств – в результате должна получиться СОЛЬ (смотри свойство № 3) а соль состоит из атомов металлов (в нашем случае калия) и кислотного остатка в состав которого входит фосфор (т.е. РО 4 -3 – фосфат) Поэтому
3К 2 О + Р 2 О 5 = 2К 3 РО 4
тип реакции – соединение (так как вступают в реакцию два вещества, а образуется – одно)
2). Осуществить превращения (цепочка).
Са → СаО → Са(ОН) 2 → СаСО 3 → СаО
Решение
Для выполнения
этого упражнения необходимо помнить,
что каждая стрелочка это одно уравнение
(одна химическая реакция). Пронумеруем
каждую стрелочку. Следовательно,
необходимо записать 4 уравнения. Вещество
записанное слева от стрелочки(исходное
вещество) вступает в реакцию, а вещество
записанное справа – образуется в
результате реакции(продукт реакции).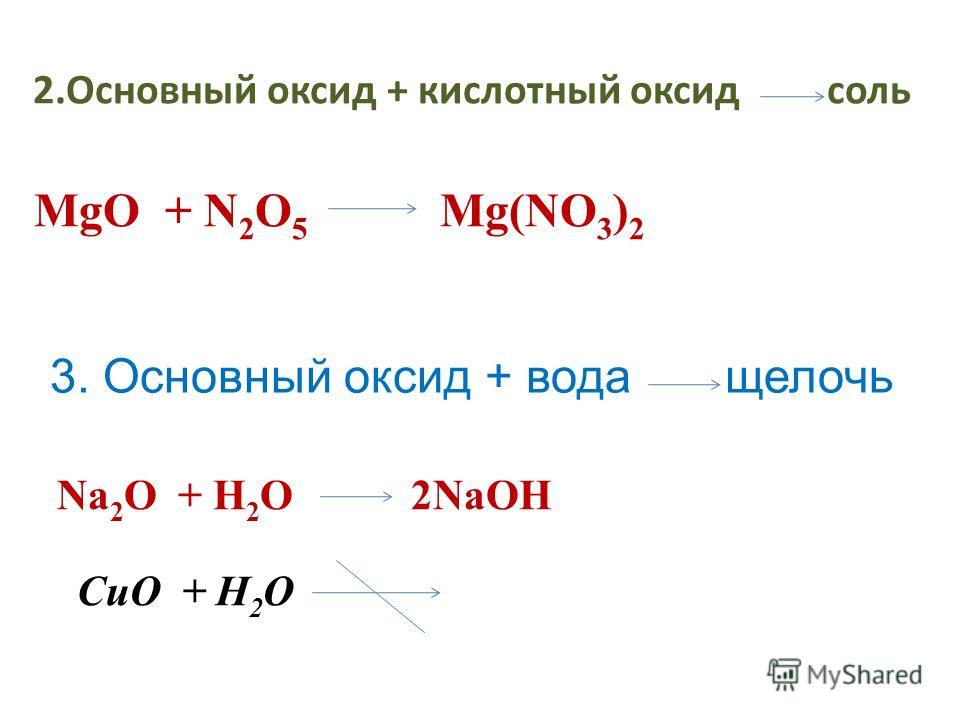 Расшифруем первую часть записи:
Расшифруем первую часть записи:
Са + …..→ СаО Мы обращаем внимание, что вступает в реакцию простое вещество, а образуется оксид. Зная способы получения оксидов (№ 1) приходим к выводу, что в данной реакции необходимо добавить –кислород (О 2)
2Са + О 2 → 2СаО
Переходим к превращению № 2
СаО → Са(ОН) 2
СаО + ……→ Са(ОН) 2
Приходим к выводу, что здесь необходимо применить свойство основных оксидов – взаимодействие с водой, т.к. только в этом случае из оксида образуется основание.
СаО + Н 2 О → Са(ОН) 2
Переходим к превращению № 3
Са(ОН) 2 → СаСО 3
Сa(OH) 2 + ….. = CaCO 3 + …….
Приходим к выводу, что здесь речь идет об углекислом газе СО 2 т.к. только он при взаимодействии со щелочами образует соль (смотри свойство № 2 кислотных оксидов)
Сa(OH) 2 + СО 2 = CaCO 3 + Н 2 О
Переходим к превращению № 4
СаСО 3 → СаО
СаСО 3 = ….. СаО + ……
Приходим к выводу
что здесь образуется еще СО 2
, т.к. СаСО 3
нерастворимая соль и именно при
разложении таких веществ образуются
оксиды.
СаСО 3 = СаО + СО 2
3). С какими из перечисленных веществ взаимодействует СО 2 . Напишите уравнения реакций.
А). Соляная кислота Б). Гидроксид натрия В). Оксид калия г). Вода
Д). Водород Е). Оксид серы (IV).
Определяем, что СО 2 – это кислотный оксид. А кислотные оксиды вступают в реакции с водой, щелочами и основными оксидами … Следовательно из приведенного списка выбираем ответы Б, В, Г И именно с ними записываем уравнения реакций:
1). СО 2 + 2NaOH = Na 2 CO 3 + H 2 O
2). CO 2 + K 2 O = K 2 CO 3
В уроке 33 «» из курса «Химия для чайников » узнаем как получать оксиды различными способами, а также познакомимся с широким спектром применения оксидов во всех отраслях промышленности и быта.
Получение оксидов
1. Взаимодействие простых веществ с кислородом
Некоторые оксиды образуются в результате сжигания в кислороде (или на воздухе) соответствующих простых веществ. Так можно получить оксиды углерода(IV), серы(IV), фосфора(V), магния и других неметаллов и металлов:
2. Взаимодействие сложных веществ с кислородом
Взаимодействие сложных веществ с кислородом
Оксиды можно получать также сжиганием в кислороде (или на воздухе) некоторых сложных веществ, например:
3. Термическое разложение нерастворимых оснований
Применение оксидов
Один из наиболее широко использующихся оксидов — вода H 2 O, о применении которой в быту, технике и ромышленности вы уже знаете.
Разнообразное применение находят и некоторые другие оксиды. Так, например, из оксида железа(III) Fe 2 O 3 , входящего в состав железных руд, в промышленности получают железо, а из оксида алюминия Al 2 O 3 — алюминий. Оксид алюминия применяют также для изготовления искусственных драгоценных камней — рубина и сапфира. Мелкие кристаллы этого оксида применяются также в производстве наждачной бумаги.
Оксид углерода(IV) (углекислый газ) используют в пищевой промышленности для изготовления всех газированных напитков, для увеличения срока сохранности фруктов и овощей. Этим веществом наполняют углекислотные огнетушители. Твердый оксид углерода(IV) под названием «сухой лед» (рис. 117) применяют для хранения мороженого, для сильного охлаждения различных материалов.
Твердый оксид углерода(IV) под названием «сухой лед» (рис. 117) применяют для хранения мороженого, для сильного охлаждения различных материалов.
Достаточно широко используется и оксид серы(IV) SO 2 (сернистый газ). Он находит применение в производстве серной кислоты, для дезинфекции складских помещений, уничтожения вредных насекомых и бактерий, отбеливания бумаги.
Оксид кремния(IV) SiO 2 в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца(II) PbO он применяется для изготовления полудрагоценных камней и украшений («кристаллы Сваровски»).
Оксид кальция СaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок. Так, например, Fe 2 O 3 используют для изготовления краски коричневого, Сr 2 O 3 — зеленого, ZnO и TiO 2 — белого цветов.
Краткие выводы урока:
- Оксиды образуются при взаимодействии кислорода с простыми и сложными веществами.

- Оксиды можно получить термическим разложением нерастворимых оснований.
- Оксиды находят широкое практическое применение в промышленности и в быту.
- Оксиды — вода H 2 O и углекислый газ СО 2 — участвуют в процессе фотосинтеза.
Надеюсь урок 33 «Получение и применение оксидов » был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl 2 + H 2 O.
В результате химических реакций можно получать и другие соли:
CuO + SO 3 → CuSO 4 .
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N 2 O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова « основание» ), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na 2 O, K 2 O, MgO, CaO и т.д.
К основным оксидам относятся, например, Na 2 O, K 2 O, MgO, CaO и т.д.
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na 2 O + H 2 O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na 2 O + SO 3 → Na 2 SO 4 .
3. Реагируют с кислотами, образуя соль и воду:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Реагируют с амфотерными оксидами:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO 2 , SO 3 , P 2 O 5 , N 2 O 3 , Cl 2 O 5 , Mn 2 O 7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
Взаимодействуют с водой, образуя кислоту:
SO 3 + H 2 O → H 2 SO 4 .
Но не все кислотные оксиды непосредственно реагируют с водой (SiO 2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO 2 + CaO → CaCO 3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO 2 + Ba(OH) 2 → BaCO 3 + H 2 O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH) 2 и H 2 ZnO 2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl 2 + H 2 O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H 2 O => Na 2 .
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле . Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
1. Окисление простых веществ кислородом (сжигание простых веществ):
2Mg + O 2 = 2МgО
4Р + 5O 2 = 2Р 2 О 5 .
Метод не применим для получения оксидов щелочных металлов, т.к. при окислении щелочные металлы обычно дают не оксиды, а пероксиды (Na 2 O 2 , K 2 O 2) .
Не окисляются кислородом воздуха благородные металлы, напрмер, Аu, Аg, Рt.
2. Окисление сложных веществ (солей некоторых кислот и водородных соединений неметаллов):
2ZnS + 3O 2 = 2ZnO + 2SO 2
2Н 2 S + 3O 2 = 2SO 2 + 2Н 2 О
3. Разложение при нагревании гидроксидов (оснований и кислородсодержащих кислот):
Сu(ОН) 2 СuО + Н 2 О
H 2 SO 3 SO 2 + H 2 O
Нельзя пользоваться этим методом для получения оксидов щелочных металлов, так как разложение щелочей происходит при слишком высоких температурах.
4. Разложение некоторых солей кислородсодержащих кислот:
СаСО 3 СаО + СО 2
2Рb(NO 3) 2 2РbО + 4NO 2 + O 2
Следует иметь в виду, что соли щелочных металлов не разлагаются при нагревании с образованием оксидов.
1.1.7. Области применения оксидов.
Ряд природных минералов представляют собой оксиды (см. табл.7) и используются как рудное сырье для получения соответствующих металлов.
табл.7) и используются как рудное сырье для получения соответствующих металлов.
Например:
Боксит А1 2 O 3 · nH 2 O.
Гематит Fe 2 O 3 .
Магнетит FеО · Fe 2 O 3 .
Касситерит SnO 2 .
Пиролюзит МnO 2 .
Рутил ТiО 2 .
Минерал корунд (А1 2 O 3) обладающий большой твердостью, используют как абразивный материал. Его прозрачные, окрашенные в красный и синий цвет кристаллы представляют собой драгоценные камни – рубин и сапфир.
Негашеная известь (CaO) , получаемая обжигом известняка (СаСО 3) , находит широкое применение в строительстве, сельском хозяйстве и как реагент для буровых растворов.
Оксиды железа (Fе 2 О 3 , Fе 3 О 4) используются при бурении нефтяных и газовых скважин в качестве утяжелителей и реагентов-нейтрализаторов сероводорода.
Оксид кремния (IV) (SiO 2) в виде кварцевого песка широко используется для производства стекла, цемента и эмалей, для пескоструйной обработки поверхности металлов, для гидропескоструйной перфорации и при гидроразрыве в нефтяных и газовых скважинах. В виде мельчайших сферических частиц (аэрозоля) находит применение в качестве эффективного пеногасителя буровых растворов и наполнителя при производстве резинотехнических изделий (белая резина).
В виде мельчайших сферических частиц (аэрозоля) находит применение в качестве эффективного пеногасителя буровых растворов и наполнителя при производстве резинотехнических изделий (белая резина).
Ряд оксидов (А1 2 O 3 ,Cr 2 O 3 , V 2 O 5 , СuО, NО) используются в качестве катализаторов в современных химических производствах.
Являющийся одним из главных продуктов сгорания угля, нефти и нефтепродуктов углекислый газ (СО 2) при закачке в продуктивные пласты способствует повышению их нефтеотдачи. Используется СО 2 также для заполнения огнетушителей и газирования напитков.
Образующиеся при нарушении режимов сгорания топлива (NO, СО) или при сгорании сернистого топлива (SO 2) оксиды являются продуктами загрязняющими атмосферу. Современное производство, а также транспорт предусматривают строгий контроль за содержанием таких оксидов и их нейтрализацию,
Оксиды азота (NO, NO 2) и серы (SO 2 , SO 3) являются промежуточными продуктами в крупнотоннажных производствах азотной (НNO 3) и серной (Н 2 SО 4) кислот.
Оксиды хрома (Сг 2 O 3) и свинца (2РbО · РbО 2 – сурик) используются для производства антикоррозионных красочных составов.
Вопросы для самоконтроля по теме оксиды
1. На какие основные классы подразделяются все неорганические соединения?
2. Что такое оксиды?
3. Какие типы оксидов Вам известны?
4. Какие оксиды относятся к несолеобразующим (безразличным)?
5. Дайте определения: а) основной оксид, б) кислотный оксид,
в) амфотерный оксид.
6. Какие элементы образуют основные оксиды?
7. Какие элементы образуют кислотные оксиды?
8. Напишите формулы некоторых амфотерных оксидов.
9. Как составляются названия оксидов оксиды?
10. Назовите следующие оксиды: Cu 2 O, FeO, Al 2 O 3 , Mn 2 O 7 , SO 2 .
11. Изобразите формулы следующих оксидов графически: а) оксид натрия, б) оксид кальция, в) оксид алюминия, г) оксид серы (1V), д) оксид марганца (VII) . Укажите их характер.
Укажите их характер.
12. Напишите формулы высших оксидов элементов II и III периодов. Назовите их. Как изменяется химический характер оксидов II и III периодов?
13. Каковы химические свойства а) основных оксидов, б) кислотных оксидов, г) амфотерных оксидов?
14. Какие оксиды реагируют с водой? Приведите примеры.
15. Докажите амфотерность следующих оксидов: а) оксид бериллия, б) оксид цинка, в) оксид олова (IV).
16. Какие способы получения оксидов Вам известны?
17. Напишите уравнения реакций получения всеми известными Вам способами следующих оксидов: а) оксид цинка, б) оксид меди (II), в) оксид кремния (1V).
18. Назовите некоторые из областей применения оксидов.
1.2. Основания
Оcнованиями называются химические вещества, распадающиеся (диссоциирующие) в водном растворе (или в расплаве) на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила (определение Аррениуса):
гидроксид натрия катион натрия гидроксид-ион
Основаниями являются сложные вещества, образующиеся при гидратации основных оксидов.
Например:
Na 2 O + H 2 O = NaOH – гидроксид натрия
BaO + H 2 O = Ва(ОН) 2 – гидроксид бария
Вещества, составляющие основу нашего физического мира, состоят из разных видов химических элементов. Четыре из них встречаются чаще всех остальных. Это водород, углерод, азот и кислород. Последний элемент может связываться с частицами металлов или неметаллов и образовывать бинарные соединения — окислы. В нашей статье мы изучим наиболее важные способы получения оксидов в лабораторных условиях и промышленности. Также рассмотрим их основные физические и химические свойства.
Агрегатное состояние
Оксиды, или окислы, существуют в трех состояниях: газообразном, жидком и твердом. Например, к первой группе относятся такие известные и широко распространенные в природе соединения, как углекислый газ — CO 2 , угарный газ — CO, двуокись серы — SO 2 и другие. В жидкой фазе существуют такие окислы, как вода — H 2 O, серный ангидрид — SO 3 , оксид азота — N 2 O 3 .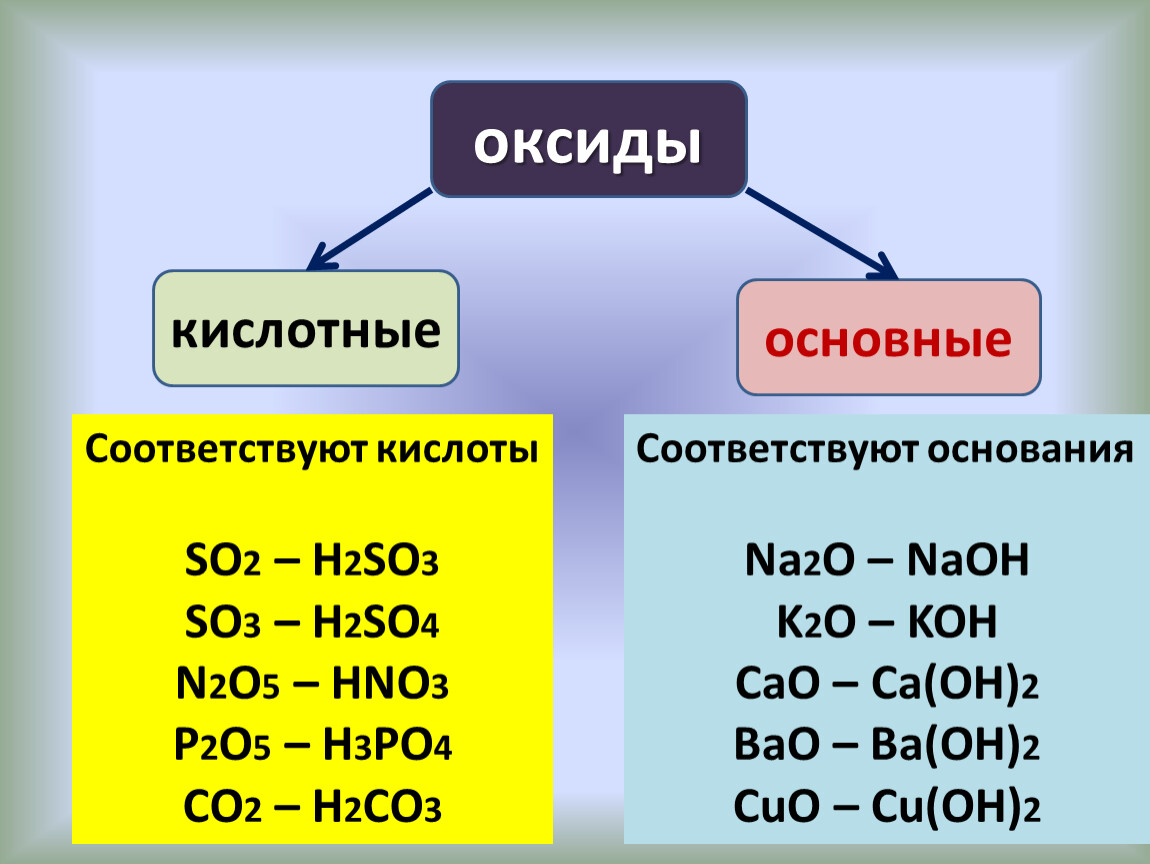 Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Классификация окислов
Можно выделить несколько видов кислородсодержащих веществ, состоящих из двух элементов. Химические свойства и способы получения оксидов будут зависеть от того, к какой из перечисленных групп относится вещество. углерода, получают прямым соединением углерода с кислородом, проводя реакцию жесткого окисления. Углекислый газ можно выделить и в процессе обмена и сильных неорганических кислот:
HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
Какая же реакция является визитной карточкой кислотных оксидов? Это их взаимодействие со щелочами:
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
Амфотерные и несолеобразующие окислы
Безразличные окислы, например CO или N 2 O, не способны к реакциям, ведущим к появлению солей. С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
Получение оксидов серы
В своих соединениях с кислородом сера проявляет различную валентность. Так, в сернистом газе, формула которого SO 2 , она четырехвалентна. В лаборатории диоксид серы получают в реакции между сульфатной кислотой и гидросульфитом натрия, уравнение которой имеет вид
NaHSO 3 + H 2 SO 4 → NaHSO 4 + SO 2 + H 2 O
Еще один способ добычи SO 2 — это окислительно-восстановительный процесс между медью и сульфатной кислотой высокой концентрации. Третий лабораторный метод получения оксидов серы — сжигание под вытяжкой образца простого вещества серы:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
В промышленности диоксид серы можно добыть выжиганием серосодержащих минералов цинка или свинца, а также обжигом пирита FeS 2 . Полученный таким методом сернистый газ используют для добычи трехокиси серы SO 3 и далее — сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H 2 SO 3:
Полученный таким методом сернистый газ используют для добычи трехокиси серы SO 3 и далее — сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H 2 SO 3:
SO 2 + H 2 O = H 2 SO 3
Данная реакция является обратимой. Степень диссоциации кислоты невелика, поэтому соединение относят к слабым электролитам, да и сама сернистая кислота может существовать только в водном растворе. В нем всегда присутствуют молекулы сернистого ангидрида, которые придают веществу резкий запах. Раагирующая смесь находится в состоянии равенства концентрации реагентов и продуктов, которое можно сместить, изменяя условия. Так, при добавлении к раствору щелочи реакция будет проходить слева направо. В случае выведения из сферы реакции сернистого ангидрида нагреванием или продуванием через смесь газообразного азота динамическое равновесие будет смещаться влево.
Серный ангидрид
Продолжим рассматривать свойства и способы получения оксидов серы.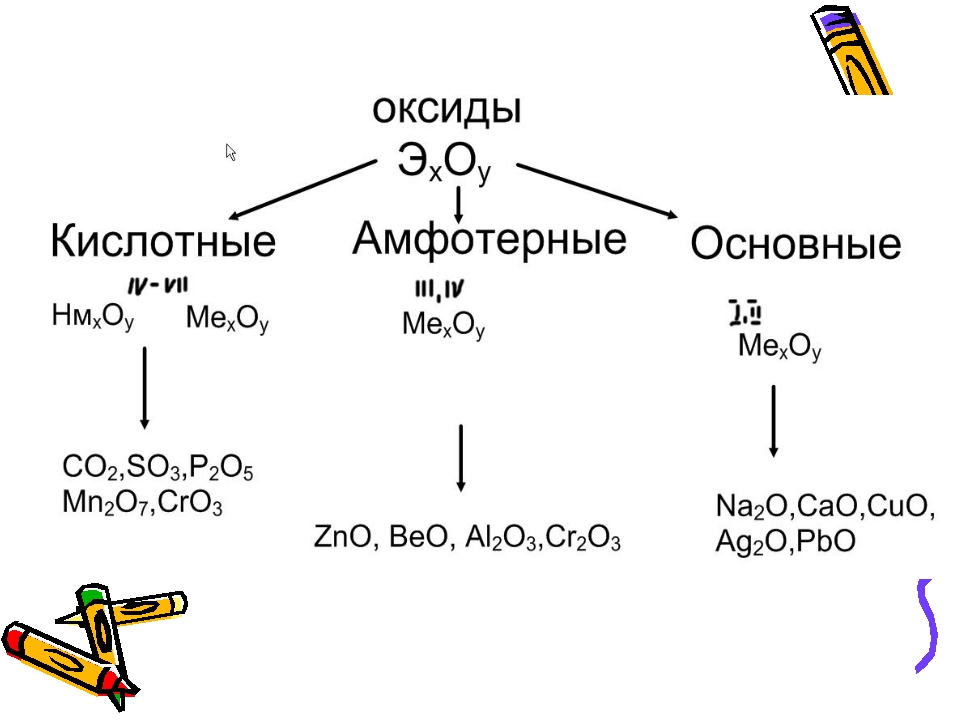 Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H 2 SO 4 добывают, растворяя серный ангидрид в концентрированной В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H 2 SO 4 добывают, растворяя серный ангидрид в концентрированной В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Основные окислы
Изучив свойства и получение оксидов серы, относящихся к группе кислотных бинарных соединений с кислородом, рассмотрим кислородные соединения металлических элементов.
Основные окислы можно определить по такому признаку, как наличие в составе молекул частиц металлов главных подгрупп первой или второй групп периодической системы. Они относятся к щелочным или щелочноземельным. Например, окись натрия — Na 2 O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды — щелочи. Однако главное химическое свойство основных оксидов — это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
Они относятся к щелочным или щелочноземельным. Например, окись натрия — Na 2 O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды — щелочи. Однако главное химическое свойство основных оксидов — это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
CuO + 2HCl = CuCl 2 + H 2 O
Нагревание твердых нерастворимых гидроксидов — еще один важных способов получения основных оксидов:
Ca(OH) 2 → CaO + H 2 O
Условия: 520-580 °C.
В нашей статье мы рассмотрели наиболее важные свойства бинарных соединений с кислородом, а также способы получения оксидов в лаборатории и промышленности.
Рекомендуем также
Оксид меди II представляет собой A Слабая кислота B Слабое основание C Сильный химический класс 11 CBSE
Подсказка: Как мы знаем, существует 3 типа соединений или веществ: кислотные, основные и нейтральные.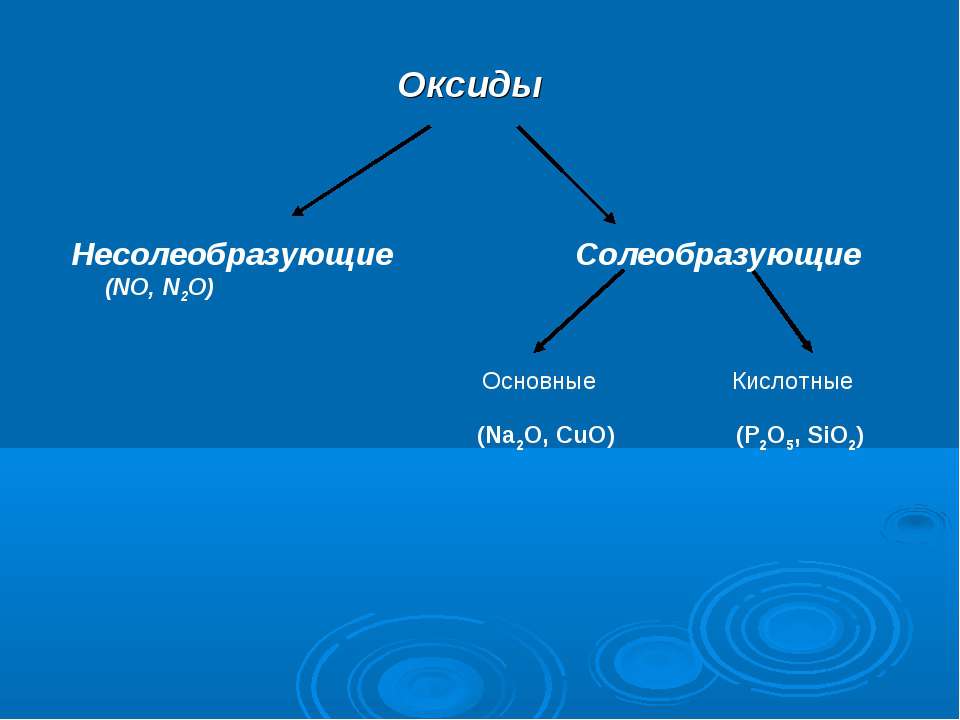 Эти кислотные и основные соединения можно дополнительно разделить на сильные и слабые в зависимости от их различных химических свойств. Таким образом, здесь мы должны сказать то же самое о соединении оксида меди (II), которое также известно как оксид меди.
Эти кислотные и основные соединения можно дополнительно разделить на сильные и слабые в зависимости от их различных химических свойств. Таким образом, здесь мы должны сказать то же самое о соединении оксида меди (II), которое также известно как оксид меди. Полный ответ:
Давайте обсудим кислоты и основания, за которыми следует оксид меди, следующим образом: —
-Кислоты: это вещества, которые отдают протоны или ионы водорода при смешивании с водным раствором.{-}} $). Они также классифицируются как сильные и слабые.
— Сильные основания — это те основания, которые полностью ионизируются в водном растворе, теряя все гидроксид-ионы, тогда как слабая кислота ионизируется частично в растворе, поскольку теряет лишь несколько своих ионов, а остальное остается нетронутым.
-Оксид меди (II): он также известен как оксид меди, а его химическая формула — CuO. Это твердое соединение черного цвета, которое действует как предшественник многих других медьсодержащих химических соединений и минералов.
-Обычно оксиды металлов имеют основную природу, тогда как оксиды неметаллов имеют кислотную природу.Поскольку оксид меди (II) является оксидом металла, он является основным по своей природе.
-Когда CuO находится в водном растворе, он не полностью диссоциирует в нем, что означает, что это слабое основание. Также, когда он растворяется в воде, он образует гидроксид меди ($ Cu {{(OH)} _ {2}} $).
Следовательно, оксид меди (II) представляет собой: (B) Слабое основание
Примечание:
— Помните, что сильные кислоты и основания имеют более высокую проводимость из-за полной диссоциации, тогда как слабые кислоты и основания имеют более низкую проводимость.По этой причине мы также можем отнести его к категории слабого основания, потому что оно также имеет низкую проводимость. Он также имеет около 11 pH, что показывает, что это слабое основание.
Оксид меди — обзор
3.11.4 Наноструктуры оксида меди
Оксиды меди существуют в двух различных формах: оксид меди (CuO) и оксид меди (Cu 2 O), в зависимости от валентного состояния меди. Здесь мы концентрируемся на CuO. CuO представляет собой полупроводник p-типа с непрямой запрещенной зоной, равной 1.2 — 1,9 эВ (см. Ray, 2001; Koffyberg, Benko, 1982; Marabelli et al. , 1995). Кристаллическая структура CuO находится в моноклинной пространственной группе C 2/ c ; постоянные решетки равны a = 4,6837 Å, b = 3,4226 Å и c = 5,1288 Å и β = 99,54 ° (см. Asbrink and Norrby, 1970). Cu в CuO находится в состоянии Cu 2+ , проявляя антиферромагнитное упорядочение (Brown et al. , 1991). Поскольку большинство монооксидов переходных металлов, таких как NiO, CrO и VO, проявляют изолятор Мотта, считается, что CuO также является изолятором Мотта.Электронная структура CuO интенсивно исследовалась в конце 1980-х — начале 1990-х годов из-за интереса к пониманию сверхпроводящих свойств купратных сверхпроводников с высоким содержанием T c (см. Tranguada et al. , 1995; Tokura et al.
Здесь мы концентрируемся на CuO. CuO представляет собой полупроводник p-типа с непрямой запрещенной зоной, равной 1.2 — 1,9 эВ (см. Ray, 2001; Koffyberg, Benko, 1982; Marabelli et al. , 1995). Кристаллическая структура CuO находится в моноклинной пространственной группе C 2/ c ; постоянные решетки равны a = 4,6837 Å, b = 3,4226 Å и c = 5,1288 Å и β = 99,54 ° (см. Asbrink and Norrby, 1970). Cu в CuO находится в состоянии Cu 2+ , проявляя антиферромагнитное упорядочение (Brown et al. , 1991). Поскольку большинство монооксидов переходных металлов, таких как NiO, CrO и VO, проявляют изолятор Мотта, считается, что CuO также является изолятором Мотта.Электронная структура CuO интенсивно исследовалась в конце 1980-х — начале 1990-х годов из-за интереса к пониманию сверхпроводящих свойств купратных сверхпроводников с высоким содержанием T c (см. Tranguada et al. , 1995; Tokura et al.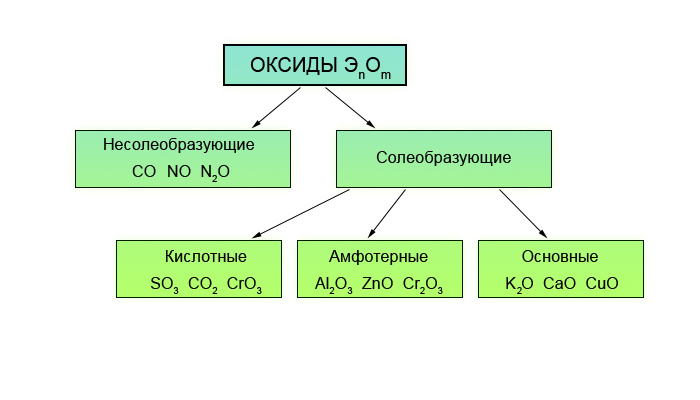 др. , 1989; Wells и др. , 1995). Ghijsen et al. (1988) исследовал электронную структуру как CuO, так и Cu 2 O экспериментально и теоретически. Они использовали расширенный базовый набор в рамках метода локализованных аугментарных сферических волн и модель взаимодействия кластерной конфигурации для расчета электронных структур и ширины запрещенной зоны как Cu 2 O, так и CuO.Они пришли к выводу, что, хотя экспериментальные результаты для закрытой оболочки Cu 2 O достаточно хорошо согласуются с расчетом одноэлектронной зонной структуры, согласие в открытой оболочке CuO является менее удовлетворительным из-за эффектов электронной корреляции. Совсем недавно Wu et al. (2006) использовал приближение локальной спиновой плотности с методом U (LSDA + U) для исследования сильно коррелированного моноклинного оксида меди CuO. Они показали, что расчет LSDA + U показал, что CuO является полупроводниковым антиферромагнитным материалом с непрямой шириной запрещенной зоны, равной 1.
др. , 1989; Wells и др. , 1995). Ghijsen et al. (1988) исследовал электронную структуру как CuO, так и Cu 2 O экспериментально и теоретически. Они использовали расширенный базовый набор в рамках метода локализованных аугментарных сферических волн и модель взаимодействия кластерной конфигурации для расчета электронных структур и ширины запрещенной зоны как Cu 2 O, так и CuO.Они пришли к выводу, что, хотя экспериментальные результаты для закрытой оболочки Cu 2 O достаточно хорошо согласуются с расчетом одноэлектронной зонной структуры, согласие в открытой оболочке CuO является менее удовлетворительным из-за эффектов электронной корреляции. Совсем недавно Wu et al. (2006) использовал приближение локальной спиновой плотности с методом U (LSDA + U) для исследования сильно коррелированного моноклинного оксида меди CuO. Они показали, что расчет LSDA + U показал, что CuO является полупроводниковым антиферромагнитным материалом с непрямой шириной запрещенной зоны, равной 1. 0 эВ и магнитный момент на единицу по формуле 0,60 μ B , что хорошо согласуется с экспериментами. На рис. 53 показана кристаллическая структура моноклинной элементарной ячейки CuO.
0 эВ и магнитный момент на единицу по формуле 0,60 μ B , что хорошо согласуется с экспериментами. На рис. 53 показана кристаллическая структура моноклинной элементарной ячейки CuO.
Рисунок 53. Кристаллическая структура моноклинной элементарной ячейки CuO. Воспроизведено с разрешения Wu D, Zhang Q, and Tao M (2006) Исследование оксидов меди с помощью LSDA + U: электронные структуры и собственные точечные дефекты. Physical Review B 73: 235206. Авторское право 2006 г., Американское физическое общество.
Экспериментально CuO широко изучался с помощью фотоэмиссионной спектроскопии (см. Thuler et al., 1982; Ghijsen et al. , 1990), рамановской спектроскопии (см. Goldstein и др. , 1990) и нейтронного рассеяния (Ain и др. , 1992). Возобновление интереса к CuO в последнее время связано с его способностью спонтанно организовываться в наноструктуры различных форм и размеров. Далее мы сосредоточимся на наноструктурах CuO, методах, используемых для синтеза наноструктурированного CuO, а также на некоторых основных свойствах и применениях наноструктурированного CuO.
Jiang et al. (2002) сообщил о простом методе из паровой фазы для синтеза нанопроволок CuO, исходя из чистой медной подложки. Медную подложку нагревали на воздухе при 400–600 ° С в течение 4 ч. Они обнаружили, что диаметр нанопроволок CuO можно регулировать от 30 до 100 нм в зависимости от температуры. ПЭМ высокого разрешения продемонстрировал, что каждая нанопроволока представляет собой бикристалл, разделенный плоскостью двойников (111) в направлении, параллельном оси роста. Изображения просвечивающей электронной микроскопии и распределение по размерам нанопроволок CuO, выращенных при различных температурах, показаны на рис.
Рис. 54. Изображения, полученные с помощью просвечивающего электронного микроскопа (ПЭМ), и распределение по размерам нанопроволок CuO, выращенных при различных температурах: (а) 400 ° C, (b) 500 ° C и (c) 600 ° C. Соответствующие распределения размеров этих нанопроволок показаны с (d) по (f). Воспроизведено с разрешения Jiang, X., Herricks, T. , Xia, Y. (2002) Нанопроволоки CuO могут быть синтезированы путем нагревания медных подложек на воздухе. Nano Letters 2 (12): 1333–1338. Авторское право 2002 г., Американское химическое общество.
, Xia, Y. (2002) Нанопроволоки CuO могут быть синтезированы путем нагревания медных подложек на воздухе. Nano Letters 2 (12): 1333–1338. Авторское право 2002 г., Американское химическое общество.
Cao et al. (2003) сообщил о способе выращивания раствора для получения НТ и наностержней Cu, Cu 2 O и CuO. Для наноструктур CuO они использовали легкую гидротермальную обработку на основе прекурсора Cu (OH) 4 2-, в результате чего были получены наностержни и наностержни CuO. Они обнаружили, что когда концентрация прекурсора Cu (OH) 4 2− составляла 8–15 мМ, продукты состояли как из наностержней CuO, так и из наностержней. Когда концентрация прекурсора Cu (OH) 4 2- увеличилась выше 15 мМ, были получены только наностержни CuO.Типичные получаемые нанопроволоки CuO имеют диаметр 5 нм и длину 100 нм, в то время как диаметр наностержней CuO варьируется от 50 до 120 нм, а длина находится в диапазоне 1–5 мкм. Типичное изображение нанотрубок CuO, полученное методом просвечивающей электронной микроскопии, показано на рис. 55, .
Типичное изображение нанотрубок CuO, полученное методом просвечивающей электронной микроскопии, показано на рис. 55, .
Рис. 55. (a) Изображение нанотрубок CuO, полученное с помощью просвечивающего электронного микроскопа (ПЭМ). На вставке — диаграмма дифракции электронов на выбранной площади (SAED) нанотрубок CuO. На (b) показано изображение одной нанотрубки CuO, полученное с помощью просвечивающего электронного микроскопа высокого разрешения (HRTEM).Воспроизведено с разрешения Cao M, Hu C, Wang Y, Guo Y, Guo C и Wang E (2003) Контролируемый путь синтеза Cu, Cu 2 O и нанотрубок и наностержней CuO. Chemical Communications 9 (15): 1884–1885. Воспроизведено с разрешения Королевского химического общества.
Hsieh et al. (2003a) описал метод, сочетающий методы электроосаждения и окисления для синтеза хорошо упорядоченных нановолокон CuO. Они использовали нанопористую мембрану из поликарбоната (ПК) в качестве шаблона для электроосаждения Cu на предварительно обработанную медную фольгу. Фольгу окисляли при 500 ° C в потоке газообразного кислорода 300 мл мин -1 . Они показали с помощью XRD, что начальная фаза электроосажденных структур Cu состояла из чистой меди, в то время как чистые нановолокна CuO выросли из центров зародышеобразования Cu. Они предложили механизм самокаталитического роста для массивов нановолокон CuO из образцов Cu, как схематично показано на рис. 56, .
Фольгу окисляли при 500 ° C в потоке газообразного кислорода 300 мл мин -1 . Они показали с помощью XRD, что начальная фаза электроосажденных структур Cu состояла из чистой меди, в то время как чистые нановолокна CuO выросли из центров зародышеобразования Cu. Они предложили механизм самокаталитического роста для массивов нановолокон CuO из образцов Cu, как схематично показано на рис. 56, .
Рис. 56. Механизм автокаталитического роста массивов наноцветов CuO из центров зародышеобразования Cu.Воспроизведено с разрешения Hsieh CT, Chen JM, Lin HH и Shih HC (2003b). Синтез упорядоченных наноцветов CuO с помощью механизма автокаталитического роста. Applied Physical Letters 82: 3316. Авторское право 2003 г., Американский институт физики.
Группа Х. К. Цзэна из Национального университета Сингапура сообщила о серии результатов, которые демонстрируют контролируемый синтез наностержней, нанолент CuO (Chang and Zeng, 2004) и самоорганизацию одуванчиков CuO (Liu and Zeng, 2004). Здесь мы кратко рассмотрим эти работы. Они впервые продемонстрировали синтез наностержней и нанолент CuO с использованием нескольких мокрых химических методов (Chang and Zeng, 2004). Типичный метод включает следующие шаги: медленно добавить 40 мл Cu (NO 3 ) 2 · 3H 2 O (0,01 M) в чистом этаноле к 40 мл NaOH (0,5 M в чистом этаноле) при температуре расход 0,1 мл min −1 ; полученный продукт необходимо нагреть при 65–80 ° C в течение 12–36 часов; после этого нанокристаллы CuO отделяют центрифугированием и многократно промывают деионизированной водой, и, наконец, твердые образцы сушат в вакууме в течение ночи.Chang и Zeng (2004) показали, что приготовленные наностержни CuO были монокристаллическими и были выращены в предпочтительном направлении <010>. Типичные наностержни CuO показаны на Рис. 57 . Цифры B, C и D относятся к разным температурам, а время старения указано в скобках.
Здесь мы кратко рассмотрим эти работы. Они впервые продемонстрировали синтез наностержней и нанолент CuO с использованием нескольких мокрых химических методов (Chang and Zeng, 2004). Типичный метод включает следующие шаги: медленно добавить 40 мл Cu (NO 3 ) 2 · 3H 2 O (0,01 M) в чистом этаноле к 40 мл NaOH (0,5 M в чистом этаноле) при температуре расход 0,1 мл min −1 ; полученный продукт необходимо нагреть при 65–80 ° C в течение 12–36 часов; после этого нанокристаллы CuO отделяют центрифугированием и многократно промывают деионизированной водой, и, наконец, твердые образцы сушат в вакууме в течение ночи.Chang и Zeng (2004) показали, что приготовленные наностержни CuO были монокристаллическими и были выращены в предпочтительном направлении <010>. Типичные наностержни CuO показаны на Рис. 57 . Цифры B, C и D относятся к разным температурам, а время старения указано в скобках.
Рис. 57. Типичные изображения на просвечивающем электронном микроскопе (ПЭМ) наностержней CuO, выращенных в различных условиях (B — 0,01 M Cu 2+ и T = 77 ° C, C — 0. 03 M Cu 2+ и T = 78 ° C, а D — 0,05 M Cu 2+ и T = 78 ° C). Воспроизведено с разрешения Chang Y и Zeng HC (2004). Управляемый синтез и самосборка монокристаллических наностержней и нанолент CuO. Выращивание кристаллов и дизайн B 4 (2): 397–402. Авторское право 2004 г., Американское химическое общество.
03 M Cu 2+ и T = 78 ° C, а D — 0,05 M Cu 2+ и T = 78 ° C). Воспроизведено с разрешения Chang Y и Zeng HC (2004). Управляемый синтез и самосборка монокристаллических наностержней и нанолент CuO. Выращивание кристаллов и дизайн B 4 (2): 397–402. Авторское право 2004 г., Американское химическое общество.
Лю et al. (2004) показали, что наноленты CuO могут организовываться в небольшие кристаллические полосы.Эти нанополосы могут в дальнейшем развиваться в сферы микронного размера с нанополосками CuO, ориентированными перпендикулярно сферической поверхности и указывающими на общий центр. Эти микросферы без сердечника содержат полость. Толщина стенки оболочки составляет от одной трети до четверти диаметра сферы. Соответствующие изображения SEM показаны на Рис. 58 .
Рис. 58. Изображения микросфер CuO, полученные с помощью сканирующего электронного микроскопа (СЭМ). (а) Общая морфология, масштабная линейка 50 мкм (б, в) подробные изображения сфер среднего размера; и (г) увеличенный вид отдельной сферы. Воспроизведено с разрешения Лю Б. и Цзэн Х.С. (2004) Мезомасштабная организация нанолент CuO: формирование одуванчиков. Журнал Американского химического общества 126 (26): 8124–8125. Авторское право 2004 г., Американское химическое общество.
Воспроизведено с разрешения Лю Б. и Цзэн Х.С. (2004) Мезомасштабная организация нанолент CuO: формирование одуванчиков. Журнал Американского химического общества 126 (26): 8124–8125. Авторское право 2004 г., Американское химическое общество.
Zhang et al. (2006) сообщил о гидротермальном методе синтеза монодисперсных микро- и наносфер. Сначала они растворили 2 мМ Cu (CH 3 COO) 2 · H 2 O в 25 мл N, N -диметилформамида (ДМФ) с последующим добавлением поли (винилпирролидона) (PVP ) и NaBH 4 .Смесь нагревали до 85–95 ° C, и через 2–6 мин цвет смеси становился оранжевым. Смесь сразу охлаждали до комнатной температуры и несколько раз промывали спиртом. Конечными продуктами на этом этапе были наносферы Cu 2 O. Эти сферы были нанесены на кремниевую пластину и высушены в печи при 60 ° C в течение 10 мин. Затем их переносили в муфельную печь и нагревали при 500 ° C в течение 1–2 ч для получения монодисперсных наносфер CuO. Типичные SEM-изображения монодисперсных наносфер CuO и результаты XRD показаны на рис.
Типичные SEM-изображения монодисперсных наносфер CuO и результаты XRD показаны на рис.
Рис. 59. (a) Изображения наносфер CuO с помощью сканирующего электронного микроскопа (СЭМ) со вставкой, показывающей детали морфологии. (б) Двумерная (2-D) картина самосборки наносферы CuO. (c) Изображение продукта CuO, полученное с помощью просвечивающего электронного микроскопа (ПЭМ), со вставкой, показывающей картину дифракции электронов одной наносферы. (d) Рентгенограмма наносферы CuO. Воспроизведено с разрешения Zhang J, Liu J, Peng Q, Wang X и Li Y (2006) Почти монодерсные наносферы Cu 2 O и CuO: подготовка и применение для чувствительных газовых сенсоров. Химия материалов 18 (4): 867–871. Авторское право 2006 г., Американское химическое общество.
Xu et al. (2009) сообщил о синтезе сотовых структур CuO с использованием двухэтапного электрохимического метода. Они использовали медную фольгу в качестве рабочего электрода и чистый графитовый стержень в качестве противоэлектрода в электролите 3 моль л –1 КОН. Сначала медная фольга анодировалась при напряжении 3–5 В в течение 1 ч. Затем медную фольгу извлекли из жидкости примерно на 0 °.5–1,0 см. Электрохимическое осаждение на медную фольгу продолжалось еще 3 ч при неизменном напряжении. Затем медную фольгу с продуктом извлекали из раствора и промывали дистиллированной водой. На этом этапе медная фольга все еще покрыта прекурсором Cu (OH) 2 . Наконец, предшественник Cu (OH) 2 нагревают при 160 ° C в течение 3 часов в атмосфере азота с образованием крупномасштабных сот из CuO. Морфология и структура медных сот из CuO показаны на рис. , рис. 60, .
Сначала медная фольга анодировалась при напряжении 3–5 В в течение 1 ч. Затем медную фольгу извлекли из жидкости примерно на 0 °.5–1,0 см. Электрохимическое осаждение на медную фольгу продолжалось еще 3 ч при неизменном напряжении. Затем медную фольгу с продуктом извлекали из раствора и промывали дистиллированной водой. На этом этапе медная фольга все еще покрыта прекурсором Cu (OH) 2 . Наконец, предшественник Cu (OH) 2 нагревают при 160 ° C в течение 3 часов в атмосфере азота с образованием крупномасштабных сот из CuO. Морфология и структура медных сот из CuO показаны на рис. , рис. 60, .
Рис. 60. Типичные изображения сот CuO с помощью сканирующего электронного микроскопа (СЭМ) посредством двухэтапного электрохимического осаждения при различных напряжениях в течение 4 ч: (а, б) В = 3 В; (в, г) В = 5 В. а — 500X; б — 400Х; c — 1000X; d — 6000X; Воспроизведено с разрешения Xu J, Yu K, Wu J, et al. (2009) Синтез, автоэлектронная эмиссия и определение влажности медных сот CuO. Физический журнал D: Прикладная физика 42: 075417. Авторское право 2009, IOP.
Физический журнал D: Прикладная физика 42: 075417. Авторское право 2009, IOP.
Далее авторы исследовали автоэмиссионные свойства прекурсора Cu (OH) 2 . В качестве катода использовались осажденные прекурсоры Cu (OH) 2 , а в качестве встречного электрода — оксид индия и олова. Расстояние между двумя электродами составляло 200 мкм. Путем их измерений было обнаружено, что напряжение включения составляло 6–7 В мкм –1 , в то время как максимальная плотность тока составляла 2,5 мА / см –2 . Это значение хорошо согласуется с результатами, полученными для нановолокон CuO Hsieh et al. (2003b).
Помимо полевой эмиссии, CuO может использоваться в качестве датчика относительной влажности. Для изготовления датчика влажности кремниевую подложку сначала очищают в ультразвуковой ванне в течение примерно 10 мин. Затем на поверхности Si путем термического окисления формируется изолирующий слой SiO 2 толщиной около 200 нм. На подготовленную подложку Si / SiO 2 методом трафаретной печати наносят гребенчатый электрод из серебра. Наконец, датчик влажности CuO может быть изготовлен путем нанесения полосового покрытия CuO сот на подложку с помощью процесса быстрого отжига в среде N 2 .Измеренные ВАХ указывают на омическое поведение.
На подготовленную подложку Si / SiO 2 методом трафаретной печати наносят гребенчатый электрод из серебра. Наконец, датчик влажности CuO может быть изготовлен путем нанесения полосового покрытия CuO сот на подложку с помощью процесса быстрого отжига в среде N 2 .Измеренные ВАХ указывают на омическое поведение.
Недавно Zhang et al. (2009 г.) разработал новый датчик гидразина на основе наноцветков CuO. Наноцветки CuO, состоящие из нанолент CuO, были приготовлены методом посадки семян в простом водном растворе, содержащем только Cu (NO 3 ) 2 и NH 3 · H 2 O. Типичные изображения этих наноцветов: показано на Рисунок 61 .
Рис. 61. (a, b) Изображение, полученное с помощью автоэмиссионного сканирующего электронного микроскопа (FESEM) с малым увеличением; (c) изображение FESEM с большим увеличением; (d) изображение на просвечивающем электронном микроскопе (ПЭМ) образца CuO, приготовленного при 100 ° C в течение 8 часов. Воспроизведено с разрешения Zhang X, Gu A, Wang G, Wang W, Wu H и Fang B (2009) Опосредованное семенами получение наноцветков CuO и их применение в качестве сенсора гидразина. Химические письма 38 (5): 466. Авторское право 2009 г., Химическое общество Японии.
Воспроизведено с разрешения Zhang X, Gu A, Wang G, Wang W, Wu H и Fang B (2009) Опосредованное семенами получение наноцветков CuO и их применение в качестве сенсора гидразина. Химические письма 38 (5): 466. Авторское право 2009 г., Химическое общество Японии.
Для изготовления сенсора гидразина наноцветки CuO сначала были диспергированы в Nafion, чтобы облегчить модификацию стеклоуглеродного электрода (GCE). Как показано на , рис. 62, , кривая 1, гидразин не показал окислительно-восстановительного пика при чистом GCE.
Рис. 62. Характеристики C – V наноцветов CuO в присутствии различного количества гидразина в 50 ммоль л -1 PBS (значение pH = 7,2) при скорости сканирования 50 мВ с -1 . Воспроизведено с разрешения Zhang X, Gu A, Wang G, Wang W, Wu H и Fang B (2009) Опосредованное семенами получение наноцветков CuO и их применение в качестве сенсора гидразина. Химические письма 38 (5): 466. Авторское право 2009 г. , Химическое общество Японии.
, Химическое общество Японии.
Таким образом, были синтезированы наноструктуры CuO различных размеров и форм и продемонстрированы различные применения.Эти наноструктурированные наностержни, наноленты, нановолокна и наносферы CuO могут быть самостоятельно собраны в другие микроскопические объекты. Дальнейшее исследование наноструктур CuO улучшит наше понимание их фундаментальных свойств и расширит возможности их применения.
Оксид меди является кислотным или основным? — AnswersToAll
Оксид меди является кислотным или основным?
Оксид меди (CuO) имеет основную природу. Поскольку большинство оксидов металлов имеют основную природу.
Что такое оксид меди?
Оксид меди представляет собой соединение двух элементов: меди и кислорода.Оксид меди может означать: оксид меди (I) (оксид меди, Cu2O) оксид меди (II) (оксид меди, CuO) пероксид меди (CuO2)
Какое соединение представляет собой оксид меди?
Оксид металла, имеющий формулу CuO. Имеет ионную структуру. Оксид меди (II) или оксид меди представляет собой неорганическое соединение с формулой CuO.
Имеет ионную структуру. Оксид меди (II) или оксид меди представляет собой неорганическое соединение с формулой CuO.
Какова природа оксида меди?
И оксид меди (CuO), и оксид меди (Cu2O) — два химических соединения, образованных кислородом и медью только в природе.Такие оксиды являются полупроводниками, где Cu2O имеет прямую запрещенную зону 2,1 эВ и имеет красноватый оттенок, а CuO с шириной запрещенной зоны 1,3 эВ имеет черный цвет [2].
Na2O является основным или кислым?
Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида O2-, который является очень сильным основанием с высокой тенденцией к объединению с ионами водорода. Реакция с водой: оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия.
Почему оксид меди является основанием?
Оксид меди является основанием, потому что он реагирует с кислотами и нейтрализует их, но не является щелочью, потому что не растворяется в воде. Как еще один пример гидроксида натрия, это основание, потому что оно реагирует с кислотами и нейтрализует их. Это также щелочь, потому что растворяется в воде.
Как еще один пример гидроксида натрия, это основание, потому что оно реагирует с кислотами и нейтрализует их. Это также щелочь, потому что растворяется в воде.
Является ли оксид меди противовирусным?
Оксид меди обладает сильными противовирусными свойствами. Была разработана платформенная технология, которая постоянно вводит оксид меди в полимерные материалы, наделяя их мощными биоцидными свойствами.
Вреден ли оксид меди для здоровья?
ЦитотоксичностьCuO-NP была связана со значительным увеличением внутриклеточного уровня АФК и потерей потенциала митохондриальной мембраны и неплотности лизосомальной мембраны.Следовательно, показано, что CuO-NP эффективно вызывают окислительный стресс в дополнение к повреждению митохондрий и лизосом в лимфоцитах крови человека.
Какой pH у оксида меди?
В основных условиях (pH ~ 12) были получены наночастицы оксида меди со средним размером частиц 90 ± 0,033 нм.
Какого цвета оксид меди II?
черный твердый
Оксид меди (II) или оксид меди представляет собой неорганическое соединение с формулой CuO. Черное твердое вещество, это один из двух стабильных оксидов меди, другой — Cu2O или оксид меди (I) (оксид меди).
Черное твердое вещество, это один из двух стабильных оксидов меди, другой — Cu2O или оксид меди (I) (оксид меди).
Оксид меди зеленый или черный?
Что касается цвета, оксид меди (I) представляет собой твердое вещество красного цвета. Однако в зависимости от размера частиц соединение также может иметь желтый или красный цвет. Точно так же оксид меди (II) представляет собой неорганическое соединение с химической формулой CuO. Он выглядит как черное твердое вещество.
Что такое pH MgO?
8–10
Большинство, если не все продукты, которые продаются как технологии стабилизации металлов, создают условия очень высокого pH в водоносных горизонтах, тогда как MgO создает идеальные условия водоносного горизонта с pH 8–10.
Каковы риски оксида меди?
Может вызывать раздражение дыхательных путей. Токсично при проглатывании. Кожа Может причинить вред при проникновении через кожу. Может вызвать раздражение кожи.
Убивает ли медь плесень?
В 1973 году исследователи из Battelle Columbus Laboratories провели всесторонний поиск литературы, технологий и патентов, которые проследили историю понимания «бактериостатических и дезинфицирующих свойств поверхностей из меди и медных сплавов», которые продемонстрировали, что медь в очень малых количествах имеет мощность…
Токсична ли медь для кожи?
Медь в металлическом состоянии не действует на кожу и становится потенциальным раздражителем или аллергеном, когда подвергается коррозии и становится растворимой под действием экссудатов, встречающихся на поверхности кожи, или в относительно агрессивной физиологической среде, такой как полость рта. или матка 3.
или матка 3.
Каков pH оксида цинка?
7.2
2 видно, что собственный pH суспензии оксида цинка при pH = 7,2 очень стабилен. Уменьшение конечного pH со временем можно объяснить небольшим растворением оксида цинка или поверхностного гидроксида Zn (OH) 2 (S) и образованием различных разновидностей цинка. С Рис.
Что такое зеленый оксид меди?
Когда вы видите этот зеленый слой на этих металлах (обычно называемый патиной или зеленью), это происходит из-за химической реакции.Медь прореагировала с кислородом, водой и углекислым газом в атмосфере. Латунь — это сплав, который обычно состоит из 67% меди и 33% цинка.
Оксид меди II: формула, свойства и структура — видео и стенограмма урока
Формула оксида меди (II)
В результате химической комбинации металла и неметалла образуется ионное соединение . Мы можем определить формулу ионного соединения на основе того, сколько электронов теряет атом металла и сколько электронов приобретает атом неметалла. Римская цифра II говорит нам об электрическом заряде или степени окисления иона меди, что составляет +2. Это означает, что каждый атом меди теряет два электрона, образуя ион Cu + 2.
Римская цифра II говорит нам об электрическом заряде или степени окисления иона меди, что составляет +2. Это означает, что каждый атом меди теряет два электрона, образуя ион Cu + 2.
Кислород не является металлом и всегда получает два электрона, что придает ему степень окисления -2. Поскольку каждый атом кислорода имеет два дополнительных электрона, образуется оксидный ион, который представляет собой O-2.
Все ионные соединения должны быть электрически нейтральными, что означает, что соотношение каждого элемента в соединении должно вносить достаточный заряд, чтобы отменить заряд другого иона.В случае иона меди (II) и иона кислорода мы видим, что оба иона имеют одинаковые и противоположные заряды. Это означает, что нам нужен только один из каждого иона для образования нейтрального соединения оксида меди (II), которым является CuO. Обсудим свойства оксида меди (II).
Свойства оксида меди (II)
Когда вы смотрите полицейские телевизионные драмы, вы можете услышать, как они описывают характеристики человека, которого они ищут. Они могут отмечать свой внешний вид, включая рост, вес, цвет глаз и т. Д.Они также могут отметить свою личность. Они дружелюбны, сдержанны или вообще капризны? Мы можем использовать эту аналогию, чтобы понять типы свойств соединения, включая его физические характеристики и химическую реакционную способность. Давайте представим, что мы частный детектив, ищущий соединение оксида меди (II), как будто мы ищем человека.
Они могут отмечать свой внешний вид, включая рост, вес, цвет глаз и т. Д.Они также могут отметить свою личность. Они дружелюбны, сдержанны или вообще капризны? Мы можем использовать эту аналогию, чтобы понять типы свойств соединения, включая его физические характеристики и химическую реакционную способность. Давайте представим, что мы частный детектив, ищущий соединение оксида меди (II), как будто мы ищем человека.
Мы ищем ионное соединение со следующими физическими характеристиками:
- Молярная масса равна 78.92 г / моль
- Черное или темно-коричневое твердое вещество, возможно в виде порошка
- Плотность около 6,31 г / см3
- Плавится при температуре чуть выше 1200 ° C
- Кипит при температуре около 2000 ° C
Оксид меди (II) представляет собой амфотерное вещество , что означает, что он может действовать как кислота или основание. Он также негорючий и нерастворим в воде. Теперь, когда мы знаем, на что обращать внимание с точки зрения свойств оксида меди (II), давайте поговорим о его структуре.
Структура оксида меди (II)
Поскольку оксид меди (II) является ионным соединением, Cu + 2 и O-2 слипаются из-за электростатического притяжения.Этот тип связи очень похож на то, как два противоположных конца магнита склеиваются вместе, за исключением того, что это происходит в атомном масштабе. Эти ионы слипаются, образуя решетчатую структуру, которая представляет собой определенное расположение ионов, которое вы можете увидеть здесь:
Резюме урока
Давайте рассмотрим. Ионные соединения — это соединения, в которых металл и неметалл слипаются из-за электростатического притяжения.Так получается оксид меди (II) , поскольку это соединение, в котором кислород и медь слипаются. Это количество электронов, которые металл теряет, и неметаллическое усиление определяет степень окисления ионов . Медь (II) имеет римскую цифру II , потому что она теряет два электрона, образуя Cu + 2. Кислород получает два электрона, образуя O-2. Поскольку эти ионы равны плюс и минус 2, они компенсируют друг друга, что является требованием для ионного соединения. Формула оксида меди (II) — CuO.
Медь (II) имеет римскую цифру II , потому что она теряет два электрона, образуя Cu + 2. Кислород получает два электрона, образуя O-2. Поскольку эти ионы равны плюс и минус 2, они компенсируют друг друга, что является требованием для ионного соединения. Формула оксида меди (II) — CuO.
Ионные соединения, такие как оксид меди (II), образуются из-за того, что противоположно заряженные ионы слипаются, как противоположные концы двух магнитов. Ионы слипаются в трехмерную решетчатую структуру.
Оксид меди (II) имеет следующие свойства:
- Молярная масса равна 78,92 г / моль
- Черное или темно-коричневое твердое вещество, возможно в виде порошка
- Плотность около 6,31 г / см3
- Плавится при температуре чуть выше 1200 ° C
- Кипит при температуре около 2000 ° C
Наконец, мы узнали, что оксид меди (II) также амфотерный , что означает, что он может действовать как кислота или основание.
Исследование кислотности сульфатированных слоев CuO, выращенных реконструкцией поверхности Cu2O с определенными выступающими гранями
rsc.org/schema/rscart38″> Три образца закиси меди с открытыми гранями {111}, {100} / {111} и {100} были синтезированы и затем окислены на воздухе путем прокаливания с образованием восстановленных образцов Cu 2 O @ CuO. 31 P MAS ЯМР с триметилфосфином в качестве молекулы зонда применяли для характеристики кислотности поверхности образцов.Было обнаружено, что образцы Cu 2 O @ CuO имеют более высокую плотность кислоты Льюиса по сравнению с исходными образцами Cu 2 O. После сульфатирования образцы SO 4 2− / Cu 2 O @ CuO имеют аналогичную общую плотность кислоты, которая намного выше, чем у образцов Cu 2 O @ CuO. . Более того, на SO наблюдались три типа кислотных центров Льюиса, отнесенных к ненасыщенным 2-координированным сайтам Cu, ненасыщенным 2-координированным сайтам Cu, связанным с SO 4 2- и ненасыщенным 3-координированным сайтам Cu. 4 2− / Cu 2 O @ CuO.Плотность этих трех кислотных центров Льюиса варьируется от разных образцов. В реакции конденсации Пехмана было замечено, что сильные кислотные центры Льюиса дезактивируются из-за адсорбции реагентов, в то время как умеренные кислотные центры Льюиса действуют как фактические активные центры.
4 2− / Cu 2 O @ CuO.Плотность этих трех кислотных центров Льюиса варьируется от разных образцов. В реакции конденсации Пехмана было замечено, что сильные кислотные центры Льюиса дезактивируются из-за адсорбции реагентов, в то время как умеренные кислотные центры Льюиса действуют как фактические активные центры.У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова?
Попробуй снова?Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Последовательность химических реакций
Превращение меди: Последовательность химических реакцийЦели
- Проиллюстрируйте множество веществ, в состав которых может входить тот или иной элемент:
металл -> синий раствор -> синее твердое вещество -> черное твердое вещество -> синий раствор (снова) -> металл (снова).

- Сохранение массы и родинок:
- Мы должны извлечь столько же меди, сколько мы начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт применения стандартных химических методов: фильтрации и количественного переноса.
Реакция
Cu (s) -> [Cu (H 2 O) 6 ] 2+ (водн.) -> Cu (OH) 2 (s) -> CuO (s) -> [Cu (H 2 O) 6 ] 2+ (водн.) -> Cu (s)- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ).Фактически, нитрат-ион окисляет металлическую медь до иона меди (II), при этом сам превращаясь в газ NO 2 ; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, — это исчезновение окрашенного в медь металла, когда раствор становится синим (из [Cu (H 2 O) 6 ] 2+ , ион гексааквакоппера) и коричневого газа (NO 2).
 ) развивается.
) развивается.Cu (s) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.) -> [Cu (H 2 O) 6 ] 2+ (водн.) + 2 NO 2 (г)
- Ион гидроксида (OH — ) связывается с ионом меди (II) даже сильнее, чем вода.В результате ион гидроксида может вытеснять воду из иона меди (II), давая гидроксид меди Cu (OH) 2 , синий осадок.
[Cu (H 2 O) 6 ] 2+ (водн.) + 2 OH — -> Cu (OH) 2 (с) + 6 H 2 O (л)
- При нагревании гидроксида меди образуется оксид меди CuO, твердое вещество черного цвета.
Cu (OH) 2 (s) -> CuO (s) + H 2 O (l)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т.) + 2 H 3 O + (водн.
 ) + 3 H 2 O (л) -> [Cu (H 2 O) 6 ] 2+ (водн. )
) + 3 H 2 O (л) -> [Cu (H 2 O) 6 ] 2+ (водн. ) - Наконец, металлический цинк восстанавливает гидратированный ион меди (II) до металлической меди, в то время как сам превращается в ионы цинка (II), окисляясь. Мы уже видели эту реакцию в лаборатории хлорида меди).
[Cu (H 2 O) 6 ] 2+ (водн.) + Zn (s) -> Cu (s) + Zn 2+ (водн.) + 6 H 2 O ( водн.)
В то же время часть металлического цинка, который присутствует в избытке, восстанавливает ионы гидроксония до H 2 .Zn (т) + 2 H 3 O + (водн.) -> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
Процедура
Я не буду вдаваться в подробности процедуры, но подчеркну некоторые моменты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от процедуры в лабораторном пакете.
- Преобразование Cu (s) в [Cu (H 2 O) 6 ] 2+ (водн.)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0.01 г . Кусочки проволоки плотнее 0,50 г, чем 0,35 г. Ничего страшного: используйте то, что мы предоставляем.
- Используйте примерно 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, при попадании на кожу она вызывает жжение и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.
- Если некоторое количество меди остается нерастворенной к тому времени, когда производство газа закончится, поставьте стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, потому что коричневый газ NO 2 является раздражителем. Держите смеси в вытяжке до тех пор, пока вы не добавите 10 мл дистиллированной воды после полного растворения меди.

- Преобразование [Cu (H 2 O) 6 ] 2+ (водн.) В Cu (OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое при контакте с кожей будет жалить. К раствору меди по каплям добавляют раствор NaOH.
- После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумаги. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, ложному синему цвету на лакмусовой бумаге. Вначале раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; после нейтрализации кислоты следующий добавленный OH — идет на образование синего осадка Cu (OH) 2 .Только после этого добавленный OH — зависает в режиме ожидания, и только в это время он станет красной лакмусовой бумажкой и станет синей.
 Мы хотим убедиться, что вся присутствующая медь превращена в Cu (OH) 2 , поэтому мы добавляем OH — , пока раствор не станет синей лакмусовой бумажкой.
Мы хотим убедиться, что вся присутствующая медь превращена в Cu (OH) 2 , поэтому мы добавляем OH — , пока раствор не станет синей лакмусовой бумажкой.
- Преобразование Cu (OH) 2 (s) в CuO (s)
- Добавьте воду к реакционной смеси, полученной на предыдущем этапе, и добавьте еще один или два кипящих камня .
- Нагрейте содержимое стакана, но не кипятите . При кипячении черный CuO становится настолько мелким, что стадия фильтрации становится чрезмерно долгой. Нагрейте химический стакан до тех пор, пока весь синий Cu (OH) 2 не исчезнет и не заменится черным CuO.
- Отфильтруйте и промойте CuO, как описано в процедуре (часть C). Оставьте твердое вещество на фильтровальной бумаге и выбросьте фильтрат.
- Превратить CuO (s) обратно в [Cu (H 2 O) 6 ] 2+ (водн.)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).

- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).

 к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3) к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3
к. CO2 — кислотный оксид, он реагирует с растворами карбонатов с образованием кислых солей Na2CO3 + CO2 + H2O = 2NaHCO3 к. основные оксиды реагируют с кислотами
к. основные оксиды реагируют с кислотами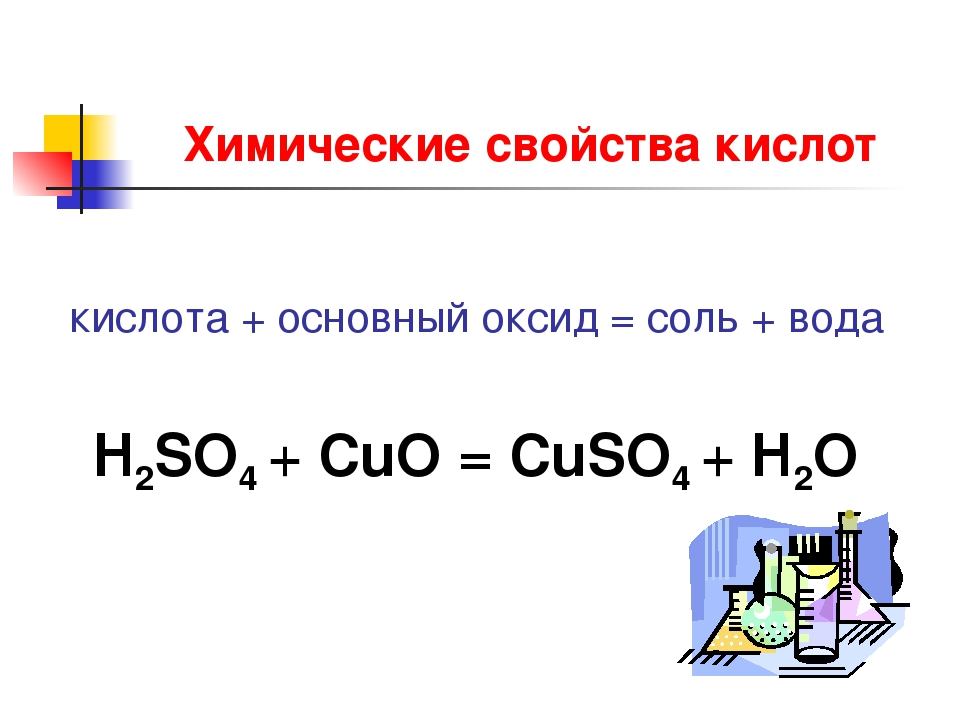 )
)


 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;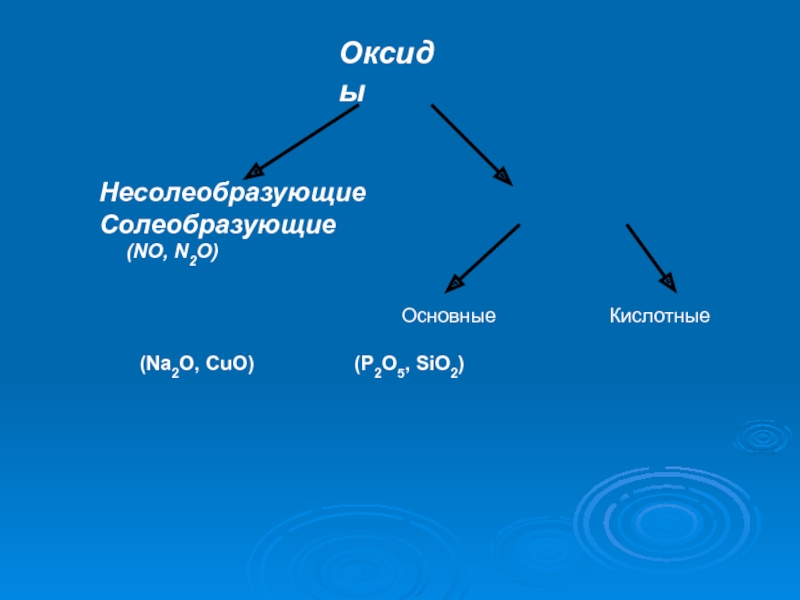

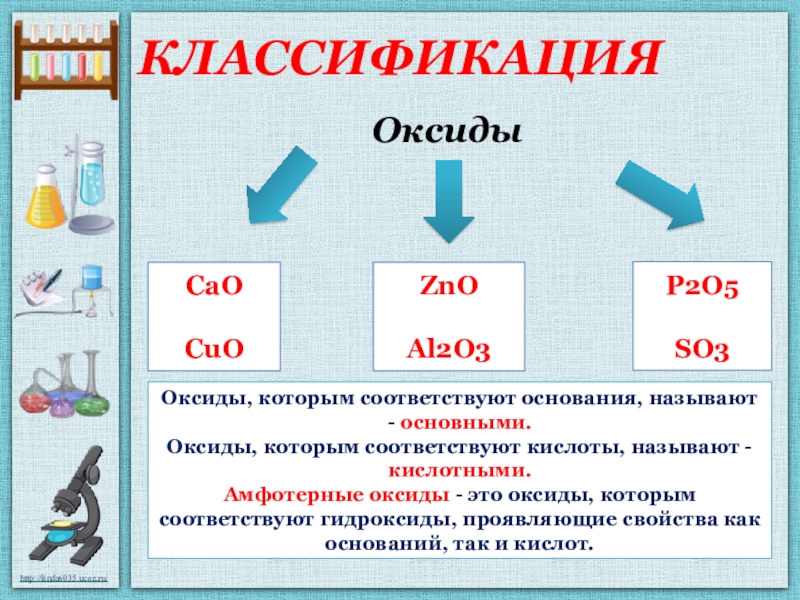
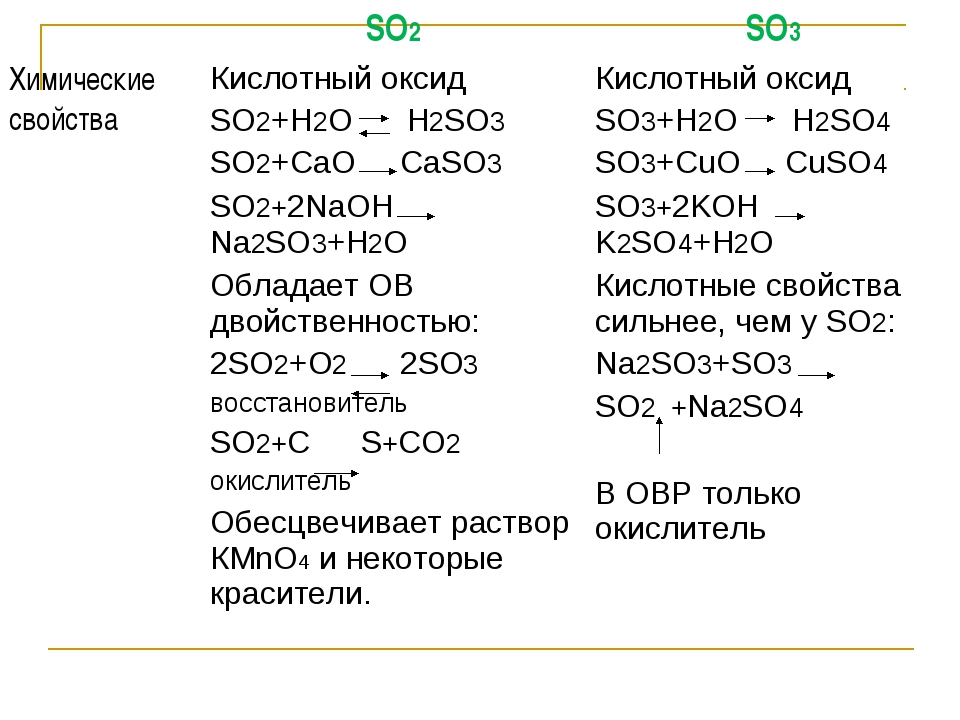 ) развивается.
) развивается. ) + 3 H 2 O (л) -> [Cu (H 2 O) 6 ] 2+ (водн. )
) + 3 H 2 O (л) -> [Cu (H 2 O) 6 ] 2+ (водн. )
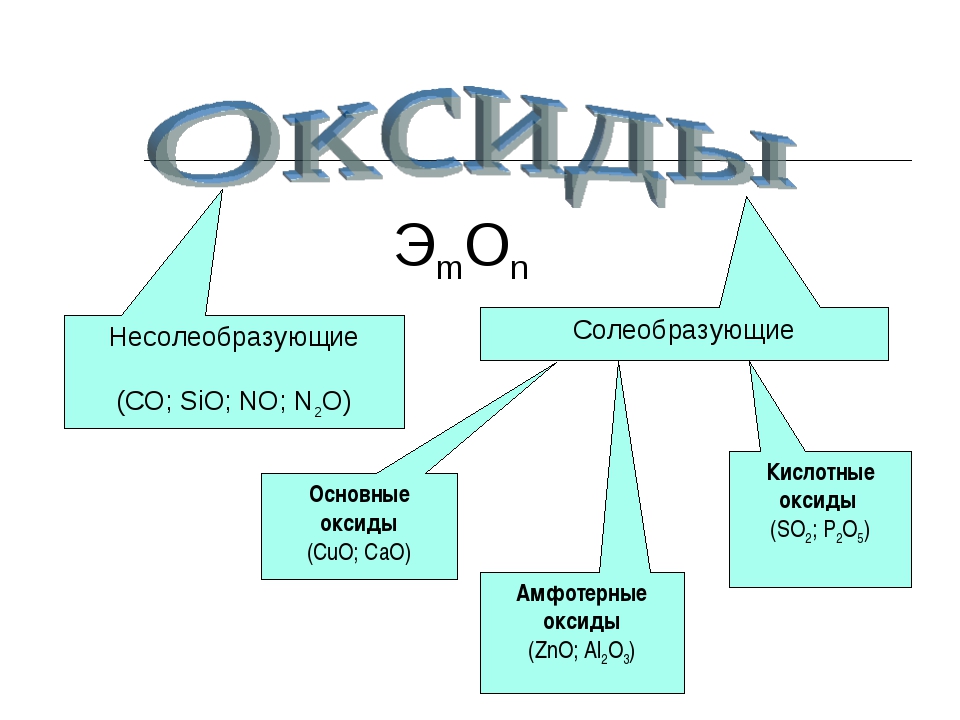 Мы хотим убедиться, что вся присутствующая медь превращена в Cu (OH) 2 , поэтому мы добавляем OH — , пока раствор не станет синей лакмусовой бумажкой.
Мы хотим убедиться, что вся присутствующая медь превращена в Cu (OH) 2 , поэтому мы добавляем OH — , пока раствор не станет синей лакмусовой бумажкой.